Twinject 0,3 Mg/ 0,3 Ml Solucion Inyectable En Jeringa Precargada
Información obsoleta, busque otroDE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
1 | |
|
Oí |
k agencia española de 1 medicamentos y I productos sanitarios |
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Twinject 0,3 mg/0,3 ml solución inyectable en jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 1 mg de epinefrina.
Una dosis contiene 0,3 mg (0,3 ml) de epinefrina.
La jeringa precargada puede administrar dos dosis de 0,3 mg (0,3 ml) de epinefrina.
Excipientes: Sulfato ácido de sodio (E-222) 0.45 mg
Cloruro sódico 2.55 mg
Hidróxido de sodio (para ajustar el pH) q.s Cantidad de sodio total 3.00 mg
Para consultar la lista completa de excipientes, ver la sección 6.1.
3. FORMA FARMACÉUTICA
Solución para inyectables (inyección) en una jeringa precargada. Solución transparente e incolora prácticamente sin partículas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de urgencia para las reacciones alérgicas agudas (anafilaxia) provocadas por alimentos, fármacos, el látex, mordeduras o picaduras de insectos y otros alérgenos, además de la anafilaxia provocada por el ejercicio físico o idiopática.
4.2 Posología y forma de administración
Vía intramuscular.
En una proporción significativa de pacientes (p. ej. en pacientes con sobrepeso) la vía de inyección es subcutánea.
Posología
Adultos, adolescentes y niños que pesan más de 30 kg:
La dosis habitual es de 0,3 mg (por inyección) en la cara anterolateral (la cara externa) del muslo (vía intramuscular).
La primera dosis se administra automáticamente después de que el paciente prepare el Twinject para la inyección.
En caso de que exista una reacción prolongada o bifásica, Twinject está diseñado para administrar una segunda dosis de 0,3 mg (0,3 ml) de epinefrina de forma manual. La unidad contiene una aguja que se empleará en ambas inyecciones.
Correo electrónicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Niños que pesan entre 15 y 30 kg:
Se recomienda emplear una formulación pediátrica con una dosis de 0,15 mg. Forma de administración
Twinject contiene una dosis de autoadministración para su uso inmediato cuando aparezcan los primeros síntomas y signos de anafilaxia. Estos pueden tener lugar a los pocos minutos de la exposición al alérgeno, y se manifiestan con mucha mayor frecuencia en forma de urticaria, ruborización o angioedema; las reacciones de mayor gravedad se presentan en los sistemas circulatorio y respiratorio.
Twinject dispone de una segunda dosis manual en caso de que los síntomas persistan (o empeoren) que se inyectará aproximadamente cinco minutos después de la primera administración y en caso de que el paciente no haya conseguido acudir a un servicio de urgencias para recibir el tratamiento adecuado.
El paciente podrá administrarse manualmente la segunda dosis tras desmontar parcialmente el dispositivo Twinject.
Vaya a la sección 6.6 para consultar las instrucciones detalladas de uso.
4.3 Contraindicaciones
Hipersensibilidad a la epinefrina, al sulfato ácido de sodio o a alguno de los excipientes (ver la sección
4.4 para consultar más información sobre los sulfitos). No obstante, no existen contraindicaciones absolutas para el uso de Twinject en una urgencia por alergia.
En la sección 4.4 se listan los cuadros clínicos que requieren precauciones especiales y en la sección 4.5 las interacciones farmacológicas pertinentes.
4.4 Advertencias y precauciones especiales de empleo
Twinject no ha sido diseñado para sustituir a la atención médica inmediata. Además de la administración de epinefrina, el paciente debe solicitar asistencia médica oportuna. El paciente debe solicitar asistencia médica urgente inmediatamente después de la administración de la primera dosis del fármaco para poder efectuar un estricto seguimiento de la crisis anafiláctica y recibir el tratamiento médico necesario.
El médico que prescribe Twinject debe revisar detalladamente el contenido de esta ficha técnica con el paciente. Esta revisión debe comprender instrucciones detalladas sobre el método de administración correcto. El prospecto y la etiqueta envolvente que acompañan al producto también deben revisarse con el paciente.
El médico debe revisar de forma regular el uso de Twinject y debe garantizar que el paciente y sus cuidadores puedan asistir a una demostración para familiarizarse con el uso del producto. Existe una muestra de demostración sin aguja a disposición de los pacientes.
Twinject debe inyectarse únicamente en la cara anterolateral (la cara externa) del muslo. Debe evitarse la inyección accidental en las manos o pies, ya que puede derivar en la ausencia de riego sanguíneo en la zona afectada. No debe inyectarse el producto en la nalga. Si existe una inyección accidental en estas zonas, indique al paciente que debe informar al profesional sanitario de dicha inyección accidental cuando acuda al servicio de urgencias más cercano para recibir un tratamiento adecuado para la anafilaxia.
Evítese una posible administración intravascular involuntaria. La inyección intravenosa de dosis elevadas o accidentales de epinefrina puede provocar una hemorragia cerebral debida a un aumento súbito de la presión arterial. No debe administrarse por vía intravenosa. Los vasodilatadores de acción rápida pueden contrarrestar los potentes efectos vasotensores de la epinefrina si se produce una administración involuntaria por esta vía.
Twinject no es adecuado para pacientes o cuidadores con discapacidades tales como una artritis incapacitante grave en las manos, dado que el uso de este producto requiere cierta destreza con las manos para poder administrarlo.
Existe un riesgo de reacciones adversas tras la administración de epinefrina en pacientes con hipertiroidismo, enfermedad cardiovascular (angina de pecho grave, miocardiopatía obstructiva y arritmia ventricular e hipertensión), feocromocitoma, presión intraocular alta, disfunción renal grave, adenoma prostático que provoca orina residual, hipercalcemia, hipopotasemia, diabetes o en pacientes ancianos o mujeres embarazadas.
La epinefrina debe emplearse con precaución en pacientes con cardiopatías como la cardiopatía coronaria y la miocardiopatía, la cardiopatía pulmonar, arritmias cardíacas o taquicardia. En estos pacientes, la epinefrina puede desencadenar o agravar la angina de pecho, además de producir arritmias ventriculares.
Los pacientes con diabetes pueden sufrir un aumento de la glucemia tras la administración de epinefrina.
Los pacientes con enfermedad de Parkinson pueden notar un empeoramiento transitorio de sus síntomas.
Advertencias sobre excipientes:
Twinject contiene sulfito ácido de sodio (E-222), que puede producir reacciones alérgicas graves y broncoespasmo, especialmente en las personas que presentan antecedentes de asma. Los pacientes con estas enfermedades deben recibir un asesoramiento detallado sobre las circunstancias en las que se debe emplear Twinject.
Twinject contiene menos de 1 mmol (23 mg) de sodio por cada 0,15 ml, por lo que se considera esencialmente “exento de sodio”.
En caso de que exista una reacción alérgica potencialmente mortal, Twinject puede utilizarse incluso si el paciente es alérgico a los sulfitos.
Uso en deportistas:
Se debe advertir a los pacientes que este medicamento contiene epinefrina, que puede producir un resultado positivo en las pruebas de control de dopaje.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los efectos de la epinefrina pueden verse potenciados por los antidepresivos tricíclicos, los antidepresivos duales noradrenérgicos y serotoninérgicos como la venlafaxina, la sibutramina o el milnaciprán y los inhibidores de la monoaminoxidasa o MAO (aumento súbito de la presión arterial y posible arritmia cardíaca), los inhibidores de la catecol-O-metiltransferasa (COMT), las hormonas tiroideas, la teofilina, la oxitocina, los fármacos parasimpaticolíticos, determinados antihistamínicos (la difenhidramina y la clorfeniramina), la levodopa y el alcohol.
Pueden presentarse hipertensión grave y bradicardia cuando se administra epinefrina junto con medicamentos betabloqueantes no selectivos.

El tratamiento simultáneo con simpaticomiméticos puede potenciar los efectos de la epinefrina.
Use Twinject con precaución en pacientes que reciben medicamentos que pueden exponer al corazón a arritmias cardíacas, como la digital, la quinidina y los anestésicos halogenados.
Los efectos vasotensores de la epinefrina pueden contrarrestarse mediante la administración de vasodilatadores de acción rápida o de medicamentos alfabloqueantes (que causan una reducción de la presión arterial). Los efectos cardiotónicos y broncodilatadores pueden inhibirse con medicamentos betabloqueantes, especialmente con betabloqueantes no selectivos.
La epinefrina inhibe la secreción de insulina, por lo que aumenta la glucemia. Por tanto, los pacientes diabéticos pueden necesitar un aumento de la dosis de insulina o de otros tratamientos hipoglucemiantes.
4.6 Embarazo y lactancia
No existen suficientes estudios adecuadamente controlados de la administración de epinefrina a mujeres embarazadas. La epinefrina sólo debe usarse en el embarazo si las ventajas potenciales justifican el posible riesgo para el feto. La adrenalina atraviesa la barrera placentaria y puede provocar hipoxia fetal, aborto espontáneo o ambos.
La epinefrina no presenta biodisponibilidad por vía oral; no se espera que ninguna concentración de epinefrina excretada en la leche materna afecte al lactante.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de la epinefrina sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. No obstante, se recomienda que los pacientes no conduzcan ni utilicen máquinas tras la administración de epinefrina, dado que los pacientes estarán afectados por los síntomas del choque anafiláctico.
4.8 Reacciones adversas
La presencia de reacciones adversas depende de la sensibilidad de cada paciente y la dosis utilizada. Las reacciones adversas provocadas por la epinefrina se indican a continuación, si bien su frecuencia no puede calcularse a partir de los datos disponibles.
• Trastornos metabólicos y nutricionales: hiperglucemia, hipopotasemia, acidosis metabólica.
• Trastornos psiquiátricos: ansiedad, alucinaciones, nerviosismo.
• Trastornos del sistema nervioso: midriasis, temblor, cefalea, astenia.
• Trastornos cardíacos: síncopes, palpitación, taquicardia, mareos, angina de pecho, hipertensión.
• Trastornos vasculares: constricción vascular, frialdad periférica.
• Trastornos respiratorios, torácicos y mediastínicos: dificultad respiratoria, edema pulmonar.
• Trastornos gastrointestinales: náuseas, vómitos.
• Trastornos musculoesqueléticos, del tejido conjuntivo y de los huesos: debilidad.
• Trastornos renales y urinarios: retención urinaria, alteración renal.
• Trastornos generales y alteraciones en la zona de administración: palidez, hiperhidrosis.
Las reacciones adversas que pueden presentarse en dosis más elevadas o en individuos susceptibles son las arritmias cardíacas (fibrilación ventricular o parada cardíaca) y un aumento súbito de la presión

arterial (que algunas veces desencadena una hemorragia cerebral), además de vasoconstricción (p. ej. en la piel, los tejidos mucosos y los riñones).
Twinject contiene un bisulfito que puede provocar reacciones alérgicas, como reacciones anafilácticas graves o potencialmente mortales o crisis asmáticas graves en determinados pacientes susceptibles.
4.9 Sobredosis
La epinefrina se inactiva rápidamente en el organismo, y el tratamiento posterior a la sobredosis con epinefrina es principalmente sintomático.
La sobredosis o la inyección intravascular accidental de epinefrina pueden provocar hemorragia cerebral por causa de un aumento súbito de la presión arterial. Puede producirse la muerte por un edema pulmonar provocado por la constricción vascular periférica y la estimulación cardíaca.
Los efectos vasotensores de la epinefrina pueden contrarrestarse mediante vasodilatadores de acción rápida o medicamentos alfabloqueantes. En caso de que se produzca una hipotensión prolongada tras la aplicación de estas medidas, puede ser necesario administrar otro medicamento vasotensor, como norepinefrina.
El edema pulmonar agudo con molestias respiratorias tras la sobredosis de epinefrina debe tratarse administrando un medicamento alfabloqueante de acción rápida como la fentolamina o mediante ventilación con presión positiva intermitente.
La sobredosis de epinefrina también puede derivar en una bradicardia transitoria seguida de taquicardia, y posteriormente desembocar en arritmias cardíacas potencialmente mortales.
Las contracciones ventriculares prematuras pueden aparecer un minuto después de la inyección, y existe la posibilidad de que les sobrevenga una taquicardia ventricular multifocal (ritmo prefibrilatorio). Tras la remisión de los efectos ventriculares puede presentarse taquicardia auricular y, en ocasiones, bloqueo auriculoventricular. El tratamiento de las arritmias consiste en administrar medicamentos betabloqueantes. Antes de su administración o junto con estos, debe administrarse un alfabloqueante para regular los efectos alfadrenérgicos sobre la circulación periférica.
La sobredosis provoca algunas veces palidez extrema y frialdad de la piel, acidosis metabólica e insuficiencia renal. En tales situaciones deben aplicarse medidas correctivas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos adrenérgicos y dopaminérgicos, epinefrina.
Código ATC: C01 CA 24
La epinefrina es una catecolamina natural secretada por la médula suprarrenal como respuesta al esfuerzo o al estrés. Es una amina simpaticomimética, un estimulante potente de los receptores adrenérgicos a y P, y sus efectos en los órganos diana son, por lo tanto, complejos. Es el medicamento de elección para aliviar rápidamente las reacciones de hipersensibilidad a las alergias o idiopáticas, además de la anafilaxia provocada por el ejercicio físico.

Si no se obtiene ningún efecto clínico, se recomienda administrar más de una inyección transcurridos cinco minutos a partir de la primera administración o antes.
Aproximadamente el 20% de los pacientes pueden necesitar más de una inyección de epinefrina.
La epinefrina ejerce una acción vasoconstrictora potente mediante la estimulación de los receptores adrenérgicos a. Esta actividad contrarresta la vasodilatación y el aumento de la permeabilidad vascular que deriva en la pérdida de líquido intravascular y en la hipotensión consiguiente, que son los principales factores farmacotoxicológicos presentes en el choque anafiláctico.
Mediante la estimulación de los receptores adrenérgicos P bronquiales, la epinefrina ejerce una acción broncodilatadora potente que alivia el broncoespasmo, las sibilancias y la disnea.
La epinefrina también alivia el prurito, la urticaria y el angioedema, y puede ser eficaz a la hora de mitigar los síntomas gastrointestinales y genitourinarios de la anafilaxia gracias a sus efectos relajantes sobre el músculo liso del estómago, los intestinos, el útero y la vejiga urinaria.
5.2 Propiedades farmacocinéticas
La epinefrina se inactiva rápidamente en el organismo, principalmente en el hígado por medio de las enzimas COMT y MAO. Una gran parte de la dosis de epinefrina se excreta en forma de metabolitos en la orina. Su semivida plasmática es de aproximadamente dos a tres minutos. Sin embargo, cuando se inyecta por vía subcutánea o intramuscular, la vasoconstricción local puede retrasar su absorción, de modo que los efectos pueden durar más de lo que parece indicar su semivida.
5.3 Datos preclínicos sobre seguridad
No se ha demostrado que la epinefrina presente ninguna propiedad mutágena ni carcinógena pertinente.
En dosis elevadas (100 veces superiores a la dosis en humanos), la epinefrina presenta efectos teratógenos en ratones, ratas, hámsteres y pollos. En dosis comprendidas en el intervalo de dosis clínicas, se ha observado hipoxia fetal que provoca la muerte del feto tras la administración intravenosa a monos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro sódico Hemihidrato de clorobutanol Bisulfito sódico (E222)
Ácido clorhídrico (para ajustar el pH) Hidróxido de sodio (para ajustar el pH) Agua para inyectables
6.2 Incompatibilidades
No procede.
6.3 Período de validez 18 meses.

6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25° C.
No refrigerar o congelar.
Conservar en el embalaje original para protegerlo de la luz.
La epinefrina es fotosensible. Los pacientes deben inspeccionar periódicamente la solución contenida en Twinject para detectar cualquier cambio de color. Si la solución presenta alguna coloración, el paciente debe sustituir el Twinject que le han proporcionado.
6.5 Naturaleza y contenido del envase
Una jeringa precargada compuesta por un cartucho de vidrio borosilicatado de tipo I con una tapa de aluminio (que contiene un tapón de goma de clorobutilo) y un émbolo de goma de clorobutilo. El fármaco y la estructura del acondicionamiento primario se proveen con un cono de aguja de polipropileno, una aguja de acero inoxidable y un capuchón que cubre la aguja de polietileno transparente que se encuentran en el interior de un medidor (autoinyector) con dos dosis de fármaco que contiene 1,1 ml de epinefrina.
La jeringa precargada está montada dentro de un ensamblaje de plexiglás que se guarda en una maleta portadora de polipropileno dentro de una caja de cartón.
Tamaños de envases: Un envase de cartón que contiene una unidad de 0,3 mg o envase de cartón con dos paquetes que contienen dos unidades de 0,3 mg y una muestra de demostración.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Instrucciones de uso:
De un solo uso (cada Twinject contiene dos dosis de 0,3 mg).
Se recomienda que un médico o farmacéutico haga una demostración real de la técnica de inyección. Con este fin se proporciona una muestra de demostración que no contiene ninguna aguja ni epinefrina.
PRIMERA DOSIS PASO 1
Extraiga el Twinject de la maleta portadora azul.
• Retire el primer capuchón VERDE [con la etiqueta 1] y observará una punta ROJA. Nunca debe poner el pulgar, el dedo o la mano sobre la punta ROJA.

• Retire el segundo capuchón VERDE [con la etiqueta 2].
PASO 2
• Coloque la punta ROJA en la zona media de la cara extema del muslo (la parte superior de la pierna) como se indica en la ilustración. Twinject puede inyectarse por encima de la ropa, incluso de la más gruesa, como por ejemplo unos pantalones vaqueros.
• Presione fuerte hasta que la aguja se introduzca en el muslo (la parte superior de la pierna) atravesando la piel. Manténgala en esa posición mientras cuenta lentamente hasta diez.
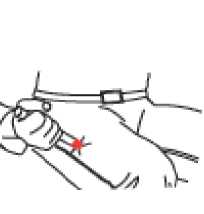

• Extraiga el Twinject del muslo.
• Compruebe la punta ROJA; si la aguja está expuesta, se ha recibido la dosis. Si no se ve la aguja, debe repetirse el paso 2 de la primera dosis. Asegúrese de que ha extraído los dos capuchones verdes con las etiquetas 1 y 2 antes de repetir el paso 2.
En este momento, el paciente debe solicitar inmediatamente asistencia médica urgente. El paciente debe prepararse para la segunda dosis.
DESPEGAR

PREPARACIÓN DE LA SEGUNDA DOSIS PASO 1
• Sujete cuidadosamente la punta roja evitando el contacto con la aguja. Desenrosque el tambor de la unidad de Twinject hasta que la tapa se suelte totalmente del tambor. Separe con cuidado el tambor de la tapa evitando tocar o doblar la aguja expuesta.
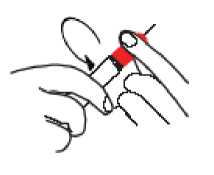
PASO 2
• Sostenga el plástico AZUL para extraer la jeringa del tambor (no toque la aguja).
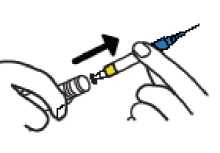
PASO 3
• Retire el precinto AMARILLO del émbolo. Tenga cuidado de no tirar del émbolo al retirar el precinto AMARILLO.
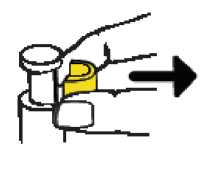
HAGA UNA PAUSA EN ESTE MOMENTO
El paciente o el cuidador deben prestar especial atención a los posibles riesgos para el paciente si la aguja se contamina entre ambas inyecciones (por ejemplo si cae al suelo), además del riesgo de pinchar a otra persona con la aguja. Por lo tanto, es necesario que el paciente o el cuidador manipulen la jeringa con mucho cuidado para garantizar que la aguja no entra en contacto con ninguna otra superficie. También debe avisar a las personas próximas de que hay una aguja expuesta.
PASO 4 (ADMINISTRACIÓN DE LA SEGUNDA DOSIS)
Si los síntomas del paciente no mejoran en un período aproximado de cinco minutos tras la administración de la primera inyección, debe inyectarse la segunda dosis.
• Introduzca la aguja en la zona media de la cara externa del muslo (la parte superior de la pierna) atravesando la piel, como se indica en la ilustración.
• Presione el émbolo hasta que alcance su recorrido completo.
Jeringa
V
Émbolo

• Extraiga la jeringa del Twinject de la piel.
El volumen restante (aproximadamente 0,5 ml) de la jeringa tras la administración de las dos dosis fijas no puede inyectarse de nuevo, y debe desecharse la jeringa según las instrucciones (ver la sección 6.6).
En los casos en que no se haya administrado la segunda dosis, también debe desecharse la jeringa (con la epinefrina sobrante).
Tras su utilización, no intente reponer el capuchón de la aguja.
Coloque una de las mitades de la maleta de transporte en una superficie lisa y deslice la jeringa con la aguja hacia abajo en la maleta de transporte.
Coloque la otra mitad de la maleta de transporte y ciérrela.
Sustituya el Twinject utilizado lo antes posible.
El producto utilizado debe entregarse al personal sanitario auxiliar o al farmacéutico que atienden al paciente en el momento en que se sustituye el producto.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Shionogi Ireland 145 Lakeview Drive Airside Business Park Swords
County Dublin Irlanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
[Para cumplimentar en cada país]
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Junio de 2011
10. FECHA DE LA REVISIÓN DEL TEXTO
Agosto de 2010
Agencia española de
medicamentos y
productos sanitarios