Suprecur Depot 3,6 Mg
Información obsoleta, busque otroDE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
1 | |
|
Oí |
k agencia española de 1 medicamentos y I productos sanitarios |
Suprecur® Depot 3,6 mg Inyección subcutánea. D.C.I.: acetato de buserelina.
Este prospecto le proporciona información importante sobre este medicamento.
Se actualiza periódicamente.
Por favor léalo con atención y si tiene alguna pregunta acuda a su médico o farmacéutico.
COMPOSICION
Una jeringa contiene 3,6 mg de acetato de buserelina (DCI) equivalentes a 3,4 mg de buserelina.
Excipientes:
Cámara 1:
Poli-(D,L-láctido-co-glicólido) 1:1, dextrano 40, polisorbato 40, cloruro sódico.
Cámara 2:
Agua para inyección.
FORMA FARMACEUTICA Y CONTENIDO DEL ENVASE.
Polvo y disolvente para suspensión inyectable. Para inyección subcutánea.
Suprecur® Depot se presenta en forma de jeringa precargada para inyección subcutánea en un envase con 1 ó 3 jeringas precargadas de doble cámara, conteniendo cada una de ellas 3,6 mg de acetato de buserelina en forma de polvo en una de las cámaras y 1,5 ml de agua para inyección como disolvente (para la resuspensión) en la otra cámara.
TIPO DE ACTIVIDAD
Actúa impidiendo la secreción de estrógenos produciendo la supresión de la función de los ovarios.
TITULAR DE LA AUTORIZACION
Hoechst Marion Roussel, S.A.
Ronda General Mitre, 72-74.
08017 Barcelona.
FABRICANTE
Hoechst Marion Roussel Deutschland, GmbH.
D-65926 Frankfurt am Main Alemania
Ó
Vetter Pharma-Fertigung GmbH & Co KG
D-88212 Ravensburg
Alemania
INDICACIONES
Siempre bajo prescripción médica, este medicamento está indicado para el tratamiento preoperatorio sintomático de los fibromas uterinos.
CONTRAINDICACIONES
No debe ser tratada con Suprecur® Depot si ha presentado en algún momento una
reacción alérgica al acetato de buserelina, a los análogos de la LHRH o a cualquiera de sus excipientes.
En caso de duda sobre si debe tomar este medicamento pida consejo a su médico o farmacéutico.
PRECAUCIONES
Correo electrónicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
El uso durante el embarazo no está indicado, por lo que usted deberá iniciar el tratamiento en el primer o segundo día de la menstruación con la finalidad de excluir esta posibilidad; ante la duda es recomendable la realización de un test de embarazo.
Si está usted tomando anticonceptivos deberá dejar de tomarlos antes de comenzar el tratamiento con Suprecur® Depot.
Si toma Suprecur® Depot de una manera periódica, cada mes, no es probable que usted se quede embarazada, sin embargo por razones de seguridad debería utilizar métodos alternativos de contracepción, no hormonales ( p.ej. preservativos) durante el tratamiento. Si a pesar de ello se quedara embarazada, será necesario suspender el tratamiento.
Se requiere un control especial de la presión arterial y del azúcar en sangre en pacientes hipertensos y diabéticos, respectivamente, ya que su situación podría empeorar.
Si ha padecido o padece depresión coménteselo a su médico, ya que existe riesgo de que la depresión vuelva a aparecer o empeore si ya la padece.
El tratamiento con agonistas de la LHRH puede ocasionar pérdidas de hueso [masa y matriz óseas], por lo que su médico deberá valorar cuidadosamente el riesgo de la administración de Suprecur® Depot frente al efecto beneficioso previsto, sobre todo en las siguientes situaciones:
-cuando usted tenga que ser sometida a tratamientos repetidos con este medicamento.
-si presenta osteoporosis o está siendo tratada con corticosteroides durante un período largo de tiempo.
INTERACCIONES
Informe a su médico acerca de todos los medicamentos que esté tomando, incluidos los que ha comprado sin receta, ya que alguno de ellos podría presentar alguna interacción con Suprecur® Depot.
Así mismo no tome ningún medicamento nuevo sin consultar con su médico.
El efecto de los antidiabéticos puede verse reducido durante el tratamiento con este medicamento.
El éxito global del tratamiento puede verse afectado si, además de con Suprecur® Depot, es tratada con hormonas sexuales (estrógenos).
INCOMPATIBILIDADES
Suprecur® Depot inyección subcutánea no debe mezclarse con otros medicamentos en la misma jeringa. ADVERTENCIAS
Embarazo y lactancia: Suprecur® Depot no debe ser administrado durante el embarazo ni durante el periodo de lactancia.
Efectos sobre la capacidad de conducir vehículos y manejar maquinaria:
Ciertos efectos indeseables como p.ej. vértigo, pueden alterar su capacidad de concentración o reacción y por consiguiente constituyen un riesgo en situaciones en las que éstas son de especial importancia como es el caso de la conducción de vehículos y el manejo de maquinaria.
POSOLOGIA
El tratamiento debe iniciarse en el primer o segundo día de la menstruación, a intervalos de 1 mes durante los 3 meses anteriores a la intervención quirúrgica programada. El intervalo entre dos inyecciones consecutivas deberá ser de 28 hasta un máximo de 35 días. La intervención quirúrgica se deberá practicar antes de transcurridas 5 semanas desde la última inyección.
Cada mes se administra una dosis de 3,6 mg de acetato de buserelina mediante inyección subcutánea, preferentemente en la pared del abdomen y eligiendo para cada inyección un punto diferente.
Se recomienda insertar la aguja 1 ó 2 cm en el tejido subcutáneo, cerciorándose antes de que la aguja no se ha introducido en un vaso sanguíneo. Es importante que la suspensión de micropartículas se inyecte inmediatamente después de su reconstitución.

INSTRUCCIONES PARA LA CORRECTA ADMINISTRACION
ESTE MEDICAMENTO DEBE SER ADMINISTRADO POR UNA PERSONA ESPECIALIZADA. Preparar buserelina micropartículas para inyección en la forma siguiente (7 ilustraciones):
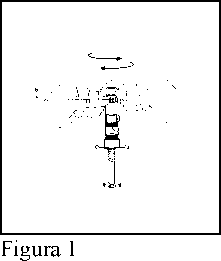
1. Sujetar la jeringa por la banda (A), seguidamente girar el precinto (B).
(Figura 1)
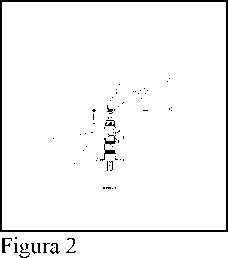
2. Retirar el tapón gris (C). (Figura 2)
3. Sin retirar el capuchón protector, insertar la aguja en la jeringa (D) (Figura 3)

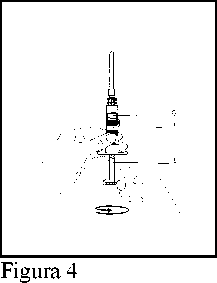
4. Girar el émbolo (E) hasta que la totalidad del agua para inyección haya pasado desde la cámara posterior (F) a la cámara anterior (G) de la jeringa. El émbolo debe girar libremente de modo que más tarde pueda ser presionado hacia delante para realizar la inyección.
(Figura 4)
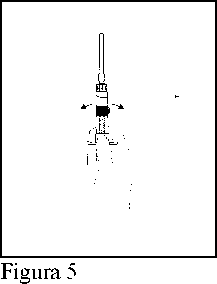
5. Suspender las micropartículas presentes en la mezcla, formadas a partir de la sustancia seca y el agua (H) dando ligeros golpecitos en la jeringa de uno y otro lado hasta que se forma una suspensión uniforme.
(Figura 5)
6. Retirar el capuchón protector de la aguja (J). (Figura 6)
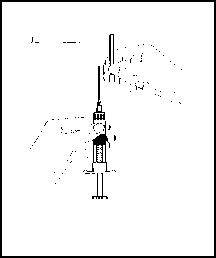
Figura 6
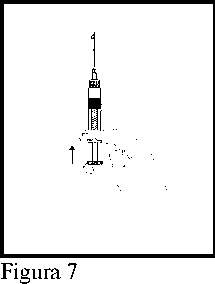
7. Expeler el aire restante de la cámara anterior y la aguja. La jeringa está preparada para efectuar la inyección de forma inmediata.
(Figura 7).
SOBREDOSIS.
Hasta el presente no se ha observado ningún caso de intoxicación con buserelina. Los efectos descritos con la sobredosis de buserelina no difieren de los efectos adversos observados durante su utilización normal. En caso necesario, el tratamiento de la sobredosis será sintomático.
En caso de sobredosis o ingestión accidental, consultar al Servicio de Información Toxicológica. Teléfono 91 5 62 04 20.
REACCIONES ADVERSAS
Pueden aparecer hemorragias uterinas en las primeras semanas de tratamiento, quistes ováricos (en la fase inicial del tratamiento), alteraciones óseas (disminución de la masa y matriz óseas) tras repetidos ciclos de tratamiento, flujo vaginal, sequedad vaginal, coito difícil o doloroso (dispareunia), aumento o disminución del tamaño de los senos con mayor sensibilidad a la presión, disminución del apetito sexual, sofocos; aumento de la sudoración, sequedad de piel, acné, aumento o pérdida de cabello; dolor de cabeza (en raras ocasiones de tipo migraña), palpitaciones, nerviosismo, alteraciones del sueño, cansancio, somnolencia, vértigo, inestabilidad emocional; dolor abdominal, náuseas, vómitos, diarrea, estreñimiento; aumento o disminución del peso corporal, dolor de espalda y dolor en las extremidades, dolor y rigidez muscular, molestias articulares; dolor o reacciones locales en el punto de inyección.
Ocasionalmente puede aparecer sequedad ocular (que puede dar lugar a irritación ocular en pacientes que usan lentes de contacto), alteración visual (p.ej. visión borrosa), sensación de presión detrás del ojo (retroocular); fragilidad de las uñas, aumento o disminución del vello corporal; secreción abundante de leche (galactorrea); edema (acumulación de agua) en cara y extremidades; alteraciones de la memoria y la concentración, sensación de ansiedad, depresión o agravamiento de una depresión preexistente; aumento de la sed, cambios en el apetito, pérdida de sensibilidad (parestesia); aumento de los niveles séricos de enzimas hepáticos (transaminasas) o la bilirrubina; reacciones en la piel tales como enrojecimiento de la piel, picor, rash cutáneo (incluyendo urticaria).
Raramente se han observado casos de alteración de los niveles de grasa en sangre (lípidos hemáticos); sensación de campanilleo (tinnitus), trastornos del oído, inflamación de la vejiga urinaria (cistitis).
En ocasiones contadas se ha dado aumento de la presión arterial y reducción de la tolerancia a la glucosa, reducción del número de plaquetas en la sangre (trombopenia), reducción del número de leucocitos en la sangre (leucopenia) y problemas respiratorios (broncospasmo y disnea).
En casos aislados se pueden producir reacciones alérgicas graves que pueden conducir a shock y destrucción de los fibromas uterinos.
El tratamiento prolongado con este medicamento puede llevar a la aparición de tumores de la glándula hipofisaria (adenomas hipofisarios), aunque hasta el momento no se ha observado ningún caso.
Al principio del tratamiento puede encontrarse peor, no se preocupe ya que esta situación es normal y desaparece.
CONSERVACION
No almacenar a temperatura superior a 25°C. Proteger de la luz.
Conserve el estuche y el prospecto hasta finalizar el tratamiento ya que ambos contienen información importante sobre el medicamento.
CADUCIDAD
Este medicamento no se debe utilizar después de la fecha de caducidad indicada en el envase. Especialidad de diagnostico hospitalario
LOS MEDICAMENTOS DEBEN MANTENERSE FUERA DEL ALCANCE DE LOS NIÑOS
Texto revisado: Febrero 2000
Con receta médica.
Suprecur® Depot 3,6 mg
(Acetato de buserelina)
H00000PR02a
Agencia española de
medicamentos y
productos sanitarios