Saronil 5 Mg Capsulas
Información obsoleta, busque otroDE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
1 | |
|
Oí |
k agencia española de 1 medicamentos y I productos sanitarios |
FICHA TÉCNICA
SARONIL® 5 mg / 5 ml solución inyectable y para perfusión
SARONIL® 5 mg cápsulas
1. NOMBRE DE LOS MEDICAMENTOS
Saronil® 5 mg / 5 ml solución inyectable y para perfusión, tropisetron (DOE) clorhidrato Saronil® 5 mg cápsulas, tropisetron (DOE) clorhidrato
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Saronil 5 mg / 5 ml solución inyectable y para perfusión 1 amp. (5ml) = tropisetron
(DOE) clorhidrato 5,64 mg
(equivalente a 5 mg de tropisetron (DOE) base)
Saronil 5 mg cápsulas 1 cáp. = tropisetron (DOE) clorhidrato 5,64 mg
(equivalente a 5 mg de tropisetron (DOE) base)
3. FORMA FARMACÉUTICA
Saronil 5 mg / 5 ml solución inyectable y para perfusión: Solución inyectable en ampollas para administración intravenosa (adultos y niños) y oral (niños).
Saronil 5 mg cápsulas : Cápsulas para administración oral (adultos y niños de más de 25 kg de peso).
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Prevención de náuseas y vómitos inducidos por la quimioterapia del cáncer.
4.2. Posología y forma de administración
Niños
En niños de más de 2 años de edad la dosis recomendada de Saronil es de 0,2 mg/kg hasta una dosis máxima diaria de 5 mg. Se recomienda la administración de Saronil por vía intravenosa el día 1, antes de la quimioterapia, bien en forma de infusión (diluida en una solución de infusión normal, como suero salino, solución de Ringer, glucosa 5%, o levulosa 5%) o bien en forma de inyección lenta (no inferior a 1 minuto), seguida de una administración oral durante los días 2 a 6.
Correo electrúnicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Saronil puede administrarse en forma de solución bebible, inmediatamente después de diluir la cantidad apropiada de tropisetron procedente de la ampolla, en zumo de naranja o cola, y deberá ingerirse por la mañana, una hora antes de ingerir cualquier alimento. Las cápsulas deberán ingerirse con agua por la mañana, inmediatamente después de despertarse, y una hora antes de ingerir cualquier alimento.
Adultos
En adultos la dosis recomendada de Saronil es de 5 mg/día durante 6 días, administrado por vía intravenosa el día 1, antes de la quimioterapia, bien en forma de infusión (diluida en una solución de infusión normal, como suero salino, solución de Ringer, glucosa 5%, o levulosa 5%) o bien en forma de inyección lenta (no inferior a 1 minuto), seguida de una administración oral durante los días 2 a 6. Las cápsulas deberán ingerirse con agua por la mañana, inmediatamente después de despertarse, y una hora antes de ingerir cualquier alimento.
La eficacia terapéutica de tropisetron puede verse incrementada por la dexametasona.
4.3. Contraindicaciones
Hipersensibilidad conocida al tropisetron, a otros antagonistas de los receptores 5-HT3, o a cualquier otro componente de la fórmula (ver 6.1. “Lista de excipientes”). Saronil no debe administrarse a mujeres embarazadas (ver 4.6. “Embarazo y lactancia”).
4.4. Advertencias y precauciones especiales de empleo Metabolizadores lentos de esparteína/debrisoquina
En los pacientes que pertenecen a este grupo (aprox. el 8% de la población caucasiana), se prolonga la vida media de eliminación del tropisetron (4-5 veces más larga que en los metabolizadores rápidos). No obstante, cuando Saronil se administró por vía i.v. a dosis de hasta 40 mg dos veces al día, durante un período de 7 días a voluntarios sanos que eran metabolizadores lentos, no se produjeron reacciones adversas graves.
Estas observaciones indican que en los pacientes con metabolismo lento, sometidos a tratamientos de 6 días, no es necesario reducir la dosis diaria habitual de 5 mg.
Pacientes con trastornos de la función hepática o renal
No se produce ningún cambio en la farmacocinética de tropisetron en los pacientes con hepatitis aguda o esteatosis hepática. En contraposición, los pacientes con cirrosis hepática o disfunción renal pueden presentar concentraciones plasmáticas hasta en un 50% superiores a las halladas en voluntarios sanos correspondientes al grupo de metabolizadores rápidos de
esparteína/debrisoquina. No obstante, no es necesario reducir la dosis en estos pacientes, cuando se administra la dosis recomendada de 5 mg/día durante 6 días.
Niños
Se ha observado que Saronil se tolera bien en niños de más de 2 años de edad (ver sección 4.2. Posología y forma de administración: niños).


Pacientes de edad avanzada
No se ha observado que los pacientes de edad avanzada requieran dosis diferentes o experimenten efectos secundarios distintos a los de pacientes más jóvenes.
Pacientes con hipertensión
En pacientes con hipertensión no controlada, deberán evitarse dosis diarias de Saronil superiores a 10 mg, dado que puede causar un mayor aumento de la presión sanguínea.
4.5. Interacción con otros medicamentos y otras formas de interacción
La administración concomitante de Saronil con rifampicina o con otros fármacos inductores de enzimas hepáticos (p.ej. fenobarbital) produce concentraciones plasmáticas más bajas de tropisetron, lo que hace necesario un aumento de la dosis en metabolizadores rápidos (pero no en metabolizadores lentos).
Los efectos de los inhibidores del enzima citocromo P450, como cimetidina, sobre los niveles plasmáticos de tropisetron, son insignificantes y no requieren ajuste de dosis.
La ingestión de la cápsula con comida puede producir un ligero aumento de la biodisponibilidad, del 60 al 80% aprox., que no es clínicamente significativo.
_Se han observado prolongaciones del intervalo QTc no significativas clínicamente. Por lo
tanto, debe tenerse precaución cuando se administra tropisetron concomitantemente con otros fármacos susceptibles de prolongar el intervalo QTc.
4.6. Embarazo y lactancia
Dado que Saronil no ha sido estudiado durante el embarazo en humanos, no debe administrarse a mujeres embarazadas.
En la rata, tras la administración de tropisetron marcado se excretó radioactividad en la leche. No se sabe si tropisetron pasa a la leche materna, por lo que las madres bajo tratamiento con Saronil deberán suspender la lactancia.
4.7. Efectos sobre la capacidad para conducir vehículos y utilizar maquinaria
No existen datos del efecto de este fármaco sobre la capacidad para conducir vehículos. Deberá tenerse en cuenta la aparición de sensación de mareo como efecto secundario.
4.8. Reacciones adversas
En general, las reacciones adversas son pasajeras a la dosis recomendada. Las reacciones adversas descritas con mayor frecuencia fueron cefalea, estreñimiento, y menos frecuentemente se observó, sensación de mareo, fatiga y trastornos gastrointestinales, tales como dolor abdominal y diarrea.
Como con otros antagonistas de los receptores 5-HT3, se han observado en raras ocasiones, reacciones de hipersensibilidad (“reacciones tipo I”) con uno o más de los síntomas siguientes:
ruborización facial y/o urticaria generalizada, tensión cardíaca, disnea, broncoespasmo agudo, hipotensión.
En muy raras ocasiones, se ha descrito colapso, síncope o paro cardíaco, pero no se ha establecido la relación con Saronil. Algunas pueden ser causadas por el tratamiento concomitante o a la propia enfermedad.
4.9. Sobredosificación
Síntomas: A dosis repetidas muy altas, se han observado alucinaciones visuales, y en los pacientes con hipertensión previa, un aumento de la presión sanguínea.
Tratamiento: Se recomienda un tratamiento sintomático con monitorización frecuente de los signos vitales, así como una estrecha vigilancia del paciente.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antagonista de los receptores 5-HT3.
Mecanismo de acción: Tropisetron es un antagonista competitivo selectivo muy potente de los receptores 5-HT3, una subclase de los receptores de la serotonina localizados en las neuronas periféricas y dentro del SNC.
Se cree que algunas substancias, incluyendo ciertos agentes quimioterápicos provocan la liberación de la serotonina (5-HT) de las células tipo enterocromafines en la mucosa visceral e inician el reflejo de la emesis, junto con su correspondiente sensación de náuseas.
Tropisetron bloquea selectivamente la excitación de los receptores 5-HT3 presinápticos de las neuronas periféricas durante este reflejo, y puede ejercer acciones directas adicionales dentro del SNC sobre los receptores 5-HT3, mediando las acciones del estímulo vagal hacia el área postrema.
Estos efectos se consideran el principal mecanismo de acción del efecto antiemético del tropisetron.
Saronil posee una duración de acción de 24 horas que permite una administración única al día.
En los estudios en los que Saronil ha sido administrado durante ciclos múltiples de quimioterapia, el tratamiento ha seguido siendo efectivo. Saronil previene las náuseas y vómitos inducidos por la quimioterapia del cáncer sin causar efectos secundarios extrapiramidales.
5.2. Propiedades farmacocinéticas
Absorción
Saronil se absorbe casi completamente (más de un 95%) en el tracto gastrointestinal, con una vida media de absorción de aproximadamente 20 minutos.
Distribución
El tropisetron se une en un 71% a las proteínas plasmáticas (especialmente ai-glicoproteínas) de forma no específica.
En adultos el volumen de distribución es de 400-600 L; en niños de 3 a 6 años es de 145 L aproximadamente y en niños de 7 a 15 años es de 265 L aproximadamente.
Biotransformación
La concentración plasmática máxima se alcanza al cabo de 3 horas. La biodisponibilidad absoluta es dependiente de la dosis y es del 60% a una dosis de 5 mg y mayor (hasta 100%) a una dosis de 45 mg.
En niños la biodisponibilidad absoluta y semivida terminal fue similar a la de los voluntarios sanos.
El metabolismo de tropisetron se produce por hidroxilación en las posiciones 5, 6 ó 7 del anillo indol, seguida de una reacción de conjugación, dando glucurónidos o sulfatos, y excreción en la orina o bilis (relación orina/heces, 5:1). Los metabolitos presentan una potencia muy reducida frente a los receptores 5-HT3 y no contribuyen a la acción farmacológica del fármaco. El metabolismo de tropisetron está ligado al polimorfismo de esparteína/debrisoquina determinado genéticamente. Se sabe que aproximadamente el 8% de la población caucasiana son metabolizadores lentos para la vía esparteína/debrisoquina.
Eliminación
La vida media de eliminación (fase P) es de aprox. 8 horas en los metabolizadores rápidos; en los metabolizadores lentos podría llegar a 45 horas (ver 4.4. “Advertencias y precauciones especiales de empleo”). El aclaramiento total de tropisetron es de aproximadamente 1 L/min. con un aclaramiento renal de aproximadamente el 10%. En los metabolizadores lentos, el aclaramiento total se reduce a 0,1-0,2 L/min., aunque el aclaramiento renal permanece inalterado. Esta reducción del aclaramiento no renal provoca una vida media de eliminación de 4 a 5 veces más larga y valores AUC de 5 a 7 veces más altos. Los valores de Cmáx y volumen de distribución no muestran diferencia alguna en comparación con los metabolizadores rápidos. En los metabolizadores lentos, se excreta en orina una mayor proporción de tropisetron inalterado que en los metabolizadores rápidos.
Los enzimas hepáticos que intervienen en el metabolismo de tropisetron pueden saturarse durante dosis múltiples, lo que podría conducir a un aumento de los niveles plasmáticos del fármaco de forma dosis-dependiente, durante administraciones repetidas. Esta acumulación es sólo farmacocinéticamente relevante a dosis superiores a 10 mg de Saronil, dos veces al día. No obstante, incluso en los metabolizadores lentos la exposición total al fármaco bajo estas condiciones es permisible dentro de los niveles tolerados por los pacientes y no debe suponer ningún problema clínico, siempre y cuando no se exceda la dosis recomendada de 5 mg una vez al día durante 6 días.
5.3. Datos preclínicos sobre seguridad
Toxicidad aguda
La dosis mínima letal fue de 30 mg/kg para ratones y ratas después de la administración i.v. y de 420 mg/kg para ratones y de 180 mg/kg para ratas después de la administración oral.
Las correspondientes dosis no letales fueron de 18 y 24 mg vía i.v. en ratones y ratas y de 300 y 100 mg/kg vía oral en ratones y ratas, respectivamente.
Toxicidad crónica y subcrónica
Administración oral
En estudios de toxicidad crónica en ratas y perros se investigó la tolerancia después de una administración oral durante 6 meses.
Con dosis elevadas de hasta 40 veces la dosis humana, se observó una ligera disminución del peso corporal y de la ingesta de comida. Los niveles de dosificación conseguidos sin efectos tóxicos fueron: 20 mg/kg al día en ratas y 20 mg/kg al día en perros.
Administración intravenosa
En perros, la administración intravenosa de tropisetron durante un período de 6 a 26 semanas produjo ligeras alteraciones clínicas tales como vómitos, incremento en la salivación, excitación y diarrea. Estos efectos indeseables, también observados en los grupos de control con placebo (aunque menos pronunciados), fueron reversibles después de la finalización del tratamiento.
En perros, la dosis sin efecto tóxico fue desde 3 hasta 10 mg/kg al día (administración en bolus).
Carcinogenicidad
En estudios de carcinogenicidad de dos años de duración en ratas y ratones, la incidencia de adenomas hepáticos aumentó únicamente en ratones macho que recibieron 30 y 90 mg/kg por día.
Estudios adicionales de investigación “in-vitro” e “in-vivo” sostuvieron que los efectos observados en el hígado de ratones macho, eran específicos de las especies y el sexo.
Toxicidad sobre la reproducción
Se estudió la toxicidad sobre la reproducción tras la administración oral en ratas y conejos.
Los parámetros de reproducción en ratas macho no se vieron influenciados por tropisetron administrado, en dosis diarias de hasta 45 mg/kg.
En ratas hembra, dosis a partir de 15 mg/kg por día, tóxicas para la madre, (150 veces la dosis diaria humana) perjudicaron la capacidad reproductora. No se observaron efectos embriotóxicos con dosis diarias de hasta 20 mg/kg en ratas y de 60 mg/kg en conejos. Se observó la muerte de embriones con dosis extremadamente elevadas, de 60 mg/kg por día en ratas, que fueron también tóxicas para las madres. En conejos se obtuvieron resultados similares, con dosis diarias de 120 mg/kg. Como consecuencia del embarazo prolongado en ratas, se redujo el peso de los fetos, y la mortalidad peri y post-natal aumentó.
Mutagenicidad
Investigaciones realizadas en ratones sobre la mutagenicidad in vivo e in vitro no proporcionaron evidencia alguna sobre el efecto mutagénico del tropisetron.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Saronil 5 mg / 5 ml solución inyectable y para perfusión: Ácido acético glacial, acetato de sodio trihidrato, cloruro de sodio, agua para inyección.
Saronil 5 mg cápsulas : Sílice coloidal anhidra, estearato magnésico, almidón de maíz, lactosa (52,86 mg/cáp.), óxido de hierro amarillo (E 172), óxido de hierro rojo (E 172), dióxido de titanio (E 171), gelatina, goma laca.
6.2. Incompatibilidades
Saronil 5 mg / 5 ml solución inyectable y para perfusión
Las soluciones para inyección que muestran ser compatibles con la solución de Saronil 5 mg / 5 ml solución inyectable y para perfusión se describen en el apartado 6.6 “Instrucciones de uso/manipulación”.
Saronil 5 mg cápsulas
Ninguna.
6.3. Período de validez
El período de validez es de 3 años tanto para Saronil 5 mg / 5 ml solución inyectable y para perfusión como para Saronil 5 mg cápsulas.
La fecha de caducidad está indicada en el envase.
horas. Desde un Si no se utiliza utilización son
Las soluciones diluidas son física y químicamente estables durante al menos 24 punto de vista microbiológico, el producto debería utilizarse inmediatamente. inmediatamente, el tiempo y las condiciones de conservación antes de su responsabilidad del manipulador y no debe exceder las 24 horas a 2-8 °C.
6.4. Precauciones especiales de conservación
Ninguna.
6.5. Naturaleza y contenido del recipiente
Saronil 5 mg / 5 ml solución inyectable y para perfusión: Las ampollas son de vidrio incoloro con una línea de ruptura por debajo del punto coloreado y dos anillos de color azul.
ESPECIALIDAD DE USO HOSPITALARIO / H
Saronil 5 mg cápsulas: Las cápsulas se acondicionan en blisters de PVC/PVDC. Las cápsulas son de gelatina dura del tamaño n° 3 con la parte superior de color amarillo opaco con el triángulo Sandoz grabado en rojo y la parte inferior de color blanco opaco con la inscripción Saronil y la concentración 5 mg impresa en rojo.
ESPECIALIDAD DE DIAGNOSTICO HOSPITALARIO / DH
6.6. Instrucciones de uso / manipulación
Las ampollas de vidrio de Saronil contienen una solución acuosa de 5 mg/5 ml. Esta solución es compatible con las siguientes soluciones de infusión (1 mg de tropisetron diluido en 20 ml): glucosa 5% (p/v); manitol 10% (p/v); solución de Ringer; cloruro de sodio 0,9% (p/v) y cloruro de potasio 0,3% (p/v); y levulosa 5% (p/v). Las soluciones son también compatibles con los tipos de envase habituales (vidrio, PVC) y sus correspondientes equipos de infusión.
Saronil 5 mg / 5 ml, solución inyectable y para perfusión:
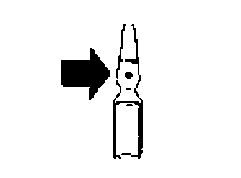
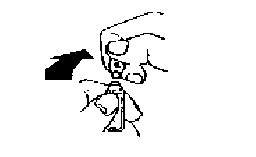
Colocar el pulgar por encima del punto coloreado y romper la ampolla presionando hacia atrás.
6.7.
Ampolla rompible.
Línea de ruptura por debajo del punto coloreado.
Nombre o razón social y domicilio permanente o sede social del titular de la autorización de comercialización
Novartis Farmacéutica, S.A.
Gran Via de les Corts Catalanes, 764 08013 - Barcelona
Fecha de publicación : Octubre 2003
Agencia española de
medicamentos y
productos sanitarios