Sandostatin 0,5 Mg/Ml Solucion Inyectable
Información obsoleta, busque otroDE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
1 | |
|
Oí |
k agencia española de 1 medicamentos y I productos sanitarios |
FICHA TÉCNICA
1. DENOMINACIÓN DEL MEDICAMENTO
Sandostatin 0,5 mg/ml solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ampolla de 1 ml contiene: 0,5 mg de octreotida. Lista de excipientes, en 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
- Acromegalia
de hormona del inadecuadamente en pacientes a sufrir una resulte completamente
Para el control sintomático y reducción de los niveles plasmáticos crecimiento y Somatomedina-C en pacientes con acromegalia que responden al tratamiento convencional. El tratamiento con Sandostatin® también está indicado acromegálicos que presentan malas condiciones físicas o se muestran poco dispuestos
intervención quirúrgica, o en el período intermedio hasta que la radioterapia efectiva.
- Tumores gastroenteropancreáticos
Para la mejoría de los síntomas asociados a tumores endocrinos gastroenteropancreáticos:
- Tumores carcinoides.
- VIPomas.
- Otros tumores gastroenteropancreáticos: glucagonomas, gastrinomas, insuli-nomas,
GRFomas.
Sandostatin® no es un tratamiento antitumoral y no resulta curativo en estos pacientes.
Correo electrónicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID

- Prevención de las complicaciones surgidas tras la cirugía pancreática
Para la prevención de las complicaciones surgidas tras la cirugía pancreática.
- Varices gastro-esofágicas sangrantes
En el tratamiento de urgencia para detener la hemorragia y proteger de una hemorragia recurrente debido a varices gastro-esofágicas en pacientes afectos de cirrosis.
Sandostatin® debe ser utilizado en asociación con un tratamiento específico, como es, la escleroterapia endoscópica.
4.2 Posología y forma de administración
- Acromegalia
Inicialmente, 0,05-0,1 mg por inyección subcutánea cada 8 ó 12 horas. El ajuste de dosis debe realizarse en base a una valoración mensual de los niveles de GH y a los síntomas clínicos, así como a la tolerancia. En la mayoría de los pacientes la dosis diaria óptima es de 0,2 a 0,3 mg. No debe sobrepasarse una dosis máxima de 1,5 mg al día.
Si a los 3 meses de tratamiento con Sandostatin® no se ha conseguido una reducción relevante de los niveles de GH ni una mejoría de los síntomas clínicos, debe considerarse la interrupción del tratamiento.
- Tumores endocrinos gastroenteropancreáticos
Inicialmente, 0,05 mg una o dos veces al día mediante inyección subcutánea. La dosis puede incrementarse gradualmente a 0,1-0,2 mg tres veces al día, según la respuesta clínica, efecto sobre los niveles de hormonas producidas por tumores (en casos de tumores carcinoides, sobre la excreción urinaria del ácido 5-hidroxiindol acético), y sobre la tolerancia.
En circunstancias excepcionales, pueden requerirse dosis superiores. Las dosis de mantenimiento son variables.
- Prevención de las complicaciones surgidas tras la cirugía pancreática
0,1 mg tres veces al día mediante inyección subcutánea durante 7 días consecutivos, empezando en el día de la operación al menos 1 hora antes de la laparotomía.
- Varices gastro-esofágicas sangrantes
25 microgramos/hora durante 5 días mediante perfusión intravenosa continua. Sandostatin® puede utilizarse en dilución con solución salina fisiológica.
En pacientes cirróticos con varices gastro-esofágicas sangrantes, Sandostatin® ha sido bien tolerado a dosis de hasta 50 microgramos/hora durante 5 días administrado en perfusión i.v. continua.
Nota: Sandostatin® puede administrarse por vía intravenosa en perfusión continua a dosis medias de 0,025 a 0,05 mg/hora.
Los pacientes que se administran ellos mismos el fármaco mediante inyección subcutánea deben recibir instrucciones precisas del médico o ATS. Para reducir las molestias locales, se recomienda que la solución alcance la temperatura ambiente antes de su inyección. Deben evitarse las inyecciones múltiples en intervalos cortos y en el mismo lugar. Para prevenir la contaminación, se recomienda no pinchar más de 10 veces el tapón del vial multidosis.
En pacientes de edad avanzada tratados con Sandostatin® no existe evidencia de una tolerancia reducida o de exigencias posológicas diferentes. La experiencia con Sandostatin® en niños es muy limitada.
4.3 Contraindicaciones
Hipersensibilidad a la octreotida o a cualquiera de los componentes contenidos en las especialidades.
4.4 Advertencias y precauciones especiales de empleo
Debido a que los tumores de la hipófisis secretores de GH pueden, en algunas ocasiones, expandirse produciendo con ello graves complicaciones (ej.: defectos del campo visual), resulta esencial que todos los pacientes sean monitorizados cuidadosamente. Si existen muestras de una expansión del tumor deben considerarse procedimientos alternativos.
En el 10-20% de los pacientes tratados con Sandostatin® a largo plazo se ha descrito la formación de cálculos biliares. Por consiguiente, se recomienda realizar un examen ecográfico de la vesícula biliar antes y a intervalos de 6 a 12 meses, durante el tratamiento con Sandostatin®. Cuando se forman cálculos biliares, éstos son normalmente asintomáticos; los cálculos sintomáticos deberán tratarse para su disolución con ácidos biliares o mediante cirugía.
En los tumores endocrinos gastroenteropancreáticos tratados con Sandostatin® puede producirse, de forma excepcional, un fenómeno de escape del control sintomático con una rápida recurrencia de los síntomas graves.
En pacientes con insulinomas, Sandostatin® puede incrementar la intensidad y prolongar la duración de la hipoglucemia, debido a su mayor potencia relativa para inhibir la secreción de la hormona de crecimiento y del glucagón, que la de insulina, y a su corta duración de acción en la inhibición de la última. Tales pacientes deben ser observados minuciosamente al inicio de tratamiento con Sandostatin® y en los cambios de dosis. Las fluctuaciones importantes de concentración de glucosa sanguínea pueden reducirse posiblemente mediante la administración más frecuente de Sandostatin®.
Los pacientes con diabetes mellitus que precisan de un tratamiento con insulina pueden reducir las necesidades de la misma, tras la administración de Sandostatin®.
Durante los episodios de una hemorragia en pacientes cirróticos, existe un riesgo incrementado de desarrollo de diabetes insulino-dependiente o de cambios en la exigencia de insulina en pacientes con diabetes pre-existente, por lo que es obligatoria una monitorización apropiada de los niveles de glucosa en sangre.
4.5 Interacción con otros medicamentos y otras formas de interacción
Sandostatin® reduce la absorción intestinal de ciclosporina y retarda la de cimetidina.
4.6 Embarazo y lactancia
No se dispone de experiencia en la administración de Sandostatin® durante el embarazo o la lactancia. Solamente se administrará el fármaco a estos pacientes, cuando las circunstancias lo hagan necesario.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Ninguno.
4.8 Reacciones adversas
Las principales reacciones adversas encontradas tras la administración de Sandostatin® son locales y gastrointestinales.
Las reacciones locales tras la administración s.c. de Sandostatin® incluyen dolor, sensación de picor, escozor o ardor en el lugar de la inyección con enrojecimiento e inflamación. En raras ocasiones la duración de estos síntomas es superior a 15 minutos.
Las molestias locales pueden reducirse permitiendo que la solución alcance la temperatura ambiente antes de su inyección o inyectando un volumen inferior utilizando la solución más concentrada.
Las reacciones adversas gastrointestinales incluyen anorexia, náuseas, vómitos, espasmos abdominales, distensión abdominal, flatulencia, deposiciones líquidas, diarrea y esteatorrea. Aunque la medición de la excreción grasa fecal puede aumentar, no existe evidencia hasta la fecha de que el tratamiento a largo plazo con Sandostatin® produzca una deficiencia nutricional debida a una malabsorción.
En raras ocasiones, las reacciones adversas gastrointestinales pueden parecerse a una obstrucción intestinal aguda con distensión abdominal progresiva, dolor epigástrico intenso con resistencia.
A fin de reducir la aparición de las reacciones adversas gastrointestinales, se recomienda administrar Sandostatin® entre las comidas o antes de acostarse.
El uso prolongado de Sandostatin® puede dar como resultado la formación de cálculos biliares (ver “Advertencias y Precauciones especiales de empleo”).
Debido a su acción inhibidora sobre la hormona de crecimiento, glucagón e insulina, Sandostatin® puede afectar en la regulación de la glucosa. Puede alterarse la tolerancia a la glucosa postprandial y, en raras ocasiones, con la administración crónica puede inducirse un estado de hiperglucemia persistente. También se han observado casos de hipoglicemia. Raramente se ha observado pérdida de cabello en pacientes tratados con Sandostatin®.
En raras ocasiones se han notificado casos de pancreatitis aguda. Generalmente, este efecto se observa durante las primeras horas o días del tratamiento con Sandostatin®, y revierte tras la retirada del fármaco. Además, la pancreatitis puede desarrollarse en pacientes que han sido sometidos a un tratamiento con Sandostatin® a largo plazo y han desarrollado colelitiasis.
Se han descrito casos aislados de disfunción hepática o biliar asociada a la administración de Sandostatin®, consistente en lo siguiente:
- Hepatitis aguda sin colestasis que al suspender la administración de Sandostatin® ha producido una normalización de los valores de las transaminasas.
- Desarrollo lento de hiperbilirrubinemia asociado a la elevación de fosfatasa alcalina, gamma-glutamil transferasa y, en menor proporción, de transaminasas.
4.9 Sobredosis
Después de una sobredosificación masiva, no se han descrito reacciones que pongan en peligro la vida del paciente. La dosis única máxima administrada hasta el momento, ha sido 1,0 mg mediante inyección intravenosa.
Los síntomas y signos observados fueron una breve caída en la frecuencia cardíaca, ruborización facial, calambres abdominales, diarrea, sensación de vacío en el estómago y náuseas, que se corrigieron durante las 24 horas siguientes a la administración del fármaco.
Se ha descrito un paciente que recibió una sobredosificación accidental de Sandostatin® mediante perfusión continua (0,25 mg por hora durante 48 horas en lugar de 0,025 mg por hora). El paciente no experimentó reacciones adversas.
El tratamiento de la sobredosificación es sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: inhibidores de la hormona del crecimiento, código ATC: H01CB02
Sandostatin® es un octapéptido sintético derivado de la somatostatina de origen natural, con efectos farmacológicos similares, pero con una duración de acción considerablemente superior. Inhibe la secreción basal y patológicamente aumentada de la hormona del crecimiento (GH), y de péptidos y serotonina producidos en el sistema endocrino gastroenteropancreático (GEP).
En animales, Sandostatin® es un inhibidor más potente de la hormona del crecimiento, del glucagón y de la liberación de insulina, que la somatostatina, con mayor selectividad para la GH y supresión del glucagón. La administración crónica (26 semanas) de una dosis máxima de 1 mg/kg al día (por vía intraperitoneal) en rata y de una dosis máxima de 0,5 mg/kg al día (por vía intravenosa) en perro, ha sido bien tolerada.
En individuos sanos normales Sandostatin® ha producido inhibición de:
- Liberación de la hormona del crecimiento (GH) estimulada por: arginina, ejercicio e hipoglucemia inducida por insulina.
- Liberación postprandial de insulina, glucagón, gastrina, otros péptidos del sistema GEP, y liberación de insulina y glucagón estimulada por arginina.
- Respuesta de la hormona estimulante del tiroides (TSH) inducida por la hormona liberadora de tirotropina (TRH).
En pacientes con acromegalia (incluyendo los que no han respondido a cirugía, radiación o tratamiento con agonistas dopaminérgicos) Sandostatin® reduce los niveles plasmáticos de hormona del crecimiento y/o de Somatomedina-C. Una reducción clínicamente relevante de GH (un 50% o más) tiene lugar en casi todos los pacientes, y una normalización (GH plasmática < 5 ng/ml) puede obtenerse en aproximadamente la mitad de los casos. En la mayoría de los pacientes Sandostatin® reduce de forma muy notable los síntomas clínicos de la enfermedad tal como la cefalea, infiltración de la piel y tejidos blandos, hiperhidrosis, artralgia y parestesias. En pacientes con macroadenoma hipofisario, el tratamiento con Sandostatin® puede producir alguna reducción del tejido tumoral.
En pacientes con tumores del sistema endocrino gastroenteropancreático, Sandostatin® debido a sus diversos efectos endocrinos, modifica diferentes características clínicas produciéndose una mejoría clínica y sintomática en pacientes que presentan síntomas relacionados con sus tumores, a pesar de tratamientos anteriores que pueden incluir cirugía, embolización arterial hepática y quimioterapias diversas, por ej.: estreptozotocina y 5-fluorouracilo.
Los efectos de Sandostatin® en los distintos tipos de tumores son los siguientes: - Tumor carcinoide
La administración de Sandostatin® puede producir una mejoría de los síntomas, concretamente de los episodios de rubor y de la diarrea. Esto va acompañado de una disminución de los niveles de serotonina plasmática y de una disminución en la excreción urinaria del ácido 5-hidroxiindol acético. En el caso de que no se produzca respuesta durante el tratamiento con Sandostatin®, se recomienda no proseguir con el tratamiento más de una semana, aunque no se hayan registrado reacciones adversas graves y persistentes en ningún paciente.
- VIPomas
La característica bioquímica de estos tumores es la superproducción de péptido intestinal vasoactivo (VIP).
En la mayoría de los casos la administración de Sandostatin® produce un alivio de la diarrea secretora grave, típica de esta afección, con la consecuente mejoría en la calidad de vida. Esto va acompañado de una mejoría de las anormalidades electrolíticas asociadas, por ej.: hipokaliemia, permitiendo suprimir el fluido parenteral, enteral y el suplemento electrolítico. En algunos pacientes el TAC (tomografía axial computerizada) revela una interrupción o disminución de la progresión del tumor, incluso la reducción del mismo, fundamentalmente de las metástasis hepáticas. La mejoría clínica va acompañada generalmente de una reducción en los niveles plasmáticos de VIP, que pueden descender hasta niveles normales de referencia.
- Otros tumores gastroenteropancreáticos
Glucagonomas: En la mayor parte de los casos, la administración de Sandostatin® produce una mejoría notable de la erupción migratoria necrolítica, característica de esta afección.


El efecto de Sandostatin® en la diabetes mellitus moderada, que frecuentemente se produce, no es notable, y en general no conduce a una reducción de las necesidades de insulina o agentes hipoglucemiantes orales. Sandostatin® produce una mejoría de la diarrea en los pacientes afectados y un aumento de peso.
Aunque la administración de Sandostatin®, conduce a menudo a una reducción immediata de los niveles de glucagón plasmáticos, esta disminución no se mantiene generalmente durante un período prolongado de administración, a pesar de la mejoría sintomática.
Gastrinomas/Síndrome de Zollinger-Ellison: Aunque el tratamiento con bloqueantes H2-selectivos y antiácidos controla la ulceración péptica recurrente, resultante de la hipersecreción crónica de ácido gástrico estimulada por la gastrina, este control resulta insuficiente. La diarrea también es un síntoma importante que no se alivia con este tratamiento. Sandostatin® en monoterapia o en combinación con antagonistas de los receptores H2, puede reducir la hipersecreción de ácido gástrico y mejorar los síntomas, incluyendo la diarrea. También pueden mejorarse otros síntomas posiblemente debidos a la producción de péptido por el tumor, por ej.: episodios de rubor.
En algunos pacientes se produce un descenso de los niveles de gastrina en plasma.
Insulinomas: La administración de Sandostatin® produce un descenso en la insulina inmunorreactiva circulante que puede ser, sin embargo, de corta duración (aprox. dos horas). En los pacientes con tumores operables, puede ayudar a restaurar y mantener la normoglucemia del pre-operatorio. En pacientes con tumores malignos o benignos no operables, el control de la glucemia puede mejorarse sin una reducción sostenida concomitante de los niveles de insulina circulantes.
GRFomas (tumores secretores de GRF): Estos tumores especiales se caracterizan por una producción del factor de liberación de la hormona del crecimiento (GRF) única o en combinación con otros péptidos activos. Sandostatin® produce una mejoría de las características y síntomas de la acromegalia resultante. Esto se debe a la inhibición del GRF y de la secreción de la hormona de crecimiento.
Para pacientes sometidos a cirugía pancreática, la administración pre- y post-operatoria de Sandostatin®, reduce la incidencia de complicaciones post-operatorias típicas (p.ej. fístula pancreática, absceso y sepsis subsiguiente, pancreatitis aguda post-operatoria).
En pacientes que presentan varices gastro-esofágicas sangrantes debido a una cirrosis subyacente, la administración de Sandostatin® en combinación con un tratamiento específico (p.ej. escleroterapia), está asociada con un mejor control de la hemorragia y de la hemorragia recurrente temprana, una necesidad de transfusión reducida y un aumento de la supervivencia a los 5 días.
Aunque el modo de acción exacto de Sandostatin® no está completamente dilucidado, se ha postulado que Sandostatin® reduce el flujo sanguíneo esplácnico inhibiendo las hormonas vasoactivas (p.ej. VIP, glucagón).
5.2 Propiedades farmacocinéticas
Sandostatin® se absorbe de forma rápida y por completo tras la administración subcutánea. Las concentraciones plasmáticas máximas se alcanzan en 30 minutos. La eliminación después de administración subcutánea tiene lugar con una vida media de 100 minutos. Después de la administración intravenosa la eliminación es bifásica con vidas medias de 10 y 90 minutos,
respectivamente. El volumen de distribución es de 0,27 l/kg de peso corporal y el aclaramiento corporal total es de 160 ml/min. La unión a las proteínas plasmáticas alcanza el 65%. La cantidad de Sandostatin® unida a las células sanguíneas no es significativa.
5.3 Datos preclínicos sobre seguridad
Toxicidad aguda
Estudios de toxicidad aguda con octreotida en ratones revelaron valores de DL50 de 72 mg/kg por vía intravenosa y de 470 mg/kg por vía subcutánea. El valor agudo de DL50 intravenosa fue determinado a 18 mg/kg. Acetato octreotida fue bien tolerado por perros que recibieron hasta 1 mg/kg de peso corporal mediante inyección intravenosa por bolo.
Toxicidad de dosis repetidas
En un estudio de toxicidad por administración intravenosa en perros durante 26 semanas realizado con dosis de hasta 0,5 mg/kg dos veces al día revelaron cambios progresivos las células acidófilas secretoras de prolactina en la pituitaria. Nuevos estudios demostraron que estos valores se encontraban dentro del rango fisiólogico, aparentemente sin relación con la somatostatina administrada exógenamente. No hubo alteraciones significativas en los niveles de hormona en plasma. Monos Rhesus hembra que recibían dosis de 0,5 mg/kg dos veces al día durante 3 semanas no mostraron cambios en la pituitaria y no hubo alteraciones en los niveles plasmáticos basales de la hormona del crecimiento, prolactina ni de la glucosa.
Mientras que el vehículo ácido produjo inflamación y fibroplasia en inyecciones subcutáneas repetidas en ratas, no hubo evidencia de que acetato octreotida causara reacciones de hipersensibilidad retardada al inyectarla intradérmicamente en cobayas mediante un solución al 0,1% solución salina fisiológica al 0,9%
Mutagenicidad
Octreotida y/o sus metabolitos no mostraron potencial mutagénico cuando se investigaron in vitro en sistemas validados de tests de células bacteriológicas y de mamíferos. Se observó un aumento en la frecuencia de cambios cromosómicos en células de hámster chinos V79 in vitro, aunque sólo a altas concentraciones y citotóxicas. Sin embargo, las aberraciones cromosómicas no aumentaron en los linfocitos humanos incubados con acetato octreotida in vitro. In vivo, no se observó actividad clastogénica en la médula ósea del ratón tratado con octreotida intravenosa (test del micronúcleo) y no se obtuvo evidencia de genotoxicicidad en las ratas macho mediante un test de reparación de DNA en las cabezas de los espermas. Las microesferas no mostraron potencial mutagénico al probarse en un ensayo en batería in vitro validado.
Cancerogénesis/ Toxicidad crónica
En estudios realizados en ratas que recibieron octreotida en dosis diarias de hasta 1,25 mg/kg de peso corporal, se observaron fibrosarcomas, sobre todo en un cierto número de animales macho, en el punto de inyección subcutánea a las 52, 104 y 113/116 semanas. También aparecieron tumores en las ratas control, sin embargo, el desarrollo de estos tumores fue atribuido a la fibroplasia desordenada, producida por los efectos irritantes continuados en los puntos de inyección, aumentados por el vehículo ácido de ácido láctico/manitol. Esta reacción del tejido no específica resultó ser característica en ratas. No se observaron lesiones neoplásicas ni en ratones
que recibieron inyecciones subcutáneas diarias de octreotida hasta 2 mg/kg durante 98 semanas, ni en perros tratados con dosis subcutáneas de fármaco durante 52 semanas.
El estudio de carcinogenicidad de 116 semanas en ratas con octreotida subcutánea también reveló adenocarcinomas de endometrio, alcanzando su incidencia significancia estadística a la dosis subcutánea más alta de 1,25 mg/kg por día. Este hecho fue asociado con una mayor incidencia de endometritis, un menor número de cuerpos lúteos ováricos, una reducción de los adenomas mamarios y la presencia de dilatación luminal y glandular uterina, sugiriendo un estado de desequilibrio hormonal. La información disponible muestra claramente que los tumores de tipo endocrino hallados en rata son específicos de la especie y no tienen significancia alguna para el uso del fármaco en el hombre.
Reproducción
En estudios de fertilidad así como estudios pre-, peri- y postnatales realizados en ratas hembras no se observaron efectos adversos en el rendimiento reproductivo ni en el desarrollo de los niños, al administrar dosis subcutáneas de hasta 1 mg/kg de peso corporal por día. Se observó cierto retraso en el crecimiento fisiológico de los cachorros que fue pasajero y atribuido a la inhibición de la GH originada por un exceso de actividad farmacodinámica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Ampolla (0,5 mg/ml): ácido láctico, manitol, bicarbonato de sodio, dióxido de carbono, agua para inyección.
6.2 Incompatibilidades
Ninguna.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
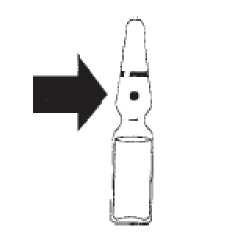
Nueva ampolla rompible. Línea de ruptura por debajo del punto coloreado.
30°C
Las ampollas de Sandostatin® deben conservarse a temperaturas entre 2-8°C (en protegerse de la luz. Para su utilización diaria pueden mantenerse a temperatura no hasta un máximo de 2 semanas.

nevera) y superior a

6.5 Naturaleza y contenido del recipiente
Envase con 5 ampollas de 0,5 mg/ml.
6.6 Instrucciones de uso y manipulación
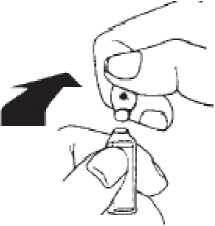
Colocar el pulgar por encima del punto coloreado y romper la ampolla presionando hacia atrás.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
NOVARTIS FARMACÉUTICA, S.A.
Gran Via de les Corts Catalanes, 764 08013 - Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
60.275
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
10. FECHA DE LA REVISIÓN DEL TEXTO
Agencia española de
medicamentos y
productos sanitarios