Rhinocort Turbuhaler 100 Mcg/Dosis
Información obsoleta, busque otroagencia española de medicamentos y productos sanitarios
FICHA TECNICA
1. NOMBRE DEL MEDICAMENTO
Rhinocort® Turbuhaler® 100 pg/dosis
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
Cada dosis contiene: budesonida 100 pg.
3. FORMA FARMACEUTICA
Inhalador de polvo para administración nasal.
4. DATOS CLINICOS
4.1 Indicaciones terapéuticas
Rinitis alérgica estacional y rinitis perenne. Rinitis vasomotora.
4.2 Posología y forma de administración
La posología debe ser individualizada y ajustarse a la mínima dosis capaz de mantener el control de los síntomas.
Adultos y ancianos: La dosis inicial recomendada es de 400 pg diarios. La dosis puede administrarse como dos aplicaciones en cada fosa nasal por la mañana.
Una vez conseguidos los efectos clínicos deseados, normalmente al cabo de 1-2 semanas, la dosis de mantenimiento debe reducirse a la cantidad mínima necesaria para controlar los síntomas.
Niños: El empleo de Rhinocort Turbuhaler en niños todavía no se ha documentado.
El tratamiento de la rinitis estacional debe iniciarse, siempre que sea posible, antes de la exposición al alergeno.
4.3 Contraindicaciones
Hipersensibilidad a la budesonida.
Correo electrónicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID

4.4 Advertencias y precauciones especiales de empleo
Se deberá informar al paciente de que no se alcanza el efecto completo hasta transcurridos unos días de tratamiento con Rhinocort Turbuhaler (en casos excepcionales hasta 2 semanas).
Pueden ser necesarios tratamientos concomitantes para el control de los síntomas oculares debidos a la alergia.
En caso de que los conductos nasales estén muy obstruidos, puede utilizarse un vasoconstrictor nasal durante los primeros 2-3 días de tratamiento.
El uso de dosis excesivas, o el tratamiento a largo plazo, con glucocorticosteroides puede desencadenar signos o síntomas de hiperadrenocorticismo, supresión de la función del eje hipotalámo-hipófisis-suprarrenal y/o supresión del crecimiento en niños. Deberá tenerse en cuenta la posible necesidad de corticosteroides sistémicos adicionales en períodos de estrés o en intervenciones quirúrgicas programadas.
Se han descrito casos de retraso del crecimiento en niños tratados con corticosteroides nasales a las dosis recomendadas. Se recomienda vigilar regularmente la altura de los niños y adolescentes sometidos a un tratamiento prolongado con corticosteroides por vía intranasal. Si se detecta un retraso del crecimiento deberá revisarse el tratamiento con objeto de, si es posible, reducir la dosis administrada a la mínima con la que se consiga un control efectivo de los síntomas.
Una función hepática reducida puede afectar la eliminación de corticosteroides. Sin embargo, la farmacocinética intravenosa de la budesonida es similar en pacientes con cirrosis y en sujetos sanos. La farmacocinética después de la administración oral puede verse afectada por una función hepática comprometida, evidenciándose por una disponibilidad sistémica incrementada. No obstante, para Rhinocort Turbuhaler, este problema resulta de poca relevancia clínica ya que después de la inhalación la contribución oral a la disponibilidad sistémica es muy pequeña.
Se prestará especial precaución en pacientes con tuberculosis pulmonar o con infecciones fúngicas o virales de las vías respiratorias no tratadas.
Durante el tratamiento con Rhinocort Turbuhaler deberá tenerse en cuenta que existe riesgo potencial de enmascarar una infección local. Se recomienda especial precaución en pacientes previamente tratados con esteroides por vía sistémica, ya que el cambio de tratamiento a esta especialidad puede producir la alteración de la función hipotalámo-hipófisis-suprarrenal.
En tratamientos de larga duración deberá inspeccionarse periódicamente la mucosa nasal.
Deberá informarse a los deportistas que este medicamento contiene un componente que puede establecer un resultado analítico de control de dopaje como positivo.
4.5 Interacción con otros medicamentos y otras formas de interacción
El ketoconazol, inhibidor potente del citocromo P 450 3A (el principal enzima metabolizador de corticosteroides), incrementa los niveles plasmáticos de la budesonida oral. A las dosis recomendadas, la cimetidina posee un ligero efecto aunque clínicamente insignificante sobre la farmacocinética de la budesonida oral mientras que el omeprazol no ejerce ningún efecto sobre la misma.
4.6 Embarazo y lactancia
Se desaconseja su empleo durante el embarazo a menos que existan causas muy justificadas. Los estudios en animales han demostrado que la budesonida, al igual que otros glucocorticosteroides, puede producir distintos tipos de malformaciones fetales, aunque se desconoce la relevancia que este hecho puede tener en el hombre.
No obstante, al igual que con otros fármacos, la administración de Rhinocort Turbuhaler durante el embarazo requiere la valoración de los beneficios para la madre frente a los riesgos para el feto.
No existe información sobre el paso de la budesonida a la leche materna.
4.7 Efectos sobre la capacidad para conducir y utilizar maquinaria Rhinocort Turbuhaler no afecta la capacidad de conducir ni utilizar maquinaria.
4.8 Reacciones adversas
No se ha identificado ningún efecto adverso frecuente en los ensayos clínicos realizados. Los estudios publicados y la experiencia desde su comercialización indican que pueden producirse ocasionalmente las siguientes reacciones adversas:
- Síntomas locales tales como sequedad nasal y estornudos inmediatamente después del uso del inhalador
- Epistaxis
- Reacciones cutáneas (urticaria, rash, dermatitis, angioedema)
En casos muy excepcionales se han producido ulceraciones de la membrana mucosa y perforación del tabique nasal tras el uso de glucocorticosteroides por vía intranasal.
Los efectos sistémicos de los corticosteroides nasales pueden presentarse sobre todo al utilizar dosis elevadas durante periodos prolongados.
4.9 Sobredosificación
Cuando se utilizan de forma crónica dosis muy elevadas pueden aparecer efectos propios de la administración de glucocorticosteroides sistémicos tales como hiperadrenocorticismo y supresión adrenal, que deberá corregirse adecuadamente.
5. PROPIEDADES FARMACOLOGICAS
5.1 Propiedades farmacodinámicas
La budesonida es un glucocorticosteroide con actividad antiinflamatoria local.
No se conoce el mecanismo de acción exacto de los glucocorticosteroides en el tratamiento de la rinitis. Las acciones antiinflamatorias tales como la inhibición de la liberación del mediador inflamatorio y la inhibición de las respuestas inmunes mediadas por la citoquina, son probablemente importantes. La potencia intrínseca de la budesonida, medida como la afinidad por el receptor glucocorticosteroide, es aproximadamente 15 veces superior a la presentada por la prednisolona.
En un estudio clínico en rinitis estacional en el que se administró budesonida por vía intranasal y oral se demostró que el efecto terapéutico de la budesonida se justifica por su acción local.
La administración profiláctica de budesonida ha demostrado un efecto protector frente a la hiperreactividad y a la eosinofilia nasal inducidas.
5.2 Propiedades farmacocinéticas
La disponibilidad sistémica de la budesonida administrada como Rhinocort Turbuhaler con respecto a la cantidad dosificada es de un 22%. El volumen de distribución de la budesonida es de 3 l/kg y la unión a proteínas plasmáticas de 85-90%. La concentración plasmática máxima después de la aplicación nasal de 800 pg de budesonida como Rhinocort Turbuhaler es de 1,1 nmol/l y se alcanza al cabo de 0,4 horas.
La cinética de la budesonida es proporcional a la dosis cuando se administran dosis clínicamente relevantes.
La budesonida experimenta un alto grado de biotransformación (aprox. 90%) en el hígado dando lugar a metabolitos de escasa actividad glucocorticosteroide. La actividad glucocorticosteroide de los principales metabolitos, 6P-hidroxibudesonida y 16a-hidroxiprednisolona, es inferior al 1% respecto a la budesonida. La budesonida no experimenta inactivación metabólica a nivel local, lo cual contribuye a que se alcance una alta concentración de fármaco inalterado en el órgano diana.
Los metabolitos de la budesonida se excretan como tales o en su forma conjugada principalmente por vía renal. No se detectó budesonida inalterada en la orina. La budesonida presenta un aclaramiento sistémico elevado (aproximadamente 1,2 l/min) y la vida media plasmática tras la administración intravenosa oscila entre las 2 y 3 horas.
5.3 Datos preclínicos sobre seguridad
Los resultados de los estudios de toxicidad aguda, subaguda y crónica mostraron que los efectos sistémicos de la budesonida son menores en algunos parámetros o similares a los observados con otros glucocorticosteroides, por ej. ganancia de peso disminuida y atrofia de los tejidos linfoides y de la corteza adrenal.
La budesonida no mostró ningún efecto mutagénico o clastogénico en ninguno de los tests realizados.
La mayor incidencia de gliomas cerebrales en ratas macho observada en un estudio de carcinogénesis no se confirmó al repetir el estudio, en el cuál la incidencia de gliomas no fue diferente entre los grupos con tratamiento activo (budesonida, prednisolona, acetónido de triamcinolona) y los grupos control.
Las anomalías hepáticas (neoplasias hepatocelulares primarias) halladas en ratas macho en el estudio de carcinogénesis inicial se observaron también en el segundo estudio con budesonida al igual que con los otros glucocorticosteroides de referencia. Estos efectos están probablemente relacionados con un efecto sobre el receptor representando, por tanto, un efecto de clase.
6.
DATOS FARMACEUTICOS
6.1 Relación de excipientes
Rhinocort Turbuhaler no contiene propelentes ni otro tipo de excipientes.
6.2 Incompatibilidades No se le conocen.
6.3 Periodo de validez
El periodo de validez de la especialidad es de 2 años.
6.4 Precauciones especiales de conservación Conservar a temperatura ambiente, por debajo de los 30 °C.
6.5 Naturaleza y contenido del recipiente
Envase de polietileno con una tapa de rosca en la parte inferior. Dentro se encuentra el inhalador cuyas partes más importantes son: adaptador nasal, sistema de dosificación y sustancia almacenada. Contiene 200 dosis.
6.6 Instrucciones de uso/manipulación
Turbuhaler es un inhalador sin propelentes, lo cual significa que la budesonida alcanza los conductos nasales cuando se respira a través del mismo. Para la correcta administración deberán seguirse las siguientes instrucciones:
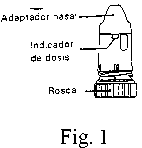
1. - Limpiar bien ambas fosas nasales. Desenroscar y sacar la tapa blanca
que cubre al Turbuhaler.
2. - Sostener el inhalador en posición vertical con la rosca gris en la parte

Fig. 2
inferior (Fig. 1). La carga de la dosis, se realiza mediante dos giros consecutivos de la rosca gris, el primero hacia la derecha (al tope) y el segundo hacia la izquierda (posición inicial) al final del cual oirá el "click" característico. En este momento ya tiene la dosis a punto para inhalarla (Fig. 2).
3. - Colocar el adaptador nasal en la fosa nasal de manera que quede bien
ajustado y tapar la otra fosa nasal con un dedo (Fig. 3). Inspirar rápida (0,5 seg) y enérgicamente.
4. - Al sacar de nuevo el aire, retirar antes el Turbuhaler de la nariz para

Fig. 3

evitar que el aire se introduzca en el mismo.
5. - Repetir de nuevo el proceso descrito en los puntos 2 a 4 en la otra fosa
nasal.
6. - Una vez terminada la administración cierre bien el Turbuhaler
enroscando la tapa blanca.
Importante:
1. - Nunca sacar aire por la nariz a través del Turbuhaler
2. - Tapar inmediatamente después de su uso.
3.- Debido a la pequeña cantidad de fármaco liberada por este sistema de dispensación, probablemente no se nota ningún sabor ni impacto alguno del producto inhalado. Sin embargo, si se siguen minuciosamente las instrucciones de empleo se habrá inhalado la dosis necesaria
Fig. 4

Fig. 5

Limpieza:
El adaptador nasal debe limpiarse externamente, con regularidad (1 vez a la semana). Nunca debe lavarse con agua.
Para saber cuándo se encuentra vacío el inhalador:
Al aparecer una marca roja en el inhalador, todavía quedan 20 dosis (Fig. 4). Si la marca roja alcanza el margen inferior de la ventana, el inhalador se encuentra vacío (Fig. 5).
El inhalador contiene en su base un producto desecante que es el causante del ruido que se aprecia al agitarlo.
6.7 Nombre y domicilio del titular de la autorización de la comercialización
ASTRA ZENECA FARMACEUTICA SPAIN, S.A. C/ SERRANO GALVACHE 56 28033 MADRID
7. NUMERO DE LA AUTORIZACION DE COMERCIALIZACION
8. FECHA DE LA APROBACION/REVISION
FT-RhinoTurb100 8 de abril de 1999/IDS 11/02/98
Agencia española de
medicamentos y
productos sanitarios