Procrin Mensual 3.75 Mg Polvo Y Disolvente Para Suspension Inyectable En Jeringa Precargada
¡m
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Procrin Mensual 3,75 mg polvo y disolvente para suspensión inyectable en jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada jeringa precargada con polvo para suspensión inyectable contiene 3,75 mg de acetato de leuprorelina, equivalente a 3,57 mg de leuprorelina.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para suspensión inyectable en jeringa precargada.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Procrin Mensual está indicado en el tratamiento paliativo del carcinoma de próstata avanzado hormonodependiente.
Procrin mensual también está indicado para el tratamiento del carcinoma de próstata localizado de alto riesgo y localmente avanzado hormonodependiente en combinación con radioterapia.
En niños
Procrin mensual también está indicado en el tratamiento de la pubertad precoz central, diagnosticada clínicamente por la aparición de los caracteres sexuales secundarios antes de los nueve años en niñas y de los diez en niños.
4.2 Posología y forma de administración
4.2.1 Posología
La dosis recomendada de Procrin Mensual es de 3,75 mg administrados en una única inyección subcutánea una vez al mes.
Procrin Mensual debe ser administrado bajo supervisión médica.
El lugar de administración de las inyecciones debe cambiarse periódicamente.
El tratamiento no se debe suspender al observar una remisión o mejora de la respuesta terapéutica.
Población _ pediátrica
El tratamiento de niños con acetato de leuprorelina debe realizarse bajo la supervisión de un pediatra endocrinólogo.
El esquema de dosificación debe ajustarse individualmente.
La dosis de inicio depende del peso.
Niños con peso > 20 kg
¡m
La dosis recomendada de acetato de leuprorelina (3,75 mg) es de 1 ml de suspensión conteniendo 44,1 mg de microesferas de liberación sostenida en 1 ml de diluyente, en una única inyección subcutánea una vez al mes.
Niños con peso < 20 kg
En estos casos, debe administrarse la siguiente dosis de acuerdo con la actividad clínica de la pubertad precoz central:
0. 5.ml (1,88 mg de acetato de leuprorelina) en una única inyección subcutánea una vez al mes. Debe desecharse el resto de la suspensión. Debe realizarse un seguimiento del aumento de peso del niño.
Dependiendo de la progresión de la pubertad precoz central puede ser necesario el aumento de dosis si se observa una supresión inadecuada (pruebas clínicas, p.ej. metrorragia, supresión inadecuada de gonadotropina en el test LHRH). La dosis mínima mensual efectiva a administrar debe determinarse en función del test LHRH).
Cuando se administran intramuscularmente dosis mayores de acetato de leuprorelina que las recomendadas, se ha observado la aparición frecuente de abscesos estériles en el lugar de inyección. Por ello, en estos casos, el medicamento debe administrarse de forma subcutánea (ver sección 4.4).
Se recomienda usar el mínimo volumen posible en las inyecciones en niños para reducir los problemas relacionados con la inyección intramuscular/subcutánea.
La duración del tratamiento depende de los parámetros clínicos al inicio del tratamiento o durante el tratamiento (pronóstico de altura final, velocidad de crecimiento, edad ósea y/o aceleración de la edad ósea) y se decide conjuntamente entre el pediatra que realiza el tratamiento, el tutor legal y, si es apropiado, el niño tratado. La edad ósea debe vigilarse durante el tratamiento cada 6-12 meses.
Teniendo en cuenta los parámetros clínicos, debe considerarse la interrupción del tratamiento en niñas con maduración ósea de más de 12 años y en niños con maduración ósea de más de 13 años.
En niñas, se debe descartar el embarazo antes de comenzar el tratamiento. Generalmente, no puede excluirse la posibilidad de embarazo durante el tratamiento. En estos casos, debe seguirse el consejo médico.
Nota:
Para evitar la recurrencia de síntomas de pubertad precoz, el periodo de administración debe ser de 30 ± 2 días.
Ajuste de la dosis en poblaciones de pacientes específicas:
No se han realizado estudios clínicos en pacientes con alteración de la función hepática o renal.
4.2.2 Forma de administración
1. Para preparar la inyección, atornillar el émbolo blanco dentro de la parte final del tapón hasta que este último empiece a girar.
2. Sostenga la jeringa verticalmente. Libere el diluyente empujando lentamente (6 a 8 segundos) el émbolo hasta que la parte inicial del tapón llegue a la línea azul en la mitad del cilindro de la jeringa.
3. Mantenga la jeringa verticalmente. Sutilmente mezcle las microesferas (partículas) completamente, hasta formar una suspensión uniforme. La suspensión será lechosa.
4. Mantenga la jeringa verticalmente. Avance el émbolo para sacar el aire de la jeringa.
5. Inyecte el contenido total de la jeringa subcutáneamente, una vez se ha reconstituido el acetato de leuprorelina debe ser mezclado y usado inmediatamente.
¡m
4.3 Contraindicaciones
Hipersensibilidad al acetato de leuprorelina o nonapéptidos similares o a alguno de los excipientes incluidos en la sección 6.1.
En pacientes que hayan sido sometidos previamente a orquiectomía.
Como tratamiento único en pacientes con cáncer de próstata con compresión de la médula espinal o evidencia de metástasis espinal (ver sección 4.4)
En niñas con pubertad precoz central:
- Embarazo y lactancia
- Sangrado vaginal no diagnosticado
Se han descrito casos aislados de anafilaxia con la formulación Mensual (Semestral o Trimestral)* de acetato de leuprorelina.
*depende de la formulación
4.4 Advertencias y precauciones especiales de empleo
La respuesta al acetato de leuprorelina debe ser monitorizada midiendo los niveles plasmáticos de testosterona así como de antígeno específico prostático. En la mayoría de los pacientes, los niveles de testosterona aumentaron sobre los niveles basales en la primera semana, descendiendo a los valores basales o por debajo de estos en la segunda semana de tratamiento. Los niveles de castración se alcanzaron entre las dos y cuatro semanas y una vez alcanzados se mantuvieron durante el tiempo que el paciente recibió el tratamiento.
En casos aislados se han observado signos y síntomas de empeoramiento durante las primeras semanas de tratamiento con análogos a la LH-RH. El empeoramiento de los síntomas puede contribuir a la aparición de parálisis, con o sin complicaciones.
Se debe considerar la administración adicional de un antiandrógeno apropiado comenzando 3 días antes del tratamiento con leuprorelina y continuando durante las dos o tres primeras semanas de tratamiento. Se ha descrito que previene las secuelas de un aumento inicial de la testosterona sérica.
Una proporción de pacientes presentará tumores no sensibles a la manipulación hormonal. La ausencia de mejoría clínica pese a una supresión adecuada de testosterona, es una señal de esta condición, para la que un tratamiento adicional con Leuprorelina no supondría ningún beneficio.
Durante la postcomercialización se han observado informes de convulsiones con la administración de medicamentos con acetato de leuprorelina. Éstos se observaron en poblaciones pediátricas y mujeres, en pacientes con historial de crisis epilépticas, epilepsia, trastornos cerebrovasculares, anomalías o tumores del sistema nervioso central y en pacientes con medicaciones concomitantes que han estado asociadas con las convulsiones como bupropión e inhibidores selectivos de la recaptación de serotonina (ISRSs). También se han referido convulsiones en pacientes en ausencia de cualquiera de los cuadros clínicos mencionados más arriba.
Durante la vigilancia post-autorización, raramente se han comunicado casos de apoplejía hipofisaria (un síndrome clínico derivado del infarto de la hipófisis) tras la administración de análogos LHRH, ocurriendo la mayoría dentro de las 2 semanas siguientes a la primera dosis, y algunos dentro de la primera hora. En estos casos, la apoplejía hipofisaria se ha presentado como cefalea súbita, vómitos, cambios visuales, oftalmoplejía, alteración del estado mental, y algunas veces colapso cardiovascular. Se requiere actuación médica inmediata.
Tal y como ocurre con otros análogos LH-RH, se observan casos aislados de obstrucción de uretra y compresión de médula espinal, que pueden contribuir a una parálisis, con o sin complicaciones graves. En
los pacientes con factores de riesgo, el médico puede considerar iniciar el tratamiento con una inyección diaria de acetato de leuprorelina, durante las primeras dos semanas para facilitar la retirada del tratamiento si fuese necesario.
Los pacientes con metástasis vertebrales y/o cerebrales, así como los pacientes con obstrucción del tracto urinario deberán ser monitorizados estrechamente durante las primeras semanas de tratamiento.
En la literatura médica se ha descrito la disminución de la densidad ósea en varones que habían sido orquiectomizados o tratados con análogos LHRH (ver sección 4.8).
La terapia antiandrogénica aumenta significativamente el riesgo de fracturas debidas a osteoporosis. El riesgo de fracturas debidas a osteoporosis es generalmente mayor que el riesgo de fracturas patológicas. Aparte del déficit prolongado de testosterona, tanto el aumento de la edad como el tabaquismo y el consumo de bebidas alcohólicas, la obesidad y la falta de ejercicio pueden influir en la aparición de osteoporosis.
Se han notificado casos de hiperglicemia y aumento del riesgo de desarrollar diabetes en hombres tratados con análogos a la hormona liberadora de gonadotropina (GnRH). La hiperglicemia puede significar en estos casos un desarrollo de diabetes mellitus o un empeoramiento del control glucémico en pacientes diabéticos. Se debe monitorizar la glucosa en sangre y/o la hemoglobina glicosilada (HbA1c) periódicamente.
Se ha notificado un aumento del riesgo cardiovascular (incluyendo infarto de miocardio, muerte repentina de origen cardíaco e ictus) asociado a hombres tratados con análogos de la GnRH. Debe tenerse en cuenta en pacientes otros factores de riesgo cardiovasculares a la hora de determinar el tratamiento.
Se debe monitorizar a los pacientes tratados con análogos de GnRH cuyos síntomas o signos sugieran la aparición de enfermedad cardiovascular.
Efecto en el intervalo QT/QTc
Se ha observado una prolongación del intervalo QT durante la privación androgénica prolongada. Se debe valorar el balance beneficio/riesgo, incluyendo el riesgo potencial de Torsade des Pointes, y usar con precaución en pacientes con síndrome congénito de QT largo, desequilibrios electrolíticos o insuficiencia cardíaca congestiva, así como en pacientes en tratamiento concomitante con medicamentos que pueden prolongar el intervalo QT (por ejemplo, antiarrítmicos de clase IA o clase III, antidepresivos tricíclicos, macrólidos...)
Existe un mayor riesgo de depresión (que puede ser grave) en pacientes sometidos a tratamiento con agonistas de la hormona liberadora de gonadotropinas (GnRH), como el acetato de leuprorelina. Los pacientes deben ser informados y recibir tratamiento si se presentan síntomas de depresión.
Población pediátrica Pubertad precoz
Antes de comenzar el tratamiento, es necesario realizar un diagnóstico preciso de la pubertad precoz idiopática y/o neurogénica central.
El tratamiento es de larga duración que se ajusta de forma individual. Procrin mensual debe administrarse de forma tan precisa como sea posible en periodos regulares de un mes. Un retraso excepcional de unos días (30 ± 2 días) en la fecha de inyección no influye en los resultados de la terapia.
En caso de absceso estéril en el lugar de inyección (que se ha notificado mayoritariamente tras la inyección intramuscular de dosis superiores a las recomendadas), la absorción a partir de la formulación depot puede verse disminuida. En este caso, deben controlarse los parámetros hormonales (testosterona, estradiol) en intervalos de 2 semanas (ver sección 4.2).
El tratamiento de niños con tumores cerebrales progresivos debe seguir una valoración individualizada del balance beneficio-riesgo.
Después de la primera inyección en niñas, puede aparecer sangrado vaginal, metrorragia y secreciones vaginales como un signo de retirada hormonal. El sangrado vaginal más allá del primer/segundo mes de tratamiento debe investigarse.
Durante el tratamiento para la pubertad precoz central con GnRHa puede disminuir la densiometría ósea (DMO). A pesar de esto, tras la finalización del tratamiento, la acumulación posterior de masa ósea se mantiene y el pico de masa ósea en la adolescencia tardía no parece estar alterado por el tratamiento.
Tras la retirada del tratamiento con GnRH, puede observarse un deslizamiento de la epífisis femoral. La teoría propuesta es que las bajas concentraciones de estrógeno durante el tratamiento con agonistas de la GnRH debilita la placa epifisaria. Tras la finalización del tratamiento, el aumento de la velocidad de crecimiento produce una reducción de la tensión necesaria para el desplazamiento de la epífisis.
Uso en deportistas
Se informa a los deportistas que este medicamento contiene un componente que puede establecer un resultado analítico de control del dopaje como positivo.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios farmacocinéticos de interacciones con otros medicamentos con acetato de leuprorelina. Sin embargo, debido a que el acetato de leuprorelina es un péptido que se degrada principalmente por el enzima peptidasa y no por los enzimas del citocromo P-450, como se observó en los estudios específicos, y debido a que se une sólo alrededor del 46% del fármaco a las proteínas plasmáticas, no se espera que se produzca interacción con otros medicamentos.
Se debe valorar cuidadosamente el uso concomitante de Procrin Mensual con medicamentos que prolongan el intervalo QT o medicamentos capaces de inducir Torsade des Pointes, tales como antiarrítmicos clase lA (por ejemplo: quinidina, disopiramida) o clase III (por ejemplo: amiodarona, sotalol, dofetilida, ibutilida), metadona, moxifloxacino, antipsicóticos, etc (ver sección 4.4) ya que el tratamiento de deprivación androgénica también puede prolongar el intervalo QT.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
El acetato de leuprorelina está contraindicado en mujeres embarazadas o que pudieran estarlo. (Ver sección
4.3)
4.6.2 Lactancia
Se desconoce si el acetato de leuprorelina se excreta por la leche humana. Si por accidente se administrase a mujeres en periodo de lactancia, deberá tenerse en cuenta que el acetato de leuprorelina está contraindicado durante la lactancia. Ver sección 4.3
4.6.3 Fertilidad
Estudios en animales han mostrado que la leuprorelina puede causar efectos sobre la fertilidad (ver sección
5.3) .
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos de Procrin Mensual sobre la capacidad para conducir y utilizar máquinas.
La capacidad para conducir y utilizar máquinas puede verse alterada debido a mareos, trastornos de la visión y somnolencia, que pueden ser posibles reacciones adversas del tratamiento o consecuencia de la enfermedad subyacente.
4.8 Reacciones adversas
Los siguientes acontecimientos adversos están asociados frecuentemente con las acciones farmacológicas del acetato de leuprorelina sobre la esteroidogénesis:
• exacerbación del tumor de próstata, agravamiento del tumor de próstata.
• aumento de peso, pérdida de peso.
• pérdida o disminución de la líbido, aumento de la líbido
• cefalea, debilidad muscular.
• vasodilatación, sofocos, hipotensión, hipotensión ortostática.
• sequedad de piel, hiperhidrosis, sarpullido, urticaria, crecimiento anormal del cabello, trastorno del cabello, sudores nocturnos, hipotricosis, trastorno de la pigmentación, sudor frío, hirsutismo.
• ginecomastia, mastodinia, disfunción eréctil, dolor testicular, hipertrofia mamaria, dolor de mama, dolor de próstata, inflamación del pene, trastorno del pene, atrofia del testículo.
• sequedad de mucosas.
• aumento del antígeno específico de la próstata (PSA), disminución de la densidad ósea.
En caso de larga exposición (6 a 12 meses): diabetes mellitus, trastorno de tolerancia a la glucosa, aumento del colesterol total, aumento de lipoproteínas de baja densidad (LDL), aumento de triglicéridos, osteoporosis, cambios de humor, depresión.
La siguiente sección presenta los acontecimientos adversos observados en los ensayos clínicos con Procrin Mensual y en la experiencia postcomercialización en hombres.
En la mayoría de los pacientes, los niveles de testosterona aumentaron por encima de los valores basales durante la primera semana, disminuyendo después hasta los valores basales o por debajo al final de la segunda semana de tratamiento.
El empeoramiento potencial de los signos y síntomas durante las primeras semanas de tratamiento es preocupante en pacientes con metástasis vertebral y/o con obstrucción urinaria o hematuria, que, si se agrava, puede llevar a problemas neurológicos como debilidad temporal y/o parestesia de las extremidades inferiores o empeoramiento de los síntomas urinarios (Ver sección 4.4).
La Tabla 1 presenta todas las reacciones adversas y las frecuencias de los ensayos clínicos en cáncer de próstata con las dosis de 3,75 mg (Procrin Mensual) y en la experiencia postcomercialización.
Las frecuencias son: muy frecuente (> 1/10); frecuente (>1/100 a <1/10); poco frecuente (>1/1000 a <1/100); no conocida (no se puede estimar la frecuencia a partir de los datos disponibles).
|
TABLA 1 |
Estudios clínicos M85-097, TAP-144-SR-2/ PD-115-PC, M85-101, n=230) |
Postcomercialización | |
|
Sistema corporal |
Término preferente |
Frecuencia |
Frecuencia |
|
Infecciones e |
Infección |
No conocida | |
|
infestaciones |
Rinitis |
Poco frecuente |
No conocida |
¡m
|
Infección del tracto urinario Faringitis Neumonía Infección fungica en piel |
Poco frecuente |
No conocida No conocida | |
|
Neoplasias benignas, malignas y no especificadas (incluyendo quistes y pólipos) |
Neoplasia Cáncer de piel |
Poco frecuente |
No conocida |
|
Trastornos de la sangre y del sistema linfático |
Anemia |
No conocida | |
|
Trastornos del sistema inmunológico |
Reacción anafiláctica |
No conocida | |
|
Trastornos endocrinos |
Bocio Apoplejía de la pituitaria |
No conocidaNo conocida | |
|
Trastornos del metabolismo y de la nutrición |
Anorexia Diabetes mellitus Aumento del apetito Hiperglucemia Hipoglucemia Deshidratación Hiperlipidemia Hiperfosfatemia Hipoproteinemia Aumento de peso anormal |
Frecuente Poco frecuente Poco frecuente |
No conocidaNo conocida No conocidaNo conocidaNo conocidaNo conocidaNo conocida |
|
Trastornos psiquiátricos |
Cambios de humor Nerviosismo Disminución de la líbido Aumento de la líbido Insomnio Trastornos del sueño Depresión |
Frecuente Poco frecuente Poco frecuente Poco Frecuente |
Frecuente (tratamiento prolongado) Poco frecuente (tratamiento corto) No conocida No conocidaNo conocidaNo conocidaPoco frecuente (Tratamiento prolongado) Frecuente (Tratamiento corto) No conocidaNo conocidaNo conocidaNo conocida |
|
Ansiedad Ideas delirantes Pensamientos de suicidio Intento de suicidio | |||
|
Trastornos del sistema nervioso |
Mareo Cefalea Parestesia Letargo Somnolencia Alteración de la memoria Disgeusia Hipoestesia Síncope Neuropatía periférica Accidente cerebrovascular |
Poco frecuente Poco frecuente Poco frecuente |
No conocidaNo conocidaNo conocidaNo conocida No conocidaNo conocidaNo conocidaNo conocidaNo conocidaNo conocida No conocidaNo conocida No conocidaNo conocidaNo conocida |
¡m
|
Pérdida de consciencia Ataque isquémico transitorio Parálisis Neuromiopatía Convulsiones | |||
|
Trastornos oculares |
Visión borrosa Trastorno ocular Disminución visual Ambliopía Sequedad ocular |
Poco frecuente |
No conocidaNo conocidaNo conocidaNo conocidaNo conocida |
|
Trastornos del oído y del laberinto |
Otalgia Tinnitus Disminución acústica |
Poco frecuente Poco frecuente |
No conocidaNo conocida |
|
Trastornos cardiacos |
Insuficiencia cardiaca congestiva Arritmia Infarto de miocardio Angina de pecho Extrasístoles ventriculares Taquicardia Bradicardia Muerte cardíaca repentina Prolongación del intervalo QT |
Poco frecuente Poco frecuente Poco frecuente |
No conocida No conocidaNo conocidaNo conocida No conocidaNo conocidaNo conocida |
|
Trastornos vasculares |
Sofocos Vasodilatación Angiopatía Linfedema Hipertensión Flebitis Trombosis Hipotensión Venas varicosas Circulación periférica insuficiente |
Muy frecuente Muy frecuente Poco frecuente Poco frecuente Poco frecuente |
No conocidaNo conocidaNo conocidaNo conocidaNo conocidaNo conocida |
|
Trastornos respiratorios, torácicos y mediastínicos |
Roce pleural Fibrosis pulmonar Epistaxis Disnea Hemoptisis Enfisema Tos Derrame pleural Infiltración pulmonar Trastorno respiratorio Congestión de los senos paranasales Embolismo pulmonar Enfermedad pulmonar intersticial |
Poco frecuente Frecuente Poco frecuente Poco frecuente |
No conocidaNo conocidaNo conocidaNo conocidaNo conocida No conocidaNo conocidaNo conocidaNo conocidaNo conocida No conocida No conocida |
|
Trastornos gastrointestinales |
Estreñimiento Náuseas Vómitos Hemorragia |
Frecuente Frecuente |
No conocidaNo conocidaNo conocidaNo conocida No conocidaNo conocidaNo |
Trastornos
hepatobiliares
Trastornos de la piel y del tejido subcutáneo
Trastornos musculoesquelétic os y del tejido conectivo
Trastornos renales y urinarios
Trastornos del aparato
reproductor y de la mama
gastrointestinal Distensión abdominal Diarrea Disfagia
Sequedad de boca Úlcera de duodeno Trastorno gastrointestinal Úlcera péptica
Pólipo rectal_
Función hepática anormal Ictericia
Lesión hepática grave Alopecia Equimosis Sarpullido
Sarpullido maculopapular
Sequedad de piel
Reacción de
fotosensibilidad
Urticaria
Hiperhidrosis
Dermatitis
Crecimiento anormal del cabello
Trastornos del cabello Prurito
Sudores nocturnos Trastorno de la pigmentación
Lesión cutánea_
Dolor óseo Mialgia
Debilidad muscular Dolor en las extremidades Inflamación ósea Artropatía Artralgia
Espondilitis anquilosante
Tenosinovitis_
Incontinencia urinaria Disuria Polaquiuria Tenesmo vesical Hematuria Retención urinaria Espasmos de vejiga Trastornos del tracto urinario
Obstrucción del tracto urinario
Poliuria_
Ginecomastia Mastodinia Disfunción eréctil Atrofia testicular Dolor testicular
Frecuente
Poco frecuente
Poco frecuente Poco frecuente
Frecuente
Poco frecuente Frecuente Poco frecuente
Poco frecuente Poco frecuente Poco frecuente Poco frecuente
Frecuente
Poco frecuente Poco frecuente
Poco frecuente Poco frecuente
Poco frecuente Poco frecuente
Frecuente
Frecuente
conocidaNo conocidaNo conocidaNo conocidaNo conocidaNo conocida
No conocidaNo conocida
No conocidaNo conocidaNo conocida
No conocidaNo conocida No conocida No conocidaNo conocida
No conocida No conocida No conocida
No conocida
No conocidaNo conocidaNo conocidaNo conocidaNo conocida
No conocida
No conocidaNo conocidaNo conocida
No conocidaNo conocida No conocida
No conocidaNo conocida No conocidaNo conocida No conocidaNo conocidaNo conocidaNo conocidaNo
Hipertrofia mamaria Dolor de mama Trastorno testicular Inflamación del pene Trastorno del pene Dolor prostático
Poco frecuente
conocida
Trastornos generales y alteraciones en el lugar de administración
Dolor
Dolor de tórax Edema
Edema periférico Astenia Fatiga Pirexia
Reacción en el lugar de la inyección
Inflamación en el lugar de la inyección Dolor en el lugar de la inyección
Induración en el lugar de la inyección Eritema en el lugar de inyección
Absceso estéril en el
lugar de la inyección
Hematoma en el lugar de
la inyección
Irritación en el lugar de
inyección
Escalofríos
Nódulo
Sed
Inflamación
Fibrosis pélvica_
Frecuente Poco frecuente
Frecuente Poco frecuente Frecuente
Poco frecuente Frecuente Frecuente Poco frecuente
Poco frecuente Poco frecuente
No conocida No conocida No conocida No conocidaNo conocida No conocida No conocida No conocida
No conocida No conocida
No conocidaNo conocidaNo conocidaNo conocidaNo conocida
Exploraciones
complementarias
Disminución de la hemoglobina Aumento de la urea sanguínea
Aumento de ácido úrico en sangre
Aumento de creatinina sérica
Aumento de calcio sérico Aumento de la fosfatasa alcalina sérica Aumento de la deshidrogenasa láctica sérica
Aumento de
alanina/aminotransferasa/
ALT
Aumento de aspartato aminotransferasa/AST Aumento de la gamma-glutamiltransferasa Electrocardiograma_
Poco frecuente Poco frecuente Poco frecuente
Poco frecuente Frecuente
Muy frecuente
Poco frecuente
Frecuente Poco frecuente
No conocida No conocida No conocida No conocida
No conocida No conocida No conocida No conocida
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos_
anormal
Signos en ECG de isquemia miocárdica Prueba de la función hepática anormal Descenso de plaquetas Descenso de potasio en sangre
Presencia de proteínas en orina
Aumento de leucocitos Descenso de leucocitos Tiempo de protrombina prolongado Tiempo de
tromboplastina parcial activada prolongado Murmullo cardiaco Aumento de lipoproteínas de baja densidad Aumento de triglicéridos en sangre
Aumento de bilirrubina en sangre
Aumento de reticulocitos
Fractura espinal
No conocida
Poco frecuente
Poco frecuente Poco frecuente
Poco frecuente
No conocidaNo conocidaNo conocida
No conocidaNo conocida No conocidaNo conocida
No conocida No conocida
No conocida
Como ocurre con otros fármacos de esta clase, se han referido casos muy raros de apoplejía pituitaria tras la administración inicial en pacientes con adenoma de la pituitaria.
4.8.1 Población pediátrica
En la fase inicial del tratamiento se produce un aumento exacerbado de los niveles de hormonas sexuales a corto plazo, seguido de un descenso a valores dentro del rango prepuberal. Debido a este efecto farmacológico, las reacciones adversas pueden ocurrir especialmente al inicio del tratamiento.
Trastornos del sistema inmune:
Muy raros: reacciones alérgicas generales (fiebre, sarpullido, ej. Picores, reacciones anafilácticas).
Trastornos psiquiátricos:
Frecuentes: inestabilidad emocional
Trastornos del sistema nervioso:
Frecuentes: cefalea.
Trastornos gastrointestinales
Frecuentes: dolor abdominal/ calambres abdominales, nauseas/vómito.
Trastornos de la piel y del tejido subcutáneo
Frecuentes: acné.
¡m
Trastornos del aparato reproductor y de la mama
Frecuentes: hemorragia vaginal, metrorragia, secreción vaginal.
Nota:
Generalmente, la aparición de metrorragia durante la continuación del tratamiento (posterior al posible sangrado por retirada en el primer mes de tratamiento) debe evaluarse como un signo potencial de infra-dosificación. En consecuencia, debe determinarse la supresión pituitaria mediante un test LHRH
Trastornos generales y alteraciones en el lugar de administración:
Frecuentes: reacciones en el lugar de la inyección.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es.
4.9 Sobredosis
No existe experiencia clínica de los efectos de una sobredosis aguda de acetato de leuprorelina. En los estudios en animales se observó que la administración de dosis aproximadamente 133 veces más elevadas de lo recomendado para el uso humano dio lugar a disnea, disminución de la actividad e irritación local en el lugar de inyección. En caso de sobredosis el paciente debe ser monitorizado y acompañado.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: análogos de la hormona liberadora de gonadotropina.Código ATC: L02A E02.
El acetato de leuprorelina es un nonapéptido sintético análogo a la hormona liberadora de gonadotropina (GnRH o LH-RH). El análogo posee mayor potencia que la hormona natural. El nombre químico es de 5-oxo-L-propil-L-histidil-L-triptofanil-L-seril-L-tirosil-D-leucil-L-leucil-Larginil-L-prolina etilamida monoacetato.
El acetato de leuprorelina, agonista de la hormona liberadora de gonadotropinas GnRH, administrado continuamente y a dosis terapéuticas actúa como un potente inhibidor de la secreción de gonadotropinas. Los estudios en animales y humanos indican que después de una estimulación inicial, la administración prolongada de acetato de leuprorelina provoca una inhibición de la esteroidogénesis ovárica y testicular. Este efecto es reversible cuando se suspende la terapia con el fármaco.
En el hombre, la administración de acetato de leuprorelina produce un aumento inicial en los niveles de hormona luteinizante (LH) y folículo-estimulante (FSH), conduciendo a un aumento transitorio en los niveles de esteroides gonadales (testosterona y dihidrotestosterona en varones y estrona y estradiol en mujeres premenopáusicas).
Sin embargo, la administración continuada de acetato de leuprorelina da lugar a un descenso de los niveles de LH y FSH y de esteroides sexuales. En los varones, la testosterona disminuye hasta niveles de castración o prepuberales. Estos cambios hormonales se producen dentro del mes de iniciada la terapia con el medicamento a las dosis recomendadas.
En un estudio a 9 meses TAP-144-SR (3M)/EC002, multicéntrico, aleatorizado y abierto cuyo objetivo del estudio era medir los niveles de castración de testosterona sérica a las 13 semanas de tratamiento y determinar si esa respuesta se mantenía, se comparó la seguridad, tolerabilidad y eficacia de dos formulaciones depot: la mensual (1M) y la trimestral (3M) en pacientes con cáncer de próstata avanzado.
Se incluyeron 237 pacientes con una esperanza de vida mayor de 12 meses en 2 grupos: el Grupo 1M
¡m
(n=80) al que se le administraron 9 inyecciones (1 al mes) por vía subcutánea y el Grupo 3M (n=157) al que se le administraron 3 inyecciones (1 al trimestre) por vía subcutánea. Los resultados del estudio mostraron que en un 80% de los pacientes con estadio T3 y T4 (n=120) se alcanzaron niveles de castración (valores de testosterona < 50 ng/dl) sin ningún escape durante los 9 meses de estudio. Estos resultados fueron muy similares en el total de la población del estudio.
Tratamiento en combinación con radioterapia
La utilidad de la terapia de deprivación androgénica en combinación con radioterapia en hombres con carcinoma localizado de alto riesgo y localmente avanzado, se ha demostrado en varios ensayos clínicos aleatorizados.
En el ensayo 96-01, 818 hombres con cáncer de próstata localmente avanzado fueron asignados de forma aleatoria a recibir radioterapia sola o radioterapia en combinación con 3 meses de terapia de deprivación androgénica (TSA) o bien 6 meses de TSA.
Los resultados con TSA, comparados con radioterapia sóla, demostraron que mejoraban la mortalidad de manera significativa [HR 0,63 (0,48-0,83)].
En otro ensayo clínico fase III, aleatorizado con 970 pacientes incluidos con cáncer de próstata localmente avanzado (principalmente pacientes T2c-T4 con algún T1c a T2b con afectación linfática regional) de los cuales 483 se asignaron a la terapia de supresión androgénica a corto plazo (6 meses) en combinación con radioterapia y 487 a la terapia a largo plazo (3 años) en combinación con radioterapia, se comparó, en un análisis de no inferioridad, el tratamiento hormonal concomitante y adyuvante a corto y largo plazo con agonistas de la GnRH (triptorelina o goserelina). La mortalidad global a 5 años fue del 19,0% y 15,2% en los grupos a corto y largo plazo respectivamente. El Hazard Ratio observado de 1,42 (IC 95,71% unilateral superior de 1,79; o IC 95,71% bilateral: 1,09 - 1,85; p = 0,65 para no inferioridad), demuestra que la combinación de radioterapia con 6 meses de terapia de deprivación androgénica proporciona una supervivencia inferior que radioterapia con 3 años de terapia de deprivación androgénica. La supervivencia global a 5 años del tratamiento a largo y corto plazo muestra una supervivencia del 84,8% y 81,0% respectivamente. La calidad de vida global, usando QLQ-C30, no difirió significativamente entre los dos grupos (p= 0,37). Los resultados están dirigidos por los resultados de la población de pacientes con tumores localmente avanzados.
La evidencia de la indicación en carcinoma de próstata localizado de alto riesgo está basada en estudios publicados sobre radioterapia en combinación con los análogos de la GnRH, incluyendo leuprorelina acetato. Se analizaron los datos clínicos de cinco estudios publicados (EORTC 22863, RTOG 85-31, RTOG 92-02, RTOG 8610, y D’Amico et al., JAMA, 2004), y todos demuestran un beneficio de la combinación de los análogos de la GnRH con radioterapia. En los estudios publicados, no fue posible una clara diferenciación entre las respectivas poblaciones del estudio para las indicaciones de carcinoma de próstata localmente avanzado y carcinoma de próstata localizado de alto riesgo.
Los datos clínicos han demostrado que la radioterapia seguida de 3 años de tratamiento con deprivación androgénica es preferible a radioterapia seguida de 6 meses de tratamiento con deprivación androgénica.
5.1.4 Población pediátrica
La administración de leuprorelina acetato depot provoca la supresión reversible de la liberación pituitaria de gonadotropina, con la consecuente disminución de los niveles de estradiol (E2) o testosterona a valores en el rango de la etapa prepuberal.
¡m
La estimulación inicial de las gónadas (reagudización) puede causar sangrado vaginal en niñas que ya se encontraban en periodo post-menarquia al inicio del tratamiento. Así mismo, al inicio del tratamiento puede ocurrir sangrado por retirada. Normalmente el sangrado cesa con el progreso del tratamiento.
Se pueden demostrar los siguientes efectos terapéuticos:
- Supresión de los niveles de gonadotropina basales y estimulados a los niveles pre-puberal.
- Supresión del aumento prematuro de los niveles de hormonas sexuales a los niveles pre-puberal e interrupción de la menstruación prematura.
- Interrupción/involución del desarrollo somático de la pubertad (Escalas de Tanner)
- Mejora/normalización de la relación entre edad cronológica y edad ósea.
- Prevención de la aceleración progresiva de la edad ósea
- Disminución de la velocidad de crecimiento y normalización de ésta.
- Aumento de la estatura final.
El tratamiento produce la supresión de la activación patológica y prematura del eje hipotalámico-pituitario-gonadal, de acuerdo a la etapa prepuberal.
En un ensayo clínico a largo plazo en niños tratados con leuprorelina con dosis mensuales de hasta 15 mg por más de 4 años, se observó la reanudación de la progresión puberal tras la finalización del tratamiento. El seguimiento hasta la edad adulta de 20 individuos mujeres mostró un 80% de ciclos menstruales normales y 12 embarazos en 7 de las 20 mujeres, incluyendo embarazos múltiples para 4 individuos.
5.2 Propiedades farmacocinéticas
El acetato de leuprorelina no es activo cuando se administra por vía oral. La biodisponibilidad de este fármaco es comparable por vía subcutánea e intramuscular.
Absorción
Tras una única administración de una suspensión de acetato de leuprorelina depot de 3,75 mg y 7,5 mg por vía subcutánea e intramuscular, a pacientes con carcinoma de próstata, se observan concentraciones plasmáticas medias de acetato de leuprorelina, al final de un mes, de 0,7 ng / ml y 1,0 ng / mL, respectivamente. No hubo evidencias de acumulación de fármaco. .
Distribución
El volumen de distribución calculado durante el estado estacionario de leuprorelina después de la administración intravenosa de un bolus a hombres sanos voluntarios fue de 27L. La unión a proteínas plasmáticas humanas in vitro osciló entre un intervalo de 43% a 49%.
Metabolismo
En voluntarios varones sanos, un bolus de 1 mg de leuprorelina administrado por vía intravenosa, reveló que la media del aclaramiento sistémico fue de 7,6 L/h, con una vida media de eliminación de aproximadamente tres horas sobre la base de un modelo bicompartimental.
Los estudios en animales han demostrado que la leuprorelina 14C marcada, se metaboliza en péptidos inactivos menores, un pentapéptido (metabolito I) tripéptidos (metabolitos II y III) y un dipéptido (Metabolito IV). Estos fragmentos pueden volver a ser metabolizados.
El principal metabolito (M-I) de las concentraciones plasmáticas medido en cinco pacientes con cáncer de próstata a los que se les dio acetato de leuprorelina depot suspensión, alcanzó una concentración máxima de dos a seis horas después de la administración y fue de aproximadamente el 6% del pico de concentración de fármaco. Una semana después de la administración de la dosis, la media de las concentraciones plasmáticas de M-I fue aproximadamente el 20% de la media de las concentraciones de leuprorelina.
Excreción
Tras la administración de acetato de leuprorelina suspensión Depot 3,75 mg a tres pacientes, menos del 5% de la dosis se recuperó como dosis inicial y metabolito M-I en la orina durante 27 días.
Poblaciones especiales
No ha sido determinada la farmacocinética del fármaco en pacientes con insuficiencia hepática o renal.
Población _ pediátrica
La figura 1 presenta los niveles séricos de leuprorelina tras la administración subcutánea única de acetato de leuprorelina depot a una dosis de 30 pg/kg de peso corporal. El pico en los niveles séricos se alcanza 60 minutos después de la administración (7,81 ± 3,59 ng/ml)- El AUC 0-672 es 105,78 ± 52,40 ng x hora/ml.
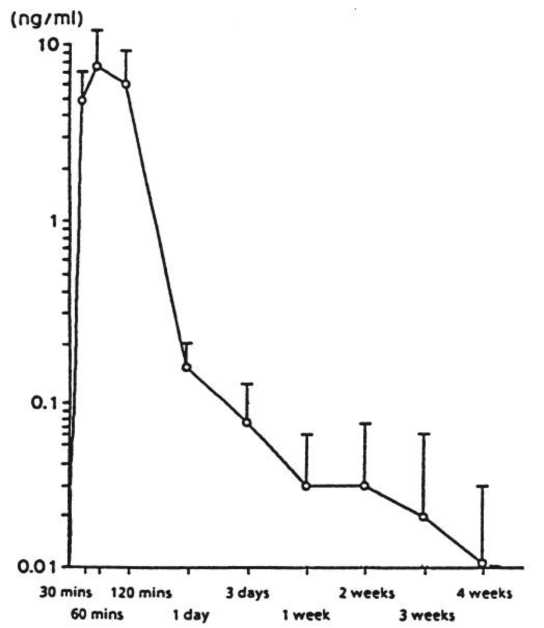
Figura 1: Niveles séricos de leuprorelina tras una única administración subcutánea de 30 pg/kg de peso corporal de leuproprelina acetato en su formulación depot (n=6) (Media± D.S).
5.3 Datos preclínicos sobre seguridad
Efectos mutagénicos
Se han realizado estudios de mutagenicidad con acetato de leuprorelina empleando sistemas bacterianos y de mamíferos. Estos estudios no produjeron evidencia de potencial mutagénico.
Efectos sobre la carcinogénesis
Se llevó a cabo un estudio de carcinogénesis durante dos años en ratones y ratas, administrados diariamente por vía subcutánea a dosis de 0.6 a 4mg/Kg y hasta 60 mg/Kg. Sólo en el estudio realizado con ratas se observó un incremento de la incidencia de hiperplasia y adenomas benignos en la pituitaria.
Efectos teratogénicos
¡m
Cuando se administró acetato de leuprorelina a conejos el día 6 de gestación a las siguientes dosis de ensayo: 0,00024, 0,0024 y 0,024 mg/kg (1/300 a 1/3* de la dosis humana más alta), se produjo un aumento en las anomalías fetales relacionado con la dosis. Estudios similares en ratas no mostraron un incremento en malformaciones fetales. Hubo un aumento de la mortalidad fetal y disminución de los pesos fetales con las dos dosis superiores en conejos y con la dosis más alta en ratas. Los efectos sobre la mortalidad fetal son consecuencia lógica de las alteraciones en los niveles hormonales que produce el fármaco. Por lo tanto, existe la posibilidad de que puedan aparecer anomalías fetales y aborto espontáneo si el fármaco se administra durante el embarazo.
Efectos sobre la fertilidad
Leuprorelina puede reducir la fertilidad en machos y hembras. La administración de acetato de leuprorelina a ratas macho y hembras a dosis de 0,024, 0,24 y 2,4 mg/kg mensualmente durante 3 meses (tan bajas como 1/300* de la dosis humana mensual estimada) causó atrofia de los organos reproductores y supresión de la función reproductora.
*NOTA: el margen de seguridad ha sido calculado basándose en la liberación diaria media estimada de acetato de leuprorelina desde la formulación depot tanto en humanos como en animales.
6 . DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Polvo:
Gelatina purificada,
Copolímero de ácido láctico/ácido glicólico y Manitol.
Disolvente:
Carboximetilcelulosa sódica,
Manitol,
Polisorbato 80 y
Agua para preparaciones inyectables.
6.2 Incompatibilidades
En ausencia de estudios de incompatibilidad, este medicamento no debe ser mezclado con otros.
6.3 Periodo de validez 3 años.
Tras la reconstitución el medicamento es estable durante 24 horas a 25 °C, aunque se recomienda su utilización inmediatamente.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Procrin Mensual se presenta en una jeringa precargada (vidrio Tipo I) con dos cámaras, con aguja de 25 G, de una única administración que contiene microsferas liofilizadas esterilizadas de acetato de leuprorelina,
en una cámara y 1 mL de disolvente en la otra. Cuando se mezcla con el disolvente se forma una suspensión de acetato de leuprorelina para administración subcutánea en una inyección mensual.
El envase también contiene un émbolo y una toallita impregnada en alcohol isopropílico al 70%.
6.6 Precauciones especiales de eliminación y otras manipulaciones
con él,
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto se realizará de acuerdo con las normativas locales.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AbbVie Spain S.L.U.
Avda. de Burgos, 91 28050 Madrid,
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
74094
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Mayo de 2011
10. FECHA DE LA REVISIÓN DEL TEXTO
06/2016
17 de 17