Osteobion 200 Ui Solucion Para Pulverizacion Nasal
Información obsoleta, busque otro
agencia española de medicamentos y productos sanitarios
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. DENOMINACIÓN DEL MEDICAMENTO
Osteobion® 200 UI solución para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 pulverización contiene 200 UI de calcitonina (DOE) sintética de salmón.
Lista de excipientes, en 6.1.
3. FORMA FARMACÉUTICA
Solución para pulverización nasal
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de osteoporosis postmenopáusica establecida para reducir el riesgo de fracturas vertebrales. No se ha demostrado una reducción en fracturas de cadera.
4.2 Posología y forma de administración
La dosis recomendada de calcitonina intranasal para el tratamiento de la osteoporosis postmenopáusica establecida es de 200 UI una vez al día. Se recomienda que el uso de calcitonina intranasal esté acompañado de una ingesta adecuada de calcio y vitamina D. El tratamiento debe ser administrado de forma prolongada. (ver 5.1., Propiedades farmacodinámicas).
Uso en pacientes ancianos, en alteración hepática y en insuficiencia renal
La amplia experiencia obtenida con el uso de calcitonina intranasal en los pacientes con edad avanzada demuestra que no existe evidencia de una disminución de la tolerancia o de la necesidad de cambiar la pauta posológica. Esto mismo puede aplicarse a pacientes con la función renal o hepática alterada.
Uso en niños
Dado que la calcitonina intranasal está indicada para mujeres postmenopáusicas, no es adecuado su uso en niños.
Nota
Las instrucciones de uso completas para el paciente se hallan en el prospecto de paciente.
4.3 Contraindicaciones
Hipersensibilidad a la calcitonina (ver 4.8. Reacciones adversas) o a cualquiera de los excipientes del preparado (ver 6.1. Lista de excipientes).
La calcitonina también está contraindicada en pacientes con hipocalcemia.
Correo electrónicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
4.4 Advertencias y precauciones especiales de empleo
Antes de iniciar el tratamiento deberá realizarse una exploración nasal y en caso de síntomas nasales no debe iniciarse el tratamiento. Si aparece ulceración grave de la mucosa nasal (p.ej. con afectación por debajo de la mucosa o asociación con sangrado importante), debe interrumpirse el tratamiento con calcitonina intranasal. En caso de ulceración moderada, deberá interrumpirse temporalmente el tratamiento hasta alcanzar la curación.
Debido a que la calcitonina es un péptido, existe la posibilidad de reacciones alérgicas sistémicas y se han descrito reacciones de tipo alérgico, incluyendo casos aislados de shock anafiláctico, en pacientes sometidos a un tratamiento con calcitonina intranasal. En pacientes con sensibilidad sospechada a la calcitonina, se debe considerar la realización de pruebas de sensibilidad antes de iniciar el tratamiento.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han descrito interacciones de calcitonina de salmón intranasal con otros medicamentos.
4.6 Embarazo y lactancia
Dado que la calcitonina intranasal está indicada para mujeres postmenopáusicas, no se han realizado estudios en mujeres embarazadas o en periodo de lactancia. Por lo tanto, no debe administrarse calcitonina intranasal a estas pacientes. Sin embargo, estudios en animales no han demostrado potencial embriotóxico y teratogénico. Parece ser que la calcitonina de salmón no atraviesa la barrera placentaria en animales.
No se sabe si la calcitonina de salmón se excreta en la leche materna. En animales, se ha demostrado que la calcitonina de salmón reduce la lactancia y se excreta en la leche.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No existen datos acerca de los efectos de la calcitonina intranasal sobre la capacidad para conducir y utilizar máquinas. La calcitonina intranasal puede causar vértigo de forma transitoria (ver 4.8. Reacciones adversas) lo cual puede disminuir la capacidad de reacción del paciente.
Por lo tanto, los pacientes deben ser advertidos de que pueden aparecer vértigos de forma transitoria , en cuyo caso no deberían conducir ni utilizar máquinas.
4.8 Reacciones adversas
Estimación de frecuencias:
Muy frecuentes (>1/10); frecuentes (>1/100, <1/10); poco frecuentes (>1/1.000, <1/100); raras (>1/10.000, <1/1.000); muy raras (<1/10.000), casos aislados.
Trastornos gastrointestinales
Frecuente: náuseas, diarrea, dolor abdominal Poco frecuente: vómitos
Trastornos vasculares
Frecuente: rubor
Poco frecuente: hipertensión
Trastornos respiratorios
Muy frecuente: rinitis (incluyendo sequedad nasal, edema nasal, congestión nasal, estornudos, rinitis alérgica), síntomas nasales inespecíficos (p.ej. irritación del conducto nasal, rash papular, parosmia, eritema, abrasión).
Frecuente: rinitis ulcerativa, sinusitis, epistaxis, faringitis.
Poco frecuente: tos
Estos efectos son generalmente moderados (en aprox. 80% de los informes) y requieren la interrupción del tratamiento en menos del 5% de los casos.
Trastornos del sistema nervioso
Frecuente: vértigos, cefalea, disgeusia.
Trastornos de los sentidos
Poco frecuente: alteración de la visión
Trastornos del tejido de la piel y subcutáneos
Poco frecuente: edema (edema facial, edema periférico y anasarca)
Trastornos musculoesqueléticos
Frecuente: dolor musculoesquelético Poco frecuente: artralgia
Trastornos del sistema inmunitario
Poco frecuente: reacciones de hipersensibilidad tales como reacciones cutáneas generalizadas, rubor, edema (edema facial, edema periférico y anasarca), hipertensión, artralgia y prurito.
Muy raras: reacciones alérgicas y reacciones de tipo anafilactoide tales como taquicardia, hipotensión, colapso circulatorio y shock anafiláctico.
Investigaciones
Raras: desarrollo de anticuerpos neutralizadores de la calcitonina. El desarrollo de estos anticuerpos no está por lo general relacionado con la pérdida de eficacia clínica, aunque su presencia en un pequeño porcentaje de pacientes tras una terapia a largo plazo con dosis altas de calcitonina podría dar como resultado una respuesta reducida al producto. La presencia de anticuerpos parece no tener relación con las reacciones alérgicas, que son raras. El descenso de regulación del receptor de calcitonina podría dar como resultado una respuesta clínica reducida en un pequeño porcentaje de pacientes tras una terapia a largo plazo con dosis altas.
Trastornos generales
Frecuente: fatiga
Poco frecuente: enfermedad que se asemeja al síndrome gripal
4.9 Sobredosis
Se sabe que las náuseas, vómitos, rubor y vértigo son reacciones dosis dependientes cuando se administra calcitonina por vía parenteral.
Se han administrado por vía parenteral dosis únicas de calcitonina de salmón (de hasta 10.000 UI) sin otros efectos adversos que náusea y vómitos y exacerbación de los efectos farmacológicos. Por lo tanto, también puede esperarse que ocurran estas reacciones en asociación con una sobredosis de calcitonina intranasal. Sin embargo, la calcitonina intranasal se ha administrado hasta 1.600 UI como una dosis única
y hasta 800 Ul/día durante tres días sin causar ninguna reacción adversa grave. Si aparecen síntomas de sobredosis, el tratamiento deberá ser sintomático.
5. PROPIEDADES FARMACOLÓGICAS
Grupo farmacoterapéutico: hormona antiparatiroidea, código ATC: H05BA01 (calcitonina de salmón).
5.1 Propiedades farmacodinámicas
La calcitonina es una hormona calciotrópica, que inhibe la resorción ósea por acción directa sobre los osteoclastos. Mediante la inhibición de la actividad de los osteoclastos, vía sus receptores específicos, la calcitonina de salmón disminuye la resorción ósea.
La calcitonina reduce considerablemente el recambio óseo en situaciones en las que se produce una tasa elevada de resorción ósea, como en la osteoporosis.
Se ha demostrado la ausencia de defecto de mineralización con calcitonina mediante estudios histomorfométricos tanto en hombre como en animales.
En estudios farmacológicos, la calcitonina ha demostrado poseer actividad analgésica en modelos animales.
La calcitonina intranasal produce una respuesta biológica clínicamente relevante en humanos, como se demuestra por un incremento de la excreción urinaria de calcio, fósforo y sodio (reduciendo su reabsorción tubular) y por un descenso en la excreción urinaria de hidroxiprolina. La administración a largo plazo de calcitonina intranasal suprime significativamente los marcadores bioquímicos de recambio óseo, tales como los C-telopéptidos séricos (sCTX) e isoenzimas esqueléticos de la fosfatasa alcalina.
La calcitonina intranasal produjo un aumento estadísticamente significativo 1-2% de Densidad Mineral Ósea (DMO) en la espina lumbar, el cual es evidente desde el primer año manteniéndose hasta 5 años. Se mantiene la DMO de la cadera.
En un ensayo de 5 años con mujeres postmenopáusicas (estudio PROOF), la administración de 200 UI de calcitonina de salmón intranasal provocó una reducción del 33% en el riesgo relativo de desarrollar fracturas vertebrales. El riesgo relativo de desarrollar fracturas vertebrales, comparado con placebo (sólo tratamiento con vitamina D y calcio) en todos los pacientes tratados con dosis diarias de 200 UI fue 0,67 (IC 95%: 0,47-0,97). El riesgo absoluto de desarrollar fracturas vertebrales durante 5 años se redujo de un 25,9% en el grupo placebo a un 17,8% en el grupo de 200 UI. No se ha demostrado una reducción de fracturas de cadera.
La dosis recomendada de calcitonina de salmón para el tratamiento de osteoporosis postmenopáusica establecida es de 200 UI una vez al día. Dosis más altas no fueron más efectivas.
5.2 Propiedades farmacocinéticas
Los parámetros farmacocinéticos de la calcitonina de salmón administrada vía intranasal son difíciles de cuantificar debido a la sensibilidad inadecuada y a la especificidad incierta de los inmunoensayos disponibles, utilizados en los estudios realizados hasta la fecha. La biodisponibilidad de la dosis de 200 UI con respecto a la administración parenteral es del 2 al 15%. La calcitonina intranasal se absorbe rápidamente por la mucosa nasal y las concentraciones plasmáticas máximas aparecen dentro de la
primera hora tras la administración. La vida media de eliminación es aproximadamente de 16 a 43 minutos y no se ha observado evidencia de acumulación con dosis múltiples. Dosis superiores a la recomendada conducen a niveles sanguíneos más elevados (tal y como se observa por un incremento en el AUC), sin embargo, la biodisponibilidad relativa no se incrementa. Como ocurre con otras hormonas polipeptídicas, la monitorización de los niveles plasmáticos de la calcitonina de salmón tiene muy poco valor ya que no es directamente predictiva de la respuesta terapéutica. Por consiguiente, la actividad de calcitonina debería evaluarse utilizando parámetros clínicos de eficacia.
La unión a proteínas plasmáticas es de 30-40%.
5.3 Datos preclínicos sobre seguridad
Se han realizado en animales de laboratorio estudios convencionales de toxicidad a largo plazo, de reproducción, de mutagenicidad y de carcinogenicidad. Además, se investigó la tolerancia nasal en perros y monos.
La calcitonina de salmón está desprovista de potencial embriotóxico, teratogénico y mutagénico. La administración intranasal diaria de dosis altas de una formulación de calcitonina conteniendo 0,01% de cloruro de benzalconio durante 26 semanas fue bien tolerada por monos.
Se ha observado un aumento de incidencia de adenomas de pituitaria en ratas recibiendo calcitonina de salmón sintética durante 1 año. Se considera un efecto específico de la especie y sin relevancia clínica.
La calcitonina de salmón no atraviesa la barrera placentaria.
En animales en periodo de lactancia que recibieron calcitonina, se observó una supresión de la producción de leche. La calcitonina se excreta en la leche.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Cloruro sódico, ácido clorhídrico, ácido cítrico monohidratado, citrato sódico dihidrato, agua purificada.
6.2. Incompatibilidades No se han descrito
6.3. Periodo de validez
2 años
6.4. Precauciones especiales de conservación
Antes de su uso, Osteobion® 200 UI solución para pulverización nasal debe mantenerse en frigorífico (2-8°C). No congelar.
Una vez abierto el envase, Osteobion® 200 UI solución para pulverización nasal debe conservarse a temperatura ambiente (no por encima de 22 °C) hasta un máximo de 4 semanas. Mantener todo el tiempo el frasco en posición vertical para reducir el riesgo de entrada de burbujas de aire en el dispositivo.

6.5. Naturaleza y contenido del recipiente
El envase consiste en un frasco de vidrio (vidrio tipo I) transparente e incoloro y un dispositivo pulverizador con un mecanismo contador de la dosis automático e integrado y un tope mecánico incorporado.
-Presentación con 1 envase de 2,1 ml de solución, conteniendo 14 pulverizaciones de 200 UI cada una. -Presentación con 1 envase de 3,5 ml de solución, conteniendo 28 pulverizaciones de 200 UI cada una.
6.6. Instrucciones de uso y manipulación
- Cada envase de 2,1 ml de Osteobion contiene 4.200 UI de calcitonina sintética de salmón, que garantizan 14 pulverizaciones de uso terapéutico y pulverizaciones adicionales necesarias para el correcto funcionamiento del dispositivo de administración.
- Cada envase de 3,5 ml de Osteobion contiene 7000 UI de calcitonina sintética de salmón, que garantizan 28 pulverizaciones de uso terapéutico y pulverizaciones adicionales necesarias para el correcto funcionamiento del dispositivo de administración.
La dosis recomendada es de 1 pulverización al día (200 UI/día).
Se recomienda ir alternando las aplicaciones en las dos fosas nasales.
Instrucciones para la correcta administración
La bomba debe cebarse antes de su primera administración. 1. Sacar la
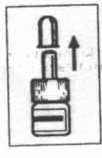
protección
del
pulverizador teniendo el pulverizador en posición vertical

2. Si se utiliza por 1a vez el pulverizador realizar dos
pulverizaciones al aire
manteniendo el pulverizador en posición vertical
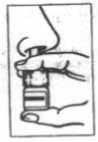
3.Introducir el pulverizador en una fosa nasal y realizar una pulverización
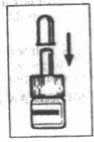
4. Cerrar de nuevo el
pulverizador con la
protección.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CENTRUM, S.A.
Sagitario, 14 03006 - Alicante
8. NÚMERO DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
59.584
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha autorización: Agosto 2002
10. FECHA DE LA REVISIÓN DEL TEXTO
Julio de 2006
Agencia española de
medicamentos y
productos sanitarios