Menitorix Polvo Y Disolvente Para Solucion Inyectable
Información obsoleta, busque otro
1.
NOMBRE DEL MEDICAMENTO
Menitorix polvo y disolvente para solución inyectable
Vacuna conjugada frente a Haemophilus tipo b y meningococo grupo C
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Después de la reconstitución, cada dosis de 0,5 ml contiene:
Polisacárido de Haemophilus tipo b (polirribosilribitol fosfato)
5 microgramos
conjugado con toxoide tetánico como proteína transportadora Polisacárido de Neisseria meningitidis serogrupo C (cepa C11) conjugado con toxoide tetánico como proteína transportadora
12,5 microgramos 5 microgramos 5 microgramos
Excipientes con efecto conocido:
Este producto contiene 75 micromoles de sodio por dosis (ver sección 4.4).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
Polvo blanco y disolvente transparente e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Inmunización activa en lactantes a partir de los dos meses de edad y en niños hasta los dos años de edad para la prevención de las enfermedades invasoras causadas por Haemophilus influenzae tipo b (Hib) y
Neisseria meningitidis grupo C (MenC).
Ver también sección 4.4.
4.2 Posología y forma de administración
Posología
Menitorix se debe utilizar de acuerdo con las recomendaciones oficiales.
Primovacunación en lactantes:
Se dispone de distintas pautas de vacunación con Menitorix para los lactantes.
Pauta de primovacunación de tres dosis
La pauta de vacunación consiste en tres dosis de primovacunación, de 0,5 ml cada una, que deben administrarse entre los 2 y los 12 meses de edad con un intervalo de al menos un mes entre las dosis (ve sección 5.1).
sanidad, pamc A SOCIAL E IGUALDAD

Pauta deprimovacunación de dos dosis
La pauta de vacunación consiste en dos dosis de primovacunación, de 0,5 ml cada una, que pueden administrarse entre los 3 y los 12 meses de edad con un intervalo de al menos dos meses entre las dosis (ver sección 5.1).
Lactantes prematuros nacidos entre las 25 y las 36 semanas de edad gestacional
Se deben administrar tres dosis de primovacunación, de 0,5 ml cada una, entre los 2 y los 12 meses de
edad con un intervalo de al menos dos meses entre las dosis (ver secciones 4.4 y 5.1).
No hay datos relativos al uso de una o dos dosis de Menitorix como serie de primovacunación y otras vacunas conjugadas Hib y/o MenC para otra(s) dosis. Se recomienda que a los lactantes a los que se administre una primera dosis de Menitorix, se les administre también esta vacuna como segunda y tercera dosis de la serie de primovacunación.
Vacunación de recuerdo:
Después de la primovacunación en el primer año de vida, se deben administrar dosis de recuerdo de Hib y MenC. En los niños que recibieron una vacuna combinada de pertussis acelular que contiene Hib en la serie primaria de inmunización infantil, la dosis de recuerdo de Hib se debe administrar antes de los dos años de edad.
Se puede utilizar una dosis de Menitorix (0,5 ml) como vacunación de recuerdo frente a Hib y MenC en niños que hayan recibido la pauta de inmunización primaria completa con Menitorix o con otras vacunas conjugadas frente a Hib o MenC (ver sección 5.1). La dosis de recuerdo de Menitorix debe administrarse antes de los 2 años de edad. La dosis de recuerdo debe administrarse a partir de los 12 meses de vida y al menos 6 meses después de la última dosis de primovacunación. En niños primovacunados con 2 dosis de Menitorix, la dosis de recuerdo debe administrarse al menos 5 meses después de la última dosis de primovacunación.
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de Menitorix en niños mayores de 2 años.
Forma de administración
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
Menitorix sólo debe administrarse mediante inyección intramuscular, preferiblemente en la región anterolateral del muslo. En niños de 12 a 24 meses de edad, la vacuna puede administrarse en la región deltoidea (ver también secciones 4.4 y 4.5).
Menitorix no debe administrarse bajo ninguna circunstancia mediante inyección intravenosa, intradérmica o subcutánea.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos, incluyendo el toxoide tetánico (ver sección 2), o a alguno de los excipientes incluidos en la sección 6.1.
Reacciones de hipersensibilidad tras la administración previa de Menitorix.
Enfermedad febril aguda severa. La presencia de una infección menor no supone una contraindicación para la vacunación.
4.4 Advertencias y precauciones especiales de empleo
Como ocurre con todas las vacunas inyectables, se debe disponer siempre de tratamiento médico y supervisión adecuadas en caso de que aparezca una reacción anafiláctica rara tras la administración de la vacuna.
La vacunación debe ir precedida por una revisión del historial médico (en particular respecto a las vacunaciones anteriores y la posible aparición de acontecimientos adversos) y por un examen clínico.
Se debe vacunar con precaución a sujetos con trombocitopenia o cualquier trastorno de la coagulación.
No se dispone de datos sobre la administración subcutánea de Menitorix, por lo que se desconoce si la administración mediante esta vía podría causar toxicidad o una reducción de la eficacia.
Menitorix sólo proporcionará protección frente a Haemophilus influenzae tipo b y Neisseria meningitidis grupo C. Como ocurre con cualquier otra vacuna, Menitorix podría no proporcionar una protección completa frente a las infecciones que pretende prevenir en todos los individuos vacunados.
No hay datos disponibles sobre la administración de Menitorix en niños en el segundo año de vida que no han recibido la serie de primovacunación con vacunas conjugadas de Hib y MenC.
Se desconoce la duración de la protección frente a la enfermedad por meningococo del grupo C en los sujetos vacunados. Sin embargo, se ha observado un descenso a lo largo del tiempo en el porcentaje de sujetos con títulos de ABSc-MenC de al menos 1:8 (ver sección 5.1).
No se dispone de datos sobre el empleo de Menitorix en pacientes inmunodeprimidos. En individuos con alteración de la respuesta inmune (debido al empleo de tratamientos inmunosupresores, un defecto genético, infección por el virus de la inmunodeficiencia humana (VIH), o cualquier otra causa) podría no obtenerse una respuesta inmunoprotectora frente a las vacunas conjugadas de Hib y MenC. Los individuos con déficits del complemento y los individuos con asplenia funcional o anatómica podrían desarrollar una respuesta inmune a las vacunas de Hib y MenC conjugadas, sin embargo se desconoce el grado de protección que podría obtenerse.
Aunque se han notificado síntomas de meningismo como dolor/rigidez de cuello o fotofobia tras la administración de otras vacunas conjugadas de MenC, no hay evidencia de que las vacunas conjugadas de MenC causen meningitis. Se debe mantener una vigilancia clínica ante la posible aparición de meningitis coincidente en el tiempo.
Cuando se administre la serie de inmunización primaria en lactantes muy prematuros de < 28 semanas de gestación y especialmente en aquellos con un historial previo de inmadurez respiratoria, se debe considerar tanto el riesgo potencial de apnea como la necesidad de monitorización respiratoria durante 48-72 horas.
Como el beneficio de la vacunación es alto en este grupo de lactantes, la vacunación no se debe impedir ni retrasar.
La inmunización con esta vacuna no sustituye a la vacunación rutinaria frente al tétanos.
Como el antígeno polisacarídico capsular de Hib se excreta por orina, el test de detección de antígeno en orina puede ser positivo de una a dos semanas después de la vacunación. Se deben utilizar otras pruebas diagnósticas, no basadas en la detección del antígeno capsular en orina, para confirmar la enfermedad por Hib durante este periodo.
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
Menitorix no debe mezclarse con ninguna otra vacuna en la misma jeringa.
Si se administran diferentes vacunas, deben inyectarse siempre en diferentes sitios de inyección.
En varios estudios con vacunas conjugadas meningocócicas grupo C monovalentes autorizadas, se ha observado que la administración simultánea con combinaciones que contienen difteria, tétanos y componentes acelulares de pertussis (con o sin poliovirus inactivados, antígeno de superficie de hepatitis B o conjugado de Hib [ej. DTPa -VHB-VPI-Hib*]), induce una menor media geométrica del título (GMT) de anticuerpos bactericidas séricos (ABS) en comparación con las administraciones por separado o con la coadministración con vacunas de tos ferina de célula completa. El porcentaje de sujetos que alcanzan títulos de ABS de al menos 1:8 no se ve afectado. Por el momento, se desconocen las implicaciones potenciales de estas observaciones en la duración de la protección.
En ensayos clínicos de primovacunación, se administró Menitorix simultáneamente (en diferentes muslos) con una vacuna de DTPa-VHB-VPI. Las respuestas a todos los antígenos coadministrados fueron adecuadas y similares a las alcanzadas en los grupos control en los que se administró DTPa-VHB-VPI -Hib* simultáneamente con una vacuna conjugada de MenC (MenCC) o DTPa-VHB-VPI * concomitantemente con una vacuna conjugada de Hib y sin MenCC. La respuesta inmune a los componentes Hib y MenC de Menitorix sólo se evaluó en los ensayos clínicos de primovacunación en los que se coadministraban vacunas de DTPa-VPI * o DTPa-VHB-VPI *.
En un ensayo clínico de primovacunación, la administración simultánea de Menitorix junto con DTPa-VHB-VPI* y una vacuna conjugada antineumocócica sacarídica 7-valente o 10-valente (las tres inyecciones se realizaron en regiones anatómicamente distantes entre sí) indujo una respuesta inmune frente a los siete o diez serotipos neumocócicos similar a la que se alcanzó en los grupos que recibieron DTPa-VHB-VPI * simultáneamente con Hib (conjugado con toxoide tetánico) y una vacuna conjugada antineumocócica sacarídica 7-valente o 10-valente.
Como dosis de recuerdo, Menitorix puede administrarse simultáneamente con una vacuna conjugada antineumocócica sacarídica 7-valente o 10 valente o con una primera dosis de una vacuna combinada frente al sarampión, la rubéola y la parotiditis (SRP, triple vírica). Los ensayos clínicos demostraron que las respuestas inmunes y los perfiles de seguridad de las vacunas coadministradas no se vieron afectados.
No se dispone de datos respecto al uso simultáneo de Menitorix con vacunas antipoliomielíticas orales y vacunas antipertussis de célula entera; sin embargo, el uso simultáneo de vacunas antipoliomielíticas orales y vacunas antipertussis de célula entera con vacunas conjugadas monovalentes de Hib y MenC no dio lugar a interferencias.
* Vacuna de GlaxoSmithKline
4.6 Fertilidad, embarazo y lactancia
Menitorix no está destinada para su uso en adultos. No se dispone de información sobre la seguridad de la vacuna cuando se utiliza durante el embarazo o la lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
En los ensayos clínicos, Menitorix se administró como pauta de primovacunación de 3 o 2 dosis (N=2.452) o como una dosis de recuerdo (N=2.190). Durante la administración de Menitorix como pauta de primovacunación, se administraron simultáneamente la vacuna DTPa-VHB-VPI* (N=2.077) o la vacuna DTPa-VPI* (N=375).
La mayoría de las reacciones adversas que ocurrieron durante estos estudios se comunicaron durante las 48 horas posteriores a la vacunación.
En dos ensayos clínicos (N=578), Menitorix se administró concomitantemente con la vacuna de sarampión, parotiditis y rubéola (triple vírica). En uno de estos ensayos, la incidencia de reacciones adversas observadas en sujetos que recibieron Menitorix simultáneamente con la triple vírica* (N=102) fue similar a la incidencia observada en los grupos que recibieron la triple vírica sola (N=91) o Menitorix sola (N=104) (ver secciones 4.5 y 5.1).
En otro ensayo clínico, se administró Menitorix como una pauta de primovacunación de 3 dosis (a los 2, 4, 6 meses de edad) a 163 lactantes prematuros (edad gestacional < 36 semanas, incluyendo 56 lactantes < 31 semanas) y a 150 lactantes a término (edad gestacional > 36 semanas). 154 lactantes prematuros y 144 lactantes a término recibieron una dosis de recuerdo entre los 16 y los 18 meses de edad.
El perfil de reactogenicidad y seguridad de Menitorix fue similar en los lactantes prematuros y en los lactantes a término.
Las reacciones adversas que se ha considerado que pueden estar al menos posiblemente relacionadas con la vacunación se han clasificado en función de la frecuencia por dosis de la siguiente manera:
Muy frecuentes (>1/10)
Frecuentes (>1/100 a <1/10)
Poco frecuentes (>1/1.000 a <1/100)
Raras (>1/10.000 a <1/1.000)
Muy raras (<1/10.000)
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas |
|
Ensayos clínicos | ||
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Disminución del apetito |
|
Trastornos psiquiátricos |
Muy frecuentes |
Irritabilidad |
|
Poco frecuentes |
Llanto | |
|
Raras |
Insomnio | |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Somnolencia |
|
Trastornos gastrointestinales |
Poco frecuentes |
Diarrea, vómitos |
|
Raras |
Dolor abdominal | |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
Dermatitis atópica, erupción |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Fiebre (rectal >38 °C), reacciones en el lugar de la inyección (hinchazón, dolor, enrojecimiento) |
|
Frecuentes |
Reacciones en el lugar de la inyección (incluyendo induración y nodulo) | |
|
Poco frecuentes |
Fiebre (rectal > 39,5 °C) | |
|
Raras |
Malestar | |
|
Experiencia post-comercialización | ||
|
Trastornos de la sangre y del sistema linfático |
Desconocida |
Linfadenopatía |
|
Trastornos del sistema inmune |
Desconocida |
Reacciones alérgicas (incluyendo urticaria y reacciones anafilactoides) |
|
Trastornos del sistema nervioso |
Desconocida |
Convulsiones febriles, hipotonía, cefalea, mareo |
|
Trastornos respiratorios, torácicos y mediastínicos |
Desconocida |
Apnea en lactantes muy prematuros (< 28 semanas de gestación) (ver sección 4.4) |
i*54
¿mí®:
Las siguientes reacciones adversas no se han comunicado asociados a la administración de Menitorix pero se han observado muy raramente durante la utilización rutinaria de vacunas conjugadas meningocócicas de grupo C autorizadas:
Reacciones cutáneas graves, colapso o estado similar al shock (episodios de hipotonía-hiporrespuesta), desmayos, convulsiones en pacientes con historial de trastornos convulsivos, hipostesia, parestesia, reagudización de un síndrome nefrótico, artralgia, petequias y/o púrpura.
* Vacuna combinada de GlaxoSmithKline
4.9 Sobredosis
No se han notificado casos de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas bacterianas. Código ATC: J07AG53
Los anticuerpos frente a Haemophilus influenzae tipo b (anti-polirribosilribitol fosfato [anti-PRP]) se midieron mediante un ensayo de inmunoabsorción ligado a enzimas (ELISA). Los anticuerpos frente a
Neisseria meningitidis del serogrupo C se midieron mediante un ensayo de actividad bactericida en suero utilizando complemento de conejo (ABSc-MenC).
Inmunogenicidad tras la pauta de primovacunación
En seis ensayos clínicos se han evaluado las respuestas de anticuerpos un mes después de la administración de dos dosis y después de completar la pauta de primovacunación de tres dosis de Menitorix administradas a 1.163 lactantes a término a los 2, 3, 4 meses o a los 2, 4, 6 meses de edad, aproximadamente. En todos los casos, Menitorix se administró simultáneamente con las vacunas combinadas de GlaxoSmithKline DTPa-VHB-VPI o DTPa-VPI. En 349 de esos lactantes se coadministró además una vacuna conjugada antineumocócica 7-valente o 10-valente.
Los porcentajes de sujetos con títulos de anticuerpos igual o por encima del punto de corte un mes después de la primovacunación con Menitorix fueron los siguientes:
|
Anticuerpo |
Pauta 2-3-4 meses | ||
|
Después de dos dosis |
Después de tres dosis | ||
|
Anti-PRP |
N |
93 |
702 |
|
% >0,15 microgramos/ml |
96,8 |
100,0 | |
|
% >1 microgramo/ml |
76,3 |
98,0 | |
|
GMC (microgramos/ml) |
3,40 |
14,25 | |
|
ABSc-MenC |
N |
93 |
688 |
|
% >1:8 |
100,0 |
99,3 | |
|
% >1:128 |
98,9 |
94,5 | |
|
GMT |
679,6 |
924,8 | |
N= número de sujetos con resultados disponibles
%= porcentaje de sujetos con títulos igual o por encima del punto de corte
GMC o GMT= media geométrica de la concentración o media geométrica del título de anticuerpos
|
Anticuerpo |
Pauta 2-4-6 meses | ||
|
Después de dos dosis |
Después de tres dosis | ||
|
Anti-PRP |
N |
457 |
453 |
|
% >0,15 microgramos/ml |
94,1 |
99,3 | |
|
% >1 microgramos/ml |
67,2 |
96,9 | |
|
GMC (microgramos/ml) |
2,06 |
12,41 | |
|
ABSc-MenC |
N |
445 |
368 |
|
% >1:8 |
98,4 |
99,7 | |
|
% >1:128 |
90,6 |
97,0 | |
|
GMT |
581 |
1.735,0 | |
N= número de sujetos con resultados disponibles
%= porcentaje de sujetos con títulos igual o por encima del punto de corte
GMC o GMT= media geométrica de la concentración o media geométrica del título de anticuerpos
Además, la inmunogenicidad de Menitorix se evaluó en un ensayo clínico en el que los sujetos fueron primovacunados con dos dosis de Menitorix (coadministradas con DTPa-VHB-VPI) a los 3 y a los 5 meses de edad.
Los porcentajes de sujetos con títulos de anticuerpos igual o por encima del punto de corte del ensayo un mes después de la pauta de primovacunación a los 3-5 meses con Menitorix, fueron los siguientes:
|
Pauta 3-5 meses | |
|
Anti-PRP | |
|
N |
325 |
|
% >0,15 microgramos/ml |
96,9 |
|
% >1 microgramo/ml |
78,8 |
|
GMC (microgramos/ml) |
4,24 |
|
ABSc-MenC | |
|
N |
323 |
|
% >1:8 |
99,1 |
|
% >1:128 |
82,4 |
|
GMT |
466,1 |
N= número de sujetos con resultados disponibles
%= porcentaje de sujetos con títulos igual o por encima del punto de corte
GMC o GMT= media geométrica de la concentración o media geométrica del título de anticuerpos Inmunogenicidad tras la vacunación de recuerdo
Las respuestas inmunes a una dosis de recuerdo de Menitorix pueden variar en función de las vacunas utilizadas para las series primarias de vacunación. Se desconoce la significancia clínica de estas diferencias. Ver más abajo para más información acerca de la persistencia de anticuerpos tras las dosis de recuerdo.
En cinco ensayos clínicos, se evaluaron las respuestas de anticuerpos un mes después de la vacunación de recuerdo con Menitorix en niños que habían recibido tres dosis de Menitorix, Menjugate o Meningitec o dos dosis de NeisVac-C durante el primer año de vida. La respuesta inmune de ABSc-MenC a una dosis de recuerdo de Menitorix tras una pauta de vacunación de tres dosis durante el primer año de vida fue menor con una vacuna conjugada MenC-CRM197 (es decir, Menjugate o Meningitec), en comparación con la administración durante el primer año de vida de una vacuna conjugada MenC-TT (es decir, dos dosis de NeisVac-C o tres dosis de Menitorix). Se debe destacar que no se han documentado respuestas inmunes a una dosis de recuerdo de Menitorix tras la administración de dos dosis de una vacuna MenC-CRM197 durante el primer año de vida y que las respuestas pueden diferir de los datos que se muestran en la tabla.
En estos ensayos clínicos la dosis de recuerdo de Menitorix se administró sola, simultáneamente con la vacuna combinada de GlaxoSmithKline DTPa-VHB-VPI o simultáneamente con la vacuna combinada de GlaxoSmithKline DTPa-VHB-VPI y una vacuna conjugada antineumocócica 7-valente o 10-valente o simultáneamente con la vacuna combinada de GlaxoSmithKline frente al sarampión, la rubéola y la parotiditis (SRP, triple vírica).
Los porcentajes de sujetos con títulos de anticuerpos igual o por encima del punto de corte del ensayo un mes después de la vacunación de recuerdo con Menitorix fueron los siguientes:
|
Historia de primovacunación | ||||
|
Sujetos primovacunados con 3 dosis de Menitorix* |
Sujetos primovacunados con 3 dosis de Meningitec + Pediacel |
Sujetos primovacunados con 3 dosis de Meningitec** o Menjugate** |
Sujetos primovacunados con 2 dosis de NeisVac-C** | |
|
Anticuerpos anti-PRP | ||||
|
N |
780 |
114 |
305 |
165 |
|
% >0,15 microgramos/ml |
100 |
100 |
100 |
100 |
|
% >1 microgramos/ml |
100 |
100 |
99,0 |
98,8 |
|
GMC (microgramos/ml) |
70,14 |
44,27 |
38,18 |
77,15 |
|
ABSc-MenC | ||||
|
N |
624 |
114 |
304 |
167 |
|
% >1:8 |
99,5 |
95,6 |
97,7 |
99,4 |
|
% >1:128 |
98,2 |
86,0 |
89,1 |
99,4 |
|
GMT |
3.486,4 |
477,9 |
575,1 |
11.710,5 |
N= número de sujetos con resultados disponibles
GMC o GMT= media geométrica de la concentración o media geométrica del título de anticuerpos %= porcentaje de sujetos con títulos igual o por encima del punto de corte *= coadministrada con la vacuna combinada de GlaxoSmithKline DTPa-VPI **= coadministrada con vacunas que contienen DTPa-Hib-TT
En un ensayo clínico se evaluaron las respuestas de anticuerpos un mes después de la vacunación de recuerdo con Menitorix en niños primovacunados en el primer año de vida con dos dosis de Menitorix o con una vacuna conjugada antimeningocócica C-TT autorizada (MenC-TT).
Las respuestas de anticuerpos un mes después de la administración de una dosis de recuerdo de Menitorix (cohorte por protocolo para inmunogenicidad) fueron las siguientes:_
|
Historia de primovacunación | |
|
Sujetos primovacunados con 2 dosis de Menitorix* | |
|
Anticuerpos anti-PRP | |
|
N |
311 |
|
% >0,15 microgramos/ml |
100 |
|
% >1 microgramos/ml |
99,4 |
|
GMC (microgramos/ml) |
30,49 |
|
ABSc-MenC | |
|
N |
310 |
|
% >1:8 |
100 |
|
% >1:128 |
98,1 |
|
GMT |
1.861,8 |
N= número de sujetos con resultados disponibles
GMC o GMT= media geométrica de la concentración o media geométrica del título de anticuerpos %= porcentaje de sujetos con títulos igual o por encima del punto de corte *= coadministrada con la vacuna DTPa-VHB-VPI/Hib
Inmunogenicidad en lactantes prematuros
En un ensayo clínico, se evaluó la inmunogenicidad de Menitorix en 143 lactantes prematuros (edad gestacional < 36 semanas incluyendo 45 lactantes < 31 semanas) y en 144 lactantes a término (edad gestacional > 36 semanas) tras una pauta de primovacunación de 3 dosis a los 2, 4 y 6 meses de edad. Se evaluó la inmunogenicidad en 135 lactantes prematuros y en 138 lactantes a término tras una dosis de recuerdo entre los 16 y los 18 meses de edad.
Las respuestas de anticuerpos un mes después de completar una pauta de primovacunación de 3 dosis y un mes después de la administración de una dosis de recuerdo de Menitorix en lactantes prematuros y lactantes a término (cohorte por protocolo para inmunogenicidad) fueron las siguientes:_
|
Prematuros |
A término | |||
|
Tras primovacunación |
Tras dosis de recuerdo |
Tras primovacunación |
Tras dosis de recuerdo | |
|
Anticuerpos anti-PRP | ||||
|
N |
140 |
132 |
142 |
134 |
|
% >0,15 microgramos/ml |
99,3 |
100 |
99,3 |
100 |
|
% >1 microgramos/ml |
95,0 |
100 |
94,4 |
100 |
|
GMC (microgramos/ml) |
10,44 |
50,34 |
10,47 |
54,62 |
|
ABSc-MenC | ||||
|
N |
143 |
133 |
140 |
137 |
|
% >1:8 |
99,3 |
99,2 |
100 |
99,3 |
|
% >1:128 |
94,4 |
98,5 |
97,1 |
99,3 |
|
GMT |
1.055,9 |
4.883.1 |
1.346,2 |
5.288,8 |
N= número de sujetos con resultados disponibles
GMC o GMT= media geométrica de la concentración o media geométrica del título de anticuerpos %= porcentaje de sujetos con títulos igual o por encima del punto de corte
Persistencia de anticuerpos
Persistencia de anticuerpos sin una dosis de recuerdo:
Se ha demostrado la persistencia de anticuerpos frente a Hib en tres ensayos clínicos (N=217) en los que un 98,2% de los sujetos presentó una concentración anti-PRP > 0,15 microgramos/ml a los 11-18 meses de edad, es decir, a los 7-14 meses de haber completado la pauta primaria de vacunación de tres dosis con Menitorix.
En tres ensayos clínicos (N=209), el 92,3% de los sujetos tuvo un título ABS-MenC > 1:8 a los 11-18 meses de edad, es decir, a los 7-14 meses de haber completado la pauta primaria de vacunación de tres dosis con Menitorix. Todos los sujetos respondieron inmunológicamente a una dosis de exposición de 10 pg de polisacárido meningocócico del grupo C no conjugado, con un incremento de treinta y tres veces en el título de ABS, demostrando que la pauta de vacunación primaria induce memoria inmunológica.
Se ha demostrado la persistencia de anticuerpos tras una pauta de primovacunación de dos dosis para Hib y para MenC en sujetos de 11-13 meses de edad y primovacunados con Menitorix durante su primer año de vida a los 3-5 meses de edad. Tras completar la pauta de primovacunación de dos dosis con Menitorix, el 86,1% de los sujetos (286/332) tuvieron unos títulos anti-PRP > 0,15 pg/ml y el 94,5% de los sujetos (308/326) tuvieron unos títulos ABS-MenC > 1:8.
Persistencia de anticuerpos después de una dosis de recuerdo:
La persistencia de anticuerpos se evaluó en sujetos primovacunados con Menitorix o primovacunados con la coadministración de la vacuna autorizada antimeningocócica conjugada del grupo C y la vacuna autorizada que contiene Hib y que recibieron una dosis de recuerdo de Menitorix.
En un estudio de persistencia de anticuerpos a largo plazo, los niveles de anticuerpos se evaluaron en sujetos primovacunados con Menitorix o con Meningitec. Ambas se administraron siguiendo una pauta de primovacunación de tres dosis y una dosis de recuerdo con Menitorix.
Los resultados en el grupo comparador no pueden predecir qué resultados se obtendrían con una pauta de primovacunación de dos dosis de Meningitec seguida de una dosis de recuerdo de Menitorix.
Los niveles de anticuerpos del mes 1 tras la vacunación de recuerdo y de los meses 12, 24 y 48, tiempos establecidos para medir la persistencia tras la vacunación de recuerdo (cohorte por protocolo para la persistencia), fueron los siguientes:
|
Historia de primovacunación |
Sujetos primovacunados con tres dosis de Menitorix1 (2, 3, 4 meses) |
Sujetos primovacunados con tres dosis de Meningitec2 (2, 3, 4 meses) | ||||||
|
Historia de vacunación de recuerdo |
Menitorix3 (12-15 meses) |
Menitorix3 (12-15 meses) | ||||||
|
Tiempo (postvacunación de recuerdo) (Mes) |
1 |
12 |
24 |
48 |
1 |
12 |
24 |
48 |
|
Anticuerpos anti-PRP | ||||||||
|
N |
195 |
164 |
194 |
197 |
57 |
48 |
56 |
58 |
|
% > 0,15 microgramos/ml |
100 |
100 |
99,5 |
100 |
100 |
100 |
98,2 |
100 |
|
GMC (microgramos/ml) |
90,10 |
7,45 |
4,93 |
3,82 |
39,10 |
3,56 |
2,08 |
1,67 |
|
ABSc-MenC | ||||||||
|
N |
195 |
166 |
187 |
194 |
58 |
45 |
56 |
58 |
|
% > 1:8 |
99,5 |
89,2 |
65,8 |
59,3 |
96,6 |
66,7 |
35,7 |
44,8 |
|
% > 1:128 |
99,0 |
53,0 |
41,7 |
29,9 |
86,2 |
24,4 |
10,7 |
8,6 |
|
GMT |
2.537,0 |
124,1 |
47,9 |
30,4 |
507,0 |
30,6 |
12,1 |
11,3 |
N= número de sujetos con resultados disponibles
GMC o GMT= media geométrica de la concentración o media geométrica del título de anticuerpos %= porcentaje de sujetos con títulos igual o por encima del punto de corte
1 coadministrada con la vacuna combinada de GlaxoSmithKline DTPa-VPI
2 coadministrada con las vacunas DTPa-VPI /Hib-TT
3 coadministrada con la vacuna combinada de GlaxoSmithKline triple vírica
En otro estudio de persistencia de anticuerpos a largo plazo, los sujetos fueron primovacunados con tres dosis de Menitorix o con dos dosis de NeisVac-C. Todos los sujetos recibieron Menitorix como vacunación de recuerdo.
Los niveles de anticuerpos de los meses 18, 30, 42, 54 y 66, tiempos establecidos para medir la persistencia tras la vacunación de recuerdo (cohorte por protocolo para la persistencia), fueron los siguientes:
an
|
Historia de primovacunació n |
Sujetos primovacunados con tres dosis de Menitorix1 (2, 4, 6 meses) |
Sujetos primovacunados con dos dosis de Neis Vac-C2 (2, 4 meses) | ||||||||
|
Historia de vacunación de recuerdo |
Menitorix (13-14 meses) |
Menitorix (13-14 meses) | ||||||||
|
Tiempo (postvacunación de recuerdo) (Mes) |
18 |
30 |
42 |
54 |
66 |
18 |
30 |
42 |
54 |
66 |
|
Anticuerpos anti-PRP | ||||||||||
|
N |
46 |
47 |
47 |
47 |
47 |
102 |
98 |
101 |
102 |
101 |
|
% > 0,15 microgramos/ml |
100 |
100 |
100 |
100 |
100 |
99,0 |
99,0 |
99,0 |
99,0 |
100 |
|
GMC (microgramos/ml) |
2,94 |
1,92 |
1,70 |
1,51 |
1,60 |
5,49 |
3,52 |
3,00 |
2,74 |
2,62 |
|
ABSc-MenC | ||||||||||
|
N |
42 |
45 |
47 |
47 |
46 |
88 |
93 |
101 |
102 |
101 |
|
% >1:8 |
97,6 |
82,2 |
80,9 |
78,7 |
82,6 |
96,6 |
94,6 |
96,0 |
97,1 |
94,1 |
|
% >1:128 |
59,5 |
57,8 |
61,7 |
55,3 |
60,9 |
84,1 |
77,4 |
79,2 |
80,4 |
68,3 |
|
GMT |
224,8 |
113,3 |
110,5 |
93,5 |
121,5 |
737,6 |
404,9 |
380,9 |
342,9 |
227,6 |
N= número de sujetos con resultados disponibles
GMC o GMT= media geométrica de la concentración o media geométrica del título de anticuerpos %= porcentaje de sujetos con títulos igual o por encima del punto de corte
1 coadministrada con la vacuna combinada de GlaxoSmithKline DTPa-HBV-VPI
2 coadministrada con las vacunas combinadas de GlaxoSmithKline DTPa-HBV-VPI /Hib-TT (a los 2, 4, 6 meses) o con DTPa-HBV-VPI /Hib-TT (a los 2, 6 meses) y DTPa-VPI /Hib-TT (a los 4 meses)
Vigilancia postcomercialización tras una campaña de inmunización en el Reino Unido
Las estimaciones sobre la efectividad de la vacuna obtenidas del programa rutinario de inmunización del Reino Unido (utilizando distintas cantidades de tres vacunas conjugadas frente a meningococo grupo C), desde el comienzo de su utilización a finales de 1999 hasta marzo de 2004, demostraron la necesidad de administrar una dosis de recuerdo después de completar la pauta de primovacunación (tres dosis administradas a los 2, 3 y 4 meses). Al año de completar la primovacunación, se estimó una efectividad vacunal en la cohorte de lactantes vacunados en el primer año de vida de un 93% (67-99 con un intervalo de confianza del 95%). Sin embargo, más de un año después de completar la pauta de primovacunación, había claras evidencias de descenso de la protección.
Hasta 2007, en las cohortes de edad de 1-18 años que recibieron una única dosis de la vacuna conjugada de meningococo grupo C durante el programa inicial de vacunación de rescate en el Reino Unido, las estimaciones globales de efectividad disminuyen entre el 83 y el 100%. Los datos muestran un descenso de la efectividad no significativo dentro de estas cohortes de edad cuando se comparan periodos de tiempo inferiores a un año o un año o más desde la inmunización.
5.2 Propiedades farmacocinéticas
No se requiere para las vacunas evaluación de las propiedades farmacocinéticas.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad y de toxicidad a dosis únicas y a dosis repetidas.
am
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Trometamol
Sacarosa
Disolvente:
Cloruro de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años
Una vez reconstituida, la vacuna debe ser administrada rápidamente o conservada en nevera (entre 2 °C y 8 °C). Si no se utiliza en 24 horas, se debe desechar.
Los datos experimentales demuestran que la vacuna reconstituida se puede mantener también 24 horas a temperatura ambiente (25 °C). Si no se utiliza en 24 horas, se debe desechar.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
Conservar en el embalaje original para protegerla de la luz.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Polvo en un vial (vidrio tipo I) con un tapón (goma de butilo).
0,5 ml de disolvente en una jeringa precargada (vidrio tipo I) con tapón del émbolo (goma de butilo) con o sin agujas separadas en los siguientes tamaños de envase:
- envase de 1 vial de polvo + 1 jeringa precargada de disolvente con 2 agujas separadas o sin agujas
- envase de 10 viales de polvo + 10 jeringas precargadas de disolvente con 20 agujas separadas o sin agujas
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
i*54
¿mí®:
Menitorix se debe reconstituir añadiendo todo el contenido de la jeringa precargada al vial que contiene el polvo.
Para saber cómo insertar la aguja en la jeringa, véase el dibujo explicativo. No obstante, la jeringa facilitada con Menitorix puede ser ligeramente diferente (sin rosca de tornillo) a la jeringa descrita en el dibujo. En tal caso, la aguja deberá insertarse sin enroscar.
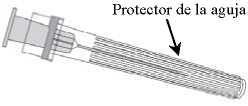
Émbolo de la jeringa
Cuerpo de la jeringa
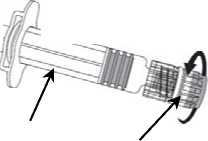
Protector de la jeringa
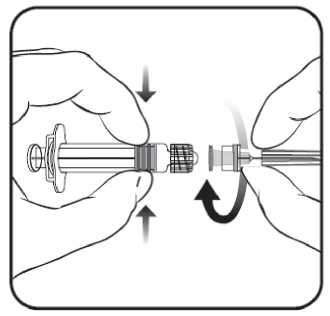
1. Sujetar el cuerpo de la jeringa con una mano (evitar sostener el émbolo de la jeringa) y con la otra, desenroscar el protector de la jeringa girándolo en sentido contrario a las agujas del reloj.
2. Insertar la aguja en la jeringa y a continuación, girar la aguja en el sentido de las agujas del reloj hasta que se bloquee (ver dibujo).
3. Retirar el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
Añadir el disolvente al polvo. Después de añadir el disolvente al polvo, se debe agitar bien la mezcla hasta que el polvo esté completamente disuelto.
La vacuna reconstituida es una solución transparente e incolora.
Se debe inspeccionar visualmente el contenido de la vacuna reconstituida para observar si existe alguna sustancia extraña y/o variación del aspecto físico antes de su administración. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Se debe utilizar una aguja nueva para administrar la vacuna.
Inyectar todo el contenido del vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7.
TITULAR DE LA AUTORIZACION DE COMERCIALIZACION
GlaxoSmithKline, SA PTM - C/ Severo Ochoa, 2 28760 Tres Cantos (Madrid)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
N° registro: 70.064
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20/Abril/2008
10. FECHA DE LA REVISIÓN DEL TEXTO
07/2013
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
FT Menitorix - 3.1 (IB/038 - Julio 2013)