Magnevist 0,5 Mmol/Ml Solucion Inyectable En Jeringa Precargada
Prospecto: información para el usuario MAGNEVIST 0,5 mmol/ml solución inyectable en jeringa precargada
Gadopentetato de dimeglumina
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o radiólogo, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Magnevist y para qué se utiliza.
2. Qué necesita saber antes de empezar a usar Magnevist.
3. Cómo usar Magnevist.
4. Posibles efectos adversos.
5. Conservación de Magnevist.
6. Contenido del envase e información adicional.
1. Qué es Magnevist y para qué se utiliza
Magnevist 0,5 mmol/ml solución inyectable en jeringa precargada es una solución para inyección intravenosa. Pertenece al grupo de medicamentos denominado agentes de diagnóstico.
Se utiliza para intensificar el contraste cuando se realiza una resonancia magnética craneal y espinal, así como de otras regiones corporales.
Este medicamento es únicamente para uso diagnóstico.
2. Qué necesita saber antes de empezar a usar Magnevist No use Magnevist:
Si es alérgico (hipersensible) al gadopentetato de dimeglumina o a cualquiera de los demás componentes de este medicamento(incluidos en la sección 6).
Si padece insuficiencia renal grave.
Advertencias y precauciones
Su médico deberá tener especial cuidado cuando le administre Magnevist:
• Si tiene tendencia a las reacciones alérgicas, en cuyo caso la decisión de realizar una exploración con Magnevist debe tomarse valorando cuidadosamente la relación beneficio/riesgo, ya que, según muestra
la experiencia, en estos pacientes se dan con mayor frecuencia reacciones de hipersensibilidad
(reacciones alérgicas).
• Si ha tenido previamente una reacción alérgica a medios de contraste.
• Si tiene o ha tenido algún tipo de alergia (p. ej. rinitis alérgica, urticaria) o asma.
• Si sufre del corazón o problemas de circulación de la sangre. Porque en el caso raro de que sufra una
reacción alérgica, hay más probabilidades que sea seria o mortal.
• No se le debe administrar Magnevist si usted tiene algún problema renal grave y/o pérdida repentina de la función renal, o si es un paciente que se le va a realizar o se le ha realizado recientemente un trasplante de hígado, ya que el uso de Magnevist en pacientes con estas enfermedades se ha asociado con una enfermedad conocida como fibrosis nefrogénica sistémica (FNS). La FNS es una enfermedad que causa un engrasamiento de la piel y de los tejidos conectivos. La FNS puede provocar una inmovilidad grave de las articulaciones, debilidad muscular o puede afectar el funcionamiento normal de los órganos intemos que puede poner en peligro la vida.
• Magnevist no debe administrarse tampoco a los neonatos (recién nacidos) de hasta 4 semanas de edad.
• Si tiene epilepsia o si padece o ha padecido trastornos convulsivos o lesiones intracraneales.En
ocasiones raras, han ocurrido ataques o convulsiones en pacientes con condiciones similares.
Informe a su médico si:
• sus riñones no funcionan correctamentey/o si sufre una pérdida repentina de la función renal,
• si recientemente se le ha realizado, o pronto se le va a realizar, un trasplante de hígado.
Antes de que se le administre Magnevist, será necesario que le realicen un análisis de sangre para
comprobar el funcionamiento correcto de sus riñones.
Pueden ocurrir reacciones alérgicas tras la administración de Magnevist. Es posible que las reacciones sean
graves. La mayoría de estas reacciones ocurren en los 30 minutos tras la administración. Por lo tanto, debe
permanecer en observación al menos 30 minutos tras la inyección.
Pueden ocurrir reacciones retardadas (horas o días después), (ver sección 4. Posibles efectos adversos).
Niños y adolescentes
Magnevist no debe utilizarse en neonatos (recién nacidos) de hasta 4 semanas. Como la función renal es inmadura en lactantes de hasta 1 año, Magnevist sólo se utilizará tras una valoración cuidadosa del médico.
Uso de Magnevist con otros medicamentos
Comunique a su médico, radiólogo o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
No se han realizado estudios de interacciones con otros medicamentos.
Interferencias con otras pruebas de diagnóstico:
Si le van a realizar un análisis, informe a su médico de que le han administrado Magnevist ya que tras su administración se han observado casos aislados de aumentos leves y asintomáticos de los valores de hierro y bilirrubina en sangre que, sin embargo, regresaron por lo general a los valores iniciales dentro de las 24 horas siguientes tras su administración.
3E
Embarazo y lactancia y fertilidad
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Embarazo:
Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, al radiólogo o al personal sanitario que le asiste antes de utilizar este medicamento. Magnevist no debe utilizarse durante el embarazo a menos que sea estrictamente necesario.
Lactancia:
Informe a su médico si está dando el pecho o a punto de empezar. Debeinterrumpirse la lactancia durante al menos 24 horas tras la administración de Magnevist.
Conducción y uso de máquinas
Este apartado no procede debido a las características del medicamento.
3. Cómo usar Magnevist
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de dudas, pregunte a su médico o farmacéutico.
Magnevist le será administrado por vía intravenosa (en una vena), en un centro sanitario por personal cualificado y preferiblemente bajo la supervisión de un médico, que indicará en todo momento las instrucciones a seguir.
• Resonancia magnética craneal y espinal
Generalmente, es suficiente la administración de 0,2 ml (0,1mmol) de Magnevist por kg de peso corporal, puede ser necesaria la administración de otra dosis en el intervalo de 30 minutos, repitiendo a continuación la resonancia magnética.
• Resonancia magnética de otras regiones corporales
Generalmente es suficiente la administración de 0,2 ml (0,1 mmol) de Magnevist por kg de peso corporal.
En casos especiales puede ser necesario administrar 0,4 ml (0,2 mmol) de Magnevist por kg de peso corporal.
Generalmente, en adultos es suficiente la administración de 0,2 ml de Magnevist por kg de peso corporal (esto significa que una persona con un peso corporal de 70 kg recibiría una dosis de 14 ml).
Posología en _poblaciones especiales
No se le debe administrar Magnevist si usted tiene problemas renales graves y/o pérdida repentina de la función renal, o si es un paciente que se le va a realizar o se le ha realizado recientemente un trasplante de hígado. Magnevist no debe tampoco utilizarse en neonatos (recién nacidos) de hasta 4 semanas.
¿¡*■5
Si usted tiene problemas renales moderados, durante una exploración sólo debe administrársele una dosis de Magnevist y no debe administrársele una segunda inyección hasta que hayan transcurrido al menos 7 días.
Como en lactantes de hasta 1 año de edad la función renal es inmadura, durante una exploración sólo debe administrarse una dosis de Magnevist y no debe administrársele una segunda inyección hasta que hayan transcurrido al menos 7 días.
Si usted tiene 65 años o es mayor no es necesario que se le ajuste la dosis pero deberá realizársele un análisis de sangre para comprobar el funcionamiento correcto de sus riñones.
Si usa más Magnevist del que debe
Hasta el momento no se han observado ni se ha informado de signos de intoxicación debidos a sobredosis durante el empleo en clínica.
No obstante, la sobredosis accidental de Magnevist podría dar lugar (particularmente en niños pequeños y en función del peso corporal) a los siguientes efectos:
- Sistémicos: Aumento de la presión arterial pulmonar, hipervolemia (aumento del volumen de líquido
circulante en el organismo), diuresis osmótica (eliminación de orina por aumento de la concentración de iones en la orina), deshidratación.
- Locales: Dolor vascular.
Es muy poco probable que se produzca intoxicación a causa de la ingestión accidental de Magnevist, debido al pequeño volumen que se administra y a su baja absorción en el estómago.
Si usted ha usado más Magnevist de lo que debe, consulte inmediatamente a su médico o farmacéutico o al Servicio de Información Toxicológica, teléfono 91 562 04 20.
4. Posibles efectos adversos
Al igual que todos los medicamentos este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
La mayoría de las reacciones adversas asociadas con el uso de Magnevist son de naturaleza de leve a moderada.
Las reacciones adversas notificadas más frecuentemente en pacientes recibiendo Magnevist (pueden afectar a 4 o más de cada 1.000 pacientes) son náuseas, cefaleas y reacciones en el lugar de inyección.
Los efectos adversos más graves en pacientes recibiendo Magnevist son la Fibrosis Nefrogénica Sistémica (FNS) y reacciones anafilactoides (reacciones como las de tipo alérgico) incluyendo reacciones graves como shock. La FNS es una reacción grave que, principalmente, produce engrasamiento de la piel y tejidos conectivos, y puede dar lugar a inmovilidad grave de las articulaciones, debilidad muscular o puede afectar el funcionamiento normal de los órganos internos, que puede poner en peligro la vida.
En casos raros pueden ocurrir reacciones de tipo alérgico, incluyendo reacciones graves como el shock, que puede necesitar atención médica inmediata.
Si usted nota una leve inflamación de la cara, labios, lengua o garganta, tos o estornudos, dificultad para respirar, picores, goteo nasal o urticaria (sarpullido como el que causa la ortiga), informe a su médico, al radiólogo o al personal sanitario inmediatamente. Estos pueden ser los primeros signos de una reacción grave. Su exploración deberá ser suspendida, y es posible que necesite tratamiento posterior.
En ocasiones raras, se han producido reacciones retardadas de los medios de contraste, algunas horas o varios días después de la administración de Magnevist. Si esto le ocurre a usted avise a su médico o radiólogo.
A continuación, se enumeran posibles efectos adversos según su probabilidad de aparición.
Poco frecuentes(afectan de 1 a 10 de cada 1.000 pacientes):
- Mareos, dolor de cabeza, pérdida del gusto.
- Vómitos, náuseas.
- Dolor, sensación de calor, sensación de frío
- Sensaciones o reacciones en el lugar de inyección como:
enfriamiento, pérdida de sensibilidad, hinchazón, calor, dolor, edema, irritación, hemorragia (sangrado), eritema (piel rojiza y dolorosa), molestias, necrosis (muerte del tejido), tromboflebitis (inflamación de una vena causada por un coágulo sanguíneo), flebitis (inflamación de una vena), inflamación, extravasación (sangrado dentro del tejido en el lugar de inyección).
Raros(afectan de 1 a 10 de cada 10.000 pacientes):
- Reacciones de hipersensibilidad (alérgicas) / anafilactoides (como las de tipo alérgico) p. ej. shock anafilactoide (reacción grave del tipo alérgico); shock (colapso circulatorio); hipotensión(presión sanguínea baja); conjuntivitis; pérdida de la conciencia; estrechamiento de la garganta; estornudos; urticaria (sarpullido como el que causa la ortiga); prurito (picor); erupción; eritema (enrojecimiento de la piel); disnea (dificultad para respirar); parada respiratoria; broncoespasmo (dificultad al respirar); sibilancias; laringoespasmo; edema laríngeo (inflamación de la laringe); edema faríngeo (inflamación de la garganta); cianosis (labios azules); rinitis (goteo de nariz); angioedema (p. ej. inflamación de la cara, garganta, boca, labios y/o lengua); edema facial (inflamación de la cara); taquicardia refleja (latidos del corazón anormalmente rápidos o lentos).
- Desorientación.
- Convulsiones(ataques o crisis); hormigueo y entumecimiento; sensación de ardor; temblores.
- Taquicardia (aumento de la frecuencia cardíaca); arritmia (ritmos anormales del corazón).
- Tromboflebitis(inflamación de una vena causada por un coágulo sanguíneo); rubor;
vasodilatación(dilatación de los vasos sanguíneos).
- Irritación de la garganta, dolor faringolaríngeo/molestias de la faringe(dolor o molestias en la garganta); tos.
- Dolor o molestias estomacales; diarrea; dolor de muelas; sequedad de boca; dolor en los tejidos blandos bucales y parestesia (hormigueo y entumecimiento en la boca).
- Dolor enbrazos, manos, piernas y pies (extremidades).
- Dolor del tórax; fiebre, inflamación de los brazos, manos, tobillos, pies y piernas(edema periférico); malestar general;cansancio (fatiga); sed; astenia (sensación generalizada de debilidad física y psíquica).
No conocida (la frecuencia no puede estimarse a partir de los datos disponibles)
- Niveles de hierro en sangre elevados(los cambios en los niveles pueden ser detectados en los análisis de sangre).
- Agitación; confusión.
- Coma; somnolencia (sueño), trastornos del habla;parosmia (percepción de olores imaginarios).
- Trastornos visuales; dolor ocular; lagrimación.
- Deterioro de la audición; dolor del oído.
- Parada cardíaca;bradicardia(disminución del latido del corazón).
- Síncope (desmayo); reacción vasovagal (disminución temporal y rápida de la presión sanguínea, palidez, puede dar lugar a pérdida de conciencia), aumento de la presión sanguínea.
- Dificultad para respirar; aumento/disminución de la velocidad de respiración;edema pulmonar (líquido en los pulmones).
- Salivación.
- Niveles elevados de bilirrubina en sangre, niveles elevados de enzimas hepáticos en sangre.
- Fibrosis Nefrogénica Sistémica (FNS es una reacción grave, que produce principalmente un engrosamiento de la piel y de tejidos conectivos, y puede dar lugar a inmovilidad grave de las articulaciones, debilidad muscular o puede afectar el funcionamiento normal de los órganos internos que puede poner en peligro la vida).
- Dolor de espalda, dolor articular.
- Insuficiencia renal en pacientes con problemas renales previos, niveles elevados de creatinina en sangre, incontinencia urinaria, urgencia urinaria.
- Escalofríos, sudoración, cambios en la temperatura corporal.
En pacientes con insuficiencia renal diálisis-dependientes tratados con Magnevist, se han observado comúnmente reacciones retardadas y transitorias del tipo inflamatorio tales como fiebre, escalofríos y aumento de proteína C-reactiva. En estos pacientes se realizó una Resonancia Magnética un día antes a la hemodiálisis.
Se han notificado casos de fibrosis nefrogénica sistémica (que provoca un endurecimiento de la piel y puede afectar también a los tejidos blandos y los órganos internos).
Los siguientes efectos adversos han puesto en peligro la vida o han sido mortales en algunos casos: fibrosis nefrogénica sistémica, shock/reacción anafilactoide, alergia, colapso circulatorio, hipotensión, pérdida de conciencia, estrechamiento de la garganta, dificultad para respirar, parada respiratoria, broncoespasmo, laringoespasmo, edema laríngeo, edema faríngeo, cianosis, angioedema, edema facial, convulsiones, taquicardia, niveles elevados de hierro en sangre, coma, somnolencia (sueño), parada cardíaca, bradicardia, desmayo y edema pulmonar.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Magnevist
Mantener este medicamento fuera de la vista y del alcance de los niños.
Conservar en el embalaje original para protegerlo de la luz y humedad.
Conservación una vez abierto el envase:
Después de abrir la jeringa precargada, Magnevist permanece estable durante el día de la exploración.
No utilice este medicamentodespués de la fecha de caducidad que aparece en el envase después de CAD.
La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Magnevist
- El principio activo es gadopentetato de dimeglumina. Cada ml de la solución para inyección contiene 0,5 mmol de gadopentetato de dimeglumina (equivalente a 469,01 mg de gadopentetato de dimeglumina).
- Los demás componentes son:
Meglumina, ácido dietilentriaminopentaacético (DTPA) y agua para preparaciones inyectables. Aspecto del producto y contenido del envase
Magnevist 0,5 mmol/ml solución inyectable en jeringa precargada se presenta en jeringas precargadas para un solo uso de 10 ml, 15 ml y 20 ml.
Tamaños de envase: 1 jeringa precargada.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización Bayer Hispania, S.L.
Av. Baix Llobregat, 3-5
08970 Sant Joan Despí (Barcelona)
España
Responsable de la fabricación BAYER PHARMA AG D-13342 Berlín
Fecha de la última revisión de este prospecto:06/2015
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
Esta información está destinada únicamente a médicos o profesionales del sector sanitario.
Forma de administración
El paciente debe estar en ayunas desde dos horas antes de la exploración.
Han de observarse las normas de seguridad habituales en resonancia magnética, p.ej., exclusión de marcapasos cardíacos e implantes ferromagnéticos.
Magnevist no debe mezclarse con otros medicamentos.

La dosis necesaria se administra por inyección intravenosa; si se desea, en bolo. Generalmente se obtiene un contraste óptimo aproximadamente en un período de 45 minutos tras la inyección de Magnevist.
En la resonancia magnética de otras regiones corporales, en caso de lesiones con escasa vascularización y/o poco espacio extracelular, puede ser necesario administrar 0,4 ml (0,2 mmol) de Magnevist por kg de peso corporal para obtener un contraste adecuado, en particular si se emplean secuencias relativamente poco potenciadas en T1.
Siempre que sea posible, la administración intravascular del medio de contraste debe realizarse con el paciente en decúbito; después de la inyección, el paciente debe permanecer bajo observación, como mínimo, durante media hora.
Sobre la base de los resultados de los estudios de toxicidad aguda, es altamente improbable el riesgo de intoxicación aguda por el empleo de Magnevist. Esta afirmación es también cierta para neonatos y bebés únicamente si la dosis de Magnevist especificada para este grupo de pacientes se inyecta manualmente, sin el empleo de un inyector.
• Presentación en jeringa precargada:
No debe extraerse Magnevist de su envase hasta inmediatamente antes de la administración. Cualquier resto del medio de contraste no empleado en una exploración debe desecharse.
Inmediatamente antes del uso, se debe separar la tapa del extremo (capuchón) de la jeringa precargada.
Para el montaje de la jeringa precargada, pueden verse las Figuras 1-6 que se adjuntan.
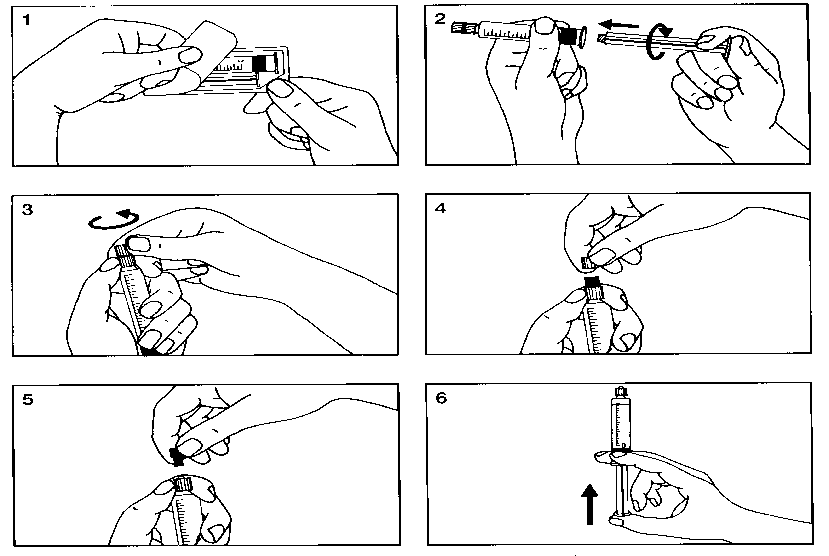
La etiqueta separable de las jeringas precargadas debe pegarse en la historia del paciente a fin de permitir un registro preciso del medio de contraste de gadolinio utilizado. También debería registrarse la dosis utilizada.En el caso que se utilicen registros electrónicos de pacientes, deben introducirse en los mismos el nombre del producto, el número de lote y la dosis administrada.
LITIGA
IALDAD
rtaóe
>1
torios
¿¡*■5
Insuficiencia renal
• Insuficiencia renal
Antes de la administración de Magnevist, se debe evaluar a todos los pacientes para detectar una posible disfunción renal mediante pruebas de laboratorio.
Se han notificado casos de fibrosis nefrogénica sistémica (FNS) asociados a la utilización de Magnevist y algunos otros medios de contraste de gadolinio en pacientes con insuficiencia renal grave aguda o crónica (TFG o tasa de filtración glomerular < 30 ml/minuto/1,73 m2) y/o lesión renal aguda. Magnevist está contraindicado en estos pacientes. Los pacientes sometidos a trasplante hepático tienen un riesgo especial ya que la incidencia de un fallo renal es elevada en este grupo. Por consiguiente, Magnevist no debe utilizarse en pacientes en el periodo perioperatorio de un trasplante hepático.
Magnevist tampoco debe administrarse a neonatos (recién nacidos) de hasta 4 semanas.
El riesgo de que los pacientes con una insuficiencia renal moderada (TFG o tasa de filtración glomerular de 30-59 ml/min/1,73 m2) desarrollen una fibrosis nefrogénica sistémica (FNS) es desconocido, por consiguiente, Magnevist debe utilizarse tras una valoración cuidadosa del riesgo/beneficio en pacientes con una insuficiencia renal moderada a una dosis no superior a 0,2 ml/kg de peso corporal. Durante una exploración no debe administrarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, la administración de Magnevist no debe repetirse a no ser que haya transcurrido un intervalo entre inyecciones de al menos 7 días.
Debido a la inmadurez de la función renal en lactantes de hasta 1 año de edad, Magnevist sólo debe utilizarse en estos pacientes tras una valoración cuidadosa a una dosis no superior a 0,2 ml/kg de peso corporal. Durante una exploración no debe administrarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, la administración de Magnevist no debe repetirse a no ser que haya transcurrido un intervalo entre inyecciones de al menos 7 días. Magnevist no debe administrarse a neonatos (recién nacidos) de hasta 4 semanas.
Dado que la eliminación renal de gadopentetato de dimeglumina puede estar reducida en los pacientes de edad avanzada, es especialmente importante evaluar a los pacientes de 65 años y mayores para detectar una posible disfunción renal.
La hemodiálisis poco después de la administración de Magnevist puede resultar útil para la eliminación corporal de Magnevist. No hay evidencia que apoye el inicio de la hemodiálisis para la prevención o tratamiento de la FNS en pacientes que no están sometidos a hemodiálisis.
Embarazo y lactancia
No debe utilizarse Magnevist durante el embarazo a no ser que la situación clínica de la mujer requiera el uso de gadopentetato de dimeglumina.
Debe interrumpirse la lactancia durante al menos 24 horas tras la administración de Magnevist.
¡y
Bros
9 de 9