Magnevist 0,5 Mmol/Ml Solucion Inyectable En Jeringa Precargada
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Magnevist 0,5 mmol/ml solución inyectable.
Magnevist 0,5 mmol/ml solución inyectable en jeringa precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución inyectable contiene 0,5 mmol de gadopentetato de dimeglumina (equivalente a 469,01 mg de gadopentetato de dimeglumina).
Contenido de gadopentetato de dimeglumina en medio de contraste por:
|
100 ml |
46,900 g |
|
30 ml |
14,070 g |
|
20 ml |
9,380 g |
|
15 ml |
7,035 g |
|
10 ml |
4,690 g |
|
5 ml |
2,345 g |
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA Solución inyectable.
Solución clara, de incolora a amarillo pálido.
Las propiedades físico-químicas de Magnevist se listan a continuación:
|
Osmolaridad (osm/l solución) A 37°C |
1,44 |
|
Osmolalidad (osm/kg H2O) A 37°C |
1,96 |
|
Presión osmótica a 37°C atm |
49,8 |
|
mPa |
5,06 |
|
Viscosidad (mPa' s ó cP) A 20°C |
4,9 |
|
A 37°C |
2,9 |
|
pH |
7,0 - 7,9 |
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Este medicamento es únicamente para uso diagnóstico.
• Resonancia magnética (RM) craneal y espinal
En especial para la detección de tumores y el ulterior diagnóstico diferencial en los casos de sospecha de meningiomas, neurinomas (del acústico), tumores invasivos (por ejemplo, gliomas) y metástasis; para la demostración de la existencia de tumores pequeños y/o isointensos; en la sospecha de recurrencia después de cirugía o radioterapia; para la representación diferencial de neoplasias raras, como hemangioblastomas, ependimomas y adenomas pequeños de la hipófisis; para la mejor evaluación de la extensión de tumores que no sean de origen cerebral.
Adicionalmente en la RM de la médula espinal: diferenciación de tumores intra- y extramedulares; demostración de zonas tumorales sólidas en siringomielia establecida; determinación de la extensión tumoral intramedular.
• RM de otras regiones corporales
Incluyen la región otorrinofaríngea, cavidad torácica y abdominal, mamas, pelvis y el sistema musculoesquelético.
En particular, Magnevist suministra información diagnóstica para:
- la demostración o exclusión de tumores, inflamaciones y lesiones vasculares, la determinación de su extensión y demarcación, y la diferenciación de su estructura interna.
- la evaluación del flujo sanguíneo en tejidos normales y patológicos.
- la diferenciación entre tumor y tejido cicatricial después de terapia.
- el diagnóstico del prolapso recurrente del disco intervertebral después de cirugía.
4.2 Posología y forma de administración
Posología
Adultos
•RM craneal y espinal
Generalmente, la administración de 0,2 ml de Magnevist por kg de peso corporal (equivalente a 0,1 mmol de gadopentetado de dimeglumina por kg de peso corporal) es suficiente para obtener un mejor realce que permita aclarar el problema diagnóstico planteado. Si a pesar de una RM con contraste normal subsistiera una fuerte sospecha clínica de existencia de lesión, puede incrementarse el valor diagnóstico de la exploración volviendo a administrar otra inyección de la misma dosis original en el intervalo de 30 minutos y repitiendo a continuación la RM.
•RM de otras regiones corporales
Generalmente la administración de 0,2 ml (0,1 mmol) de Magnevist por kg de peso corporal es suficiente para obtener un mejor realce que permita aclarar el problema diagnóstico planteado.
En casos especiales, por ej. en lesiones con escasa vascularización y/o poco espacio extracelular, puede ser necesario administrar 0,4 ml (0,2 mmol) Magnevist por kg de peso corporal para obtener un contraste adecuado, en particular si se emplean secuencias relativamente poco potenciadas en T1.
• Poblaciones Especiales
Insuficiencia renal
Magnevist está contraindicado en pacientes con insuficiencia renal grave (TFG o tasa de filtración glomerular <30 ml/min/1,73 m2) y/o lesión renal agudao en pacientes en el periodo perioperatorio de un trasplante hepático (ver sección 4.3). Magnevist sólo debe utilizarse en pacientes con una insuficiencia renal moderada (TFG o tasa de filtración glomerular de 30-59 ml/min/1,73 m2) a una dosis no superior a 0,2 ml/kg de peso corporal (ver sección 4.4), tras una valoración cuidadosa del riesgo/beneficio. Durante una exploración no debe administrarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, la administración de Magnevist no debe repetirse a no ser que haya transcurrido un intervalo entre inyecciones de al menos 7 días.
Población pediátrica
Neonatos de hasta 4 semanas y lactantes de hasta 1 año de edad y niños.
Magnevist está contraindicado en neonatos de hasta 4 semanas (ver sección 4.3). Debido a la inmadurez de la función renal de los lactantes de hasta 1 año de edad, Magnevist sólo debe utilizarse en estos pacientes tras una valoración cuidadosa a una dosis no superior a 0,2 ml/kg de peso corporal. Durante una exploración no debe administrarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, la administración de Magnevist no debe repetirse a no ser que haya transcurrido un intervalo entre inyecciones de al menos 7 días.
En lactantes menores de 6 meses de edad no está recomendado el uso para resonancia magnética (RM) de cuerpo entero.
En niños menores de 2 años de edad la experiencia en el uso para resonancia magnética (RM) de cuerpo entero es limitada.
Pacientes de edad avanzada (población de 65 años y mayores)
No se considera necesario ajustar la dosis. Debe tenerse precaución en los pacientes de edad avanzada (ver sección 4.4).
Forma de administración
Este medicamento es únicamente para uso intravenoso.
El paciente debe estar en ayunas desde dos horas antes de la exploración.
Han de observarse las normas de seguridad habituales en resonancia magnética, p.ej., exclusión de marcapasos cardíacos e implantes ferromagnéticos.
La dosis necesaria se administra por inyección intravenosa; si se desea, en bolo. Generalmente se obtiene un contraste óptimo aproximadamente en un período de 45 minutos tras la inyección de Magnevist.
Las secuencias de imagen potenciadasen T1 son especialmente idóneas para las exploraciones con contraste.
3E
Siempre que sea posible, la administración intravascular del medio de contraste debe realizarse con el paciente en decúbito; después de la inyección, el paciente debe permanecer bajo observación, como mínimo, durante media hora.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Magnevist está contraindicado en pacientes con insuficiencia renal grave (TFG o tasa de filtración glomerular <30 ml/min/1,73 m2) y/o lesión renal aguda, en pacientes en el periodo perioperatorio de un trasplante hepático y en neonatos de hasta 4 semanas (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
•Reacciones de hipersensibilidad:
Como ocurre con otros medios de contraste, Magnevist puede asociarse a reacciones de hipersensibilidad/anafilácticas o a otras reacciones idiosincrásicas caracterizadas por manifestaciones cardiovasculares, respiratorias o cutáneas, que pueden llegar a ser graves incluyendo shock.
El riesgo de reacciones de hipersensibilidad es mayor en los siguientes casos:
-reacción previa a medios de contraste.
-antecedentes de asma bronquial.
-antecedentes de trastornos alérgicos.
En pacientes con una predisposición alérgica (especialmente con historia de previa de alguna de las condiciones arriba mencionadas) la decisión de utilizar Magnevist debe hacerse tras una evaluación cuidadosa del balance riesgo-beneficio.
La mayoría de estas reacciones ocurren en la media hora tras la administración. Por lo tanto, se recomienda mantener al paciente en observación después del procedimiento.
Es necesario disponer de la medicación adecuada para el tratamiento de las reacciones de hipersensibilidad, así como la preparación para la aplicación de medidas de emergencia.
En raras ocasiones, se han producido reacciones retardadas después de horas o incluso días después de la administración (ver sección 4.8.Reacciones Adversas).
Los pacientes con enfermedad cardiovascular son más susceptibles a sufrir reacciones de hipersensibilidad graves e incluso mortales.
•Pacientes con insuficiencia renal:
Antes de la administración de Magnevist, se debe evaluar a todos los pacientes para detectar una posible disfunción renal mediante pruebas de laboratorio.
Se han notificado casos de fibrosis nefrogénica sistémica (FNS) asociados a la utilización de Magnevist y algunos otros medios de contraste de gadolinio en pacientes con insuficiencia renal grave aguda o crónica (TFG o tasa de filtración glomerular < 30 ml/min/1,73 m2) y/o lesión renal aguda. Magnevist está contraindicado en estos pacientes (ver sección 4.3).Los pacientes sometidos a trasplante hepático tienen un riesgo especial ya que la incidencia de un fallo renal agudo es elevada en este grupo. Por consiguiente,
Magnevist no debe utilizarse en pacientes en el periodo perioperatorio de un trasplante hepático ni en neonatos (ver sección 4.3).
El riesgo de que los pacientes con una insuficiencia renal moderada (TFG o tasa de filtración glomerular de 30-59 ml/min/1,73 m2) desarrollen una fibrosis nefrogénica sistémica (FNS) es desconocido. Por consiguiente, Magnevist debe utilizarse solamente tras una valoración cuidadosa del riesgo/beneficio en pacientes con una insuficiencia renal moderada.
La hemodiálisis poco después de la administración de Magnevist puede resultar útil para la eliminación de Magnevist del organismo. No hay evidencia que apoye el inicio de la hemodiálisis para la prevención o tratamiento de la FNS en pacientes que no están sometidos a hemodiálisis.
•Trastornos convulsivos:
Los pacientes con trastornos convulsivos o lesiones intracraneales pueden tener un mayor riesgo de actividad convulsiva ya que en ocasiones raras se ha informado de casos de este tipo con la administración de Magnevist (ver sección 4.8.Reacciones adversas).
•Población pediátrica: Uso en neonatos y lactantes:
Magnevist está contraindicado en neonatos de hasta 4 semanas (ver sección 4.3). Debido a la inmadurez de la función renal de los lactantes de hasta 1 año de edad, Magnevist sólo debe utilizarse en estos pacientes tras una valoración cuidadosa.
• Uso en pacientes de edad avanzada:
Dado que la eliminación renal del gadopentetato de dimeglumina puede estar reducida en los pacientes de edad avanzada, es especialmente importante evaluar a los pacientes de 65 años y mayores para detectar una posible disfunción renal.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
Interacción con otras pruebas diagnósticas:
A causa del DTPA (ácido dietilentriaminopentaacético = ácido pentético) libre contenido en Magnevist, la determinación del hierro en suero por métodos complexométricos (p.ej., batofenantrolina) puede dar lugar a falsos valores bajos.
4.6 Fertilidad, embarazo y lactancia
• Embarazo
No existen datos sobre la utilización de gadopentetato de dimeglumina en mujeres embarazadas. Los estudios realizados en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción (ver sección 5.3). No debe utilizarse Magnevist durante el embarazo a no ser que la situación clínica de la mujer requiera tratamiento con gadopentetato de dimeglumina.
• Lactancia
Se desconoce si el gadopentetato de dimeglumina se excreta en la leche materna. Los datos disponibles en animales han mostrado que el gadopentetato de dimeglumina se excreta en la leche (para detalles ver sección 5.3). No se puede excluir el riesgo en lactantes. Debe interrumpirse la lactancia durante al menos 24 horas tras la administración de Magnevist.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas Resumen del perfil de seguridad
El perfil de seguridad global de Magnevist se basa en datos de seguimiento post-comercialización y en datos de ensayos clínicos de más de 11.000 pacientes.
Las reacciones adversas observadas más frecuentemente (> 0,4%) en pacientes recibiendo Magnevist en ensayos clínicos son:
• Náuseas
• Cefaleas
• Reacciones diversas en el lugar de inyección.
La mayoría de reacciones adversas observadas en los ensayos clínicos fueron de intensidad leve a moderada.
Las reacciones adversas más graves en pacientes recibiendo Magnevist son:
• Fibrosis nefrogénica sistémica
• Reacciones anafilactoides/ shock anafiláctico
En raras ocasiones se han observado reacciones de hipersensibilidad/ anafilactoides retardadas (tras horas o días).
Lista tabulada de reacciones adversas
En la tabla siguiente se enumeran las reacciones adversas según la clasificación MedDRA de órganos del sistema (MedDRA). Para describir una determinada reacción y sus sinónimos y trastornos relacionados se utiliza el término MedDRA más adecuado.
Se ordenan las frecuencias estimadas para reacciones adversas de acuerdo con el siguiente criterio: frecuente (>1/100, < 1/10), poco frecuente (>1/1.000, <1/100); rara (>1/10.000, <1/1.000); muy rara (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1: Reacciones adversas notificadas en ensayos clínicos o durante el seguimiento postcomercialización en pacientes tratados con Magnevist.
|
Clasificación de órganos del sistema (MedDRA) |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos de la sangre y del sistema linfático |
Niveles de hierro en sangre elevados* | ||
|
Trastornos del sistema inmunológico |
Reacción de hipersensibilidad/ana filactoide (p. ej. Shock anafilactoide*, Reacción anafilactoide§*, Reacciones de hipersensibilidad§*, Shock§*, Hipotensión§*, Conjuntivitis, Pérdida de la conciencia§*, Estrechamiento de la garganta*, Estornudos, Urticaria, Prurito, Erupción, Eritema, Disnea*, Parada respiratoria§*, Broncoespasmo§*, Sibilancias, Laringoespasmos§*, Edema laríngeo§*, Edema faríngeo§*, Cianosis§*, Rinitis§, Angioedema§*, Edema facial*, Taquicardia refleia§) | ||
|
Trastornos psiquiátricos |
Desorientación |
Agitación Confusión | |
|
Trastornos del sistema nervioso |
Mareos Cefaleas Disgeusia |
Convulsiones* Parestesia Sensación de ardor Temblores |
Coma* Somnolencia* Trastornos del habla Parosmia |
|
Trastornos oculares |
Trastornos visuales Dolor ocular Lagrimación | ||
|
Trastornos del oído y del laberinto |
Deterioro de la audición Dolor de oído | ||
|
Trastornos del sistema cardiovascular |
Taquicardia* Arritmia |
Parada cardíaca* Disminución del latido del corazón/ bradicardia* | |
|
Trastornos vasculares |
Tromboflebitis Rubores Vasodilatación |
Síncope* Reacción vasovagal Aumento de la presión sanguínea |
MINISTERIODE )E 5AN IDAD, POLITICA LITIGA SOCIAL E IGUALDAD IALDAD Agencia esparto» de cSacse-medicamentos y ¡y Cfoouctos san-tancs [finos
|
Clasificación de órganos del sistema (MedDRA) |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos respiratorios, torácicos y mediastínicos |
Irritación de la garganta Dolor faringolaríngeo / molestias de faringe Tos |
Dificultad respiratoria Aumento /disminución de la velocidad de respiración Edema pulmonar* | |
|
Trastornos gastrointestinales |
Vómitos Náuseas |
Dolor abdominal Molestias estomacales Diarrea Dolor de muelas Sequedad de boca Dolor en los tejidos blandos bucales y parestesia |
Salivación |
|
Trastornos hepatobiliares |
Niveles elevados de bilirrubina en sangre Niveles elevados de enzimas hepáticos en sangre | ||
|
Trastornos de la piel y el tejido subcutáneo |
Fibrosis nefrogénica sistémica (FNS)* | ||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor en las extremidades |
Dolor de espalda Artralgia | |
|
Trastornos renales y urinarios |
Insuficiencia renal grave*,** Niveles elevados de creatinina en sangre** Incontinencia urinaria Urgencia urinaria | ||
|
Trastornos generales y alteraciones del lugar de administración |
Dolor Sensación de calor Sensación de frío Reacciones en el lugar de inyección (por. ej. enfriamiento del lugar de inyección, parestesia, hinchazón, calor, dolor, edema, irritación, hemorragia, eritema, molestias, necrosis§, tromboflebitis§, flebitis§, inflamación§, extravasación§) |
Dolor del tórax Pirexia Edema periférico Malestar general Fatiga Sed Astenia |
Escalofríos Sudoración Temperatura corporal elevada/disminuida |
MINISTERIODE )E 5AN IDAD, POLITICA LITIGA SOCIAL E IGUALDAD IALDAD Agencia esparto» de cSacse-medicamentos y ¡y Cfoouctos san-tancs [finos
|
Clasificación de órganos del sistema (MedDRA) |
Poco frecuentes |
Raras |
Frecuencia no conocida |
* Se han notificado casos mortales o que han puesto en peligro la vida
**En pacientes con insuficiencia renal pre-existente
§ Reacciones identificadas sólo durante el seguimiento post-comercialización (frecuencia no conocida) Descripción de reacciones adversas seleccionadas
En pacientes con insuficiencia renal diálisis-dependientes tratados con Magnevist, se han observado comúnmente reacciones retardadas y transitorias del tipo inflamatorio tales como fiebre, escalofríos y aumento de proteína C-reactiva. En estos pacientes se realizó una Resonancia Magnética un día antes a la hemodiálisis.
Se han notificado casos de fibrosis nefrogénica sistémica (FNS) con Magnevist (ver sección 4.4). Notificación de sospechas de reacciones adversas:
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://notificaram.es.
4.9 Sobredosis
Hasta el momento no se han observado ni se ha informado de signos de intoxicación debidos a una sobredosis accidental durante el empleo en clínica. Sobre la base de los resultados de los estudios de toxicidad aguda, es altamente improbable el riesgo de intoxicación aguda por el empleo de Magnevist. Esta afirmación es también cierta para neonatos y bebés únicamente si la dosis de Magnevist especificada para este grupo de pacientes se inyecta manualmente, sin el empleo de un inyector.
No obstante, la sobredosis accidental de Magnevist, a causa de la hiperosmolalidad de la solución podría dar lugar (particularmente en niños pequeños y en dependencia del peso corporal) a los siguientes efectos:
- Sistémicos: Aumento de la presión arterial pulmonar, hipervolemia, diuresis osmótica,
deshidratación.
- Locales: Dolor vascular.
Teniendo en cuenta el pequeño volumen que se administra y la bajísima tasa de absorción gastrointestinal de Magnevist (< 1%), es extremadamente improbable una intoxicación por ingestión oral inadvertida de este medio de contraste.
En el caso de sobredosis accidental, o en pacientes con función renal gravemente restringida, Magnevist puede ser eliminado mediante hemodiálisis. Sin embargo, no hay evidencia que indique que la hemodiálisis es adecuada para la prevención de la fibrosis nefrogénica sistémica (FNS).
En caso de sobredosis accidental en pacientes con insuficiencia renal debe monitorizarse la función renal.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: medios de contrastes paramagnéticos. Código ATC: V08CA01.
Magnevist es un medio de contraste paramagnético para empleo en resonancia magnética. El efecto intensificador de contraste es producido por la sal di-N-metilglucamínica del ácido gadopentético (Gd-DTPA; gadopentetato), complejo de gadolinio del ácido pentético (dietilentriaminopentaacético = DTPA). Utilizando una secuencia adecuada (p.ej., técnica espín-eco potenciadaen T1) en la resonancia magnética de protones, el acortamiento del tiempo de relajación espín-red de los núcleos atómicos excitados, inducido por el gadolinio, da lugar a un aumento de la intensidad de señal y, por tanto, a un incremento del contraste de la imagen de ciertos tejidos.
El gadopentetato es un compuesto fuertemente paramagnético que reduce notablemente el tiempo de relajación, incluso a bajas concentraciones. La efectividad paramagnética, conocida como relaxividad, determinada por la influencia sobre el tiempo de relajación espín-red de los protones en agua, es de aproximadamente 3,8 l/mmol/seg, a pH 7 y a temperatura de 39°C, y depende sólo débilmente de la intensidad del campo magnético.
El ion paramagnético gadolinio forma con DTPA un complejo extraordinariamente estable tanto in vivo como in vitro (log k = 22-23). El gadopentetato de dimeglumina es un compuesto extremadamente hidrofílico, muy soluble en agua, cuyo coeficiente de reparto entre n-butanol y tampón a pH = 7,6 es de aprox. 0,0001. La sustancia no se une a proteínas en cantidad apreciable ni muestra interacción inhibitoria con enzimas tales como las ATP-asas de Na+ y K+ del miocardio. Magnevist tampoco activa el sistema de complemento y, por tanto, tiene muy escaso riesgo de provocar una reacción anafilactoide. No se ha observado deterioro de la función renal.
In vitro, la morfología eritrocitaria sólo se afectó, en grado ligero, tras incubación durante tiempo prolongado a altas concentraciones de gadopentetato. Tras la administración i.v. de Magnevist en humanos, el proceso reversible puede causar una leve hemólisis intravascular, lo que explicaría el ligero incremento de bilirrubina y hierro séricos que se ha observado, ocasionalmente, en las primeras horas postadministración.
Los resultados de los ensayos clínicos no suministraron indicio alguno de deterioro del estado general ni de las funciones hepática, renal o cardiovascular.
5.2 Propiedades farmacocinéticas
El gadopentetato se comporta en el organismo como otros compuestos altamente hidrófilos, biológicamente inertes (p.ej., manitol o inulina).
Absorción y distribución
Después de la administración i.v., el compuesto difunde rápidamente en el espacio extracelular y se elimina inalterado en la orina, por filtración glomerular. La porción eliminada extrarrenalmente es extremadamente pequeña. Siete días después de la administración i.v. de gadopentetato marcado radioactivamente, se hallaron en el cuerpo de la rata y del perro cantidades muy inferiores al 1% de la dosis administrada. Las concentraciones relativamente más altas se encontraron en los riñones, en forma de Gd-DTPA inalterado. El compuesto no atraviesa la barrera hematoencefálica intacta ni la hemato-seminal. La escasa cantidad que atraviesa la barrera placentaria es rápidamente eliminada por el feto.
Los parámetros farmacocinéticos observados en el hombre fueron independientes de la dosis. Hasta 0,25 mmol de gadopentetato/kg de peso corporal (= 0,5 ml Magnevist/kg.p.c.), los niveles plasmáticos, después de una primera fase de distribución de pocos minutos de duración, declinaron con una vida media de aproximadamente 90 minutos, idéntica a la velocidad de eliminación renal. Con una dosis de 0,1 mmol de gadopentetato/kg de peso corporal (= 0,2 ml Magnevist/kg.p.c.) se hallaron 0,6 mmol de gadopentetato/ l de plasma a los 3 min post-inyección y 0,24 mmol de gadopentetato/l de plasma a los 60 min p.i. Una media del 83% de la dosis se elimina por vía renal a las 6 horas, y aproximadamente el 91% de la dosis se recupera en orina dentro de las primeras 24 horas. Al 5° día después de la inyección, la porción de dosis eliminada por heces fue menor del 1%. No se detectó ruptura ni degradación metabólica del complejo. El aclaramiento renal del gadopentetato, referido a 1,73 m2 fue de aproximadamente 120 ml/min y es, por tanto, comparable al de inulina o 51Cr-EDTA.
Eliminación
El gadopentetato se elimina casi completamente por vía renal, aún en presencia de función renal alterada (aclaramiento de creatinina> 20 ml/min); la vida media en plasma aumenta en relación con el grado de insuficiencia renal, pero no se observa incremento de la eliminación extrarrenal.
Puesto que la vida media plasmática en el suero se prolonga (hasta 30 horas) en presencia de función renal severamente restringida (aclaramiento de creatinina< 20 ml/min), el gadopentetato debería eliminarse mediante hemodiálisis extracorpórea.
Se ha observado un incremento de la semivida de eliminación en neonatos debido a la inmadurez de la función renal.
Población pediátrica
En un estudio con pacientes pediátricos de 2 meses a menos de 2 años de edad, la farmacocinética (aclaramiento normalizado por peso corporal, volumen de distribución, área bajo la curva concentración-tiempo y semivida terminal) del gadopentetato fue similar a los adultos.
5.3 Datos preclínicos sobre seguridad
De acuerdo con los resultados de toxicidad por dosis única, el riesgo de intoxicación aguda con el empleo de Magnevist es extremadamente improbable.
Los estudios de tolerancia sistémica tras administración intravenosa repetida diaria, no revelan ningún hallazgo que desaconseje la administración diagnóstica única de Magnevist en el ser humano.
Los estudios de embriotoxicidad no indicaron potencial teratogénico o embriotóxico alguno tras la administración de Magnevist durante la gestación.
Los estudios de tolerancia local después de la administración intravenosa única y repetida, así como tras la administración intraarterial única, no indicaron que se puedan producir efectos adversos locales en los vasos sanguíneos.
Los estudios de tolerancia local tras administración única paravenosa, subcutánea, así como aplicación intramuscular, indicaron que se podrían manifestar ligeras reacciones de intolerancia local en el lugar de la administración, después de la inyección accidental paravenosa.
En los estudios sobre genotoxicidad no se halló ningún efecto mutagénico, ni in vitro ni in vivo. Estos resultados y la ausencia de indicios de efectos tóxicos sobre los tejidos de crecimiento rápido en los estudios de administración repetida, así como la farmacocinética del producto y su frecuencia de administración diagnóstica, normalmente única, llevan a considerar como muy improbable el riesgo de efecto tumorígeno en humanos.
Los estudios de sensibilización por contacto en animales de experimentación no indicaron la existencia de potencial sensibilizante alguno con Magnevist.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Meglumina.
Ácido dietilentriaminopentaacético (DTPA).
Agua para preparaciones inyectables.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
Magnevist 0,5 mmol/ml solución inyectable: 5 años.
Magnevist 0,5 mmol/ml solución inyectable en jeringa precargada: 3 años.
• Conservación una vez abierto el envase:
Después de abrir el vial/frasco o preparar la jeringa precargada, Magnevist permanece estable durante el día de la exploración Este tiempo de validez no se refiere a estabilidad físico-química, sino a la posibilidad de contaminación microbiana.
6.4 Precauciones especiales de conservación
Magnevist debe conservarse en lugar fresco y seco, y protegido de la luz.
Conservar el envase en el embalaje exterior para protegerlo de la luz.
]£
6.5 Naturaleza y contenido del envase
Magnevist se presenta en envases para un solo uso:
- viales de 5 ml, 10 ml, 15 ml y 30 ml.
- jeringas precargadas de 10 ml, 15ml y 20 ml.
- frascos de 100 ml para empleo con inyector.
Puede que solamente estén comercializados algunos tamaños de envase.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Durante la manipulación no es necesario protegerlo de la luz. Para información adicional ver sección 6.4
Precauciones especiales de conservación.
Inspección visual
Este medicamento debe ser inspeccionado visualmente antes de ser administrado.
Magnevist no debe utilizarse en caso de decoloración grave, que hayan partículas en suspensión o el envase esté defectuoso.
• Presentación en vial
No debe extraerse Magnevist con la jeringa hasta inmediatamente antes de la administración.
En ningún caso debe perforarse más de una vez el tapón de goma.
Cualquier resto del medio de contraste no empleado en una exploración debe desecharse.
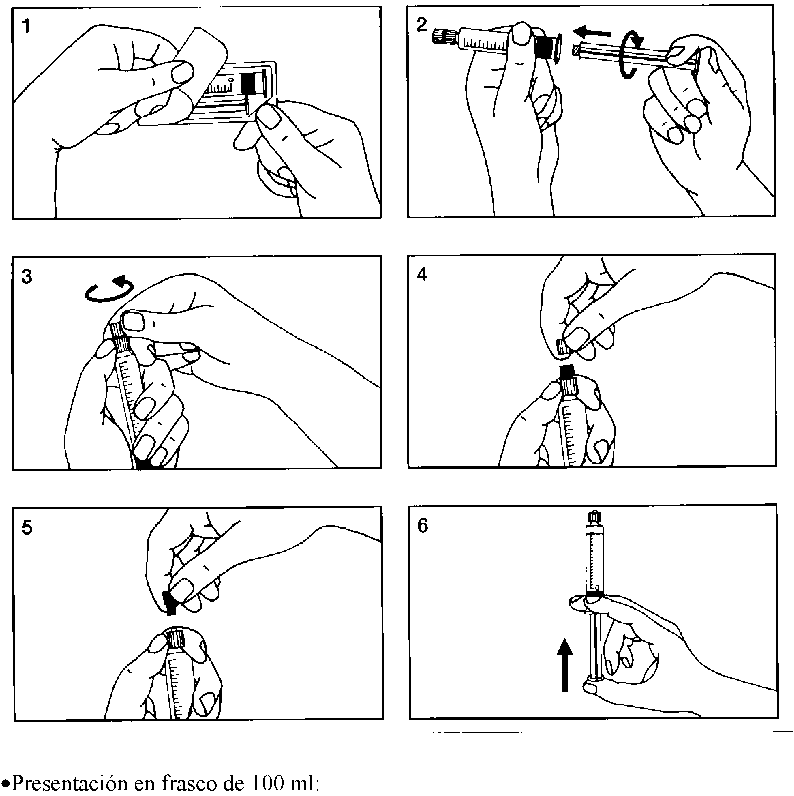
• Presentación en jeringa precargada
La jeringa precargada se deberá extraer del envase y preparar para la inyección inmediatamente antes de la administración. Inmediatamente antes del uso, se debe separar la tapa del extremo (capuchón) de la jeringa precargada.
Cualquier resto del medio de contraste no empleado en una exploración debe desecharse.
Para el montaje de la jeringa precargada, pueden verse las Figuras 1 a 6 que se presentan a continuación:
La administración del medio de contraste deberá realizarse mediante inyector, cuyo uso está contraindicado en neonatos y bebés (ver sección 4.9). Los elementos del inyector en contacto con el paciente deberán ser sustituidos después de cada exploración, al estar contaminados con sangre. Los restos de solución del medio de contraste que permanezcan en el frasco, así como los tubos de conexión y los elementos fungibles del sistema de inyección, se desecharán al final del día de la exploración. Es imprescindible seguir las instrucciones adicionales facilitadas por los fabricantes del inyector.
La etiqueta separable de los viales/jeringas/frascos debe pegarse en la historia del paciente a fin de permitir un registro preciso del medio de contraste de gadolinio utilizado. También debería registrarse la dosis utilizada.En el caso que se utilicen registros electrónicos de pacientes, deben introducirse en los mismos el nombre del producto, el número de lote y la dosis administrada.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Bayer Hispania, S.L.
Av. Baix Llobregat, 3-5
08970 Sant Joan Despí (Barcelona)
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Magnevist 0,5 mmol/ml solución inyectable: 59.379.
Magnevist 0,5 mmol/ml solución inyectable en jeringa precargada: 61.986.
ÜE
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Magnevist 0,5 mmol/ml solución inyectable: 02/03/93.
Magnevist 0,5 mmol/ml solución inyectable en jeringa precargada: 13/10/98.
10. FECHA DE LA REVISIÓN DEL TEXTO
06/2015
MI MISTERIO DE )E
SANIDAD.POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD
Agencia esparto» de cSacse-
medicamentos y ¡y
Cfoouctos san-íanos [finos
15 de 15