Lutrate Depot 3.75 Mg Polvo Y Disolvente Para Suspension Inyectable
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Lutrate Depot 3,75 mg polvo y disolvente para suspensión de liberación prolongada inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 3,75 mg de acetato de leuprorelina (equivalente a 3,57 mg de base libre de leuprorelina). 1 ml de suspensión reconstituida contiene 1,875 mg de acetato de leuprorelina.
Excipientes con efecto conocido
Cada vial contiene de 1,3 a 2,2 mg (< 1 mmol) de sodio (como carmelosa de sodio).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para suspensión de liberación prolongada inyectable.
Polvo: polvo blanco o casi blanco.
Disolvente: solución transparente e incolora (pH 5,0-7,0).
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Lutrate Depot está indicado para el tratamiento paliativo del cáncer de próstata localmente avanzado o metastásico.
4.2 Posología y forma de administración
4.2.1 Posología
La dosis habitual recomendada de Lutrate Depot es de 3,75 mg en forma de una inyección depot mensual y administrada como una única inyección intramuscular cada mes.
Lutrate Depot debe administrarse bajo la supervisión de un médico o un profesional sanitario cualificado.
La dosis de Lutrate Depot que permite la liberación continua de acetato de leuprorelina durante un mes está incorporada a una formulación de liberación prolongada. El polvo liofilizado debe reconstituirse y administrarse en forma de inyección intramuscular a intervalos mensuales. No debe administrarse por vía intravenosa o intraarterial. El vial de polvo de microesferas de Lutrate Depot debe reconstituirse inmediatamente antes de su administración mediante inyección intramuscular. Como otros medicamentos que se administran de forma regular mediante inyección, el lugar de la inyección debe variar periódicamente.
El tratamiento con Lutrate Depot no debe interrumpirse cuando se experimente mejora o remisión.
La respuesta al tratamiento con Lutrate Depot debe supervisarse analizando periódicamente los niveles séricos de testosterona y del antígeno prostático específico (PSA). Los estudios clínicos han demostrado que los niveles de testosterona aumentaron durante los primeros 4 días de tratamiento en la mayoría de pacientes no orquiectomizados.A continuación descendieron y alcanzaron niveles de castración en 3-4
.<ítp.
semanas.Una vez alcanzados, los niveles de castración (definido como un nivel de testosterona inferior a 0,5 mg/ml) se mantuvieron durante todo el tratamiento con el fármaco.
Si la respuesta de un paciente no es óptima, es aconsejable confirmar que los niveles séricos de testosterona han alcanzado o se mantienen a niveles de castración. En ocasiones pueden producirse elevaciones pasajeras del nivel de fosfatasa ácida al inicio del periodo de tratamiento, si bien generalmente este nivel retorna a valores normales o casi normales en la cuarta semana de tratamiento.
Duración del tratamiento
Lutrate Depot se administra en forma de inyecciones intramusculares mensuales.
Poblaciones especiales Población pediátrica
No se ha establecido la seguridad y eficacia de Lutrate Depot en pacientes pediátricos. Por tanto, el uso de Lutrate Depot no está recomendado en niños o adolescentes hasta que se disponga de datos de eficacia y seguridad.
Insuficiencia hepática/renal
No se ha determinado la farmacocinética de Lutrate Depot en pacientes con insuficiencia hepática o renal.
Ancianos
En el ensayo clínico de Lutrate Depot, la media de edad de los pacientes estudiados fue de 71,6 ± 9,2 años. Por tanto, la ficha técnica refleja la farmacocinética, eficacia y seguridad de Lutrate Depot en esta población.
4.2.2 Forma de administración
Lutrate Depot debe administrase únicamente por vía intramuscular. No administrar el producto por ninguna otra vía. Si por error se administrara el producto por vía subcutánea, el paciente debería ser estrechamente monitorizado puesto que no hay datos disponibles sobre la administración de Lutrate Depot por otras vías aparte de la vía intramuscular. Las instrucciones para la reconstitución del medicamento antes de su administración se describen en la sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, los análogos de la hormona liberadora de gonadotropina (LHRH) o a alguno de los excipientes incluidos en la sección 6.1. Se han descrito reacciones anafilácticas a la LHRH sintética (Factrel) o a análogos agonistas de la LHRH en la literatura médica.
Orquiectomía previa.
Lutrate Depot no debe utilizarse como tratamiento único en pacientes con cáncer de próstata e indicios de compresión de la médula espinal o metástasis medular.
Lutrate Depot no está indicado para uso en mujeres.
Lutrate Depot no está indicado para uso en pacientes pediátricos.
4.4 Advertencias y precauciones especiales de empleo
Al inicio del tratamiento con Lutrate Depot, como sucede durante el tratamiento con otros agonistas de la LHRH, puede producirse un aumento pasajero de los niveles de testosterona.En algunos casos, este aumento puede estar asociado a un empeoramiento o exacerbación del crecimiento del tumor, que provoca un agravamiento temporal de los síntomas del cáncer de próstata.Estos síntomas generalmente disminuyen al continuar el tratamiento. En algunos casos la exacerbación puede manifestarse en forma de síntomas sistémicos o neurológicos (por ejemplo, dolor óseo). También se han descrito casos de atrofia testicular y ginecomastia asociados al tratamiento con otros agonistas de la LHRH.
El tratamiento deberá ser suspendido inmediatamente si el paciente desarrolla cualquier signo o síntoma de anafilaxis/reacción anafiláctica (disnea, asma, rinitis, edema angioneurótico o glotis, hipotensión, urticaria, erupción, prurito o neumonitis intersticial). Los pacientes deben ser informados antes de empezar el tratamiento, advirtiéndoles de interrumpir el tratamiento y consultar con su médico si alguno de los síntomas mencionados aparece. Los pacientes que hayan experimentado alguna reacción de hipersensibilidad a leuprolide deberán ser estrechamente monitorizados y no se les debe volver a administrar Lutrate Depot.
En pacientes tratados con acetato de leuprorelina, se han observado casos aislados de obstrucción ureteral (con o sin hematuria) y compresión medular o lesiones vertebrales metastásicas, que pueden contribuir a la aparición de parálisis con o sin complicaciones mortales.Los pacientes con riesgo de obstrucción ureteral, compresión de la médula espinal o lesiones vertebrales metastásicas deberán ser tratados cuidadosamente y se supervisarán de forma estrecha durante las primeras semanas de tratamiento.Para estos pacientes se deberá considerar la posibilidad de administrar tratamiento profiláctico con antiandrógenos.
Si se producen complicaciones urológicas/neurológicas, éstas deberán tratarse con medidas específicas apropiadas.
Existe riesgo alto de incidencia de depresión (que puede ser severa) en pacientes que reciben tratamiento con agonistas de la GnRH como el acetato de leuprorelina. Los pacientes deben ser informados al respecto y ser tratados adecuadamente si los síntomas aparecen.
En la literatura médica se ha descrito reducción de la densidad ósea en varones que se habían sometido a orquiectomía o que habían recibido tratamiento con un agonista de la LHRH.La adición de tratamiento antiandrogénico a la pauta de tratamiento reduce la pérdida ósea, pero aumenta el riesgo de reacciones adversas tales como problemas de coagulación y edema.Si se emplea un antiandrógeno durante un periodo prolongado, deberá prestarse la atención debida a las contraindicaciones y precauciones asociadas a su uso prolongado.Los pacientes con riesgo de padecer osteoporosis o con antecedentes clínicos de este trastorno deberán ser tratados cuidadosamente, y serán estrechamente supervisados durante el tratamiento con acetato de leuprorelina.
Se ha descrito disfunción hepática e ictericia con elevación de las enzimas hepáticas con el uso de acetato de leuprorelina.Por tanto, se realizará una observación minuciosa y se adoptarán las medidas adecuadas que sean necesarias.
La respuesta al tratamiento con Lutrate Depot deberá controlarse mediante parámetros clínicos y analizando periódicamente los niveles séricos de testosterona y PSA.
Los pacientes pueden experimentar cambios metabólicos (por ejemplo, intolerancia a la glucosa o empeoramiento de la diabetes existente), hipertensión, alteraciones de peso y trastornos cardiovasculares. Tal como cabe esperar para este tipo de medicamento, puede aparecer diabetes o empeoramiento de la diabetes existente. Por tanto, los pacientes diabéticos pueden necesitar de una monitorización más frecuente de los niveles sanguíneos de glucosa durante el tratamiento con Lutrate Depot. Los pacientes con riesgo elevado de enfermedad metabólica o cardiovascular deberán ser evaluados cuidadosamente antes de iniciar el tratamiento, y se les someterá a un control adecuado durante el tratamiento de privación de andrógenos.El tratamiento con acetato de leuprorelina causa la supresión del sistema hipófiso-gonadal.Los resultados de las pruebas diagnósticas de las funciones gonadal e hipofisaria gonadotrópica realizadas durante y después del tratamiento con acetato de leuprorelina pueden verse afectados.
Se ha descrito aumento del tiempo de protrombina en pacientes en tratamiento con acetato de leuprorelina.
Se han descrito convulsiones con la administración de acetato de leuprorelina.Estos casos se han observado en pacientes con antecedentes de convulsiones, epilepsia, trastornos cerebrovasculares, anomalías o tumores del sistema nervioso central, y en pacientes en tratamiento con medicamentos concomitantes que se han asociado a convulsiones, tales como bupropión o inhibidores selectivos de la recaptación de serotonina (ISRS).También se han descrito convulsiones en ausencia de los trastornos mencionados arriba.
El acetato de leuprorelina debe utilizarse con precaución en presencia de enfermedad cardiovascular (incluida insuficiencia cardiaca congestiva), tromboembolia, edema, depresión y apoplejía hipofisaria.
El acetato de leuprorelina debe utilizarse con precaución en pacientes con trastornos conocidos de la coagulación, trombocitopenia o en tratamiento con anticoagulantes. Los deportistas procederán con precaución dado que Lutrate Depot contiene un componente que podría dar un resultado positivo en los controles de dopaje.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por vial.Básicamente está libre de sodio.
El tratamiento de deprivación androgénica puede prolongar el intervalo QT.
En pacientes con antecedentes o con factores de riesgo de prolongación del intervalo QT y enpacientes que reciben medicamentos concomitantes que podrían prolongar el intervalo QT (versección 4.5), los profesionales sanitarios deben evaluar el balance beneficio/riesgo incluyendo elriesgo potencial de Torsade des Pointes antes de iniciar el tratamiento con Lutrate Depot.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción farmacológica basados en la farmacocinética con acetato de leuprorelina.No obstante, dado que se trata de un péptido que es degradado principalmente por peptidasas y no por enzimas del citocromo P-450 como han demostrado estudios específicos, y dado que el fármaco solo se une a proteínas plasmáticas en un 46%, no cabe esperar interacciones farmacocinéticas.
Se debe valorar cuidadosamente el uso concomitante de Lutrate Depot con medicamentosque prolongan el intervalo QT o medicamentos capaces de inducir Torsade des Pointes, tales comoantiarrítmicos clase lA (por ej emplo: quinidina, disopiramida) o clase m (por ejemplo:amiodarona, sotalol, dofetilida, ibutilida), metadona, moxifloxacino, antipsicóticos, etc (versección 4.4) ya que el tratamiento de deprivación androgénica también puede prolongar elintervalo QT.
4.6 Fertilidad, embarazo y lactancia
Lutrate Depot no está indicado para uso en mujeres.
La inyección de acetato de leuprorelina puede causar daños fetales cuando se administra a mujeres embarazadas.
Por tanto, existe la posibilidad de aborto espontáneo si el fármaco se administra durante el embarazo.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La capacidad para conducir y utilizar máquinas puede verse alterada a causa de alteraciones visuales y mareos.
4.8 Reacciones adversas
A menos que se especifique lo contrario, el siguiente perfil de seguridad de Lutrate Depot se basa en los resultados de un ensayo de fase III en el que pacientes con cáncer de próstata recibieron tratamiento con seis dosis intramusculares mensuales de Lutrate Depot y fueron sometidos a seguimiento durante un total de 26 semanas.La mayoría de los AA relacionados con el tratamiento descritos fueron los acontecimientos habituales asociados al tratamiento de supresión de testosterona.
Las reacciones adversas notificadas con mayor frecuencia con Lutrate Depot son sofocos, dolor en la zona de inyección, irritación en la zona de inyección, sudores nocturnos y cefalea.
A continuación se enumeran las reacciones adversas observadas en investigaciones clínicas según la clasificación por órganos y sistemas, y en orden de incidencia decreciente (muy frecuentes:=1/10; frecuentes:=1/100 a <1/10; poco frecuentes:= 1/1000 a < 1/100; raras:=1/10.000 a <1/1000; muy raras:< 1/10.000).
Trastornos del metabolismo y de la nutrición
Frecuentes:Apetito aumentado
Poco frecuentes:Anorexia, hipercolesterolemia, hiperlipidemia Trastornos psiquiátricos
Poco frecuentes:Trastornos del sueño, insomnio, disminución de la libido, alteración del humor y depresión*
Trastornos del sistema nervioso Frecuentes:Cefalea Poco frecuentes:Somnolencia Trastornos del oído y del laberinto
Poco frecuentes:Vértigo
Trastornos vasculares
Muy frecuentes:Acaloramientos Trastornos gastrointestinales
Poco frecuentes:Dolor en la zona inferior del abdomen, diarrea, náuseas,
vómitos
Trastornos hepatobiliares
Poco frecuentes: Hiperbilirrubinemia Trastornos de la piel y del tejido subcutáneo
Frecuentes:Hiperhidrosis, sudores nocturnos, sudor frío Poco frecuentes:Edema periorbital, urticaria, prurito Trastornos musculoesqueléticos y del tejido conjuntivo Frecuentes:Dolor de espalda
Poco frecuentes:Artralgia, espasmos musculares, dolor en extremidad Trastornos renales y urinarios
Poco frecuentes:Retención urinaria, incontinencia urinaria, polaquiuria Trastornos del aparato reproductor y de la mama
Frecuentes:Disfunción eréctil
Poco frecuentes: Hinchazón de la mama, dolor mamario a la palpación, insuficiencia eyaculatoria
Trastornos cardíacos
Frecuencia no conocida: prolongación del intervalo QT (ver secciones 4.4 y 4.5).
Trastornos generales y alteraciones en el lugar de administración
Frecuentes:Fatiga, astenia, pirexia, reacciones adversas locales (ver tabla 2) Poco frecuentes:Debilidad, sensación de calor y de frío, sensación de inquietud Exploraciones complementarias
MINISTER10DE )E
SAN IDAD, POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD
Agencia esparto» de cSacse-
medicamentos y ¡y
Sfoouctos san-tanos taws
Poco frecuentes: Elevación de la AST, elevación de la ALT, aumento
de la bilirrubina, aumento de la gamma-glutamiltransferasa
*en un estudio de post-marketing los cambios en el estado de ánimo y la depresión en pacientes en tratamiento crónico fue frecuente.
En términos de intensidad, el 98% de todos los AA relacionados con el tratamiento fueron leves o moderados.El noventa y ocho por ciento (98%) de los sofocos se describieron como leves y el nueve por ciento (9%) como moderados.Dos casos de sofocos (0,2%) se notificaron como intensos.
Se describieron un total de 35 reacciones adversas locales (RAL) en la zona de inyección por 29 pacientes (18,1%) durante el estudio.
Las reacciones adversas locales tras la administración de Lutrate 3,75 mg son las descritas generalmente con otros productos similares administrados mediante inyección intramuscular.Las reacciones notificadas con mayor frecuencia son dolor en la zona de inyección, irritación en la zona de inyección, molestia en la zona de inyección, y eritema y cardenales en la zona de inyección.Las reacciones poco frecuentes fueron reacción en la zona de inyección, hinchazón, herida y hemorragia (Tabla 2).
Tabla 2. Frecuencia de pacientes con reacciones adversas locales durante el tratamiento con Lutrate Depot.
|
SOC principal* |
Pacientes con RAL relacionadas |
|
Término preferente:Trastornos generales y alteraciones en el lugar de administración |
% |
|
Frecuentes | |
|
Dolor en la zona de inyección |
8,1 |
|
Irritación en la zona de inyección |
4,4 |
|
Molestia en la zona de inyección |
1,9 |
|
Eritema en la zona de inyección |
1,3 |
|
Cardenales en la zona de inyección |
1,3 |
|
Poco frecuentes |
0,6 0,6 |
|
Reacción en la zona de inyección Hinchazón en la zona de inyección | |
|
Lesión en el lugar de inyección |
0,6 |
|
Hemorragia en la zona de inyección |
0,6 |
*Los pacientes pueden ser incluidos en más de una categoría, RAL:reacción adversa local; SOC:clasificación por órganos y sistemas.
Tras la administración repetida de Lutrate Depot, se describió hinchazón (0,6%), dolor (0,6%), hematoma (0,6%) e irritación (0,6%) como reacciones locales adversas recurrentes.Estos acontecimientos fueron todos descritos como no graves y leves.Ningún paciente abandonó el tratamiento a causa de acontecimientos adversos locales.
En un ensayo clínico de fase I (CRO-02-43) realizado con sujetos sanos tratados con una sola dosis de Leuprolide Depot GP-Pharm 7,5 mg se describió un caso de induración en la zona de inyección.
Otros acontecimientos adversos descritos con el tratamiento con acetato de leuprorelina incluyen impotencia, pérdida de la libido (ambas consecuencias farmacológicas de la privación de testosterona), edema periférico, embolia pulmonar, palpitaciones, mialgia, debilidad muscular, disnea, vértigo periférico, exantema, amnesia, alteraciones visuales y alteración de la sensación de la piel.En casos aislados se ha descrito infarto de adenomas hipofisarios preexistentes tras la administración de agonistas de la LHRH de acción corta o prolongada. Se han descrito informes raros de trombocitopenia y leucopenia.Se han notificado alteraciones de la tolerancia a la glucosa.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es.
4.9 Sobredosis
No se dispone de experiencia clínica sobre los efectos de una sobredosis aguda de Lutrate Depot o acetato de leuprorelina. En ensayos clínicos que utilizaban acetato de leuprorelina administrado a diario por vía subcutánea a pacientes con cáncer de próstata, dosis de hasta 20 mg/día durante un periodo de hasta dos años no causaron AA distintos de los observados con la dosis de 1 mg/día.
En estudios con animales, dosis de hasta 500 veces la dosis recomendada en humanos causaron disnea, reducción de la actividad e irritación local en la zona de inyección. En caso de sobredosis, se supervisará estrechamente al paciente y el tratamiento será sintomático y de soporte.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Terapia endocrina.Hormonas y sustancias relacionadas.Análogos de la hormona liberadora de gonadotropina; código ATC: L02AE02.
El nombre químico del acetato de leuprorelina es 5-oxo-L-prolil-L-histidil-L-triptofil-L-seril-L-tyrosil-D-leucil-L-leucil-L-arginil-L-prolil-etilamida.
El acetato de leuprorelina es inactivo cuando se administra por vía oral a causa de una baja permeabilidad de la membrana y una casi completa inactivación por enzimas proteolíticos intestinales.
El acetato de leuprorelina tiene un potente efecto agonista de la LHRH cuando se administra durante el tratamiento a corto plazo e intermitente; no obstante, cuando se administra de forma continua y no pulsátil, los análogos de la LHRH inducen inhibición de la secreción de gonadotropinas y supresión de la esteroidogénesis testicular.
Con la unión a los receptores de LHRH hipofisarios, el acetato de leuprorelina provoca un aumento inicial de los niveles circulantes de hormona luteinizante (LH) y hormona foliculoestimulante (FSH), causando un aumento agudo de los niveles de testosterona y dihidrotestosterona. Sin embargo, en un plazo de cinco a ocho días tras su administración, los análogos de la LHRH producen la desensibilización del complejo del receptor de LHRH y/o la regulación negativa de la hipófisis anterior. A causa del menor número de receptores en la superficie celular, la estimulación celular se reduce y se sintetiza y segrega una menor
cantidad de gonadotropinas. Finalmente, tras varias semanas de tratamiento con el agonista de la LHRH, la secreción de LH y FSH se suprime por completo. Como consecuencia de ello, las células de Leydig de los testículos dejan de producir testosterona, y la concentración sérica de testosterona disminuye hasta niveles de castración (menos de 0,5 ng/ml) en un plazo de dos a cuatro semanas desde el inicio del tratamiento.
En un estudio clínico abierto, multicéntrico y de dosis múltiples de Lutrate Depot, se reclutó a 160 pacientes con cáncer de próstata que no habían recibido tratamiento sistémico previo ni hormonoterapia para el tratamiento del cáncer, ni se habían sometido a orquiectomía o cirugía prostética. El objetivo fue determinar la eficacia y seguridad de Lutrate Depot cuando se administra a pacientes con cáncer de próstata que podrían beneficiarse de la terapia de privación de andrógenos.Lutrate Depot se administró por vía intramuscular en 6 dosis a intervalos mensuales.
Los niveles de testosterona se analizaron en diferentes días durante 168 días. Como cabía esperar, tras la primera inyección los niveles medios de testosterona aumentaron rápidamente respecto al nivel basal (4,119 ± 1,341 ng/ml), alcanzando un nivel máximo (Cmáx) de 6,598 ± 2,249 ng/ml en el tercer día. Tras alcanzar el nivel máximo, los niveles de testosterona disminuyeron y en el día 21 el 78,7% de pacientes evaluables había alcanzado la castración clínica (definida como una concentración de testosterona inferior a 0,5 ng/ml). En el día 28, el 96,8% había alcanzado niveles de castración, y el 73,1% había alcanzado niveles = 0,2 ng/ml (Figura 1).
Figura 1. Media (± DE) de la concentración plasmática de testosterona durante el tratamiento con inyecciones i.m. mensuales de Lutrate Depot 3,75 mg durante 6 meses
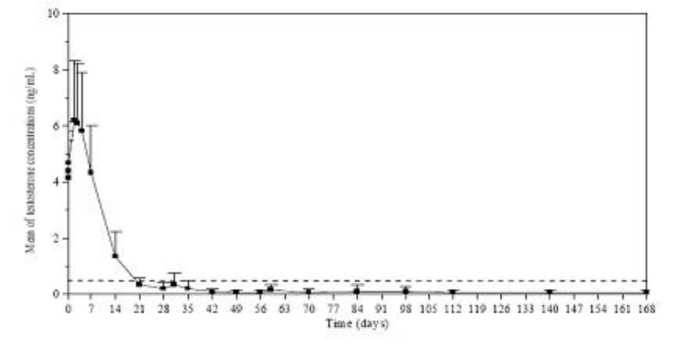
Los criterios secundarios de valoración de la eficacia incluyeron la determinación de las concentraciones séricas de LH, FSH y PSA. En el día 14 y el día 4 tras la primera inyección de Lutrate Depot, las concentraciones séricas medias de LH y FSH habían descendido por debajo de las concentraciones basales. Las concentraciones permanecieron por debajo de los niveles basales desde el día 28 hasta el fin del estudio. Durante el tratamiento, las concentraciones séricas medias de PSA se redujeron gradualmente (primer mes) y luego permanecieron por debajo del nivel basal de forma constante hasta el fin del estudio. No obstante, se observó una amplia variación interindividual en las concentraciones de PSA durante todo el estudio.
La frecuencia de la respuesta aguda sobre la crónica fue de un 10,5% y la frecuencia de escapes de testosterona fue de 11,8%. No se comunicaron efectos adversos relacionados con el tratamiento que fuesen clínicamente indicativos de un pico en los niveles de testosterona (retención urinaria, compresión de la médula espinal, o exacerbación del dolor óseo) en ninguno de los pacientes en los que se registró un escape en los niveles de testosterona.
5.2 Propiedades farmacocinéticas
5.2.1 Absorción
Tras la administración de inyecciones mensuales de Lutrate Depot durante tres meses en una muestra de pacientes con cáncer de próstata (N = 12), la concentración plasmática máxima de acetato de leuprorelina fue similar en los tres ciclos. Después de la primera administración (días 0-28), la Cmáxfue de 13.145,6 ± 3070,6 pg/ml. La mediana de tiempo hasta alcanzar la Cmáx (Tmáx) fue de 0,04 días, correspondiente a 0,96 h (intervalo 0,96-4,08 h).
5.2.2 Distribución
No se han realizado estudios de distribución con Lutrate Depot. No obstante, en voluntarios varones sanos, el volumen de distribución medio en estado estacionario de acetato de leuprorelina tras la administración de una dosis en bolo intravenosa (i.v.) fue de 27 l. La unión a proteínas plasmáticas in vitro osciló entre el 43% y el 49%.
5.2.3 Metabolismo o Biotransformación
No se han realizado estudios de metabolismo con Lutrate Depot. No obstante, en voluntarios varones sanos, un bolo de 1,0 mg de acetato de leuprorelina administrado por vía intravenosa puso de manifiesto que el aclaramiento sistémico medio era de 7,6 l/h, con una semivida de eliminación terminal de aproximadamente 3 horas según un modelo bicompartimental.
Se espera que la Leuprorelina se metabolice en pequeños péptidos inactivos que pueden ser eliminados o catabolizados.
5.2.4 Eliminación
No se han realizado estudios de eliminación del fármaco con Lutrate Depot. No obstante, tras la administración de acetato de leuprorelina a 3 pacientes, menos del 5% de la dosis se recuperó en forma de compuesto original y metabolito M-I en la orina.
Poblaciones especiales
Insuficiencia hepática/renal
No se ha determinado la farmacocinética del medicamento en pacientes con insuficiencia hepática o renal. 5.3 Datos preclínicos sobre seguridad
Los datos de los estudios preclínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas y genotoxicidad realizados con acetato leuprorelina.
Como cabe esperar por sus propiedades farmacológicas conocidas, los estudios preclínicos demostraron efectos sobre el sistema reproductor, que fueron reversibles. En los estudios de toxicidad para la reproducción, el acetato de leuprorelina no mostró teratogenicidad. No obstante, se observó embriotoxicidad/letalidad en conejos.
Los estudios de carcinogenicidad realizados en ratas con administración subcutánea de acetato de leuprorelina (0,6-4 mg/kg/día) demostraron un aumento relacionado con la dosis de los adenomas hipofisarios. Además se observó un aumento significativo pero no relacionada con la dosis de células de los
islotes pancreáticos-adenomas en hembras y de adenomas celulares intersticiales testiculares en machos. La mayor incidencia se observó en el grupo de dosis baja. La administración de acetato de leuprorelina provocó la inhibición del crecimiento de ciertos tumores dependientes de hormonas (tumores prostáticos en ratas macho Noble y Dunning y tumores mamarios inducidos por DMBA en ratas hembra). No se observaron tales efectos en los estudios de carcinogenicidad realizados en ratones. No se han realizado estudios de carcinogenicidad con Lutrate Depot.
Los estudios con acetato de leuprorelina demostraron que el producto no era mutagénico en una serie de ensayos in vitro e in vivo. No se han realizado estudios de mutagenicidad con Lutrate Depot.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Excipientes del liofilizado (vial):
Polisorbato 80 Manitol (E-421)
Carmelosa sódica (E-466)
Trietil citrato
Poli(DL-láctido-co-glicólido) (PLGA)
Excipientes del disolvente (jeringa precargada):
Manitol (E-421)
Hidróxido de sodio (para ajuste de pH)
Acido clorhídrico (para ajuste de pH)
Agua para inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
Para la reconstitución del polvo de Lutrate Depot no puede utilizarse ningún otro disolvente estéril que el disolvente que se proporciona para Lutrate Depot.
6.3 Periodo de validez
3 años sin abrir.
Una vez reconstituido con el disolvente, la suspensión debe administrarse inmediatamente.
6.4 Precauciones especiales de conservación
Conservar por debajo de 25°C. No congelar.
Conservar en el embalaje original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
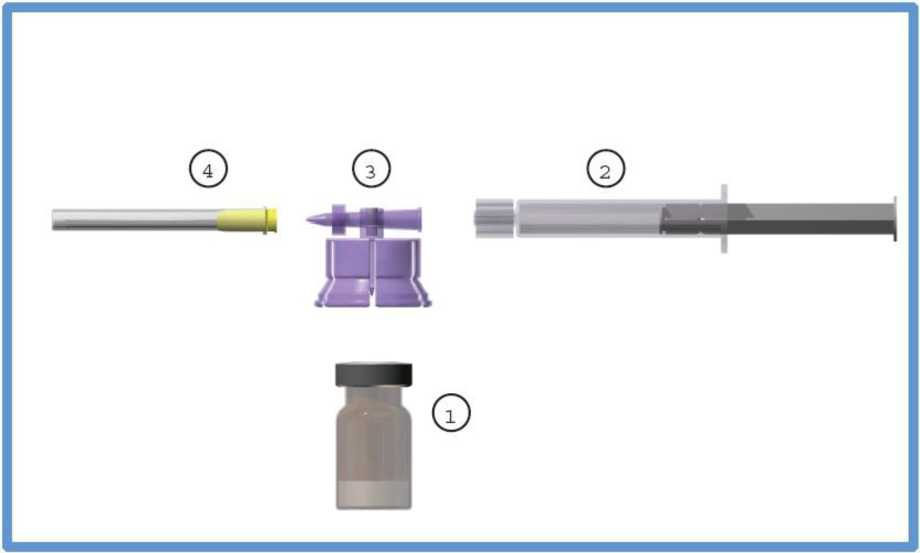
El kit comercial incluye:
1. Un (1) vial de vidrio de tipo I que contiene 3,75 mg de acetato de leuprorelina en forma de polvo liofilizado, sellado con un tapón de bromobutilo y un cierre desprendible de aluminio.
2. Una (1) jeringa de vidrio de tipo I precargada que contiene 2 ml de disolvente, sellada con un tapón de elastómero.
]£
3. Un (1) sistema adaptador de policarbonato/HDPE.
4. Una (1) aguja esteril del calibre 20.
6.6 Precauciones especiales de eliminación Precauciones especiales de eliminación y otras manipulaciones
Método de Administración
El vial de Lutrate Depot deberá ser reconstituido inmediatament antes de la administración por vía intramuscular. Asegurese de que se sigue un método aséptico.
La solución reconstituida es una suspensión lechosa de color blanco.
No puede utilizarse otro disolvente para la reconstitución de Lutrate Depot.
Reconstituir Lutrate Depot conforme a las siguientes instrucciones:
1

Retire la tapa azul del vial
2

Ajuste el sistema adaptador (de color morado) al vial hasta que oiga un “clic”.
3
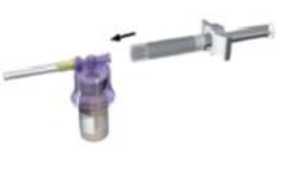
Adapte la pieza blanca a la jeringa que contiene el disolvente
Retire el tapón de goma de la
jeringa y acople la jeringa al sistema adaptador.
4
A
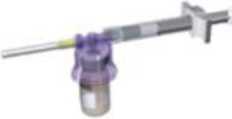
Manteniendo la jeringa y el vial bien acoplados en posición vertical, empuje lentamente el émbolo para transferir todo el diluyente al vial.
7
5
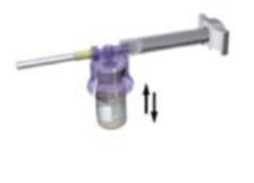
Con la jeringa todavía acoplada al vial, agite suavemente el vial durante un minuto aproximadamente hasta obtener una suspensión lechosa uniforme.
8
6

Coloque el sistema del revés, y tire cuidadosamente del émbolo para extraer el fármaco resuspendido desde el vial a la jeringa.
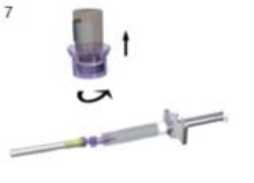
Retire la jeringa y la aguja del sistema adaptador girando la pieza superior del adaptador en el sentido contrario a las agujas del reloj. El medicamento está listo para ser administrado.

Limpie la zona de inyección con un algodón impregnado en alcohol y deje que se seque la piel.
Inyecte la suspensión por vía intramuscular en el cuadrante superior externo del glúteo.
Parte del producto puede acumularse o depositarse en la pared del vial. Esto se considera normal. Durante el desarrollo del producto, el vial se llena con exceso de producto para garantizar que se administra una dosis final de 3,75 mg de acetato de leuprorelina.
El producto está diseñado para administrar una única inyección. El producto restante debe desecharse.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GP-PHARM , S.A.
Pol. Ind. Els Vinyets -Els Fogars Sector 2 Carretera comarcal 244, km22 08777 Sant Quintí de Mediona
España
¡m
MINISTER10DE )E
SANIDAD, POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD
Agencia esparto» de cSacse-
medicamentos y ¡y
proouctcs san-íanos [finos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Número(s) de autorización de comercialización: 74980
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: Noviembre de 2011
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2015
14 de 14