Levovist 2,5 G Polvo Y Disolvente Para Suspension Inyectable
Información obsoleta, busque otroMINISTERIO
DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
agencia española de medicamentos y productos sanitarios
1. NOMBRE DEL MEDICAMENTO
Levovist® 2,5 g
Levovist® 4 g
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 g de granulos contiene 999 mg de galactosa y 1 mg de ácido palmítico.
Levovist® 2,5 g: 2,5 g de granulos contienen 2,4975 g de galactosa y 0,0025 de ácido palmítico.
Levovist® 4 g: 4 g de gránulos contienen 3,996 g de galactosa y 0,004 g de ácido palmítico.
Propiedades físico-químicas
Osmolalidad máxima a 37°C Solución
200 mg / ml 1175 mOsm/kg 300 mg / ml 1965 mOsm/kg 400 mg / ml 2985 mOsm/kg
Osmolalidad “efectiva” a 25°C Filtrado
200 mg / ml 910 mOsm/kg 300 mg / ml 980 mOsm/kg 400 mg / ml 950 mOsm/kg
Viscosidad a 25°C Filtrado
200 mg / ml 1,4 mPas 300 mg / ml 1,4 mPas 400 mg / ml 1,4 mPas
Suspensión lista para su empleo 200 mg / ml < 3 mPas 300 mg / ml < 7 mPas 400 mg / ml < 14 mPas
3. FORMA FARMACÉUTICA
Suspensión microcristalina extemporánea para administración intravenosa.
(El producto se presenta como polvo granulado estéril para administración intravenosa, una vez reconstituido con el diluyente que se facilita. (agua para inyección), para obtener concentraciones de 200, 300, y 400 mg de micropartículas por ml de suspensión).
Correo electrónicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
4.
DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Casos en los que se requiera una intensificación de la imagen en:
• Ecografía Doppler mono y bi-dimensional del flujo sanguíneo.
• Ecocardiografía de contraste, modo B, incluyendo la obtención de imágenes con 2° armónico.
• Diagnóstico del reflujo vesicoureteral (RVU) en niños mediante eco-cistografía con contraste.
4.2 Posología y forma de administración 4.2.1. Posología
Se recomiendan las siguientes dosis:
ECOGRAFÍA DOPPLER MONO Y BI-DIMENSIONAL
■ Ecografía Doppler vascular
- Adultos:
• En el caso de señales moderadamente detectables, pero insuficientes desde un punto de vista diagnóstico, administrar 10-16 ml de la concentración de 200 mg/ml.
• En el caso de señales Doppler débiles, es decir, en presencia de vasos pequeños, escaso flujo sanguíneo o condiciones de barrido desfavorables, administrar 5-10 ml de la concentración de 300 mg/ml.
• En el caso de señales Doppler muy débiles o ausentes, administrar 5-8 ml de la concentración de 400 mg/ml.
- Edad pediátrica:
|
Edad |
Volumen |
Concentración |
|
hasta 1 mes |
0,5 ml |
200 mg/ml |
|
1-12 meses |
1-2 ml |
200 mg/ml |
|
1-5 años |
2 ml |
200 mg/ml |
|
6-12 años |
3-4 ml |
200 mg/ml |
|
13-18 años |
4-10 ml |
200 mg/ml |
En casos especiales puede ser necesaria otra inyección de Levovist, por ejemplo, para examinar distintos planos de secciones. Para lograr un efecto más intenso o una mayor duración del realce, puede aumentarse la dosificación, preferiblemente empleando una mayor concentración. La duración de la intensidad de la señal aumentada es generalmente de 2-4 minutos.
Dosis máxima recomendada: 6 inyecciones de las cantidades anteriormente indicadas como dosis unitaria.

■ Ecocardiografía Doppler de las cavidades derecha e izquierda del corazón
- Adultos:
• Administrar 10-16 ml de la concentración de 200 mg/ml.
• En pacientes con señales Doppler muy débiles o ausentes y para el diagnóstico de la insuficiencia mitral: administrar 5-10 ml de la concentración de 300 mg/ml
• Exploración sólo de la cavidad derecha del corazón: administrar 4-10 ml de la concentración de 200 mg/ml.
- Edad pediátrica:
Edad_Volumen Concentración
|
hasta 1 mes |
0,5 ml |
200 mg/ml | |
|
1-12 meses |
1-2 ml |
200 mg/ml | |
|
1-5 años |
2 |
ml |
200 mg/ml |
|
6-12 años |
3 |
ml |
200 mg/ml |
|
13-18 años |
3-4 ml |
200 mg/ml | |
En casos especiales puede ser necesaria otra inyección de Levovist, por ejemplo, para examinar distintos planos de imágenes. Para lograr un mayor efecto o una mayor duración del realce, puede aumentarse la dosificación, preferiblemente empleando una mayor concentración. La duración de la intensidad de la señal aumentada es generalmente 1-2 minutos.
Dosis máxima recomendada: 6 inyecciones de las cantidades anteriormente indicadas como dosis unitaria. ECOCARDIOGRAFÍA DE CONTRASTE, MODO B
- Adultos:
• Administrar 10 ml de la concentración de 300 mg/ml.
• En casos de condiciones desfavorables para la conducción del sonido y para ecocardiografía de estrés: administrar 5-8 ml de la concentración de 400 mg/ml.
• Exploración sólo de la cavidad derecha del corazón: administrar 4-10 ml de la concentración de 300 mg/ml.
- Edad pediátrica:
Edad_Volumen Concentración
|
hasta 1 mes |
0,5 ml |
200 mg/ml |
|
1-12 meses |
1-2 ml |
200 mg/ml |
|
1-5 años |
2 ml |
200 mg/ml |
|
6-12 años |
3 ml |
300 mg/ml |
|
13-18 años |
3-4 ml |
300 mg/ml |
Dosis máxima recomendada: 6 inyecciones de las cantidades anteriormente indicadas como dosis unitaria.

ECO-CISTOGRAFÍA CON CONTRASTE
Para el diagnóstico del reflujo vesículo ureteral en niños mediante eco-cistografía con contraste, se recomienda la concentración de 300 mg/ml.
Administrar: 5-15 ml de la concentración de 300 mg/ml.
La siguiente tabla muestra los volúmenes recomendados de la suspensión de Levovist de 300 mg/ml y el uso de los viales de Levovist.
|
Viales a usar | |||
|
Volumen de llenado de la vejiga con suero salino |
Volumen de suspensión de Levovist de 300 mg/ml |
Vial de 2.5 g |
Vial de 4 g |
|
<85 ml |
<8.5 ml |
1 | |
|
85-135 ml |
8.5-13.5 ml |
1 | |
|
135-170 ml |
13.5-17.0 ml |
2 | |
|
170-220 ml |
17-22 ml |
1 |
1 |
|
220-270 ml |
22-27 ml |
2 | |
4.2.2. Forma de administración Información general
Se debe preparar la suspensión según las instrucciones, inmediatamente antes de su administración (ver apartado 6.6. instrucciones de uso/manipulación)
Ecografía Doppler mono y bi-dimensional del flujo sanguíneo:
La inyección intravenosa debe realizarse a una velocidad de aproximadamente 1-2 ml/seg, para conseguir un realce homogéneo en el registro Doppler.
Ecocardiogarfia de contraste, modo B:
La inyección intravenosa debe realizarse en bolo. Si se desea, es posible mejorar la reproducibilidad de los efectos de contraste cuantitativamente medibles (p. ej., para exploraciones cuantitativas) administrando inmediatamente después del contraste una inyección de 5-10 ml de solución salina fisiológica, con el fin de garantizar que se administre la totalidad de la dosis de contraste.
Se aconseja el empleo de una llave de 3 vías para poder inyectar sin retraso e inmediatamente después de la administración del contraste, la solución salina.
Se recomienda el uso únicamente de soluciones salinas suministradas en envases de plástico. Las soluciones salinas contenidas en envase de vidrio, por lo general, contienen pequeñas cantidades de aire disuelto y, por tanto, disminuye la estabilidad de las microburbujas.
Ecocistografía de contraste:
Se recomienda el siguiente procedimiento para la prueba:
Ecografía rutinaria del sistema urinario. Si no se logra visualizar los riñones o el espacio retrovesical, no se realizará una eco-cistografía con contraste.
2. Cateterización transuretral de la vejiga. Mediante el uso de catéter se procede al vaciado de la vejiga.
3. Se llena la vejiga con solución salina normal precalentada. Se debe administrar la solución salina en la vejiga lentamente hasta que el niño sienta la necesidad de orinar o el operador note una ligera presión retrógrada debida a la inyección.
4. El volumen de llenado de la vejiga servirá como referencia para calcular la dosis de Levovist que debe administrarse: con la concentración recomendada de 300 mg/ml, un volumen de suspensión de aproximadamente el 10% del volumen de llenado es una dosis clínicamente suficiente.
5. La suspensión de Levovist debe inyectarse lentamente bajo directa monitorización ecográfica. Con el fin de reducir al mínimo la destrucción de microburbujas, la potencia del equipo debe ajustarse inicialmente a un nivel bajo. Normalmente, es adecuado administrar el volumen calculado en una sola inyección.
Dependiendo de las propiedades ecogénicas individuales de cada paciente y de las características del equipo de ecocardiografía utilizado, la aplicación de la dosis recomendada en una sola inyección (10% del volumen de la vejiga) puede producir sombras. En tales casos, es aconsejable interrumpir la administración de Levovist a la mitad del volumen calculado y comenzar la exploración en la posición de decúbito supino. La segunda mitad del volumen calculado debería inyectarse antes de realizar la prueba en posición de decúbito prono.
Los niños pequeños orinan frecuentemente, incluso cuando el volumen de llenado de la vejiga es bajo. Si después de la inyección con suero salino, no se puede mantener la vejiga llena durante el tiempo suficiente, el procedimiento debe modificarse: primero se deben inyectar en la vejiga vacía 5 ml de la solución de Levovist, seguida inmediatamente por la inyección de suero salino normal mientras se exploran vejiga y riñones.
6. Para asegurar que no queda Levovist en el catéter, debería lavarse éste con 5 ml de suero salino.
7. Tras haber conseguido la distribución homogénea de las microburbujas en la vejiga, la exploración del sistema urinario debe hacerse en las posiciones de decúbito prono y supino. A continuación se le pide al paciente que orine. Durante y después de la micción se debe continuar la realización de la ecografía.
8. Si la vejiga no se vacía con la micción, se debe proceder al vaciado de la misma por medio del catéter al final de la exploración.
4.3 Contraindicaciones
Galactosemia.
Hipersensibilidad conocida a alguno de los componentes del producto.
4.4 Advertencias y precauciones especiales de empleo
En pacientes con insuficiencia cardiovascular grave (por ejemplo NYHA clase IV), debe tenerse en cuenta la carga total osmótica originada por las inyecciones de Levovist.
En la eco-cistografía con contraste, no existe experiencia clínica en pacientes con infecciones agudas del sistema urinario. En estos pacientes, se debe considerar cuidadosamente la necesidad de administrar Levovist.
• Uso en niños
Ver apartado de “Posología y forma de administración”.
• Uso en ancianos
Dosificación igual que en adultos.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se conocen
4.6 Embarazo y lactancia
Los posibles efectos nocivos de Levovist durante el embarazo y la lactancia no se han estudiado, por lo que, al igual que con todos los medicamentos, antes de emplear Levovist en estas circunstancias deberán valorarse cuidadosamente los posibles riesgos frente a los beneficios esperados.
4.7 Efectos sobre la capacidad de conducir y utilizar maquinaria
No procede
4.8 Reacciones adversas
• Administración intravenosa
Ocasionalmente, puede producirse dolor transitorio y una sensación de calor o frío en el lugar de la inyección, durante la inyección o poco después de la administración del preparado.
En casos aislados se han objetivado sensaciones gustativas, disnea, cambios de la presión sanguínea o del pulso, náuseas y vómitos, así como cefalea, mareos y reacciones cutáneas.
Debido a la hiperosmolalidad del Levovist puede producirse irritación pasajera, inespecífica, del endotelio vascular.
En raras ocasiones puede producirse broncoespasmo.
En caso de inyección paravascular accidental, puede producirse dolor e irritación tisular.
• Eco-cistografía con contraste:
En ocasiones, tras la exploración se puede producir dolor abdominal o uretral leve. En un paciente se produjo cistitis.
4.9 Sobredosificación
El riesgo de intoxicación accidental es muy bajo.
En caso de síntomas de diuresis osmótica, se deben controlar los electrolitos séricos y la volemia, y si es necesario, iniciar tratamiento de sustitución.
En caso de síntomas de hipervolemia, administrar diuréticos por vía i.v. (por ej. furosemida).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: V04A4 Preparados para diagnóstico. Contrastes radiológicos. Otros contrastes radiológicos.
Medios de contraste para exploraciones ecográficas
Levovist es un medio de contraste que, tras su inyección en vena periférica, produce temporalmente un aumento de las señales de eco de las cavidades cardiacas y vasos sanguíneos.
Esta clara amplificación de las señales de eco se debe principalmente a las burbujas de aire de tamaño micrométrico, que se originan después de la suspensión de los gránulos en agua. El ácido palmítico confiere estabilidad a las burbujas durante varios minutos mientras circulan hacia el corazón y pulmones, así como en el subsiguiente lecho vascular, antes de disolverse en el torrente sanguíneo.
Tras su inyección en la vejiga urinaria para la realización de una eco-cistografía con contraste, se observan ecos de ultrasonido intensificados causados por el contenido de la vejiga urinaria. La presencia de material ecogénico que pasa de la vejiga urinaria hacia los utéteres y la pelvis renal es indicativa de la existencia de reflujo vesiculoureteral. La media de duración de la señal ecográfica potenciada es de aproximadamente 9.5 minutos. La estabilidad de las microburbujas no se ve afectada por variaciones del pH de entre 5 y 9.
5.2 Propiedades farmacocinéticas
Los estudios farmacocinéticos de Levovist se han efectuado con la concentración de 400 mg/ml empleando volúmenes de inyección 35 y 70 ml.
Después de la administración intravenosa de Levovist, las micropartículas de galactosa se disuelven rápidamente en el torrente sanguíneo. La galactosa se distribuye principalmente en el espacio extracelular, en el que sufre un metabolismo glucosídico independiente de insulina. La galactosa se deposita principalmente a nivel hepático, mediante la formación de galactosa-1-fosfato o es degradada después de isomerización a glucosa-1-fosfato y metabolizada a CO2. La galactosa se excreta por vía renal cuando sus
niveles plasmáticos superan los 50 mg/100 ml.
La velocidad de eliminación se reduce en pacientes con hepatopatía, dependiendo de la función hepática, y debería esperarse, por consiguiente, una prolongada vida media de eliminación. La eliminación puede verse considerablemente prolongada por efecto del alcohol.
La galactosa y el ácido palmítico son sustancias fisiológicas, con un metabolismo rápido. Las vidas medias plasmáticas están entre 10-11 minutos y 1-4 minutos, respectivamente.
En la eco-cistografía con contraste, la suspensión de Levovist se inyecta en la vejiga urinaria. No existen indicios de que la galactosa ni el ácido palmítico se absorban a través del sistema urinario en cantidades relevantes durante este periodo de tiempo relativamente corto.
5.3 Datos preclínicos sobre seguridad
Aún después de la administración repetida de la dosis diagnóstica de Levovist a intervalos cortos, no existe riesgo de intoxicación aguda.
En los estudios de tolerancia sistémica tras la administración repetida diaria del preparado por vía intravenosa, así como tras la administración intracardíaca (ventrículo izquierdo), no se hallaron evidencias que contraindiquen la administración del preparado. No se observaron efectos organotóxicos incluso tras la administración intravenosa de altas dosis del preparado.
En un estudio en perros Beagle sanos a los que se administraron dosis superiores a cinco veces la dosis máxima prevista en humanos, se observaron reacciones transitorias de aumento de la presión arterial pulmonar, que desaparecieron tan pronto como el volumen administrado atravesó los vasos pulmonares y se diluyó. No se observaron otras reacciones secundarias.
En perros Beagle afectos de hipertensión pulmonar aguda, dosis superiores a la equivalente habitual para el ser humano no originaron efectos cardiovasculares negativos, aparte de los atribuibles a la hiperosmolaridad del producto.
De estos y otros estudios de tolerancia sistémica tras administración intravenosa e intracardíaca repetida, no se han desprendido hallazgos que comporten riesgo para el ser humano en las condiciones de uso previstas en clínica.
Los estudios toxicológicos de reproducción no indicaron ningún efecto teratogénico o embriotóxico potencial. Tampoco hubo indicios de efecto alguno sobre la fertilidad.
Los resultados de los estudios sobre tolerancia local tras administración única intravenosa única intraarterial, subcutánea, paravenosa e intramuscular han demostrado que tras la inyección paravenosa accidental, en algunos casos, se han producido ligeros síntomas de intolerancia local.
No se ha considerado necesario realizar estudios de mutagénesis, tumorigénesis o sensibilización, debido a que los componentes de Levovist, galactosa y ácido palmítico, se encuentran normalmente en el organismo humano y no producen estos efectos.
6. DATOS FARMACÉUTICOS
6.1 Relación de excipientes
Agua para inyección
6.2 Incompatibilidades
No se conocen.
6.3 Período de validez
24 meses para el producto envasado para la venta.
Una vez reconstituida la suspensión de Levovist, su periodo de validez es de 10 minutos siguientes el caso de la concentración de 200mg/ml, 25 minutos en el caso de la concentración de 300 mg/ml, y 40 minutos en el caso de la concentración de 400 mg/ml.
6.4 Precauciones especiales de conservación
Levovist debe conservarse a temperatura no superior a 30°C. Presérvese de la luz.
6.5 Naturaleza y contenido del recipiente
Granulado
Vial para inyección: vidrio tipo I
Tapón: clorobutil-caucho, gris, recubierto con fluoropolímero Cápsula rebordeadora: disco protector de polipropileno Envase para el agua


Ampollas de polietileno de 20 ml Equipo
Perforador: plástico
Jeringa desechable: jeringa graduada de plástico de 20 ml, con escala triple
Levovist 2,5 g
Envase combinado conteniendo:
1 Vial de 20 ml con 2,5 g de gránulos 1 Perforador
1 Jeringa desechable de 20 ml, graduada a 11, 7 y 5 ml 1 Ampolla de plástico con 20 ml de agua para inyección
Levovist 4 g
Envase combinado conteniendo:
1 Vial de 20 ml con 4 g de gránulos 1 Perforador
1 Jeringa desechable de 20 ml, graduada a 17, 11 y 8 ml 1 Ampolla de plástico con 20 ml de agua para inyección
6.6 Instrucciones de uso/manipulación
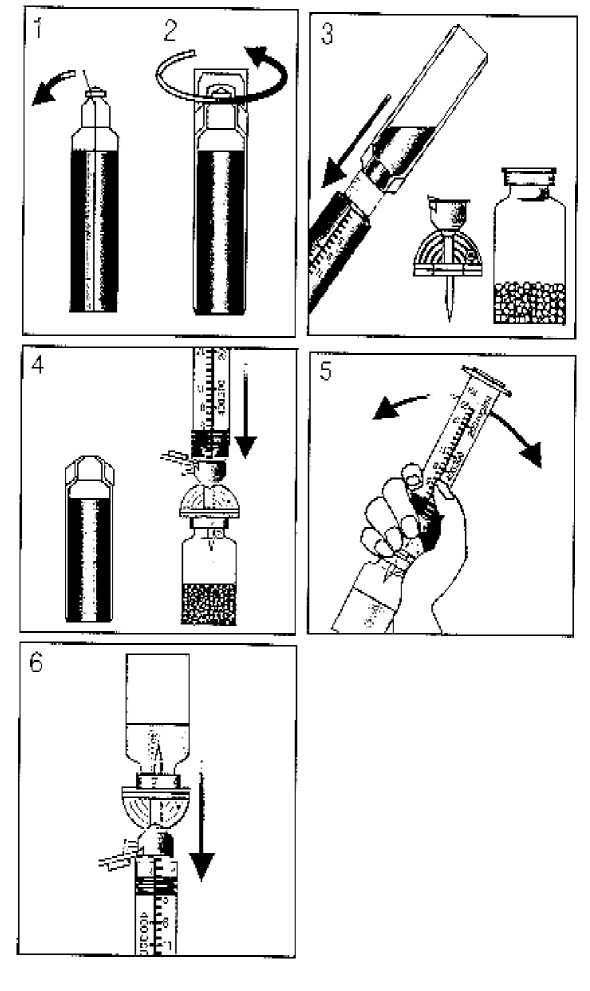
La suspensión de Levovist debe prepararse inmediatamente antes de su uso, ciñéndose a las siguientes instrucciones (ver figura 1):
E IGUALDAD_
Agencia española de medicamentos y productos sanitarios
1. Doblar hacia atrás la lengüeta de la parte superior de la ampolla de plástico que contiene el agua para inyección (¡Utilizar sólo el agua para inyección que se incluye en el envase!).
2. Girar para abrir.
|
Extraer la cantidad necesaria de agua para inyección, utilizando la jeringa que se acompaña. | ||
|
Vial con 2,5 g de gránulos | ||
|
Concentración Levovist |
Volumen de agua requerido |
Volumen total resultante* |
|
(mg micropartículas/ml) |
(ml) |
(ml) |
|
aprox. 200 |
11 |
12,5 |
|
aprox. 300 |
7 |
8,5 |
|
aprox. 400 |
5 |
6,5 |
|
* Volumen extraíble: aprox. |
1-2 ml menos | |
|
Vial con 4 g de gránulos | ||
|
Concentración Levovist |
Volumen de agua requerido |
Volumen total resultante* |
|
(mg micropartículas/ml) |
(ml) |
(ml) |
|
aprox. 200 |
17 |
19,5 |
|
aprox. 300 |
11 |
13,5 |
|
aprox. 400 |
8 |
10,5 |
* Volumen extraíble: aprox. 1-2 ml menos
Retirar la tapa de plástico del vial que contiene los gránulos sin quitar la cápsula rebordeadora. Perforar el tapón con el perforador.
4. Sujetar la jeringa a la conexión Luer-Lok del perforador Sterifix (capuchón verde) y transferir el agua al vial. El "air-bleed duct" integrado con el filtro estéril permite compensar la presión.
5. Preparar la suspensión agitando de forma manual, inmediata y vigorosamente, durante 5-10 segundos. No utilizar agitadores mecánicos ni baño de ultrasonidos. Dejar reposar la suspensión durante 2 minutos antes de emplearla.
6. Extraer con la jeringa y a través del perforador la suspensión lechosa, homogénea, lista para su empleo. Inyectarla antes de los 10 minutos siguientes el caso de la concentración de 200mg/ml, 25 minutos en el caso de la concentración de 300 mg/ml, y 40 minutos en el caso de la concentración de 400 mg/ml.
Los gránulos y el agua para inyección deben estar a temperatura ambiente antes de realizar la suspensión. Debe evitarse en lo posible el calentamiento de la suspensión (p. ej. por mantenerla en las manos demasiado tiempo) y la inducción de una presión negativa excesiva (p. ej. al aspirar la suspensión) a fin de no originar una reducción del número de microburbujas y la formación de burbujas de aire de mayor tamaño, como resultado de procesos de desgasificación.
Es aconsejable administrar la inyección mediante una cánula venosa flexible de calibre suficientemente grande (p. ej. 19 a 20 G). El empleo de conexiones Luer- Lok supone también una ventaja práctica.
Como es usual, antes de la inyección hay que cerciorarse cuidadosamente de haber eliminado todas las burbujas de aire macroscópicamente visibles.
Si durante el tiempo de espera se produjera una sedimentación de las micropartículas, se recomienda agitar muy suavemente el vial, volteándolo de arriba a abajo para volver a obtener la suspensión del preparado.

Cualquier resto de suspensión no utilizada en una exploración debe desecharse.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BAYER HISPANIA, S.L .
Av. Baix Llobregat, 3-5 -08970-Sant Joan Despi (Barcelona)
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Levovist 2,5 g: n° reg. 61.311 Levovist 4 g: n° reg. 61.360
9. FECHA DE PRIMERA AUTORIZACIÓN/REVALIDACIÓN DE LA AUTORIZACIÓN
Levovist 2,5 g: 30.07.97 Levovist 4 g: 27.12.96
10. FECHA DE REVISIÓN DEL TEXTO
Diciembre 21.12.2000
02.01
Agencia española de
medicamentos y
productos sanitarios