Ionsys 40 Microgramos Por Dosis, Sistemas Transdermicos Iontoforeticos
Información obsoleta, busque otroFICHA TECNICA O RESUMEN DE LAS
ANEXO I CAR
ARAC
£
&
TERISTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
IONSYS 40 microgramos por dosis, sistemas transdérmicos iontoforéticos.
2
COMPOSICION CUALITATIVA Y CUANTITATIVA
Cada sistema de IONSYS contiene 10,8 mg de hidrocloruro de fentanilo equivalente a 9,7 mg de fentanilo y libera 40 microgramos de fentanilo por dosis, hasta un máximo de 3,2 mg (80 dosis).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Sistema transdérmico iontoforético (STI).
rvorios de hidrogel, uno a demanda. La parte SYS™’.
IONSYS está compuesto por un controlador electrónico compacto y dos de los cuales contiene hidrocloruro de fentanilo en forma de gel, sin superior del producto es blanca y aparece el nombre de identificación I
4. DATOS CLÍNICOS 4.1. Indicaciones terapéuticas
V*
IONSYS está indicado en el tratamiento hospitalario del dolor agudo post-operatorio de grado de moderado a intenso.
4.2. Posología y forma de administración
IONSYS debe estar restringido sólo a us< del fentanilo, los médicos deben evalu; (ver sección 4.4).

,
pitalario. Debido a que es conocido el probable abuso pacientes, acerca de su historia de consumo de drogas
Deben seguirse precauciones es IONSYS debe ser activado

es de eliminación (ver sección 6.6). el paciente.
Antes de realizar cualquier intervención quirúrgica, el profesional sanitario debe asegurarse que el paciente ha sido informado correctamente sobre como usar IONSYS después de la intervención. IONSYS libera 40 microgramos por dosis a demanda hasta un máximo de 240 microgramos por hora (6 dosis, cada una de 10 minutos de duración) y no más de un máximo de 80 dosis en un periodo de 24 horas. Los pacientes deben estar controlados en un nivel aceptable de analgesia, antes de iniciar el empleo de ION
El sistema debe activarse sólo por el paciente en respuesta al dolor. IONSYS funcionará durante 24 horas después de la terminación de la primera dosis o durante 80 dosis, lo que ocurra primero, y luego se hace inoperativo. Si el paciente intenta iniciar una dosis después de 80 dosis ó 24 horas desde la primera dosis, el sistema no responderá (es decir no aparecerá ninguna luz roja, ni ningún pitido). La duración máxima del tratamiento es de 72 horas (3 sistemas), aunque la mayoría de los pacientes, deben solo necesitar un sistema. Los pacientes no deben ponerse más de un sistema al mismo tiempo. Los sistemas usados, no deben volverse a reutilizar.
Los pacientes no deben mojar el sistema IONSYS. El contacto prolongado con el agua podría afectar al funcionamiento del sistema y provocar que el sistema funcione mal o que se despegue.

IONSYS debe ser retirado antes de que el paciente sea dado de alta.
Pacientes pediátricos
No se recomienda el empleo de IONSYS en niños menores de 18 años, debido a que no se dispone de datos suficientes de seguridad y eficacia.
Pacientes de edad avanzada
Los datos disponibles sobre farmacocinética, seguridad y eficacia de IONSYS en pacientes > 75 años, son limitados.
xicidad

Los pacientes de edad avanzada deben ser vigilados cuidadosamente de cualquier signo de toxi por fentanilo.
IONSYS Instrucciones de comprobación del funcionamiento para el farmacéuto profesional sanitario (para ser realizado antes de la dispensación): Por favor, consultar la si
Método de Aplicación
$
El sistema IONSYS no se debe usar si el sellado del sobre está roto.
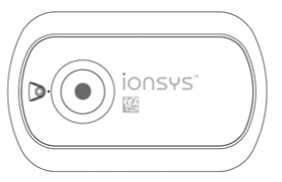
LED = Diodo emisor de luz
IONSYS debe aplicarse en una zona de la piel que se encuentre intacta, no irritada y no irradiada, en el tórax o parte superior externa del brazo. IONSYS no se debe colocar en zonas con problemas de la piel, como cicatrices, quemaduras, tatuajes, etc. Antes de aplicar el sistema, el vello se debe cortar (no afeitar), en el lugar de aplicación. IONSYS no debe ser aplicado en una zona de la piel que haya sido utilizada previamente.
- Antes de la aplicación del sistema IONSYS, el lugar de aplicación debe ser limpiado con un algodón con alcohol estándar y dejar que la piel se seque completamente. No se deben usar jabones, aceites, lociones, u otros agentes que puedan irritar la piel o cambiar sus características de absorción.
- El sobre que contiene IONSYS se debe abrir comenzando por la muesca precortada, tirando después cuidadosamente a lo largo de la parte superior del sobre. El sistema se debe extraer del sobre y usarlo inmediatamente. Una vez abierto el sobre, se debe desechar el absorbente de humedad. Si no hay absorbente de humedad, o si no está intacto, no lo use y devuélvalo al fabricante.
- El protector transparente de plástico que cubre el adhesivo se debe quitar y desechar con cuidado, evitando tocar los geles.
- Se debe presionar el sistema IONSYS firmemente en la zona de aplicación de la piel, con el lado adhesivo en contacto con la misma, durante al menos 15 segundos. La presión se debe aplicar con los dedos alrededor de los bordes externos, para asegurar la adherencia a la zona de la piel durante el período completo de 24 horas que se lleva puesto. Ocasionalmente, el sistema IONSYS puede desprenderse; si esto ocurre, se puede usar un esparadrapo hipoalergénico, para asegurar que todos los bordes del sistema estén en contacto completo con la piel. Se debe tener cuidado para no presionar o tapar con el esparadrapo, el botón o la luz roja.
Liberación de una dosis
apagí
mero apr< ca la ad 1 a 5 d
En la parte superior del sistema IONSYS se sitúan un botón de dosificación a demanda y una luz roja. Para iniciar la administración de una dosis de fentanilo, el paciente debe presionar el botón de demanda, dos veces en 3 segundos. IONSYS debe ser activado sólo por el paciente. Un pitido indica el comienzo de la liberación de dosis; la luz roja permanece encendida durante el intervalo de dosificación de 10 minutos. La dosis siguiente, no se puede iniciar hasta que se haya completado el ciclo de 10 minutos de liberación anterior. Si se presiona el botón durante la liberación de una dosis, no se producirá la administración de una dosis adicional de medicamento. La luz roja se apaga después de que la dosis de 10 minutos ha sido liberada.
Determinación del número aproximado de dosis liberadas
roximado de
Entre dosis, la luz roja parpadeará en pulsos de un segundo, para indicar el nú dosis administradas hasta el momento. Cada pulso de luz por segundo, indica la administración de
hasta cinco dosis. Así, un simple pulso de luz de un segundo, representa de 1 a 5 dosis; dos pulsos representan de 6-10 dosis; tres pulsos representan de 11-15 dosis; hasta 16 pulsos, que representan de 76-80 dosis liberadas. Durante la administración de una dosis, el sistema puede dar información si se pulsa el botón una vez. El diodo emisor de luz roja parpadeará como se ha descrito anteriormente, para indicar el número aproximado de dosis liberadas a demanda hasta el momento que se ha hecho la consulta. Esta consulta no influirá en la liberación de dosis.
Retirada del sistema
IONSYS puede ser retirado en cualquier momento retirado, el mismo sistema no se debe volver a aplic; que hayan sido liberadas 80 dosis, se retirará el sis roja y despegando el sistema del lugar de la piel donde tratamiento, se puede aplicar un nuevo sistema en una externa del brazo o en el tórax.
ry
Solución de Incidencias
bargo, una vez que un sistema ha sido inal de 24 horas de empleo o después de ONSYS con cuidado, levantando la lengüeta está aplicado. Si el paciente sigue necesitando nueva zona de la piel, en la parte superior
Cada sistema IONSYS se diseña para liberar una dosis a demanda de fentanilo durante aproximadamente 10 minutos. Si se sospecha un fallo técnico en un sistema, el personal facultativo o el paciente deben supervisar, tanto la iluminación del diodo emisor de luz roja como cualquier señal audible (pitidos), durante la siguiente dosis. La tabla siguiente representa los diferentes mensajes de error que pueden ocurrir, junto con la acción apropiada a tomar:
|
Mensajes de Error Frecuentes |
Acción |
|
2 pitidos repetidos 8 veces (aproximadamente 15 segundos) y el diodo emisor de luz roja se apaga antes de 10 minutos |
Se pueden hacer hasta 2 intentos más, para solicitar una nueva liberación. Si todos los intentos fallan, se debe retirar el sistema y aplicar uno nuevo, en una nueva zona de la piel. |
|
4 pitidos continuos y el diodo emisor de luz roja se apaga antes de 10 minutos |
El sistema no puede ser reiniciado de nuevo. Se debe retirar el sistema y aplicar uno nuevo, en una zona nueva de la piel. |
|
Fallos de iluminación en el diodo emisor de luz roja |
Se debe retirar el sistema y aplicar uno nuevo, en una nueva zona de la piel. |
4.3. Contraindicaciones
Hipersensibilidad al principio activo, o a alguno de los excipientes.
4.4. Advertencias y precauciones especiales de empleo
Para evitar una posible sobredosis, IONSYS debe ser activado sólo por el paciente. IONSYS debe restringirse sólo a uso hospitalario.
La ingestión oral del gel que contiene el fentanilo, puede causar hipoventilación o muerte. No se debe tocar el gel o permitir que entre en contacto con la boca u otras áreas mucosas.

ca Nuclear
Después de su uso una cantidad potencialmente peligrosa de fentanilo permanece en el sistema IONSYS.
Por favor, consultar la sección 6.6 para conocer las Precauciones especiales de elir
El sistema IONSYS debe retirarse antes de un procedimiento de Resonancia M; (RMN), cardioversión, o desfibrilación.
Abuso potencial y dependencia
El principio activo de IONSYS es fentanilo, debido a que es conocid lo el p robable abuso del fentanilo los médicos deben evaluar a los pacientes acerca de su historia de consumo de drogas y seguir
AO+rAollOmAtl+A O to 1 A» O nOAl A11+AC >
orto plazo, ruebas d
o el p
estrechamente a tales pacientes.
los riesgos relacionados con una de abuso del sistema durante los
Puesto que IONSYS está indicado sólo en tratamiento a corte posible dependencia no son de interés. Además no hubo pr ensayos clínicos.
Depresión respiratoria
Como con todos los opioides potentes, con IONSYS se puede presentar una depresión respiratoria significativa, debiéndose vigilar estos efectos en los pacientes (ver sección 4.9). El uso de medicamentos concomitantes con actividad sobre el Sistema Nervioso Central (SNC), puede aumentar el riesgo de depresión respiratoria (ver sección 4.5).
,„ui—,ró„, o
Los pacientes que presentan enfermedad pulmonar obstructiva crónica o pacientes con condiciones que los predisponen a hipoventilación, pueden experimentar reacciones adversas mucho más graves. En dichos pacientes, los opioides pueden disminuir el estimulo respiratorio y aumentar la resistencia de las vías aéreas.
Traumatismo craneal
ertensión intracraneal
IONSYS no se i intracraneales trastornos de con trauma

Enfermedad cardiaca
ebe usar en pacientes que puedan ser particularmente susceptibles a los efectos ención de CO2, tales como aquellos con evidencia de hipertensión intracraneal, onciencia o coma. Los opioides pueden enmascarar el curso clínico de los pacientes craneal. IONSYS se debe emplear con cuidado en pacientes con tumores cerebrales.
Fentanilo puede producir bradicardia o hipotensión y por tanto se debe administrar con precaución en pacientes que presentan bradiarritmias o cualquier enfermedad cardiovascular significativa.
Íleo paralítico
IONSYS se debe usar con precaución en pacientes que presentan íleo paralítico.
En el metabolismo del fentanilo se producen metabolitos inactivos en el hígado. Las enfermedades hepáticas pueden retrasar la eliminación. Se debe observar de cerca, los pacientes con trastornos hepáticos, en busca de signos de toxicidad por fentanilo.
Enfermedad renal
O
Menos del 10 % del fentanilo administrado se excreta inalterado por el riñón. A diferenc morfina, ningún metabolito activo se elimina por el riñón. Los datos obtenidos con fentanilo intravenoso en pacientes con insuficiencia renal, sugieren que el volumen de distribución de fentanilo puede cambiar por la diálisis. Esto puede afectar las concentraciones séricas. Si los pacientes con trastornos renales reciben IONSYS, deben observarse con cuidado en busca de signos de toxicidad por fentanilo.
Pacientes de edad avanzada
de IONSY
YS en pacientes > 75 años,
Los datos disponibles sobre farmacocinética, seguridad y eficacia son limitados.
Los pacientes de edad avanzada deben ser vigilados cuidadosamente por signos de toxicidad por fentanilo.
Pacientes obesos

No se ha establecido la eficacia y seguridad en paciecon Índice de masa corporal mayor de 40.
Hipoacusia
es qu
IONSYS se debe usar con precaución en pacientes que presentan hipoacusia, los cuales pueden no ser capaces de oír las señales audibles del sistema.
Cirugías de tórax/pecho y abdomen su
perior
Los datos disponibles acerca del uso de IONSYS en pacientes sometidos a cirugías de tórax/pecho y abdomen superior, son limitados. IONSYS, por lo tanto, se debe usar con precaución en estos pacientes.
Fibrosis Quística
Q)
No se ha establecido la eficacia y seguridad en pacientes que presentan fibrosis quística.
. rr
Estado físico
No se ha establecido la seguridad de IONSYS en pacientes con estado físico clasificación IV de la Sociedad Americana de Anestesistas (ASA).
Al principio de cada nueva aplicación de IONSYS, el paciente podría usarlo con más frecuencia que durante las 24 horas restantes de dosificación, debido a la baja absorción de fentanilo durante las primeras horas (ver sección 5.2).
lecido
4.5. Interacción con otros medicamentos y otras formas de interacción
Los estudios de interacciones se han realizado sólo en adultos.
El uso concomitante de otros depresores del sistema nervioso central, incluidos otros opioides, sedantes o hipnóticos, anestésicos generales, fenotiazinas, tranquilizantes, relajantes músculo-esqueléticos, antihistamínicos sedantes y bebidas alcohólicas, puede producir efectos depresores aditivos. Se pueden producir hipoventilación, hipotensión y sedación profunda o coma. Por tanto, el uso concomitante de algunos de estos fármacos con IONSYS, requiere especial cuidado y observación del paciente.
Fentanilo, un principio activo de aclaramiento elevado, se metaboliza rápida y extensamente principalmente por el CYP3A4. La administración vía oral de 200 mg/día durante 4 días de Itraconazol, un potente inhibidor del CYP3A4, no tuvo un efecto significativo sobre la farmacocinética del fentanilo intravenoso. Ritonavir oral, uno de los inhibidotes del CYP3A4 más potentes, disminuye dos tercios el aclaramiento del fentanilo intravenoso. El uso concomitante de inhibidores potentes del CYP3A4 como ritonavir, con IONSYS, puede dar lugar a un aumento de las concentraciones en plasma de fentanilo, las cuales podrían aumentar o prolongar tanto los efectos

ria grave. En esta uso concomitante te esté monitorizado
terapéuticos, como los acontecimientos adversos y pueden causar depresión re situación, es apropiado, el cuidado y observación del paciente. No se recomi de ritonavir u otros inhibidores del CYP3A4 con IONSYS, a menos que el p de forma constante.

Ya que se ha informado de una potenciación grave e inesperada de los analgésicos opioides mediada por los inhibidores de la MAO, no se recomienda el uso de IONSYS en pacientes que han recibido inhibidores de la monoamino oxidasa (IMAO) dentro de 14 días, anteriores al inicio del tratamiento.
4.6. Embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de fentanilo en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (véase sección 5.3). Se desconoce el riesgo potencial en seres humanos. IONSYS no debería utilizarse durante el embarazo, excepto si fuese claramente necesario.
No se recomienda la administración durante el parto, porque fentanilo atraviesa la placenta y el centro respiratorio fetal es sensible a opiáceos. Si se administra IONSYS, debe estar disponible fácilmente un antídoto para el niño. Después del tratamiento a largo plazo, fentanilo puede causar abstinencia en el recién nacido.
S)
Lactancia
Fentanilo se excreta en la leche materna. No se recomienda lactancia materna en las 24 horas siguientes a la retirada de IONSYS.
mente
Mujeres potencialmente fértiles/ Fertilidad
Véase sección 5.3 (Toxicología reproductiva).
4.7. Efectos dad para conducir y utilizar máquinas
La influencia de IONSYS sobre la capacidad de conducir y usar máquinas es importante.
Fentanilo puede causar vértigo y somnolencia, por lo tanto, los pacientes sólo deben conducir vehículos o manejar la maquinaria pesada, después de la administración de IONSYS sí ha transcurrido tiempo suficiente.
4.8. Reacciones adversas
La seguridad de IONSYS 40 microgramos, fue evaluada en un total de 791 pacientes, en estudios clínicos controlados. Las reacciones adversas, notificadas más comúnmente, fueron náuseas, vómitos, cefalea y prurito. La mayoría de ellas fueron de gravedad de leve a moderada. En los ensayos clínicos se han notificado las reacciones adversas siguientes, que al menos posiblemente, están relacionadas con el tratamiento; no todas estas reacciones han sido atribuidas uniformemente a IONSYS, por los investigadores, por lo tanto la causalidad no puede ser establecida.
|
Reacciones Adversas Muy Frecuentes (> 1/10) |
Reacciones Adversas Frecuentes (> 1/100, < 1/10) |
Reacciones Adversas Poco frecuentes (> 1/1000, < 1/100) | |
|
Trastornos Vasculares |
Vasodilatación | ||
|
Trastornos del Sistema Nervioso |
Mareo Somnolencia £ |
Agitación Alteraciones del Sueño IAnlsuocminnaicoi ones Depresión Hipoestesia Nerviosismo Temblor Vértigo | |
|
Trastornos Cardiacos |
Hipotensión i |
Taquicardia Bradicardia Hipertensión Migraña Sincope | |
|
Trastornos del Metabolismo y de la nutrición |
i |
■ |
Mialgia Edema Hipocalcemia Hipoglucemia Hipopotasemia |
|
Trastornos respiratorios, torácicos y mediastínicos A |
& *9 |
Hipoxia |
Apnea Hipo Hipoventilación Disnea Trastornos pulmonares Aumento de tos Rinitis |
|
Trastornos Gastrointestinales / |
Náusea Vómitos |
Estreñimiento Flatulencias |
Erupto Trastornos gastrointestinales Íleo Boca seca Dispepsia Anorexia |
|
Trastornos de la piel y del tejido subcutáneo |
Prurito |
Rash Inflamación en el sitio de una herida edema | |
|
Trastornos renales y urinarios |
Retención urinaria |
Oliguria Trastorno urinario | |
|
Trastornos generales y alteraciones en el lugar de administración |
Cefaleas, *ASRs - eritema |
*ASRs - picores, vesículas Fiebre |
*ASRs- pápulas/pústulas, sudor, |
|
Reacciones Adversas Muy Frecuentes (> 1/10) |
Reacciones Adversas Frecuentes (> 1/100, < 1/10) |
Reacciones Adversas Poco frecuentes (> 1/1000, < 1/100) | |
|
piel seca y escamosa quemazón Dolor abdominal Dolor de espalda Dolor Escalofríos |
*ASRs = Reacciones en el lugar de administración
4.9. Sobredosis
acciones farmacológicas,
Síntomas
Las manifestaciones de la sobredosis de fentanilo son una extensión de sus ac siendo el efecto más grave la depresión respiratoria.
Tratamiento
sapsiaractcoiroinae,
•:cy
Como medida inmediata para el tratamiento de la depresión respiratoria, se retirará el sistema IONSYS y se provocará la estimulación física y verbal del paciente. Estas acciones pueden ir seguidas de la administración de un antagonista específico de los opioides, como la naloxona. La depresión respiratoria después de una sobredosis puede durar más que la acción del antagonista opioide administrado. La semivida del antagonista puede ser corta, por lo tanto, hay que repetir la administración o puede ser necesaria la perfusión continua. La inversión del efecto narcótico puede producir la aparición de dolor agudo y la liberación de catecolaminas.
Si la situación clínica obliga a ello, puede ser preciso establecer y mantener una vía aérea, posiblemente con una vía orofaríngea o un tubo endotraqueal y se debe administrar oxígeno y controlar y mantener la respiración, según se precise. Se debe mantener una temperatura corporal adecuada y una ingesta suficiente de líquidos.
Si se produce hipotensión grave el problema con administración
5. PROPIEDADES

ACOLOGICAS
tente, se debe considerar la posibilidad de hipovolemia y tratar teral de líquidos.
5.1. Propiedades Farmacodinámicas
Grupo fármacoterapéutico: Analgésico opioide (derivado de fenilpiperidina). Código ATC: N02A B03.
Fentanilo es un analgésico opioide, que interacciona fundamentalmente con el receptor opioide-q. Sus acciones terapéuticas principales son la analgesia y la sedación. Sus efectos farmacológicos secundarios son depresión respiratoria, bradicardia, hipotermia, estreñimiento, miosis, dependencia física y euforia. Las concentraciones séricas analgésicas mínimas de fentanilo, en pacientes que no han sido tratados con opioides para el dolor agudo post-operatorio, varían de 0,2 a 1,2 ng/ml; la frecuencia de efectos secundarios aumenta para niveles en suero por encima de 2 ng/ml.
5.2. Propiedades Farmacocinéticas
Al inicio de cada dosis, una corriente eléctrica mueve una cantidad predeterminada de fentanilo, desde el depósito que contiene el principio activo a través de la piel, a la circulación sistémica. IONSYS libera una dosis nominal de 40 microgramos de fentanilo en cada período de dosificación de 10 minutos. Después de la última dosis y la retirada del sistema, la disminución de la concentración sérica de fentanilo es similar a la de fentanilo intravenoso.
Cuando se aplica IONSYS sin activar la corriente, el promedio de la absorción de fentanilo durante 24 horas es de 2,3 microgramos fentanilo/hora, indicando una liberación mínima pasiva.
El promedio de concentraciones séricas observadas en pacientes post-quirúrgicos, estaba en el rango de 0,4-1,5 ng/ml durante un período de 24 horas de dosificación. En general, la concentración sérica máxima de fentanilo, aparece aproximadamente a los 15 minutos después del inicio de una dosis.
Después de que IONSYS libere una dosis a demanda de fentanilo, este tiene una semivida de absorción de aproximadamente 15 minutos.
nutos; la semivida de la 13 horas.
La distribución de fentanilo presenta una farmacocinética tricompartimental. Con administración intravenosa, la semivida de la distribución inicial es aproximadamente 6 segunda distribución es 1 hora, y la semivida de la distribución termin
ios para las fracciones libres de fentanilo en no aparece fentanilo metabolizado liberado
El volumen medio de distribución para fentanilo en el estado estacionario es 6 l/kg, el aclaramiento medio es de 53 l/Kg. Los pacientes de edad avanzada, caquécticos o debilitados pueden presentar una disminución en el aclaramiento de fentanilo y, por tanto, el principio activo puede tener en ellos, una semivida terminal más prolongada. Fentanilo sé metaboliza principalmente en el hígado. Aproximadamente un 75 % de fentanilo se excreta en la orina, en su mayoría como metabolitos, con menos de un 10 % como principio activo inalterado. Cerca del 9 % de la dosis se recupera en las heces, principalmente como metabolitos. Los valore plasma se estiman están entre el 13 y el 21 %. En la pi
transdérmicamente.
Después del uso de IONSYS, ninguno de los cuatro factores demográficos estudiados [peso (delgado/ obeso), edad, raza, o sexo] tuvieron un efecto significativo en la exposición del principio activo (AUC). La absorción del fentanilo es similar si se aplica IONSYS en la parte superior externa del brazo o en el tórax. Cuando el sistema se aplica en la parte inferior interna del brazo, la cantidad de fentanilo absorbida, es aproximadamente el 20 % más baja que cuando se aplica en el brazo en la parte superior externa o en el tórax. La farmacocinética del fentanilo parece ser similar tanto con una sola aplicación de 24 horas como con aplicaciones múltiples. La absorción sistémica de fentanilo, aumenta en función del tiempo, pero independiente de la frecuencia de dosificación, siendo la absorción de la dosis inicial aproximadamente el 40 % de la dosis nominal de 40 microgramos, que es absorbida entre 12 y 24 horas después de su aplicación. Este perfil farmacocinético de absorción se repetirá con cada aplicación en un nuevo sitio de la piel, por lo tanto, con cada nueva aplicación la absorción es menor
que cuando IONS concentracione

clínicos sobre seguridad
plica por primera vez, y por consiguiente ocurrirá una caída de las áticas de fentanilo.
5.3.
Los datos de los estudios no-clínicos basados en estudios convencionales de toxicidad a dosis repetidas, no mostraron riesgos especiales para humanos.
Toxicidad reproductiva:
Se han realizado estudios de toxicidad reproductiva estándar y del desarrollo, usando administración parenteral de fentanilo.
En un estudio en ratas, el fentanilo no influyó en la fertilidad masculina. Estudios con ratas hembras mostraron una reducción de la fertilidad y elevaron la mortalidad del embrión. Una dosis intravenosa de hasta 0,4mg/kg/día durante 14 días a ratas hembras, no produjo ningún efecto sobre la fertilidad.
Una sola dosis diaria de fentanilo en bolus, de 0,3 veces la dosis humana, perjudicó la fertilidad en ratas cuando fue administrada vía intravenosa, durante 12 días.
Estudios más recientes mostraron que los efectos sobre el embrión, fueron debidos a la toxicidad materna y no a los efectos directos de la sustancia en el desarrollo embrionario. No hubo ninguna indicación de efectos teratogénicos en estudios en dos especies (ratas y conejos). En un estudio sobre el desarrollo pre y post-natal, a las dosis que redujeron ligeramente el peso materno, se redujo considerablemente el ratio de supervivencia del descendiente. Este efecto, podría o ser debido a una alteración del cuidado materno o a un efecto directo de fentanilo sobre los cachorros. No se observaron efectos sobre el desarrollo somático y el comportamiento del descendiente.
Los estudios de mutagenicidad en bacterias y roedores dieron resultados negativos. E efectos mutagénicos en células madre de mamífero in vitro, comparables a la vista analgésicos opioides. Parece improbable un riesgo mutagénico utilizando dosis te efectos aparecieron sólo a altas concentraciones.
No ha sido estudiada la carcinogenidad del fentanilo.
Toxicidad Aguda: Ver sección 4.9 Sobredosis.


ilo indujo os
icas, ya que los
6. DATOS FARMACEUTICOS 6.1. Lista de excipientes
Compartimento inferior del ensamblaje:
- Tereftalato de polietileno de glicol modificado
- hidrogel del ánodo: agua purificada, hidróxidc
- hidrogel del cátodo: citrato sódico, alcohol ] cetilpiridina, agua purificada y cloruro sód
- electrodo del ánodo: lámina de plata y cinta adhesiva conductora de electricidad (ECAT).
- electrodo del cátodo: material compuesto de trilaminato de cloruro de plata, lámina de plata, ECAT.
- adhesivo que se pega a la piel: po
- plástico protector del adhesivo: pel
sP
eo, polacrilina y alcohol polivinilico. ilico, ácido cítrico anhidro, cloruro de
6.2

o, éster de resina. ula de poliéster, silicona.
Incompatibilidades
o
No procede. <z>
6.3. Período de validez
<7f
1 año
Usar inmediatamente después de abrir.
6.4. Precauciones especiales de conservación
No conservar a temperatura superior a 25°C. Conservar en el embalaje original.
Cada sistema IONSYS está envasado individualmente en un sobre rectangular sellado, junto con un absorbente de humedad. El sobre, está formado por una lámina de nylon, lámina de aluminio y una capa sellada por calor de un copolímero de polietileno y ácido polimetacrílico.
Cada sobre se envasa en una caja de cartón. Hay una unidad por caja.

6.6. Precauciones especiales de eliminación
El contacto con el gel puede ser perjudicial para los seres humanos. Si el gel de fentanilo entra en contacto con la piel durante la aplicación o la retirada, se debe lavar el área con abundante agua. No se debe usar jabón, alcohol u otros disolventes para quitar el gel, porque pueden realzar la capacidad del principio activo de penetrar la piel.
&
IONSYS Instrucciones de comprobación de funcionamiento para el Farmacéutico u otro Profesional Sanitario (Para ser realizado antes de la Dispensación).
Cada sistema IONSYS deberá probarse antes de que sea aplicado a un paciente para asegurar que el sistema funciona adecuadamente. Esto se puede realizar presionando el botón de dosificación de IONSYS, sin sacarlo del sobre sellado. No se libera del sistema, ningún principio activo a no ser que IONSYS se aplique a la piel. Por lo tanto, se dispondrá todavía de 80 dosis y 24 horas de empleo, después de que se realice la siguiente prueba de funcionamiento:
1. Sostenga sin abrir el sobre que contiene IONSYS.
cual es el lado redondeado de
2. A través del tacto, determine donde está el sistema IONSYS y cual
IONSYS.
3. Con el lado redondeado hacia arriba, deslice un dedo a lo largo de la unidad, hasta que note el botón al final.
v(y
4. Presione el botón firmemente y suéltelo dos veces en 3 segundos.
señal s
a) Inmediatamente, se emitirá un pitido audible único confirmando que la unidad IONSYS funciona adecuadamente y puede ser utilizada.
b) Después de 4 minutos, IONSYS emitirá una señal sonora durante aproximadamente 15 segundos. Esto es normal e indica que IONSYS no está en contacto con la piel. Esta alarma que emite una señal sonora, no afecta a la funcionalidad del IONSYS.
Si no se oyen, ni el pitido único emitido después de la doble presión del botón de dosificación, ni la señal sonora de los 15 segundos después de 4 minutos, debe devolverse IONSYS en su embalaje intacto al fabricante. No abra el sobre y no administre así el sistema IONSYS a un paciente.
Eliminación J2T
El contacto con el gel puede ser perjudicial para los seres humanos. El personal médico y los pacientes deberán manejar el sistema usado, con cuidado y sólo por los lados y el compartimento superior. El diseño del sistema permite la eliminación por separado del compartimento rojo inferior, que contiene fentanilo y del compartimento blanco de la parte superior, que contiene la batería electrónica.
El método de eliminación del sistema IONSYS es: rpn
1. Tire de la lengüeta roja para separar el compartimento inferior del compartimento superior.
2. Doble el compartimento inferior que contiene el gel por la mitad con el lado adhesivo hacia dentro.
3. Elimine el compartimento inferior de acuerdo a la legislación local. El compartimento inferior de IONSYS usado, contiene una cantidad peligrosa de fentanilo.
4. Elimine el compartimento superior, que contiene la batería electrónica, según los procedimientos locales para desechar baterías.
Las disposiciones locales deben asegurar que los sistemas usados son devueltos de manera apropiada (por ejemplo a farmacias de hospital) para la eliminación del fentanilo residual del hidrogel y serán eliminados de acuerdo con las exigencias locales.
i?
7. TITULAR DE LA AUTORIZACION DE COMERCIALIZACION
Janssen-Cilag International NV Turnhoutseweg, 30,
B-2340 Beerse Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/326/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ REN AUTORIZACIÓN
OVACIÓN DE LA
iv'
Fecha de la primera autorización: 24 de Enero de 2006 10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea del Medicamento (EMEA) http://www.emea.europa.eu/.


A. TITULAR(ES) DE LA RESPONSABLE(S) DE

B. CONDICIONES DE LA AUTORIZACIÓN DE

A. TITULAR(ES) DE LA AUTORIZACION DE FABRICACION RESPONSABLE(S) DE
LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Janssen Pharmaceutica NV Turnhoutseweg 30 B-2340 Beerse, Belgium
B. CONDICIONES DE LA AUTORIZACION DE COMERCIALIZACION
• CONDICIONES O RESTRICCIONES DE DISPENSACIÓN Y USO
TITULAR DE LA AUTORIZACION DE COMERCIALIZACION
A
xo I: Fich
IMPUEST
TAS AL
Medicamento sujeto a prescripción médica especial y restringida (Ver anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
• CONDICIONES O RESTRICCIONES EN RELACION SEGURA Y EFICAZ DEL MEDICAMENTO
CON LA
UTILIZACION
El titular de la autorización de comercialización, antes de la co autoridades competentes en el Estado Miembro, debe poner e
$
ización y de acuerdo con las cha lo siguiente:
;vv'
Un plan educativo para médicos y profesionales sanitarios, con el propósito de minimizar el riesgo y mantener el empleo seguro y eficaz del producto. En este plan se deben tratar los siguientes puntos:
mmearrcci
en ma
Sobredosis / Infradosis Exposición accidental Mal uso/abuso/desviación Fallos mecánicos
Uso en pacientes con historia de consumo de drogas Eliminación según las exigencias locales
Un plan educativo para los pacientes, con el propósito de minimizar el riesgo y mantener el empleo seguro y eficaz del producto. La educación para los pacientes será vía un profesional sanitario. En este plan se deben tratar los siguientes puntos:
Sobredosis / Dosis inferior Exposición accid Mal uso/abuso/desviación Fallos m ecánico
Eliminación según las exigencias locales
OTRAS
AS C
ONDICIONES
El titular de la autorización de comercialización debe asegurar que existe un sistema de fármacovigilancia en funcionamiento antes de que el producto se comercialice.
El titular de la autorización de comercialización se compromete a la realización de estudios y actividades adicionales de fármacovigilancia detalladas en el Plan de Fármacovigilancia.
Cuando acontece un hito importante (Fármacovigilancia o Minimización del Riesgo) o cuando los resultados de un estudio están disponibles o a petición de la autoridad competente, en un plazo de 60 días se debe presentar, al mismo tiempo que los informes periódicos de seguridad (IPSs), un plan actualizado del manejo del riesgo de acuerdo a lo descrito en las recomendaciones del Comité Europeo de Medicamentos de uso Humano (CHMP) sobre Sistemas de Manejo del riesgo para productos medicinales de uso humano.

&
ETIQUETADO Y PROSPECTO
& $
ANEXO III
. „OSP]
<#■
O
o°
/
/

|
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR Y EL ACONDICIONAMIENTO PRIMARIO | |
|
{NATURALEZA/TIPO} | |
|
1. NOMBRE DEL MEDICAMENTO | |
|
IONSYS 40 microgramos por dosis, sistemas transdérmicos iontoforéticos. Fentanilo |
& |
|
2. PRINCIPIO(S) ACTIVO(S) |
- |
asta un r
máximo de 3,2 mg
Cada sistema libera 40 microgramos de fentanilo por dosis de 10 minutos, h;
(80 dosis).
Cada sistema contiene 10,8 mg de hidrocloruro de fentanilo equivalente a 9,7 mg de fentanilo.
vCy
3.
LISTA DE EXCIPIENTES
=
Compartimento inferior del ensamblaje:
- Tereftalato de polietileno de glico- modificado.
ico, p
- hidrogel del ánodo: agua purificada, hidróxido sódico, polacrilina y alcohol polivinilico.
óindiilcioc
- hidrogel del cátodo: citrato sódico, alcohol polivinilico, ácido cítrico anhidro, cloruro de cetilpiridina, agua purificada y cloruro sódico.
nta adhe
- electrodo del cátodo: material compuesto de trilaminato de cloruro de plata, lámina de plata, ECAT.
- adhesivo que se pega a la piel: polibutano, éster de resina.
- Plástico protector del adhesivo: película de poliéster, silicona.
- electrodo del ánodo: lámina de plata y cinta adhesiva conductora de electricidad (ECAT).
|
4. |
FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE | |
|
Sistema transdérmico iontofoi |
ético (STI); contiene un sistema + un absorbente de humedad. ► | |
|
5. |
FORMA Y VÍA(S) DE |
: ADMINISTRACIÓN |
|
Uso transdérmico. J | ||
|
6. |
ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS | |
Mantener fuera del alcance y de la vista de los niños.
Solo para uso hospitalario.
Usar inmediatamente una vez abierto.
NO USAR, SI EL SELLADO DEL SOBRE ESTÁ ROTO O SI NO HAY ABSORBENTE DE HUMEDAD O ESTE NO ESTÁ INTACTO.
Para información adicional, lea el prospecto adjunto.
|
8. FECHA DE CADUCIDAD | |
|
CAD {MM/AAAA} | |
|
9. CONDICIONES ESPECIALES DE CONSERVACIÓN | |
|
No conservar a temperatura superior de 25°C. Conservar en el envase original. |
<*> & |
No refrigerar o congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACION DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
grosa d
ADVERTENCIA: Una cantidad potencialmente peli después de su uso.
Ver el prospecto para información de eliminación.
—
e fentanilo permanece en el sistema
ón.
TITUL
11. NOMBRE Y DIRECCIÓN DEL
COMERCIALIZACION
—
Janssen-Cilag International NV Turnhoutseweg 30, B-2340 Beerse, Bélgica
__
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/326/001
13. núme:
Lote {núm ero} _
RO DE L
AR DE LA AUTORIZACION DE
LOTE DEL FABRICANTE
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a condiciones de prescripción especiales y restrictivas.
15. INSTRUCCIONES DE USO

IONSYS 40 microgramos por dosis, sistemas transdérmicos iontoforéticos. Fentanilo
&
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
{NATURALEZA/TIPO} SOBRE DE ALUMINIO_
1.
NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Contiene 10,8 mg de hidrocloruro de fentanilo equivalente a 9,7 mg de fentanilo. Uso transdérmico.
2. FORMA DE ADMINISTRACIÓN
—
Lea el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
-
_
<CAD {MM/AAAA}>
4. NÚMERO DE LOTE
<Lote> {numéro}
_
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
Un sistema + un absorbente de humedad.
meda
NT
6
OTROS
—
-
Comprobar que el siste
ma func
iona antes de abrir el sobre - ver prospecto adjunto.
nn° NCIA: U
Abrir, tirar cuidadosamente comenzando por la muesca precortada. Usar inmediatamente una vez abierto. No usar si no hay absorbente de humedad, o si no está intacto.
és de su u
ADVERTENCIA: Una cantidad potencialmente peligrosa de fentanilo permanece en el sistema después de su uso.

IONSYS 40 microgramos por dosis, sistema transdérmico iontoforético.
Fentanilo
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.

- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualqu adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto:
1. Qué es IONSYS y para qué se utiliza
2. Antes de usar IONSYS
3. Cómo usar IONSYS
4. Posibles efectos adversos
5. Conservación de IONSYS
6. Información adicional
1. QUE ES IONSYS Y PARA QUE SE UTILIZA
IONSYS es un sistema que puede manejar para controlar su dolor.
IONSYS se usa sólo en el hospital, para tratar el dolor después de una operación. Bajo la dirección del personal médico, usted controla su propio tratamiento.

tanilo, vendas adhesivas o esparadrapos, o a cualquiera de los
Tenga especial cuidado con ION
Informe a su médico o enfermera:
- si tiene problemas con sus pulmones o con la respiración
- si tiene problemas con su corazón, hígado o riñones
- si tiene dolores de cabeza o traumatismo craneal si tiene problemas de oído
si tiene eva
ciones intestinales lentas de modo anormal
Uso de otros medicamentos
Algunos medicamentos pueden afectar el mecanismo de acción de IONSYS, o favorecer la producción de efectos secundarios.
Compruebe con su médico si está usando:
- algún medicamento que produzca sedación o sueño (como otros analgésicos relacionados con la morfina, antihistamínicos o tranquilizantes)
- relajantes musculares (estos pueden ser prescritos para el dolor de espalda)
- ritonavir u otros inhibidotes del CYP3A4 (medicamentos para el tratamiento del SIDA)
antidepresivos llamados inhibidores de la MAO (monoamino-oxidasa), o si los ha tomado en los últimos 14 días
Informe a su médico o enfermera si está utilizando, o ha utilizado recientemente cualquier otro medicamento, incluso los adquiridos sin receta.
Uso de IONSYS con los alimentos y las bebidas No beba alcohol mientras lleve un dispositivo IONSYS.
Embarazo y lactancia
Consulte a su médico o farmacéutico antes de usar IONSYS, si usted está embarazada o tiene previsto quedarse embarazada. Su médico le explicará los posibles riesgos y ventajas potenciales de usar IONSYS mientras usted está embarazada. IONSYS no se debe administrar durante el parto. Si le administran IONSYS durante el parto podrían dar a su bebé un antídoto cuando nace. El tratamiento prolongado con fentanilo, el principio activo en IONSYS, puede causar síndrome de abstinencia en el bebé recién nacido.
No usar IONSYS si usted está dando el pecho. Fentanilo puede pasar a la xhe materna. Usted no debe empezar a dar el pecho hasta pasadas 24 horas de que el sistema IONSS haya sido retirado.
Conducción y uso de máquinas
No conduzca o maneje máquinas, cuando usted abandone e IONSYS porque el analgésico produce en algunas personas No maneje herramientas o máquinas.
3. CÓMO USAR IONSYS
Instrucciones para la correcta utilización


tal después de la utilización
ión de mareo o somnolencia.
el dispositivo IONSYS por usted. Sólo usted sabe la jar IONSYS para iniciar una dosis del medicamento.
:ta de medicamento, presione el sistema IONSYS en
No permita que su familia o amigos activ
magnitud de su dolor, y sólo usted debe Para asegurar que consigue la cantidad cuanto usted comience a sentir dolor.

No trague los geles. Tragar el gel que contiene fentanilo, puede causar dificultades en la respiración y poner en peligro su vida ó incluso producir la muerte. No toque el lado del pegamento del sistema o los geles ni permita que los geles entren en contacto con su boca. Si el medicamento de IONSYS entra en los ojos o en la boca podría ser perjudicial o incluso causar la muerte. No toque el lado del pegamento del sistema o los geles incluso después de que haya dejado de usar el sistema y haya sido quitado, todavía hay bastante fentanilo en el sistema como para causar dificultades respiratorias que pongan en peligro su vida o incluso la muerte.
Si usted, accidentalmente, toca los geles que están por debajo del sistema:
- Alerte a una enfermera o doctor enseguida
- Aclare sus manos con abundante agua
- No use jabón, alcohol, u otros disolventes para quitar el gel, porque pueden aumentar la capacidad del medicamento para atravesar la piel.
La enfermera o el doctor pondrán IONSYS sobre su piel, y lo quitarán o lo sustituirán cuando sea necesario. La enfermera o el doctor también quitarán el sistema antes de que usted abandone el hospital. No se lo quité o no intente volver a ponérselo usted mismo.
No permita que se moje el dispositivo IONSYS. Esto podría hacer que el dispositivo deje de funcionar o se caiga.
Dosificación
Usted puede aplicar una dosis siempre que lo necesite para su dolor, o justo antes de que haga una actividad que pueda aumentar su dolor (fisioterapia, levantarse de la cama, etc.). Cada vez que le dan un nuevo sistema IONSYS, usted puede notar que al principio necesita más dosis, que más tarde a lo largo del tratamiento.
itivo
Para iniciar una dosis de IONSYS, presione el botón firmemente, dos veces. El dispositivo comenzará a liberar una dosis de fentanilo durante aproximadamente 10 minutos.
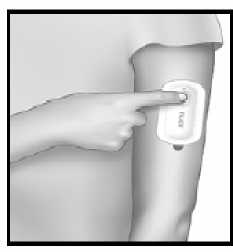
.
stración d <>V
La luz roja se enciende cuando inicia la administración de una dosis. Esta se queda encendida mientras libera el medicamento. No puede iniciar la administración de otra dosis mientras la luz esté encendida.
La luz roja parpadeará entre dosis. Cuando la luz roja comienza a parpadear, puede iniciar la administración de otra dosis en cualquier momento, si fuera necesario. Presione sólo el botón cuando necesite aliviar el dolor. Los destellos dan información a su enfermera de cuantas dosis se ha
administrado.
Cada vez que comience a administrar una dosis, oirá un pitido de IONSYS. Si el sistema emite una señal sonora en cualquier otro momento o más de una vez, coméntelo a su enfermera o doctor. Ellos comprobarán que el sistema trabaja correctamente.
0
Cada dispositivo trabaja durante 24 horas desde su primera dosis y contiene 80 dosis. El sistema IONSYS dejará de trabajar después de 24 horas o después de que hayan sido liberadas 80 dosis. En este momento el sistema se debe retirar.
Su médico o enfermera
le quita
rán el sistema IONSYS antes de que usted abandone el hospital.
Después de retirar el sistema IONSYS, podría ver una pequeña señal rojiza en la piel. Esto es común y no debe preocuparse. El área roja irá desapareciendo en los siguientes días.
Siempre use IONSYS exactamente como su doctor le ha indicado. Compruébelo con su doctor o enfermera si no está seguro.
Si usa
IONSYS del que debería
El sistema está diseñado de modo que no pueda recibir un exceso de IONSYS, proporcionando dosis sólo cuando pulsa, y sólo cuando necesita aliviar el dolor. Sin embargo, si se siente mareado o tiene dificultad para respirar, informe a un doctor o enfermera inmediatamente.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o enfermera.
4. POSIBLES EFECTOS ADVERSOS
Al igual que todos los medicamento, IONSYS puede producir efectos adversos, aunque no todas las personas los sufran.
Si se siente mareado o tiene dificultad para respirar, informe al doctor o enfermera inmediatamente.
Efectos secundarios más comunes
(estos pueden afectar a 10 de cada 100 personas o más)
Sentirse o estar mareado (náuseas,vómitos); Dolor de cabeza, enrojecimiento de la piel en el l aplicación del parche.
lugar de
Efectos secundarios menos comunes
(estos pueden afectar hasta 9 de cada 100 personas)
Mareos y somnolencia; picor; hipotensión; estreñimiento; gases; oxígeno bajo en sangre (hipoxia) que puede causar mareos o calambres; calentamiento de la piel en el sitio de aplicación del parche; retención de orina; fiebre.
c>
Efectos secundarios raros
(estos pueden afectar menos de 1 de cada 100 personas)
Catarro; ansiedad; insomnio, sueños anormales; alucinaci depresión; piel sensible; nerviosismo, temblor; vértigo; latido del corazón rápido, lento o irregular; dificultad al respirar, tos; hipo; nariz bloqueada; erupción; desmayos; dolor muscular; retención de líquidos; alteraciones en análisis bioquímicos de la sangre; boca seca; pérdida de peso; orinar con más o menos frecuencia que lo normal; dolor de estómago; enfriamientos; ciática; tensión arterial elevada; glucosa baja en sangre; eructar.
&
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
5.
El personal de hospital alm
El sistema usado también debe ser desechado por el personal médico.
No conservar a temperatura superior a 25°C.
No refrigerar o congelar.
ase orí:
Conservar en el envase original.
Mantener fuera del alcance y la vista de los niños.
6
Composición de IONSYS
El principio activo en IONSYS es fentanilo.
Los demás componentes son agua, polacrilina, alcohol polivinilico, ácido cítrico, citrato sódico, cloruro sódico, hidróxido sódico, cloruro de cetilpiridina.
El compartimento inferior está fabricado con tereftalato de polietileno de glicol modificado, y contiene: hidrogel en el ánodo, incluyendo hidrocloruro de fentanilo, polacrilina, agua purificada, hidróxido sódico, alcohol polivinilico; hidrogel en el cátodo, incluyendo agua purificada, cloruro sódico, citrato sódico, alcohol de polivinilico, ácido cítrico anhidro, cloruro de cetilpiridina; el electrodo del ánodo, conteniendo capas de láminas de plata y cinta adhesiva conductora de la electricidad; el electrodo del cátodo que consiste en capas de material compuesto de cloruro de plata, lámina de plata, y cinta adhesiva conductora de electricidad; el pegamento de la piel compuesto de una mezcla de dos poliisobutilenos, un polibutano, y un éster de resina que actúa como promotor de adhesibilidad; la capa protectora que es una película de poliéster cubierta en uno de los lados con silicona.
os con
o superior o superior ~ *
nto inferio ado h
ie se quita antes del empleo. El
Aspecto del producto y contenido del envase
IONSYS es un sistema transdérmico iontoforético (STI). El compartimento superior está fabricado con plástico blanco y contiene una batería de litio electrónica. El compartimento inferior rojo contiene el principio activo (fentanilo, un potente analgésico opioide) en un gel (llamado hidrogel), y una capa adhesiva que se usa para pegar el sistema en la piel.
La parte inferior del sistema está cubierta por una película protectora sistema y el pegamento están libres de látex.
ra que s
Titular de la Autorización de Comercialización: Janssen-Cilag International NV, Turnhoutseweg 30 B 2340 Beerse, Bélgica.
Responsable de la Fabricación: Janssen Pharmaceutica NV, Turnhoutseweg 30, B-2340 Beerse, Belgium.
O
o°
<>
&
/
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
JANSSEN-CILAG N.V./S.A. Tél/Tel: + 32 3 280 54 11
Luxembourg/Luxemburg
JANSSEN-CILAG N.V./S.A. Tél: +32 3 280 54 11
o°
France
JANSSEN-1 Tel: + 33
44

Osterreicl
JANSSEN-CILAG
+43 1 610 300
:
Bt^rapnn
npegcTaBHTencTBO Ha Johnson & Johnson d.o.o, Tea.:+359 2 489 9400(05)
Ceská republika JANSSEN-CILAG s.r.o.
Tel: +420 227 012 222
Danmark
JANSSEN-CILAG A/S Tlf: +45 45 94 82 82
Deutschland
JANSSEN-CILAG GmbH Tel: +49 2137-955-955
Eesti
JANSSEN-CILAG Polska Sp z o.o.
Eesti filiaal
Tel.: + 372 626 6500
EkXáda
JANSSEN-CILAG Tpk: +30 210 61 40 061
España
JANSSEN-CILAG, S.A.
Tel: +34 91 722 81 00 Xr
CILAG 1 55 00 44 4
Ireland
JANSSEN-CILAG Ltd.
Tel: +44 1 494 567 567
d
JANSSEN-CILAG Tel: +354 530 7100
Magyarország JANSSEN-CILAG Kft. Tel. :+36 23 513-800
Malta
AM MANGION LTD Tel: +356 2397 6000
Nederland
JANSSEN-CILAG Tel: +31 13 5
Norge
JANSSEN Tlf: + 47)5 00
Polska
JANSSEN-CILAG Polska Sp. z o.o., ul. Tel.: + 48 22 237 6000
Portugal
JANSSEN-CILAG FARMACEUTICA, LDA
Tel: +351 21-4368835 Romania
JOHNSON AND JOHNSON d.o.o Tel: +40 21 207 1800
Slovenija
Johnson & Johnson d.o.o.
Tel: + 386 1 401 18 30
Slovenská republika
Johnson & Johnson s.r.o.
Tel: +421 233 552 600
Italia
JANSSEN-CILAG SpA Tel: +39 02/2510.1
Suomi/Finland
JANSSEN-CILAG OY Puh/Tel: +358 9 4155 5300
Kúnpoq
BapváPag XaxZnnavaypg AtS
Sverige
JANSSEN-CILAG AB

Latvija United Kingdom
JANSSEN-CILAG Polska Sp. z o.o. JANSSEN-CILAG Ltd.
filíale Latvija Tel: 0800 032 3013
Talr. +371 7103007
Lietuva
UAB „Johnson & Johnson “
Tel.: +370 5 278 68 88
Este prospecto ha sido aprobado en MM/AAAA.
La información detallada de este medicamento está disponible en la página de Medicamentos (EMEA) http://www.emea.europa.eu/.

INFORMACIÓN IMPORTANTE PARA EL PROFESIONAL SANITARIO:
Instrucciones de comprobación de funcionamiento de IONSYS
Cada IONSYS se debe probar antes de que sea aplicado a un paciente, para asegurar que el sistema funciona adecuadamente. Esto se puede hacer con IONSYS todavía en su sobre sellado. No se libera ningún medicamento del sistema a no ser que IONSYS se aplique en la piel. Después de que se realice la siguiente prueba de funcionamiento, las 80 dosis y 24 horas de empleo estarán todavía disponibles:
S es redon
1. Mantenga sin abrir el sobre de aluminio que contiene IONSYS.
2. A través del tacto, determine donde está el sistema IONSYS y qué lado de IONSYS es redondeado.
3. Con el lado redondeado hacia arriba deslice un dedo a lo largo de la unidad, hasta que note el botón
al final. ....... ^ y
4. Presione el botón firmemente y suéltelo dos veces en 3 segundos.
sto confi
firma que la unidad
El sistema IONSYS emitirá inmediatamente, un pitido único audible. Est
IONSYS funciona y puede ser utilizada.
Después de 4 minutos, IONSYS emitirá una señal sonora durante aproximadamente 15 segundos. Esto es normal e indica que IONSYS no está en contacto con la piel. Esta alarma que emite una señal sonora, no afecta a la funcionalidad de IONSYS.
otón de dosificación, ni el de en su
Si no se oyen, ni el pitido emitido después de la doble presión del bot 15 segundos después de 4 minutos, se debe devolver IONSYS al fabricante en su embalaje intacto. No abra el sobre y no administre IONSYS al paciente.
wO
Instrucciones de aplicación de IONSYS
El sobre contiene un sistema IONSYS más un absorbente de humedad.
Aplicar en la piel intacta (no irritada y no irradiada) en el tórax o en la parte externa superior del brazo.
con problemas de la piel, como cicatrices, quemaduras,
zonas co
IONSYS no se debe colocar en tatuajes.
Antes de aplicar el sistem a, el vel lo, se debe cortar (no afeitar) en el lugar de aplicación.
a, el vell
Limpiar el lugar de aplicación con un algodón con alcohol y dejar que la piel se seque completamente, antes de la aplicación del sistema IONSYS.
- No use jabones, aceites, lociones, u otros agentes que pueda irritar la piel o cambiar sus características de absorción.
Abrir el sobre, co
abriendo a lo
absorbente de devuélvalo

Aplicar sobre la piel inmediatamente después de sacarlo del sobre sellado individual. - No usar si el sellado de la bolsa está roto.
rompiendo la muesca precortada, después continuar tirando con cuidado a parte superior del sobre. Una vez abierto el sobre se debe desechar el ad. Si no hay absorbente de humedad, o si no está intacto, no lo use y ricante.
Quitar y desechar el protector transparente de plástico que cubre el adhesivo.
Presionar el sistema IONSYS firmemente en la zona de la piel, con el lado adhesivo en contacto con la misma, durante al menos 15 segundos. La presión se debe aplicar con los dedos alrededor de los bordes externos, para asegurar la adherencia a la zona de la piel durante el período completo de 24 horas que se lleva puesto.
Ocasionalmente, el sistema IONSYS puede despegarse; si esto ocurre, se puede usar un esparadrapo hipoalergénico, para asegurar que todos los bordes del sistema hacen contacto completo con la piel.
- Tener cuidado de no presionar o tapar con el esparadrapo el botón o la luz roja.
IONSYS en uso

uevo darse un
Cada sistema IONSYS puede ser usado durante 24 horas desde la primera dosis o hasta que se hayan administrado 80 dosis, lo que ocurra primero. El sistema entonces se cerrará y no podrá liberar ninguna dosis adicional. De requerir analgesia de opioides adicional, se debe apli sistema IONSYS en una zona diferente de la piel después de retirar el sistema anterior. P máximo de tratamiento de 3 días.
Los pacientes no deben llevar más de un sistema IONSYS al mismo tiempo. Los sistemas usados no se deben volver a aplicar a pacientes.
Los pacientes no deben mojar el sistema IONSYS. No sumergirlo en agua. El contacto prolongado
con el agua, podría afectar el funcionamiento de sistema y hacer que el si disminuya la acción.
a funcione mal o
IONSYS se puede quitar en cualquier momento. Sin embargo, retirado, no se debe volver a aplicar el mismo sistema. Al final que 80 dosis se hayan liberado, retirar el sistema IONSYS despegando el sistema del lugar de la piel donde está aplic adicional o continuación, se puede aplicar un nuevo siste parte superior externa del brazo o en el tórax. Se pueden d; usando tres sistemas separados.
V
a vseizstqeumeaun sistema ha sido
oras de empleo o después de ado, levantando la lengüeta roja y el paciente requiere alivio del dolor una zona de la piel diferente, en la a un máximo de tratamiento de 3 días,
Liberación de la dosis
En la parte superior del sistema IONSYS se sitúan un botón de dosificación a demanda y una luz roja. Para iniciar la administración de una dosis de fentanilo, el paciente debe presionar el botón de demanda, dos veces en 3 segundos. Un pitido indica el comienzo de la liberación de dosis; la luz roja permanece encendida durante el intervalo de dosificación de 10 minutos. La dosis siguiente, no se puede iniciar hasta que se haya completado el ciclo: Si se presiona el botón durante la liberación de una dosis, no resultará en la administración de una dosis de medicamento adicional. La luz roja comienza a parpadear después de que la dosis de 10 minutos ha sido liberada.
Número aproximado de
para indicar el número

iberadas. Entre dosis, la luz roja parpadeará en pulsos de un segundo, imado de dosis administradas.
Cada pulso de luz por segundo, indica la administración de hasta cinco dosis. Así:
- un simple parpadeo ^presenta de 1 a 5 dosis
- dos parpadeos representan de 6-10 dosis
- tres parpadeos representan de 11-15 dosis
Esto continúa hasta un máximo de 16 pulsos que representan de 76-80 dosis liberadas.
Durante la administración de una dosis, el sistema puede dar información presionando el botón una vez. La luz roja parpadeará como está descrito arriba para indicar el número aproximado de dosis liberadas a demanda hasta el momento que se ha hecho la consulta. Esta consulta no influirá en la liberación de dosis.
Solución de Incidencias
Cada sistema IONSYS se diseña para liberar una dosis a demanda de fentanilo durante aproximadamente 10 minutos. Si se sospecha un fallo técnico en un sistema, el personal facultativo o el paciente deben supervisar tanto la iluminación de la luz roja como cualquier señal audible (pitidos) durante la dosis siguiente. La tabla siguiente representa los diferentes mensajes de error que pueden ocurrir, junto con la acción apropiada a tomar:
|
Mensajes de Error Frecuentes |
Acción |
|
2 pitidos repetidos 8 veces (aproximadamente 15 segundos) y la luz roja se apaga antes de 10 minutos |
Se pueden hacer hasta 2 intentos más, para solicitar una nueva liberación. Si todos los intentos fallan, se debe retirar el sistema y aplicar uno nuevo, en una nueva zona de la piel. |
|
4 pitidos continuos y la luz roja se apaga antes de 10 minutos |
El sistema no puede ser reiniciado de nuevo. Se debe retirar el sistema y aplicar uno nuevo, en una zona nueva de la piel. |
|
Fallos en la iluminación de la luz roja |
Se debe retirar el sistema y aplicar uno nuevo, en una nueva zona de la piel. |
Eliminación Segura de IONSYS
El sistema usado debe ser eliminado sólo por el personal médico.
El contacto con el gel de fentanilo puede ser perjudicial para los seres humanos. Manejar el sistema usado con cuidado y sólo por los lados y el compartimento superior. El parche usado se debe eliminar como residuo médico conforme a regulaciones locales.
Si lo requieren las regulaciones locales, el diseño del sistema permite una eliminación separada del compartimento rojo inferior, que contiene fentanilo y el compartimento blanco de la parte superior, que contiene la batería electrónica. El método de eliminación del sistema IONSYS es:
1.
2.
3.
Tire de la lengüeta roja para separar el compartimento inferior del compartimento superior. Doble el compartimento inferior que contiene el gel por la mitad con el lado adhesivo hacia dentro.
Elimine el compartimento inferior de acuerdo a la legislación local. El compartimento inferior de IONSYS usado, contiene una cantidad peligrosa de fentanilo.
Elimine el compartimento superior, conteniendo la batería electrónica, según los
inferior d
o, co ntiene una cantidad peligrosa de fentanilo.
procedimientos locales para estos residuos.
/
34