Humulina Regular Pen 100 Ui/Ml, Solucion Inyectable En Pluma Precargada
Información obsoleta, busque otroFT070403-A
DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
1 | |
|
Oí |
k agencia española de 1 medicamentos y I productos sanitarios |
|
Humulina Regular 100 UI/ml, solución inyectable (Inyección de insulina soluble) |
Vial de 10 ml. Cartuchos de 3 ml, para su uso en una pluma recargable. Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml. (Humaplus Regular). Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml. (Humulina Regular Pen). |
|
Humulina NPH 100 UI/ml, suspensión inyectable (Inyección de insulina isófana) |
Vial de 10 ml. Cartuchos de 3 ml, para su uso en una pluma recargable. Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml.(Humaplus NPH). Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml. (Humulina NPH Pen). |
|
Humulina 10:90 100 UI/ml, suspensión inyectable (Inyección de insulina isófana bifásica) (20% de insulina soluble y 80% de insulina isófana) |
Vial de 10 ml. Cartuchos de 3 ml, para su uso en una pluma recargable. |
|
Humulina 20:80 100 UI/ml, suspensión inyectable (Inyección de insulina isófana bifásica) (20% de insulina soluble y 80% de insulina isófana) |
Vial de 10 ml. Cartuchos de 3 ml, para su uso en una pluma recargable. Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml. (Humaplus 20:80). Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml. (Humulina 20:80 Pen). |
|
Humulina 30:70 100 UI/ml, suspensión inyectable (Inyección de insulina isófana bifásica) (30% de insulina soluble y 70% de insulina isófana) |
Vial de 10 ml. Cartuchos de 3 ml, para su uso en una pluma recargable. Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml. (Humaplus 30:70). Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml. (Humulina 30:70 Pen). |
|
Humulina 40:60 100 UI/ml, suspensión inyectable (Inyección de insulina isófana bifásica) (20% de insulina soluble y 80% de insulina isófana) |
Cartuchos de 3 ml, para su uso en una pluma recargable. |
|
Humulina 50:50 100 UI/ml, suspensión inyectable (Inyección de insulina isófana bifásica) (50% de insulina soluble y 50% de insulina isófana) |
Vial de 10 ml. Cartuchos de 3 ml, para su uso en una pluma recargable. Dispositivos de inyección, tipo pluma, desechables, precargados con un cartucho de 3 ml. (Humaplus 50:50). |
|
Humulina Lenta 100 UI/ml, suspensión inyectable (Suspensión inyectable de insulina zinc) |
Vial de 10 ml. |
|
Humulina Ultralenta 100 UI/ml, suspensión inyectable (Suspensión cristalina inyectable de insulina zinc) |
Vial de 10 ml. |
Correo electrúnicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Humulina y Humaplus son las marcas registradas a las que se refiere este documento. Las formulaciones anteriormente citadas reciben también otros nombres dentro de la Unión Europea. Por ejemplo: Regular se llama también Soluble; NPH se llama también Isófana; Ultralenta se llama también Zinc; 10:90, 20:80, 30:70, 40:60 y 50:50 se llaman también Mezcla o Perfil 1, Mezcla o Perfil 2, etc.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml contiene 100 UI de insulina humana (producido en cepas de E.coli por tecnología de ADN recombinante).
1 vial contiene 10 ml que equivalen a 1000 UI.
1 cartucho contiene 3 ml que equivalen a 300 UI.
1 pluma precargada contiene 3 ml que equivalen a 300 UI.
Lista de excipientes, ver epígrafe 6.1
3. FORMA FARMACÉUTICA
Solución o suspensión inyectable en:
A. Cartuchos para administrarse con:
i. Dispositivos reutilizables.
Cada cartucho se ha de utilizar en una pluma con marcado CE, según se indica en la información que proporciona el fabricante de la pluma.
o
ii. Dispositivos de inyección, tipo pluma, precargados desechables.
Humaplus es un dispositivo de inyección, tipo pluma, desechable, precargado con un cartucho de
3,0 ml. Cada pluma Humaplus dispensa hasta un máximo de 96 unidades por inyección, con incrementos de dos unidades.
Humulina Pen es un dispositivo de inyección, tipo pluma, desechable, precargado con un cartucho de 3,0 ml. Cada pluma Humulina Pen dispensa hasta un máximo 60 unidades por inyección, con incrementos de una unidad.
B. Viales:
Vial de 10 ml para usar junto con una jeringuilla adecuada (con marcas para 100 UI/ml).
Humulina Regular es una solución acuosa, estéril, clara e incolora de insulina humana ajustada a un pH entre 7,0 y 7,8.
Humulina Regular es un preparado de insulina de acción rápida.
Humulina NPH es una suspensión estéril de un precipitado blanco y cristalino de insulina humana isófana en un tampón isotónico de fosfato, ajustada a un pH entre 6,9 y 7,5.
Humulina NPH es un preparado de insulina de acción intermedia.
Humulina 10:90, 20:80, 30:70, 40:60 y 50:50 son suspensiones estériles de insulina humana en la proporción de 10%, 20%, 30%, 40% y 50% de insulina soluble y 90%, 80%, 70%, 60% y 50% de insulina isófana respectivamente, ajustadas a un pH entre 6,9 y 7,5.
Estas mezclas de Humulina son preparados de insulina de acción intermedia.
Humulina Lenta es una suspensión estéril de insulina humana zinc en suspensión, en la proporción de 30% amorfa y 70% cristalina, ajustada a un pH entre 7,0 y 7,8.
Humulina Lenta es un preparado de insulina de acción intermedia.
Humulina Ultralenta es una suspensión blanca, estéril, de insulina humana cristalina zinc en suspensión, ajustada a un pH entre 7,0 y 7,8.
Humulina Ultralenta es un preparado de insulina de acción prolongada.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de pacientes con diabetes mellitus que requieran insulina para el mantenimiento del control glucémico. Humulina también está indicada para el control inicial de la diabetes mellitus y de la diabetes mellitus en el embarazo.
4.2 Posología y forma de administración
La dosis debe ser determinada por el médico, según los requerimientos del paciente.
Humulina Regular debe ser administrada por inyección subcutánea y puede, aunque no es recomendable, ser administrada por inyección intramuscular. También puede ser administrada por vía intravenosa.
Las Humulinas NPH, mezclas, Lenta y Ultralenta en viales y NPH y Mezclas en cartuchos se deben administrar por inyección subcutánea y pueden, aunque no es recomendable, administrarse por vía intramuscular. Estas formulaciones no se deben administrar por vía intravenosa.
La administración subcutánea se debe realizar en la zona superior de los brazos, muslos, nalgas o abdomen. La utilización de estas zonas de inyección debe alternarse, de tal forma que un mismo lugar de inyección no se utilice más de una vez al mes aproximadamente.
Hay que tomar precauciones cuando se inyecte cualquier preparación de Humulina para tener la seguridad de no haber penetrado un vaso sanguíneo. Después de la inyección de insulina, no debe realizarse masaje en la zona de inyección. Se debe enseñar a los pacientes las técnicas de inyección correctas.
Se puede administrar Humulina NPH, Lenta y Ultralenta en combinación con Humulina Regular (ver 6.6 Instrucciones de uso, manipulación y eliminación, epígrafe Mezcla de insulinas).
Las mezclas de Humulina son formulaciones con una mezcla previa definida de insulina soluble e insulina isófana, para evitar que el paciente tenga que realizarla. El régimen de tratamiento de cada paciente se debe establecer en función de sus necesidades metabólicas.
4.3 Contraindicaciones
Hipoglucemia.
Hipersensibilidad a Humulina o a los excipientes de las formulaciones, a menos que forme parte de un programa de desensibilización.
Bajo ninguna circunstancia se deberá utilizar por vía intravenosa otra formulación que no sea Humulina Regular.
4.4 Advertencias y precauciones especiales de empleo
La decisión de modificar el tipo o marca de insulina administrada a un paciente, se debe tomar bajo estricta supervisión médica. Los cambios en la concentración, nombre comercial (fabricante), tipo (Regular, NPH, Lenta, etc.), especie (animal, humana, análogo de insulina humana) y/o método de fabricación (técnicas de DNA recombinante frente a insulina de origen animal) pueden dar lugar a la necesidad de un cambio en la dosis.
Los pacientes tratados con insulina humana pueden requerir un cambio en la dosis con respecto a la utilizada con insulinas de origen animal. Si fuese necesario hacer algún ajuste éste podría producirse con la primera dosis o durante las primeras semanas o meses.
Algunos pacientes que han experimentado reacciones hipoglucémicas tras el cambio a insulina humana, han comunicado que los síntomas tempranos de alarma fueron menos pronunciados o diferentes de los que experimentaban con su insulina animal previa. Los pacientes cuyo control glucémico esté muy mejorado, por ejemplo mediante pautas insulínicas intensificadas, pueden perder alguno o todos los síntomas de alarma de hipoglucemia; por ello, se les debe avisar convenientemente. Otros factores que pueden hacer que los síntomas de alarma iniciales de hipoglucemia sean diferentes o menos pronunciados son diabetes de larga duración, afectación neurológica de origen diabético o fármacos como por ejemplo los beta bloqueantes. La falta de corrección de las reacciones hipoglucémicas o hiperglucémicas puede ser causa de pérdida de conciencia, coma o muerte.
El uso de dosis que no sean adecuadas o la supresión del tratamiento, especialmente en diabéticos insulino-dependientes, puede producir hiperglucemia y cetoacidosis diabética; ambas situaciones son potencialmente letales.
El tratamiento con insulina humana puede producir la formación de anticuerpos, aunque los títulos de anticuerpos son inferiores a los producidos por insulinas animales purificadas.
Los requerimientos de insulina pueden cambiar significativamente en presencia de una enfermedad de las glándulas adrenales, tiroidea o pituitaria y en presencia de alteraciones renales o hepáticas.
Los requerimientos de insulina pueden aumentar debido a una enfermedad o a alteraciones emocionales.
También puede ser necesario un ajuste de la dosis de insulina si los pacientes cambian la intensidad de su actividad física o modifican su dieta habitual.
4.5 Interacción con otros medicamentos y otras formas de interacción
Algunos medicamentos interaccionan con el metabolismo de la glucosa. El médico debería tener en cuenta estas posibles interacciones y preguntar a los pacientes si toman otros medicamentos además de la insulina humana.
Los requerimientos de insulina pueden aumentar debido a medicamentos con actividad hiperglucemiante, tales como glucocorticoides, hormonas tiroideas, danazol, simpaticomiméticos beta2 (tales como ritodrina, salbutamol, terbutalina), tiazidas.
Los requerimientos de insulina pueden disminuir en presencia de medicamentos con actividad hipoglucemiante, tales como hipoglucemiantes orales, salicilatos (por ejemplo, ácido acetil salicílico), ciertos antidepresivos (inhibidores de la monoamino oxidasa), ciertos inhibidores del enzima convertidor de la angiotensina (IECAS) (captopril, enalapril), agentes betabloqueantes no selectivos y alcohol.
Los análogos de somatostatina (octeotrida, lanreotida) pueden disminuir e incrementar los requerimientos de insulina.
4.6 Embarazo y lactancia
Es esencial mantener un buen control de las pacientes tratadas con insulina (diabetes insulino-dependiente o diabetes gestacional), a lo largo de todo el embarazo. Los requerimientos de insulina habitualmente disminuyen durante el primer trimestre y se incrementan durante el segundo y tercer trimestres. Debe aconsejarse a las pacientes con diabetes que informen a sus médicos si están embarazadas o si piensan quedarse embarazadas.
Una cuidadosa monitorización del control glucémico, así como de la salud en general, son esenciales en mujeres embarazadas con diabetes.
Las pacientes diabéticas, durante el periodo de lactancia, pueden requerir un ajuste de la dosis de insulina y/o de la dieta.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La capacidad de concentración y de reacción de los pacientes diabéticos puede verse afectada por una hipoglucemia. Esto puede ser causa de riesgo en situaciones que precisen un estado especial de alerta, como el conducir automóviles o manejar maquinaria.
Debe advertirse a los pacientes que extremen las precauciones para evitar una hipoglucemia mientras conducen, esto es particularmente importante en aquellos pacientes con una reducción en su capacidad para percibir los síntomas de una hipoglucemia, o que padecen hipoglucemia recurrente.
Se considerará la conveniencia de conducir en estas circunstancias.
4.8 Reacciones adversas
La hipoglucemia es la reacción adversa que con más frecuencia puede sufrir un paciente diabético durante la terapia con insulina. Una hipoglucemia grave puede producir la pérdida de conciencia y, en casos extremos, muerte.
Una alergia local en los pacientes se manifiesta como enrojecimiento, hinchazón y picor en el lugar de inyección de la insulina. En general, esta situación remite al cabo de unos días o semanas. En algunos casos, esta reacción puede ser debida a factores distintos a la insulina, tales como irritantes en el agente limpiador de la piel o a una mala técnica de inyección.
La alergia sistémica, menos común pero potencialmente más grave, es una alergia generalizada a la insulina. Puede producir una erupción en todo el cuerpo, dificultad respiratoria, sibilancias, disminución de la presión arterial, aceleración del pulso o sudoración. Los casos graves de alergia generalizada pueden poner en peligro la vida del enfermo. En el caso poco frecuente de una alergia grave a Humulina, ésta requiere tratamiento inmediato. Puede ser necesario un cambio de insulina o un tratamiento de desensibilización.
Puede aparecer lipodistrofia en el lugar de la inyección.
4.9 Sobredosis
La insulina no tiene una definición específica de sobredosificación. Las concentraciones séricas de glucosa son el resultado de interacciones complejas entre los niveles de insulina, disponibilidad de glucosa y otros procesos metabólicos. La hipoglucemia puede producirse como resultado de un exceso de insulina en relación con la ingesta calórica y el gasto energético.
La hipoglucemia puede estar asociada con apatía, confusión, palpitaciones, dolor de cabeza, sudoración y vómitos.
Los episodios leves de hipoglucemia responderán a la administración oral de glucosa o productos azucarados.
La corrección de un episodio de hipoglucemia moderadamente grave puede realizarse mediante la administración intramuscular o subcutánea de glucagón, seguida de la administración por vía oral de carbohidratos cuando la recuperación del paciente sea suficiente. Los pacientes que no respondan a glucagón, deben recibir una solución intravenosa de glucosa.
Si el paciente está comatoso, debe administrarse glucagón por vía subcutánea o intramuscular. Sin embargo, si el glucagón no está disponible o el paciente no responde a glucagón, debe administrarse una solución de glucosa por vía intravenosa. El paciente debe recibir alimentos tan pronto como recobre la conciencia.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: insulinas.
Código ATC: Humulina Regular A10A B01,
Humulina NPH A10A C01,
Mezclas de Humulina A10A D01,
Humulina Lenta A10A E01,
Humulina Ultralenta A10A E01.
La principal acción de la insulina es la regulación del metabolismo de la glucosa.
Además, la insulina tiene diversas acciones anabólicas y anti-catabólicas sobre una variedad de tejidos. Dentro del tejido muscular se incluyen el incremento de glucógeno, ácidos grasos, glicerol, síntesis proteica y captación de aminoácidos, mientras que disminuye la glucogenolisis, gluconeogénesis, cetogénesis, lipolisis, catabolismo protéico y la pérdida de aminoácidos.
El perfil de actividad típico (curva de utilización de glucosa), tras la administración subcutánea se ilustra en las gráficas siguientes (línea más clara). Las variaciones que un determinado paciente puede experimentar en los tiempos y/o la intensidad de la actividad de la insulina se ilustran por el área sombreada. La variabilidad individual dependerá de factores tales como la dosis, lugar de inyección, temperatura y actividad física del paciente.
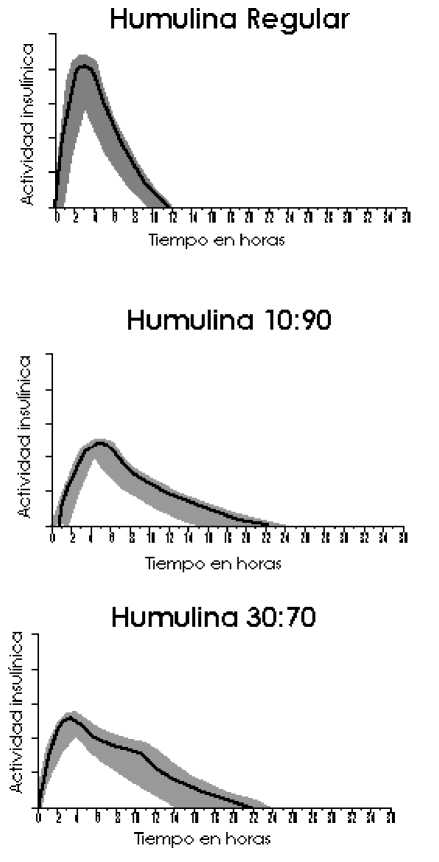
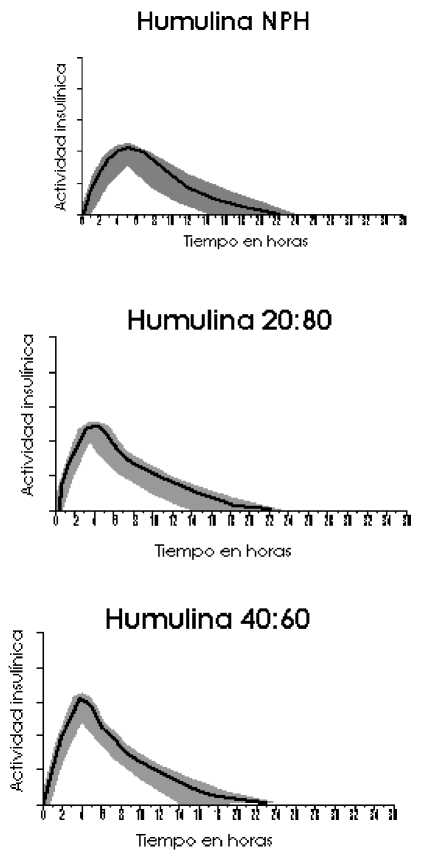
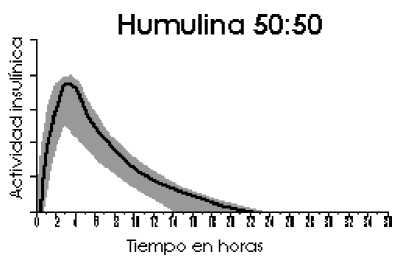
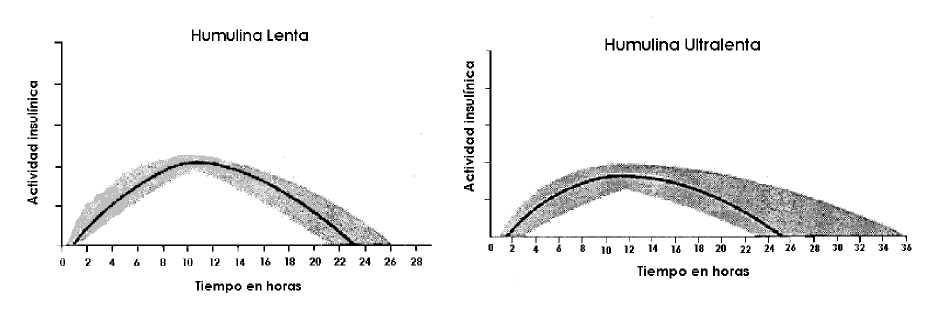
5.2 Propiedades farmacocinéticas
La farmacocinética de la insulina no refleja la acción metabólica de esta hormona. Por lo tanto, es más apropiado examinar las curvas de utilización de glucosa (tal y como se comentó anteriormente), cuando se considera la actividad insulínica.
5.3 Datos preclínicos sobre seguridad
Humulina es insulina humana producida por técnicas de recombinación. No se han comunicado acontecimientos graves en estudios subcrónicos de toxicología. En una serie de ensayos de toxicidad genética in vitro e in vivo la insulina humana no ha demostrado actividad mutagénica.
6. DATOS FARMACÉUTICOS 6.1 Lista de Excipientes
Para las presentaciones de Humulina Regular
m-cresol
glicerol
agua para inyección
Se pueden utilizar para ajustar el pH:
Ácido clorhídrico y/o Hidróxido de sodio

Para las presentaciones de Humulina NPH y Humulina mezclas m-cresol
glicerol
fenol
sulfato de protamina fosfato de sodio dibásico óxido de zinc agua para inyección
Se pueden utilizar para ajustar el pH: ácido clorhídrico y/o hidróxido de sodio
Para las presentaciones de Humulina Lenta y Ultralenta
acetato de sodio cloruro de sodio metilparabeno agua para inyección óxido de zinc
Se pueden utilizar para ajustar el pH: ácido clorhídrico y/o hidróxido de sodio
6.2 Incompatibilidades
Los preparados de humulina no deben mezclarse con insulinas producidas por otros fabricantes o con preparados de insulina animal.
6.3 Periodo de validez
El periodo de validez de Humulina Regular, NPH, Ultralenta y Mezclas es de dos años.
El periodo de validez de Humulina Lenta es de 18 meses.
Una vez en uso, todas las presentaciones se pueden utilizar hasta un máximo de 28 días.
6.4 Precauciones especiales de conservación
Conservar entre 2°C y 8°C (en un frigorífico).
No congelar. No exponer al calor excesivo ni a la luz solar directa.
Mantener en el embalaje externo.
Una vez en uso, los viales de Humulina, cartuchos y las plumas precargadas se pueden utilizar durante un máximo de 28 días. No se pueden utilizar después de dicho periodo.
Una vez en uso, los viales y cartuchos de Humulina y las plumas precargadas no deben guardarse a una temperatura superior a 30°C.

6.5 Naturaleza y contenido del recipiente
Viales de Humulina: el producto se presenta en viales que cumplen los requerimientos de la Farmacopea Europea para vidrio flint Tipo I, cerrados con tapones de goma y precintados con un sello de aluminio combinados con un plástico “flip top”.
Cada envase contiene un vial de 10 ml.
En algunos países las presentaciones Humulina 30:70, Regular, NPH, Lenta y Ultralenta se encuentran, además, comercializadas en envases conteniendo dos viales de 10 ml.
Cartuchos de Humulina , Humaplus y Humulina Pen: el producto se presenta en cartuchos que cumplen los requerimientos de la Farmacopea Europea para vidrio flint Tipo I, sellados con tapones de goma consistentes en un émbolo en la parte inferior y un precinto de sellado en la parte superior del cartucho.
Cartuchos de Humulina 3 ml:
Cada envase contiene 6 cartuchos de 3 ml.
Plumas precargadas Humaplus:
Cada envase contiene 6 plumas de 3 ml.
Plumas precargadas Humulina Pen:
Cada envase contiene 6 plumas de 3 ml.
Puede que no estén comercializadas todas las presentaciones en todos los países.
6.6 Instrucciones de uso, manipulación y eliminación
a) Preparación de la dosis
Los viales, cartuchos o plumas precargadas que contengan Humulina Regular, no requieren resuspensión y deben ser utilizados solamente si la solución es transparente, incolora, sin partículas sólidas visibles y si tiene una apariencia acuosa.
Los viales que contengan formulaciones de Humulina NPH, Mezclas, Lenta y Ultralenta deben moverse varias veces entre las palmas de las manos, antes de su utilización, para resuspender la insulina completamente. Los cartuchos o las plumas precargadas que contengan formulaciones de Humulina NPH y Mezclas se deben mover entre las palmas de las manos 10 veces e invertirlas 180° 10 veces para resuspender la insulina, inmediatamente antes de su utilización, hasta que el preparado aparezca uniformemente turbio o lechoso. En caso contrario, repita el procedimiento indicado anteriormente hasta que se hayan mezclado los componentes. Los cartuchos contienen una pequeña perla de cristal para favorecer la mezcla. No agitar fuertemente ya que se puede producir espuma que interferiría en la correcta medida de la dosis.
Los cartuchos, plumas y viales deben ser examinados frecuentemente y no deben ser utilizados si hay acúmulos de material o partículas sólidas blancas adheridas en el fondo o en las paredes del cartucho o vial, dándole una apariencia similar a la escarcha.
Los cartuchos y plumas no están diseñados para permitir que ninguna otra insulina sea mezclada en el cartucho. Los cartuchos y plumas no están diseñados para ser rellenados.
Mezcla de insulinas: en primer lugar se debe introducir en la jeringuilla la insulina de acción más rápida, para prevenir la contaminación del vial o del cartucho por la preparación de acción retardada. Es aconsejable inyectar directamente después de hacer la mezcla. Sin embargo, si fuese necesario retrasar la inyección, se deberá seguir una rutina adecuada.
Alternativamente, se puede utilizar una jeringuilla o un cartucho de Humulina Regular y de NPH por separado para administrar la cantidad correcta de cada formulación.
Viales
Preparar la jeringuilla antes de la inyección, como le indique su médico o educador en diabetes. Utilice una jeringuilla de insulina cuyas marcas correspondan a la concentración de 100 UI/ml.
Cartuchos y plumas precargadas
i) Dispositivos reutilizables
Para cargar el cartucho, ajustar la aguja y administrar la inyección de insulina se deben seguir las instrucciones del fabricante con cada una de las plumas.
ii) Dispositivos de inyección, tipo pluma, precargados desechables
Para ajustar la aguja y administrar la inyección de insulina se deben seguir las instrucciones que se acompañan con la pluma precargada.
En las plumas precargadas se debe colocar siempre la aguja antes de purgar, establecer la dosis e inyectar una dosis de insulina. Las plumas Humaplus y Humulina Pen se deben purgar siempre antes de cada inyección. Si las plumas precargadas no se purgan la dosificación puede ser incorrecta.
b) Inyección de la dosis
Inyectar la dosis correcta de insulina tal y como le haya indicado su médico o educador en diabetes.
Las zonas de inyección deben alternarse de tal forma que un mismo lugar de inyección no se utilice más de una vez al mes aproximadamente.
En cada envase se incluye un prospecto de información para el paciente con instrucciones sobre cómo inyectar la insulina.
c) Eliminación de agujas y envases utilizados
No reutilice las agujas. Deseche la aguja de forma responsable. No se deben compartir ni las agujas ni las plumas. Se pueden utilizar los viales, cartuchos y plumas precargadas hasta que se vacíen; luego se deben desechar adecuadamente.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Humulina está actualmente aprobado en toda la Comunidad Europea. Los titulares de las autorizaciones de comercialización en cada estado miembro son las correspondientes afiliadas de la compañía Lilly o los comercializadores autorizados.
En España el titular de todas las presentaciones de Humulina es Lilly, S.A., Avda. de la Industria n° 30. 28108 Alcobendas, Madrid, a excepción de Humulina Lenta 100 UI/ml suspensión inectable en viales y Humulina Ultralenta 100 UI/ml suspensión inyectable en viales, cuyo titular es Lilly France S. A.S., Rue du Colonel Lilly, 67640 Fegersheim, Francia.
8. NÚMERO(S) DEL REGISTRO DE MEDICAMENTOS
Las presentaciones de Humulina y Humaplus están registradas en España con los siguientes números:
VIALES: Humulina Regular 100 UI: 56.317; Humulina NPH 100 UI: 56.318; Humulina 10:90 100 UI: 58.141; Humulina 20:80 100 UI: 58.142; Humulina 30:70 100 UI: 58.149; Humulina 40:60 100 UI: 59.870; Humulina 50:50 100 UI: 59.871; Humulina Lenta 100 UI: 58.147; Humulina Ultralenta 100 UI: 58.165.
CARTUCHOS: Humulina Regular 100 UI: 60.566; Humulina NPH 100 UI: 60.567; Humulina 10:90 100 UI: 60.561; Humulina 20:80 100 UI: 60.562; Humulina 30:70 100 UI: 60.563; Humulina 40:60 100 UI: 60.564; Humulina 50:50 100 UI: 60.565.
PLUMAS: Humaplus Regular 100 UI: 60.573; Humaplus NPH 100 UI: 60.574; Humaplus 20:80 100 UI: 60.569; Humaplus 30:70 100 UI: 60.570; Humaplus 50:50 100 UI: 60.572.
Humulina Regular Pen: 62.244; Humulina NPH Pen: 62.243; Humulina 20:80 Pen: 62.239; Humulina 30:70 Pen: 62.240.
9. FECHA DE LA PRIMERA AUTORIZACIÓN O DE LA RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la Revalidación europea para viales, cartuchos y Humaplus: 24 de abril de 2001.
Fecha de la Revalidación europea para Humulina Pen: 19 de septiembre de 2002.
10. FECHA DE LA REVISIÓN DEL TEXTO: Diciembre 2004
Agencia española de
medicamentos y
productos sanitarios