Dorzolamida / Timolol Dr. Gerhard Mann 20 Mg/Ml + 5 Mg/Ml Colirio En Solucion
Información obsoleta, busque otrofjljp
am
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Dorzolamida/Timolol Dr. Gerhard Mann 20 mg/ml + 5 mg/ml colirio en solución
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene 22,26 mg de dorzolamida hidrocloruro, equivalente a 20 mg de dorzolamida y 6,83 mg de maleato de timolol, lo que corresponde a 5 mg de timolol.
Excipientes: cloruro de benzalconio 0,075 mg/ml
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Colirio en solución (colirio)
Dorzolamida/Timolol Dr. Gerhard Mann colirio en solución es una solución estéril transparente de incolora a un color amarillo claro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Indicado en el tratamiento de la presión intraocular (PIO) elevada en pacientes con glaucoma de ángulo abierto o glaucoma pseudoexfoliativo cuando la monoterapia con un betabloqueante tópico no sea suficiente.
4.2 Posología y forma de administración Posología
Adultos
La dosis es de una gota en el saco conjuntival de cada ojo afectado dos veces al día.
Si se está utilizando otro medicamento oftálmico, Dorzolamida/Timolol Dr. Gerhard y el otro medicamento se deben administrar con un intervalo de al menos diez minutos de diferencia.
Se debe advertirse a los pacientes que se laven las manos antes de la administración y que eviten que el extremo del cuentagotas entre en contacto con los ojos o el área circundante.
Además, se debe informar a los pacientes de que los colirios, si se manipulan incorrectamente, se pueden contaminar con bacterias ubicuas, capaces de producir infecciones oculares. La utilización de colirios contaminados puede dar lugar a daño ocular grave, con la subsiguiente pérdida de visión.
Se debe informar a los pacientes acerca de la correcta manipulación del frasco.
Instrucciones de uso
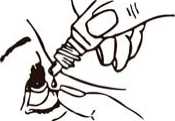
1. Lávese las manos y siéntese cómodamente o permanezca de pie en una postura cómoda.
2. Desenrosque la tapa.
3. Incline la cabeza hacia atrás.
4. Con el dedo, tire ligeramente hacia abajo del párpado inferior del ojo afectado.
5. Invierta el frasco y coloque el extremo del frasco próximo al ojo pero sin tocarlo.
NO TOQUE EL OJO O EL PÁRPADO CON EL EXTREMO DEL CUENTAGOTAS.
MINISTB?K) DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia españo¡aóe medrcametilos y producios sanéanos

6. Presione suavemente el frasco hasta que caiga una gota en el ojo y, a continuación, suelte el párpado inferior.
7. Cierre el ojo y presione con el dedo el extremo del ojo afectado más próximo a la nariz. Manténgalo presionado durante 1 minuto.
8. Repita la misma operación en el otro ojo si el médico le ha indicado que lo haga.
9. Cierre el frasco volviendo a colocar la tapa.
Población pediátrica
4.3 Contraindicaciones
Dorzolamida/Timolol Dr. Gerhard Mann está contraindicado en pacientes con:
Hipersensibilidad a uno o a los dos principios activos o a alguno de los excipientes.
Enfermedad reactiva de las vías respiratorias, incluyendo asma bronquial o antecedentes de asma bronquial, o enfermedad pulmonar obstructiva crónica grave
Insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) o acidosis hiperclorémica
Estas contraindicaciones están basadas en los principios activos respectivos y no son exclusivas de la combinación de ambos.
4.4 Advertencias y precauciones especiales de empleo
Insuficiencia hepática
Dorzolamida/Timolol Dr. Gerhard Mann no se ha estudiado en pacientes con disfunción hepática, por lo que se debe utilizar con precaución en estos pacientes.
Inmunología e hipersensibilidad
Como con otros medicamentos oftálmicos de administración tópica, este medicamento puede absorberse sistémicamente. Dorzolamida contiene un grupo sulfonamido que también está presente en las sulfonamidas. Por lo tanto, con la administración tópica se pueden presentar las mismas reacciones adversas observadas en el tratamiento sistémico con sulfonamidas. Si se presentan signos de reacciones graves o de hipersensibilidad, se debe interrumpir el uso de este medicamento.
Durante el tratamiento con Dorzolamida/Timolol Dr. Gerhard Mann se han observado reacciones adversas oculares locales, similares a las observadas con dorzolamida hidrocloruro colirio. Si se producen estas reacciones, se debe considerar la interrupción del tratamiento con Dorzolamida/Timolol Dr. Gerhard Mann.Durante la administración de betabloqueantes, los pacientes con antecedentes de atopia o reacción anafiláctica grave a diversos alérgenos pueden ser más sensibles de lo normal a la exposición repetida accidental, diagnóstica o terapéutica a dichos alérgenos. Estos pacientes pueden no responder a la dosis habitual de epinefrina utilizada en el tratamiento de las reacciones anafilácticas.
MINISTBÍIODE
sanidad, pamc A SOCIAL E IGUALDAD

an
Tratamiento concomitante
No se recomienda la administración concomitante de los medicamentos siguientes:
> dorzolamida e inhibidores orales de la anhidrasa carbónica
> bloqueantes de los receptores beta adrenérgicos tópicos.
Interrupción del tratamiento
Al igual que con los betabloqueantes sistémicos, si resulta necesario interrumpir la administración del colirio de maleato de timolol en pacientes con cardiopatía coronaria, el tratamiento se debe disminuir gradualmente .
Efectos adicionales del tratamiento con betabloqueantes
El tratamiento con betabloqueantes puede enmascarar algunos síntomas de hipoglucemia en pacientes con diabetes mellitus o hipoglucemia.
El tratamiento con betabloqueantes puede enmascarar algunos síntomas de hipertiroidismo. La suspensión brusca del tratamiento con betabloqueantes puede precipitar un agravamiento de los síntomas.
El tratamiento con betabloqueantes puede agravar los síntomas de miastenia gravis.
Efectos adicionales de la inhibición de la anhidrasa carbónica
El tratamiento con inhibidores orales de la anhidrasa carbónica se ha asociado a urolitiasis como consecuencia de alteraciones del equilibrio acidobásico, especialmente en pacientes con antecedentes de cálculos renales. Aunque no se han observado alteraciones del equilibrio acidobásico con Dorzolamida/Timolol Dr. Gerhard Mann, se han notificado raramente casos de urolitiasis. Como Dorzolamida/Timolol Dr. Gerhard Mann contiene un inhibidor tópico de la anhidrasa carbónica que se absorbe sistémicamente, los pacientes con antecedentes de cálculos renales pueden presentar un riesgo mayor de urolitiasis durante el tratamiento con este medicamento.
Otros
El tratamiento de los pacientes con glaucoma agudo de ángulo cerrado requiere intervenciones terapéuticas complementarias, además de la administración de hipotensores oculares Dorzolamida/Timolol Dr. Gerhard Mann no se ha estudiado en pacientes con glaucoma agudo de ángulo cerrado.
Durante el tratamiento con dorzolamida, se han notificado casos de edema corneal y descompensación corneal irreversible en pacientes con defectos corneales crónicos preexistentes y/o antecedentes de cirugía intraocular. Dorzolamida tópica se debe utilizar con precaución en estos pacienteDespués de cirugía de filtración, se ha notificado desprendimiento de la coroides en combinación con hipotensión ocular con la administración de medicamentos que inhiben la producción de humor acuoso.
Al igual que con el uso de otros medicamentos antiglaucoma, se ha notificado una disminución de la respuesta a colirios de maleato de timolol en algunos pacientes después de un tratamiento prolongado. No obstante, en ensayos clínicos en los que se hizo un seguimiento de 164 pacientes durante al menos 3 años, no se observó ningún cambio significativo en la presión intraocular media después de la estabilización inicial.
Uso de lentes de contacto
Dorzolamida/Timolol Dr. Gerhard Mann puede producir irritación ocular, ya que contiene cloruro de benzalconio como conservante. Evitar el contacto con las lentes de contacto blandas.
Retirar las lentes de contacto antes de la aplicación y, esperar al menos 15 minutos antes de volver a colocarlas. El cloruro de benzalconio produce la decoloración de las lentes de contacto blandas.
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agenos espanta oe mescamemos y productos san liares
íkti
Efectos cuando se utilizan incorrectamente para fines de dopaje
En las pruebas de dopaje, el uso de Dorzolamida/Timolol Dr. Gerhard Mann puede dar resultados positivos.
Ver sección 5.1.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones con Dorzolamida/Timolol Dr. Gerhard Mann colirio en solución.
En los ensayos clínicos, Dorzolamida/Timolol Dr. Gerhard Mann se administró de forma concomitante con los siguientes medicamentos sistémicos sin que se observaran signos de interacciones: IECA, antagonistas del calcio, diuréticos, antiinflamatorios no esteroideos incluyendo ácido acetilsalicílico, y hormonas (por ejemplo, estrógenos, insulina y tiroxina).
El componente dorzolamida de Dorzolamida/Timolol Dr. Gerhard Mann es un inhibidor de la anhidrasa carbónica que, aunque se administra por vía tópica, se absorbe sistémicamente. En los estudios clínicos, no se produjo alteración alguna del equilibrio acidobásico durante el tratamiento con el colirio de dorzolamida hidrocloruro. Sin embargo, con la administración de inhibidores orales de la anhidrasa carbónica, sí se han observado estas alteraciones, que han ocasionado interacciones en algunos casos (por ejemplo, efectos tóxicos durante el tratamiento con salicilatos a dosis altas). Por lo tanto, se debe considerar la posibilidad de que se produzcan esas interacciones en pacientes que reciban Dorzolamida/Timolol Dr. Gerhard Mann.
Los betabloqueantes orales pueden agravar la hipertensión que puede producirse como efecto rebote de la interrupción del tratamiento con clonidina.
Fertilidad, embarazo y lactancia
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Dorzolamida/Timolol Dr. Gerhard Mann colirio en solución sobre la capacidad para conducir y utilizar máquinas es moderada. En algunos pacientes, la capacidad para conducir y utilizar máquinas puede verse reducida por posibles reacciones adversas, tales como visión borrosa.
4.8 Reacciones adversasEn los ensayos clínicos, no se han observado acontecimientos adversos asociados a Dorzolamida/Timolol ; las reacciones adversas se limitaron a las notificadas previamente con dorzolamida hidrocloruro y/o con maleato de timolol. En general, las reacciones adversas frecuentes fueron de intensidad leve y no provocaron la suspensión del tratamiento.
Durante el desarrollo de los ensayos clínicos, 1035 pacientes recibieron tratamiento con Dorzolamida/Timolol . El 2,4% aproximadamente de todos los pacientes suspendió el tratamiento con Dorzolamida/Timolol debido a reacciones adversas oculares locales y el 1,2% aproximadamente de todos los pacientes lo suspendió debido a reacciones adversas locales que sugerían la presencia de alergia o hipersensibilidad (tales como inflamación del párpado y conjuntivitis).
Se han notificado las siguientes reacciones adversas con Dorzolamida/Timolol o con uno de sus principios activos durante los ensayos clínicos o durante la post-comercialización:
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agenos espanta oe mescamemos y productos san liares
fw|
an
Las reacciones adversas se clasifican en función de su frecuencia de la siguiente manera:
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1000 a < 1/100)
Raras (> 1/10 000 a < 1/1000)
Muy raras (< 1/10 000)
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Trastornos del sistema nervioso:
Dorzolamida hidrocloruro colirio:
Frecuentes: cefalea Raros: mareo, parestesia
Maleato de timolol colirio:
Frecuentes: cefalea
Poco frecuentes: mareo, depresión
Raros: insomnio, pesadillas, pérdida de memoria, parestesia, aumento de los síntomas objetivos y subjetivos de miastenia gravis, accidente cerebrovascular
Trastornos oculares: Dorzolam ida/Timolol
Muy frecuentes: quemazón y escozor
Frecuentes: hiperemia conjuntival, visión borrosa, erosión corneal, prurito ocular, lagrimeo Dorzolamida hidrocloruro colirio:
Frecuentes: inflamación del párpado, irritación del párpado Poco frecuentes: iridociclitis
Raros: irritación, por ejemplo, enrojecimiento, dolor, costras en el párpado, miopía transitoria (que se resolvió tras la suspensión del tratamiento), edema corneal, hipotensión ocular y desprendimiento de la coroides (después de cirugía de filtración)
Frecuentes: síntomas subjetivos y objetivos de irritación ocular (p. ej., quemazón, entumecimiento, picor, lagrimeo y enrojecimiento) tales como blefaritis, queratitis, disminución de la sensibilidad corneal y ojos secos
Poco frecuentes: alteraciones visuales, tales como cambios refractivos (en algunos casos, debido a la suspensión del tratamiento para la miosis)
Raros: ptosis, diplopia, desprendimiento de la coroides (después de cirugía filtrante); ver 4.4 Advertencias y precauciones especiales de empleo)
Trastornos del oído y del laberinto:
Maleato de timolol colirio:
Raros: acúfenos
Trastornos cardíacos y vasculares:
Maleato de timolol colirio:
Poco frecuentes: bradicardia, síncope
Raros: hipotensión, dolor torácico, palpitaciones, edema, arritmia, insuficiencia cardíaca congestiva, bloqueo auriculoventricular, insuficiencia cardíaca, paro cardíaco, isquemia cerebral, claudicación, síndrome de Raynaud, manos y pies fríos
Trastornos respiratorios, torácicos y mediastínicos:
Dorzolamida/Timolol Frecuentes: sinusitis
Raros: disnea, insuficiencia respiratoria, rinitis Dorzolamida hidrocloruro colirio:
MINISTB?K)DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agenos «pañete óe medeamentosy productos sanearos
an
Raros: epistaxis
Maleato de timolol colirio:
Poco frecuentes: disnea
Raros: broncoespasmo (principalmente en pacientes con enfermedad broncoespástica preexistente), tos
Trastornos gastrointestinales:
Dorzolamida/Timolol
Muy frecuentes: alteración del gusto
Dorzolamida hidrocloruro colirio:
Frecuentes: náuseas
Raros: irritación de garganta, sequedad de boca
Raros: diarrea, sequedad de boca, dolor abdominal, vómitos
Trastornos de la piel y del tejido subcutáneo:
Dorzolamida/Timolol
Raros: dermatitis de contacto
Dorzolamida hidrocloruro colirio:
Raros: exantema
Raros: alopecia, erupción psoriasiforme o empeoramiento de la psoriasis, erupción cutánea.
Trastornos renales y urinarios:
Dorzolamida/Timolol Poco frecuentes: urolitiasis.
Trastornos del aparato reproductor y de la mama:
Raros: enfermedad de Peyronie, disfunción sexual, disminución de la libido.
Trastornos generales y alteraciones en el lugar de administración:
Dorzolamida/Timolol
Raros: síntomas subjetivos y objetivos de reacciones alérgicas sistémicas, incluyendo angioedema, urticaria, prurito, exantema, reacción anafiláctica, broncoespasmo
Dorzolamida hidrocloruro colirio:
Frecuentes: astenia/cansancio
Maleato de timolol colirio:
Poco frecuentes: astenia/cansancio
Trastornos metabólicos y nutricionales:Hipoglucemia.
4.9 Sobredosis
No se dispone de datos en humanos sobre sobredosis por ingestión accidental o deliberada de Dorzolamida/Timolol Dr. Gerhard Mann.
Síntomas
Se han notificado casos de sobredosis accidental con maleato de timolol colirio que ocasionaron efectos sistémicos similares a los observados con bloqueantes beta adrenérgicos, tales como mareo, cefalea, disnea, bradicardia, broncoespasmo y paro cardíaco. Los síntomas objetivos y subjetivos más frecuentes que cabe esperar en caso de sobredosis con dorzolamida hidrocloruro son alteraciones en el equilibrio hidroelectrolítico, desarrollo de acidosis y posibles efectos sobre el SNC.
Solo se dispone de información limitada acerca de sobredosis en humanos después de ingestión accidental o deliberada de dorzolamida hidrocloruro. Tras la ingestión oral, se ha notificado somnolencia; tras la aplicación tópica, se han notificado náuseas, mareo, cefalea, cansancio, sueños anómalos y disfagia.
MINISTB*K)DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD AgeflcaespariwaOe mescamemos y productos sanéanos
am
Tratamiento
El tratamiento debe ser sintomático y paliativo. Se deben controlar los niveles séricos de electrolitos (especialmente potasio) y del pH sanguíneo. Los estudios han mostrado que timolol no se dializa fácilmente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: preparados contra el glaucoma y mióticos, agentes betabloqueantes, timolol, combinaciones, código ATC: S01ED51
Mecanismo de acción
Dorzolamida/Timolol Dr. Gerhard Mann está compuesto por dos principios activos: dorzolamida hidrocloruro y maleato de timolol. Cada uno de estos principios activos disminuyen la presión intraocular elevada mediante la reducción de la producción de humor acuoso, aunque utilizando cada uno mecanismos de acción diferentes.
Dorzolamida hidrocloruro es un potente inhibidor de la anhidrasa carbónica II humana. La inhibición de la anhidrasa carbónica en los procesos ciliares del ojo disminuye la producción de humor acuoso, probablemente mediante la ralentización de la formación de iones de bicarbonato, con la reducción subsiguiente del transporte de sodio y fluido.
El maleato de timolol es un bloqueante no selectivo de los receptores beta adrenérgicos. Por el momento, no se ha determinado claramente el mecanismo exacto de acción mediante el cual el maleato de timolol reduce la presión intraocular, si bien un estudio con fluoresceína y estudios de tonografía indican que la acción predominante puede estar relacionada con una disminución de la formación de humor acuoso. Sin embargo, en algunos estudios, también se observó un ligero aumento de la evacuación del humor acuoso. El efecto combinado de estos dos agentes ocasiona una reducción adicional de la presión intraocular (PIO), en comparación con la administración de cualquiera de los dos componentes en monoterapia.
Tras la administración tópica, Dorzolamida/Timolol Dr. Gerhard Mann disminuye la presión intraocular, con independencia de que esté o no asociada a glaucoma. La presión intraocular elevada es uno de los principales factores de riesgo en la patogenia de las lesiones del nervio óptico y de la pérdida glaucomatosa de campo visual. Dorzolamida/Timolol Dr. Gerhard Mann reduce la presión intraocular sin los efectos adversos frecuentes de los mióticos, tales como ceguera nocturna, espasmo acomodativo y constricción pupilar.
Efectos farmacodinámicos
Efectos clínicos:
Se llevaron a cabo ensayos clínicos de hasta 15 meses de duración para comparar el efecto sobre la disminución de la PIO de Dorzolamida/Timolol dos veces al día (por la mañana y al acostarse) con timolol 5 mg/ml y dorzolamida 20 mg/ml administrados individualmente, y también de forma concomitante, a pacientes con glaucoma o hipertensión ocular para los que el tratamiento concomitante se consideró apropiado en los ensayos. En los ensayos se incluyó tanto a pacientes no tratados como a pacientes mal controlados con timolol en monoterapia.
Antes de su inclusión en el estudio, la mayoría de los pacientes recibió tratamiento con betabloqueantes tópicos en monoterapia. En un análisis de los estudios combinados, el efecto sobre la reducción de la PIO de Dorzolamida/Timolol colirio en solución aplicado dos veces al día fue mayor que con dorzolamida 20 mg/ml tres veces al día o timolol 5 mg/ml dos veces al día, ambos en monoterapia. El efecto sobre la reducción de la PIO de Dorzolamida/Timolol colirio en solución aplicado dos veces al día fue equivalente al del tratamiento concomitante con dorzolamida dos veces al día y timolol dos veces al día. Se demostró el efecto sobre la reducción de la PIO de Dorzolamida/Timolol colirio en solución aplicado dos veces al día cuando se midió en distintos momentos a lo largo del día y este efecto se mantuvo durante la administración a largo plazo.
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agencia es pariera óe mencámenlos y productos sanrBnos
an
Población pediátrica
Se ha realizado un ensayo controlado de 3 meses de duración con el objetivo principal de documentar la seguridad de la solución oftálmica de dorzolamida hidrocloruro 20 mg/ml en niños menores de 6 años. En este ensayo, 30 pacientes con edades comprendidas entre 2 y 6 años y con una PIO mal controlada con dorzolamida o timolol en monoterapia recibieron Dorzolamida/Timolol colirio en solución en una fase abierta. No se ha determinado la eficacia en estos pacientes. En este pequeño grupo de pacientes, la administración dos veces al día de Dorzolamida/Timolol en solución fue, por lo general, bien tolerada y 19 pacientes completaron el periodo de tratamiento y 11 pacientes lo interrumpieron para someterse a una intervención quirúrgica, por un cambio de medicación o por otros motivos.
5.2 Propiedades farmacocinéticas
Dorzolamida hidrocloruro
A diferencia de los inhibidores de la anhidrasa carbónica orales, la administración tópica de dorzolamida hidrocloruro permite que el fármaco ejerza sus efectos directamente en el ojo con una dosis significativamente menor y, por lo tanto, con menor exposición sistémica. En ensayos clínicos, esto se tradujo en una reducción de la presión intraocular sin alteraciones en el equilibrio acidobásico o el desequilibrio hidroelectrolítico característico de los inhibidores orales de la anhidrasa carbónica.
Tras la administración tópica, dorzolamida llega a la circulación sistémica. Para evaluar el potencial de inhibición sistémica de la anhidrasa carbónica tras la administración tópica, se determinaron las concentraciones del principio activo y sus metabolitos en los eritrocitos y en el plasma, así como la inhibición de la anhidrasa carbónica en los eritrocitos. Durante el tratamiento de mantenimiento, dorzolamida se acumula en los eritrocitos debido a la unión selectiva a la anhidrasa carbónica II (AC-II), mientras en el plasma se mantienen concentraciones extraordinariamente bajas del principio activo libre.
Aunque el fármaco original forma un único metabolito N-desetilado que inhibe la anhidrasa carbónica II (AC-II) con menor potencia que el fármaco original, también inhibe otra isoenzima menos activa (AC-I). El metabolito también se acumula en los eritrocitos, donde se une principalmente a la AC-I. Dorzolamida se une moderadamente a las proteínas plasmáticas (aproximadamente en un 33 %) y se excreta principalmente inalterada en la orina; el metabolito también se excreta en la orina. Una vez finalizada la administración, dorzolamida se elimina de los eritrocitos de forma no lineal, lo que ocasiona una disminución rápida de su concentración, seguida de una fase de eliminación más lenta con una semivida de aproximadamente cuatro meses.
Después de la administración oral de dorzolamida para simular una exposición sistémica máxima después del uso prolongado de la solución oftálmica tópica, el estado de equilibrio se alcanzó en un plazo de 13 semanas. En el estado de equilibrio, no se detectó la presencia del principio activo libre ni del metabolito en plasma; la inhibición de la anhidrasa carbónica en los eritrocitos fue inferior a la que se consideraba necesaria para conseguir un efecto farmacológico sobre la función renal o sobre la respiración. Se obtuvieron resultados farmacocinéticos similares después del tratamiento tópico de mantenimiento con dorzolamida hidrocloruro. Sin embargo, aunque algunos pacientes de edad avanzada con insuficiencia renal (aclaramiento de creatinina estimado de 30 - 60 ml/minuto) presentaron concentraciones más altas del metabolito en los eritrocitos, los resultados no mostraron diferencias significativas en la inhibición de la anhidrasa carbónica ni efectos adversos sistémicos clínicamente significativos.
Maleato de timolol
Nivel de humor acuoso: en conejos, los niveles máximos de humor acuoso, que fueron de 461 ng/100 mg, se midieron 60 minutos después de la administración de 1 gota de timolol al
1,0 %. En humanos, los niveles de humor acuoso de timolol durante la primera y la segunda
MINISTERIO DE SANIDAD, POLIT1C A SOCIAL E IGUALDAD AgeflcaespariwaOe mescamemos y productos sanéanos
an
hora después de la administración de 2 gotas de timolol 5 mg/ml fueron de 150 ng/100 mg. Una vez transcurridas 7 horas, el nivel cayó a 10 ng/100 mg.
Nivel en el tejido ocular:
Después de aplicar una gota de una solución al 0,25 % de timolol marcado con 14C, los distintos tejidos oculares del ojo del conejo alcanzaron una radioactividad máxima al cabo de 15 a 60 minutos. La cornea, la membrana nictitante y el iris/cuerpo ciliar presentaron una radioactividad comprendida entre 1 y 10 ng de timolol/100 mg de tejido.
Resorción sistémica:
Los estudios han mostrado que, tras su aplicación local en el ojo, timolol se reabsorbe sistémicamente. En un estudio, timolol se detectó en la orina de todos los sujetos sanos y pacientes examinados. (El maleato hidrogenado de timolol y sus metabolitos se excretan principalmente en los riñones.)
Nivel en sangre:
Con frecuencia no es posible detectar timolol en sangre en humanos tras su aplicación local en el ojo a la dosis clínica recomendada (inferior a 2 ng/ml), ni después de una dosis única ni tras un periodo de tratamiento de dos semanas. Los niveles plasmáticos máximos medidos fueron de
9,6 ng/ml con una dosis de 2 x 2 gotas/día. Los niveles plasmáticos máximos se alcanzaron después de 30 - 90 minutos.
En varios casos, se mostró que la aplicación de un colirio que contenía timolol a neonatos y lactantes de 1 a 2 años a la dosis recomendada producía unas concentraciones plasmáticas de timolol significativamente más altas que en adultos. El nivel plasmático en un neonato de tres semanas después de la administración 2 veces de un 1 gota diaria de un colirio que contenía timolol al 0,25 % fue de 34 ng/ml.
5.3 Datos preclínicos sobre seguridad
El perfil de seguridad ocular y sistémica de cada uno de los principios activos es suficientemente conocido.
En estudios preclínicos, se observaron efectos solo con exposiciones muy superiores a la exposición máxima en humanos, lo que es poco pertinente para el uso clínico.
Dorzolamida
Se observaron malformaciones de los cuerpos vertebrales en conejos que recibieron dosis maternotóxicas asociadas a acidosis metabólica.
Timolol
Se observaron efectos preclínicos tras exposición a timolol si la cantidad administrada era bastante superior a la dosis terapéutica máxima para humanos. Se considera que la pertinencia para humanos es mínima.
Los estudios en animales no han mostrado efectos teratogénicos.
Además, no se observaron efectos oculares adversos en animales que recibieron tratamiento tópico con soluciones oftálmicas de dorzolamida hidrocloruro y maleato de timolol o con tratamiento concomitante con dorzolamida hidrocloruro y maleato de timolol. Los estudios in vitro e in vivo con cada uno de estos dos principios activos no revelaron un potencial mutagénico. Por lo tanto, cabe esperar que, a dosis terapéuticas de Dorzolamida/Timolol Dr.
Gerhard Mann, no exista riesgo significativo para la seguridad en humanos.
6. DATOS FARMACÉUTICOS
MINISTERIO DE SANIDAD, POLITIC A SOCIAL E IGUALDAD Agenos espanta oe mescamemos y productos san liares
fwj
6.1 Lista de excipientes
Cloruro de benzalconio
Hidroxietilcelulosa
Manitol
Citrato de sodio
Hidróxido de sodio (para ajustar el pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
Periodo de validez: 24 meses
Periodo de validez tras la primera apertura: 28 días
6.4 Precauciones especiales de conservación
Conservar por debajo de 25 C.
Conservar el frasco en el embalaje exterior para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Frasco de polietileno de baja densidad (LDPE) con un cuentagotas de LDPE y cápsula de cierre polipropileno (PP) que contiene una solución de 5 ml.
Dorzolamida/Timolol Dr. Gerhard Mann colirio en solución está disponible en los tamaños de envases siguientes:
Envase con 1 frasco de 5 ml Envase con 3 frascos de 5 ml cada uno Envase con 6 frascos de 5 ml cada uno
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Dr. Gerhard Mann Chem.-pharm. Fabrik GmbH Brunsbütteler Damm 165 - 173 13581 Berlín- Alemania
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
MINISTB?IODE SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agencia es pariera de mencámenlos y productos saratanos
Abril/2012
MINISTB*K)DE SANIDAD, POLITICA SOCIAL E IGUALDAD AgeflcaespariwaOe medcamentosy producios san liares