Dolmigral 6 Mg Inyectable
Información obsoleta, busque otro
agencia española de medicamentos y productos sanitarios
DOLMIGRAL
Sumatriptán (succinato)
1. NOMBRE DEL MEDICAMENTO
DOLMIGRAL 6 mg, Inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
DOLMIGRAL 6mg, Inyectable
Cada jeringa precargada contiene:
Sumatriptán (succinato) 6,0 mg
Lista de excipientes, ver epígrafe 6.1.
3. FORMA FARMACÉUTICA
DOLMIGRAL 6 mg, Inyectable se suministra en jeringas precargadas conteniendo 6 mg de sumatriptán en una solución isotónica en un volumen de 0,5 ml. Las jeringas se utilizan con un autoinyector.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
DOLMIGRAL 6 mg, Inyectable está indicado para el alivio de ataques agudos de migraña con o sin aura y para el tratamiento de ataques agudos de cefalea acuminada (cefalea en racimos).
4.2. Posología y forma de administración No utilizar DOLMIGRAL profilácticamente.
Se recomienda que el tratamiento comience tan pronto como sea posible tras el inicio del ataque de migraña o cefalea acuminada (cefalea en racimos), si bien sumatriptán es eficaz administrado en cualquier fase del ataque.
ADULTOS
Migraña
DOLMIGRAL 6 mg, Inyectable se administrará por vía subcutánea, utilizando un autoinyector. Se advertirá a los pacientes que sigan estrictamente las INSTRUCCIONES PARA LA CORRECTA ADMINISTRACIÓN DEL PREPARADO del prospecto, en especial en lo referente al modo de desechar de forma segura las jeringas y agujas utilizadas. Se evitará que DOLMIGRAL sea administrado por vía intravenosa. En caso de administrarse en el brazo, no se inyectará en la zona del codo debido a la existencia de venas superficiales.
La dosis recomendada es de 6mg por vía subcutánea En caso de que el paciente haya respondido a la primera dosis pero los síntomas hayan recurrido, podrá administrarse una segunda dosis de 6 mg por vía subcutánea en las siguientes 24 horas, siempre que haya transcurrido 1 hora como mínimo desde la primera dosis. La dosis máxima en 24 horas es de dos inyecciones de 6 mg (12 mg).
Cefalea acuminada (cefalea en racimos) Correo electrúnicoI
C/ CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
La dosis recomendada es de 6 mg por vía subcutánea para cada ataque. La dosis máxima en 24 horas es de dos inyecciones de 6 mg (12 mg), con un intervalo mínimo de 1 hora entre las dos dosis.
Si el paciente no responde a la primera dosis de sumatriptán, no debe administrarse una segunda dosis para el mismo ataque. Puede tomarse DOLMIGRAL para ataques posteriores.
NIÑOS Y ADOLESCENTES (menores de 18 años)DOLMIGRAL 6 mg, Inyectable no ha sido estudiado en adolescentes o niños.
PACIENTES MAYORES DE 65 AÑOS:
La experiencia de uso de sumatriptán en pacientes mayores de 65 años es limitada. La farmacocinética no difiere significativamente de la observada en la población más joven, pero hasta que pueda disponerse de datos adicionales no se recomienda el uso de sumatriptán en pacientes mayores de 65 años.
4.3. Contraindicaciones
Hipersensibilidad a cualquier componente de DOLMIGRAL.
Está contraindicado el uso concomitante de sumatriptán y preparaciones conteniendo ergotamina o sus derivados incluyendo metisergida (ver 4.5 Interacción con otros medicamentos y otras formas de interacción).
Está contraindicado el uso de DOLMIGRAL en pacientes que reciben tratamiento concurrentemente o en las dos semanas siguientes a la finalización de un tratamiento con inhibidores de la monoaminooxidasa. Sumatriptán no deberá administrarse a pacientes que han tenido un infarto de miocardio o tienen isquemia cardíaca o vasospasmo coronario (angina de Prinzmetal), vasculopatía periférica o a pacientes con síntomas o signos compatibles con los de una isquemia cardiaca
Sumatriptán no deberá administrarse a pacientes con antecedentes de accidente cerebrovascular o ataque isquémico transitorio.
Está contraindicada la administración de sumatriptán a pacientes con hipertensión no controlada. Sumatriptán no deberá administrarse a pacientes con insuficiencia hepática grave.
4.4. Advertencias y precauciones especiales de empleo
DOLMIGRAL sólo debe utilizarse cuando se disponga de un diagnóstico claro de migraña o cefalea acuminada.
Sumatriptán no está indicado para ser utilizado en el tratamiento de la migraña hemipléjica, basilar u oftalmopléjica.
Como con otras terapias antimigrañosas, antes de tratar cefaleas en pacientes no diagnosticados previamente de migrañosos, así como en pacientes migrañosos con síntomas atípicos, se guardará la debida precaución con el fin de excluir la presencia de otras enfermedades neurológicas potencialmente graves Debe advertirse que en pacientes migrañosos hay riesgo de existencia de determinadas alteraciones cerebrales (p.ej. accidente cerebreovascular, ataque isquémico transitorio).
La administración de sumatriptán puede asociarse a síntomas transitorios, incluyendo dolor y opresión torácicos que pueden ser intensos y extenderse a la garganta (ver epígrafe 4.8. Reacciones adversas). Si se considera que tales síntomas indican una enfermedad isquémica cardiaca, no deberán administrarse más dosis de sumatriptán y se realizarán los exámenes pertinentes.
No se administrará sumatriptán a pacientes con factores de riesgo de enfermedad isquémica cardiaca sin realizar previamente una evaluación cardiovascular (ver epígrafe 4.3 Contraindicaciones). Debe prestarse especial atención a mujeres posmenopáusicas y hombres de más de 40 años de edad con estos factores de riesgo. Sin embargo, estas evaluaciones pueden no identificar a todos los pacientes que tienen una enfermedad cardiaca y, en muy raros casos, han ocurrido acontecimientos cardíacos graves en pacientes sin enfermedad cardiovascular subyacente.
Sumatriptán debe ser administrado con precaución a pacientes con hipertensión controlada, ya que se han observado aumentos transitorios de la tensión arterial y en la resistencia vascular periférica en una pequeña proporción de pacientes.
Raramente se han recibido informes post-comercialización que describen pacientes con síndrome serotoninérgico (incluyendo estado mental alterado, inestabilidad autonómica y anomalías neuromusculares) tras la utilización de un inhibidor selectivo de la recaptación de serotonina (ISRS) y sumatriptán. Se han comunicado casos de síndrome serotoninérgico tras el tratamiento concomitante con triptanes e inhibidores selectivos de la recaptación de serotonina y noradrenalina (IRNS). Si está clínicamente justificado un tratamiento concomitante con sumatriptán y un ISRS/IRNS, se aconseja mantener al paciente bajo observación (ver epígrafe 4.5 Interacción con otros medicamentos y otras formas de interacción).
No se recomienda la administración de triptanes/agonistas 5-HT1 de forma concomitante con sumatriptán.
Sumatriptán deberá administrarse con precaución a pacientes con enfermedades que puedan alterar significativamente la absorción, el metabolismo o la excreción del fármaco, por ejemplo con insuficiencia hepática o renal.
Se administrará con precaución DOLMIGRAL a pacientes con una historia de convulsiones u otros factores que disminuyan el umbral de convulsines.
Como ocurre con otros tratamientos agudos de la migraña, se ha informado de cefales crónica diaria/exacerbación de la cefalea con un uso excesivo de sumatriptán, lo que podría hacer necesaria una retirada del fármaco.
Los pacientes con hipersensibilidad a las sulfonamidas pueden experimentar una reacción alérgica, tras la administración de sumatriptán. Las reacciones pueden variar desde hipersensibilidad cutánea a anafilaxia. Es limitada la evidencia de sensibilidad cruzada; no obstante, deberá tenerse precaución antes de utilizar sumatriptán en estos pacientes.
DOLMIGRAL 6mg, Inyectable no se administrará por vía intravenosa debido al potencial riesgo de vasospasmo coronario.
Los efectos indeseables pueden ser más comunes durante la utilización concomitante de triptanos y preparados de hierbas medicinales que contengan Hierba de San Juan (hypericum perforatum).
No deberán aumentarse las dosis recomendadas de DOLMIGRAL.

4.5. Interacción con otros medicamentos y otras formas de interacción
No hay evidencia de interacciones con propranolol, flunarizina, pizotifeno o alcohol.
Se han comunicado casos de vasoespasmo prolongado con ergotamina. Como este efecto puede ser aditivo, después de administrar ergotamina deberá transcurrir un periodo de 24 horas antes de administrar sumatriptán. A la inversa, después de administrar sumatriptán deberá transcurrir un periodo de 6 horas antes de administrar ergotamina (ver epígrafe 4.3 Contraindicaciones).
Puede haber interacción entre sumatriptán y los inhibidores de la monoaminooxidasa, estando contraindicada la administración concomitante de estos fármacos (ver epígrafe 4.3 Contraindicaciones).
Raramente se han recibido informes post-comercialización que describen pacientes con síndrome serotoninérgico (incluyendo estado mental alterado, inestabilidad autonómica y anomalías neuromusculares) tras la utilización de un inhibidor selectivo de la recaptación de serotonina (ISRS) y sumatriptán. También se han comunicado casos de síndrome serotoninégico tras el tratamiento concomitante con triptanes e inhibidores selectivos de la recaptación de serotonina y noradrenalina (IRNS).
4.6. Embarazo y lactancia
La administración de sumatriptán solamente deberá considerarse si el beneficio esperado para la madre es mayor que cualquier posible riesgo para el feto.
Los resultados del embarazo en 1.000 mujeres expuestas a sumatriptán han sido documentados a partir de los datos post-comercialización obtenidos de múltiples registros prospectivos de embarazos. Aunque no hay información suficiente para obtener conclusiones definitivas, los hallazgos no han detectado un aumento en la frecuencia de defectos en el nacimiento ni un patrón consistente de los mismos, en mujeres expuestas a sumatriptán frente a la población general.
Lactancia
Se ha demostrado que tras la administración por vía subcutánea, sumatriptán se excreta en leche materna. La exposición del lactante puede minimizarse interrumpiendo la lactancia durante las 12 horas siguientes al tratamiento. La leche materna producida en ese periodo debe ser desechada.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
Puede aparecer somnolencia, como consecuencia de la migraña o de su tratamiento con sumatriptán. Se recomienda administrar con precaución a pacientes que desempeñan tareas que requieren cierta habilidad, tales como la conducción o el manejo de máquinas.
4.8. Reacciones adversas
A continuación se presentan las reacciones adversas clasificadas por sistema corporal, órgano y frecuencia. Las frecuencias se definen como: muy frecuentes (> 1/10), frecuentes (> 1/100, < 1/10), poco frecuentes (> 1/1.000, < 1/100), raras (> 1/10.000, <1/1.000) y muy raras (< 1/10.000), incluyendo notificaciones aisladas.
Datos de Ensayos Clínicos
Trastornos del sistema nervioso
Frecuentes: Mareo, somnolencia, trastorno sensitivo incluyendo parestesias
e hipoestesia.
Trastornos vasculares
Frecuentes: Aumentos transitorios de la presión sanguínea poco después del
tratamiento. Rubor.
Trastornos gastrointestinales
Frecuentes: Algunos pacientes han experimentado náuseas y vómitos pero no está
claro si están relacionados con el sumatriptán o con la condición subyacente.
Trastornos musculoesqueléticos y del tejido conjuntivo
Frecuente: Sensación de pesadez (generalmente transitoria, podría ser intensa y
afectar a cualquier parte del cuerpo incluyendo el pecho y la garganta).
Trastornos generales y alteraciones en el lugar de la administración
Frecuentes: Dolor, sensación de calor o frío, presión u opresión (estas reacciones son
generalmente transitorias y podrían ser intensas y afectar a cualquier parte del cuerpo incluyendo el pecho y la garganta).
Frecuentes: Sensaciones de debilidad, fatiga (estas reacciones son en su mayoría de
intensidad leve a moderada y transitorias).
Exploraciones complementarias
Muy raras: Se han observado alteraciones menores en las pruebas de función
hepática.
Los efectos secundarios más frecuentes relacionados con el tratamiento con sumatriptán cuando se
administra por vía subcutánea son:
Trastornos generales y alteraciones en el lugar de la administración
Muy frecuentes: Dolor transitorio en el punto de inyección. También se han notificado
picazón/quemazón, inflamación, eritema, magullamiento y hemorragia en el punto de inyección.
Aunque no se dispone de comparaciones directas, el rubor, las parestesias y las sensaciones de calor, presión y abatimiento pueden ser más comunes tras la inyección.
A la inversa, las náuseas, vómitos y la fatiga parecen ser menos frecuentes con la administración por vía subcutánea de sumatriptán que con la administración de los comprimidos.
Datos post-comercialización
Trastornos del sistema inmunológico
Muy raras: Reacciones de hipersensibilidad que oscilan desde hipersensibilidad
cutánea hasta anafilaxia.
Trastornos del sistema nervioso
Muy raras: Convulsiones, aunque algunas han aparecido en pacientes bien con una
historia de convulsiones o bien con condiciones concurrentes predisponentes a tener convulsiones. También hay notificaciones de pacientes en quienes tales factores predisponentes no son aparentes.
Temblor, distonía, nistagmo, escotoma.
Trastornos oculares
Muy raras: Parpadeo, diplopía, visión reducida, pérdida de visión (generalmente
transitoria). No obstante, también pueden aparecer alteraciones visuales durante un ataque de migraña.
Trastornos cardíacos
Muy raras: Bradicardia, taquicardia, palpitaciones, arritmias cardíacas, alteraciones
transitorias en el electrocardiograma de naturaleza isquémica, vasoespasmo arterial coronario, angina e infarto de miocardio (ver epígrafes 4.3 Contraindicaciones y 4.4 Advertencias y Precauciones especiales de empleo).
Trastornos vasculares
Muy raras: Hipotensión, fenómeno de Raynaud.
Trastornos gastrointestinales
Muy raras: Colitis isquémica.
Trastornos musculoesqueléticos y del tejido conjuntivo Muy raras: Rigidez de cuello.
4.9. Sobredosis
Se han descrito algunos casos de sobredosis con sumatriptán inyectable. Algunos pacientes que han recibido hasta 12 mg en dosis única por vía subcutánea, no han experimentado reacciones adversas significativas.
Dosis de hasta 16 mg por vía subcutánea no se asociaron a otras reacciones adversas además de las mencionadas.
En caso de sobredosis, se realizará un seguimiento del paciente durante al menos diez horas y se aplicará el tratamiento de soporte pertinente.
No se conoce el efecto que la hemodiálisis o la diálisis peritoneal tiene sobre la concentración plasmática de sumatriptán.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Sumatriptán ha demostrado ser.un agonista selectivo del receptor vascular de la 5-hidroxitriptamina (5-HTid) que carece de efecto en otros subtipos de receptor de la 5HT (5HT2 a 5HT7). El receptor se encuentra predominantemente en los vasos sanguíneos craneales e interviene en la vasoconstricción. En animales, sumatriptán constriñe selectivamente la circulación de la arteria carótida sin alterar el flujo sanguíneo cerebral. La.circulación de la arteria carótida suministra sangre a los tejidos extracraneales e intracraneales tales como las meninges y se considera que la dilatación y/o la formación de edema en estos vasos constituye el mecanismo subyacente de la migraña en el hombre.
Además, la evidencia de los estudios realizados con animales señala que sumatriptán inhibe la actividad del nervio trigémino. Ambas acciones (vasoconstricción craneal e inhibición de la actividad del nervio trigémino) pueden contribuir a la acción antimigrañosa de sumatriptán en humanos.
La respuesta clínica comienza a los 10-15 minutos de una inyección por vía subcutánea, a los 15 minutos de la administración de una dosis de 20 mg por vía intranasal y a los 30 minutos de la administración de una dosis de 100 mg por vía oral.
Sumatriptán es efectivo en el tratamiento agudo de los ataques de migraña asociados al periodo menstrual.
5.2. Propiedades farmacocinéticas
La farmacocinética de sumatriptán no parece que se vea afectada de manera significativa por los ataques de migraña.
Absorción
La biodisponibilidad media de sumatriptán administrado por vía subcutánea es elevada (96 %), alcanzándose concentraciones séricas máximas en los 25 minutos siguientes a la administración. La concentración sérica máxima promedio después de una inyección subcutánea de 6 mg es 72 ng/ml.
Distribución
La unión a proteínas plasmáticas es baja (14-21 %) y el volumen total de distribución medio 170 litros. Metabolismo
El principal metabolito de sumatriptán, el análogo del ácido indolacético, se excreta principalmente en orina, estando presente en forma de ácido libre y de glucurónido conjugado. Este metabolito carece de actividad conocida 5-HT1 ó 5-HT2. No se han identificado metabolitos menores.
Eliminación
La vida media de eliminación es de aproximadamente 2 horas. El aclaración plasmático total es de aproximadamente 1.160 ml/min y el aclaración renal medio es de aproximadamente 260 ml/min. El aclaramiento no renal constituye el 80% del aclaramiento total. Sumatriptán se elimina principalmente por metabolismo oxidativo mediado por la monoaminooxidasa A.
5.3. Datos preclínicos sobre seguridad
Sumatriptán careció de actividad genotóxica y carcinogénica en sistemas in vitro y en estudios con animales.
En un estudio sobre la fertilidad en ratas, se observó una reducción en el éxito de la inseminación con niveles plasmáticos 150 veces superiores a los observados en humanos tras una dosis subcutánea de 6 mg.
Este efecto no ocurrió durante un estudio por vía subcutánea, donde los niveles plasmáticos máximos alcanzados fueron 100 veces superiores a los de la vía subcutánea en humanos.
No se han observado efectos teratogénicos en ratas ni conejos. Sumatriptán no tiene efecto sobre el desarrollo post-natal de la rata.
Cuando se administró a conejos preñados durante el periodo de organogénesis, sumatriptán produjo en raras ocasiones mortalidad embrionaria a dosis lo suficientemente elevadas como para causar toxicidad materna.
6. DATOS FARMACÉUTICOS
6.1 Relación de excipientes
DOLMIGRAL 6 mg, Inyectable
Cloruro de sodio
Agua para preparaciones inyectables 0,5 ml
6.2 Incompatibilidades No se han descrito.
6.3. Periodo de validez
DOLMIGRAL 6 mg, Inyectable: Dos años a temperaturas por debajo de 30°C.
6.4. Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
DOLMIGRAL 6 mg, Inyectable, ha de protegerse de la luz.
6.5. Naturaleza y contenido del recipiente
DOLMIGRAL 6 mg, Inyectable se suministra en jeringas precargadas que contienen 6 mg de sumatriptán base, en forma de sal succinato, en una solución isotónica en un volumen de 0,5 ml. Estas jeringas se utilizan junto a a un dispositivo para autoinyección.
El dispositivo para autoinyección consta de tres partes: estuche o petaca, cartucho y autoinyector. En la petaca se alojan el autoinyector y el cartucho. El cartucho contiene dos jeringas precargadas protegidas cada una por una tapa provista de cierre inviolable. El autoinyector es un tubo hueco que contiene un émbolo accionado por un muelle y un mecanismo disparador, que está diseñado para insertar la aguja a una profundidad reproducible y liberar la dosis con un movimiento suave.
El envase que se utilizará consta de un estuche o petaca con dos jeringas precargadas y un dispositivo para autoinyección.
6.6. Instrucciones de uso/manipulación
DOLMIGRAL 6 mg, Inyectable:
Contenido del estuche o petaca
a) Al abrir la tapa del estuche o petaca, podrá ver el autoinyector y el cartucho con las jeringas.
b) Comprobar que el cartucho está correctamente colocado, esto es, cuando se vean los botones azules a través de los orificios del estuche o petaca.

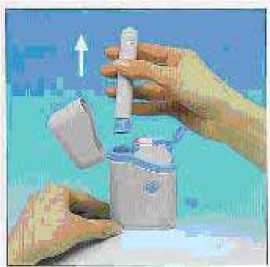

1. Abrir el estuche o petaca.
Quitar el precinto de una de las dos jeringas que contiene el cartucho.
2. Abrir la tapa de la jeringa correspondiente.
3.S3caS ac ateb aiyóoypdídredfuche o petaca. estuche o petaca.
4. Introducir con firmeza el autoinyector en el cartucho y girar el autoinyector en el sentido de las agujas de reloj hasta no poder girar más.
5. Tirar con firmeza del autoinyector cargado hacia afuera. Es posible que le cueste un poco hacerlo. Hay un botón de seguridad que evita una inyección accidental hasta que usted esté preparado.

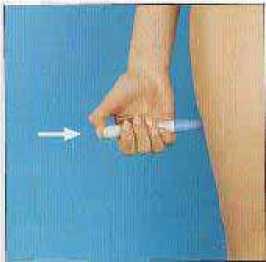
6. Presionar firmemente el autoinyector cargado contra la piel - preferentemente en la cara externa del muslo o en la parte superior de la cara externa del brazo (músculo deltoides) -, de forma que la parte gris se deslice justo hasta la parte azul. Para inyectar, apretar el botón azul del autoinyector y mantenerlo así fijo durante cinco segundos por lo menos (o contar hasta diez).
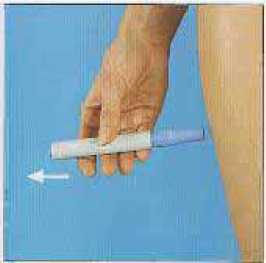
7. Cuidadosamente retirar el autoinyector. Tenga cuidado pues se verá la aguja.

8. Inmediatamente devolver la jeringa utilizada colocándola en el cartucho, empujando el autoinyector hacia abajo en el interior del mismo hasta donde llegue. Luego, girar el autoinyector en el sentido contrario al de las agujas de reloj hasta que salga del cartucho.


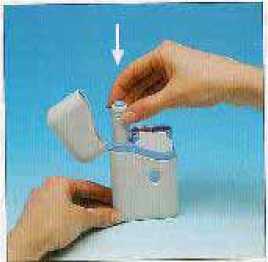
9.
Sacar el autoinyector del cartucho; luego, cerrar la tapa sobre la jeringa utilizada.

10. Devolver el autoinyector a su sitio en la petaca o estuche empujándolo hacia abajo. Escuchará un chasquido cuando el autoinyector esté bien colocado.
Se advertirá a los pacientes que sigan estrictamente las INSTRUCCIONES PARA LA CORRECTA ADMINISTRACIÓN DEL PREPARADO del prospecto, en especial en lo referente al modo de desechar de forma segura las jeringas y agujas utilizadas.
El manejo de agujas y jeringas puede ser peligroso y deben desecharse segura e higiénicamente.
7. Nombre y dirección del titular de la autorización
GlaxoSmithKline, S.A.
Parque Tecnológico de Madrid
C/ Severo Ochoa, 2
28760 Tres Cantos (Madrid).
Última revisión: Abril 2007
Agencia española de
medicamentos y
productos sanitarios