Bretaris Genuair
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Bretaris Genuair 322 microgramos polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis liberada (la dosis que sale por la boquilla) contiene 375 ^g de bromuro de aclidinio equivalente a 322 ^g de aclidinio. Esto corresponde a una dosis medida de 400 ^g de bromuro de aclidinio equivalente a 343 ^g de aclidinio.
Excipientes con efecto conocido:
Cada dosis medida contiene 12,6 mg de lactosa monohidrato.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para inhalación.
Polvo blanco o casi blanco en un inhalador de color blanco con un indicador de dosis integrado y un botón de dosificación de color verde.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Bretaris Genuair está indicado como tratamiento broncodilatador de mantenimiento para aliviar los síntomas en los pacientes adultos con enfermedad pulmonar obstructiva crónica (EPOC).
4.2 Posología y forma de administración
Posología
La dosis recomendada es una inhalación de 322 ^g de aclidinio dos veces al día.
Si se olvida una dosis, la siguiente dosis debe administrarse lo antes posible. Sin embargo, si es casi la hora de la siguiente dosis, la dosis olvidada debe saltarse.
Población de edad avanzada
No es necesario ajuste de dosis en los pacientes de edad avanzada (ver sección 5.2).
Insuficiencia renal
No es necesario ajuste de dosis en los pacientes con insuficiencia renal (ver sección 5.2).
Insuficiencia hepática
No es necesario ajuste de dosis en los pacientes con insuficiencia hepática (ver sección 5.2).
Población pediátrica
No existe una recomendación de uso específica para Bretaris Genuair en niños y adolescentes (menores de 18 años de edad) para la indicación de EPOC.
Forma de administración Vía inhalatoria.
Los pacientes deberán recibir instrucciones sobre la forma correcta de administrar el producto. Instrucciones de uso:
Familiarizarse con Bretaris Genuair:
Indicador „ , ,
de dosis Boton verde

Ventana de control con indicador de color
Boquilla
Extraiga el inhalador Genuair de la bolsa y familiarícese con sus componentes. Cómo usar Bretaris Genuair
Resumen
Para usar su inhalador Genuair hay dos pasos que debe realizar después de retirar la tapa:
Paso 1: Pulse y SUELTE el botón verde y suelte todo el aire completamente con la boca apartada del inhalador.
Paso 2: Apriete los labios alrededor de la boquilla e inspire CON FUERZA y PROFUNDAMENTE a través del inhalador.
Tras la inhalación, recuerde volver a poner la tapa protectora.
Cómo empezar
• Antes del primer uso, abra la bolsa cerrada por la hendidura y extraiga el inhalador Genuair.
• Cuando se vaya a administrar su dosis de medicamento, retire la tapa protectora presionando ligeramente las flechas que aparecen a cada lado y estirando hacia fuera (ver imagen 1).
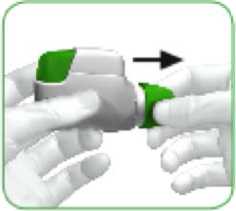
IMAGEN 1
• Compruebe que no hay nada que bloquee la boquilla.
• Sostenga el inhalador Genuair en posición horizontal con la boquilla hacia usted y el botón verde hacia arriba (ver imagen 2).
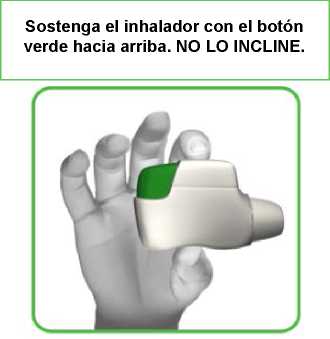
IMAGEN 2
PASO 1: PULSE el botón verde hasta el fondo y luego SUÉLTELO (ver imágenes 3 y 4).
NO SIGA PULSANDO EL BOTÓN VERDE.
PULSE el botón verde SUELTE el botón verde hasta el fondo

IMAGEN 3 IMAGEN 4
Pare y compruebe: Asegúrese de que la dosis está lista para la inhalación
• Compruebe que la ventana de control con indicador de color ha cambiado a verde (ver imagen
5).
• La ventana de color verde confirma que su medicamento está listo para la inhalación.

IMAGEN 5
SI LA VENTANA DE CONTROL CON INDICADOR DE COLOR SIGUE ROJA, POR FAVOR REPITA LAS ACCIONES DE PULSAR Y SOLTAR (VER PASO 1).
• Antes de llevarse el inhalador a la boca, suelte todo el aire completamente. No expulse el aire dentro del inhalador.
PASO 2: Apriete los labios alrededor de la boquilla del inhalador Genuair e inhale CON FUERZA y PROFUNDAMENTE a través de la boquilla (ver imagen 6).
Esta inspiración fuerte y profunda hace que el medicamento atraviese el inhalador y entre en sus pulmones.
ATENCIÓN: NO MANTENGA PULSADO EL BOTÓN VERDE MIENTRAS INHALA.
CORRECTO
INCORRECTO
IMAGEN 6
• Mientras inspira oirá un “CLIC” que indica que está utilizando el inhalador Genuair correctamente.
• Siga inspirando incluso después de oír el “CLIC” del inhalador para asegurarse de que se administra la dosis completa.
• Retire el inhalador Genuair de su boca y contenga la respiración mientras se sienta cómodo y luego expulse el aire lentamente por la nariz.
Nota: algunos pacientes pueden experimentar un ligero sabor dulce o ligeramente amargo, o una sensación arenosa dependiendo del paciente, al inhalar el medicamento. No se administre una dosis adicional si no nota ningún sabor ni siente nada después de la inhalación.
Pare y compruebe: Asegúrese de que ha inhalado correctamente
• Compruebe que la ventana de control ha cambiado a rojo (ver imagen 7). Esto confirma que ha inhalado correctamente la dosis completa.

SI LA VENTANA DE CONTROL CON INDICADOR DE COLOR SIGUE VERDE, POR FAVOR VUELVA A INHALAR CON FUERZA Y PROFUNDAMENTE POR LA BOQUILLA (VER PASO 2).
• Si la ventana sigue sin cambiar a rojo, puede que haya olvidado soltar el botón verde antes de inhalar o que no haya inhalado correctamente. En ese caso, vuelva a intentarlo.
Asegúrese de SOLTAR el botón verde e inhale CON FUERZA y profundamente a través de la boquilla.
Nota: si es incapaz de inhalar correctamente después de varios intentos, consulte a su médico.
• Una vez que la ventana se vuelva roja, vuelva a colocar la tapa protectora presionándola sobre la boquilla (ver imagen 8).
r
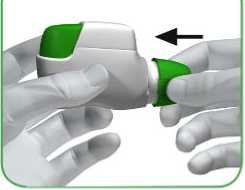
IMAGEN 8
¿Cuándo debe conseguir un nuevo inhalador Genuair?
• El inhalador Genuair cuenta con un indicador de dosis que le muestra aproximadamente cuántas dosis quedan en el inhalador. El indicador de dosis desciende lentamente mostrando intervalos de 10 (60, 50, 40, 30, 20, 10, 0) (ver imagen A). Cada inhalador Genuair administrará al menos 60 dosis.
• Cuando aparece una banda a rayas rojas en el indicador de dosis (ver imagen A) significa que se acerca a la última dosis y debe obtener un nuevo inhalador Genuair.
El indicador de dosis desciende en intervalos de 10: 60, 50, 40, 30, 20, 10, 0.
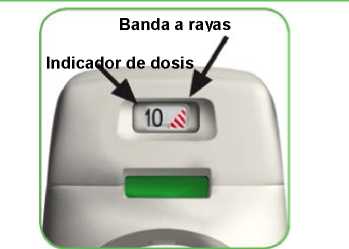
IMAGEN A
Nota: si el inhalador Genuair parece dañado o si pierde la tapa, debe reemplazar su inhalador. NO NECESITA limpiar el inhalador Genuair. Sin embargo, si desea limpiarlo, pase un pañuelo seco o una toalla de papel por la parte exterior de la boquilla. NUNCA utilice agua para limpiar el inhalador Genuair porque podría dañar el medicamento.
¿Cómo sabe que el inhalador Genuair está vacío?
• Cuando aparece 0 (cero) en la mitad del indicador de dosis, debe seguir utilizando las dosis que queden en el inhalador Genuair.
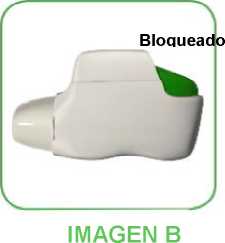
• Cuando la última dosis esté lista para inhalar, el botón verde no recuperará su posición superior, sino que se quedará bloqueado en una posición intermedia (ver imagen B). Aun cuando el botón verde esté bloqueado, puede seguir inhalando la última dosis. Después de eso, el inhalador Genuair no puede volver a utilizarse y debe empezar a usar un nuevo inhalador Genuair.

4.3 Contraindicaciones
Hipersensibilidad al bromuro de aclidinio, la atropina o sus derivados, incluidos el ipratropio, el oxitropio o el tiotropio, o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Asma:
Bretaris Genuair no debe utilizarse en asma. No se han realizado ensayos clínicos con bromuro de aclidinio en asma.
Broncoespasmo paradójico:
Como en otros tratamientos inhalados, la administración de Bretaris Genuair puede causar broncoespasmo paradójico. En ese caso, debe interrumpirse el tratamiento con Bretaris Genuair y considerarse otros tratamientos.
Empeoramiento de la enfermedad:
El bromuro de aclidinio es un broncodilatador de mantenimiento y no debe utilizarse para el alivio de los episodios agudos de broncoespasmo, es decir, como tratamiento de rescate. En caso de un cambio en la intensidad de la EPOC mientras el paciente recibe bromuro de aclidinio, de manera que el paciente considere que es necesario un medicamento de rescate adicional, debe realizarse una reevaluación del paciente y su tratamiento.
Efectos cardiovasculares:
El perfil de seguridad cardiovascular se caracteriza por los efectos anticolinérgicos.
Bretaris Genuir debe utilizarse con precaución en los pacientes con infarto de miocardio en los seis meses previos, angina inestable, arritmia de nuevo diagnóstico en los tres meses previos u hospitalización en los 12 meses previos debido a insuficiencia cardíaca de las clases funcionales III y IV según la New York Heart Association. Estos pacientes fueron descartados de los ensayos clínicos y el mecanismo de acción anticolinérgico puede afectar a dichos trastornos.
Actividad anticolinérgica:
La sequedad de boca, que se ha observado con el tratamiento anticolinérgico, puede asociarse a largo plazo con caries dental.
Debido a su actividad anticolinérgica, el bromuro de aclidinio debe emplearse con precaución en pacientes con hiperplasia prostática sintomática, obstrucción del cuello vesical o con glaucoma de ángulo estrecho (aunque el contacto directo del producto con los ojos es muy improbable).
Excipientes:
Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se ha estudiado la administración concomitante de bromuro de aclidinio con otros medicamentos que contienen anticolinérgicos y, por tanto, no se recomienda.
Aunque no se han realizado estudios de interacción farmacológica in vivo, el bromuro de aclidinio inhalado se ha utilizado de manera concomitante con otros medicamentos para la EPOC, incluidos broncodilatadores simpaticomiméticos, metilxantinas y corticoides orales e inhalados sin evidencia clínica de interacciones farmacológicas.
Los estudios in vitro indican que, a dosis terapéuticas, no se prevé que el bromuro de aclidinio o sus metabolitos causen interacciones con los fármacos con sustratos de la glicoproteína P (P-gp) o los fármacos metabolizados por las enzimas del citocromo P450 (CYP450) y esterasas (ver sección 5.2).
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos sobre la utilización del bromuro de aclidinio en mujeres embarazadas.
Los estudios realizados en animales han mostrado fetotoxicidad solo a niveles de dosis muy superiores a la dosis humana máxima de exposición al bromuro de aclidinio (ver sección 5.3). El bromuro de aclidinio solo debe utilizarse durante el embarazo si los beneficios esperados superan los posibles riesgos.
Lactancia
Se desconoce si el bromuro de aclidinio y/o sus metabolitos se excretan en la leche materna. Dado que los estudios en animales han mostrado la excreción de pequeñas cantidades de bromuro de aclidinio y/o metabolitos en la leche, se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con bromuro de aclidinio tras considerar el beneficio de la lactancia para el niño frente al beneficio del tratamiento prolongado con bromuro de acidinio para la madre.
Fertilidad
Los estudios realizados en ratas revelan una leve reducción de la fertilidad solo a niveles de dosis muy superiores a la dosis humana máxima de exposición al bromuro de aclidinio (ver sección 5.3). Se considera improbable que el bromuro de aclidinio administrado a la dosis recomendada afecte a la fertilidad en los humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia del bromuro de aclidinio sobre la capacidad para conducir y utilizar máquinas es pequeña. La aparición de cefalea, mareo o visión borrosa tras la administración de bromuro de aclidinio (ver sección 4.8) puede influir en la capacidad para conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas notificadas con mayor frecuencia con Bretaris Genuair fueron cefalea (6,6%) y nasofaringitis (5,5%).
Tabla resumen de las reacciones adversas
Las frecuencias asignadas a las reacciones adversas que se enumeran a continuación se basan en la tasa de incidencia bruta de reacciones adversas (es decir, acontecimientos atribuidos a Bretaris Genuair) observados con Bretaris Genuair 322 pg y obtenidas del análisis conjunto de tres ensayos clínicos aleatorizados y controlados con placebo (636 pacientes), uno de seis meses y dos de tres meses de duración.
La frecuencia de las reacciones adversas se define utilizando el siguiente convenio: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1000 a <1/100); raras (>1/10 000 a <1/1000); muy raras (<1/10 000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación por órganos y sistemas |
Reacción adversa |
Frecuencia |
|
Infecciones e infestaciones |
Sinusitis |
Frecuente |
|
Nasofaringitis |
Frecuente | |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Rara |
|
Angioedema |
Frecuencia no conocida | |
|
Trastornos del sistema nervioso |
Cefalea |
Frecuente |
|
Mareo |
Poco frecuente | |
|
Trastornos oculares |
Visión borrosa |
Poco frecuente |
|
Trastornos cardíacos |
Taquicardia |
Poco frecuente |
|
Palpitaciones |
Poco frecuente | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
Frecuente |
|
Disfonía |
Poco frecuente | |
|
Trastornos gastrointestinales |
Diarrea |
Frecuente |
|
Náuseas* |
Frecuente | |
|
Boca seca |
Poco frecuente | |
|
Estomatitis |
Poco frecuente |
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea |
Poco frecuente |
|
Prurito |
Poco frecuente | |
|
Trastornos renales y urinarios |
Retención urinaria |
Poco frecuente |
* La incidencia de náuseas en ensayos clínicos fue inferior con aclidinio que con placebo (43,9 frente a 48,3 con 1000 pacientes/año respectivamente)
Notificación de sospechas de reacciones adversas
Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Anexo V.
4.9 Sobredosis
Las dosis elevadas de bromuro de aclidinio pueden provocar signos y síntomas anticolinérgicos.
Sin embargo, se han administrado dosis únicas inhaladas de hasta 6000 ^g de bromuro de aclidinio a sujetos sanos sin observarse efectos adversos anticolinérgicos sistémicos. Además, no se observaron efectos adversos clínicamente relevantes tras la administración de dosis de hasta 800 ^g de bromuro de aclidinio dos veces al día durante siete días en sujetos sanos.
La intoxicación aguda por la ingestión accidental del bromuro de aclidinio es poco probable debido a su baja biodisponibilidad oral y al mecanismo de administración del inhalador Genuair activado por la respiración.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: anticolinérgicos, código ATC: R03BB05.
El bromuro de aclidinio es un antagonista selectivo competitivo de los receptores muscarínicos (también denominados anticolinérgicos) con un tiempo de permanencia más prolongado en los receptores M3 que en los receptores M2. Los receptores M3 median en la contracción del músculo liso de las vías respiratorias. El bromuro de aclidinio actúa localmente en los pulmones para antagonizar los receptores M3 en el músculo liso de las vías respiratorias e inducir broncodilatación. Los estudios no clínicos in vitro e in vivo demostraron una inhibición rápida, dependiente de la dosis y de larga duración de la broncoconstricción inducida por la acetilcolina por parte del aclidinio. El bromuro de aclidinio se hidroliza con rapidez en el plasma, por lo que el grado de efectos adversos anticolinérgicos sistémicos es bajo.
Efectos farmacodinámicos
Los estudios de eficacia mostraron que Bretaris Genuair mejoró la función pulmonar de forma clínicamente significativa (medida como el volumen espiratorio forzado en el primer segundo [FEVi]) a lo largo 12 horas tras la administración por la mañana y por la noche, y esta mejora fue evidente a los 30 minutos desde la primera dosis (aumentos respecto al inicio de 124-133 ml). La broncodilatación máxima se alcanzó de 1 -3 horas tras la administración, con valores medios de FEV i pico respecto al inicio de 227-268 ml en el estado estacionario.
Electrofisiología cardíaca
No se observaron alteraciones en el intervalo QT (corregido según el método de Fridericia o Bazett o individualmente) cuando se administró bromuro de aclidinio (200 ^g o 800 ^g) una vez al día durante tres días a sujetos sanos en un estudio específico del intervalo QT.
Además, no se observaron efectos clínicamente significativos de Bretaris Genuair en el ritmo cardíaco de 336 pacientes (164 de los cuales recibieron Bretaris Genuair 322 ^g dos veces al día) con monitorización con Holter durante 24 horas después de tres meses de tratamiento.
Eficacia clínica
El programa de desarrollo clínico de fase III de Bretaris Genuair incluyó a 269 pacientes tratados con Bretaris Genuair 322 ^g dos veces al día en un estudio aleatorizado controlado con placebo de seis meses de duración y a 190 pacientes tratados con Bretaris Genuair 322 ^g dos veces al día en un estudio aleatorizado controlado con placebo de tres meses de duración. La eficacia se evaluó mediante medidas de la función pulmonar y las variables sintomáticas como la disnea, el estado de salud específico de la enfermedad, el uso de medicación de rescate y la aparición de exacerbaciones. En los estudios de seguridad a largo plazo, Bretaris Genuair se asoció a eficacia broncodilatadora cuando se administró a lo largo de un año.
Broncodilatación
En el estudio de seis meses de duración, los pacientes que recibieron Bretaris Genuair 322 ^g dos veces al día experimentaron una mejora clínicamente significativa en la función pulmonar (medida como FEV1). Los efectos broncodilatadores máximos fueron evidentes desde el día uno y se mantuvieron a lo largo de seis meses. Al cabo de seis meses, la mejora media en el FEV1 pre-dosis matutino (valle) respecto al placebo fue de 128 ml (IC 95% = 85-170; p <0,0001).
Se realizaron observaciones parecidas en el estudio de tres meses de Bretaris Genuair.
Estado de salud específico de la enfermedad y beneficios sintomáticos
Bretaris Genuair demostró producir mejoras clínicamente significativas en la disnea (evaluada
mediante el Índice de Transición de la Disnea [ITD]) y el estado de salud específico de la enfermedad
(evaluado mediante el St. George’s Respiratory Questionnaire [SGRQ]). En la tabla que aparece a
continuación se muestra el alivio sintomático obtenido tras seis meses de tratamiento con Bretaris
Genuair.
|
Variable |
Tratamiento |
Mejora respecto al placebo |
Valor de p | |
|
Bretaris Genuair |
Placebo | |||
|
ITD | ||||
|
Porcentaje de pacientes que lograron una DMCIa |
56,9 |
45,5 |
1,68c de aumento de la probabilidad |
0,004 |
|
Cambio medio respecto al inicio |
1,9 |
0,9 |
1,0 unidades |
<0,001 |
|
SGRQ | ||||
|
Porcentaje de pacientes que lograron una DMCIb |
57,3 |
41,0 |
1,87c de aumento de la probabilidad |
<0,001 |
|
Cambio medio respecto al inicio |
-7,4 |
-2,8 |
-4,6 unidades |
<0,0001 |
a Diferencia mínima clínicamente importante (DMCI) de al menos 1 unidad en el ITD. b DMCI de al menos -4 unidades en el SGRQ.
c Razón de probabilidades, aumento en la probabilidad de lograr una DMCI en comparación con el placebo.
Los pacientes tratados con Bretaris Genuair necesitaron menos medicación de rescate que los pacientes que recibieron placebo (una reducción de 0,95 inhalaciones al día a los seis meses [p = 0,005]). Bretaris Genuair también mejoró los síntomas diarios de EPOC (disnea, tos y producción de esputo) y los síntomas nocturnos y matutinos.
El análisis conjunto de la eficacia de los estudios controlados con placebo de seis y tres meses de duración demostró una reducción estadísticamente significativa en la tasa de exacerbaciones de moderadas a graves (que precisaron tratamiento con antibióticos o corticoesteroides o que requirieron hospitalización) con aclidinio 322 ^g dos veces al día en comparación con placebo (tasa por paciente por año: 0,31 frente a 0,44 respectivamente; p = 0,0149).
Tolerancia al ejercicio
En un estudio clínico cruzado, aleatorizado, controlado con placebo y de tres semanas de duración Bretaris Genuair se asoció con una mejoría estadísticamente significativa en el tiempo de resistencia al ejercicio en comparación con el placebo de 58 segundos (95 % IC=9-108; p=0,021; valor anterior al tratamiento: 486 segundos). Bretaris Genuair redujo de manera estadísticamente significativa la hiperinsuflación pulmonar en reposo (capacidad funcional residual [CFR]=0,197 L [95 % IC=0,321, 0,072; p=0,002]; volumen residual [VR]=0,238 L [95 % IC=0,396, 0,079; p=0,004]), también mejoró la capacidad inspiratoria (en 0,078 L; 95 % IC=0,01, 0,145; p=0,025) y redujo la disnea durante el ejercicio (escala de Borg) (en 0,63 unidades de Borg; 95 % IC=1,11, 0,14; p=0,012).
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Bretaris Genuair en los diferentes grupos de la población pediátrica en la EPOC (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
El bromuro de aclidinio se absorbe rápidamente del pulmón y alcanza concentraciones plasmáticas máximas a los cinco minutos después de la inhalación en los sujetos sanos, y normalmente a los 15 primeros minutos en los pacientes con EPOC. La fracción de la dosis inhalada que llega a la circulación sistémica en forma de aclidinio inalterado es muy pequeña, inferior al 5%.
Las concentraciones plasmáticas máximas alcanzadas tras la inhalación de dosis únicas de 400 ^g de bromuro de aclidinio en forma de polvo seco por pacientes con EPOC fueron aproximadamente de 80 pg/ml. La concentración plasmática en el estado estacionario se alcanzó a los siete días tras una administración de dos veces al día y, teniendo en cuenta la corta semivida, el estado estacionario puede alcanzarse poco después de la primera dosis. No se observó acumulación alguna con la administración repetida en el estado estacionario.
Distribución
La deposición pulmonar total del bromuro de aclidinio inhalado mediante el inhalador Genuair fue aproximadamente del 30% de media de la dosis medida.
La unión a las proteínas plasmáticas del bromuro de aclidinio determinada in vitro corresponde muy probablemente a la unión a las proteínas de los metabolitos debido a la rápida hidrólisis del bromuro de aclidinio en el plasma; la unión a las proteínas plasmáticas fue del 87% para el metabolito del ácido carboxílico y del 15% para el metabolito de alcohol. La principal proteína plasmática que se une al bromuro de aclidinio es la albúmina.
Biotransformación
El bromuro de aclidinio se hidroliza rápida y ampliamente en sus derivados de alcohol y ácido carboxílico, farmacológicamente inactivos. La hidrólisis se produce tanto por vía química (no enzimática) como enzimática a través de las esterasas siendo la butirilcolinesterasa la principal esterasa humana que interviene en la hidrólisis. La concentración plasmática del metabolito ácido es aproximadamente 100 veces superior a la del metabolito alcohol y a la del principio activo inalterado después de la inhalación.
La baja biodisponibilidad absoluta del bromuro de aclidinio inhalado (< 5%) se debe al hecho de que el bromuro de aclidinio experimenta una amplia hidrólisis sistémica y presistémica cuando se deposita en el pulmón o se traga.
La biotransformación a través de las enzimas del CYP450 desempeña un papel menor en la eliminación metabólica total del bromuro de aclidinio.
Los estudios in vitro han puesto de manifiesto que el bromuro de aclidinio a dosis terapéuticas o sus metabolitos no inhiben ni inducen las enzimas del citocromo P450 (CYP450) ni tampoco inhiben las esterasas (carboxilesterasa, acetilcolinesterasa y butirilcolinesterasa). Los estudios in vitro han mostrado que ni el bromuro de aclidinio ni sus metabolitos son sustratos o inhibidores de la glicoproteína P.
Eliminación
La semivida de eliminación terminal del bromuro de aclidinio es de entre dos y tres horas aproximadamente.
Tras la administración intravenosa de 400 ^g de bromuro de aclidinio radiomarcado a sujetos sanos, se excretó aproximadamente el 1% de la dosis en forma de bromuro de aclidinio inalterado en la orina. Se eliminó hasta el 65% de la dosis en forma de metabolitos en la orina, y hasta el 33% en forma de metabolitos en las heces.
Tras la inhalación de 200 (ig y 400 (ig de bromuro de aclidinio por sujetos sanos o pacientes con EPOC, la excreción urinaria de aclidinio inalterado fue muy baja, de aproximadamente el 0,1% de la dosis administrada, lo que indica que el aclaramiento renal desempeña un papel menor en la eliminación total del aclidinio del plasma.
Linealidad/No linealidad
El bromuro de aclidinio demostró cinética lineal y una farmacocinética independiente del tiempo en el rango terapéutico.
Relación(es) farmacocinética/farmacodinamia(s)
Dado que el bromuro de aclidinio actúa localmente en los pulmones y se hidroliza con rapidez en el plasma, no hay ninguna relación directa entre la farmacocinética y la farmacodinámica.
Poblaciones especiales
Pacientes de edad avanzada
Las propiedades farmacocinéticas del bromuro de aclidinio en los pacientes con EPOC moderada a grave son similares en los pacientes de 40-59 años de edad y en los pacientes > 70 años. Por tanto, no es necesario ajustar la dosis en los pacientes con EPOC de edad avanzada.
Pacientes con insuficiencia hepática
No se han realizado estudios en pacientes con insuficiencia hepática. Dado que el bromuro de aclidinio se metaboliza principalmente por hidrólisis química y enzimática en el plasma, es muy improbable que la disfunción hepática altere su exposición sistémica. No es necesario ajustar la dosis en los pacientes con EPOC con insuficiencia hepática.
Pacientes con insuficiencia renal
No se observaron diferencias farmacocinéticas significativas entre los sujetos con función renal normal y los sujetos con insuficiencia renal. Por tanto, no es necesario ajustar la dosis ni realizar controles adicionales en los pacientes con EPOC con insuficiencia renal.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de seguridad farmacológica, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción y el desarrollo.
Unicamente se observaron reacciones en los estudios no clínicos en exposiciones consideradas superiores a la exposición máxima humana en lo que respecta a los parámetros cardiovasculares (aumento de la frecuencia cardíaca en perros), toxicidad reproductiva (efectos fetotóxicos) y fertilidad (ligeros descensos en la tasa de concepción, el número de cuerpos lúteos y las pérdidas pre- y postimplantación), lo que indica poca relevancia para su uso clínico.
La baja toxicidad observada en los estudios no clínicos de toxicidad se debe en parte al rápido metabolismo del bromuro de aclidinio en el plasma y a la ausencia de actividad farmacológica significativa de los metabolitos principales. En estos estudios, los márgenes de seguridad para la exposición sistémica en humanos tratados con 400 pg dos veces al día a niveles de efecto adverso no observable fueron 17 y 187 veces superiores.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Lactosa monohidrato
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
Usar en los 90 días posteriores a la apertura de la bolsa.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
Mantener el inhalador Genuair dentro de la bolsa hasta que se inicie el tratamiento.
6.5 Naturaleza y contenido del envase
El dispositivo de inhalación es un dispositivo multicomponente compuesto de policarbonato, acrilonitrilo-butadieno-estireno, polioximetileno, poliéster-butileno-tereftalato, polipropileno, poliestireno y acero inoxidable. Es de color blanco con un indicador de dosis integrado y un botón de dosificación de color verde. La boquilla está cubierta por una tapa protectora desmontable de color verde. El inhalador se proporciona en una bolsa de plástico laminada, situada dentro de un envase de cartón.
Envase que contiene 1 inhalador con 30 dosis.
Envase que contiene 1 inhalador con 60 dosis.
Envase que contiene 3 inhaladores con 60 dosis cada uno.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Para consultar las instrucciones de uso, ver la sección 4.2.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca AB SE-151 85 Sódertalje Suecia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/781/001
EU/1/12/781/002
EU/1/12/781/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 20/julio/2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
ANEXO II
A.
B.
C.
FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
A FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Industrias Farmacéuticas Almirall, S.A.
Ctra. Nacional II, Km. 593 08740 Sant Andreu de la Barca Barcelona España
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sistema de farmacovigilancia
El Titular de la Autorización de Comercialización (TAC) debe asegurar que el Sistema de Farmacovigilancia, presentado en el Módulo 1.8.1. de la Autorización de Comercialización, esté instaurado y en funcionamiento antes de que el medicamento se comercialice y durante el tiempo que permanezca en el mercado.
Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades de farmacovigilancia detalladas en el Plan de Farmacovigilancia, de acuerdo con la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y cualquier actualización posterior del PGR acordada por el Comité de Medicamentos de Uso Humano (CHMP).
De acuerdo con la Directriz del CHMP sobre Sistemas de Gestión de Riesgos para medicamentos de uso humano, el PGR actualizado se debe presentar junto con el siguiente Informe Periódico de Seguridad (IPS).
Además, se debe presentar un PGR actualizado:
• Cuando se reciba nueva información que pueda afectar a las especificaciones de seguridad vigentes, al Plan de Farmacovigilancia o las actividades de minimización de riesgos
• Dentro de los 60 días posteriores a la consecución de un hito importante (farmacovigilancia o minimización de riesgos)
• A petición de la Agencia Europea de Medicamentos.
• CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
No procede.
• OBLIGACIÓN ESPECÍFICA DE REALIZAR MEDIDAS POST-AUTORIZACIÓN
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Estudio de Cohortes de la Seguridad (Post-Authorisation Safety Cohort Study, PASS) del Bromuro de Aclidinio Inhalado y el Riesgo de Determinados Criterios de Valoración Cardiovasculares. Los protocolos de estudio completos deben presentarse antes del inicio del estudio para su revisión por el CHMP previamente al lanzamiento del producto. |
Los protocolos de estudio deberán presentarse antes de septiembre del 2012. El PASS se iniciará cuando haya 2000 prescripciones en la base de datos definida. |
ANEXO III
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR Cartonaje exterior_
1. NOMBRE DEL MEDICAMENTO
Bretaris Genuair 322 microgramos polvo para inhalación Aclidinio (bromuro de aclidinio)
2. PRINCIPIO(S) ACTIVO(S)
Cada dosis liberada contiene 375 microgramos de bromuro de aclidinio equivalente a 322 microgramos de aclidinio.
3. LISTA DE EXCIPIENTES
También contiene: lactosa monohidrato
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1 inhalador que contiene 30 dosis 1 inhalador que contiene 60 dosis 3 inhaladores que contienen 60 dosis cada uno
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía inhalatoria
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Mantener el inhalador Genuair dentro de la bolsa hasta que se inicie el tratamiento.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca AB SE-151 85 Sódertalje Suecia
AstraZeneca (logotipo AstraZeneca)
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/781/001 30 dosis EU/1/12/781/002 60 dosis EU/1/12/781/003 3 inhaladores
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
bretaris genuair
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Etiqueta del inhalador_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Bretaris Genuair 322 mcg polvo para inhalación Aclidinio (bromuro de aclidinio)
2. FORMA DE ADMINISTRACIÓN
Vía inhalatoria
3. FECHA DE CADUCIDAD
Usar en los 90 días posteriores a la apertura de la bolsa. CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 dosis 60 dosis
6. OTROS
AstraZeneca (logotipo AstraZeneca)
B. PROSPECTO
Bretaris Genuair 322 microgramos polvo para inhalación
Aclidinio (bromuro de aclidinio)
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Bretaris Genuair y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Bretaris Genuair
3. Cómo usar Bretaris Genuair
4. Posibles efectos adversos
5. Conservación de Bretaris Genuair
6. Contenido del envase e información adicional
7. El inhalador Genuair: instrucciones de uso
1. Qué es Bretaris Genuair y para qué se utiliza Qué es Bretaris Genuair
El principio activo de Bretaris Genuair es el bromuro de aclidinio que pertenece a una clase de medicamentos denominados broncodilatadores. Los broncodilatadores relajan las vías respiratorias y ayudan a mantener abiertos los bronquiolos. Bretaris Genuair es un inhalador de polvo seco que usa su respiración para administrar el medicamento directamente en los pulmones. Esto facilita la respiración de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
Para qué se utiliza Bretaris Genuair
Bretaris Genuair está indicado para ayudar a abrir las vías respiratorias y aliviar los síntomas de la EPOC, una enfermedad pulmonar grave de larga evolución que se caracteriza por la dificultad para respirar. El uso regular de Bretaris Genuair puede ayudarle cuando experimenta dificultad continua para respirar debido a la enfermedad y le ayudará a minimizar los efectos de la enfermedad en su vida diaria.
2. Qué necesita saber antes de empezar a usar Bretaris Genuair No use Bretaris Genuair:
- si es alérgico al bromuro de aclidinio o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a la atropina o a los medicamentos broncodilatadores derivados de ésta, como por ejemplo el ipratropio, el tiotropio o el oxitropio.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Bretaris Genuair:
- si tiene asma;
- si ha tenido problemas cardíacos recientemente;
- si ve halos en torno a las luces o imágenes en color (glaucoma);
- si tiene hipertrofia de próstata, problemas al orinar o una obstrucción en su vejiga.
Bretaris Genuair está indicado para el tratamiento de mantenimiento de la enfermedad pulmonar obstructiva crónica. No debe emplearse para tratar un ataque repentino de dificultad para respirar o pitos (sibilancias). Si los síntomas de la EPOC (dificultad para respirar, pitos o la tos) no mejoran o empeoran debe consultar con su médico lo antes posible.
La sequedad de boca, que se ha observado con los medicamentos como Bretaris Genuair, puede asociarse con caries dental después del uso del medicamento durante un periodo prolongado. Por lo tanto, acuérdese de cuidar su higiene bucal.
Deje de utilizar Bretaris Genuair y busque ayuda médica inmediatamente si:
- nota opresión en el pecho, tos, pitos o dificultad para respirar inmediatamente después de utilizar este medicamento. Pueden ser signos de un trastorno denominado broncoespasmo.
Niños y adolescentes
Bretaris Genuair no debe usarse en niños o adolescentes menores de 18 años de edad.
Uso de Bretaris Genuair con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Informe a su médico si ha utilizado o está utilizando medicamentos similares para problemas respiratorios, p. ej., medicamentos que contienen tiotropio, ipratropio. En caso de duda, consulte a su médico o farmacéutico. No se recomienda el uso de Bretaris Genuair con estos medicamentos.
Uso de Bretaris Genuair con alimentos y bebidas
Puede usar Bretaris Genuair en cualquier momento antes o después de comer o beber.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. No debe utilizar Bretaris Genuair si está embarazada o en periodo de lactancia a menos que se lo haya recomendado su médico.
Conducción y uso de máquinas
La influencia de Bretaris Genuair sobre la capacidad para conducir y utilizar máquinas es pequeña. Este medicamento puede producir dolor de cabeza, mareo o visión borrosa. Si experimenta cualquiera de estas reacciones adversas no conduzca ni utilice máquinas hasta que haya desaparecido su dolor de cabeza, la sensación de mareo haya pasado y se haya normalizado su visión.
Bretaris Genuair contiene lactosa monohidrato
Este medicamento contiene lactosa. Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo usar Bretaris Genuair
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte a su médico o farmacéutico.
- La dosis recomendada es una inhalación dos veces al día, por la mañana y por la noche.
- Los efectos de Bretaris Genuair duran 12 horas, por lo tanto, debe intentar utilizar el inhalador Bretaris Genuair a la misma hora todas las mañanas y noches. Esto garantiza que siempre haya suficiente medicamento en su cuerpo para ayudarle a respirar más fácilmente durante todo el día y toda la noche. Esto también le ayudará a acordarse que debe utilizarlo.
- Instrucciones de uso: consulte las instrucciones de uso del inhalador Genuair en la sección 7, al final de este prospecto. En caso de duda sobre cómo usar Bretaris Genuair, consulte a su médico o farmacéutico.
La EPOC es una enfermedad de larga evolución, por lo tanto, se recomienda el uso de Bretaris Genuair cada día, dos veces al día y no sólo cuando se tengan problemas para respirar u otros síntomas de EPOC.
La dosis recomendada puede utilizarse en pacientes de edad avanzada y en pacientes con problemas de riñón o hígado. No es necesario ajustar la dosis.
Si usa más Bretaris Genuair del que debe
Si cree que ha usado más Bretaris Genuair del que debe, consulte a su médico o farmacéutico.
Si olvidó usar Bretaris Genuair
Si olvida una dosis de Bretaris Genuair, inhale la dosis en cuanto se acuerde. Sin embargo, si falta poco para la hora de la siguiente dosis, sáltese la dosis olvidada.
No se administre una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Bretaris Genuair
Este medicamento es para un tratamiento de larga duración. Si desea interrumpir el tratamiento, consulte primero a su médico, ya que sus síntomas pueden empeorar.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Bretaris Genuair puede producir efectos adversos, aunque no todas las personas los sufran.
En raras ocasiones, pueden producirse reacciones alérgicas. Suspenda el uso del medicamento y póngase inmediatamente en contacto con su médico si experimenta una hinchazón en la cara, en la garganta, en los labios o en la lengua (con o sin dificultad para respirar o para tragar), o si aparece hinchazón grave con picor en la piel (habones), ya que pueden ser síntomas de una reacción alérgica.
Al utilizar Bretaris Genuair pueden producirse los siguientes efectos adversos:
Frecuentes: pueden afectar hasta 1 de cada 10 pacientes
- Dolor de cabeza
- Inflamación de los senos paranasales (sinusitis)
- Resfriado común (nasofaringitis)
- Tos
- Diarrea
- Náuseas
Poco frecuentes: pueden afectar hasta 1 de cada 100 pacientes
- Mareo
- Sequedad de boca
- Inflamación de la boca (estomatitis)
- Ronquera (disfonía)
- Aumento del ritmo cardíaco (taquicardia)
- Sensación de que el corazón late con fuerza (palpitaciones)
- Dificultad para orinar (retención urinaria)
- Visión borrosa
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Bretaris Genuair
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del inhalador y el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Usar en los 90 días posteriores a la apertura de la bolsa.
Mantener el inhalador Genuair dentro de la bolsa hasta que se inicie el tratamiento.
No utilice Bretaris Genuair si observa que el envase está dañado o muestra signos de manipulación.
Una vez que haya utilizado la última dosis, el inhalador debe desecharse. Al desechar el inhalador vacío o no utilizado debe seguir las normas locales para residuos domésticos. Pregunte a su farmacéutico cómo deshacerse de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Composición de Bretaris Genuair
- El principio activo es bromuro de aclidinio. Cada dosis liberada contiene 375 microgramos de bromuro de aclidinio equivalente a 322 microgramos de aclidinio.
- El otro componente es lactosa monohidrato.
Aspecto del producto y contenido del envase
Bretaris Genuair es un polvo blanco o casi blanco.
El dispositivo inhalador Genuair es de color blanco con un indicador de dosis integrado y un botón de dosificación de color verde. La boquilla está cubierta por una tapa protectora desmontable de color verde. Se proporciona en una bolsa de plástico.
Tamaños de envase proporcionados:
Envase que contiene 1 inhalador con 30 dosis.
Envase que contiene 1 inhalador con 60 dosis.
Envase que contiene 3 inhaladores con 60 dosis cada uno.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
AstraZeneca AB SE-151 85 Sódertalje Suecia
medicamento dirigiéndose al representante local del
Responsable de la fabricación:
Industrias Farmacéuticas Almirall, S.A.
Ctra. Nacional II, km. 593
08740 Sant Andreu de la Barca, Barcelona
España
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
AstraZeneca S.A./N.V.
Tel: +32 2 370 48 11
Etarapna
Tn “EepnHH-XeMH AF’
Tea.: +359 2 96 55 365
Ceská republika
Berlin-Chemie/A.Menarini Ceska republika s.r.o. Tel: +420 267 199 333
Danmark
AstraZeneca A/S Tlf: +45 43 66 64 62
Lietuva
UAB “BERLIN-CHEMIE MENARINI BALTIC” Tel: +370 52 691 947
Luxembourg/Luxemburg
AstraZeneca S.A./N.V.
Tel: +32 2 370 48 11
Magyarország
Berlin-Chemie/A. Menarini Kft.
Tel.: +36 23501301
Malta
Associated Drug Co. Ltd Tel: +356 2277 8000
Deutschland
Berlin-Chemie AG Tel: +49 (0) 30 67070
AstraZeneca GmbH Tel: +49 41 03 7080
Eesti
OÜ Berlin-Chemie Menarini Eesti Tel: +372 667 5001
EXláSa
MENARINI HELLAS AE Tn^: +30 210 8316111-13
España
Laboratorios Menarini S.A.
Tel: +34-93 462 88 00
France
MENARINI France Tél: +33 (0)1 45 60 77 20
Hrvatska
Berlin-Chemie Menarini Hrvatska d.o.o. Tel: + 385 1 4821 361
Ireland
AstraZeneca Pharmaceuticals (Ireland) Ltd Tel: +353 1609 7100
Ísland
Vistor hf.
Sími: +354 535 70 00 Italia
Laboratori Guidotti S.p.A.
Tel: +39- 050 971011
Kúrcpog
A^skt©p Oap^aKeuxiKq AxS Tn^: +357 22490305
Latvija
SIA Berlin-Chemie/Menarini Baltic Tel: +371 67103210
Nederland
AstraZeneca BV Tel: +31 79 363 2222
Norge
AstraZeneca AS Tlf: +47 21 00 64 00
Osterreich
A. Menarini Pharma GmbH.
Tel: +43 1 879 95 85-0
Polska
Berlin-Chemie/Menarini Polska Sp. z o.o.
Tel.: +48 22 566 21 00
Portugal
A. Menarini Portugal - Farmacéutica, S.A.
Tel: +351 210 935 500
Romanía
Berlin-Chemie A.Menarini S.R.L.
Tel: +40 21 232 34 32
Slovenija
Berlin-Chemie AG, Podruznica Ljubljana Tel: +386 01 300 2160
Slovenská republika
Berlin-Chemie AG - obchodné zastúpenie v SR Tel: +421 2 544 30 730
Suomi/Finland
AstraZeneca Oy Puh/Tel: +358 10 23 010
Sverige
AstraZeneca AB Tel: +46 8 553 26 000
United Kingdom
AstraZeneca UK Ltd Tel: +44 1582 836 836
Fecha de la última revisión de este prospecto: {mes AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Inhalador Genuair: instrucciones de uso
7.
Esta sección contiene información sobre cómo usar el inhalador Genuair. Si tiene alguna duda acerca de cómo usar el inhalador, consulte a su médico, farmacéutico o enfermero.
Antes de usar el inhalador Genuair, por favor lea todas las instrucciones.
Familiarizarse con Bretaris Genuair: extraiga el inhalador Genuair de la bolsa y familiarícese con sus componentes.
Indicador
de dosis Boton verde

Ventana de control con indicador de color
Boquilla
Cómo usar Bretaris Genuair
Resumen
Para usar su inhalador Genuair hay dos pasos que debe realizar después de retirar la tapa:
Paso 1: Pulse y SUELTE el botón verde y suelte todo el aire completamente con la boca apartada del inhalador.
Paso 2: Apriete los labios alrededor de la boquilla e inspire CON FUERZA y PROFUNDAMENTE a través del inhalador.
Tras la inhalación, recuerde volver a poner la tapa protectora.
Cómo empezar
• Antes del primer uso, abra la bolsa cerrada por la hendidura y extraiga el inhalador Genuair.
• Cuando se vaya a administrar su dosis de medicamento, retire la tapa protectora presionando ligeramente las flechas que aparecen a cada lado y estirando hacia fuera (ver imagen 1).
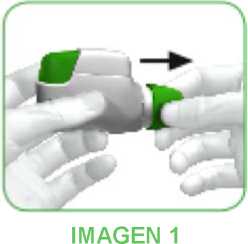
• Compruebe que no hay nada que bloquee la boquilla.
Sostenga el inhalador Genuair en posición horizontal con la boquilla hacia usted y el botón verde hacia arriba (ver imagen 2).
Sostenga el inhalador con el botón verde hacia arriba. NO LO INCLINE.

IMAGEN 2
PASO 1: PULSE el botón verde hasta el fondo y luego SUÉLTELO (ver imágenes 3 y 4).
NO SIGA PULSANDO EL BOTÓN VERDE.
PULSE el botón verde SUELTE el botón verde hasta el fondo
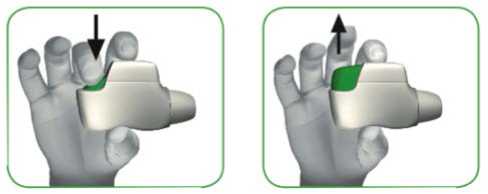
IMAGEN 3 IMAGEN 4
Pare y compruebe: Asegúrese de que la dosis está lista para la inhalación
• Compruebe que la ventana de control con indicador de color ha cambiado a verde (ver imagen
5).
• La ventana de color verde confirma que su medicamento está listo para la inhalación.

SI LA VENTANA DE CONTROL CON INDICADOR DE COLOR SIGUE ROJA, POR FAVOR REPITA LAS ACCIONES DE PULSAR Y SOLTAR (VER PASO 1).
Antes de llevarse el inhalador a la boca, suelte todo el aire completamente. No expulse el aire dentro del inhalador.
PASO 2: Apriete los labios alrededor de la boquilla del inhalador Genuair e inhale CON FUERZA y PROFUNDAMENTE a través de la boquilla (ver imagen 6).
- Esta inspiración fuerte y profunda hace que el medicamento atraviese el inhalador y entre en sus pulmones.
ATENCIÓN: NO MANTENGA PULSADO EL BOTÓN VERDE MIENTRAS INHALA.
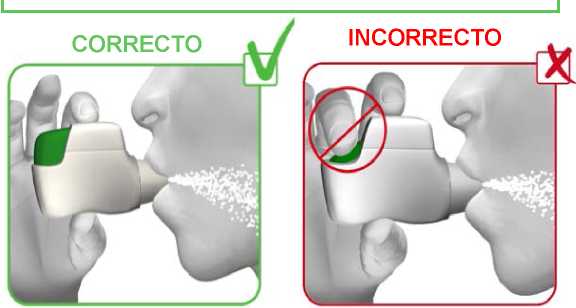
IMAGEN 6
• Mientras inspira oirá un “CLIC” que indica que está utilizando el inhalador Genuair correctamente.
• Siga inspirando incluso después de oír el “CLIC” del inhalador para asegurarse de que se administra la dosis completa.
• Retire el inhalador Genuair de su boca y contenga la respiración mientras se sienta cómodo y luego expulse el aire lentamente por la nariz.
Nota: algunos pacientes pueden experimentar un ligero sabor dulce o ligeramente amargo, o una
sensación arenosa dependiendo del paciente, al inhalar el medicamento. No se administre una dosis
adicional si no nota ningún sabor ni siente nada después de la inhalación.
Pare y compruebe: Asegúrese de que ha inhalado correctamente
• Compruebe que la ventana de control ha cambiado a rojo (ver imagen 7). Esto confirma que ha inhalado correctamente la dosis completa.

SI LA VENTANA DE CONTROL CON INDICADOR DE COLOR SIGUE VERDE, POR FAVOR VUELVA A INHALAR CON FUERZA Y PROFUNDAMENTE POR LA BOQUILLA (VER PASO 2).
• Si la ventana sigue sin cambiar a rojo, puede que haya olvidado soltar el botón verde antes de inhalar o que no haya inhalado correctamente. En ese caso, vuelva a intentarlo.
Asegúrese de SOLTAR el botón verde e inhale CON FUERZA y profundamente a través de la boquilla.
Nota: si es incapaz de inhalar correctamente después de varios intentos, consulte a su médico.
• Una vez que la ventana se vuelva roja, vuelva a colocar la tapa protectora presionándola sobre la boquilla (ver imagen 8).
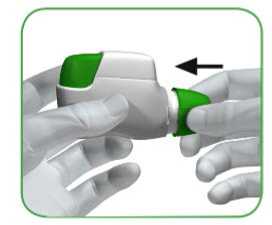
IMAGEN 8
¿Cuándo debe conseguir un nuevo inhalador Genuair?
• El inhalador Genuair cuenta con un indicador de dosis que le muestra aproximadamente cuántas dosis quedan en el inhalador. El indicador de dosis desciende lentamente mostrando intervalos de 10 (60, 50, 40, 30, 20, 10, 0) (ver imagen A). Cada inhalador Genuair administrará al menos 60 dosis.
• Cuando aparece una banda a rayas rojas en el indicador de dosis (ver imagen A) significa que se acerca a la última dosis y debe obtener un nuevo inhalador Genuair.
El indicador de dosis desciende a intervalos de 10: 60, 50, 40, 30, 20, 10, 0.
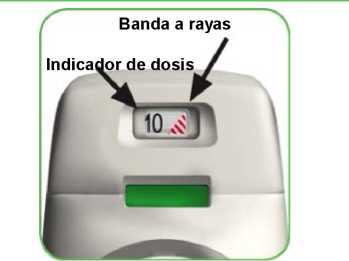
IMAGEN A
Nota: si el inhalador Genuair parece dañado o si pierde la tapa, debe reemplazar su inhalador. NO NECESITA limpiar el inhalador Genuair. Sin embargo, si desea limpiarlo, pase un pañuelo seco o una toalla de papel por la parte exterior de la boquilla. NUNCA utilice agua para limpiar el inhalador Genuair porque podría dañar el medicamento.
¿Cómo sabe que el inhalador Genuair está vacío?
• Cuando aparece 0 (cero) en la mitad del indicador de dosis, debe seguir utilizando las dosis que queden en el inhalador Genuair.
• Cuando la última dosis esté lista para inhalar, el botón verde no recuperará su posición superior, sino que se quedará bloqueado en una posición intermedia (ver imagen B). Aun cuando el botón verde esté bloqueado, puede seguir inhalando la última dosis. Después de eso, el inhalador Genuair no puede volver a utilizarse y debe empezar a usar un nuevo inhalador Genuair.
35