Bocouture 4 Unidades/0,1 Ml Polvo Para Solucion Inyectable
Información obsoleta, busque otroFICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
BOCOUTURE 4 unidades/0,1 ml polvo para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un vial contiene 50 unidades DL50* de toxina botulínica tipo A (150 kD), libre de proteínas complejantes. 0,1 ml de solución contienen 4 unidades DL50* de toxina botulínica tipo A (150 kD), libre de proteínas complejantes cuando se reconstituye en 1,25 ml.
• Una unidad corresponde a la dosis letal media (DL50) cuando el producto reconstituido se inyecta por vía intraperitoneal a ratones en condiciones definidas.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para solución inyectable Polvo blanco
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
BOCOUTURE está indicado para la mejoría temporal en el aspecto de las siguientes líneas faciales, cuando la intensidad de las mismas es moderada o grave:
• las líneas verticales del entrecejo producidas en fruncimiento (líneas glabelares)
• las líneas laterales periorbitales producidas en máxima sonrisa (patas de gallo)
en adultos menores de 65 años cuando la intensidad de estas líneas tiene un impacto psicológico importante para el paciente.
4.2 Posología y forma de administración
Las dosis unitarias recomendadas para BOCOUTURE no son intercambiables con las de otras preparaciones de toxina botulínica.
Para información detallada relativa a ensayos clínicos con BOCOUTURE en comparación con el complejo convencional de toxina botulínica de tipo A (900 kD), ver sección 5.1.
BOCOUTURE sólo puede ser administrado por médicos con la formación adecuada y con experiencia demostrada en este tipo de terapia y que dispongan del equipo necesario.
Una vez reconstituido, BOCOUTURE debe administrarse mediante inyección intramuscular.
BOCOUTURE debe usarse inmediatamente después de la reconstitución y sólo puede ser utilizado para un tratamiento por paciente.
Para consultar las instrucciones de eliminación de los viales, ver sección 6.6.
BOCOUTURE reconstituido se inyecta usando una aguja estéril fina (por ejemplo una aguja de calibre 30).
Líneas Verticales del Entrecejo (Líneas Glabelares)
Posología
Después de la reconstitución de BOCOUTURE (50 unidades/1,25 ml) se inyecta el volumen de inyección recomendado de 0,1 ml (4 unidades) en cada uno de los 5 puntos de inyección: dos inyecciones en cada músculo corrugador y una inyección en el músculo procero, lo que corresponde a una dosis estándar de 20 unidades. La dosis puede ser incrementada por el médico, si las necesidades del paciente lo requieren, hasta un máximo de 30 unidades con al menos un intervalo de 3 meses entre tratamientos.
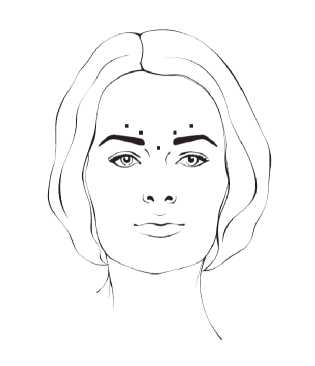
Se produce generalmente una mejoría en el aspecto de las líneas verticales del entrecejo (líneas glabelares) a los 2 ó 3 días, observándose el efecto máximo en el día 30. El efecto dura hasta 4 meses después de la inyección.
Forma de administración
Antes y durante la inyección, realizar una presión firme debajo del borde orbital del ojo con ayuda del pulgar y el dedo índice para evitar la extravasación de la solución en esta zona. Durante la inyección debe mantenerse la alineación superior y medial de la jeringa. Para reducir el riesgo de blefaroptosis, se deben evitar las inyecciones cerca del músculo elevador del párpado y en la porción craneal del músculo orbicular del ojo. Las inyecciones en el músculo corrugador se deben hacer en la porción media del músculo y en la porción central de dicho músculo al menos 1 cm por encima del borde del hueso de la órbita del ojo.
Líneas Laterales Periorbitales producidas en máxima sonrisa (Patas de Gallo)
Posología
Después de la reconstitución de BOCOUTURE (50 unidades/ 1,25 ml), se inyecta bilateralmente el volumen recomendado de 0,1 ml (4 unidades) en cada uno de los 3 puntos de inyección. Una inyección de 0,1 ml se coloca aproximadamente a 1 cm del lateral del borde óseo orbital. Cada una de las otras dos inyecciones de 0,1 ml se debe colocar aproximadamente 1 cm por encima y por debajo del área de la primera inyección.
ÜE
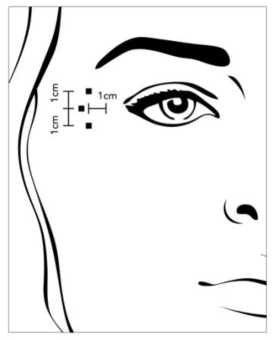
La dosis total estándar recomendada por tratamiento es 12 unidades por lado (dosis global total: 24 unidades).
Generalmente se produce una mejoría en las líneas laterales periorbitales producidas en máxima sonrisa (patas de gallo) en los primeros 6 días observándose el máximo efecto en el día 14. El efecto tiene una duración de hasta 3 meses después de la inyección.
Actualmente no se dispone de datos de eficacia y seguridad en las líneas periorbitales laterales producidas en máxima sonrisa para más de dos inyecciones separadas por un intervalo de 4 meses.
Forma de administración
La inyección se debe realizar por vía intramuscular en el músculo orbicular del ojo, directamente bajo la dermis para evitar la difusión de BOCOUTURE. Se deben evitar las inyecciones demasiado cercanas al músculo cigomático mayor para prevenir la ptosis del labio.
Todas las indicaciones
Los intervalos entre tratamientos no deben ser inferiores a 3 meses. Si el tratamiento fracasa o el efecto disminuye con inyecciones repetidas, se deben utilizar métodos de tratamiento alternativos.
Poblaciones especiales
Existen datos clínicos limitados de estudios de fase III de BOCOUTURE en pacientes mayores de 65 años de edad. Hasta que no se realicen otros estudios en este grupo de edad, no se recomienda el uso de BOCOUTURE en pacientes mayores de 65 años de edad.
Población pediátrica
No se han estudiado la seguridad y eficacia de BOCOUTURE para el tratamiento de las líneas verticales del entrecejo o de las líneas periorbitales laterales producidas en máxima sonrisa en individuos menores de 18 años. Por lo tanto, no está recomendado el uso de BOCOUTURE en individuos menores de 18 años.
Información general
Si no se produce el efecto del tratamiento en el plazo de un mes desde la inyección inicial, se deben adoptar las siguientes medidas:
• Análisis de las razones por las que no se haya producido respuesta, como por ejemplo, inyección en los músculos equivocados, método de inyección, dosis insuficiente, formación de anticuerpos neutralizantes de la neurotoxina
• Comprobar de nuevo si la neurotoxina botulínica tipo A es la terapia adecuada
• Si no se han producido reacciones adversas durante el tratamiento inicial, se puede realizar un tratamiento adicional en las siguientes condiciones: 1.) ajuste de la dosis en base al análisis de falta de respuesta al tratamiento previo 2.) cumplimiento del intervalo mínimo de 3 meses entre el tratamiento inicial y el repetido.
4.3 Contraindicaciones
Hipersensibilidad a la sustancia activa o a alguno de los excipientes enumerados en la sección 6.1
Trastornos generalizados de la actividad muscular (por ejemplo, miastenia grave, síndrome de Lambert-Eaton)
Presencia de infección o inflamación en el lugar propuesto para la inyección
4.4 Advertencias y precauciones especiales de empleo
BOCOUTURE sólo se podrá aplicar para el uso pretendido, para tratar un único paciente y para una sesión. Se debe tener especial cuidado cuando se prepare y se administre el producto, y cuando se inactive y elimine la solución no utilizada (ver sección 6.6).
Se debe tener cuidado para asegurar que no se inyecta BOCOUTURE en un vaso sanguíneo.
Se han notificado casos muy raros de reacciones adversas que podrían estar relacionados con la difusión de la toxina a lugares distantes al lugar de la inyección (ver sección 4.8). Los pacientes tratados con dosis terapéuticas pueden experimentar debilidad muscular exagerada. La inyección de BOCOUTURE no está recomendada para pacientes con antecedentes de disfagia y aspiración.
Se deberá informar a los pacientes o a los cuidadores que deben buscar inmediatamente ayuda médica en el caso de que se presenten alteraciones en la deglución o trastornos del habla o de la respiración.
Puede producirse una reacción anafiláctica, en casos muy poco frecuentes, después de inyectar la neurotoxina botulínica tipo A (ver sección 4.8). Deberán tenerse a mano adrenalina y otras medidas para el tratamiento de la anafilaxis.
Antes de administrar BOCOUTURE, el médico debe conocer las características anatómicas del paciente y cualquier alteración de las mismas causada por intervenciones quirúrgicas anteriores.
BOCOUTURE debe emplearse con precaución:
• Si existe un trastorno hemorrágico de cualquier tipo
• En pacientes que reciben tratamiento anticoagulante o toman otras sustancias que pueden tener efecto anticoagulante a determinadas dosis
• En pacientes que padecen esclerosis lateral amiotrófica u otras enfermedades que produzcan disfunción neuromuscular periférica
• Si los músculos que son objeto de la acción del medicamento muestran una debilidad o atrofia pronunciada.
La administración demasiado frecuente o de dosis demasiado altas puede incrementar el riesgo de formación de anticuerpos, lo que puede conducir a un fracaso del tratamiento incluso si el producto está siendo utilizado para tratar otras indicaciones (ver sección 4.2).
BOCOUTURE contiene albúmina, un derivado de la sangre humana. Entre las medidas habituales para prevenir infecciones producidas por el uso de medicamentos preparados a partir de sangre o plasma humano se incluyen una cuidadosa selección de los donantes, screening de donaciones individuales y de mezclas de plasma con marcadores específicos de infección y la implementación de procedimientos efectivos de inactivación o eliminación de virus en las etapas de producción. A pesar de estas medidas, al administrar medicamentos preparados con sangre o plasma humano, no se puede excluir completamente la posibilidad de transmitir agentes infecciosos. Esto también se aplica en el caso de cualquier virus desconocido o emergente, o de otros agentes patógenos.
No existe ninguna notificación de transmisión de virus con albúmina fabricada según las especificaciones de la Farmacopea Europea utilizando los procedimientos establecidos.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción.
En teoría, el efecto de la neurotoxina botulínica tipo A puede potenciarse por los antibióticos aminoglucósidos o por otros medicamentos que interfieren con la transmisión neuromuscular (por ejemplo, los relajantes musculares de tipo tubocurarina).
Por lo tanto, el empleo concomitante de BOCOUTURE con aminoglucósidos o espectinomicina requiere especial precaución. Los relajantes musculares periféricos deben usarse con precaución, reduciendo, si fuese necesario, la dosis inicial del relajante o empleando mejor una sustancia de acción intermedia como vecuronio o atracurio que relajantes con efectos más prolongados.
Las 4-aminoquinolinas pueden reducir el efecto de BOCOUTURE..
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos adecuados sobre la utilización de la Neurotoxina botulínica tipo A en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). Se desconoce el posible riesgo para seres humanos.
En consecuencia, BOCOUTURE no debe utilizarse durante el embarazo excepto si fuese claramente necesario.
Lactancia
Se desconoce si la Neurotoxina botulínica tipo A se excreta en la leche humana. Por lo tanto, BOCOUTURE no se debe usar durante la lactancia materna.
Fertilidad
No hay datos clínicos de la utilización de la Neurotoxina botulínica tipo A. No se detectaron efectos adversos en la fertilidad masculina o femenina en un estudio en animales (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
BOCOUTURE tiene un efecto menor o moderado en la capacidad para conducir y utilizar máquinas. Existe un posible riesgo de debilidad muscular localizada o alteraciones visuales debidas al uso de este medicamento que pueden afectar de manera transitoria a la capacidad para conducir y utilizar máquinas.
Los individuos que conducen vehículos o manejan maquinaria deberán ser informados de los posibles riesgos de astenia, debilidad muscular, mareos y trastornos de la visión, que podrían ser causados por este medicamento, y podrían hacer peligrosa la conducción de vehículos o el manejo de maquinaria.
4.8 Reacciones adversas
Por lo general, las reacciones adversas se observan en la primera semana después del tratamiento y son de naturaleza transitoria. Las reacciones adversas pueden estar relacionadas con la sustancia activa, el método de inyección o ambos.
La debilidad muscular localizada es uno de los efectos farmacológicos esperados de la toxina botulínica. La blefaroptosis, que puede ser causada por el método de inyección, se asocia con el efecto farmacológico de BOCOUTURE.
Se puede producir dolor localizado, sensibilidad, picor, hinchazón y/o hematoma conjuntamente con la inyección. Pueden producirse reacciones vasovagales transitorias asociadas con la ansiedad previa a la inyección tales como síncope, problemas circulatorios, náuseas o tinnitus.
Frecuencia de aparición
Basándose en la experiencia clínica, se presenta a continuación información sobre la frecuencia de las reacciones adversas. Las categorías de las frecuencias se definen a continuación: muy frecuentes (> 1/10); frecuentes (> 1/100, < 1/10); poco frecuentes (> 1/1.000, < 1/100), raras (> 1/10.000, < 1/1.000); muy raras (< 1/10.000).
Lista tabulada de reacciones adversas en Líneas Verticales del Entrecejo (Líneas Glabelares)
La tabla siguiente recoge las reacciones adversas notificadas con BOCOUTURE. Además, se muestran las reacciones adversas que han sido notificadas con el comparador, usado en algunos estudios clínicos de BOCOUTURE, que contiene el complejo convencional de toxina botulínica tipo A. Estas reacciones adversas están señaladas con un asterisco. No se puede excluir que estas reacciones adversas puedan ocurrir también con BOCOUTURE:
Infecciones e infestaciones
Poco frecuentes: bronquitis, nasofaringitis, gripe, infección*
Trastornos psiquiátricos
Poco frecuentes: depresión, insomnio
Trastornos del sistema nervioso Frecuentes: cefalea
Poco frecuentes: parálisis facial (ptosis de la ceja), síncope vasovagal, parestesia*,
mareo*
Trastornos oculares
Poco frecuentes: edema palpebral, ptosis, visión borrosa, blefaritis*, dolor ocular*
Trastornos del oído
Poco frecuentes: tinnitus
Trastornos gastrointestinales
Poco frecuentes: náuseas, sequedad de boca*
Trastornos de la piel y del tejido subcutáneo
Poco frecuentes: prurito, nódulos en la piel, fotosensibilidad*, sequedad de piel*
Trastornos musculoesqueléticos y del tejido conjuntivo
Frecuentes: trastornos musculares (elevación de las cejas), sensación de
pesadez
Poco frecuentes: espasmos musculares, calambres musculares
Trastornos generales y alteraciones en el lugar de la inyección Poco frecuentes: reacciones en el lugar de la inyección (hematoma, prurito),
sensación de tensión, síntomas gripales, fatiga (cansancio)
Lista tabulada de reacciones adversas enLíneas Laterales Periorbitales producidas en máxima sonrisa (Patas de Gallo)
La tabla siguiente recoge las reacciones adversas notificadas con BOCOUTURE:
Trastornos oculares
Frecuentes: edema palpebral, sequedad ocular
Trastornos generales y alteraciones en el lugar de la inyección Frecuentes: hematoma en el lugar de la inyección
Experiencia después de la comercialización. Se han comunicado casos de síntomas similares a los de la gripe y reacciones de hipersensibilidad como hinchazón, edema (también, aparte del lugar de la inyección), eritema, prurito, sarpullido (local y generalizado) y dificultad para respirar.
Generales
Durante el tratamiento de otras indicaciones con toxinas botulínicas, se han observado en muy raras ocasiones reacciones adversas relacionadas con la diseminación de la toxina en lugares distantes al punto de inyección (debilidad muscular excesiva, disfagia, neumonía por aspiración con un desenlace fatal en algunos casos) (ver sección 4.4). Se han notificado en raras ocasiones reacciones de hipersensibilidad graves y/o inmediatas, incluyendo anafilaxis, enfermedad del suero, urticaria, edema de tejido blando y disnea. Algunas de estas reacciones se han notificado después del uso del complejo convencional de toxina botulínica de tipo A, ya sea solo o en combinación con otros agentes que se conoce que causan reacciones similares.
No pueden descartarse por completo reacciones adversas de este tipo con el uso de BOCOUTURE. Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
Síntomas de sobredosis:
Las dosis aumentadas de neurotoxina botulínica tipo A pueden causar una parálisis neuromuscular pronunciada, distante del lugar de inyección. Los síntomas de sobredosis no se observan inmediatamente después de la inyección y pueden consistir en debilidad muscular, ptosis, diplopía, dificultades en el habla, parálisis de los músculos respiratorios y dificultades en la deglución que pueden dar lugar a una neumonía por aspiración.
Medidas a tomar en casos de sobredosis:
En caso de sobredosis, debe monitorizarse al paciente durante varios días. Si aparecen signos de intoxicación, se requiere la hospitalización con medidas generales de apoyo. Si se produce una parálisis de los músculos respiratorios, puede resultar necesaria la intubación y ventilación asistida hasta que se produzca mejoría.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: otros relajantes musculares, agentes de acción periférica, código ATC: M03AX01
La neurotoxina botulínica tipo A bloquea la transmisión colinérgica en la unión neuromuscular, mediante la inhibición de la liberación de acetilcolina. Las terminaciones nerviosas de la unión neuromuscular dejan de responder a los impulsos nerviosos y se impide la secreción del neurotransmisor (denervación química) en las placas motoras. La transmisión de los impulsos se reestablece mediante la formación de nuevas terminaciones nerviosas y la reconexión con las placas terminales motoras.
El mecanismo de acción mediante el cual la neurotoxina botulínica tipo A ejerce su acción sobre las terminaciones nerviosas colinérgicas puede describirse mediante un proceso secuencial de cuatro pasos, que incluye las siguientes etapas:
• Unión: La cadena pesada de la neurotoxina botulínica tipo A se une con una selectividad y afinidad excepcionalmente altas a los receptores que sólo se encuentran en las terminaciones colinérgicas.
• Internalización: Constricción de la membrana de la terminación nerviosa y absorción de la toxina en la terminación nerviosa (endocitosis).
• Translocación: El segmento amino-terminal de la cadena pesada de la neurotoxina forma un poro en la membrana de la vesícula, se escinde el enlace disulfuro y la cadena ligera de la neurotoxina pasa a través del poro al citosol.
• Efecto: Después de la liberación de la cadena ligera, se une muy específicamente a una proteína diana (SNAP 25) que es esencial para la liberación de la acetilcolina.
Normalmente, la recuperación completa de la función de la placa motora/transmisión del impulso tras la inyección se produce después de 3-4 meses, a medida que las terminaciones nerviosas se desarrollan y vuelven a conectarse a la placa terminal.
Resultados de los estudios clínicos
Líneas Verticales del Entrecejo (Líneas Glabelares)
En los estudios relativos a la eficacia de BOCOUTURE para la indicación glabelar participaron un total de 447 sujetos con líneas glabelares moderadas a graves en fruncimiento máximo. De ellos, 169 sujetos (> 18 años) fueron tratados con BOCOUTURE en la etapa principal del estudio pivotal de Fase III, doble-ciego, controlado con placebo y 236 sujetos fueron tratados en la etapa de extensión abierta (OLEX) de ese estudio. El estudio demostró una eficacia estadísticamente significativa y clínicamente relevante de 20 unidades de BOCOUTURE en comparación con el placebo. Esto fue confirmado por el mayor número de respondedores en el día 30 en fruncimiento máximo de acuerdo con la Escala de Arrugas Faciales, tanto por la evaluación del investigador como por la del paciente, mostrando una proporción significativamente mayor de respondedores entre los pacientes que recibieron 20 unidades de BOCOUTURE en comparación con el placebo.
El análisis de subgrupos mostró que la eficacia en pacientes mayores de 50 años es menor en comparación con pacientes más jóvenes. De ellos, 113 sujetos tenían 50 o menos años y 56 sujetos eran mayores de 50 años. La eficacia en hombres es inferior que en mujeres. De ellos, 33 sujetos eran hombres y 136 eran mujeres.
Se ha observado la no inferioridad de la eficacia de BOCOUTURE en comparación con el producto comparador que contiene el complejo convencional de toxina botulínica de tipo A, onabotulinumtoxin A (900kD), en un ensayo comparativo de fase III de dosis única en pacientes con líneas glabelares (MRZ 60201/GL/3002, n=381). Los resultados del estudio sugieren también que BOCOUTURE y este producto comparador tienen un perfil similar de eficacia y seguridad en pacientes con líneas glabelares cuando se utilizan con un ratio de conversión de dosis de 1:1 (ver sección 4.2).
Líneas Laterales Periorbitales producidas en máxima sonrisa (Patas de Gallo)
En un estudio de fase III, 111 sujetos con líneas periorbitales laterales moderadas a graves fueron tratados durante 1 ciclo con 12 unidades de BOCOUTURE o placebo por lado (área del ojo derecho/izquierdo) comparando esquemas de inyección de 3 puntos y de 4 puntos. Se definió el éxito del tratamiento como una mejoría de al menos 1 punto en la escala de 4 puntos valorada por un evaluador independiente en la semana 4 usando fotografías digitales estandarizadas tomadas en sonrisa máxima para cada área del ojo comparada con el estado basal.Tanto el esquema de inyección de 3 puntos como el de 4 puntos demostraron superioridad respecto al placebo. Para el esquema de 3 puntos, la tasa de éxito fue 69,9% en el grupo de BOCOUTURE vs. 21,4% en el grupo de placebo, y para el esquema de inyección de 4 puntos, 68,7% vs. 14,3%, respectivamente. No se observó empeoramiento en ningún paciente tratado con BOCOUTURE. Esto fue validado por el número más alto de pacientes que respondieron en el día 30 de acuerdo con la escala de 4 puntos en máxima sonrisa por ambas evaluaciones del investigador y del paciente, mostrando una proporción significativamente más alta de respondedores entre los pacientes que recibieron 12 unidades de BOCOUTURE por área del ojo en comparación con placebo.
5.2 Propiedades farmacocinéticas
Características generales de la sustancia activa
No pueden realizarse estudios cinéticos y de distribución clásicos con la neurotoxina botulínica tipo A porque la sustancia activa se aplica en cantidades muy pequeñas (picogramos por inyección) y porque se une rápida e irreversiblemente a las terminaciones nerviosas colinérgicas.
La toxina botulínica nativa es un complejo de alto peso molecular que, además de la neurotoxina (150 kD), contiene otras proteínas no tóxicas, como hemaglutininas y no hemaglutininas. A diferencia de las preparaciones convencionales que contienen el complejo de toxina botulínica tipo A, BOCOUTURE contiene neurotoxina pura (150 kD), ya que carece de proteínas complejantes.
Como muchas otras proteínas, se ha demostrado que la neurotoxina botulínica tipo A sufre un transporte axonal retrógrado después de la inyección intramuscular. Sin embargo, no se ha encontrado el pasaje trans-sináptico retrógrado de la neurotoxina botulínica tipo A en el sistema nervioso central.
La neurotoxina botulínica tipo A unida a los receptores sufre un proceso de endocitosis en la terminación nerviosa antes de llegar a su destino (SNAP 25) y después se degrada intracelularmente. Las moléculas de neurotoxina botulínica tipo A que circulan libremente, que no se han unido a los receptores presinápticos de las terminaciones nerviosas colinérgicas sufren un proceso de fagocitosis o pinocitosis, y se degradan como cualquier otra proteína que circule libremente.
Distribución de la sustancia activa en los pacientes
Por las razones explicadas en el apartado anterior, no se han realizado estudios farmacocinéticos de BOCOUTURE en seres humanos.
5.3 Datos preclínicos sobre seguridad
Los datos no clínicos basados en estudios farmacológicos de seguridad cardiovascular revelan que no existen riesgos especiales para humanos.
Los resultados de toxicidad sistémica derivados de los estudios de toxicidad a dosis repetidas de BOCOUTURE en animales están principalmente relacionados con sus propiedades farmacodinámicas, es decir, signos de atonía muscular local como reducción de la motilidad y disminución del tono muscular.
No se han observado signos de intolerancia local. Los estudios de toxicidad reproductiva realizados con BOCOUTURE en conejos no mostraron efectos adversos sobre la fertilidad de machos o hembras ni efectos directos sobre el desarrollo embrional. Sin embargo, la administración de BOCOUTURE a dosis que presentan una toxicidad materna clara, a intervalos semanales o quincenales, aumentó el número de abortos en un estudio de toxicidad prenatal en conejos. No puede asumirse necesariamente una exposición sistémica continua de las madres durante la fase sensible (desconocida) de la organogénesis como un requisito previo para la inducción de efectos teratógenos.
No se han realizado con BOCOUTURE estudios de genotoxicidad, carcinogenicidad o desarrollo pre y postnatal.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Albúmina humana Sacarosa
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
Vial sin abrir:
3 años
Solución reconstituida:
Se ha demostrado estabilidad química y física en uso durante 24 horas, a una temperatura de 2°C a 8 °C. Desde un punto de vista microbiológico, el producto debe emplearse inmediatamente.
6.4 Precauciones especiales de conservación
Vial sin abrir: No conservar a temperatura superior a 25°C.
Para las condiciones de conservación de la solución reconstituida, ver la sección 6.3.
6.5 Naturaleza y contenido del envase
Vial (vidrio de tipo 1), con un tapón (goma de bromobutilo), y precinto de seguridad (aluminio). Envases de 1, 2, 3 ó 6 viales.
Puede que no se comercialicen todas las presentaciones.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Se reconstituyen 50 unidades de BOCOUTURE antes de usar en 1,25 ml de solución inyectable de cloruro de sodio sin conservantes, a una concentración de 9 mg/ml (0,9%), que corresponde a una concentración de 40 unidades/ml. La reconstitución y la dilución deben realizarse de acuerdo con las normas de buenas prácticas clínicas, en particular para garantizar la asepsia.
Se recomienda llevar a cabo la reconstitución del vial y la preparación de la jeringa sobre toallas de papel con recubrimiento plástico para recoger posible material vertido. Con una jeringa, se extrae una cantidad apropiada de solución de cloruro de sodio. La solución de cloruro de sodio debe inyectarse con cuidado en el vial. El vial debe desecharse si el vacío no aspira el disolvente hacia el interior del vial. BOCOUTURE reconstituido es una solución transparente e incolora, que no contiene partículas.
No debe usarse BOCOUTURE si la solución reconstituida (preparada según las instrucciones anteriores) tiene un aspecto turbio o si contiene material floculado o partículas.
Deberá desecharse cualquier solución inyectable que se haya conservado durante más de 24 horas y cualquier solución inyectable sin usar.
PROCEDIMIENTO A SEGUIR PARA UNA ELIMINACIÓN SEGURA DE VIALES, JERINGAS Y MATERIALES UTILIZADOS
Para una eliminación segura, los viales de BOCOUTURE no reconstituidos deben reconstituirse con una pequeña cantidad de agua y posteriormente ser sometidos a un proceso de esterilización en autoclave. Los viales vacíos, los viales que contengan solución residual, jeringas y vertidos deben someterse a un proceso de esterilización en autoclave. Alternativamente, los residuos de BOCOUTURE pueden inactivarse con solución de hidróxido de sodio diluida (NaOH 0,1 N) o con solución de hipoclorito de sodio diluida (NaOCl 0,5% ó 1%).
Después de la inactivación, los viales, jeringas y materiales utilizados no deben vaciarse, sino que se deben desechar en contenedores apropiados y ser eliminados de acuerdo con los procedimientos locales.
RECOMENDACIONES ANTE CUALQUIER INCIDENTE QUE PUEDA PRODUCIRSE DURANTE LA MANIPULACIÓN DE TOXINA BOTULÍNICA
• Se debe limpiar cualquier resto del producto, ya sea usando material absorbente impregnado con una solución de hidróxido de sodio o hipoclorito de sodio (lejía) en caso del polvo, o con material absorbente seco, si se trata del producto reconstituido.
• Las superficies contaminadas se deben limpiar con material absorbente empapado en una solución de hidróxido de sodio o hipoclorito de sodio (lejía) y secar posteriormente.
• Si se rompe un vial, proceda como se mencionó anteriormente, recogiendo con cuidado los pedazos de vidrio rotos y limpiando el producto vertido, evitando cortes en la piel.
• Si el producto entra en contacto con la piel, lave el área afectada con una solución de hidróxido de sodio o hipoclorito de sodio (lejía) y luego aclare con abundante agua.
• Si el producto entra en contacto con los ojos, enjuague con abundante agua o con una solución oftálmica de lavado.
• Si el producto entra en contacto con una herida, corte o piel no intacta, enjuague con abundante agua y tome las medidas médicas apropiadas de acuerdo a la dosis inyectada.
Se deberán seguir estrictamente estas instrucciones de uso, manipulación y eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merz Pharma España S.L.
Avenida de Bruselas 5
28108 Alcobendas - Madrid
Teléfono: +34 91 657 47 84
Fax: +34 91 662 94 10
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
72709
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Mayo 2010
10. FECHA DE LA REVISIÓN DEL TEXTO
Julio 2014