Azelastina Viatris 1 Mg/Ml Solucion Para Pulverizacion Nasal
Información obsoleta, busque otroDE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
1 | |
|
Oí |
k agencia española de 1 medicamentos y I productos sanitarios |
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Azelastina VIATRIS 1 mg/ml solución para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Por 100 ml: azelastina (DOE) hidrocloruro 0,1 g
Una aplicación (0,14 ml) contiene 0,14 mg de hidrocloruro de azelastina.
3. FORMA FARMACÉUTICA Solución para pulverización nasal.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Para el tratamiento sintomático de la rinitis alérgica estacional y exacerbaciones agudas de la rinitis alérgica perenne.
4.2. Posología y forma de administración
Adultos y niños mayores de 6 años: una aplicación (0,14 ml) en cada fosa nasal, dos veces al día (0,56 mg de hidrocloruro de azelastina).
Ancianos: no se han realizado estudios específicos en ancianos
4.3. Contraindicaciones
Alergia demostrada al hidrocloruro de azelastina.
4.4. Advertencias y precauciones especiales de empleo
Si bien la experiencia clínica con el pulverizador nasal de azelastina en la población pediátrica de edad comprendida entre los 6 y 12 años es inferior a la obtenida en pacientes mayores de 12 años, los ensayos clínicos realizados hasta la fecha no muestran diferencia respecto de la eficacia y seguridad del producto en esta población.
4.5. Interacciones con otros medicamentos y otras formas de interacción
No se han estudiado interacciones específicas.
4.6. Embarazo y lactancia
En los estudios de toxicidad durante la reproducción en animales, con altas dosis, 500 veces la dosis oral diaria propuesta para humanos, se ha producido muerte fetal, retraso del crecimiento y un incremento de la incidencia de anormalidades esqueléticas.
Correo electronicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Debido a la vía de administración nasal y a la baja dosis administrada se puede esperar una exposición sistémica mínima. Sin embargo, así como ocurre con todos los medicamentos, se deben tomar precauciones durante el uso en embarazo y lactancia.
4.7. Efecto sobre la capacidad para conducir vehículos y utilizar maquinaria
No se han descrito.
4.8. Reacciones adversas
En un 0,7% aparece irritación de la mucosa nasal que se puede manifestar con escozor, picor, estornudos. Tras la administración puede aparecer un sabor amargo (grado de incidencia 3%) debido a un método de aplicación incorrecto, por ejemplo, con la cabeza demasiado inclinada hacia atrás. En ocasiones, este sabor amargo puede originar náuseas. En casos aislados puede aparecer epistaxis.
4.9. Sobredosis
Los resultados de los estudios en animales muestran que las dosis tóxicas pueden producir síntomas sobre el SNC, por ejemplo, excitación, temblor, convulsiones. Si esto ocurriese en humanos, se iniciará un tratamiento sintomático y de apoyo puesto que no existe un antídoto específico. Si la sobredosis es reciente se recomienda un lavado gástrico. Con la vía de administración nasal no se prevén reacciones de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico (código ATC): R06A: Antihistamínicos sistémicos
Azelastina, derivado de la ftalazinona de nueva estructura, está clasificado como un potente antialérgico de acción prolongada con propiedades antagonistas H1 especialmente fuertes.
Datos de estudios en animales muestran que cuando se alcanzan niveles altos de azelastina se produce tanto la inhibición como la liberación de los mediadores químicos (ej., leucotrienos, histamina, serotonina) involucrados en la reacción alérgica.
5.2. Propiedades farmacocinéticas
Después de aplicaciones nasales repetidas (0,14 mg en cada fosa nasal dos veces al día), los niveles plasmáticos de azelastina fueron alrededor de 0,26 ng/ml. Los niveles del metabolito activo demetilazelastina fueron detectados en el límite inferior de cuantificación (0,12 ng/ml) o por debajo de él.
Después de administraciones orales repetidas, se determinó la Cmax media de los niveles plasmáticos en equilibrio estacionario, siendo 3.9 ng/ml para azelastina y 1.86 ng/ml para demetilazelastina después de administrar 2.2 mg de azelastina dos veces al día, que es la dosis oral terapéutica para el tratamiento de la rinitis alérgica. Tras la administración oral, azelastina se absorbe rápidamente mostrando una biodisponibilidad absoluta del 81%.
Los alimentos no tienen influencia sobre la absorción. El volumen de distribución es alto indicando una distribución predominantemente en los tejidos periféricos. El grado de unión a
proteínas es bajo (80-95%) un nivel demasiado bajo como para afectar a las reacciones de desplazamiento del fármaco.
La vida media de eliminación plasmática tras la dosis única de azelastina es de aproximadamente 20 horas para azelastina y de unas 45 horas para N-demetil azelastina (metabolito terapéuticamente activo). La excreción se produce principalmente por vía fecal. La eliminación prolongada de pequeñas cantidades de la dosis en heces sugiere que puede tener lugar una circulación enterohepática.
6. DATOS FARMACÉUTICOS
6.1 Relación de excipientes
Hidroxipropilmetilcelulosa, edetato de disodio, ácido cítrico anhidro, fosfato sódicox12H2O, cloruro de sodio, agua purificada.
6.2. Incompatibilidades
Ninguna
6.3 Período de validez
3 años
6.4 Precauciones especiales de conservación
No almacenar por debajo de 8aC. No refrigerar.
6.5 Naturaleza y contenido del recipiente
Frascos de cristal ámbar de 10 ml y 20 ml con válvula dosificadora incorporada.
6.6. Instrucciones de uso/manipulación
1. Quitar tapa de protección
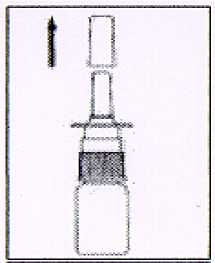
2. Antes de usar, pulsar la bomba unas veces (3-4 veces) hasta pulverización constante.

3. Atomizar una vez en cada fosa nasal manteniendo la cabeza vertical.
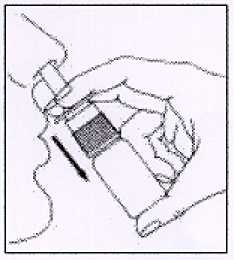
4. Limpiar y colocar la tapa protectora.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Meda Pharma S.A.
Av. Castilla, 2 (P.E. San Fernando)
28830 San Fernando de Henares (Madrid)
8. NÚMERO DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
61.057
9. FECHA DE LA PRIMERA AUTORIZACIÓN/REVALIDACIÓN DE LA AUTORIZACIÓN
Marzo 2003
10. FECHA DE REVISIÓN DEL TEXTO
Marzo 2003
Agencia española de
medicamentos y
productos sanitarios