Acido Zoledronico Strides 4 Mg/5 Ml Concentrado Para Solucion Para Perfusion Efg
Información obsoleta, busque otroFICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Ácido zoledrónico Strides 4 mg/5 ml concentrado para solución para perfusión EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un vial de 5 ml de concentrado contiene 4 mg de ácido zoledrónico, equivalentes a 4,264 mg de ácido zoledrónico monohidrato.
Cada mililitro contiene 0,8 mg de ácido zoledrónico (en forma de monohidrato).
Excipientes con efecto conocido: 2,14 mg (0,9 mmol) de sodio (en forma de citrato sódico anhidro) por vial.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado para solución para perfusión.
Solución transparente e incolora. pH: entre 5,7 y 6,7
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Prevención de episodios relacionados con el esqueleto (fracturas patológicas, compresión medular, radiación o cirugía ósea, o hipercalcemia inducida por tumor) en pacientes adultos con neoplasias malignas avanzadas con afectación ósea.
Tratamiento de la hipercalcemia inducida por tumor (HIT) en pacientes adultos.
4.2 Posología y forma de administración
Únicamente los profesionales sanitarios con experiencia en la administración de bisfosfonatos por vía intravenosa deben prescribir y administrar Ácido zoledrónico Strides.
Posología
Prevención de episodios relacionados con el esqueleto en pacientes con neoplasias malignas avanzadas con afectación ósea.
Adultos y personas de edad avanzada
La dosis recomendada en la prevención de episodios relacionados con el esqueleto en pacientes con neoplasias malignas avanzadas con afectación ósea es de 4 mg de ácido zoledrónico cada 3 o 4 semanas. También se deberá administrar a los pacientes un suplemento oral de calcio de 500 mg y 400 UI de vitamina D a diario.
Al decidir el tratamiento preventivo de episodios relacionados con el esqueleto en los pacientes con metástasis óseas se deberá tener en cuenta que el efecto del tratamiento se manifiesta a los 2-3 meses.
1 de 18
.<ítp.
Adultos y personas de edad avanzada
La dosis recomendada en la hipercalcemia (concentración corregida del calcio sérico respecto a la albúmina 12,0 mg/dl o 3,0 mmol/l) es una dosis única de 4 mg de ácido zoledrónico.
Insuficiencia renal:
HIT:
El tratamiento con Ácido Zoledrónico Strides en pacientes con HIT que también sufran insuficiencia renal grave se deberá considerar únicamente tras la evaluación de los riesgos y los beneficios del tratamiento. En los ensayos clínicos se excluyeron a los pacientes con una concentración de creatinina sérica > 400 pmol/l o > 4,5 mg/dl. En los pacientes con HIT y una concentración de creatinina sérica < 400 pmol/l o < 4,5 mg/dl no se precisa un ajuste de la dosis (ver sección 4.4).
Prevención de episodios relacionados con el esqueleto en pacientes con neoplasias malignas avanzadas con afectación ósea:
Cuando se inicie el tratamiento con Ácido Zoledrónico Strides en pacientes con mieloma múltiple o con lesiones metastásicas óseas de tumores sólidos, se deberá determinar la concentración de creatinina sérica y el aclaramiento de la creatinina (ClCr). El ClCr se calcula a partir de la creatinina sérica mediante la fórmula de Cockcroft-Gault. Ácido zoledrónico Strides no está recomendado en pacientes con una insuficiencia renal grave, definida para esta población de pacientes como ClCr < 30 ml/min, antes del inicio del tratamiento. En los ensayos clínicos realizados con Ácido zoledrónico Strides se excluyeron a los pacientes con una concentración de creatinina sérica > 265 pmol/l o > 3,0 mg/dl.
|
En los pacientes con metástasis óseas que presenten insuficiencia renal de leve a moderada, definida para esta población de pacientes como ClCr 30-60 ml/min, antes del inicio del tratamiento, se recomienda la siguiente dosis de Ácido zoledrónico Strides (ver también la sección 4.4): | |
|
Aclaramiento de la creatinina inicial (ml/min) |
Dosis recomendada de Ácido zoledrónico Strides 4 mg/5 mi* |
|
> 60 |
4,0 mg de ácido zoledrónico |
|
50-60 |
3,5 mg* de ácido zoledrónico |
|
40-49 |
3,3 mg* de ácido zoledrónico |
|
30-39 |
3,0 mg* de ácido zoledrónico |
|
* Las dosis se han calculado asumiendo un ABC de referencia de 0,66 (mg^h/l) (ClCr =75 ml/min). Se prevé que las dosis reducidas para los pacientes con insuficiencia renal alcancen la misma ABC que la observada en los pacientes con aclaramiento de la creatinina de 75 ml/min. | |
Una vez iniciado el tratamiento, se deberá medir la creatinina sérica antes de cada dosis de Ácido zoledrónico Strides y el tratamiento se deberá interrumpir si la función renal se ha deteriorado. En los ensayos clínicos realizados, el deterioro renal se definió tal como se indica a continuación:
• En el caso de pacientes con una concentración de creatinina sérica inicial normal (< 1,4 mg/dl o < 124 pmol/l), un aumento de 0,5 mg/dl o 44 pmol/l;
• En el caso de pacientes con una concentración de creatinina sérica inicial anómala (> 1,4 mg/dl o > 124 pmol/l), un aumento de 1,0 mg/dl o 88 pmol/l.
En los ensayos clínicos llevados a cabo, el tratamiento con Ácido zoledrónico Strides se reanudó únicamente cuando la concentración de creatinina volvió a hallarse en el 10 % del valor inicial (ver
.<ítp.
sección 4.4). El tratamiento con Ácido zoledrónico Strides se deberá reanudar con la misma dosis que se administraba antes de la interrupción del tratamiento.
Población pediátrica
No se ha establecido la seguridad y eficacia de Ácido zoledrónico Strides en niños de 1 a 17 años. Los datos actualmente disponibles están descritos en la sección 5.1; sin embargo, no se puede hacer una recomendación posológica.
Forma de administración Vía intravenosa.
Ácido zoledrónico Strides 4 mg concentrado para solución para perfusión, una vez diluido en 100 ml (ver sección 6.6), deberá administrase como perfusión intravenosa única durante un mínimo de 15 minutos.
En pacientes con una insuficiencia renal de leve a moderada se recomienda una dosis reducida de Ácido zoledrónico Strides (ver el apartado «Posología» anterior y la sección 6.3).
Instrucciones para la preparación de dosis reducidas de Ácido zoledrónico Strides 4 mg/5 ml:
Retire un volumen adecuado del concentrado que sea necesario, tal como se indica a continuación:
• 4,4 ml para una dosis de 3,5 mg
• 4,1 ml para una dosis de 3,3 m
• 3,8 ml para una dosis de 3,0 mg
Antes de la administración de Ácido zoledrónico Strides, consulte las instrucciones de dilución de la sección 6.6. La cantidad de concentrado retirada deberá diluirse en 100 ml de solución estéril de cloruro sódico al 0,9 % m/v o en una solución glucosada al 5 % m/v. La dosis se deberá administrar como una perfusión intravenosa única durante un mínimo de 15 minutos.
Ácido zoledrónico Strides concentrado no debe mezclarse con soluciones para perfusión que contengan calcio u otros cationes bivalentes, como la solución de lactato sódico compuesta y se deberá administrar como solución intravenosa única en una vía de perfusión individual.
Antes de la administración de Ácido zoledrónico Strides y durante la misma se deberá mantener a los pacientes bien hidratados.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo, a otros bisfosfonatos o a alguno de los excipientes incluidos en la sección 6.1.
• Lactancia (ver sección 4.6)
4.4 Advertencias y precauciones especiales de empleo
General
Antes de la administración de Ácido zoledrónico Strides se deberá evaluar a los pacientes para comprobar que estén debidamente hidratados.
Deberá evitarse la hiperhidratación de los pacientes con riesgo de insuficiencia cardíaca.
Tras el inicio del tratamiento con Ácido zoledrónico Strides se deberán vigilar detenidamente los parámetros metabólicos habituales relacionados con la hipercalcemia, como las concentraciones séricas de calcio, fosfato y magnesio. Es posible que sea necesario un tratamiento complementario a corto plazo si aparece hipocalcemia, hipofosfatemia o hipomagnesemia. Los pacientes con hipercalcemia no tratada suelen presentar algún grado de insuficiencia de la función renal, por lo que se deberá considerar la vigilancia estrecha de la función renal.
Se han notificado casos de hipocalcemia grave que precisaron hospitalización. En algunas ocasiones podría presentarse una hipocalcemia potencialmente mortal.
No se deberá tratar de forma simultanea a los pacientes que estén siendo tratados con Ácido zoledrónico Strides con otros medicamentos que contengan ácido zoledrónico u otro bisfosfonato, ya que se desconocen los efectos combinados de estos fármacos.
Este medicamento contiene menos de 1 mmol (2,14 mg) de sodio por dosis, es decir, prácticamente no contiene sodio.
Insuficiencia renal
Se deberá evaluar adecuadamente a los pacientes con HIT e indicios de deterioro de la función renal, teniendo en cuenta si el posible beneficio del tratamiento con Ácido zoledrónico Strides supera el posible riesgo.
Al decidir el tratamiento preventivo de episodios relacionados con el esqueleto en los pacientes con metástasis óseas se deberá tener en cuenta que el efecto del tratamiento se manifiesta a los 2-3 meses.
Ácido zoledrónico Strides se ha asociado a notificaciones de alteración de la función renal. Los factores que podrían aumentar el riesgo de deterioro de la función renal incluyen la deshidratación, una insuficiencia renal preexistente, varios ciclos de Ácido zoledrónico Strides y otros bisfosfonatos, así como el uso de otros fármacos nefrotóxicos. A pesar de que el riesgo se reduce con una dosis de 4 mg de ácido zoledrónico administrada durante unos 15 minutos, todavía podría producirse el deterioro de la función renal. En algunos pacientes se han notificado casos deterioro de la función renal, progresión de la insuficiencia renal y diálisis tras la dosis inicial o una dosis única de 4 mg de ácido zoledrónico. En algunos pacientes con una administración crónica de Ácido zoledrónico Strides en las dosis recomendadas para la prevención de episodios relacionados con el esqueleto también se producen aumentos de la concentración de creatinina sérica, aunque con una frecuencia menor.
Antes de cada dosis de Ácido zoledrónico Strides se deberá valorar la concentración de creatinina sérica de los pacientes. Al inicio del tratamiento en pacientes con metástasis óseas e insuficiencia renal de leve a moderada, se recomiendan dosis más bajas de Ácido zoledrónico Strides. Se deberá interrumpir la administración de Ácido zoledrónico Strides en los pacientes que muestren signos de deterioro de la función renal durante el tratamiento. Únicamente se deberá reanudar el tratamiento con Ácido zoledrónico Strides cuando la concentración de creatinina sérica vuelva a hallarse en el 10 % del valor inicial. El tratamiento con Ácido zoledrónico Strides se deberá reanudar con la misma dosis que se administraba antes de la interrupción del tratamiento.
No se recomienda el uso de Ácido zoledrónico Strides en pacientes con insuficiencia renal grave, dado el posible efecto del ácido zoledrónico en la función renal, la ausencia de datos clínicos de seguridad en pacientes con insuficiencia renal grave inicial (definida en los ensayos clínicos como una concentración de la creatinina sérica 400 pmol/l o 4,5 mg/dl en pacientes con HIT y 265 pmol/l o 3,0 mg/dl en pacientes con cáncer y metástasis óseas, respectivamente) y los pocos datos farmacocinéticos de pacientes con insuficiencia renal grave basal (aclaramiento de la creatinina < 30 ml/min).
Insuficiencia hepática
Puesto que se dispone de pocos datos clínicos en pacientes con insuficiencia hepática grave, no pueden darse recomendaciones específicas para esta población de pacientes.
Osteonecrosis maxilar
Se han notificado casos de osteonecrosis maxilar (ONM) en pacientes tratados con medicamentos inhibidores de la resorción ósea, como Ácido zoledrónico Strides, en especial los pacientes oncológicos. Muchos de estos pacientes también recibían quimioterapia y corticoesteroides. La mayoría de los casos notificados se han asociado a procedimientos odontológicos como las extracciones dentales. Muchos de ellos mostraron signos de infección local, inclusive osteomielitis.
Cuando se evalúe el riesgo de un paciente de desarrollar una ONM, se deberán tener en cuenta los siguientes factores de riesgo:
• Actividad del bisfosfonato (los compuestos con mayor actividad tienen un mayor riesgo), vía de administración (mayor riesgo en la administración parenteral) y dosis acumulada.
• Cáncer, quimioterapia, radioterapia, corticoesteroides y tabaquismo.
• Antecedentes de enfermedades dentales, higiene bucal deficiente, enfermedades gingivales, tratamientos dentales invasivos y prótesis dentales con una fijación inadecuada.
En los pacientes con factores de riesgo concomitantes se deberá considerar una exploración dental con la odontología preventiva adecuada, antes de iniciar el tratamiento con bisfosfonatos.
Estos pacientes deberán evitar los procedimientos dentales invasivos durante el tratamiento. La cirugía dental puede agravar la situación en los pacientes que desarrollen osteonecrosis maxilar durante el tratamiento con bisfosfonatos. No existen datos que indiquen si la interrupción del tratamiento con bisfosfonatos reduce el riesgo de osteonecrosis maxilar en pacientes que precisen procedimientos odontológicos. La valoración clínica del médico que lleve el tratamiento deberá orientar el plan terapéutico de cada paciente en función de la valoración individual de la relación riesgo-beneficio.
Dolor musculoesquelético
Se han notificado casos de dolor óseo, articular o muscular agudo y, a veces, incapacitante, en pacientes en tratamiento con Ácido zoledrónico Strides en la etapa de poscomercialización. No obstante, estas notificaciones han sido poco frecuentes. La aparición de los síntomas varió entre un día y varios meses tras el inicio del tratamiento. La mayoría de los pacientes dejaron de padecer los síntomas tras la interrupción del tratamiento. Un subgrupo de pacientes padeció recidivas de los síntomas con la reexposición a Ácido zoledrónico Strides u otros bisfosfonatos.
Fracturas atípicas del fémur
Se han notificado fracturas femorales atípicas de la sección subtroncantérea y diafisaria del fémur durante el tratamiento con bisfosfonatos, principalmente en pacientes en tratamiento a largo plazo para la osteoporosis. Estas fracturas transversas u oblicuas cortas pueden darse en cualquier parte del fémur, desde justo por debajo del trocánter menor hasta por encima de la tuberosidad supracondilea. Estas fracturas pueden producirse tras un traumatismo leve o en ausencia del mismo y algunos pacientes experimentan dolor en el fémur o la ingle, a menudo con imágenes características de las fracturas por sobrecarga, semanas o meses antes de presentarse con una fractura femoral completa. Las fracturas suelen ser bilaterales, por lo que se deberá examinar la parte opuesta del fémur en los pacientes que estén en tratamiento con bisfosfonatos y que hayan padecido una fractura del cuerpo del fémur. También se ha notificado la mala consolidación de estas fracturas. En los pacientes en los que se sospeche la presencia de una fractura de fémur atípica se deberá considerar la interrupción del tratamiento con bisfosfonatos, dependiendo de la evaluación del paciente y en función de la evaluación individual de la relación riesgo-beneficio.
Durante el tratamiento con bisfosfonatos se deberá advertir a los pacientes que deben notificar cualquier dolor de fémur, cadera o ingle, y a cualquier paciente que presente alguno de estos síntomas se le deberá examinar por si existe una fractura de fémur incompleta.
4.5 Interacción con otros medicamentos y otras formas de interacción
En los ensayos clínicos, se ha administrado Ácido zoledrónico Strides simultáneamente con antineoplásicos, diuréticos, antibióticos y analgésicos utilizados habitualmente sin que se produjeran interacciones manifiestas desde el punto de vista clínico. En las pruebas in vitro, el ácido zoledrónico no muestra una fijación considerable a las proteínas plasmáticas y no inhibe las enzimas humanas del citocromo P450 (ver el apartado 5.2), aunque no se han realizado ensayos clínicos formales sobre interacciones.
Se recomienda precaución cuando se administran bisfosfonatos con aminoglucósidos, ya que ambos agentes pueden ejercer un efecto aditivo, dando como resultado una menor concentración de calcio en sangre durante periodos más largos de los necesarios.
Se recomienda precaución cuando se utilice Ácido zoledrónico Strides junto con otros fármacos que puedan ser nefrotóxicos. También debe prestarse atención a la posibilidad de que se desarrolle hipomagnesemia durante el tratamiento.
En los pacientes con mieloma múltiple, el riesgo de insuficiencia renal puede verse aumentado cuando se utilice Ácido zoledrónico Strides en combinación con talidomida.
Se han recibido notificaciones de ONM en pacientes tratados con Zometa y antiangiogénicos de forma simultanea.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o estos son limitados relativos al uso del ácido zoledrónico en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3). Se desconoce el riesgo potencial en humanos, por lo que Ácido zoledrónico Strides no debe utilizarse durante el embarazo.
Lactancia
Se desconoce si el ácido zoledrónico/metabolitos se excreta en la leche materna. Ácido zoledrónico Strides está contraindicado durante la lactancia (ver sección 4.3).
Fertilidad
Se han estudiado los posibles efectos adversos del ácido zoledrónico en la fertilidad de la generación parental y la F1 de ratas. Los estudios mostraron unos efectos farmacológicos desmesurados y se consideró que tenían relación con la inhibición de la metabolización esquelética del calcio del compuesto, dando como resultado hipocalcemia puerperal —un efecto de los bisfosfonatos—, distocia y la finalización anticipada del estudio. Por tanto estos resultados impidieron la determinación de los efectos definitivos del ácido zoledrónico en la fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Las reacciones adversas como los mareos y la somnolencia podrían influir en la capacidad de conducción o en el uso de máquinas, por lo que se debe tener precaución durante el tratamiento con Ácido zoledrónico Strides cuando se conduzca o se maneje maquinaria.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los tres días posteriores a la administración de Ácido zoledrónico Strides se ha notificado con frecuencia una reacción de fase aguda, cuyos síntomas incluyen dolor óseo, fiebre, fatiga, artralgia, mialgia y escalofríos; estos síntomas suelen remitir a los pocos días (ver la descripción de las reacciones adversas seleccionadas).
A continuación se presentan los riesgos identificados más relevantes de Ácido zoledrónico Strides para las indicaciones autorizadas:
Deterioro de la función renal, osteonecrosis maxilar, reacción en fase aguda, hipocalcemia, acontecimientos adversos oculares, fibrilación auricular y anafilaxia. En la Tabla 1 se muestran las frecuencias de cada uno de estos riesgos identificados.
Clasificación de reacciones adversas
Las siguientes reacciones adversas (listadas en la Tabla 1) se han recopilado a partir de los ensayos clínicos y los informes de poscomercialización, principalmente tras el tratamiento crónico con 4 mg de ácido zoledrónico:
Tabla 1
Las reacciones adversas están ordenadas según su frecuencia, presentándose en primer lugar las más frecuentes y utilizando el siguiente convenio: Muy frecuentes ( 1/10), frecuentes ( 1/100 a <1/10), poco frecuentes ( 1/1.000 a <1/100), raras ( 1/10.000 a <1/1000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Trastornos de la sangre y del sistema linfático | |
|
Frecuentes: |
Anemia |
|
Poco frecuentes: |
Trombocitopenia, leucopenia |
|
Raras: |
Pancitopenia |
|
Trastornos del sistema inmunológico | |
|
Poco frecuentes: |
Reacciones de hipersensibilidad |
|
Raras: |
Edema angioneuropático |
|
Trastornos psiquiátricos | |
|
Poco frecuentes: |
Ansiedad, alteraciones del sueño |
|
Raras: |
Confusión |
|
Trastornos del sistema nervioso | |
|
Frecuentes: |
Cefalea |
|
Poco frecuentes: |
Mareo, parestesia, alteraciones del gusto, hipoestesia, hiperestesia, temblor, somnolencia |
|
Trastornos oculares | |
|
Frecuentes: |
Conjuntivitis |
|
Poco frecuentes: |
Visión borrosa, escleritis e inflamación orbitaria |
|
Muy raras: |
Uveítis, episcleritis |
|
Trastornos cardíacos | |
|
Poco frecuentes: |
Hipertensión, hipotensión, fibrilación auricular, hipotensión que puede causar síncope o colapso circulatorio |
|
Raras: |
Bradicardia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Poco frecuentes: |
Disnea, tos, broncoconstricción |
|
Raras: |
Enfermedad pulmonar intersticial |
|
Trastornos gastrointestinales | |
|
Frecuentes: |
Náuseas, vómitos, anorexia |
|
Poco frecuentes: |
Diarrea, estreñimiento, dolor abdominal, dispepsia, estomatitis, sequedad |
de boca
|
Trastornos de la piel y del tejido conjuntivo | |
|
Poco frecuentes: |
Prurito, erupción (que incluye erupción eritematosa y macular), aumento de la sudoración |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Frecuentes: |
Dolor óseo, mialgia, artralgia, dolor generalizado |
|
Poco frecuentes: |
Calambres musculares, osteonecrosis maxilar |
|
Trastornos renales y urinarios | |
|
Frecuentes: |
Insuficiencia renal: |
|
Poco frecuentes: |
Fallo renal agudo, hematuria, proteinuria |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Frecuentes: |
Fiebre, síntomas gripales (que incluyen fatiga, escalofríos, malestar y sofocos) |
|
Poco frecuentes: |
Astenia, edema periférico, reacciones en el lugar de la inyección (que incluye dolor, irritación, hinchazón, induración), dolor torácico, aumento de peso, reacción/shock anafiláctico, urticaria |
|
Exploraciones complementarias | |
|
Muy frecuentes: |
Hipofosfatemia |
|
Frecuentes: |
Aumento de la creatinina y la urea en sangre, hipocalcemia |
|
Poco frecuentes: |
Hipomagnesemia, hipopotasemia |
|
Raras: |
Hiperpotasemia, hipernatremia |
Descripción de las reacciones adversas seleccionadas
Deterioro de la función renal
Ácido zoledrónico Strides se ha asociado a notificaciones de alteración de la función renal. En un análisis agrupado de los datos de seguridad de los ensayos clínicos para el registro de Zometa como tratamiento preventivo de los acontecimientos relacionados con el esqueleto en pacientes con neoplasias malignas en estadio avanzado con afectación ósea, se sospechó que la frecuencia de los acontecimientos adversos de deterioro de la función renal estaba relacionada con Zometa (reacciones adversas), con los siguientes resultados: mieloma múltiple (3,2 %), cáncer de próstata (3,1 %), cáncer de mama (4,3 %), cáncer de pulmón y otros tumores sólidos (3,2 %). Los factores que podrían aumentar el riesgo de deterioro de la función renal incluyen la deshidratación, una insuficiencia renal preexistente, varios ciclos de Ácido zoledrónico Strides u otros bisfosfonatos, así como el uso simultáneo de fármacos nefrotóxicos o el empleo de perfusiones administradas en un intervalo de tiempo más breve que el recomendado actualmente. En algunos pacientes se han notificado casos de deterioro de la función renal, progresión de la insuficiencia renal y diálisis tras la dosis inicial o una dosis única de 4 mg de ácido zoledrónico (ver sección 4.4).
Osteonecrosis maxilar
Se han notificado casos de osteonecrosis (principalmente, maxilar) en pacientes tratados con medicamentos inhibidores de la resorción ósea, como Ácido zoledrónico Strides, en especial en pacientes oncológicos. Muchos de estos pacientes presentaron signos de infección local, inclusive osteomielitis, y la mayoría de los informes hacen referencia a pacientes oncológicos tras una extracción dentaria u otras cirugías dentales. La osteonecrosis maxilar tiene distintos factores de riesgo bien documentados, entre ellos, el diagnóstico de cáncer diagnosticado, los tratamientos concomitantes (p. ej., quimioterapia, radioterapia, corticosteroides) y enfermedades asociadas (p. ej., anemia, coagulopatías, infección o afecciones bucales preexistentes).
Aunque no se ha determinado la causalidad, se recomienda evitar la cirugía dental, ya que la recuperación podría ser larga (ver sección 4.4).
Fibrilación auricular
En un ensayo clínico aleatorizado, con doble enmascaramiento, controlado y de 3 años de duración en el que se estudiaba la eficacia y la seguridad de la dosis de 5 mg de ácido zoledrónico, en comparación con el placebo, para el tratamiento de la osteoporosis posmenopáusica (OPM), la incidencia global de fibrilación auricular fue del 2,5 % (96 casos de 3862) en el caso de los pacientes tratados con 5 mg de ácido zoledrónico y del 1,9 % (75 casos de 3852) en los pacientes del grupo placebo. El índice de acontecimientos adversos graves de fibrilación auricular fue del 1,3 % (51 casos de un total de 3862 pacientes) en el grupo de tratamiento con 5 mg de ácido zoledrónico y del 0,6 % (22 casos de un total de 3852 pacientes) en el grupo tratado con el placebo. Las diferencias observadas en este estudio no se han observado en otros ensayos clínicos con ácido zoledrónico, inclusive los realizados con Ácido zoledrónico Strides (ácido zoledrónico) 4 mg cada 3-4 semanas en pacientes oncológicos. Se desconoce el mecanismo subyacente que aumenta la incidencia de la fibrilación auricular en este ensayo clínico en particular.
Reacción en fase aguda
Estas reacciones adversas consistieron en un gran número de síntomas, entre ellos, fiebre, mialgia, cefalea, dolor en las extremidades, náuseas, vómitos, diarrea y artralgia. La aparición de los síntomas es de < 3 días tras la perfusión de Ácido zoledrónico Strides y la reacción también se denomina con los términos de «síntomas gripales» o «posteriores a la administración de la dosis».
Fracturas atípicas del fémur
Durante el período de poscomercialización se han notificado las siguientes reacciones (frecuencia rara):
Fracturas atípicas de la sección subtroncantérea y diafisaria del fémur (reacción adversa relacionada con los bisfosfonatos).
4.9 Sobredosis
La experiencia clínica con sobredosis agudas de Ácido zoledrónico Strides es limitada. Se ha notificado la administración por error de dosis de hasta 48 mg de ácido zoledrónico. Los pacientes que hayan recibido dosis superiores a las recomendadas (ver sección 4.2) deberán someterse a vigilancia estrecha, ya que se ha observado deterioro de la función renal (inclusive, fallo renal) y anomalías en la concentración sanguínea de electrólitos (entre otros, calcio, fósforo y magnesio). En el caso de producirse hipocalcemia, se deberá administrar la perfusión indicada clínicamente de gluconato cálcico.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos para el tratamiento de enfermedades óseas, bisfosfonatos, código ATC: M05BA08
Ácido zoledrónico Strides pertenece a la clase de los bisfosfonatos y actúa principalmente en el hueso. Es un inhibidor de la resorción ósea osteoclástica.
La acción ósea selectiva de los bisfosfonatos se basa en su gran afinidad por el hueso mineralizado, pero el mecanismo molecular preciso que da lugar a la inhibición de la actividad osteoclástica aún no está claro. En los estudios de larga duración realizados en animales, el ácido zoledrónico inhibe la resorción ósea sin perjudicar a la formación, la mineralización ni a las propiedades mecánicas del hueso.
Además de ser un inhibidor potente de la resorción ósea, el ácido zoledrónico también posee varias propiedades antitumorales que podrían contribuir a su eficacia global en el tratamiento de las metástasis óseas. En los ensayos preclínicos se han demostrado las siguientes propiedades:
• In vivo: Inhibición de la resorción ósea osteoclástica, lo que altera el microentomo de la médula ósea, haciendo que sea menos favorable para el crecimiento celular tumoral, la actividad antiangiogénica y la actividad analgésica.
• In vitro: Inhibición de la proliferación osteoblástica, actividad citostática directa y proapoptótica sobre las células tumorales, efecto citostático sinérgico con otros fármacos antineoplásicos y actividad antiadhesiva/invasiva.
Resultados de los ensayos clínicos realizados en la prevención de episodios relacionados con el esqueleto en pacientes con neoplasias malignas avanzadas con afectación ósea.
El primer estudio aleatorizado, con doble enmascaramiento y controlado con placebo comparaba la dosis de 4 mg de ácido zoledrónico con el placebo para la prevención de episodios relacionados con el esqueleto (ERE) en pacientes con cáncer de próstata. La dosis de 4 mg de ácido zoledrónico disminuyó significativamente el porcentaje de pacientes que padecieron al menos un episodio relacionado con el esqueleto (ERE), retrasó la mediana del tiempo transcurrido hasta el primer ERE en más de 5 meses y redujo la incidencia anual de episodios por paciente —tasa de morbilidad esquelética—. El análisis de episodios múltiples mostró una disminución del 36 % del riesgo de desarrollar ERE en el grupo tratado con 4 mg de ácido zoledrónico, en comparación con el placebo. Los pacientes que recibieron 4 mg de ácido zoledrónico registraron un aumento inferior del dolor que los que recibieron placebo y se obtuvieron diferencias significativas en los meses 3, 9, 21 y 24. Un menor número de pacientes tratados con 4 mg de ácido zoledrónico sufrió fracturas patológicas. Los efectos del tratamiento fueron menos evidentes en los pacientes con lesiones blásticas. En la Tabla 2 se muestran los resultados de la eficacia.
En un segundo estudio en el que se incluían tumores sólidos (que no fueran cáncer de mama ni de próstata), la dosis de 4 mg de ácido zoledrónico disminuyó significativamente el porcentaj e de pacientes que sufrieron un ERE, retrasó la mediana del tiempo transcurrido hasta el primer ERE en más de 2 meses y redujo la tasa de morbilidad esquelética. El análisis de episodios múltiples mostró una disminución del 30,7 % del riesgo de desarrollar ERE en el grupo tratado con 4 mg de ácido zoledrónico, en comparación con el placebo. En la Tabla 3 se muestran los resultados de la eficacia.
Tabla 2: Resultados de la eficacia (pacientes con cáncer de próstata que recibieron tratamiento hormonal)
|
Cualquier ERE (+ HIT) |
Fracturas* |
Radioterapia ósea | |||||||
|
Ácido zoledrónico 4 mg |
Placebo |
Ácido zoledrónico 4 mg |
Placebo |
Ácido zoledrónico 4 mg |
Placebo | ||||
|
N |
214 |
208 |
214 |
208 |
214 |
208 | |||
|
Porcentaje de pacientes con ERE (%) |
38 |
49 |
17 |
25 |
26 |
33 | |||
|
Valor p |
0,028 |
0,052 |
0,119 | ||||||
|
Mediana del tiempo transcurrido hasta ERE (días) |
488 |
321 |
NA |
NA |
NA |
640 | |||
|
Valor p |
0,009 |
0,020 |
0,055 | ||||||
|
Tasa de morbilidad esquelética |
0,77 |
1,47 |
0,20 |
0,45 |
0,42 |
0,89 | |||
|
Valor p |
0,005 |
0,023 |
0,060 | ||||||
|
Disminución del riesgo de padecer episodios múltiples** (%) |
36 |
- |
NAp |
NAp |
NAp |
NAp | |||
|
Valor p |
0,002 |
NAp |
NAp |
* Incluye fracturas vertebrales y no vertebrales.
** Tiene en cuenta todos los episodios esqueléticos, el número total y el tiempo transcurrido hasta cada episodio durante el ensayo.
NA: no alcanzado NAp: no aplicable
Tabla 3: Resultados de la eficacia (tumores sólidos que no sean cáncer de mama ni de próstata)
|
Cualquier ERE (+ HIT) |
Fracturas* |
Radioterapia ósea | ||||
|
Ácido zoledrónico 4 mg |
Placebo |
Ácido zoledrónico 4 mg |
Placebo |
Ácido zoledrónico 4 mg |
Placebo | |
|
N |
257 |
250 |
257 |
250 |
257 |
250 |
|
Porcentaje de pacientes con ERE (%) |
39 |
48 |
16 |
22 |
29 |
34 |
|
Valor p |
0,039 |
0,064 |
0,173 | |||
|
Mediana del tiempo transcurrido hasta ERE (días) |
236 |
155 |
NA |
NA |
424 |
307 |
|
Valor p |
0,009 |
0,020 |
0,079 | |||
|
Tasa de morbilidad esquelética |
1,74 |
2,71 |
0,39 |
0,63 |
1,24 |
1,89 |
|
Valor p |
0,012 |
0,066 |
0,099 | |||
|
Disminución del riesgo de padecer episodios múltiples** (%) |
30,7 |
NAp |
NAp |
NAp |
NAp | |
|
Valor p |
0,003 |
NAp |
NAp | |||
* Incluye fracturas vertebrales y no vertebrales.
** Tiene en cuenta todos los episodios esqueléticos, el número total y el tiempo transcurrido hasta cada episodio durante el ensayo.
NA: no alcanzado NAp: no aplicable
En un tercer ensayo en fase III, aleatorizado y con doble enmascaramiento se compararon las dosis de 4 mg de ácido zoledrónico o 90 mg de pamidronato cada 3-4 semanas en pacientes con mieloma múltiple o cáncer de mama con una lesión ósea como mínimo. Los resultados demostraron que la dosis de 4 mg de ácido zoledrónico mostraba una eficacia comparable a la de 90 mg de pamidronato en la prevención de ERE. El análisis de episodios múltiples mostró una disminución significativa del riesgo del 16 % en pacientes tratados con 4 mg de ácido zoledrónico, en comparación con los pacientes que recibieron pamidronato. En la Tabla 4 se muestran los resultados de la eficacia.
Tabla 4: Resultados de la eficacia (pacientes con cáncer de mama y mieloma múltiple)
|
Cualquier ERE (+ HIT) |
Fracturas* |
Radioterapia ósea | ||||
|
Ácido |
Pamidronato |
Ácido |
Pamidronato |
Ácido |
Pamidronato | |
|
zoledrónico 4 mg |
90 mg |
zoledrónico 4 mg |
90 mg |
zoledrónico 4 mg |
90 mg | |
|
N |
561 |
555 |
561 |
555 |
561 |
555 |
|
Porcentaje de pacientes con ERE (%) |
48 |
52 |
37 |
39 |
19 |
24 |
|
Valor p |
0,198 |
0,653 |
0,037 | |||
|
Mediana del tiempo transcurrido hasta ERE (días) |
376 |
356 |
NA |
714 |
NA |
NA |
|
Valor p |
0,151 |
0,672 |
0,026 | |||
|
Tasa de morbilidad esquelética |
1,04 |
1,39 |
0,53 |
0,60 |
0,47 |
0,71 |
|
Valor p |
0,084 |
0,614 |
0,015 | |||
|
Disminución del riesgo de padecer episodios múltiples** (%) |
16 |
NAp |
NAp |
NAp |
NAp | |
|
Valor p |
0,030 |
NAp |
NAp | |||
* Incluye fracturas vertebrales y no vertebrales.
** Tiene en cuenta todos los episodios esqueléticos, el número total y el tiempo transcurrido hasta cada episodio durante el ensayo.
NA: no alcanzado NAp: no aplicable
La dosis de 4 mg de ácido zoledrónico también se estudió en un ensayo clínico con doble enmascaramiento, aleatorizado y controlado con placebo, llevado a cabo en 228 pacientes con metástasis óseas documentadas causadas por el cáncer de mama para evaluar el efecto de la dosis de 4 mg de ácido zoledrónico en la tasa de episodios relacionados con el esqueleto (ERE), calculada como el número total de episodios ERE (a excepción de la hipercalcemia y ajustado para las fracturas previas) dividido por el período total de riesgo. Los pacientes recibieron 4 mg de ácido zoledrónico o placebo cada cuatro semanas durante un año. Los pacientes fueron distribuidos uniformemente a los grupos de tratamiento con ácido zoledrónico o con placebo.
La tasa de ERE (episodios/persona al año) fue de 0,628 en el caso del ácido zoledrónico y de 1,096 para el placebo. El porcentaje de pacientes con al menos un ERE (a excepción de la hipercalcemia) fue del 29,8 % en el grupo tratado con el ácido zoledrónico y del 49,6 % en el grupo tratado con placebo (p = 0,003). En el grupo tratado con ácido zoledrónico no se alcanzó la mediana del tiempo transcurrido hasta la aparición del primer ERE al final del estudio y se prolongó significativamente, en comparación con el grupo de placebo (p = 0,007). En comparación con el placebo, la dosis de 4 mg de ácido zoledrónico disminuyó el riesgo de ERE en un 41 % en el análisis de episodios múltiples (tasa de riesgo = 0,59; p = 0,019).
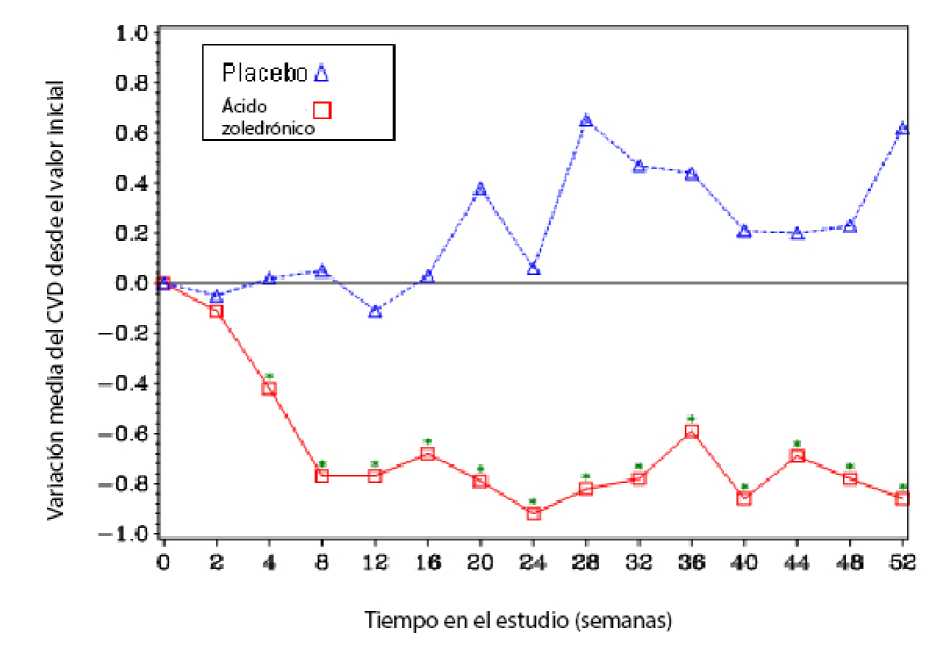
En el grupo tratado con ácido zoledrónico se observó cuando se comparó con el placebo una mejoría estadísticamente significativa en las puntuaciones del dolor (empleando el cuestionario breve del dolor, CVD) a las 4 semanas y en cada uno de los puntos temporales consecutivos del estudio (Figura 1). La puntuación del dolor del grupo de ácido zoledrónico fue sistemáticamente inferior a la inicial y la disminución del dolor estuvo acompañada por una tendencia en la reducción de la puntuación de analgésicos.
<$tp
¿lillas
Figura 1: Variaciones medias de las puntuaciones CVD desde el inicio Las diferencias estadísticamente significativas están marcadas (*p < 0,05) para facilitar la comparación entre los tratamientos (4 mg de ác. zoledrónico comparado con placebo)
Resultados de los ensayos clínicos en el tratamiento de la HIT
Los ensayos clínicos sobre hipercalcemia inducida por tumor (HIT) demostraron que el efecto del ácido zoledrónico se caracteriza por disminuir la concentración del calcio sérico y la excreción urinaria de calcio. En los estudios en Fase I de determinación de la dosis en pacientes con hipercalcemia de leve a moderada inducida por tumor (HIT), las dosis eficaces ensayadas estaban contenidas en el intervalo aproximado de 1,2-2,5 mg.
Para valorar los efectos de ácido zoledrónico 4 mg en comparación con pamidronato 90 mg, se combinaron los resultados de dos ensayos multicéntricos fundamentales en pacientes con HIT en un análisis planificado previamente. Hubo una normalización más rápida de las concentraciones corregidas del calcio sérico en el Día 4 para la dosis de 8 mg de ácido zoledrónico, y en el Día 7 para las dosis de 4 mg y 8 mg de ácido zoledrónico. Se observaron las siguientes tasas de respuesta:
Tabla 5: Porcentaje de individuos con respuesta completa por día en los estudios combinados de HIT
|
Día 4 |
Día 7 |
Día 10 | |
|
Ácido zoledrónico 4 mg (n = 86) |
45,3 % (p = 0,104) |
82,6 % (p = 0,005)* |
88,4 % (p = 0,002)* |
|
Ácido zoledrónico 8 mg (n = 90) |
55,6 % (p = 0,021)* |
83,3 % (p = 0,010)* |
86,7 % (p = 0,015)* |
|
Pamidronato 90 mg |
33,3 % |
63,6 % |
69,7 % |
|
(n = 99) | |||
|
* valores de p comparados |
con pamidronato | ||
|
La mediana del tiempo |
transcurrido hasta la normocalcemia fue de 4 días. |
La mediana del tiempo | |
transcurrido hasta una recaída (nuevo aumento de los valores de calcio sérico corregidos respecto a la albúmina 2,9 mmol/l) fue de 30 a 40 días para los pacientes tratados con ácido zoledrónico, en comparación con los 17 días de los tratados con 90 mg de pamidronato (valores de p: 0,001 para la dosis de 4 mg y 0,007 para la de 8 mg). No hubo diferencias estadísticamente significativas entre las dos dosis de ácido zoledrónico.
En los ensayos clínicos se volvió a tratar a 69 pacientes que recayeron o fueron resistentes al tratamiento inicial (4 mg u 8 mg de ácido zoledrónico o 90 mg de pamidronato) con 8 mg de ácido zoledrónico. La tasa de respuesta en estos pacientes fue de un 52 %. Puesto que estos pacientes fueron tratados de nuevo únicamente con la dosis de 8 mg, no se dispone de datos que permitan la comparación con la dosis de 4 mg de ácido zoledrónico.
En los ensayos clínicos realizados en pacientes con hipercalcemia inducida por tumor (HIT), el perfil de seguridad global de los tres grupos de tratamiento (4 mg y 8 mg de ácido zoledrónico y 90 mg de pamidronato) fue similar en cuanto al tipo y la gravedad.
Población pediátrica
Resultados de los ensayos clínicos en el tratamiento de la osteogénesis imperfecta grave en pacientes pediátricos con edades comprendidas entre 1 y 17 años
En un estudio internacional, multicéntrico, aleatorizado, en abierto y con dos grupos de tratamiento de 74 y 76 pacientes, se compararon los efectos del ácido zoledrónico intravenoso en el tratamiento de pacientes pediátricos (edad comprendida entre 1 y 17 años) con osteogénesis imperfecta grave (tipos I, III y IV) con el tratamiento con pamidronato intravenoso, respectivamente. El período de tratamiento del estudio fue de 12 meses, con un período previo de cribado de 4-9 semanas durante el que se administraron suplementos de vitamina D y calcio elemental durante un mínimo de 2 semanas. En el programa clínico, los pacientes con edades comprendidas entre 1 y menos de 3 años recibieron 0,025 mg/kg de ácido zoledrónico (hasta una dosis única máxima de 0,35 mg) cada 3 meses, y los pacientes con edades comprendidas entre 3 y 17 años recibieron 0,05 mg/kg de ácido zoledrónico (hasta una dosis única máxima de 0,83 mg) cada 3 meses. Se llevó a cabo un estudio de extensión para evaluar la seguridad general y renal a largo plazo de la administración de ácido zoledrónico 1 vez/año o 2 veces/año a lo largo de un período de tratamiento de extensión de 12 meses en niños que habían sido sometidos a un tratamiento de un año con ácido zoledrónico o pamidronato en el estudio principal.
El criterio de valoración principal del estudio fue el cambio porcentual desde el inicio de la densidad mineral ósea (DMO) de la columna lumbar transcurridos 12 meses de tratamiento. Los efectos calculados del tratamiento en la DMO fueron similares, pero el diseño del estudio no fue suficientemente potente para establecer la ausencia de inferioridad de la eficacia del ácido zoledrónico. En concreto, no se obtuvieron datos evidentes de la eficacia en la incidencia de fracturas o dolor. Se notificaron acontecimientos adversos de fracturas de huesos largos en las extremidades inferiores en un 24 % (fémur) y un 14 % (tibia) en los pacientes tratados con ácido zoledrónico, en comparación con el 12 % y el 5 % de los pacientes tratados con pamidronato con osteogénesis imperfecta grave, independientemente del tipo y de la causalidad de la enfermedad, pero la incidencia general de fracturas se pudo comparar entre los pacientes tratados con ácido zoledrónico y pamidronato: 43 % (32/74) comparado con 41 % (31/76). La interpretación del riesgo de fractura es confusa por el hecho de que las fracturas son episodios frecuentes en los pacientes con osteogénesis imperfecta como parte del proceso patológico.
El tipo de reacciones adversas observadas en esta población de pacientes fue similar a las observadas previamente en adultos con neoplasias malignas en estadio avanzado con afectación ósea (ver sección 4.8). En la Tabla 6 se muestran las reacciones adversas clasificadas en función de la frecuencia. Se ha empleado la siguiente clasificación normativa: muy frecuentes ( 1/10), frecuentes ( 1/100 a <1/10), poco frecuentes (
1/1.000 a <1/100), raras ( 1/10.000 a <1/1000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 6: Reacciones adversas observadas en la población pediátrica con osteogénesis imperfecta grave1
|
Trastornos del sistema nervioso | ||
|
Frecuentes: |
Cefalea | |
|
Trastornos cardíacos | ||
|
Frecuentes: |
Taquicardia | |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Frecuentes: |
Nasofaringitis | |
|
Trastornos gastrointestinales | ||
|
Muy frecuentes: |
Vómitos, náuseas | |
|
Frecuentes: |
Dolor abdominal | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Frecuentes: |
Dolor de extremidades, artralgia, dolor musculoesquelético | |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Muy frecuentes: |
Pirexia, fatiga | |
|
Frecuentes: |
Reacción en fase aguda, dolor | |
|
Exploraciones complementarias | ||
|
Muy frecuentes: |
Hipocalcemia | |
|
Frecuentes: |
Hipofosfatemia | |
Se evaluaron clínicamente los acontecimientos adversos que se presentaron con una incidencia inferior al 5 % y se observó que estos casos concuerdan con el perfil de seguridad establecido de Ácido zoledrónico Strides (ver sección 4.8).
En los pacientes pediátricos con osteogénesis imperfecta grave, el ácido zoledrónico parece estar asociado a un riesgo más evidente de reacción en fase aguda, hipocalcemia y taquicardia idiopática, en comparación con el pamidronato, aunque esta diferencia se redujo después de las perfusiones sucesivas.
La Agencia Europea del Medicamento ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con el fármaco de referencia que contiene ácido zoledrónico (Zometa) en los diferentes grupos de la población pediátrica en el tratamiento hipercalcemia inducida por tumor y la prevención de episodios relacionados con el esqueleto en pacientes con neoplasias malignas en estadio avanzado con afectación ósea (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Las perfusiones únicas y múltiples durante 5 y 15 minutos de 2, 4, 8 y 16 mg de ácido zoledrónico en 64 pacientes con metástasis óseas dieron como resultado los siguientes datos farmacocinéticos, observándose que son independientes de la dosis.
Después de iniciar la perfusión de ácido zoledrónico, las concentraciones plasmáticas del ácido zoledrónico aumentaron rápidamente y alcanzaron su nivel máximo al final del periodo de perfusión, seguido de un rápido descenso hasta < 10 % del punto máximo transcurridas 4 horas y < 1 % del punto máximo
transcurridas 24 horas, con un período posterior prolongado de concentraciones muy bajas que no superan el 0,1 % del máximo antes de la segunda perfusión de ácido zoledrónico el Día 28.
El ácido zoledrónico administrado por vía intravenosa se elimina por un proceso en tres fases: eliminación bifásica rápida de la circulación sistémica, con semividas de t1/2a 0,24 y t1/2p 1,87 horas, seguida de una fase de eliminación prolongada con una semivida de eliminación terminal de t1/2y 146 horas. Después de la administración de dosis múltiples de ácido zoledrónico cada 28 días no hubo acumulación de éste en plasma. El ácido zoledrónico no se metaboliza y se excreta inalterado por vía renal. Durante las primeras 24 horas, el 39 ± 16 % de la dosis administrada se recupera en la orina, mientras que el resto se une principalmente al tejido óseo. Se libera muy lentamente del tejido óseo, volviendo a la circulación sistémica y se elimina por vía renal. El aclaramiento corporal total es de 5,04 ± 2,5 l/h, es independiente de la dosis y no se ve afectado por el sexo, la edad, la etnia ni el peso corporal. El aumento del tiempo de perfusión de 5 a 15 minutos produjo un descenso del 30 % en la concentración de ácido zoledrónico al final de la perfusión, pero no afectó al área bajo la curva de la concentración plasmática frente al tiempo.
La variabilidad entre pacientes de los parámetros farmacocinéticos del ácido zoledrónico fue elevada, tal como se ha observado en otros bisfosfonatos.
No se dispone de datos farmacocinéticos del ácido zoledrónico de pacientes con hipercalcemia ni de pacientes con insuficiencia hepática. El ácido zoledrónico no inhibe las enzimas humanas del citocromo P450 in vitro, no muestra biotransformación y, en los estudios realizados con animales, se recuperó menos del 3 % de la dosis administrada en las heces, lo que indica que la función hepática no desempeña una función importante en la farmacocinética del ácido zoledrónico.
El aclaramiento renal del ácido zoledrónico se correlacionó con el aclaramiento de creatinina, representando el aclaramiento renal el 75 ± 33 % del aclaramiento de creatinina, que mostró una media de 84 ± 29 ml/min (intervalo de 22 a 143 ml/min) en los 64 pacientes oncológicos estudiados. El análisis de la población mostró que para un paciente con un aclaramiento de la creatinina de 20 ml/min (insuficiencia renal grave) o 50 ml/min (insuficiencia moderada), el correspondiente aclaramiento del ácido zoledrónico esperado sería de un 37 % o 72 % respectivamente, el de un paciente que presentara un aclaramiento de creatinina de 84 ml/min. Unicamente se dispone de datos farmacocinéticos limitados en pacientes con insuficiencia renal grave (aclaramiento de la creatinina < 30 ml/min).
El ácido zoledrónico no muestra afinidad por los elementos celulares de la sangre y su unión a las proteínas plasmáticas es baja (aproximadamente, un 56 %) e independiente de la concentración de ácido zoledrónico.
Poblaciones específicas
Pacientes pediátricos
Los escasos datos farmacocinéticos en niños con osteogénesis imperfecta grave sugieren que las farmacocinéticas del ácido zoledrónico en la población pediátrica con edades comprendidas entre 3 y 17 años es similar a las de los adultos con una concentración de la dosis mg/kg similar. Parece ser que la edad, el peso corporal, el sexo y el aclaramiento de la creatinina no tienen efecto alguno sobre la exposición sistémica al ácido zoledrónico.
5.3 Datos preclínicos sobre seguridad
Toxicidad aguda
La dosis única intravenosa máxima no letal fue de 10 mg/kg de peso corporal en ratones y de 0,6 mg/kg en ratas.
Toxicidad crónica y subcrónica
El ácido zoledrónico fue bien tolerado cuando se administró por vía subcutánea a ratas y por vía intravenosa a perros en dosis de hasta 0,02 mg/kg al día durante 4 semanas. La administración de 0,001 mg/kg/día por vía subcutánea a ratas y de 0,005 mg/kg por vía intravenosa una vez cada 2-3 días a perros durante un máximo de 52 semanas también fue bien tolerada.
El signo más frecuente de los estudios de dosis repetidas consistió en el aumento de la sustancia esponjosa primaria de las metáfisis de los huesos largos de animales en período de crecimiento a prácticamente todas las dosis, lo que refleja la actividad farmacológica inhibidora de la resorción del compuesto.
Los márgenes de seguridad relativos a los efectos renales fueron estrechos en los estudios realizados con animales a largo plazo y con dosis parenterales repetidas, pero los niveles acumulados sin efectos adversos (NOAEL, no adverse event levels) en los estudios de dosis única (1,6 mg/kg) y dosis múltiples durante un máximo de un mes (0,06-0,6 mg/kg/día) no indicaron efectos renales con dosis equivalentes o superiores a la dosis terapéutica mayor recomendada en humanos. La administración repetida a más largo plazo de dosis cercanas a la dosis terapéutica mayor recomendada en humanos de ácido zoledrónico produjo efectos tóxicos en otros órganos, entre ellos, el tubo digestivo, el hígado, el bazo y los pulmones, además de en las zonas de inyección intravenosa.
Toxicidad para la reproducción
El ácido zoledrónico fue teratógeno en ratas en dosis subcutáneas 0,2 mg/kg. Aunque no se observó teratogenicidad o fetotoxicidad en los conejos, sí se observó toxicidad materna. En ratas se observó distocia en la dosis más baja (0,01 mg/kg de peso corporal) analizada.
Mutagenicidad y potencial carcinogénico
El ácido zoledrónico no fue mutagénico en los ensayos de mutagenicidad realizados y los ensayos de carcinogénesis no revelaron signo alguno de potencial carcinogénico.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Manitol (E-421)
Citrato sódico (E-331)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
Este medicamento no debe mezclarse con soluciones para perfusión que contengan calcio u otros cationes bivalentes, como la solución de lactato sódico compuesta, y se deberá administrar como solución intravenosa única en una vía de perfusión individual.
6.3 Periodo de validez
2 años
Tras la dilución: Desde el punto de vista microbiológico, la solución diluida para perfusión deberá utilizarse de inmediato. Si no se usa de inmediato, el tiempo y las condiciones de conservación antes de su uso son responsabilidad del usuario y por lo general no deberían superar las 24 horas a 2-8 °C. La solución refrigerada deberá atemperarse antes de su administración.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
Para las condiciones de conservación tras la dilución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de cristal incoloro de 5 ml, con tapón de goma de bromobutilo con revestimiento de fluoropolímero de color gris y cápsula de aluminio con un disco de plástico superpuesto de color rojo.
Se comercializa en envases de 1, 4 o 10 viales. Cada vial contiene 5 ml de solución.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Antes de la administración se deberán diluir 5,0 ml de concentrado de un vial o del volumen del concentrado retirado debidamente en 100 ml de solución estéril que no contenga calcio (solución de cloruro sódico al 0,9 % m/v o solución glucosada al 5 % m/v).
En la sección 4.2 puede consultar más información sobre la manipulación de Ácido zoledrónico Strides, así como las indicaciones para la preparación de las dosis reducidas.
La preparación de la perfusión se deberá realizar con métodos asépticos. Para un solo uso.
Únicamente se deberá emplear la solución transparente, sin partículas ni alteración del color.
Se recuerda al personal sanitario que la eliminación de Ácido zoledrónico Strides sobrante no debe realizarse a través del sistema de desagüe convencional.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizarán de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Strides Arcolab International Ltd.
Unit 4, Metro Centre, Tolpits Lane,
Watford, Hertfordshire WD 189SS Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Agosto de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
12/2012
18 de 18