Acido Ibandronico Kern Pharma 6 Mg Concentrado Para Solucion Para Perfusion Efg
Información obsoleta, busque otroFICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Ácido Ibandrónico Kem Pharma 6 mg concentrado para solución para perfusión EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un vial de 6 ml de concentrado para solución para perfusión contiene 6 mg de ácido ibadrónico (como 6,75 mg de ácido ibandrónico, sal monosódica, monohidrato).
Excipiente(s) con efecto conocido: Sodio (menos de 1 mmol por dosis).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado para solución para perfusión.
Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Ácido Ibandrónico Kern Pharma está indicado en adultos para:
• La prevención de acontecimientos óseos (fracturas patológicas, complicaciones óseas que requieren radioterapia o cirugía) en pacientes con cáncer de mama y metástasis óseas.
Tratamiento de la hipercalcemia inducida por un tumor, con o sin metástasis.
4.2 Posología y forma de administración
La terapia con Ácido Ibandrónico Kern Pharma sólo debe iniciarla un médico con experiencia en el tratamiento del cáncer.
Posología
Prevención de acontecimientos óseos en pacientes con cáncer de mama y metástasis óseas La dosis recomendada para la prevención de acontecimientos óseos en pacientes con cáncer de mama y metástasis óseas es de 6 mg en inyección intravenosa, administrada cada 3-4 semanas. La dosis debe ser perfundida durante al menos 15 minutos. Para la perfusión, se debe añadir el contenido del víal(es) a sólo 100 ml de una solución isotónica de cloruro sódico o a 100 ml de solución de glucosa al 5%.
Sólo debe emplearse un tiempo de perfusión más corto (es decir, 15 minutos) en pacientes con función renal normal o con una alteración renal leve. No hay datos disponibles que avalen el uso de un tiempo de perfusión más corto en pacientes con un aclaramiento de creatinina por debajo de 50 ml/min. Para recomendaciones sobre dosis y administración en este grupo de pacientes, los médicos deben consultar el epígrafe Pacientes con insuficiencia renal (ver sección 4.2.)
Tratamiento de la hipercalcemia inducida por tumores
Antes del tratamiento con Ácido Ibandrónico Kem Pharma, el paciente debe ser rehidratado adecuadamente con 9 mg/ml (0,9%) de cloruro sódico. Debe considerarse tanto la gravedad de la hipercalcemia como el tipo de tumor. En general, los pacientes con metástasis óseas osteolíticas requieren dosis más bajas que los pacientes con hipercalcemia de tipo humoral. En la mayoría de pacientes con hipercalcemia grave (calcio sérico corregido por la albúmina* > 3 mmol/l ó > 12 mg/dl) 4 mg es una dosis única adecuada. En pacientes con hipercalcemia moderada (calcio sérico corregido por la albúmina < 3 mmol/l o <12 mg/dl) 2 mg es una dosis eficaz. La dosis máxima empleada en ensayos clínicos fue de 6 mg, pero esta dosis no aporta beneficio adicional en términos de eficacia.
* Nota: las concentraciones de calcio sérico corregido por la albúmina se calculan como sigue:
Calcio sérico corregido por la albúmina (mmol/l)
Calcio sérico corregido por la albúmina (mg/dl)
calcio sérico (mmol/l) - [0,02 x albúmina (g/l)] + 0,8 O bien
calcio sérico (mg/dl) + 0,8 x [4 - albúmina (g/dl)]
Para convertir el valor del calcio sérico corregido por la albúmina de mmol/l en mg/dl, hay que multiplicar por 4.
En la mayoría de los casos, un nivel aumentado de calcio sérico puede reducirse a niveles normales en un plazo de 7 días. La mediana del tiempo hasta la recaída (nuevo aumento por encima de 3 mmol/l del nivel sérico de calcio sérico corregido por la albúmina) fue de 18-19 días para las dosis de 2 mg y 4 mg. La mediana del tiempo hasta la recaída fue de 26 días con la dosis de 6 mg.
Un número limitado de pacientes (50 pacientes) recibieron una segunda perfusión por hipercalcemia. En caso de hipercalcemia recurrente o falta de eficacia puede considerarse una repetición del tratamiento.
Pacientes con insuficiencia hepática
No se requiere ajuste de dosis (ver sección 5.2).
Pacientes con insuficiencia renal
No se requiere ajuste de dosis para pacientes con insuficiencia renal leve (CLcr = 50 y < 80 ml/min). Los pacientes con insuficiencia renal moderada (CLcr = 30 y < 50 ml/min) o con insuficiencia renal grave (CLcr < 30 ml/min), que además padecen cáncer de mama y enfermedad metastásica ósea y, que están siendo tratados para la prevención de acontecimientos óseos deben seguir las siguientes recomendaciones posológicas (ver sección 5.2):
|
Aclaramiento de Creatinina (ml/min) |
1 Dosis / Tiempo de perfusión |
Volumen de perfusión2 |
|
>50 CLcr <80 |
6 mg / 15 minutos |
100 ml |
|
>30 CLcr <50 |
4 mg / 1 hora |
500 ml |
|
<30 |
2 mg / 1 hora |
500 ml |
1 Administración cada 3-4 semanas
2 0,9% de solución de cloruro sódico ó 5% de solución de glucosa
No se ha estudiado un tiempo de perfusión de 15 minutos en pacientes con cáncer con un CLCr < 50 ml/min.
Pacientes de edad avanzada No se requiere un ajuste de dosis.
Población pediátrica
No se ha establecido la seguridad y eficacia de Ácido Ibandrónico Kem Pharma en niños y adolescentes menores de 18 años. No hay datos disponibles.
Forma de administración Por vía intravenosa.
Para un solo uso. Únicamente se debe emplear si la solución es transparente y sin partículas.
Ácido Ibandrónico Kern Pharma 6 mg concentrado para solución para perfusión debe administrarse como perfusión intravenosa. Para ello hay que agregar el contenido de los viales a 500 ml de solución isotónica de cloruro sódico (ó 500 ml de solución de dextrosa al 5%) y perfundirlo durante dos horas.
Considerando que tanto la administración intra-arterial accidental de preparaciones no expresamente recomendadas para este fin, como la extravasación venosa pueden producir lesiones tisulares, hay que tener especial precaución en que Ácido Ibandrónico Kern Pharma 6 mg concentrado para solución para perfusión sea administrado por vía intravenosa.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes.
• Debe prestarse especial atención a los pacientes con hipersensibilidad conocida a otros bifosfonatos.
Hipocalcemia.
4.4 Advertencias y precauciones especiales de empleo
Pacientes con alteraciones del metabolismo óseo y mineral
Antes de comenzar el tratamiento con Ácido Ibandrónico Kern Pharma para las metástasis óseas, se debe tratar de forma efectiva la hipocalcemia y otras alteraciones del metabolismo óseo y mineral.
Es importante que exista una adecuada ingesta de calcio y vitamina D en todos los pacientes. Los pacientes deberán recibir suplementos de calcio y/o de vitamina D en caso de que la ingesta en la dieta no sea adecuada.
Osteonecrosis mandibular (ONM)
Se han notificado casos de osteonecrosis mandibular generalmente asociados con extracciones dentales y/o infecciones locales (incluyendo osteomielitis) en pacientes oncológicos que recibieron un tratamiento que incluía principalmente bifosfonatos de administración intravenosa. La mayoría de estos pacientes también recibieron quimioterapia y corticosteroides. También se ha notificado osteonecrosis mandibular en pacientes con osteoporosis tratados con bifosfonatos de administración oral.
En aquellos pacientes con factores de riesgo concomitantes (p.ej. cáncer, quimioterapia, radioterapia, corticosteroides, higiene bucal pobre) antes de iniciar el tratamiento con bifosfonatos deberá considerarse la realización de un examen dental con una odontología preventiva apropiada.
En la medida de lo posible, los pacientes deben evitar procesos dentales invasivos durante el tratamiento. La cirugía dental puede agravar la situación de los pacientes que desarrollen osteonecrosis mandibular durante la terapia con bifosfonatos. No hay datos disponibles que sugieran que la interrupción del tratamiento con bisfosfonatos reduce el riesgo de osteonecrosis mandibular en pacientes que precisen procesos dentales. La valoración clínica, debe orientar sobre cómo proceder con cada paciente según la valoración individual de la relación beneficio-riesgo.
Fracturas atípicas de fémur
Se han notificado casos de fracturas atípicas subtrocantéricas y diafisarias del fémur asociadas al tratamiento con bisfosfonatos, principalmente en pacientes en tratamiento prolongado para la osteoporosis. Estas fracturas transversales u oblicuas cortas pueden ocurrir en cualquier parte a lo largo del fémur, desde justo debajo del trocánter menor hasta justo por encima de la cresta supracondílea. Estas fracturas se producen después de un traumatismo mínimo o en ausencia de él y algunos pacientes tienen dolor en el muslo o en la ingle, a menudo asociado con imágenes características de fracturas por sobrecarga, semanas a meses antes de que se presente la fractura femoral completa. Las fracturas son generalmente bilaterales; por lo tanto, el fémur del lado opuesto debe ser examinado en los pacientes tratados con bisfosfonatos que hayan tenido una fractura de la diáfisis femoral. También se ha notificado un bajo índice de consolidación de estas fracturas. Debe considerarse la interrupción del tratamiento con bisfosfonatos, valorando de forma individualizada el balance beneficio/riesgo, en aquellos pacientes en los que exista sospecha de fractura atípica de fémur pendiente de evaluación. Durante el tratamiento con bisfosfonatos debe advertirse a los pacientes que notifiquen cualquier dolor en el muslo, cadera o ingle. En cualquier paciente que presente dichos síntomas deberá valorarse si existe una fractura de fémur incompleta.
Pacientes con insuficiencia renal
Los ensayos clínicos no han mostrado ninguna evidencia de deterioro de la función renal relacionada con el tratamiento a largo plazo con Ácido Ibandrónico Kern Pharma. Aun así, de acuerdo con la evaluación clínica individual de cada paciente, se recomienda monitorizar la función renal y el calcio, fosfato y magnesio séricos en los pacientes tratados con Ácido Ibandrónico Kern Pharma.
Pacientes con insuficiencia hepática
Considerando que no se dispone de datos clínicos, no es posible hacer recomendaciones sobre la dosis a emplear en pacientes con insuficiencia hepática grave.
Pacientes con insuficiencia cardiaca
Hay que evitar la hiperhidratación en pacientes con riesgo de insuficiencia cardiaca.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios de interacciones se han realizado sólo en adultos.
No se ha observado interacción en la co-administración con melfalan/prednisolona en pacientes con mieloma múltiple.
Otros estudios de interacción llevados a cabo en mujeres postmenopáusicas han demostrado la ausencia de cualquier interacción potencial con tamoxifeno o terapia hormonal sustitutoria (estrógenos).
En relación con la disponibilidad del medicamento, no son probables interacciones medicamentosas que sean clínicamente relevantes. El ácido ibandrónico sólo se elimina por secreción renal y no sufre ninguna biotransformación. La vía secretora no parece que incluya ningún sistema conocido de transporte básico o ácido relacionado con la excreción de otros principios activos. Además, el ácido ibandrónico no inhibe las principales isoenzimas P450 hepáticas humanas y tampoco induce el sistema del citocromo P450 hepático en ratas. La unión a proteínas plasmáticas es baja a concentraciones terapéuticas y, por tanto, es improbable que el ácido ibandrónico desplace a otros principios activos.
Se recomienda especial precaución en caso de que los bifosfonatos se administren con aminoglucósidos, ya que ambos medicamentos pueden disminuir los niveles de calcio sérico durante períodos de tiempo prolongados. También se debe prestar atención a la posible existencia de hipomagnesemia simultánea.
En ensayos clínicos, se ha administrado concomitantemente ácido ibandrónico con antineoplásicos, diuréticos, antibióticos y analgésicos empleados comúnmente, sin que se apreciaran interacciones clínicas.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización del ácido ibandrónico en mujeres embarazadas. Los estudios realizados en ratas han mostrado la existencia de toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. En consecuencia, Ácido Ibandrónico Kern Pharma no debe utilizarse durante el embarazo.
Lactancia
Se desconoce si el ácido ibandrónico se excreta en la leche humana. Los estudios realizados en ratas lactantes mostraron la presencia de niveles bajos de ácido ibandrónico en la leche tras su administración intravenosa. Ácido Ibandrónico Kern Pharma no debe utilizarse durante la lactancia.
Fertilidad
No hay datos de los efectos del ácido ibandrónico en humanos. En estudios sobre la función reproductora en ratas por vía oral, el ácido ibandrónico disminuyó la fertilidad. En estudios en ratas por vía intravenosa, el ácido ibandrónico disminuyó la fertilidad a dosis diarias altas (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas se listan por frecuencias, empezando por las más frecuentes y siguiendo la siguiente convención: muy frecuentes (> 1/10), frecuentes ( > 1/100 y < 1/10), poco frecuentes (> 1/1.000 y < 1/100), raras ( > 1/10.000 y 1/1.000) y muy raras ( < 1/10.000).
Tratamiento de la hipercalcemia inducida por tumores
El perfil de seguridad de ácido ibandrónico en hipercalcemia inducida por tumores se deriva de los ensayos clínicos controlados en esta indicación y tras la administración intravenosa de ácido ibandrónico a las dosis recomendadas. El tratamiento fue comúnmente asociado con un aumento de la temperatura corporal. Ocasionalmente, se ha notificado un síndrome seudogripal con fiebre, escalofríos, dolor óseo y/o dolor muscular. En la mayoría de los casos no se requirió ningún tratamiento específico y los síntomas desaparecieron en un par de horas/días.
Tabla 1 Reacciones Adversas en los ensayos clínicos controlados en tratamiento con ácido ibandrónico para la hipercalcemia inducida por tumores
|
Clasificación Órgano Sistema |
Muy frecuentes |
Poco frecuentes | |||
|
F recuentes |
Raras |
Muy raras | |||
|
Trastornos del sistema inmunológico |
Hipersensibilidad | ||||
|
Trastornos del metabolismo y de la nutrición |
Hipocalcemia** | ||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Broncoespasmos | ||||
|
Trastornos de la piel y del tejido |
Edema angioneurótico |
|
subcutáneo | |||||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor óseo |
Mialgia | |||
|
Trastornos generales y alteraciones en el lugar de administración |
Pirexia |
Enfermedad seudogripal**, escalofríos |
Nota: Se han agrupado los datos obtenidos con las dosis de 2 mg y 4 mg de ácido ibandrónico. **Ver abajo más información
Hipocalcemia
La reducción de la excreción renal de calcio se acompaña de un descenso de los niveles de fosfato sérico, que no requiere medidas terapéuticas. El nivel de calcio en el suero puede descender a valores hipocalcémicos.
Enfermedad seudogripal
En el síndrome seudogripal se han presentado síntomas de fiebre, escalofríos, dolor óseo y/o muscular. En la mayoría de los casos estos síntomas remitieron sin requerir medidas adicionales tras un par de horas/días.
Prevención de acontecimientos óseos en pacientes con cáncer de mama y metástasis óseas El perfil de seguridad de ácido ibandrónico intravenoso en pacientes con cáncer de mama y metástasis óseas se deriva de un ensayo clínico controlado en esta indicación y tras la administración de ácido ibandrónico a las dosis recomendadas.
La Tabla 2 enumera las reacciones adversas al fármaco de un ensayo pivotal en fase III (152 pacientes tratados con ácido ibandrónico 6 mg), observadas con remota, posible o probable relación con la medicación en estudio, y de la experiencia post-comercialización.
Tabla 2 Reacciones adversas al fármaco ocurridas en pacientes con metástasis óseas provocadas por el cáncer de mama y tratadas con ácido ibandrónico 6 mg intravenoso
|
Clasificación Órgano Sistema |
Muy frecuentes |
F recuentes |
Poco frecuentes |
Raras |
Muy raras |
|
Infecciones e infestaciones |
Infección |
Cistitis, vaginitis, candidiasis oral | |||
|
Neoplasias benignas, malignas y no especificadas |
Neoplasia benigna de piel | ||||
|
Trastornos de la sangre y del sistema linfático |
Anemia, discrasia sanguínea | ||||
|
Trastornos endocrinos |
Alteraciones paratiroideas | ||||
|
Trastornos del metabolismo y de la nutrición |
Hipofosfatemia |
|
Trastornos psiquiátricos |
Alteración del sueño, ansiedad, inestabilidad afectiva | ||||
|
Trastornos del sistema nervioso |
Dolor de cabeza, Mareos, disgeusia (alteración del gusto) |
Alteración cerebrovascular, lesión de la raíz nerviosa, amnesia, migrañas, neuralgia, hipertonía, hiperestesia, parestesia peribucal, parosmia | |||
|
Trastornos oculares |
Cataratas |
Inflamación ocular f** | |||
|
Trastornos del oído y del laberinto |
Sordera | ||||
|
Trastornos cardiacos |
Bloqueo de rama |
Isquemia miocárdica, alteración cardiovascular, palpitaciones | |||
|
Trastornos respiratorios, torácicos y mediastínicos |
Faringitis |
Edema pulmonar, estridor | |||
|
Trastornos gastrointestinales |
Diarrea, vómitos, dispepsia, dolor gastrointestinal, alteración dental |
Gastroenteritis, gastritis, ulceración bucal, disfagia, quelitis | |||
|
Trastornos hepatobiliares |
Colelitiasis | ||||
|
Trastornos de la piel y del tejido subcutáneo |
Alteración cutánea, Equímosis |
Rash, alopecia | |||
|
Trastornos musculoesqueléti-cos y del tejido conjuntivo |
Artrosis, mialgia, artralgia, alteración articular |
Fracturas atípicas subtrocantéri-cas y diafisarias del fémur f (reacción adversa de clase de los bisfosfonatos) |
Osteonecrosi s mandibular f** | ||
|
Trastornos renales y urinarios |
Retención urinaria, quiste renal | ||||
|
Trastornos del |
Dolor pélvico |
|
aparato reproductor y de la mama | |||||
|
Trastornos generales y alteraciones en el lugar de administración |
Enfermedad seudogripal,edema periférico, astenia, sed excesiva |
Hipotermia | |||
|
Exploraciones complementarias |
Aumento de la Gamma-GT, aumento de la creatinina |
Aumento de la fosfatasa alcalina en sangre, pérdida de peso | |||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Lesión, dolor en el lugar de la inyección |
**Ver abajo más información
fIdentificados en la experiencia post-comercialización
Osteonecrosis mandibular
Se ha notificado osteonecrosis mandibular en pacientes tratados con bifosfonatos. La mayoría de los informes se refieren a pacientes oncológicos, pero también se han notificado casos en pacientes tratados de osteoporosis. La osteonecrosis mandibular generalmente se asocia con extracciones dentales y/o infecciones locales (incluyendo osteomielitis). También se consideran factores de riesgo el diagnóstico de cáncer, quimioterapia, radioterapia, corticosteroides y una higiene bucal pobre (ver sección 4.4)
Inflamación ocular
Se han notificado casos de inflamación ocular como uveítis, episcleritis y escleritis con el tratamiento con ácido ibandrónico. En algunos casos estos acontecimientos no se resolvieron hasta que se interrumpió el tratamiento con ácido ibandrónico.
Notificación de sospechas de reaciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
Hasta el momento no hay experiencia de intoxicación aguda con Ácido Ibandrónico concentrado para solución para perfusión. Teniendo en cuenta que en los estudios preclínicos a dosis altas se observó que tanto el riñón como el hígado son órganos diana en cuanto a la toxicidad, se deben controlar la función renal y hepática. La hipocalcemia clínicamente relevante deberá corregirse mediante la administración intravenosa de gluconato cálcico.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Medicamentos para el tratamiento de las enfermedades óseas, bifosfonato, código ATC: M05B A 06
El ácido ibandrónico pertenece al grupo de los bifosfonatos, compuestos que actúan específicamente sobre el hueso. Su acción selectiva sobre el tejido óseo se debe a la alta afinidad de los bifosfonatos por el mineral óseo. Los bifosfonatos actúan inhibiendo la actividad de los osteoclastos, aunque el mecanismo exacto todavía no está claro.
In vivo, el ácido ibandrónico previene la destrucción ósea inducida experimentalmente por la supresión de la función gonadal, retinoides, tumores o extractos tumorales. La inhibición de la resorción ósea endógena ha sido también demostrada mediante estudios cinéticos con 45Ca y mediante la liberación de tetraciclina radioactiva previamente incorporada al esqueleto.
A dosis considerablemente más altas que las dosis farmacológicamente eficaces, el ácido ibandrónico no tuvo ningún efecto sobre la mineralización ósea.
La resorción ósea provocada por la enfermedad maligna se caracteriza por una excesiva resorción ósea que no está equilibrada con la apropiada formación ósea. El ácido ibandrónico inhibe selectivamente la actividad de los osteoclastos, reduciendo la resorción ósea y, por tanto, reduce las complicaciones esqueléticas de la enfermedad maligna.
Ensayos clínicos en el tratamiento de la hipercalcemia inducida por tumores
Los ensayos clínicos realizados en hipercalcemia causada por tumores malignos han demostrado que el efecto inhibidor del ácido ibandrónico sobre la osteolisis tumoralmente inducida, así como, específicamente, sobre la hipercalcemia inducida por un tumor, se caracteriza por un descenso del calcio sérico y de la excreción urinaria de calcio.
En los rangos terapéuticos recomendados para el tratamiento se han observado en los ensayos clínicos los siguientes índices de respuesta con los respectivos intervalos de confianza para pacientes con calcio sérico basal corregido por la albúmina > 3,0 mmol/l después de una adecuada rehidratación.
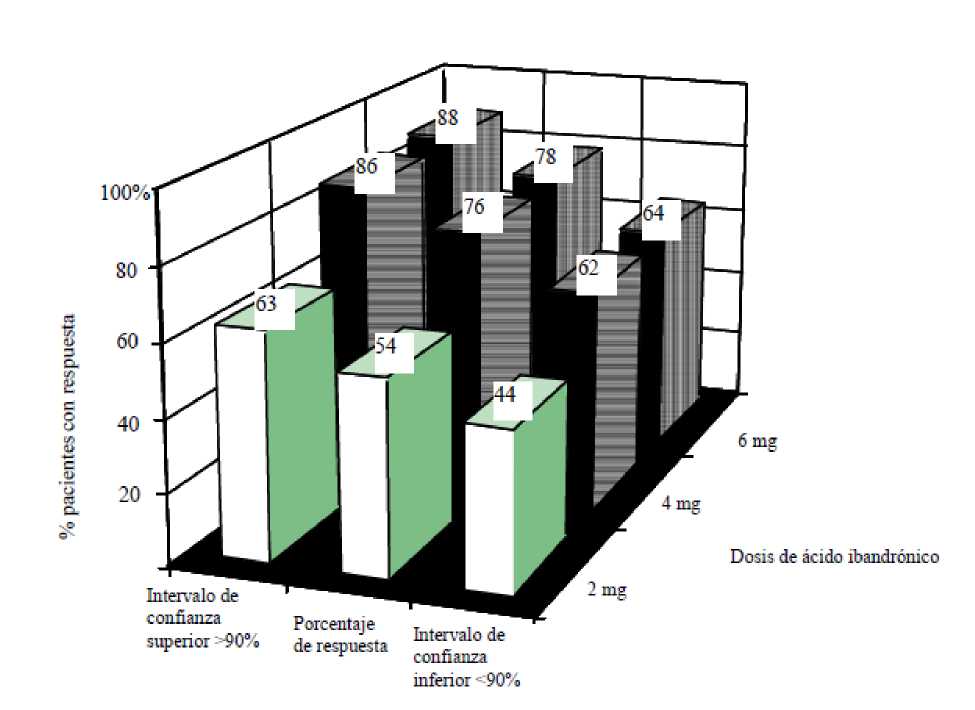
Para estos pacientes y dosis, la mediana del tiempo para alcanzar la normalización de los valores de calcio fue de 4 a 7 días. La mediana del tiempo hasta la recaída (recuperación del calcio sérico corregido por la albúmina por encima de 3,0 mmol/l) fue de 18 a 26 días.
Ensayos clínicos en la prevención de acontecimientos óseos en pacientes con cáncer de mama y metástasis óseas
Los ensayos clínicos en pacientes con cáncer de mama y metástasis óseas han demostrado que existe un efecto inhibidor dosis dependiente de la osteolisis del hueso, expresado por los marcadores de resorción ósea, así como un efecto dosis dependiente sobre los acontecimientos esqueléticos.
La prevención de acontecimientos óseos en pacientes con cáncer de mama y metástasis óseas con ácido ibandrónico 6 mg intravenoso se evaluó en un ensayo fase III aleatorizado controlado con placebo, con una duración de 96 semanas. Las pacientes con cáncer de mama y con metástasis óseas radiológicamente confirmadas, fueron aleatorizadas para recibir placebo (158 pacientes) o 6 mg de ácido ibandrónico (154 pacientes). Los resultados de este ensayo se resumen más adelante.
Variables primarias de eficacia
La variable principal del ensayo fue el índice del periodo de morbilidad esquelético (skeletal morbidity period rate, SMPR). Este fue una variable compuesta que contempló los siguientes sub-componentes y acontecimientos relacionados con el esqueleto (skeletal related events, SREs):
• Radioterapia ósea para el tratamiento de fracturas declaradas o próximas a producirse
• Cirugía ósea para el tratamiento de fracturas
• Fracturas vertebrales
• Fracturas no vetebrales
El análisis del SMPR se ajustó por tiempo y consideró que uno o más acontecimientos sucedidos en un periodo único de 12 semanas podían estar potencialmente relacionados. Los acontecimientos múltiples
'luis:
fueron por tanto contabilizados una única vez para el propósito de este análisis. Los datos provenientes de este ensayo demostraron una ventaja significativa para el ácido ibandrónico 6 mg intravenoso sobre el placebo en la reducción de los SREs medidos por el SMPR ajustado por tiempo (p=0,004). El número de SREs fue también significativamente más reducido con ácido ibandrónico 6 mg IV y hubo una reducción del 40% del riesgo de SRE frente a placebo (riesgo relativo 0,6, p=0,003).
Los resultados de eficacia se resumen en la Tabla 3.
Tabla 3 Resultados de eficacia (pacientes con cáncer de mama con metástasis óseas)
|
Todos los acontecimientos esqueléticos relacionados (SREs) | |||
|
Placebo n=158 |
Ácido ibandrónico ó mg n=154 |
Valor de p | |
|
S MPR. (por paci entecan o) |
1.48 |
1.19 |
p=0.004 |
|
Número de eventos (por paciente) |
3.(54 |
2.65 |
p=0.025 |
|
Riesgo relativo de SRE |
- |
0.60 |
p=0.003 |
Variables secundarias de eficacia
Se observó una mejoría del dolor óseo estadísticamente significativa para el ácido ibandrónico 6 mg intravenoso si se compara frente al placebo. La reducción de dolor se mantuvo de forma consistente por debajo de la basal a lo largo del ensayo completo y se acompañó de una reducción significativa en cuanto al uso de analgésicos. El deterioro de la Calidad de Vida fue significativamente menor en los pacientes tratados con ácido ibandrónico comparados con aquellos tratados con placebo. En la Tabla 4 se presenta un resumen tabulado de estos resultados secundarios de eficacia.
Tabla 4 Resultados secundarios de eficacia (pacientes con cáncer de mama con metástasis óseas)
|
Placebo n=158 |
Ácido ibandrónico 6 mg n=154 |
Valor de p | |
|
Dolor óseo * |
0,21 |
-0,28 |
p<0,001 |
|
Uso de analgésicos * |
0,90 |
0,51 |
p=0,083 |
|
Calidad de vida * |
-45,4 |
-10,3 |
p=0,004 |
* Cambio medio desde la basal hasta la última evaluación.
En pacientes tratados con ácido ibandrónico, se observó una marcada reducción de los marcadores urinarios de resorción ósea (piridinolina y deoxipiridinolina) estadísticamente significativa en comparación con placebo.
En un ensayo con 130 pacientes con cáncer de mama metastásico se comparó la seguridad de la perfusión de ácido ibandrónico durante 1 hora o durante 15 minutos. No se observaron diferencias en los indicadores de la función renal. El perfil general de acontecimientos adversos del ácido ibandrónico tras una perfusión de 15 minutos fue consistente con el perfil de seguridad conocido para perfusiones de mayor duración y no se identificaron nuevos problemas de seguridad relacionados con el uso de un tiempo de perfusión de 15 minutos.
En pacientes con cáncer con un aclaramiento de creatinina < 50 ml/min no se ha estudiado un tiempo de perfusión de 15 minutos.
Población pediátrica
No se ha establecido la seguridad y eficacia de ácido ibandrónico en niños y adolescentes menores de 18 años. No hay datos disponibles.
5.2 Propiedades farmacocinéticas
Después de una perfusión de dos horas de 2, 4 y 6 mg de ácido ibandrónico, los parámetros farmacocinéticos son proporcionales a la dosis.
Distribución
Tras la exposición sistémica inicial, el ácido ibandrónico se une rápidamente al hueso o es excretado por la orina. En humanos, el volumen de distribución aparente terminal es de al menos 90 litros y la cantidad de la dosis que llega al hueso se estima que es de un 40-50% de la dosis circulante. A concentraciones terapéuticas, la unión a proteínas en el plasma humano es aproximadamente un 87% por lo que es improbable una interacción medicamento-medicamento producida por desplazamiento de dicha unión.
Biotransformación
No existe evidencia de que el ácido ibandrónico se metabolice ni en animales ni en humanos.
Eliminación
El rango observado de las semi-vidas aparentes es amplio y dependiente de la dosis y de la sensibilidad del método, pero la semi-vida terminal aparente se encuentra generalmente en el rango de 10-60 horas. Sin embargo, los niveles plasmáticos iniciales descienden rápidamente, alcanzando el 10% de los valores máximos entre 3 y 8 horas tras la administración intravenosa u oral, respectivamente. No se ha observado acumulación sistémica cuando el ácido ibandrónico se administró por vía intravenosa una vez cada 4 semanas durante 48 semanas a pacientes con metástasis óseas.
El aclaramiento total del ácido ibandrónico es bajo con valores medios en el rango de 84-160 ml/min. El aclaramiento renal (alrededor de 60 ml/min en mujeres postmenopáusicas sanas) es de un 50-60% del aclaramiento total y está relacionado con el aclaramiento de creatinina. La diferencia entre el aclaramiento total y renal se considera que es el resultado de la captación por el hueso.
Farmacocinética en poblaciones especiales
Género
La biodisponibilidad y la farmacocinética del ácido ibandrónico son similares en hombres y mujeres.
Raza
No existen evidencias de diferencias interétnicas clínicamente relevantes entre Asiáticos y Caucásicos en cuanto a la disponibilidad del ácido ibandrónico. Solamente se dispone de muy pocos datos en pacientes de origen africano.
Pacientes con insuficiencia renal
La exposición al ácido ibandrónico en pacientes con distintos grados de insuficiencia renal está relacionada con el aclaramiento de creatinina (CLcr). En sujetos con insuficiencia renal grave (aclaramiento medio estimado de creatinina = 21,2 ml/min), la media del AUC0-24h ajustada a la dosis aumentó un 110 % en comparación con voluntarios sanos. En el ensayo clínico farmacológico WP18551, después de la administración de una dosis única intravenosa de 6 mg (durante 15 minutos de perfusión), la media de AUC0-24, en pacientes con alteración renal leve (aclaramiento de creatinina medio estimado= 68,1 ml/min) y con alteración renal moderada (aclaramiento de creatinina medio estimado= 41,2 ml/min) aumentó un 14% y 86% respectivamente comparado con voluntarios sanos (aclaramiento de creatinina medio estimado = 120 ml/min). La media de la Cmax no aumentó en pacientes con alteración renal leve y en pacientes con alteración renal moderada aumentó un 12 %. No se requiere ajuste de dosis para pacientes con insuficiencia renal leve (CLCr = 50 y < 80 ml/min). Se recomienda un ajuste de la dosis en pacientes con insuficiencia renal moderada (CLCr = 30 y < 50 ml/min) o con insuficiencia renal grave (CLCr < 30 ml/min), que además padecen cáncer de mama y enfermedad metastásica ósea y están siendo tratados para la prevención de acontecimientos óseos (ver sección 4.2).
Pacientes con insuficiencia hepática
No se dispone de datos farmacocinéticos con el ácido ibandrónico en pacientes con insuficiencia hepática. El hígado no tiene un papel significativo en el aclaramiento del ácido ibandrónico dado que éste no se metaboliza pero es aclarado por excreción renal y captado por el hueso. Por lo tanto, no es necesario un ajuste de dosis en el caso de pacientes con insuficiencia hepática. Además, como la unión a proteínas del ácido ibandrónico es aproximadamente un 87% a concentraciones terapéuticas, es improbable que una hipoproteinemia en enfermedad hepática grave conduzca a incrementos clínicamente significativos de la concentración plasmática libre.
Pacientes de edad avanzada
En un análisis multivariable, no se encontró que la edad fuera un factor independiente en ninguno de los parámetros farmacocinéticos estudiados. Dado que la función renal disminuye con la edad, este es el único factor que debería ser considerado (ver sección insuficiencia renal).
Población pediátrica
No se dispone de datos relativos al uso de Iasibon en pacientes menores de 18 años.
5.3 Datos preclínicos sobre seguridad
Únicamente se observaron reacciones en los estudios no clínicos con exposiciones consideradas suficientemente superiores a la exposición humana máxima, lo que indica poca relevancia clínica. Como ocurre con otros bifosfonatos, se ha identificado el riñón como órgano diana primario en cuanto a toxicidad sistémica se refiere.
Mutagenicidad/Carcinogenicidad:
No se ha observado ninguna indicación de potencial carcinogénico. Los ensayos de genotoxicidad no han mostrado evidencia de efectos sobre la actividad genética del ácido ibandrónico.
Toxicidad reproductora:
No se ha observado evidencia de toxicidad fetal directa o efectos teratogénicos en ratas y conejos tratados con ácido ibandrónico por vía intravenosa. Los efectos sobre la función reproductora de la rata en estudios por vía oral, consistieron en un aumento de pérdidas preimplantación a dosis de 1 mg/kg/día y superiores. En estudios sobre la función reproductora de las ratas por vía intravenosa, el ácido ibandrónico disminuyó el recuento de esperma a dosis de 0,3 y 1 mg/kg/día y disminuyó la fertilidad en los machos a 1 mg / kg / día y en las hembras a 1,2 mg / kg / día. Las reacciones adversas del ácido ibandrónico determinadas en estudios de toxicidad reproductora en ratas son los que cabían esperar para esta clase de medicamentos (bifosfonatos). Estas incluyeron una disminución del número de lugares de implantación, dificultades para el parto natural (distocia), incremento en modificaciones viscerales (síndrome pelvis renal uréter) así como anomalías en la dentición en la generación F1 en ratas.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro sódico Ácido acétio (E260)
Acetato sódico (E262)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Para evitar incompatibilidades potenciales, Ácido Ibandrónico Kern Pharma 6 mg concentrado para solución para perfusión debe diluirse sólo con solución isotónica de cloruro sódico o con solución de glucosa al 5%.
Ácido Ibandrónico Kem Pharma no se debe mezclar con soluciones que contengan calcio.
6.3 Periodo de validez
2 años
Se ha demostrado la estabilidad química y física de uso tras la dilución en solución de cloruro sódico al 0,9% o de glucosa al 5% a una concentración de 0,012 mg/ml, durante 24 horas en condiciones de refrigeración y a 25 °C.
Tras la dilución: Desde un punto de vista microbiológico, la solución para perfusión debe ser empleada de inmediato. Si no se usa inmediatamente, el tiempo y las condiciones de almacenamiento hasta su empleo serán responsabilidad del usuario y normalmente no deberían superar las 24 horas entre 2 y 8° C.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación antes de la reconstitución.
6.5 Naturaleza y contenido del envase
Ácido Ibandrónico Kern Pharma 6 mg se presenta en envases de 1, 5 y 10 viales (viales de 6 ml de vidrio tipo I). Los viales están cerrados con tapones de caucho que cumplen con la Ph. Eur.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local. La eliminación de productos farmacéuticos en el medio ambiente se debe reducir al mínimo.
Para un sólo uso.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
KERN PHARMA, S.L.
Pol. Ind. Colón II, C/ Venus 72 08228 Terrassa (Barcelona)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Octubre 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
Marzo de 2013
14 de 14