Xtandi 40Mg Capsulas Blandas
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Xtandi 40 mg cápsulas blandas
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula blanda contiene 40 mg de enzalutamida.
Excipiente con efecto conocido:
Cada cápsula blanda contiene 52,4 mg de sorbitol.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula blanda.
Cápsulas blandas oblongas (de aproximadamente 20 x 9 mm), de color blanco a blanquecino, con “ENZ” impreso en tinta negra en una cara.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Xtandi está indicado para:
• el tratamiento de hombres adultos con cáncer de próstata metastásico resistente a la castración que sean asintomáticos o levemente sintomáticos tras el fracaso del tratamiento de deprivación de andrógenos en los cuales la quimioterapia no está aún clínicamente indicada (ver sección 5.1).
• el tratamiento de hombres adultos con cáncer de próstata metastásico resistente a la castración cuya enfermedad ha progresado durante o tras el tratamiento con docetaxel.
4.2 Posología y forma de administración
Posología
La dosis recomendada es de 160 mg de enzalutamida (cuatro cápsulas de 40 mg) en una sola dosis diaria oral.
Se debe mantener la castración médica con un análogo de la LHRH durante el tratamiento en los pacientes no sometidos a castración quirúrgica.
Si un paciente olvida tomar Xtandi a la hora habitual, la dosis prescrita se debe tomar lo más cerca posible a la hora habitual. Si un paciente olvida la dosis durante un día entero, el tratamiento se debe reanudar al día siguiente con la dosis diaria habitual.
Si un paciente presenta toxicidad de grado > 3 o una reacción adversa intolerable, se debe suspender la administración durante una semana o hasta que los síntomas mejoren a grado < 2, y posteriormente restablecer la misma dosis o una dosis reducida (120 mg o 80 mg), siempre que esté justificado.
Uso concomitante con inhibidores potentes del CYP2C8
Se debe evitar el uso concomitante de inhibidores potentes del CYP2C8 siempre que sea posible. Si se debe administrar simultáneamente a los pacientes un inhibidor potente del CYP2C8, la dosis de enzalutamida se debe reducir a 80 mg una vez al día. Si se suspende la administración simultánea del inhibidor potente del CYP2C8, se debe volver a la dosis de enzalutamida utilizada antes de empezar a administrar el inhibidor del CYP2C8 (ver sección 4.5).
Personas de edad avanzada
No es necesario ajustar la dosis en personas de edad avanzada (ver secciones 5.1 y 5.2).
Insuficiencia hepática
No es necesario ajustar la dosis en los pacientes con insuficiencia hepática leve, moderada o grave (clase A,
B o C de Child-Pugh, respectivamente). Sin embargo, se ha observado un aumento de la semivida del fármaco en pacientes con insuficiencia hepática grave (ver sección 4.4 y 5.2).
Insuficiencia renal
No es necesario ajustar la dosis en los pacientes con insuficiencia renal leve o moderada (ver sección 5.2). Se recomienda precaución en los pacientes con insuficiencia renal grave o enfermedad renal terminal (ver sección 4.4).
Población pediátrica
No existe una recomendación de uso específica para enzalutamida en la población pediátrica para la indicación de tratamiento de hombres adultos con cáncer de próstata metastásico resistente a la castración.
Forma de administración
Xtandi se administra por vía oral. Las cápsulas se deben tragar enteras con agua y se pueden tomar con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Mujeres embarazadas o que puedan quedarse embarazadas (ver sección 4.6).
4.4 Advertencias y precauciones especiales de empleo Riesgo de crisis epilépticas
Se debe tener precaución al administrar Xtandi a pacientes con antecedentes de crisis epilépticas u otros factores de predisposición, entre ellos, lesión cerebral subyacente, ictus, tumores cerebrales primarios o metástasis cerebrales, o alcoholismo. Además, el riesgo de crisis epilépticas puede ser mayor en los pacientes tratados con medicamentos concomitantes que reducen el umbral epiléptico.
Síndrome de encefalopatía posterior reversible
Se han notificado casos raros de síndrome de encefalopatía posterior reversible (SEPR) en pacientes que estaban recibiendo Xtandi (ver sección 4.8). SEPR es un trastorno neurológico, raro, reversible, que se puede presentar con síntomas que evolucionan rápidamente, incluyendo crisis epiléptica, cefalea, confusión, ceguera, y otras alteraciones visuales y neurológicas, con o sin hipertensión asociada. Un diagnóstico del SEPR requiere confirmación mediante técnicas de imagen cerebral, preferiblemente resonancia magnética (RM). Se recomienda interrumpir el tratamiento con Xtandi en los pacientes que desarrollen SEPR.
Uso concomitante con otros medicamentos
Enzalutamida es un inductor enzimático potente y puede dar lugar a una pérdida de eficacia de muchos medicamentos de uso común (ver ejemplos en sección 4.5). Por lo tanto, cuando se inicia el tratamiento con enzalutamida se debe realizar una revisión de los medicamentos concomitantes. Generalmente, se debe evitar el uso concomitante de enzalutamida con medicamentos que sean sustratos sensibles de muchos enzimas o transportadores metabólicos (ver sección 4.5), si su efecto terapéutico es de gran importancia para el paciente, y si no se pueden realizar fácilmente ajustes de dosis basados en un seguimiento de la eficacia o de las concentraciones plasmáticas.
Se debe evitar la administración simultánea con warfarina y anticoagulantes cumarínicos. En caso de que Xtandi se administre simultáneamente con un anticoagulante metabolizado por el CYP2C9 (tales como warfarina o acenocumarol), se deben realizar controles adicionales del Cociente Normalizado Internacional (INR) (ver sección 4.5).
Insuficiencia renal
Se debe administrar con precaución a pacientes con insuficiencia renal grave ya que enzalutamida no se ha estudiado en esta población de pacientes.
Insuficiencia hepática grave
Se ha observado un aumento de la semivida del fármaco en pacientes con insuficiencia hepática grave, posiblemente relacionado con un aumento de la distribución tisular. Se desconoce la relevancia clínica de esta observación. Sin embargo, se prevé una prolongación del tiempo para alcanzar las concentraciones en estado estacionario, y se puede aumentar el tiempo para el efecto farmacológico máximo, así como el tiempo de inicio y la disminución de la inducción enzimática (ver sección 4.5).
Enfermedad cardiovascular reciente
En los ensayos de fase 3 se excluyó a los pacientes con infarto de miocardio reciente (en los últimos 6 meses) o angina inestable reciente (en los últimos 3 meses), insuficiencia cardíaca de clase III o IV según la New York Heart Association (NYHA) excepto si la Fracción de Eyección Ventricular Izquierda (FEVI) > 45%, bradicardia o hipertensión incontrolada. Esto se debe tener en cuenta si se prescribe Xtandi a estos pacientes.
El tratamiento de deprivación androgénica puede producir una prolongación del intervalo QT En pacientes con antecedentes o factores de riesgo de prolongación del intervalo QT, y en pacientes tratados con medicación concomitante que pueda producir una prolongación del intervalo QT (ver sección 4.5), los médicos deben evaluar la relación beneficio riesgo, incluyendo el riesgo potencial de Torsade de pointes, antes de iniciar el tratamiento con Xtandi.
Uso con quimioterapia
No se ha establecido la seguridad ni la eficacia del uso concomitante de Xtandi con quimioterapia citotóxica. La administración simultánea de enzalutamida no muestra un efecto clínicamente relevante sobre la farmacocinética de docetaxel intravenoso (ver sección 4.5); sin embargo, no se puede descartar un aumento de la aparición de neutropenia inducida por docetaxel.
Excipientes
Xtandi contiene sorbitol (E420). Los pacientes con intolerancia hereditaria a la fructosa no deben tomar este medicamento.
Reacciones de hipersensibilidad
Se han observado reacciones de hipersensibilidad con el tratamiento con enzalutamida (ver sección 4.8), que se manifiestan por síntomas que incluyen, aunque no exclusivamente, edema de la lengua, edema de labio y edema faríngeo.
4.5 Interacción con otros medicamentos y otras formas de interacción
Posibilidad de que otros medicamentos modifiquen la exposición a enzalutamida
Inhibidores del CYP2C8
El CYP2C8 desempeña una función importante en la eliminación de enzalutamida y en la formación de su metabolito activo. Tras la administración oral a hombres sanos de gemfibrozilo (600 mg dos veces al día), un inhibidor potente del CYP2C8, el AUC de enzalutamida aumentó un 326%, mientras que la Cmáx de enzalutamida disminuyó un 18%. Para la suma de enzalutamida libre más el metabolito activo libre, el AUC aumentó un 77%, mientras que la Cmáx disminuyó un 19%. Se recomienda evitar o usar con precaución los
inhibidores potentes del CYP2C8 (p. ej. gemfibrozilo) durante el tratamiento con enzalutamida. Si se debe administrar simultáneamente a los pacientes un inhibidor potente del CYP2C8, la dosis de enzalutamida se debe reducir a 80 mg una vez al día (ver sección 4.2).
Inhibidores del CYP3A4
El CYP3A4 desempeña un papel secundario en el metabolismo de enzalutamida. Tras la administración oral a hombres sanos de itraconazol (200 mg una vez al día), un inhibidor potente del CYP3A4, el AUC de enzalutamida aumentó un 41%, mientras que la Cmáx se mantuvo. Para la suma de enzalutamida libre más el metabolito activo libre, el AUC aumentó un 27%, mientras que la Cmáx se mantuvo nuevamente. No es necesario ajustar la dosis al administrar Xtandi simultáneamente con inhibidores del CYP3A4.
Inductores del CYP2C8y CYP3A4
Tras la administración oral a hombres sanos de rifampicina (600 mg una vez al día), un inductor moderado del CYP2C8 y un inductor potente del CYP3A4, el AUC de enzalutamida más el metabolito activo disminuyó un 37%, mientras que la Cmáx no varió. No es necesario ajustar la dosis al administrar Xtandi simultáneamente con inductores del CYP2C8 o CYP3A4.
Posibilidad de que enzalutamida modifique las exposiciones a otros medicamentos
Inducción enzimática
Enzalutamida es un inductor enzimático potente y aumenta la síntesis de muchos enzimas y transportadores; por lo tanto, se espera que haya interacción con muchos medicamentos comunes que sean sustratos de enzimas o transportadores. La reducción de las concentraciones plasmáticas puede ser sustancial, y puede dar lugar a una pérdida o reducción del efecto clínico. También hay un riesgo de que la formación de metabolitos activos aumente. Las enzimas que pueden ser inducidas incluyen el CYP3A en el hígado e intestino, CYP2B6, CYP2C9, CYP2C19 y la uridina 5'-difosfo-glucuronosiltransferasa (UGTs - enzimas de conjugación glucurónica). La proteína transportadora gp-P también puede ser inducida, y probablemente otros transportadores también, como por ejemplo la proteína asociada a resistencia a múltiples drogas 2 (MRP2), la proteína de resistencia al cáncer de mama (BCRP) y el polipéptido transportador de aniones orgánicos 1B1 (OATP1B1).
Los estudios in vivo han mostrado que enzalutamida es un inductor potente del CYP3A4 y un inductor moderado del CYP2C9 y CYP2C19. La administración simultánea de enzalutamida (160 mg una vez al día) con dosis orales únicas de sustratos sensibles del CYP a pacientes con cáncer de próstata dio como resultado una disminución de un 86% del AUC de midazolam (sustrato del CYP3A4), de un 56% del AUC de S-warfarina (sustrato del CYP2C9) y de un 70% del AUC de omeprazol (sustrato del CYP2C19). También pudo producirse una inducción de la UGT1A1. En un ensayo clínico en pacientes con CPRC metastásico, Xtandi (160 mg una vez al día) no mostró un efecto clínicamente relevante sobre la farmacocinética de docetaxel administrado por vía intravenosa (75 mg/m2 mediante perfusión cada 3 semanas). El AUC de docetaxel disminuyó un 12% [razón media geométrica (GMR) = 0,882 (IC 90%: 0,767, 1,02)], mientras que la Cmax disminuyó un 4% [GMR = 0,963 (IC 90%: 0,834, 1,11)].
Se esperan interacciones con determinados medicamentos que se eliminan a través del metabolismo o del transporte activo. Se recomienda evitar o usar con precaución estos medicamentos, si su efecto terapéutico es de gran importancia para el paciente, y no se pueden realizar fácilmente ajustes de dosis basados en un seguimiento de la eficacia o de las concentraciones plasmáticas. Se sospecha que el riesgo de lesión hepática después de la administración de paracetamol es mayor en pacientes tratados concomitantemente con inductores enzimáticos.
Entre los grupos de medicamentos que se pueden ver afectados figuran, entre otros, los siguientes:
• Analgésicos (p. ej. fentanilo, tramadol)
• Antibióticos (p. ej. claritromicina, doxiciclina)
• Agentes anticancerosos (p. ej. cabazitaxel)
• Anticoagulantes (p. ej. acenocumarol, warfarina)
• Antiepilépticos (p. ej. carbamazepina, clonazepam, fenitoína, primidona, ácido valproico)
• Antipsicóticos (p. ej. haloperidol)
• Betabloqueantes (p. ej. bisoprolol, propranolol)
• Antagonistas del canal del calcio (p. ej. diltiazem, felodipino, nicardipino, nifedipino, verapamilo)
• Glucósidos cardíacos (p. ej. digoxina)
• Corticoides (p. ej. dexametasona, prednisolona)
• Antivirales frente al VIH (p. ej. indinavir, ritonavir)
• Hipnóticos (p. ej. diazepam, midazolam, zolpidem)
• Estatinas metabolizadas por el CYP3A4 (p. ej. atorvastatina, simvastatina)
• Medicamentos tiroideos (p. ej. levotiroxina)
Puede que todo el potencial de inducción de enzalutamida no se manifieste hasta aproximadamente un mes después del inicio del tratamiento, al alcanzarse las concentraciones plasmáticas en estado estacionario de enzalutamida, aunque ciertos efectos inductores pueden ser evidentes antes. Durante el primer mes de tratamiento con enzalutamida se debe valorar la posible pérdida de los efectos farmacológicos (o aumento de los efectos en los casos en que se formen metabolitos activos) en los pacientes que están tomando medicamentos que sean sustratos del CYP2B6, CYP3A4, CYP2C9, CYP2C19 o UGT1A1 y considerar si es necesario un ajuste de la dosis. Teniendo en cuenta la semivida prolongada de enzalutamida (5,8 días, ver sección 5.2), los efectos sobre las enzimas pueden persistir durante un mes o más después de interrumpir la administración de enzalutamida. Cuando se interrumpe el tratamiento con enzalutamida, puede ser necesaria una reducción gradual de la dosis del medicamento concomitante.
Sustratos del CYP1A2 y CYP2C8
Enzalutamida (160 mg una vez al día) no provocó una variación clínicamente significativa del AUC o de la Cmáx de cafeína (sustrato del CYP1A2) o pioglitazona (sustrato del CYP2C8). El AUC de pioglitazona aumentó un 20%, mientras que la Cmáx disminuyó un 18%. El AUC y la Cmáx de cafeína disminuyó un 11% y un 4% respectivamente. No está indicado realizar un ajuste de la dosis al administrar un sustrato del CYP1A2 o CYP2C8 simultáneamente con Xtandi.
Sustratos del gp-P
Los datos in vitro indican que enzalutamida puede ser un inhibidor del transportador de salida gp-P. El efecto de enzalutamida sobre sustratos del gp-P no se ha evaluado in vivo; sin embargo, en condiciones de uso clínico, enzalutamida puede ser un inductor del gp-P mediante activación del receptor nuclear de pregnano (PXR). Los medicamentos con un estrecho margen terapéutico que sean sustratos del gp-P (p. ej. colchicina, dabigatrán etexilato o digoxina) se deben usar con precaución cuando se administran simultáneamente con Xtandi y puede ser necesario ajustar la dosis para mantener unas concentraciones plasmáticas óptimas.
Sustratos de BCRP, MRP2, OAT3 y OCT1
Según los datos obtenidos in vitro, no se puede descartar la inhibición de BCRP y MRP2 (en el intestino), así como la del transportador de aniones orgánicos 3 (OAT3) y la del transportador de cationes orgánicos 1 (OCT1) (sistémicamente). Teóricamente, la inducción de estos transportadores también es posible, y actualmente el efecto neto se desconoce.
Medicamentos que producen una prolongación del intervalo QT
Debido a que el tratamiento de deprivación androgénica puede producir una prolongación del intervalo QT, el uso concomitante de Xtandi con medicamentos que producen una prolongación del intervalo QT o de medicamentos capaces de inducir Torsades de pointes, tales como antiarrítmicos de clase IA (ej. quinidina, disopiramida) o de clase III (ej. amiodarona, sotalol, dofetilida, ibutilida), metadona, moxifloxacino, antipsicóticos, etc, deben ser cuidadosamente evaluados (ver sección 4.4).
Efecto de los alimentos sobre la exposición a enzalutamida
Los alimentos no tienen efectos clínicamente significativos sobre el grado de exposición a enzalutamida. En los ensayos clínicos, Xtandi se ha administrado sin tener en cuenta la ingesta de alimentos.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
No hay datos relativos al uso de Xtandi en mujeres embarazadas, por lo que no se debe utilizar este medicamento en mujeres en edad fértil.
Anticoncepción en hombres y mujeres
Se desconoce si enzalutamida o sus metabolitos están presentes en el semen. Si el paciente mantiene relaciones sexuales con una mujer embarazada, debe utilizar un preservativo durante el tratamiento con enzalutamida y en los 3 meses posteriores al mismo. Si el paciente mantiene relaciones sexuales con una mujer en edad fértil, debe utilizar un preservativo y otro método anticonceptivo durante el tratamiento con enzalutamida y en los 3 meses posteriores al mismo. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
Embarazo
Enzalutamida no está indicado en mujeres. Enzalutamida está contraindicado en mujeres embarazadas o que puedan quedarse embarazadas (ver secciones 4.3 y 5.3).
Lactancia
Enzalutamida no está indicado en mujeres.
Fertilidad
Los estudios realizados en animales mostraron que enzalutamida afectaba al sistema reproductor de ratas y perros machos (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de enzalutamida sobre la capacidad para conducir y utilizar máquinas puede ser moderada, ya que se han notificado acontecimientos psiquiátricos y neurológicos, incluyendo crisis epiléptica (ver sección 4.8). Los pacientes con antecedentes de crisis epilépticas u otros factores de predisposición (ver sección 4.4) deben ser advertidos del riesgo de conducir o utilizar máquinas. No se han realizado estudios para determinar los efectos de enzalutamida sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes son astenia/fatiga, sofocos, cefalea e hipertensión. Otras reacciones adversas importantes incluyen, caídas, fracturas no patológicas, trastorno cognoscitivo y neutropenia.
Las crisis epilépticas se presentaron en el 0,5% de los pacientes tratados con enzalutamida, el 0,1% de los pacientes tratados con placebo, y el 0,3% de los pacientes tratados con bicalutamida.
Se han notificado casos raros de síndrome de encefalopatía posterior reversible en pacientes tratados con enzalutamida (ver sección 4.4).
Tabla de reacciones adversas
Las reacciones adversas observadas en los ensayos clínicos se enumeran a continuación en orden de frecuencia. Las categorías de frecuencia se definen de la siguiente manera: muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1.000 a <1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Tabla 1: Reacciones adversas it |
entificadas en ensayos clínicos controlados y postcomercialización |
|
Clasificación de órganos del sistema MedDRA |
Frecuencia |
|
Trastornos de la sangre y del sistema linfático |
poco frecuentes: leucopenia, neutropenia no conocida*: trombocitopenia |
|
Trastornos del sistema inmunológico |
no conocida*: edema de la lengua, edema de labio y edema faríngeo |
|
Trastornos generales |
muy frecuentes: astenia/fatiga |
|
Trastornos psiquiátricos |
frecuentes: ansiedad poco frecuentes: alucinaciones visuales |
|
Trastornos del sistema nervioso |
muy frecuentes: cefalea frecuentes: alteración de la memoria; amnesia, alteración de la atención, síndrome de piernas inquietas poco frecuentes: trastorno cognoscitivo, crisis epiléptica no conocida*: síndrome de encefalopatía posterior reversible |
|
Trastornos cardiacos |
no conocida*: prolongación del intervalo QT (ver secciones 4.4 y 4.5) |
|
Trastornos del aparato reproductor y de la mama |
frecuentes: ginecomastia |
|
Trastornos vasculares |
muy frecuentes: sofocos, hipertensión |
|
Trastornos gastrointestinales |
no conocida*: náuseas, vómitos, diarrea |
|
Trastornos de la piel y del tejido subcutáneo |
frecuentes: piel seca, prurito no conocida*: erupción |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
frecuentes: fracturas** no conocida*: mialgia, espasmos musculares, debilidad muscular, dolor de espalda |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
frecuentes: caídas |
* Notificaciones espontáneas procedentes de la experiencia postcomercialización.
** Incluyen todas las fracturas excepto las fracturas patológicas.
Descripción de algunas reacciones adversas
Crisis epiléptica
En los ensayos clínicos controlados hubo 10 (0,5%) de los 2051 pacientes tratados con una dosis diaria de 160 mg de enzalutamida que presentaron una crisis epiléptica, mientras que un paciente (< 0,1%) que recibía placebo y un paciente (0,3%) que recibía bicalutamida tuvieron una crisis epiléptica. Parece que la dosis es un factor predictivo importante del riesgo de crisis epilépticas, como indican los datos preclínicos, y los datos de un estudio de escalado de dosis. En los ensayos clínicos controlados, se excluyeron a los pacientes con crisis epilépticas previas o factores de riesgo de padecerlas.
En el ensayo AFFIRM, seis (0,8%) de los 800 pacientes tratados post-quimioterapia con una dosis diaria de 160 mg de enzalutamida presentaron una crisis epiléptica, mientras que no se produjeron crisis en los tratados con placebo. Varios de estos pacientes presentaban posibles factores contribuyentes que podrían haber aumentado independientemente su riesgo de sufrir crisis epilépticas. En el ensayo PREVAIL, un paciente (0,1%) de los 871 pacientes que no habían recibido quimioterapia tratados con una dosis diaria de 160 mg de enzalutamida, y un paciente (0,1%) que recibía placebo, tuvieron una crisis epiléptica. En los ensayos controlados con bicalutamida, 3 pacientes (0,8%) de los 380 pacientes tratados con enzalutamida que no habían recibido quimioterapia y 1 paciente (0,3%) de los 387 que recibían bicalutamida tuvieron una crisis epiléptica.
Se desconoce el mecanismo mediante el cual enzalutamida puede reducir el umbral epiléptico, aunque podría estar relacionado con los datos obtenidos en estudios in vitro que indican que enzalutamida y su metabolito activo pueden unirse e inhibir la actividad del canal de cloro activado por GABA.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
No existe ningún antídoto para enzalutamida. En caso de sobredosis, se debe interrumpir el tratamiento con enzalutamida e iniciar medidas de apoyo general teniendo en cuenta su semivida de 5,8 días. Los pacientes pueden tener un mayor riesgo de sufrir crisis epilépticas tras una sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: no se ha asignado aún, código ATC: no se ha asignado aún Mecanismo de acción
Se sabe que el cáncer de próstata es sensible a los andrógenos y responde a la inhibición de la señalización de los receptores androgénicos. La señalización de los receptores androgénicos sigue favoreciendo la progresión de la enfermedad aunque las concentraciones plasmáticas de andrógenos sean bajas o incluso indetectables. La estimulación del crecimiento de la célula tumoral a través del receptor androgénico requiere localización nuclear y unión al ADN. Enzalutamida es un inhibidor potente de la señalización de los receptores androgénicos que bloquea varios pasos en la vía de señalización del receptor androgénico. Enzalutamida inhibe de manera competitiva la unión de los andrógenos a los receptores androgénicos, inhibe la translocación nuclear de los receptores activados e inhibe la asociación del receptor androgénico activado con el ADN, incluso en situación de sobreexpresión del receptor androgénico y de células de cáncer de próstata resistentes a los antiandrógenos. El tratamiento con enzalutamida disminuye el crecimiento de las células del cáncer de próstata y puede inducir la muerte de las células cancerosas y la regresión del tumor. En estudios preclínicos, enzalutamida carece de actividad agonista de los receptores androgénicos.
Efectos farmacodinámicos
En un ensayo clínico de fase 3 de pacientes que fracasaron con la quimioterapia previa con docetaxel, el 54% de los pacientes tratados con enzalutamida, en comparación con el 1,5% de los pacientes que recibieron placebo, presentó una disminución de las concentraciones de PSA como mínimo del 50% con respecto a los valores basales.
Eficacia clínica y seguridad
La eficacia de enzalutamida quedó demostrada en dos ensayos clínicos de fase 3 multicéntricos, aleatorizados y controlados con placebo [CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)], realizados en pacientes con cáncer de próstata metastásico progresivo en los que había fracasado la terapia de deprivación de andrógenos [análogo de la hormona liberadora de hormona luteinizante (LHRH) o tras haberse sometido a una orquiectomía bilateral]. El ensayo PREVAIL incluyó pacientes que no habían recibido quimioterapia; mientras que el ensayo AFFIRM incluyó pacientes que habían recibido previamente docetaxel. Todos los pacientes continuaron recibiendo un análogo de la LHRH o se habían sometido a una orquiectomía bilateral. En el grupo de tratamiento activo, se administró Xtandi por vía oral a una dosis de 160 mg al día. En ambos ensayos clínicos, los pacientes del grupo control recibieron placebo y a los pacientes se les permitió, aunque no se les exigió, que tomaran prednisona (la dosis diaria máxima permitida fue de 10 mg de prednisona o equivalente).
Los cambios en la concentración sérica de PSA de forma independiente, no siempre predicen un beneficio clínico. Por lo tanto, en ambos ensayos se recomendó que los pacientes continuaran con los tratamientos en estudio hasta que se cumplieran los criterios de suspensión que se especifican más adelante para cada ensayo.
Ensayo MDV3100-03 (PREVAIL) (pacientes que no habían recibido quimioterapia)
Un total de 1717 pacientes asintomáticos o levemente sintomáticos que no habían recibido quimioterapia previamente, fueron asignados aleatoriamente 1:1 para recibir enzalutamida por vía oral en una dosis de 160 mg una vez al día (N = 872) o placebo por vía oral una vez al día (N = 845). Se admitieron pacientes con afectación visceral, pacientes con antecedentes de insuficiencia cardiaca leve o moderada (clase 1 o 2 NYHA) y pacientes que tomaban medicamentos asociados con una disminución del umbral epiléptico. Se excluyeron los pacientes con antecedentes de crisis epiléptica o de enfermedad que pudiera predisponer a las crisis epilépticas, y pacientes con dolor moderado o intenso debido al cáncer de próstata. El tratamiento en estudio se continuó hasta la progresión de la enfermedad (evidencia de progresión radiológica, un evento óseo o progresión clínica) y el inicio de una quimioterapia citotóxica o un agente en investigación, o hasta una toxicidad inaceptable.
Los datos demográficos de los pacientes y las características basales de la enfermedad estuvieron equilibrados entre los grupos de tratamiento. La mediana de edad era de 71 años (intervalo 42-93) y la distribución racial fue 77% de raza caucásica, 10% de raza asiática, 2% de raza negra y 11% de otras razas o de raza desconocida. El sesenta y ocho por ciento (68%) de los pacientes tenían una puntuación del estado funcional ECOG de 0 y el 32% de los pacientes de 1. La puntuación del dolor basal fue de 0-1 (asintomático) en el 67% de los pacientes y de 2-3 (levemente sintomático) en el 32% de los pacientes según la escala resumida del dolor Brief Pain Inventory Short Form (peor dolor en las 24 horas anteriores medido en una escala del 0 al 10). En el momento de la inclusión en el ensayo, aproximadamente el 45% de los pacientes presentaba enfermedad apreciable en tejidos blandos y el 12% de los pacientes tenían metástasis viscerales (pulmón y/o hígado).
Las co-variables primarias de eficacia fueron la supervivencia global y la supervivencia libre de progresión radiológica (SLPr). Además de las co-variables primarias, también se determinó el beneficio en base al tiempo hasta el comienzo de la quimioterapia citotóxica, la respuesta objetiva en tejidos blandos, el tiempo hasta el primer evento óseo, la respuesta del PSA (disminución > 50% desde el inicio), tiempo hasta la progresión del PSA y el tiempo hasta el empeoramiento de la escala FACT-P (puntuación total).
La progresión radiológica se evaluó utilizando estudios secuenciales por imagen según se definen en los criterios del grupo Prostate Cáncer Clinical Trials Working Group 2 (PCWG2) (para lesiones óseas) y/o los criterios Response Evaluation Criteria in Solid Tumors (RECIST v 1.1) (para las lesiones en tejidos blandos). El análisis de la SLPr se realizó mediante revisión centralizada de la determinación de progresión radiológica.
En el análisis intermedio preestablecido de la supervivencia global cuando se observaron 540 muertes, el tratamiento con enzalutamida demostró una mejora estadísticamente significativa en la supervivencia global en comparación con el tratamiento con placebo, con una reducción del 29,4% en el riesgo de muerte [HR = 0,706, (IC del 95%: 0,596; 0,837), p < 0,0001]. Se realizó un análisis de supervivencia actualizado cuando se observaron 784 muertes. Los resultados de este análisis fueron consistentes con los obtenidos en el análisis intermedio (Tabla 2, Figura 1). En el análisis actualizado, el 52% de los pacientes tratados con enzalutamida y el 81% de los pacientes tratados con placebo habían recibido tratamientos posteriores para el CPRC metastásico que pueden prolongar la supervivencia global.
Tabla 2: Supervivencia Global de los Pacientes Tratados con Enzalutamida o con Placebo en el Ensayo PREVAIL (análisis por intención de tratar) __
|
Enzalutamida (N = 872) |
Placebo (N = 845) | |
|
Análisis intermedio preestablecido | ||
|
Número de muertes (%) |
241 (27,6%) |
299 (35,4%) |
|
Mediana de supervivencia, meses (IC del 95%) |
32,4 (30,1, NA) |
30,2 (28,0, NA) |
|
Valor pa |
< 0,0001 | |
|
Hazard ratio (IC del 95%)b |
0,71 (0,60, 0,84) | |
|
Análisis de supervivencia actualizado | ||
|
Número de muertes (%) |
368 (42,2%) |
416 (49,2%) |
|
Mediana de supervivencia, meses (IC del 95%) |
35,3 (32,2, NA) |
31,3 (28,8, 34,2) |
|
Valor pa |
0,0002 | |
|
Hazard ratio (IC del 95%)b |
0,77 (0,67, 0,88) | |
a El valor de p se deriva de una prueba de rangos logarítmicos no estratificada
b Hazard ratio se deriva de un modelo no estratificado de riesgos proporcionales. Hazard ratio < 1 favorece a
enzalutamida
NA, no alcanzado.
Figura 1: Curvas de Kaplan-Meier de Supervivencia Global basadas en el Análisis de Supervivencia Actualizado en el Ensayo PREVAIL (análisis por intención de tratar)
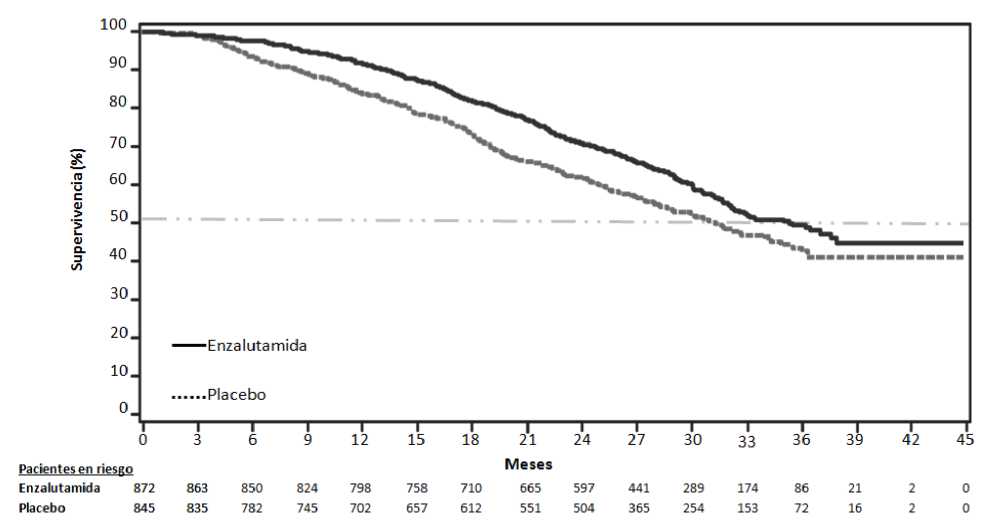
Figura 2: Análisis de Supervivencia Global Actualizado por Subgrupos: Hazard Ratio e Intervalo de Confianza del 95% en el Ensayo PREVAIL (análisis por intención de tratar)
|
Subgrupo |
N°de Pacientes Enzalutamida/ Placebo |
Hazard Ratio de muerte (IC 95%) | |
|
Todos los pacientes |
872/845 |
1 HtH i |
0,77(0,67, 0,88) |
|
Calidad de vida ECOG al inicio = 0 |
584/585 |
!-•—I1 i |
0,80 (0,67, 0,96) |
|
Calidad de vida ECOG al inicio = 1 |
288/260 |
! |
0,68(0,54, 0,86) |
|
Edad< 75 años |
555/553 |
i 1—•—H |
0,87(0,72,1,04) |
|
Edad> 75 años |
317/292 |
H#—1 ■ i |
0,62(0,50, 0,78) |
|
Región Geográfica-América del Norte |
218/208 |
i • ¡ i |
0,88(0,66, 1,17) |
|
Región Geográfica- Europa |
465/446 |
i H*H i |
0,74(0,61,0,90) |
|
Región Geográfica- Resto del mundo |
189/191 |
i—•—i' i |
0,71 (0,52, 0,97) |
|
Afectación visceral (pulmonary/o hepática) - Si |
98/106 |
1 |
0,69(0,48,1,01) |
|
Afectación visceral (pulmonary/o hepática)- No |
774/739 |
i h*H i -.-1-, |
0,78(0,67, 0,91) |
0 0,5 1,0 1,5
Favorece a enzalutamida Favorece al placebo
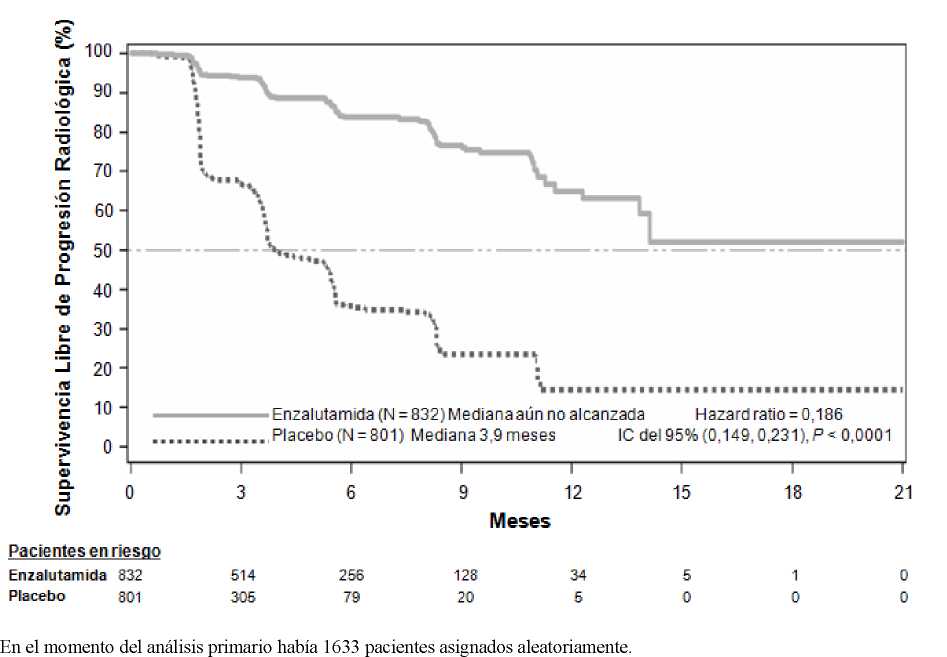
En el análisis preestablecido de la SLPr se demostró una mejora estadísticamente significativa entre los grupos de tratamiento, con una reducción del 81,4% en el riesgo de progresión radiológica o muerte [HR = 0,186 (IC del 95%: 0,149; 0,231), p < 0,0001]. Ciento dieciocho pacientes (14%) tratados con enzalutamida y 321 (40%) pacientes tratados con placebo experimentaron un acontecimiento. La mediana de la SLPr no se alcanzó (IC del 95%: 13,8; no alcanzado) en el grupo tratado con enzalutamida y fue de 3,9 meses (IC del 95%: 3,7; 5,4) en el grupo tratado con placebo (Figura 3). Se observó un beneficio constante en la SLPr en todos los subgrupos de pacientes preestablecidos (p. ej., edad, estado funcional ECOG basal, valores de PSA y LDH basales, puntuación de Gleason en el momento del diagnóstico, y afectación visceral en la selección). Un análisis preestablecido de seguimiento de la SLPr basado en la evaluación de la progresión radiológica por parte del investigador, demostró una mejora estadísticamente significativa entre los grupos de tratamiento, con una reducción del 69,3% en el riesgo de progresión radiológica o muerte [HR = 0,307 (IC del 95%: 0,267; 0,353), p < 0,0001]. La mediana de la SLPr fue de 19,7 meses en el grupo de enzalutamida y de 5,4 meses en el grupo de placebo.
Figura 3: Curvas de Kaplan-Meier de Supervivencia Libre de Progresión Radiológica en el Ensayo PREVAIL (análisis por intención de tratar)
Además de las co-variables primarias de eficacia, también se demostraron mejoras estadísticamente significativas en las siguientes variables definidas prospectivamente.
La mediana del tiempo hasta el inicio de la quimioterapia citotóxica fue de 28,0 meses para los pacientes que recibieron enzalutamida y de 10,8 meses para los pacientes que recibieron placebo (HR = 0,350, IC del 95%: [0,303; 0,403], p < 0,0001).
La proporción de pacientes tratados con enzalutamida con enfermedad medible basal que lograron una respuesta objetiva en tejidos blandos fue del 58,8% (IC del 95%: 53,8; 63,7) en comparación con el 5,0% (IC del 95%: 3,0; 7,7) de pacientes que recibieron placebo. La diferencia absoluta en la respuesta objetiva en tejidos blandos entre los grupos de enzalutamida y de placebo fue del 53,9% (IC del 95%: 48,5%; 59,1%, p < 0,0001). Se notificaron respuestas completas en el 19,7% de los pacientes tratados con enzalutamida en comparación con el 1,0% de los pacientes tratados con placebo, y se notificaron respuestas parciales en el 39,1% de los pacientes tratados con enzalutamida, en comparación con el 3,9% de los pacientes tratados con placebo.
Enzalutamida disminuyó significativamente el riesgo de primer evento óseo en un 28% [HR = 0,718 (IC del 95%: 0,610; 0,844) valor de p < 0.0001]. Un evento óseo se definió como tratamiento de radioterapia o cirugía ósea para el cáncer de próstata, fractura ósea patológica, compresión de la médula espinal o cambio en el tratamiento antineoplásico para tratar el dolor óseo. El análisis incluyó 587 eventos óseos , de los cuales 389 (66,3%) eventos fueron radiación en el hueso, 79 (13,5%) eventos fueron compresión de la médula espinal, 70 (11,9%) eventos fueron fractura ósea patológica, 45 (7,6%) eventos fueron cambio en el tratamiento antineoplásico para tratar el dolor óseo y 22 (3,7%) eventos fueron cirugía ósea.
Los pacientes que recibieron enzalutamida demostraron una tasa de respuesta total del PSA significativamente superior (definida como una reducción > 50% desde el inicio), en comparación con los pacientes que recibieron placebo, 78,0% frente al 3,5% (diferencia = 74,5%, p < 0,0001).
La mediana del tiempo hasta la progresión del PSA según los criterios PCWG2 fue de 11,2 meses para los pacientes tratados con enzalutamida y de 2,8 meses para los pacientes que recibieron placebo [HR = 0,169, (IC del 95%: 0,147; 0,195), p < 0,0001].
El tratamiento con enzalutamida redujo el riesgo de empeoramiento de la FACT-P en un 37,5% en comparación con placebo (p < 0,001). La mediana del tiempo hasta el empeoramiento de la FACT-P fue de 11,3 meses en el grupo de enzalutamida y de 5,6 meses en el grupo de placebo.
Ensayo 9785-CL-0222 (TERRAIN) (pacientes que no habían recibido quimioterapia)
El ensayo TERRAIN incluyó 375 pacientes que no habían recibido tratamiento antiandrogénico o quimioterapia previamente que fueron asignados aleatoriamente para recibir enzalutamida en una dosis de 160 mg una vez al día (N = 184) o bicalutamida en una dosis de 50 mg una vez al día (N = 191). La mediana de SLP fue de 15,7 meses para pacientes con enzalutamida versus de 5,8 meses para pacientes con bicalutamida [HR = 0,44, (IC del 95%: 0,34; 0,57), p < 0,0001].
Se definió supervivencia libre de progresión como evidencia radiológica objetiva de la progresión de la enfermedad por revisión centralizada independiente, eventos óseos, inicio de nuevo tratamiento antineoplásico o muerte por cualquier causa, lo que primero ocurriera. Se observó un efecto beneficioso constante en la SLP en todos los subgrupos de pacientes preestablecidos.
Ensayo CRPC2 (AFFIRM) (pacientes que habían recibido quimioterapia previa)
La eficacia y la seguridad de enzalutamida en pacientes con cáncer de próstata metastásico resistente a la castración que habían recibido docetaxel y estaban utilizando un análogo de la LHRH o se habían sometido a una orquiectomía, se evaluaron en un ensayo clínico de fase 3, multicéntrico, aleatorizado y controlado con placebo. Se asignó aleatoriamente a un total de 1199 pacientes en una proporción 2:1 para recibir enzalutamida por vía oral en una dosis de 160 mg una vez al día (N = 800) o placebo una vez al día (N = 399). Se permitió a los pacientes, aunque no se les exigió, que tomaran prednisona (la dosis diaria máxima permitida fue de 10 mg de prednisona o equivalente). Los pacientes aleatorizados a cualquiera de los grupos tenían que continuar el tratamiento hasta la progresión de la enfermedad (definida como progresión radiológica confirmada o aparición de un evento óseo) y el inicio de un nuevo tratamiento antineoplásico sistémico, toxicidad inaceptable, o retirada del ensayo.
Los datos demográficos de los pacientes y características basales de la enfermedad estuvieron equilibrados entre los grupos de tratamiento. La mediana de edad era de 69 años (intervalo, 41-92) y la distribución racial fue 93% de raza caucásica, 4% de raza negra, 1% asiática y 2% de otras razas. La puntuación funcional ECOG fue de 0-1 en el 91,5% y 2 en el 8,5% de los pacientes; el 28% tuvo una puntuación media en la escala del dolor Brief Pain Inventory > 4 (media del peor dolor notificado por el paciente en las 24 horas previas calculadas durante los siete días antes de la aleatorización). La mayoría (91%) de los pacientes presentaba metástasis óseas y el 23% presentaba afectación visceral pulmonar y/o hepática. En el momento de la inclusión en el estudio, el 41% de los pacientes aleatorizados presentaba sólo progresión del PSA, mientras que el 59% presentaba progresión radiológica. El cincuenta y uno por ciento (51%) de los pacientes recibía bifosfonatos al inicio del estudio.
En el ensayo AFFIRM se excluyó a los pacientes con enfermedades que pudieran predisponerlos a sufrir crisis epilépticas (ver sección 4.8) y medicamentos que disminuyen el umbral epiléptico, así como con enfermedades cardiovasculares clínicamente significativas, como hipertensión incontrolada, antecedentes recientes de infarto de miocardio o angina de pecho inestable, insuficiencia cardíaca de clase III o IV según la New York Heart Association (a menos que la fracción de eyección fuera > 45%), arritmias ventriculares clínicamente significativas o bloqueo AV (sin marcapasos permanente).
El análisis intermedio tras 520 muertes preestablecido en el protocolo, mostró una superioridad estadísticamente significativa en cuanto a supervivencia global en los pacientes tratados con enzalutamida en comparación con placebo (Tabla 3 y Figuras 4 y 5).
Tabla 3: Supervivencia Global de los Pacientes Tratados con Enzalutamida o con Placebo en el Ensayo AFFIRM (análisis por intención de tratar)__
|
Enzalutamida (N = 800) |
Placebo (N = 399) | |
|
Muertes (%) |
308 (38,5%) |
212 (53,1%) |
|
Mediana de supervivencia (meses) (IC del 95%) |
18,4 (17,3, NA) |
13,6 (11,3, 15,8) |
|
Valor pa |
< 0,0001 | |
|
Hazard ratio (IC del 95%)b |
0,631 (0,529, 0,752) | |
a El valor p se deriva de una prueba de rangos logarítmicos estratificada de acuerdo a la puntuación del estado funcional ECOG (0-1 frente a 2) y la puntuación media de dolor (< 4 frente a > 4). b Hazard ratio se deriva de un modelo estratificado de riesgos proporcionales. Hazard ratio < 1 favorece a enzalutamida.
NA, no alcanzado.
Figura 4: Curvas de Kaplan-Meier de supervivencia global en el Ensayo AFFIRM (análisis por intención de tratar)
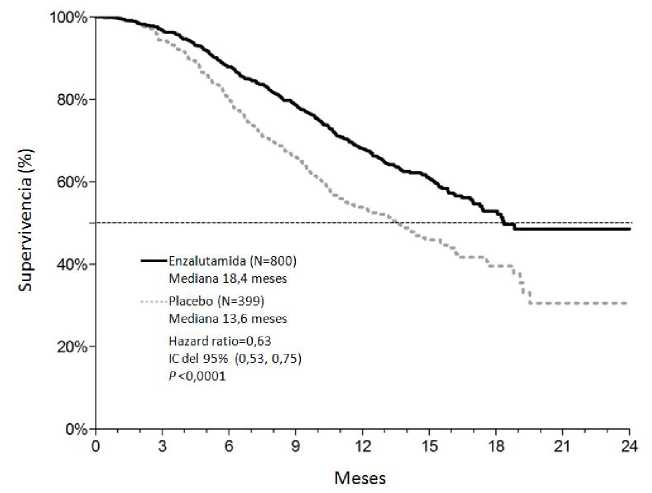
Figura 5: Supervivencia global por subgrupos en el Ensayo AFFIRM - hazard ratio e intervalo de confianza del 95%
Subgrupo
Numero de Pacientes Enzalutamida/Placebo
Hazard Ratio de muerte Mediana (IC del 95%)
de supervivencia global (mes) Enzalutamida/Placebo
|
Todos los Pacientes |
600/399 |
h*—I |
0,63 (0,53-0,75) |
18,4/13,6 |
|
Edad | ||||
|
<65 |
232/130 |
I—•-i |
0,63 (0,46-0,87) |
—/12,4 |
|
>65 |
568/269 |
l ♦ l |
0,63 (0,51-0,78) |
18,4/13,9 |
|
Puntuación Basal del Estado Funcional ECOG | ||||
|
0-1 |
730/367 |
l-«—l |
0,62 (0,52-0,75) |
—/14,2 |
|
2 |
70/32 |
i--- |
H 0,65(0,39-1,07) |
10,5/7,2 |
|
Puntuación Media Dolor Basal escala BPI-SF (Pregunta n° 3) | ||||
|
<4 |
574/284 |
1—•—l |
0,59 (0,47-0,74) |
—/16,2 |
|
>4 |
226/115 |
0,71 (0,54-0,94) |
12,4/9,1 | |
|
Número de Esquemas Previos de Quimioterapia | ||||
|
1 |
579/296 |
h«-1 |
0,59 (0,48-0,73) |
—/14,2 |
|
>2 |
221/103 |
1 0,74(0,54-1,03) |
15,9/12,3 | |
|
Tipo de Progresión en el Momento de la Inclusión | ||||
|
Solo Progresión del PSA |
326/164 |
1—■-1 |
0,62 (0,46-0,83) |
—/19,5 |
|
Progresión Radiológica ± Progresión del PSA |
470/234 |
I-*—1 |
0,64 (0,52-0,80) |
17,3/13,0 |
|
Valor Basal del PSA | ||||
|
<mediana (111,2 pg/l) |
412/188 |
1—•-1 |
0,67 (0,50-0,89) |
—/19,2 |
|
>mediana (111,2 gg/l) |
388/211 |
l—•—l |
0,62 (0,50-0,78) |
15,3/10,3 |
|
Valor Basal de LDH | ||||
|
<mediana (211 U/l) |
411/192 |
1—•-1 |
0,63 (0,46-0,86) |
—/19,2 |
|
>mediana (211 U/l) |
389/205 |
1 » 1 |
0,61 (0,50-0,76) |
12,4/8,5 |
|
Puntuación Total Gleason en el Momento del Diagnóstico | ||||
|
<7 |
360/175 |
1—•-1 |
0,67 (0,51-0,88) |
18,4/14,8 |
|
>8 |
366/193 |
l—■—l |
0,60 (0,47-0,76) |
18,2/11,3 |
|
Afectación Visceral Pulmonar y/o Hepática en la Selección | ||||
|
No |
604/317 |
1—•—1 |
0,56 (0.46-0,69) |
—714^2 |
|
0,0 |
o.s ii |
0 i,5 2¡0 | ||
|
A favor de Enzalutamida |
A favor de Placebo | |||
ECOG: Eastern Cooperative Oncology Group; BPI-SF: Cuestionario breve de dolor-edición corta; PSA: Antígeno Prostático Específico
Además de la mejoría observada en la supervivencia global, las variables secundarias principales (progresión del PSA, supervivencia libre de progresión radiológica y tiempo hasta el primer evento óseo) favorecieron a enzalutamida y fueron estadísticamente significativas después de realizar los ajustes necesarios para los distintos análisis.
La supervivencia libre de progresión radiológica evaluada por el investigador mediante los criterios RECIST v1.1 para tejidos blandos y la aparición de 2 o más lesiones óseas en una gammagrafía ósea, fue de 8,3 meses en los pacientes tratados con enzalutamida y de 2,9 meses en los que recibieron placebo (HR = 0,404; IC del 95%: [0,350, 0,466]; p < 0,0001). En el análisis se incluyeron 216 muertes sin progresión documentada y 645 acontecimientos con progresión documentada, de los que 303 (47%) se debieron a progresión en tejidos blandos, 268 (42%) se debieron a progresión de lesiones óseas y 74 (11%) se debieron a ambas, lesiones en tejidos blandos y lesiones óseas.
La disminución confirmada del PSA del 50% o 90% fue del 54,0% y 24,8%, respectivamente, en los pacientes tratados con enzalutamida y del 1,5% y 0,9%, respectivamente, en los que recibieron placebo (p < 0,0001). La mediana del tiempo hasta la progresión del PSA fue de 8,3 meses en los pacientes tratados con enzalutamida y de 3,0 meses en los que recibieron placebo (HR= 0,248; IC del 95%: [0,204, 0,303];
p < 0,0001).
La mediana del tiempo hasta el primer evento óseo fue de 16,7 meses en los pacientes tratados con enzalutamida y de 13,3 meses en los que recibieron placebo (HR = 0,688; IC del 95%: [0,566, 0,835]; p < 0,0001). Se definió evento óseo como radioterapia o cirugía ósea, fractura ósea patológica, compresión medular o modificación del tratamiento antineoplásico para tratar el dolor óseo. En el análisis se incluyeron 448 eventos óseos, de los que 277 eventos (62%) fueron radioterapia ósea, 95 eventos (21%) fueron compresión medular, 47 eventos (10%) fueron fractura ósea patológica, 36 eventos (8%) fueron modificación del tratamiento antineoplásico para tratar el dolor óseo y 7 eventos (2%) fueron cirugía ósea.
No se ha estudiado la eficacia de enzalutamida en pacientes que hayan recibido previamente acetato de abiraterona.
Personas de edad avanzada
De los 1671 pacientes de los ensayos de fase 3 que recibieron enzalutamida, 1261 pacientes (75%) tenían 65 años o más, y 516 pacientes (31%) tenían 75 años o más. No se observaron diferencias globales en cuanto a seguridad o eficacia entre estos pacientes de edad avanzada y los pacientes más jóvenes.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con enzalutamida en los diferentes grupos de la población pediátrica en el carcinoma de próstata (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Enzalutamida es poco soluble en agua. En este producto, los macrogolglicéridos de caprilocaproílo, como emulsionantes/surfactantes, aumentan la solubilidad de enzalutamida. En estudios preclínicos, la absorción de enzalutamida aumentó cuando se disolvió en macrogolglicéridos de caprilocaproílo.
La farmacocinética de enzalutamida se ha evaluado en pacientes con cáncer de próstata y en hombres sanos. La semivida terminal (tJ/2) media de enzalutamida en pacientes que han recibido una dosis oral única, es de 5,8 días (intervalo de 2,8 a 10,2 días), y el estado estacionario se alcanza en, aproximadamente, un mes. Con la administración diaria por vía oral, enzalutamida se acumula, aproximadamente, 8,3 veces más que una dosis única. Las fluctuaciones diarias de las concentraciones plasmáticas son bajas (cociente entre concentración máxima y mínima de 1,25). El aclaramiento de enzalutamida se realiza, principalmente, por metabolismo hepático, produciendo un metabolito activo que es igual de activo que enzalutamida y que circula aproximadamente en la misma concentración plasmática que enzalutamida.
Absorción
La concentración plasmática máxima (Cmáx) de enzalutamida en los pacientes se observa entre 1 y 2 horas después de la administración. Según un estudio de balance de masa en seres humanos, se estima que la absorción oral de enzalutamida es, como mínimo, del 84,2%. Enzalutamida no es un sustrato de los transportadores de salida gp-P o BCRP. En estado estacionario, los valores medios de Cmáx para enzalutamida y su metabolito activo son de 16,6 ^g/ml (23% de coeficiente de variación [CV]) y 12,7 ^g/ml (30% de CV), respectivamente.
Los alimentos carecen de efecto clínicamente significativo sobre el grado de absorción. En los ensayos clínicos, Xtandi se administró sin tener en cuenta la ingesta de alimentos.
Distribución
El volumen de distribución (V/F) medio aparente de enzalutamida, en pacientes tras una dosis oral única es de 110 l (29% de CV). El volumen de distribución de enzalutamida es mayor que el volumen de agua corporal total, lo que indica una amplia distribución extravascular. Los estudios realizados en roedores indican que enzalutamida y su metabolito activo pueden atravesar la barrera hematoencefálica.
Enzalutamida se une a las proteínas plasmáticas en un 97 a 98%, principalmente a la albúmina. El metabolito activo se une a las proteínas plasmáticas en un 95%. No hubo desplazamiento de la unión a proteínas entre enzalutamida y otros fármacos de alta unión (warfarina, ibuprofeno y ácido salicílico) in vitro.
Biotransformación
Enzalutamida se metaboliza ampliamente. En el plasma humano hay dos metabolitos principales: N-desmetil enzalutamida (activo) y un derivado del ácido carboxílico (inactivo). Enzalutamida se metaboliza por el CYP2C8 y, en menor grado, por el CYP3A4/5 (ver sección 4.5), los cuales participan en la formación del metabolito activo. In vitro, N-desmetil enzalutamida se metaboliza al metabolito del ácido carboxílico a través de la carboxilesterasa 1, que también desempeña un papel menor en el metabolismo de enzalutamida al metabolito del ácido carboxílico. N-desmetil enzalutamida no fue metabolizada por los CYP in vitro.
En condiciones de uso clínico, enzalutamida es un inductor potente del CYP3A4, un inductor moderado del CYP2C9 y CYP2C19 y carece de efectos clínicamente significativos sobre el CYP2C8 (ver sección 4.5).
Eliminación
El aclaramiento medio (CL/F) de enzalutamida en pacientes oscila entre 0,520 y 0,564 l/h.
Tras la administración oral de 14C-enzalutamida, el 84,6% de la radiactividad se recupera 77 días después de la administración: el 71,0% se recupera en la orina (principalmente en forma de metabolito inactivo, con cantidades mínimas de enzalutamida y del metabolito activo) y el 13,6% en las heces (0,39% de la dosis en forma de enzalutamida sin modificar).
Los datos in vitro indican que enzalutamida no es un sustrato del OATP1B1, OATP1B3, ni del OCT1; y N-desmetil enzalutamida no es un sustrato de gp-P ni de BCRP.
Los datos in vitro indican que enzalutamida y sus metabolitos principales no inhiben los siguientes transportadores a concentraciones clínicamente relevantes: OATP1B1, OATP1B3, OCT2 o OAT1.
Linealidad
No se observan desviaciones importantes en el intervalo de dosis de 40 a 160 mg con respecto a la proporcionalidad de la dosis. Los valores de Cmin de enzalutamida y su metabolito activo en estado estacionario en pacientes concretos, permanecieron constantes durante más de un año de tratamiento crónico, lo que demuestra una farmacocinética lineal con el tiempo una vez que se alcanza el estado estacionario.
Insuficiencia renal
No se han realizado estudios formales de enzalutamida en pacientes con insuficiencia renal. Se excluyó de los ensayos clínicos a los pacientes con una creatinina sérica > 177 ^mol/l (2 mg/dl). Según un análisis de farmacocinética poblacional, no es necesario ajustar la dosis en los pacientes con valores calculados de aclaramiento de creatinina (CrCL) > 30 ml/min (estimados mediante la fórmula de Cockcroft y Gault). Enzalutamida no se ha evaluado en pacientes con insuficiencia renal grave (CrCL < 30 ml/min) o enfermedad renal terminal y se aconseja precaución al tratar a estos pacientes. Es poco probable que enzalutamida se elimine significativamente mediante hemodiálisis intermitente o diálisis peritoneal ambulatoria continua.
Insuficiencia hepática
La insuficiencia hepática no tuvo un efecto pronunciado sobre la exposición total a enzalutamida o a su metabolito activo. Sin embargo, la semivida del fármaco fue el doble en los pacientes con insuficiencia hepática grave comparado con los controles sanos (10,4 días comparado con 4,7 días), posiblemente relacionado con un aumento de la distribución tisular.
La farmacocinética de enzalutamida se evaluó en sujetos con insuficiencia hepática basal leve (N = 6), moderada (N = 8) o grave (N = 8) (clase A, B o C de Child-Pugh, respectivamente) comparados con 22 sujetos de control con una función hepática normal. Tras administrar una dosis oral única de 160 mg de enzalutamida, el AUC y la Cmáx de enzalutamida en sujetos con insuficiencia leve aumentaron un 5% y un 24%, respectivamente, el AUC y la Cmáx de enzalutamida en sujetos con insuficiencia moderada aumentó un 29% y disminuyó un 11%, respectivamente, y el AUC y la Cmáx de enzalutamida en sujetos con insuficiencia grave aumentó un 5% y disminuyó un 41%, respectivamente, en comparación con los sujetos de control sanos. Para la suma de enzalutamida libre más el metabolito activo libre, el AUC y la Cmáx en sujetos con insuficiencia leve aumentaron un 14% y un 19%, respectivamente, el AUC y la Cmáx en sujetos con insuficiencia moderada aumentó un 14% y disminuyó un 17%, respectivamente, y el AUC y la Cmáx en sujetos con insuficiencia hepática grave aumentó un 34% y disminuyó un 27%, respectivamente, en comparación con los sujetos de control sanos.
Raza
La mayoría de los pacientes de los ensayos clínicos (> 84%) eran de raza caucásica. Según los datos farmacocinéticos de un estudio realizado en pacientes japoneses con cáncer de próstata, no hay diferencias clínicamente relevantes en la exposición entre los japoneses y los caucásicos. Los datos disponibles son insuficientes para evaluar las posibles diferencias en la farmacocinética de enzalutamida en otras razas.
Personas de edad avanzada
No se observó un efecto clínicamente relevante de la edad sobre la farmacocinética de enzalutamida en el análisis de farmacocinética poblacional.
5.3 Datos preclínicos sobre seguridad
El tratamiento de ratones gestantes con enzalutamida dio lugar a un aumento de la incidencia de muertes embriofetales y alteraciones externas y esqueléticas. No se han realizado estudios de toxicidad para la reproducción con enzalutamida, pero en los estudios efectuados en ratas (4 y 26 semanas) y perros (4, 13 y 39 semanas) se observó atrofia, aspermia/hipospermia e hipertrofia/hiperplasia en el aparato reproductor, consecuente con la actividad farmacológica de enzalutamida. En los estudios realizados en ratones (4 semanas), ratas (4 y 26 semanas) y perros (4, 13 y 39 semanas), las alteraciones de los órganos reproductores asociadas a enzalutamida fueron disminuciones del peso de los órganos con atrofia de la próstata y del epidídimo. Se observaron hipertrofia y/o hiperplasia de las células de Leydig en ratones (4 semanas) y perros (39 semanas). Otras alteraciones de los tejidos reproductores incluyeron hipertrofia/hiperplasia de la hipófisis y atrofia de las vesículas seminales en ratas, e hipospermia testicular y degeneración de los túbulos seminíferos en perros. Se observaron diferencias en función del sexo en las glándulas mamarias de la rata (atrofia en los machos e hiperplasia lobulillar en las hembras). Las alteraciones de los órganos reproductores en ambas especies fueron consecuentes con la actividad farmacológica de enzalutamida y fueron reversibles o se resolvieron parcialmente tras un periodo de recuperación de 8 semanas. No se produjeron otras alteraciones importantes en patología clínica o histopatología en ningún otro sistema orgánico, incluido el hígado, en ninguna de las especies.
Enzalutamida no indujo mutaciones en el ensayo de mutagénesis microbiana (Ames) y no fue clastogénico en el análisis citogenético in vitro con células de linfoma de ratón ni en el análisis de micronúcleos de ratón in vivo. No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de enzalutamida. Enzalutamida no presentó fototoxicidad in vitro.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula Macrogol-8 glicéridos de caprilocaproílo Butilhidroxianisol (E320) Butilhidroxitolueno (E321)
Cubierta de la cápsula Gelatina
Solución de sorbitán sorbitol Glicerol
Dióxido de titanio (E171)
Agua purificada
Tinta de impresión Óxido de hierro negro (E172)
Ftalato de acetato de polivinilo
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Estuche de bolsillo de cartón que incorpora un blíster de PVC/PCTFE/aluminio con 28 cápsulas blandas. Cada envase contiene 4 estuches de bolsillo (112 cápsulas blandas).
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Astellas Pharma Europe B.V.
Sylviusweg 62 2333 BE Leiden Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/846/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización 21/Junio/2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricante(s) responsable^) de la liberación de los lotes
Astellas Pharma Europe B.V.
Sylviusweg 62 2333 BE Leiden Países Bajos
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 8 meses después de la autorización. Posteriormente, el titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Xtandi 40 mg cápsulas blandas enzalutamida
2. PRINCIPIO(S) ACTIVO(S)
Cada cápsula contiene 40 mg de enzalutamida.
3. LISTA DE EXCIPIENTES
Contiene sorbitol (E420).
Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
112 cápsulas blandas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Astellas Pharma Europe B.V. Sylviusweg 62 2333 BE Leiden Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/846/001 112 cápsulas blandas
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xtandi 40 mg
1. NOMBRE DEL MEDICAMENTO
Xtandi 40 mg cápsulas blandas enzalutamida
2. PRINCIPIO(S) ACTIVO(S)
Cada cápsula contiene 40 mg de enzalutamida.
3. LISTA DE EXCIPIENTES
Contiene sorbitol (E420).
Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
28 cápsulas blandas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Vía oral.
Lunes
Martes
Miércoles
Jueves
Viernes
Sábado
Domingo
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Astellas Pharma Europe B.V. Sylviusweg 62 2333 BE Leiden Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xtandi 40 mg
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS
BLÍSTER_
1. NOMBRE DEL MEDICAMENTO_
Xtandi 40 mg
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
3. FECHA DE CADUCIDAD_
EXP
4. NÚMERO DE LOTE_
Lot
5. OTROS
B. PROSPECTO
Prospecto: información para el paciente
Xtandi 40 mg cápsulas blandas
enzalutamida
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Xtandi y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Xtandi
3. Cómo tomar Xtandi
4. Posibles efectos adversos
5. Conservación de Xtandi
6. Contenido del envase e información adicional
1. Qué es Xtandi y para qué se utiliza
Xtandi contiene el principio activo enzalutamida. Xtandi se utiliza para tratar a hombres adultos con cáncer de próstata que se ha extendido a otras partes del cuerpo.
Cómo actúa Xtandi
Xtandi es un medicamento que actúa bloqueando la actividad de unas hormonas llamadas andrógenos (como la testosterona). Al bloquear los andrógenos, enzalutamida hace que las células del cáncer de próstata dejen de crecer y dividirse.
2. Qué necesita saber antes de empezar a tomar Xtandi No tome Xtandi:
- Si es alérgico (hipersensible) a enzalutamida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- Si está embarazada o puede quedarse embarazada (ver “Embarazo, lactancia y fertilidad”).
Advertencias y precauciones
Crisis epiléptica
Se han comunicado crisis epilépticas en 5 de cada 1.000 personas que tomaban Xtandi, y en menos de una de cada 1.000 personas que tomaban placebo (ver también “Uso de Xtandi con otros medicamentos” en esta sección y “Posibles efectos adversos” en sección 4).
Algunas situaciones en las que puede tener un mayor riesgo de sufrir una crisis epiléptica son:
- Si ha tenido episodios anteriores de crisis epilépticas
- Si ha sufrido una lesión grave en la cabeza o tiene antecedentes de traumatismo craneal
- Si ha tenido determinados tipos de ictus
- Si ha tenido un tumor cerebral o cáncer que se ha extendido al cerebro
- Si consume habitualmente o de vez en cuando cantidades muy elevadas de alcohol
- Si está tomando un medicamento que puede causar crisis epilépticas o que puede aumentar la predisposición a tener crisis epilépticas (ver a continuación ”Uso de Xtandi con otros medicamentos”)
Si tiene una crisis epiléptica durante el tratamiento:
Deje de tomar Xtandi y no tome ninguna cápsula más. Acuda a su médico lo antes posible.
Síndrome de encefalopatía posterior reversible (SEPR)
Se han comunicado casos raros de SEPR, una enfermedad, rara, reversible, que afecta al cerebro, en pacientes tratados con XTANDI. Si tiene una crisis epiléptica, empeoramiento del dolor de cabeza, confusión, ceguera, u otros problemas en la visión, contacte con su médico lo antes posible. (Ver también sección 4 “Posibles efectos adversos”).
Consulte a su médico antes de empezar a tomar Xtandi
- Si está tomando medicamentos para prevenir los coágulos de sangre (p. ej. warfarina, acenocumarol)
- Si tiene problemas de hígado
- Si tiene problemas de riñones
Informe a su médico si padece:
Cualquier alteración cardiaca o de los vasos sanguíneos, incluidos los problemas de ritmo cardiaco (arritmias), o si está siendo tratado con medicamentos para corregir estas alteraciones. El riesgo de problemas de ritmo cardiaco se puede ver aumentado con la utilización de Xtandi.
Si algo de lo anterior le aplica a usted o si no está seguro, consulte a su médico antes de tomar este medicamento.
Niños y adolescentes
Este medicamento no se debe administrar a niños ni adolescentes.
Uso de Xtandi con otros medicamentos
Informe a su médico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento. Necesita saber los nombres de los medicamentos que toma. Lleve consigo una lista de éstos para mostrársela a su médico cuando le receten un nuevo medicamento. No debe empezar o dejar de tomar ningún medicamento antes de consultar al médico que le recetó Xtandi.
Informe a su médico si está tomando alguno de los siguientes medicamentos. Estos medicamentos pueden aumentar el riesgo de sufrir una crisis epiléptica cuando se toman a la vez que Xtandi:
- Determinados medicamentos utilizados para tratar el asma y otras enfermedades respiratorias (p. ej. aminofilina, teofilina)
- Medicamentos utilizados para tratar determinados trastornos psiquiátricos, como depresión y esquizofrenia (p. ej. clozapina, olanzapina, risperidona, ziprasidona, bupropión, litio, clorpromazina, mesoridazina, tioridazina, amitriptilina, desipramina, doxepina, imipramina, maprotilina, mirtazapina)
- Determinados medicamentos para el tratamiento del dolor (p. ej. petidina)
Informe a su médico si está tomando los siguientes medicamentos. Estos medicamentos pueden influir en el efecto de Xtandi o Xtandi puede influir en el efecto de estos medicamentos:
Esto incluye determinados medicamentos utilizados para:
- Reducir el colesterol (p. ej. gemfibrozilo, atorvastatina, simvastatina)
- Tratar el dolor (p. ej. fentanilo, tramadol)
- Tratar el cáncer (p. ej. cabazitaxel)
- Tratar la epilepsia (p. ej. carbamazepina, clonazepam, fenitoína, primidona, ácido valproico)
- Tratar determinados trastornos psiquiátricos como ansiedad grave o esquizofrenia (p. ej. diazepam, midazolam, haloperidol)
- Tratar trastornos del sueño (p. ej. zolpidem)
- Tratar problemas cardiacos o disminuir la presión arterial (p. ej. bisoprolol, digoxina, diltiazem, felodipino, nicardipino, nifedipino, propranolol, verapamilo)
- Tratar enfermedades graves relacionadas con la inflamación (p. ej. dexametasona, prednisolona)
- Tratar la infección por el VIH (p. ej. indinavir, ritonavir)
- Tratar infecciones bacterianas (p. ej. claritromicina, doxiciclina)
- Tratar trastornos del tiroides (p. ej. levotiroxina)
- Tratar la gota (p. ej. colchicina)
- Prevenir problemas cardiacos o ictus (dabigatrán etexilato)
Xtandi puede interferir con algunos medicamentos que se utilizan para tratar problemas del ritmo cardiaco (p. ej: quinidina, procainamida, amiodarona y sotalol) o puede aumentar el riesgo de problemas del ritmo cardiaco cuando se usa con ciertos medicamentos (p. ej: metadona (se usa para el alivio del dolor y como parte de la desintoxicación de la drogadicción), moxifloxacino (un antibiótico), antipsicóticos usados para enfermedades mentales graves).
Informe a su médico si está tomando alguno de los medicamentos citados anteriormente. Podría ser necesario modificar la dosis de Xtandi o de cualquier otro medicamento que esté tomando.
Embarazo, lactancia y fertilidad
- Xtandi no está indicado en las mujeres. Este medicamento puede ser perjudicial para el feto si lo toma una mujer embarazada. No se debe administrar a mujeres embarazadas, que se puedan quedar embarazadas o que estén durante el periodo de lactancia.
- Es posible que este medicamento afecte a la fertilidad masculina.
- Si mantiene relaciones sexuales con una mujer en edad fértil, debe utilizar un preservativo y otro método anticonceptivo eficaz durante el tratamiento y en los 3 meses posteriores al tratamiento con este medicamento. Si mantiene relaciones sexuales con una mujer embarazada, debe utilizar un preservativo para proteger al feto.
Conducción y uso de máquinas
Este medicamento puede tener un efecto moderado sobre su capacidad para conducir o utilizar herramientas o máquinas, ya que entre los efectos adversos de Xtandi se incluyen las crisis epilépticas. Si tiene un mayor riesgo de sufrir crisis epilépticas (ver sección 2), debe consultar a su médico.
Xtandi contiene sorbitol
Este medicamento contiene sorbitol (un tipo de azúcar). Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo tomar Xtandi
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
La dosis recomendada es de 160 mg (cuatro cápsulas), tomadas al mismo tiempo una vez al día.
Cómo tomar Xtandi
- Trague las cápsulas enteras con agua.
- No mastique, disuelva ni abra las cápsulas antes de tragarlas.
- Xtandi se puede tomar con o sin alimentos.
Es posible también que su médico le recete otros medicamentos mientras esté tomando Xtandi.
Si toma más Xtandi del que debe
Si toma más cápsulas de las recetadas, deje de tomar Xtandi y contacte con su médico. Puede tener un mayor riesgo de sufrir una crisis epiléptica u otros efectos adversos.
Si olvidó tomar Xtandi
- Si olvidó tomar Xtandi a la hora habitual, tome la dosis habitual en cuanto se acuerde.
- Si olvidó tomar Xtandi durante todo el día, tome la dosis habitual al día siguiente.
- Si olvidó tomar Xtandi durante más de un día, consulte a su médico inmediatamente.
- No tome una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Xtandi
No deje de tomar este medicamento a menos que su médico se lo indique.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Crisis epilépticas
Se han comunicado crisis epilépticas en 5 de cada 1.000 personas que tomaban Xtandi, y en menos de una de cada 1.000 personas que tomaban placebo.
Las crisis epilépticas son más probables si toma una dosis de este medicamento superior a la recomendada, si toma determinados medicamentos o si presenta un riesgo mayor al habitual de sufrir una crisis epiléptica (ver sección 2).
Si tiene una crisis epiléptica, acuda a su médico lo antes posible. Deje de tomar Xtandi.
Síndrome de Encefalopatía Posterior Reversible (SEPR)
Se han comunicado casos raros de SEPR (pueden afectar hasta 1 de cada 1.000 personas), una enfermedad rara, reversible, que afecta al cerebro, en pacientes tratados con XTANDI. Si tiene una crisis epiléptica, empeoramiento del dolor de cabeza, confusión, ceguera, u otros problemas en la visión, contacte con su médico lo antes posible.
Otros posibles efectos adversos son:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
Cansancio, dolor de cabeza, sofocos, presión arterial alta
Frecuentes (pueden afectar hasta 1 de cada 10 personas)
Caídas, fracturas de huesos, sensación de ansiedad, piel seca, picor, dificultad para recordar, aumento del tamaño de la mama en los hombres (ginecomastia), síntoma de síndrome de piernas inquietas (necesidad incontrolable de mover una parte del cuerpo, normalmente las piernas), pérdida de concentración, olvidos
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
Alucinaciones, dificultad para pensar con claridad, recuento bajo de glóbulos blancos
No conocida (la frecuencia no puede estimarse a partir de los datos disponibles)
Dolor muscular, espasmos musculares, debilidad muscular, dolor de espalda, cambios en el electrocardiograma (prolongación del intervalo QT), molestias en el estómago incluyendo sensación de mareo (náuseas), erupción cutánea, vómitos, hinchazón de los labios, lengua y/o garganta, disminución del número de plaquetas en sangre (lo que aumenta el riesgo de hemorragias o hematoma), diarrea
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
Conservación de Xtandi
5.
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el estuche de bolsillo de cartón y en el envase exterior. La fecha de caducidad es el último día del mes que se indica.
No requiere condiciones especiales de conservación.
No tome ninguna cápsula que presente pérdida de contenido, esté dañada o muestre signos de manipulación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Xtandi
- El principio activo es enzalutamida. Cada cápsula contiene 40 mg de enzalutamida.
- Los demás componentes de la cápsula son macrogol-8 glicéridos de caprilocaproílo, butilhidroxianisol (E320) y butilhidroxitolueno (E321).
- Los componentes de la cubierta de la cápsula son gelatina, solución de sorbitán sorbitol (ver sección 2), glicerol, dióxido de titanio (E171) y agua purificada.
- Los componentes de la tinta son óxido de hierro negro (E172) y ftalato de acetato de polivinilo.
Aspecto del producto y contenido del envase
- Xtandi cápsulas son cápsulas blandas oblongas (de aproximadamente 20 x 9 mm), de color blanco a blanquecino, con ”ENZ” impreso en una cara.
- Cada envase contiene 112 cápsulas en 4 blísters en estuches de bolsillo de 28 cápsulas cada uno.
Titular de la autorización de comercialización y responsable de la fabricación
Astellas Pharma Europe B.V.
Sylviusweg 62 2333 BE Leiden Países Bajos
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Etarapna
Acreaac OapMa EOOfl Tea.: + 359 2 862 53 72
Lietuva
Astellas Pharma a/s Danija
Tel: +45 4343 0355
Luxembourg/Luxemburg
Astellas Pharma B.V.Branch Belgique/Belgien Tél/Tel: + 32 (0)2 5580710
Magyarország
Astellas Pharma Kft.
Tel.: +36 1 577 8200
|
Danmark Astellas Pharma a/s Tlf: + 45 43 430355 |
Malta E.J. Busuttil Ltd. Tel: + 356 21 447184 |
|
Deutschland Astellas Pharma GmbH Tel: + 49 (0)89 454401 |
Nederland Astellas Pharma B.V. Tel: + 31 (0)71 5455745 |
|
Eesti Astellas Pharma a/s. Taani Tel: +45 4343 0355 |
Norge Astellas Pharma Tlf: + 47 66 76 46 00 |
|
EXXáSa Astellas Pharmaceuticals AEBE Tn^: + 30 210 8189900 |
Osterreich Astellas Pharma Ges.m.b.H. Tel: + 43 (0)1 8772668 |
|
España Astellas Pharma S.A. Tel: + 34 91 4952700 |
Polska Astellas Pharma Sp.z.o.o. Tel.: + 48 225451 111 |
|
France Astellas Pharma S.A.S. Tél: + 33 (0)1 55917500 |
Portugal Astellas Farma, Lda. Tel: + 351 21 4401320 |
|
Hrvatska Astellas d.o.o. Tel: + 385 1 670 01 02 |
Romania S.C.Astellas Pharma SRL Tel: + 40 (0)21 361 04 95 /96 /92 |
|
Ireland Astellas Pharma Co. Ltd. Tel: + 353 (0)1 4671555 |
Slovenija Astellas Pharma d.o.o. Tel: + 386 14011 400 |
|
Ísland Vistor hf Sími: + 354 535 7000 |
Slovenská republika Astellas Pharma s.r.o., Tel: + 421 2 4444 2157 |
|
Italia Astellas Pharma S.p.A. Tel: + 39 02 921381 |
Suomi/Finland Astellas Pharma Puh/Tel: + 358 (0)9 85606000 |
|
Kúnpoq Astellas Pharmaceuticals AEBE EAAáSa Tn^: + 30 210 8189900 |
Sverige Astellas Pharma AB Tel: + 46 (0)40-650 15 00 |
|
Latvija Astellas Pharma a/s Danija Tel: +45 4343 0355 |
United Kingdom Astellas Pharma Ltd. Tel: + 44 (0)203 379 8700 |
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
36