Xgeva 120 Mg Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
XGEVA 120 mg solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 120 mg de denosumab en 1,7 ml de solución (70 mg/ml).
Denosumab es un anticuerpo monoclonal IgG2 humano producido en una línea celular de mamíferos (CHO) mediante tecnología del ADN recombinante.
Excipiente con efecto conocido
Cada 1,7 ml de solución contiene 78 mg de sorbitol (E420).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución transparente, de incolora a ligeramente amarillenta, que puede contener cantidades residuales de partículas proteicas de translúcidas a blancas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Prevención de eventos relacionados con el esqueleto (fractura patológica, radioterapia ósea, compresión de la médula espinal o cirugía ósea) en adultos con metástasis óseas de tumores sólidos.
Tratamiento de adultos y adolescentes con el esqueleto maduro con tumor de células gigantes de hueso no resecable o cuando la resección quirúrgica implique morbilidad grave.
4.2 Posología y forma de administración
XGEVA debe ser administrado bajo la responsabilidad de un profesional sanitario.
Posología
Todos los pacientes deben tomar suplementos de al menos 500 mg de calcio y 400 UI de vitamina D diarios, a no ser que presenten hipercalcemia (ver sección 4.4).
Los pacientes tratados con XGEVA deben recibir el prospecto y la tarjeta recordatorio para el paciente.
Prevención de eventos relacionados con el esqueleto en pacientes adultos con metástasis óseas de tumores sólidos
La dosis recomendada es de 120 mg administrados en una única inyección subcutánea una vez cada 4 semanas en el muslo, el abdomen o la parte superior del brazo.
Tumor de células gigantes de hueso
La dosis recomendada de XGEVA es de 120 mg administrados en una única inyección subcutánea una vez cada 4 semanas en el muslo, el abdomen o la parte superior del brazo con unas dosis adicionales de 120 mg en los días 8 y 15 del primer mes de tratamiento.
De acuerdo con el protocolo, los pacientes en el estudio de fase II que presentaban resección completa de tumor de células gigantes de hueso recibieron 6 meses de tratamiento adicional después de la cirugía.
Los pacientes con tumor de células gigantes de hueso se deben evaluar en intervalos regulares para determinar si continúan beneficiándose del tratamiento. En pacientes cuya enfermedad está controlada por XGEVA, no se ha evaluado los efectos de la interrupción o cese de tratamiento, no obstante, los datos limitados en estos pacientes no indican un efecto rebote tras la interrupción del tratamiento.
Pacientes con insuficiencia renal
No se requieren ajustes de dosis en pacientes con insuficiencia renal (para consultar las recomendaciones respecto a la monitorización del calcio, ver sección 4.4, 4.8 y 5.2).
Pacientes con insuficiencia hepática
No se ha estudiado la seguridad y la eficacia de denosumab en pacientes con insuficiencia hepática (ver sección 5.2).
Pacientes de edad avanzada (edad > 65)
No se requieren ajustes de dosis en pacientes de edad avanzada (ver sección 5.2).
Población pediátrica
La seguridad y la eficacia de XGEVA no se ha establecido en pacientes pediátricos (edad < 18) excepto en adolescentes con el esqueleto maduro con tumor de células gigantes de hueso.
XGEVA no está recomendado en pacientes pediátricos (edad < 18) excepto en aquellos adolescentes con el esqueleto maduro con tumor de células gigantes de hueso (ver sección 4.4).
El tratamiento en adolescentes con el esqueleto maduro con tumor de células gigantes de hueso no resecable o cuando la resección quirúrgica implique morbilidad grave: la posología es la misma que en los adultos.
La inhibición del RANK/ligando del RANK (RANKL) en estudios con animales se ha asociado con la inhibición del crecimiento óseo y con la falta de aparición de la dentición, y estos cambios fueron parcialmente reversibles al suspender la inhibición del RANKL (ver sección 5.3).
Forma de administración Vía subcutánea.
Para consultar las instrucciones de uso, manipulación y eliminación, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Hipocalcemia grave sin tratar (ver sección 4.4).
Lesiones no curadas debido a una cirugía dental o bucal.
4.4 Advertencias y precauciones especiales de empleo
Suplementos de calcio y vitamina D
Todos los pacientes deben recibir suplementos de calcio y vitamina D, a no ser que presenten hipercalcemia (ver sección 4.2).
Hipocalcemia
La hipocalcemia preexistente debe corregirse antes de iniciar el tratamiento con XGEVA. La hipocalcemia puede aparecer en cualquier momento durante el tratamiento con XGEVA. Se debe monitorizar los niveles de calcio (i) antes de administrar la dosis inicial de XGEVA, (ii) dentro de las dos semanas siguientes tras la administración de la dosis inicial, (iii) en caso de sospecha de aparición de síntomas de hipocalcemia (consultar los síntomas en la sección 4.8). Se debe considerar una monitorización adicional de los niveles de calcio en pacientes con alto riesgo de hipocalcemia, o si por el contrario está indicado en base a la condición clínica del paciente.
Se debe animar a los pacientes a notificar los síntomas indicativos de hipocalcemia. Si se produce hipocalcemia durante el tratamiento con XGEVA, puede ser necesario un suplemento de calcio adicional y una monitorización adicional.
La hipocalcemia sintomática grave ha sido notificada en el ámbito poscomercialización (incluyendo casos con desenlace mortal) (ver sección 4.8), que ocurrieron en la mayoría de los casos en las primeras semanas de iniciar el tratamiento, aunque podría ocurrir posteriormente.
Insuficiencia renal
Los pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) o en diálisis presentan un mayor riesgo de desarrollar hipocalcemia. El riesgo de desarrollar hipocalcemia y elevaciones asociadas de hormona paratiroidea aumenta a medida que aumenta el grado de insuficiencia renal. El control regular de los niveles de calcio en estos pacientes es especialmente importante.
Osteonecrosis mandibular (ONM)
Se han notificado de forma frecuente casos de ONM en pacientes que reciben XGEVA (ver sección 4.8).
El inicio del tratamiento/nuevo periodo de tratamiento se debe retrasar en los pacientes que presenten lesiones no curadas y abiertas en el tejido blando de la boca. Se recomienda la realización de una revisión dental con un tratamiento odontológico preventivo y una evaluación individual del beneficio-riesgo antes de iniciar el tratamiento con XGEVA.
Cuando se evalúe el riesgo de un paciente de desarrollar ONM se deben considerar los siguientes factores de riesgo:
• potencia del medicamento que inhibe la resorción ósea (mayor riesgo para los compuestos muy potentes), vía de administración (mayor riesgo para la administración parenteral) y dosis acumulativa de tratamiento de resorción ósea.
• cáncer, comorbilidades (p. ej. anemia, coagulopatías, infección), fumar.
• tratamientos concomitantes: corticosteroides, quimioterapia, inhibidores de la angiogénesis, radioterapia de cabeza y cuello.
• higiene bucal deficiente, enfermedad periodontal, prótesis dentales mal ajustadas, enfermedad dental preexistente, procedimientos dentales invasivos, p. ej. extracciones dentales.
Se debe animar a todos los pacientes a mantener una buena higiene bucal, a someterse a revisiones dentales rutinarias y a notificar inmediatamente cualquier síntoma oral, como movilidad dental, dolor o inflamación, o úlceras que no se curan o que supuran durante el tratamiento con XGEVA. Mientras se esté en tratamiento, los procedimientos dentales invasivos se deben realizar únicamente después de considerarse detenidamente y se deben evitar en periodos cercanos a la administración de XGEVA.
Se debe establecer el plan de manejo de los pacientes que desarrollen ONM en estrecha colaboración entre el médico que le trata y un dentista o cirujano maxilofacial con experiencia en ONM. Se debe considerar la interrupción temporal del tratamiento con XGEVA hasta que la situación se resuelva y se mitiguen, en la medida de lo posible, los factores de riesgo contribuyentes.
Fracturas atípicas de fémur
Se han notificado casos de fracturas atípicas de fémur en pacientes tratados con XGEVA (ver sección 4.8). Las fracturas atípicas de fémur pueden ocurrir sin trauma o con trauma leve en la región subtrocantérea y diafisaria del fémur. Estos eventos se identifican mediante hallazgos radiográficos específicos. Las fracturas atípicas de fémur también se han notificado en pacientes que presentan ciertas comorbilidades (p. ej. deficiencia de vitamina D, artritis reumatoide, hipofosfatasia) y con el uso de ciertos fármacos (p. ej. bisfosfonatos, glucocorticoides, inhibidores de la bomba de protones). Estos eventos también han ocurrido sin tratamiento con terapia antirresortiva. Las fracturas similares notificadas en asociación con bisfosfonatos son a menudo bilaterales; por lo tanto se debe examinar el fémur contralateral en los pacientes tratados con denosumab que hayan sufrido una fractura de la diáfisis del fémur. Se debe considerar la interrupción del tratamiento con XGEVA en los pacientes con sospecha de fractura atípica de fémur hasta la evaluación del paciente en base a una evaluación individual del beneficio riesgo. Se debe aconsejar a los pacientes que si experimentan un dolor reciente o inusual en muslo, cadera o ingle durante el tratamiento con XGEVA lo notifiquen. Los pacientes que presenten estos síntomas se deben evaluar para descartar una fractura femoral incompleta.
Pacientes con esqueleto en crecimiento
XGEVA no está recomendado en pacientes con esqueleto en crecimiento (ver sección 4.2). Se han notificado casos clínicamente relevantes de hipercalcemia semanas o meses posteriores al cese del tratamiento en pacientes con esqueleto en crecimiento que habían sido tratados con XGEVA.
Otras
Los pacientes tratados con XGEVA no deben ser tratados concomitantemente con otros medicamentos que contengan denosumab (para indicaciones en osteoporosis).
Los pacientes tratados con XGEVA no deberían ser tratados concomitantemente con bisfosfonatos.
La neoplasia maligna del Tumor de Células Gigantes de Hueso o la progresión de la enfermedad metastásica es un evento infrecuente y un riesgo conocido en pacientes con Tumor de Células Gigantes de Hueso. Los pacientes se deben monitorizar para detectar signos radiológicos de malignidad, nueva radiolucencia u osteolisis. Los datos clínicos disponibles no sugieren un mayor riesgo de neoplasia maligna en pacientes con TCG tratados con XGEVA.
Advertencias sobre los excipientes
XGEVA contiene sorbitol. Los pacientes con problemas hereditarios raros de intolerancia a la fructosa no deben utilizar XGEVA.
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por 120 mg, por lo que se considera esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
En los ensayos clínicos, XGEVA se ha administrado en combinación con un tratamiento antineoplásico estándar y en sujetos que previamente recibieron bisfosfonatos. No hubo alteraciones clínicamente relevantes en la concentración sérica ni en la farmacodinamia de denosumab (telopéptido N urinario ajustado a la creatinina, uNTx/Cr) con la quimioterapia concomitante y/o terapia hormonal o con la exposición previa a bisfosfonatos por vía intravenosa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos adecuados sobre el uso de XGEVA en mujeres embarazadas. En un estudio en macacos, que recibieron dosis de denosumab durante el embarazo con exposiciones de AUC 12 veces superiores a la dosis humana, se ha mostrado toxicidad para la reproducción (ver sección 5.3).
No está recomendado el uso de XGEVA en mujeres embarazadas ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos altamente efectivos. Se debe recomendar a las mujeres no quedarse embarazadas durante el tratamiento con XGEVA y al menos 5 meses después. Cualquier efecto de XGEVA es probable que sea mayor durante el segundo y tercer trimestre del embarazo ya que los anticuerpos monoclonales son transportados a través de la placenta de forma lineal mientras el embarazo progresa, con la mayor cantidad transferida durante el tercer trimestre.
Se anima a las mujeres que queden embarazadas durante el tratamiento con XGEVA a inscribirse en el programa de Supervisión del Embarazo de Amgen. Los datos de contacto figuran en la sección 6 del prospecto.
Lactancia
Se desconoce si denosumab se excreta en la leche materna. Los estudios en ratones knockout indican que la ausencia del RANKL durante el embarazo puede interferir en la maduración de las glándulas mamarias alterando la lactancia posparto (ver sección 5.3). La decisión de no amamantar o no seguir el tratamiento con XGEVA debe tomarse teniendo en cuenta las ventajas de la lactancia para el recién nacido/lactante y las ventajas del tratamiento con XGEVA para la mujer.
Se anima a las mujeres que estén en periodo de lactancia durante el tratamiento con XGEVA a inscribirse en el programa de Supervisión de la Lactancia de Amgen. Los datos de contacto figuran en la sección 6 del prospecto.
Fertilidad
No hay datos disponibles del efecto de denosumab sobre la fertilidad humana. Los estudios en animales no evidencian efectos perjudiciales directos o indirectos relativos a la fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de XGEVA sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
El perfil general de seguridad es consistente en todas las indicaciones aprobadas.
Se han notificado casos de hipocalcemia de manera frecuente tras la administración de XGEVA, mayoritariamente dentro de las 2 primeras semanas. La hipocalcemia puede ser grave y sintomática (ver sección 4.8 - descripción de las reacciones adversas seleccionadas). Las disminuciones de los niveles de calcio sérico generalmente se trataron de forma adecuada mediante el suplemento de calcio y vitamina D. Las reacciones adversas más frecuentes con XGEVA son los dolores musculoesqueléticos.
La seguridad de XGEVA se evaluó en:
• 5.931 pacientes con neoplasias avanzadas con afectación ósea en ensayos clínicos con control activo que examinaron la eficacia y la seguridad de XGEVA en comparación con ácido zoledrónico en la prevención de la aparición de eventos relacionados con el esqueleto.
• 523 pacientes con tumor de células gigantes de hueso en ensayos clínicos de un solo brazo, que examinaban la eficacia y la seguridad de XGEVA.
Las reacciones adversas identificadas en estos ensayos clínicos y de la experiencia poscomercialización se presentan en la tabla 1.
Tabla de reacciones adversas
Para clasificar las reacciones adversas basadas en la tasa de incidencia de tres estudios clínicos de fase III y dos de fase II, se utilizó la convención siguiente (consulte la tabla 1): muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000) y muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia y clasificación de órganos.
Tabla 1 Reacciones adversas notificadas en pacientes con neoplasias avanzadas con afectación ósea o tumor de células gigantes^ de hueso__
|
Clasificación de órganos del sistema MedDRA |
Categoría de frecuencia |
Reacciones adversas |
|
Trastorno del sistema inmunológico |
Raras |
Hipersensibilidad al medicamento1 |
|
Raras |
Reacción anafiláctica1 | |
|
Trastornos del metabolismo y de la nutrición |
Frecuentes |
Hipocalcemia1,2 |
|
Frecuentes |
Hipofosfatemia | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Muy frecuentes |
Disnea |
|
Trastornos gastrointestinales |
Muy frecuentes |
Diarrea |
|
Frecuentes |
Extracción dental | |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes |
Hiperhidrosis |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Muy frecuentes |
Dolor musculoesquelético1 |
|
Frecuente |
Osteonecrosis mandibular1 | |
|
Raras |
Fractura atípica de fémur1 |
1 Ver sección Descripción de las reacciones adversas seleccionadas
2 Ver sección otras poblaciones especiales
Descripción de las reacciones adversas seleccionadas
Hipocalcemia
En tres ensayos clínicos de fase III con control activo en pacientes con neoplasias avanzadas con afectación ósea, se notificó hipocalcemia en el 9,6% de los pacientes tratados con XGEVA y en el 5,0% de los pacientes tratados con ácido zoledrónico.
El 2,5% de los pacientes tratados con XGEVA y el 1,2% de los pacientes tratados con ácido zoledrónico experimentaron una disminución de grado 3 de las concentraciones séricas de calcio. El 0,6% de los pacientes tratados con XGEVA y el 0,2% de los pacientes tratados con ácido zoledrónico experimentaron una disminución de grado 4 de las concentraciones séricas de calcio (ver sección 4.4).
En dos ensayos clínicos de fase II de un solo brazo en pacientes con tumor de células gigantes de hueso, se notificó hipocalcemia en un 5,7% de los pacientes. Ninguno de los acontecimientos adversos se consideró grave.
La hipocalcemia sintomática grave ha sido notificada en el ámbito poscomercialización (incluyendo casos con desenlace mortal), que ocurrieron, en la mayoría de los casos, a las primeras semanas de iniciar el tratamiento. Ejemplos de manifestaciones clínicas de hipocalcemia sintomática grave incluyeron prolongación del intervalo QT, tetania, convulsiones y estado mental alterado (incluyendo coma) (ver sección 4.4). Los síntomas de hipocalcemia en ensayos clínicos incluyeron parestesias o agarrotamiento muscular, contracciones, espasmos y calambres musculares.
Osteonecrosis mandibular (ONM)
En los ensayos clínicos, la incidencia de ONM fue más alta con una duración más prolongada de exposición; la ONM ha sido también diagnosticada después de interrumpir el tratamiento con XGEVA, ocurriendo la mayoría de los casos dentro de los 5 meses después de la última dosis. Se excluyeron de los ensayos clínicos pacientes con un historial previo de ONM u osteomielitis de la mandíbula, patología dental o mandibular activa que requiere una cirugía maxilofacial, cirugía dental/oral no curada, o cualquier procedimiento dental invasivo planeado.
En las fases de tratamiento primario de tres ensayos clínicos de fase III con control activo en pacientes con neoplasias avanzadas con afectación ósea, se confirmó ONM en el 1,8% de los pacientes tratados con XGEVA (mediana de exposición de 12,0 meses; rango 0,1 - 40,5) y en el 1,3% de los pacientes tratados con ácido zoledrónico. Las características clínicas de estos casos fueron similares entre los grupos de tratamiento. La mayoría de los sujetos con ONM confirmada (81% en ambos grupos de tratamiento) tenían antecedentes de extracciones dentales, higiene bucal deficiente y/o uso de implantes dentales. La mayoría de los sujetos estaban recibiendo o habían recibido quimioterapia.
Los ensayos en pacientes con cáncer de mama o de próstata incluyeron una fase de extensión de tratamiento con XGEVA (mediana de exposición global de 14,9 meses, rango 0,1 - 67,2). Se confirmó ONM en un 6,9% de pacientes con cáncer de mama y próstata durante la extensión de la fase de tratamiento.
La incidencia global ajustada por paciente-año de ONM confirmada fue del 1,1% durante el primer año de tratamiento, 3,7% en el segundo año y del 4,6% por año, a partir de entonces. La mediana de tiempo hasta ONM fue de 20,6 meses (rango: 4 - 53).
En dos ensayos clínicos de fase II de un solo brazo en pacientes con tumor de células gigantes de hueso, la ONM ocurrió en un 2,3% (12 de 523) de pacientes tratados con XGEVA (exposición global mediana de 20,3 meses; rango: 0 - 83,4). La incidencia ajustada por paciente-año de ONM fue de 0,2% durante el primer año de tratamiento y 1,7% en el segundo año. La mediana de tiempo hasta la ONM fue de 19,4 meses (rango: 11 - 40). En base a la duración de la exposición, no hay datos suficientes en pacientes con TCG para valorar el riesgo de ONM más allá de 2 años.
En un estudio de fase III en pacientes con cáncer de próstata no metastásico (una población de pacientes para la cual XGEVA no está indicado), con una exposición más larga al tratamiento de hasta 7 años, la incidencia ajustada por paciente-año de ONM confirmada fue del 1,1% durante el primer año de tratamiento, 3,0% en el segundo año y del 7,1% por año, a partir de entonces.
Reacciones de hipersensibilidad relacionadas con el medicamento
En la experiencia poscomercialización, se han notificado eventos de hipersensibilidad, incluyendo en raras ocasiones reacciones anafilácticas, en pacientes que recibían XGEVA.
Fracturas atípicas de fémur
En el programa del ensayo clínico, rara vez se notificaron fracturas atípicas de fémur en pacientes tratados con denosumab (ver sección 4.4).
Dolor musculoesquelético
En pacientes que recibían XGEVA en el ámbito poscomercialización, se han notificado casos de dolor musculoesquelético, incluyendo casos graves. En los ensayos clínicos, el dolor musculoesquelético fue muy frecuente tanto en el grupo de denosumab como en el grupo de ácido zoledrónico. El dolor musculoesquelético que provocara la suspensión del tratamiento fue poco frecuente.
Población pediátrica
XGEVA se estudió en un ensayo clínico abierto que reclutó a 18 adolescentes con el esqueleto maduro con tumor de células gigantes de hueso. En base a estos datos limitados, el perfil de los acontecimientos adversos parece similar al de los adultos.
Otras poblaciones especiales
Insuficiencia renal
En un ensayo clínico de pacientes sin cáncer avanzado con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) o en diálisis, hubo un riesgo mayor de desarrollar hipocalcemia a falta de administración de suplementos de calcio. El riesgo de desarrollar hipocalcemia durante el tratamiento de XGEVA es mayor a medida que aumenta el grado de insuficiencia renal. En un ensayo clínico en pacientes sin cáncer avanzado, el 19% de los pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min) y un 63% de pacientes en diálisis, desarrollaron hipocalcemia a pesar de tomar suplementos de calcio. La incidencia global de hipocalcemia clínicamente relevante fue de 9%.
En pacientes que recibían XGEVA con insuficiencia renal grave o en diálisis también se ha observado aumento de la hormona paratiroidea. La monitorización de los niveles de calcio y una adecuada ingesta de calcio y vitamina D es especialmente importante en pacientes con insuficiencia renal (ver sección 4.4).
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Anexo V.
4.9 Sobredosis
No hay experiencia de sobredosis en los ensayos clínicos. XGEVA se ha administrado en estudios clínicos utilizando dosis de hasta 180 mg cada 4 semanas y 120 mg cada semana durante 3 semanas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos para el tratamiento de enfermedades óseas - Otros fármacos que afectan la estructura ósea y la mineralización, código ATC: M05BX04
Mecanismo de acción
El RANKL se expresa como una proteína soluble o transmembrana. El RANKL es esencial para la formación, función y supervivencia de los osteoclastos, el único tipo de célula responsable de la resorción ósea. El aumento de la actividad osteoclástica, estimulada por el RANKL, es un mediador clave de la destrucción ósea en la enfermedad ósea metastásica y mieloma múltiple. Denosumab es un anticuerpo monoclonal humano (IgG2) que se dirige y se une con gran afinidad y especificidad al RANKL, lo que impide que la interacción del RANKL/RANK se produzca y provoca la reducción del número y la función de los osteoclastos, lo que disminuye la resorción ósea y la destrucción ósea inducida por el cáncer.
Los tumores de células gigantes de hueso se caracterizan por la expresión del ligando del RANK por células neoplásicas del estroma y por la expresión del RANK por células gigantes osteoclastos. En pacientes con tumor de células gigantes de hueso, denosumab se une al ligando del RANK, reduciendo significativamente o eliminando las células gigantes osteoclastos. Consecuentemente, la osteolisis se reduce y el estroma del tumor proliferativo se remplaza por no proliferativo, diferenciándose un tejido denso en el nuevo hueso.
Efectos farmacodinámicos
En ensayos clínicos de fase II realizados en pacientes con neoplasias avanzadas con afectación ósea, las dosis subcutáneas (SC) de XGEVA administradas o cada 4 semanas o cada 12 semanas produjeron una rápida reducción de los marcadores de resorción ósea (uNTx/Cr, CTx sérico), con reducciones medianas de uNTx/Cr de aproximadamente el 80% producidas en el plazo de 1 semana, independientemente del tratamiento previo con bisfosfonatos o el valor basal de uNTx/Cr. En los ensayos clínicos de fase III, las reducciones medianas de uNTx/Cr de aproximadamente el 80% se mantuvieron después de 3 meses de tratamiento en 2.075 pacientes con cáncer avanzado tratados con XGEVA que nunca habían sido tratados con bisfosfonatos por vía I.V.
Inmunogenicidad
En los ensayos clínicos no se han observado anticuerpos neutralizantes contra XGEVA. Utilizando un inmunoanálisis sensible, < 1% de los pacientes tratados con denosumab durante un máximo de hasta 3 años dieron un resultado positivo para anticuerpos de unión no neutralizantes sin indicios de alteración de la farmacocinética, de la toxicidad o de la respuesta clínica.
Eficacia clínica en pacientes con metástasis óseas de tumores sólidos
La eficacia y la seguridad de 120 mg de XGEVA por vía SC cada 4 semanas o 4 mg de ácido zoledrónico (dosis ajustada a la función renal reducida) por vía I.V. cada 4 semanas se compararon en tres ensayos aleatorizados, a doble ciego y con control activo en pacientes con neoplasias avanzadas con afectación ósea que nunca habían sido tratados con bisfosfonatos por vía I.V.: adultos con cáncer de mama (ensayo 1), otros tumores sólidos o mieloma múltiple (ensayo 2) y cáncer de próstata resistente a la castración (ensayo 3). Los pacientes con antecedentes de ONM u osteomielitis de la mandíbula, patología dental o mandibular activa que requería cirugía maxilofacial, cirugía dental u oral sin cicatrizar o un procedimiento dental invasivo previsto no se eligieron para ser incluidos en estos ensayos. Las variables primarias y secundarias evaluaron la aparición de uno o más eventos relacionados con el esqueleto (ERE). En estudios que demuestran la superioridad de XGEVA frente a ácido zoledrónico, se ofreció a los pacientes participar en un ensayo abierto de XGEVA con fase de extensión de tratamiento preestablecido de 2 años.
XGEVA redujo el riesgo de desarrollar uno o varios ERE (primero y posteriores) en pacientes con metástasis óseas de tumores sólidos (consulte la tabla 2).
Tabla 2: Resultados de eficacia en pacientes con neoplasias avanzadas con afectación ósea
|
Ensayo 1 cáncer de mama |
Ensayo 2 otros tumores sólidos** o mieloma múltiple |
Ensayo 3 cáncer de próstata |
Cáncer avanzado combinado | |||||
|
XGEVA |
ácido zoledrónico |
XGEVA |
ácido zoledrónico |
XGEVA |
ácido zoledrónico |
XGEVA |
ácido zoledrónico | |
|
N |
1.026 |
1.020 |
886 |
890 |
950 |
951 |
2.862 |
2.861 |
|
Primer ERE | ||||||||
|
Mediana de tiempo (meses) |
NA |
26,4 |
20,6 |
16,3 |
20,7 |
17,1 |
27,6 |
19,4 |
|
Diferencia en la mediana de tiempo (meses) |
ND |
4,2 |
3,5 |
8,2 | ||||
|
HR (IC del 95%) / RRR (%) |
0,82 (0,71- 0,95) / 18 |
0,84 (0,71- 0,98) / 16 |
0,82 (0,71- 0,95) / 18 |
0,83 (0,76- 0,90) / 17 | ||||
|
Valores p de no inferioridad / superioridad |
< 0,000E / 0,0101t |
0,00071 / 0,06191 |
0,00021 / 0,00851 |
< 0,0001 / < 0,0001 | ||||
|
Proporción de sujetos (%) |
30,7 |
36,5 |
31,4 |
36,3 |
35,9 |
40,6 |
32,6 |
37,8 |
|
Ensayo 1 cáncer de mama |
Ensayo 2 otros tumores sólidos** o mieloma múltiple |
Ensayo 3 cáncer de próstata |
Cáncer avanzado combinado | |||||
|
XGEVA |
ácido zoledrónico |
XGEVA |
ácido zoledrónico |
XGEVA |
ácido zoledrónico |
XGEVA |
ácido zoledrónico | |
|
Primer y posteriores ERE* | ||||||||
|
Número medio/paciente |
0,46 |
0,60 |
0,44 |
0,49 |
0,52 |
0,61 |
0,48 |
0,57 |
|
Razón de tasas (IC del 95%) / RRR (%) |
0,77 (0,66- 0,89) / 23 |
0,90 (0,77- 1,04) / 10 |
0,82 (0,71- 0,94) / 18 |
0,82 (0,75- 0,89) / 18 | ||||
|
Valor p de superioridad |
0,0012t |
0,1447t |
0,0085t |
< 0,0001 | ||||
|
SMR por año |
0,45 |
0,58 |
0,86 |
1,04 |
0,79 |
0,83 |
0,69 |
0,81 |
|
Primer ERE o HCM | ||||||||
|
Mediana de tiempo (meses) |
NA |
25,2 |
19,0 |
14,4 |
20,3 |
17,1 |
26,6 |
19,4 |
|
HR (IC del 95%) / RRR (%) |
0,82 (0,70- 0,95) / 18 |
0,83 (0,71- 0,97) / 17 |
0,83 (0,72- 0,96) / 17 |
0,83 (0,76- 0,90) / 17 | ||||
|
Valor p de superioridad |
0,0074 |
0,0215 |
0,0134 |
< 0,0001 | ||||
|
Primera radioterapia ósea | ||||||||
|
Mediana de tiempo (meses) |
NA |
NA |
NA |
NA |
NA |
28,6 |
NA |
33,2 |
|
HR (IC del 95%) / RRR (%) |
0,74 (0,59- 0,94) / 26 |
0,78 (0,63- 0,97) / 22 |
0,78 (0,66- 0,94) / 22 |
0,77 (0,69- 0,87) / 23 | ||||
|
Valor p de superioridad |
0,0121 |
0,0256 |
0,0071 |
< 0,0001 | ||||
NA = no alcanzado; ND = no disponible; HCM = hipercalcemia tumoral; SMR = tasa de morbilidad esquelética; HR = hazard ratio; RRR = reducción del riesgo relativo f Se presentan valores p ajustados para los estudios 1, 2 y 3 (variables del primer ERE y del primer y posteriores ERE); * Abarca todos los eventos esqueléticos a lo largo del tiempo; sólo se tienen en cuenta los eventos ocurridos > 21 días después del evento previo.
** Incluidos el CPNM, el cáncer de células renales, el cáncer colorrectal, el cáncer de pulmón microcítico, el cáncer de vejiga, el cáncer de cabeza y cuello, el cáncer genitourinario/GI y otros, excepto el cáncer de próstata y de mama
Figura 1. Gráficos de Kaplan-Meier del tiempo hasta el primer ERE durante el estudio
ZA: 4 mg de ácido zoledrónico Q4W Dmab: 120 mg de denosumab Q4W
Ensayo 1* Ensayo 2** Ensay3 3*
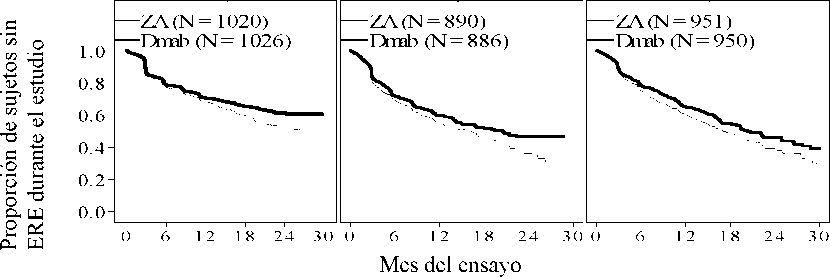
N = Número total de sujetos aleatorizados
*= superioridad estadísticamente significativa; **= no inferioridad estadísticamente significativa
Progres ión de la enfermedad y supervivencia global
La progresión de la enfermedad fue similar entre los grupos de XGEVA y ácido zoledrónico en los tres ensayos y en el análisis preespecificado de los tres ensayos combinados.
En los tres estudios, la supervivencia global estuvo equilibrada entre los grupos de XGEVA y ácido zoledrónico en pacientes con neoplasias avanzadas con afectación ósea: pacientes con cáncer de mama (hazard ratio e IC del 95% fue de 0,95 [0,81- 1,11]), pacientes con cáncer de próstata (hazard ratio e IC del 95% fue de 1,03 [0,91- 1,17]) y pacientes con otros tumores sólidos o mieloma múltiple (hazard ratio e IC del 95% fue de 0,95 [0,83- 1,08]). En un análisis post-hoc del ensayo 2 (pacientes con otros tumores sólidos o mieloma múltiple) se examinó la supervivencia global en los 3 tipos de tumores utilizados para la estratificación (cáncer de pulmón no microcítico, mieloma múltiple y otros). La supervivencia global fue mayor para XGEVA en el cáncer de pulmón no microcítico (hazard ratio [IC del 95%] de 0,79 [0,65- 0,95]; n = 702), mayor para el ácido zoledrónico en el mieloma múltiple (hazard ratio [IC del 95%] de 2,26 [1,13- 4,50]; n = 180) y similar entre los grupos de XGEVA y ácido zoledrónico en otros tipos de tumores (hazard ratio [IC del 95%] de 1,08 [0,90- 1,30]; n = 894). En este ensayo no se controlaron los factores de pronóstico ni los tratamientos antineoplásicos. En un análisis preespecificado combinado de los ensayos 1, 2 y 3, la supervivencia global fue similar entre los grupos de XGEVA y ácido zoledrónico (hazard ratio e IC del 95%: 0,99 [0,91- 1,07]).
Efecto sobre el dolor
El tiempo hasta la mejora del dolor (es decir, disminución > 2 puntos respecto al nivel basal en la puntuación del peor dolor de BPI-SF) fue similar para denosumab y ácido zoledrónico en cada ensayo y en los análisis integrados. En un análisis post-hoc del conjunto de datos combinados, la mediana de tiempo hasta el empeoramiento del dolor (> 4 puntos en la puntuación del peor dolor), en pacientes con dolor leve o sin dolor a nivel basal, se retrasó con XGEVA en comparación con ácido zoledrónico (198 frente a 143 días) (p = 0,0002).
Eficacia clínica en adultos y en adolescentes con el esqueleto maduro con tumor de células gigantes de hueso
La seguridad y eficacia de XGEVA se estudió en dos ensayos de fase II abiertos, de un solo brazo (estudios 4 y 5), que reclutaron a 529 pacientes con tumor de células gigantes de hueso tanto no resecable como pacientes en los que la cirugía se asociaba a una morbilidad grave.
El estudio 4 reclutó a 37 pacientes adultos con histología confirmada de tumor de células gigantes de hueso no resecable o recurrente. El criterio de respuesta incluyó la eliminación de células gigantes basadas en histopatología o ausencia de progresión por radiografía.
De los 35 pacientes incluidos en el análisis de eficacia, 85,7% (IC del 95%: 69,7; 95,2) obtuvieron una respuesta al tratamiento de XGEVA. Los 20 pacientes (100%) con valoraciones histológicas respondieron. De los 15 pacientes restantes, las evaluaciones por radiografía de 10 (67%) no mostraron progresión de la lesión diana.
El estudio 5 reclutó 507 adultos o adolescentes con el esqueleto maduro con tumor de células gigantes de hueso y evidencia de enfermedad activa medible.
En la Cohorte 1 (pacientes con enfermedad quirúrgicamente insalvable), no se alcanzó la mediana de tiempo hasta la progresión de la enfermedad, 21 de los 258 pacientes tuvieron progresión de la enfermedad. En la Cohorte 2 (pacientes con enfermedad quirúrgicamente salvable cuya cirugía planeada estaba asociada a morbilidad grave), 209 de los 228 pacientes evaluables tratados con XGEVA no se sometieron a una cirugía hasta los 6 meses. De un total de 225 pacientes en los que se había planeado la cirugía de tumor de células gigantes de hueso (excluyendo únicamente metástasis de pulmón), a 109 no se les realizó cirugía y en 84 la cirugía implicó menor morbilidad que el procedimiento planeado al inicio. La mediana de tiempo hasta la cirugía fue 261 días.
Después del reclutamiento de 305 pacientes en los estudios 4 y 5, se realizó una revisión independiente retrospectiva de datos de imagen radiográfica. Ciento noventa tuvieron al menos 1 una respuesta evaluable y se incluyeron en el análisis (tabla 3). En general, XGEVA alcanzó el objetivo de respuesta tumoral en 71,6% (IC del 95% 64,6; 77,9) de los pacientes (tabla 3) evaluada por cualquier modalidad, con la mayoría de respuestas definidas por una reducción de actividad PET fluorodeoxiglucosa o aumento de la densidad medida en TC/HU, sólo un 25,1% de los pacientes tenían una respuesta por RECIST. La mediana de tiempo hasta la respuesta fue de 3,1 meses (IC del 95% 2,89; 3,65). La duración de la mediana de respuesta no se puede estimar (cuatro pacientes presentaron progresión de enfermedad tras una respuesta objetiva). En 190 sujetos evaluables para respuesta tumoral objetiva 55 sujetos tuvieron cirugía de TCGH, de los cuales, 40 sujetos presentaron una resección completa.
Tabla 3: Respuesta objetiva de tratamiento en pacientes con tumor de células gigantes de hueso
|
Número de pacientes evaluables por respuesta |
Número de pacientes con una respuesta objetiva |
Proporción (%) (IC del 95%) 1 | |
|
En base a la mejor respuesta |
190 |
136 |
71,6(64,6; 77,9) |
|
RECIST 1.12 |
187 |
47 |
25,1(19,1; 32,0) |
|
EORTC3 |
26 |
25 |
96,2(80,4; 99,9) |
|
Densidad/tamaño4 |
176 |
134 |
76,1(69,1; 82,2) |
1 IC = Intervalo de Confianza Exacto
2 RECIST 1.1: Criterio de Evaluación de respuesta modificada en tumores sólidos para evaluar la carga de tumor en base a la tomografía computerizada (TC)/Resonancia magnética de imagen (RMI)
3 EORTC: Criterio de la Organización Europea para la investigación y el tratamiento del cáncer para evaluar la respuesta metabólica, utilizando tomografía de emisión positrón fluorodeoxiglucosa (FDG-PET)
4 Densidad/tamaño: Criterios Inverse Choi modificada para evaluar el tamaño del tumor y la densidad utilizando unidades Hounsfield basado en TC/RMI.
Efecto sobre el dolor
Después del reclutamiento de 282 pacientes, en el estudio 5, cohortes 1 y 2 combinadas, se notificó una reducción clínicamente significativa del peor dolor (es decir, disminución > 2 puntos respecto al nivel basal) para 31,4% de pacientes en riesgo (es decir, aquellos que tenían una puntuación del peor dolor > 2 al nivel basal) en 1 semana de tratamiento, y > 50% a la semana 5. Estas mejoras del dolor se mantuvieron en las evaluaciones siguientes. El uso de analgésicos antes del tratamiento basal en la cohorte 1 y en la cohorte 2 se califica en una escala de siete puntos, donde el 74,8% de los pacientes informó de no uso o uso esporádico de analgésicos (es decir, la puntuación de uso de analgésicos < 2) y el 25,2% de los pacientes utilizaba opioides fuertes (es decir, la puntuación de uso de analgésicos de 3 a 7).
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con XGEVA en los diferentes grupos de la población pediátrica en prevención de eventos relacionados con el esqueleto en pacientes con metástasis óseas y subgrupos de población pediátrica por debajo de 12 años en el tratamiento de tumor de células gigantes de hueso (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
En el estudio 5, XGEVA se evaluó en un subgrupo de 18 pacientes adolescentes (13-17 años) con tumor de células gigantes de hueso que habían alcanzado madurez esquelética definida por presentar al menos 1 hueso largo maduro (p ej., húmero con la placa de crecimiento epifisaria cerrada) y peso corporal > 45 kg. Se observó respuesta objetiva en cuatro de los seis pacientes adolescentes evaluados en un análisis interino del estudio 5. El informe de evaluación por los investigadores notificó que los 18 pacientes adolescentes tenían como mejor respuesta, la enfermedad estable o mejor (respuesta completa en 2 pacientes, respuesta parcial en 8 pacientes, y enfermedad estable en 8 pacientes). La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados finales de este estudio.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración SC, la biodisponibilidad fue del 62%.
Biotransformación
Denosumab está compuesto únicamente de aminoácidos e hidratos de carbono como las inmunoglobulinas naturales y es improbable que se elimine a través de mecanismos metabólicos hepáticos. Se prevé que su metabolismo y eliminación sigan las vías de aclaramiento de las inmunoglobulinas, que se degradan en pequeños péptidos y aminoácidos simples.
Eliminación
En sujetos con cáncer avanzado, que recibieron múltiples dosis de 120 mg cada 4 semanas, se observó una acumulación aproximadamente 2 veces mayor en las concentraciones séricas de denosumab y el estado de equilibrio se alcanzó al cabo de 6 meses, lo que coincide con una farmacocinética independiente del tiempo. En sujetos con tumor de células gigantes de hueso que recibieron 120 mg cada 4 semanas con dosis de carga en el día 8 y 15, los niveles de estado estacionario se alcanzaron en el primer mes de tratamiento. Entre las semanas 9 y 49, los niveles valle medianos variaron menos del 9%. En los sujetos que interrumpieron el tratamiento con 120 mg cada 4 semanas, la semivida media fue de 28 días (intervalo de 14 a 55 días).
Un análisis farmacocinético de la población no indicó cambios clínicamente significativos en la exposición sistémica de denosumab en estado de equilibrio en relación con la edad (de 18 a 87 años), la raza/etnia (negros, hispanos, asiáticos y caucásicos), el sexo o el tipo de tumor sólido. El aumento del peso corporal se asoció con disminuciones en la exposición sistémica y viceversa. Las alteraciones no se consideraron clínicamente relevantes, ya que los efectos farmacodinámicos basados en los marcadores de remodelado óseo fueron constantes en un amplio intervalo de pesos corporales.
Linealidad/No linealidad
Denosumab presentó una farmacocinética no lineal con una dosis superior respecto a una amplia gama de dosis, pero aumentos aproximadamente proporcionales a la dosis en exposiciones de dosis de 60 mg (o 1 mg/kg) y mayores. La no linealidad probablemente se debe a una vía importante de eliminación mediada por células diana saturables en concentraciones bajas.
Insuficiencia renal
En ensayos realizados con denosumab (60 mg, n = 55 y 120 mg, n = 32) en pacientes sin cáncer avanzado pero con distintos grados de función renal, incluidos los pacientes en diálisis, el grado de insuficiencia renal no tuvo ningún efecto sobre la farmacocinética de denosumab; en consecuencia no se requiere el ajuste de dosis para insuficiencia renal. No es necesario realizar una monitorización de la función renal con XGEVA.
Insuficiencia hepática
No se realizó ningún ensayo específico en pacientes con insuficiencia hepática. En general, los anticuerpos monoclonales no se eliminan por metabolismo hepático. No se espera que la insuficiencia hepática afecte a la farmacocinética de denosumab.
Pacientes de edad avanzada
No se han observado diferencias globales de seguridad o eficacia entre los pacientes de edad avanzada y los pacientes más jóvenes. Los ensayos clínicos controlados de XGEVA en pacientes mayores de 65 años con neoplasias avanzadas con afectación ósea revelaron una eficacia y una seguridad similares entre los pacientes mayores y los más jóvenes. No se requieren ajustes de dosis en pacientes de edad avanzada.
Población pediátrica
No se evaluó el perfil farmacocinético en poblaciones pediátricas.
5.3 Datos preclínicos sobre seguridad
Como la actividad biológica de denosumab en animales es específica de los primates no humanos, la evaluación de ratones manipulados genéticamente (knockout) o el uso de otros inhibidores biológicos de la vía RANK/RANKL, como OPG-Fc y RANK-Fc, se utilizaron para evaluar las propiedades farmacodinámicas de denosumab en modelos de roedores.
En modelos de ratones con metástasis óseas de cáncer de mama humano con receptores estrogénicos positivos y negativos, cáncer de próstata y cáncer de pulmón no microcítico, OPG-Fc redujo las lesiones osteolíticas, osteoblásticas y osteolíticas/osteoblásticas, retrasó la formación de metástasis óseas de novo y redujo el crecimiento tumoral esquelético. Cuando en estos modelos se combinó OPG-Fc con terapia hormonal (tamoxifeno) o quimioterapia (docetaxel), se produjo una inhibición aditiva del crecimiento tumoral esquelético en el cáncer de mama, próstata y pulmón, respectivamente. En un modelo de ratón con tumor mamario inducido, RANK-Fc redujo la proliferación epitelial mamaria inducida por hormonas y retrasó la formación de tumores.
No se han evaluado las pruebas estándar para investigar el potencial genotóxico de denosumab, ya que estas pruebas no son relevantes para esta molécula. Sin embargo, por su naturaleza, es poco probable que denosumab tenga potencial genotóxico.
El potencial carcinogénico de denosumab no se ha evaluado en estudios a largo plazo en animales.
En estudios de toxicidad con dosis únicas y repetidas en macacos, dosis de denosumab que provocaron una exposición sistémica de 2,7 hasta 15 veces mayor que la dosis recomendada en humanos no tuvieron impacto en la fisiología cardiovascular, la fertilidad masculina o femenina ni produjeron toxicidades en órganos diana específicos.
En un estudio en macacos que recibieron dosis de denosumab durante el periodo equivalente al primer trimestre de embarazo, las dosis de denosumab provocaron una exposición sistémica 9 veces mayor que la dosis recomendada en humanos, no indujo toxicidad materna ni daño fetal durante un período equivalente al primer trimestre, aunque los ganglios linfáticos fetales no se examinaron.
En otro estudio en macacos, que recibieron dosis de denosumab durante el embarazo, con exposiciones sistémicas de 12 veces superiores a la dosis en humanos, se observó un incremento de nacimientos de fetos muertos y de mortalidad postnatal; crecimiento anormal del hueso, que dio lugar a una resistencia ósea disminuida, reducción de la hematopoyesis, y mala alineación dental; ausencia de los ganglios linfáticos periféricos; y disminución de crecimiento del recién nacido. No se ha establecido una dosis sin efecto adverso en la reproducción. Tras un período de 6 meses después del nacimiento, los cambios relacionados con el hueso, mostraron recuperación y no hubo ningún efecto en la dentición. Sin embargo, los efectos en los ganglios linfáticos y la mala alineación dental persistieron, y en un animal se observó una mineralización de mínima a moderada en múltiples tejidos (relación incierta con el tratamiento). No hubo evidencia de daño materno antes del parto; efectos adversos maternos fueron poco frecuentes durante el parto. El desarrollo de la glándula mamaria materna fue normal.
En estudios preclínicos de calidad ósea realizados en monos tratados con denosumab a largo plazo, la disminución del remodelado óseo se asoció con la mejora de la resistencia ósea y de la histología ósea normal.
En ratones macho modificados genéticamente para expresar huRANKL (ratones con activación genética), sometidos a una fractura transcortical, denosumab retrasó la eliminación de cartílago y la remodelación del callo de la fractura en comparación con el grupo control, aunque no afectó negativamente a la fuerza biomecánica.
En estudios preclínicos, los ratones knockout sin RANK o RANKL presentaron ausencia de lactación debido a la inhibición de la maduración de las glándulas mamarias (desarrollo de la glándula lóbulo-alveolar durante el embarazo) y mostraron una alteración en la formación de los ganglios linfáticos. Los ratones recién nacidos con inactivación genética del RANK/RANKL presentaron una disminución del peso corporal, una reducción del crecimiento óseo, placas de crecimiento alteradas y ausencia de dentición. También se observó una reducción del crecimiento óseo, placas de crecimiento alteradas y ausencia de dentición en estudios de ratas recién nacidas tratadas con inhibidores del RANKL, y estos cambios fueron parcialmente reversibles al suspender la dosis de inhibidor del RANKL. En primates adolescentes que recibieron dosis de denosumab 2,7 y 15 veces (dosis de 10 y 50 mg/kg) se observaron placas de crecimiento anómalas en la exposición clínica. Por lo tanto, el tratamiento con denosumab puede alterar el crecimiento óseo en niños con placas de crecimiento abiertas e inhibir la dentición.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Ácido acético glacial*
Hidróxido sódico (para ajuste del pH)*
Sorbitol (E420)
Agua para preparaciones inyectables
* La solución tampón de acetato se forma mezclando ácido acético con hidróxido sódico
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Período de validez 3 años.
XGEVA puede conservarse a temperatura ambiente (hasta 25 °C) durante un máximo de 30 días en el envase original. Una vez fuera de la nevera, XGEVA debe utilizarse dentro de este plazo de 30 días.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
Conservar el vial en el embalaje exterior para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Solución de 1,7 ml en un vial de un solo uso (vidrio de tipo I) con tapón (elastomérico recubierto con fluoropolímero) y precinto (aluminio) con una cápsula de cierre del tipo flip-off.
El tamaño del envase es de uno, tres o cuatro viales.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La solución de XGEVA debe examinarse visualmente antes de su administración. La solución puede contener cantidades residuales de partículas proteicas de translúcidas a blancas. No inyecte la solución si está turbia o descolorida. No agitar excesivamente. Para evitar molestias en la zona de la administración, antes de inyectar, deje que el vial alcance la temperatura ambiente (hasta 25 °C) antes de inyectarla y realice la inyección lentamente. Inyecte todo el contenido del vial. Para la administración de denosumab se recomienda utilizar una aguja del calibre 27. No reinserte la aguja en el vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Amgen Europe B.V.
Minervum 7061 NL-4817 ZK Breda Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/703/001 EU/1/11/703/002 EU/1/11/703/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 13 julio 2011 Fecha de la última renovación:
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes del principio activo biológico
Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer Strasse 65 D-88397 Biberach an der Riss Alemania
Amgen Inc. (ATO)
One Amgen Center Drive, Thousand Oaks, CA 91320 Estados Unidos
Amgen Manufacturing Limited (AML)
State Road 31, Kilometer 24.6, Juncos, Puerto Rico 00777
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
Amgen Europe B.V.
Minervum 7061 NL-4817 ZK Breda Países Bajos
Amgen Technology Ireland (ADL)
Pottery Road Dun Laoghaire Co Dublin Irlanda
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN • Informes periódicos de seguridad
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo
acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de
Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Medidas adicionales de minimización de riesgos
El TAC asegurará la implementación de la tarjeta recordatorio para el paciente sobre
osetonecrosis mandibular.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA
1. NOMBRE DEL MEDICAMENTO
XGEVA 120 mg solución inyectable denosumab
2. PRINCIPIO ACTIVO
Cada vial contiene 120 mg de denosumab en 1,7 ml de solución (70 mg/ml).
3. LISTA DE EXCIPIENTES
Ácido acético glacial, hidróxido sódico, sorbitol (E420) y agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable.
1 vial de un solo uso.
3 viales de un solo uso
4 viales de un solo uso
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía subcutánea.
No agitar excesivamente.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. No congelar.
Conservar en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Amgen Europe B.V. Minervum 7061 NL-4817 ZK Breda Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/703/001 - 1 envase
EU/1/11/703/002 - 4 envase EU/1/11/703/003 - 3 envase
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xgeva
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
XGEVA 120 mg inyectable denosumab
SC
2. FORMA DE ADMINISTRACIÓN_
3. FECHA DE CADUCIDAD_
EXP
4. NÚMERO DE LOTE_
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES_
1,7 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el paciente
XGEVA 120 mg solución inyectable
denosumab
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
- Su médico le proporcionará una tarjeta recordatorio para el paciente, que contiene información importante de seguridad que debe conocer antes y durante su tratamiento con XGEVA.
Contenido del prospecto
1. Qué es XGEVA y para qué se utiliza
2. Qué necesita saber antes de empezar a usar XGEVA
3. Cómo usar XGEVA
4. Posibles efectos adversos
5. Conservación de XGEVA
6. Contenido del envase e información adicional
1. Qué es XGEVA y para qué se utiliza
XGEVA contiene denosumab, una proteína (anticuerpo monoclonal) que frena la destrucción ósea que se produce cuando el cáncer se disemina por los huesos (metástasis ósea) o por tumor de células gigantes de hueso.
XGEVA se utiliza en adultos con cáncer para prevenir las complicaciones graves causadas por las metástasis óseas (p. ej., fracturas, compresión en la médula espinal o la necesidad de recibir radioterapia o cirugía). XGEVA también se utiliza para tratamiento de tumor de células gigantes del hueso, que no se puede tratar con cirugía o cuando la cirugía no es la mejor opción, en adultos y adolescentes cuyos huesos han dejado de crecer.
2. Qué necesita saber antes de empezar a usar XGEVA No use XGEVA
- si es alérgico a denosumab o a cualquiera de los demás componentes de XGEVA.
Su profesional sanitario no le administrará XGEVA si tiene un nivel muy bajo de calcio en su sangre que no ha sido tratado.
Su profesional sanitario no le administrará XGEVA si tiene heridas sin cicatrizar producidas por cirugía dental o bucal.
Advertencias y precauciones
Suplementos de calcio y vitamina D
Debe tomar suplementos de calcio y vitamina D durante el tratamiento con XGEVA a no ser que sus niveles de calcio en sangre sean elevados. Su médico le explicará este aspecto. Si su nivel de calcio en sangre es bajo, puede que su médico decida recetarle suplementos de calcio antes de empezar el tratamiento con XGEVA.
Concentraciones bajas de calcio en sangre
Contacte inmediatamente con su médico si experimenta espasmos, tics o calambres en los músculos y/o entumecimiento u hormigueo en los dedos de las manos y de los pies o alrededor de la boca y/o convulsiones, confusión o pérdida del conocimiento durante el tratamiento con XGEVA. Es posible que su nivel de calcio en sangre sea bajo.
Informe a su médico si tiene o ha tenido problemas renales graves, insuficiencia renal o si ha necesitado someterse a diálisis, ya que esto puede aumentar el riesgo de bajada de la concentración de calcio en sangre, especialmente si no toma suplementos de calcio.
Problemas con la boca, los dientes y la mandíbula
Se ha comunicado de forma frecuente (puede afectar hasta 1 de cada 10 personas) un efecto adverso llamado osteonecrosis mandibular (daño en el hueso de la mandíbula) en pacientes que reciben XGEVA inyectable para las afecciones relacionadas con el cáncer. La osteonecrosis mandibular también puede ocurrir después de interrumpir el tratamiento.
Es importante intentar prevenir el desarrollo de la osteonecrosis mandibular ya que puede ser una afección dolorosa que puede ser difícil de tratar. Para reducir el riesgo de desarrollar osteonecrosis mandibular, debe tomar algunas precauciones.
Antes de recibir el tratamiento, informe a su médico o enfermero (profesional sanitario) si tiene algún problema con su boca o dientes. Su médico debe retrasar el inicio de su tratamiento en caso de que tenga heridas sin cicatrizar en su boca producidas por procedimientos dentales o cirugía bucal. Su médico le recomendará un examen dental antes de iniciar el tratamiento con XGEVA.
Mientras esté siendo tratado, debe mantener una buena higiene bucal y recibir revisiones dentales periódicas. Si usa prótesis dental, debe asegurarse de que ésta se ajusta adecuadamente.
Si está en tratamiento dental o se someterá a una cirugía dental (p. ej extracciones de dientes), informe a su médico sobre su tratamiento dental e informe a su dentista que está siendo tratado con XGEVA.
Contacte inmediatamente con su médico y dentista si presenta cualquier problema con la boca o los dientes, como dientes flojos, dolor o inflamación, úlceras que no curan o que supuran, ya que éstos podrían ser signos de osteonecrosis mandibular.
Pacientes sometidos a quimioterapia y /o radioterapia, tomando esteroides o medicamentos anti-angiogénicos (utilizados para tratar el cáncer), intervenidos por una cirugía dental, que no realicen revisiones dentales periódicas o tengan enfermedad en las encías, sean fumadores, podrían tener un riesgo mayor de desarrollar osteonecrosis mandibular.
Fracturas inusuales del hueso del muslo
Algunas personas han desarrollado fracturas inusuales del hueso del muslo durante el tratamiento con XGEVA. Contacte con su médico si presenta dolor reciente o inusual en la cadera, ingle o muslo.
Niños y adolescentes
XGEVA no está recomendado para niños y adolescentes menores de 18 años de edad excepto para adolescentes con tumor de células gigantes de hueso cuyos huesos han dejado de crecer. No se ha estudiado el uso de XGEVA en niños y adolescentes con otros tipos de cáncer que se han propagado a los huesos.
Uso de XGEVA con otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta. Es muy importante que informe a su médico si está siendo tratado con
• otro medicamento que contenga denosumab
• un bisfosfonato
No debería tomar XGEVA junto con otros medicamentos que contengan denosumab o bisfosfonatos. Embarazo y lactancia
XGEVA no se ha probado en mujeres embarazadas. Es importante que informe a su médico si está embarazada, cree que puede estarlo o planea quedarse embarazada. No se recomienda utilizar XGEVA durante el embarazo. Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento con XGEVA y al menos 5 meses después de interrumpir el tratamiento con XGEVA.
Si se queda embarazada durante el tratamiento con XGEVA o menos de 5 meses después de interrumpir el tratamiento con XGEVA, por favor, informe a su médico. Usted podría ser inscrita en un programa de Supervisión del Embarazo de Amgen. Los datos de contacto del representante local de Amgen figuran en la sección 6 del prospecto.
Se desconoce si XGEVA se excreta en la leche materna. Es importante que le comunique a su médico si está en período de lactancia o si planea estarlo. Su médico le ayudará a decidir sobre si debe abandonar la lactancia, o si debe dejar de usar XGEVA, teniendo en cuenta el beneficio de la lactancia materna para el niño y el beneficio de XGEVA para la madre.
Si está en periodo de lactancia durante el tratamiento con XGEVA, por favor, informe a su médico. Usted podría ser inscrita en un programa de Supervisión de la Lactancia de Amgen. Los datos de contacto del representante local de Amgen figuran en la sección 6 del prospecto.
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
La influencia de XGEVA sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
XGEVA contiene sorbitol
Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de usar este medicamento, ya que contiene sorbitol (E420).
XGEVA contiene sodio
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por 120 mg, por lo que se considera esencialmente “exento de sodio”.
3. Cómo usar XGEVA
La dosis recomendada de XGEVA es 120 mg administrada una vez cada 4 semanas en una única inyección debajo de la piel (vía subcutánea). XGEVA se inyectará en el muslo, el abdomen o la parte superior del brazo. Si va a ser tratado para el tumor de células gigantes de hueso, recibirá una dosis adicional 1 y 2 semanas después de la primera dosis.
XGEVA deberá ser administrado bajo la responsabilidad de un profesional sanitario.
No agitar excesivamente.
También debe tomar suplementos de calcio y vitamina D durante el tratamiento con XGEVA. Su médico le explicará este aspecto.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, XGEVA puede producir efectos adversos, aunque no todas las personas los sufran.
Informe a su médico inmediatamente si aparece alguno de estos síntomas durante el tratamiento con XGEVA:
• espasmos, tics, calambres en los músculos, entumecimiento u hormigueo en los dedos de las manos y los pies o alrededor de la boca y/o convulsiones, confusión o pérdida del conocimiento. Estos síntomas pueden ser un signo de que sus niveles de calcio en sangre son bajos. La bajada de calcio en la sangre puede también producir un cambio en el ritmo del corazón llamado prolongación QT, que se observa mediante un electrocardiograma (ECG).
Informe a su médico y dentista inmediatamente si presenta alguno de estos síntomas durante el tratamiento con XGEVA o después de interrumpir el tratamiento:
• dolor en la boca y/o en la mandíbula, inflamación o úlceras que no se curan en la boca o en la mandíbula, supuración, entumecimiento o sensación de pesadez en la mandíbula o aflojamiento de un diente pueden ser signos de daño óseo en la mandíbula (osteonecrosis).
Efectos adversos muy frecuentes (puede afectar a más de 1 de cada 10 personas):
• dolor en el hueso, articulaciones y/o músculos que a veces es intenso,
• dificultades respiratorias,
• diarrea.
Efectos adversos frecuentes (puede afectar hasta 1 de cada 10 personas):
• concentraciones bajas de calcio en la sangre (hipocalcemia),
• concentraciones bajas de fosfato en la sangre (hipofosfatemia),
• dolor persistente y/o úlceras que no se curan en la boca o en la mandíbula (osteonecrosis mandibular),
• extracción dental,
• sudoración excesiva.
Efectos adversos raros (puede afectar hasta 1 de cada 1.000 personas):
• reacciones alérgicas (por ejemplo: sibilancias o dificultades respiratorias; hinchazón de la cara, los labios, la lengua, garganta u otras partes del cuerpo; erupción cutánea, picor o ronchas en la piel). En raras ocasiones, las reacciones alérgicas podrían ser graves.
• dolor reciente o inusual en la cadera, ingle o muslo (puede ser una primera indicación de una posible fractura del hueso del muslo).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de XGEVA
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta después de “CAD” o “EXP”. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Antes de la inyección, el vial puede dejarse fuera de la nevera para que alcance la temperatura ambiente (hasta 25 °C). De este modo la inyección será menos molesta. Una vez que el vial haya alcanzado la temperatura ambiente (hasta 25 °C), debe utilizarse antes de que pasen 30 días.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de XGEVA
- El principio activo es denosumab. Cada vial contienen 120 mg de denosumab en 1,7 ml de solución (lo que equivale a 70 mg/ml).
- Los demás componentes son ácido acético glacial, hidróxido sódico, sorbitol (E420) y agua para preparaciones inyectables.
Aspecto de XGEVA y contenido del envase
XGEVA es una solución inyectable en un vial.
Cada envase contiene uno, tres o cuatro viales.
Puede que solamente estén comercializados algunos tamaños de envases.
XGEVA es una solución transparente, de incolora a ligeramente amarillenta, que puede contener cantidades residuales de partículas proteicas de translúcidas a blancas.
Titular de la autorización de comercialización y responsable de la fabricación:
Amgen Europe B.V.
Mirevum 7061 NL-4817 ZK Breda Países Bajos
Titular de la autorización de comercialización:
Amgen Europe B.V.
Minervum 7061 NL-4817 ZK Breda Países Bajos
Fabricante:
Amgen Technology Ireland (ADL)
Pottery Road Dun Laoghaire Co Dublin Irlanda
Puede solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
|
Belgie/Belgique/Belgien s.a. Amgen n.v. Tel/Tél: +32 (0)2 7752711 |
Lietuva Amgen Switzerland AG Vilniaus filialas Tel: +370 5 219 7474 |
|
Etnrapna AMg^eH Etnrapna EOOfl Ten.: +359 (0)2 424 7440 |
Luxembourg/Luxemburg s.a. Amgen Belgique/Belgien Tel/Tél: +32 (0)2 7752711 |
|
Ceská republika Amgen s.r.o. Tel: +420 221 773 500 |
Magyarország Amgen Kft. Tel.: +36 1 35 44 700 |
|
Danmark Amgen filial af Amgen AB, Sverige Tlf: +45 39617500 |
Malta Amgen B.V. The Netherlands Tel: +31 (0)76 5732500 |
|
Deutschland AMGEN GmbH Tel.: +49 89 1490960 |
Nederland Amgen B.V. Tel: +31 (0)76 5732500 |
|
Eesti Amgen Switzerland AG Vilniaus filialas Tel: +372 586 09553 |
Norge Amgen AB Tel: +47 23308000 |
|
EXláda Amgen E^Mg OapgaKeoxiKá E.n.E. Tr(k:. +30 210 3447000 |
Osterreich Amgen GmbH Tel: +43 (0)1 50 217 |
|
España Amgen S.A. Tel: +34 93 600 18 60 |
Polska Amgen Biotechnologia Sp. z o.o. Tel.: +48 22 581 3000 |
|
France Amgen S.A.S. Tél: +33 (0)9 69 363 363 |
Portugal Amgen Biofarmaceutica, Lda. Tel: +351 21 4220550 |
|
Hrvatska Amgen d.o.o. Tel: +385 (0)1 562 57 20 |
Romania Amgen Romania SRL Tel: +4021 527 3000 |
Ireland Slovenija
Amgen Limited AMGEN zdravila d.o.o.
United Kingdom Tel: +386 (0)1 585 1767
Tel: +44 (0)1223 420305
Italia
Amgen S.r.l.
Tel: +39 02 6241121
Suomi/Finland
Amgen AB, sivuliike Suomessa/Amgen AB, filial i Finland
Puh/Tel: +358 (0)9 54900500
Latvija United Kingdom
Amgen Switzerland AG Rlgas filíale Amgen Limited
Tel: +371 257 25888 Tel: +44 (0)1223 420305
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
Esta información está destinada únicamente a profesionales sanitarios:
La solución de XGEVA debe examinarse visualmente antes de su administración. La solución puede contener cantidades residuales de partículas proteicas de translúcidas a blancas. No inyecte la solución si está turbia o descolorida. No agitar excesivamente. Para evitar molestias en la zona de la administración, antes de inyectar, deje que el vial alcance la temperatura ambiente (hasta 25 °C) antes de inyectarla y realice la inyección lentamente. Inyecte todo el contenido del vial. Para la administración de denosumab se recomienda utilizar una aguja del calibre 27. No reinserte la aguja en el vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
33