Xeplion 150 Mg Suspension Inyectable De Liberacion Prolongada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Xeplion 25 mg suspensión inyectable de liberación prolongada Xeplion 50 mg suspensión inyectable de liberación prolongada Xeplion 75 mg suspensión inyectable de liberación prolongada Xeplion 100 mg suspensión inyectable de liberación prolongada Xeplion 150 mg suspensión inyectable de liberación prolongada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
25 mg suspensión inyectable
Cada jeringa precargada contiene 39 mg de palmitato de paliperidona equivalentes a 25 mg de paliperidona.
50 mg suspensión inyectable
Cada jeringa precargada contiene 78 mg de palmitato de paliperidona equivalentes a 50 mg de paliperidona.
75 mg suspensión inyectable
Cada jeringa precargada contiene 117 mg de palmitato de paliperidona equivalentes a 75 mg de paliperidona.
100 mg suspensión inyectable
Cada jeringa precargada contiene 156 mg de palmitato de paliperidona equivalentes a 100 mg de paliperidona.
150 mg suspensión inyectable
Cada jeringa precargada contiene 234 mg de palmitato de paliperidona equivalentes a 150 mg de paliperidona.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión inyectable de liberación prolongada.
La suspensión es de color blanco a blanquecino. La suspensión tiene un pH neutro (aproximadamente 7,0).
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Xeplion está indicado para el tratamiento de mantenimiento de la esquizofrenia en pacientes adultos estabilizados con paliperidona o risperidona.
En determinados pacientes adultos con esquizofrenia y respuesta previa a paliperidona o risperidona oral, Xeplion puede ser utilizado sin necesidad de estabilización previa con tratamiento oral si los síntomas psicóticos son leves o moderados y es necesario un tratamiento con un inyectable de acción prolongada.
4.2 Posología y forma de administración
Posología
Se recomienda iniciar Xeplion con una dosis de 150 mg en el día 1 de tratamiento y 100 mg una semana después (día 8), ambos administrados en el músculo deltoides para alcanzar concentraciones terapéuticas rápidamente (ver sección 5.2). La tercera dosis se debe administrar un mes después de la segunda dosis de inicio. La dosis de mantenimiento mensual recomendada es de 75 mg; algunos pacientes pueden beneficiarse de dosis inferiores o superiores dentro del rango recomendado de 25 a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente. Los pacientes con sobrepeso u obesos pueden requerir dosis situadas en la parte superior del intervalo (ver sección 5.2). Después de la segunda dosis de inicio, las dosis de mantenimiento mensuales se pueden administrar tanto en el músculo deltoides como en el glúteo.
El ajuste de la dosis de mantenimiento se puede hacer mensualmente. Al realizar ajustes de la dosis, se deben tener en cuenta las características de liberación prolongada de Xeplion (ver sección 5.2), dado que el pleno efecto de las dosis de mantenimiento puede no resultar evidente durante varios meses.
Cambio desde paliperidona oral o risperidona oral
El tratamiento recibido previamente con paliperidona oral o risperidona oral puede ser interrumpido en el momento de iniciar el tratamiento con Xeplion. Algunos pacientes se pueden beneficiar de una retirada gradual. Xeplion debe iniciarse según se describe al principio de la sección 4.2 anterior.
Cambio desde Risperidona inyectable de acción prolongada
Al realizar el cambio de tratamiento de los pacientes desde risperidona inyectable de acción prolongada, inicie el tratamiento con Xeplion en lugar de la siguiente inyección programada. A partir de entonces, Xeplion se debe continuar en intervalos mensuales. No es necesario seguir el régimen de dosificación inicial de una semana incluyendo las inyecciones intramusculares (día 1 y 8, respectivamente) según se describe en la sección 4.2 anterior. Los pacientes previamente estabilizados con diferentes dosis de risperidona inyectable de acción prolongada pueden alcanzar una exposición similar a paliperidona en estado estacionario durante el tratamiento de mantenimiento con dosis mensuales de Xeplion según se describe a continuación:
Dosis de risperidona inyectable de acción prolongada y Xeplion necesaria para alcanzar una exposición a paliperidona similar en estado estacionario
|
Dosis previa de risperidona inyectable de acción prolongada |
Inyección de Xeplion |
|
25 mg cada 2 semanas |
50 mg mensualmente |
|
37,5 mg cada 2 semanas |
75 mg mensualmente |
|
50 mg cada 2 semanas |
100 mg mensualmente |
La interrupción de los medicamentos antipsicóticos debe realizarse de acuerdo a una apropiada información de prescripción. En caso de interrupción de Xeplion, se deben considerar sus características de liberación prolongada. Se ha de reevaluar periódicamente la necesidad de continuar con la administración de los medicamentos actuales para el tratamiento de los síntomas extrapiramidales (SEP).
Medidas para evitar la omisión de dosis
Se recomienda que la segunda dosis de iniciación de Xeplion se administre una semana después de la primera dosis. Para evitar la omisión de esta dosis, los pacientes pueden recibir la segunda dosis 4 días antes o después del momento de administración semanal (día 8). Del mismo modo, se recomienda administrar mensualmente la tercera inyección y las siguientes después del régimen de iniciación. Para evitar la omisión de la dosis mensual, los pacientes pueden recibir la inyección hasta 7 días antes o después del momento de administración mensual.
Si se omite la fecha límite para la segunda inyección de Xeplion (día 8 ± 4 días), el momento de reinicio recomendado depende del tiempo que haya transcurrido desde la primera inyección del paciente.
Omisión de la segunda dosis de iniciación (<4 semanas desde la primera inyección)
Si han transcurrido menos de 4 semanas desde la primera inyección, se le debe administrar al paciente la segunda inyección de 100 mg en el músculo deltoides tan pronto como sea posible. Se debe administrar una tercera inyección de Xeplion de 75 mg en el músculo deltoides o en el glúteo 5 semanas después de la primera inyección (independientemente del momento en el que se haya administrado la segunda inyección). A partir de entonces, se debe seguir el ciclo normal de inyecciones mensuales, ya sea en el músculo deltoides o en el glúteo, de 25 mg a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente.
Omisión de la segunda dosis de iniciación (entre 4 y 7 semanas desde la primera inyección)
Si han transcurrido entre 4 y 7 semanas desde la primera inyección de Xeplion, reanude la administración con dos inyecciones de 100 mg de la siguiente manera:
1. una inyección en el deltoides tan pronto como sea posible,
2. otra inyección en el deltoides una semana más tarde,
3. reanudación del ciclo normal de inyecciones mensuales, ya sea en el músculo deltoides o en el glúteo, de 25 mg a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente.
Omisión de la segunda dosis de iniciación (>7 semanas desde la primera inyección)
Si han transcurrido más de 7 semanas desde la primera inyección de Xeplion, inicie la administración según las pautas recomendadas para la iniciación de Xeplion recogidas anteriormente.
Omisión de la dosis de mantenimiento mensual (1 mes a 6 semanas)
Tras la iniciación, el ciclo de inyección recomendado de Xeplion es mensual. Si han transcurrido menos de 6 semanas desde la última inyección, entonces se debe administrar la dosis previamente estabilizada tan pronto como sea posible, seguida de inyecciones a intervalos mensuales.
Omisión de la dosis de mantenimiento mensual (> 6 semanas a 6 meses)
Si han transcurrido más de 6 semanas desde la última inyección de Xeplion, la recomendación es la siguiente:
Para los pacientes estabilizados con dosis de 25 a 100 mg
1. una inyección en el deltoides tan pronto como sea posible, de la misma dosis en la que el paciente se estabilizó previamente
2. otra inyección en el deltoides (misma dosis) una semana más tarde (día 8)
3. reanudación del ciclo normal de inyecciones mensuales, ya sea en el músculo deltoides o en el
glúteo, de 25 mg a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente
Para los pacientes estabilizados con 150 mg
1. una inyección en el deltoides tan pronto como sea posible, de una dosis de 100 mg
2. otra inyección en el deltoides una semana más tarde (día 8) de una dosis de 100 mg
3. reanudación del ciclo normal de inyecciones mensuales, ya sea en el músculo deltoides o en el
glúteo, de 25 mg a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente
Omisión de la dosis de mantenimiento mensual (> 6 meses)
Si han transcurrido más de 6 meses desde la última inyección de Xeplion, inicie la administración según las pautas recomendadas para la iniciación de Xeplion recogidas anteriormente.
Poblaciones especiales
Población de edad avanzada
No se ha establecido la eficacia y la seguridad en la población de edad avanzada > 65 años.
En general, la dosis recomendada de Xeplion en los pacientes de edad avanzada con función renal normal es la misma que para los pacientes adultos más jóvenes con función renal normal. Sin embargo, ya que los pacientes de edad avanzada pueden tener disminuida la función renal, puede ser necesario ajustar la dosis (ver Insuficiencia renal más adelante para conocer las recomendaciones de dosificación en pacientes con insuficiencia renal).
Insuficiencia renal
No se ha estudiado Xeplion sistemáticamente en los pacientes con insuficiencia renal (ver sección 5.2). En los pacientes con insuficiencia renal leve (aclaramiento de creatinina > 50 a < 80 ml/min), se recomienda iniciar Xeplion con una dosis de 100 mg el día 1 del tratamiento y 75 mg una semana después, ambos administrados en el músculo deltoides. La dosis de mantenimiento mensual recomendada es de 50 mg con un rango de 25 a 100 mg, en función de la tolerabilidad y/o eficacia individual del paciente.
Xeplion no está recomendado en pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina < 50 ml/min) (ver sección 4.4).
Insuficiencia hepática
Basándose en la experiencia con paliperidona oral, no es preciso ajustar las dosis en los pacientes con insuficiencia hepática leve o moderada. Dado que paliperidona no se ha estudiado en pacientes con insuficiencia hepática grave, se recomienda precaución en estos pacientes.
Población pediátrica
No se ha establecido la seguridad y la eficacia de Xeplion en niños y adolescentes <18 años de edad. No hay datos disponibles.
Forma de administración
Xeplion se utiliza únicamente para uso intramuscular. Se debe inyectar lentamente, profundamente en el músculo. Cada inyección debe ser administrada por un profesional sanitario. La administración debe realizarse en una sola inyección. La dosis no se debe administrar en inyecciones divididas. La dosis no se debe administrar por vía intravascular o subcutánea.
Las dosis de iniciación del día 1 y del día 8 se deben administrar ambas en el músculo deltoides para alcanzar concentraciones terapéuticas rápidamente (ver sección 5.2). Después de la segunda dosis de inicio, las dosis de mantenimiento mensuales se pueden administrar tanto en el músculo deltoides como en el glúteo. Se debe cambiar del glúteo al deltoides (y viceversa) en caso de dolor en el lugar de inyección si no se tolera bien el malestar en el lugar de inyección (ver sección 4.8). También se recomienda alternar entre los lados izquierdo y derecho (ver más adelante).
Para consultar las instrucciones de uso y manipulación de Xeplion, ver prospecto (información destinada únicamente a médicos o profesionales del sector sanitario).
Administración en el músculo deltoides
El tamaño de la aguja recomendado para la administración inicial y de mantenimiento de Xeplion en el músculo deltoides viene determinada por el peso del paciente. En los pacientes > 90 kg, se recomienda la aguja de calibre 22 de 1% pulgadas (38,1 mm x 0,72 mm). En los pacientes < 90 kg, se recomienda
la aguja de calibre 23 de 1 pulgada (25,4 mm x 0,64 mm). Las inyecciones en el deltoides se deben alternar entre los dos músculos deltoides.
Administración en el músculo glúteo
El tamaño de la aguja recomendado para la administración de mantenimiento de Xeplion en el músculo glúteo es el de una aguja de calibre 22 de 1% pulgadas (38,1 mm x 0,72 mm). La administración se debe realizar en el cuadrante superior externo de la zona glútea. Las inyecciones en el glúteo se deben alternar entre los dos músculos glúteos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a risperidona o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Uso en pacientes que se encuentran en un estado sumamente agitado o psicótico grave
Xeplion no se debe utilizar para el tratamiento de estados agitados agudos o psicóticos graves cuando esté justificado el control inmediato de los síntomas.
Intervalo QT
Se debe tener precaución al recetar paliperidona a pacientes con enfermedad cardiovascular conocida o antecedentes familiares de prolongación del intervalo QT, y en caso de uso concomitante con otros medicamentos que prolonguen el intervalo QT.
Síndrome neuroléptico maligno
Se han notificado casos del Síndrome Neuroléptico Maligno (SNM), que se caracteriza por hipertermia, rigidez muscular, inestabilidad autonómica, alteración de la consciencia y elevación de los niveles séricos de creatina fosfocinasa relacionados con paliperidona. Otros signos clínicos pueden ser mioglobinuria (rabdomiólisis) e insuficiencia renal aguda. Si un paciente desarrolla signos o síntomas indicativos del SNM, se debe interrumpir la administración de todos los antipsicóticos, incluido paliperidona.
Discinesia tardía
Los medicamentos con propiedades antagonistas del receptor de la dopamina se han asociado con la inducción de discinesia tardía, caracterizada por movimientos rítmicos involuntarios, predominantemente de la lengua y/o la cara. Si aparecen signos y síntomas de discinesia tardía, se debe considerar la interrupción de la administración de todos los antipsicóticos, incluido paliperidona.
Leucopenia, neutropenia y agranulocitosis
Se han notificado casos de leucopenia, neutropenia y agranulocitosis con Xeplion. La agranulocitosis ha sido notificada en muy raras ocasiones (<1/10.000 pacientes) durante la experiencia postcomercialización. Pacientes con un historial de un bajo recuento de glóbulos blancos clínicamente significativo (GB) o una leucopenia/neutropenia inducida por el medicamento deben ser monitorizados durante los primeros meses de tratamiento y se considerará discontinuar el tratamiento con Xeplion si aparecen los primeros signos de disminución clínicamente significativa de GB, en ausencia de otros factores causales. Pacientes con neutropenia clínicamente significativa deben ser cuidadosamente monitorizados por la fiebre u otros síntomas o signos de infección y se deben tratar inmediatamente en caso de aparecer estos síntomas o signos. En pacientes con neutropenia grave (recuento total de neutrófilos <1x109/L) se debe discontinuar el tratamiento con Xeplion y controlar los niveles de GB hasta la recuperación.
Reacciones de hipersensibilidad
Durante la experiencia pos-comercialización se han notificado raramente reacciones anafilácticas en pacientes que previamente han tolerado risperidona oral y paliperidona oral (ver las secciones 4.1 y 4.8).
Si ocurren reacciones de hipersensibilidad, interrumpir el tratamiento con Xeplion, iniciar medidas generales de soporte clínicamente apropiadas y vigilar al paciente hasta que los signos y síntomas se resuelvan (ver las secciones 4.3 y 4.8).
Hiperglucemia y diabetes mellitus
Se ha notificado hiperglucemia, diabetes mellitus y exacerbación de diabetes pre-existente durante el tratamiento con paliperidona. En algunos casos, se ha notificado un aumento de peso previo que puede ser un factor de predisposición. Se ha notificado en muy raras ocasiones la asociación con cetoacidosis y en raras ocasiones con coma diabético. Se recomienda una monitorización clínica adecuada de acuerdo con las guías antispicóticas utilizadas. A los pacientes tratados con antipsicóticos atípicos, incluido Xeplion, se les deben monitorizar los síntomas de la hiperglucemia (tales como polidipsia, poliuria, polifagia y debilidad) y a los pacientes con diabetes mellitus se les debe monitorizar regularmente el empeoramiento del control de glucosa.
Aumento de peso
Se ha notificado un aumento de peso significativo con el uso de Xeplion. El peso debe controlarse regularmente.
Hiperprolactinemia
Los estudios de cultivo de tejidos sugieren que la prolactina puede estimular el crecimiento de células en los tumores de mama humanos. Aunque hasta ahora los estudios clínicos y epidemiológicos no han demostrado la existencia de una asociación clara con la administración de antipsicóticos, se recomienda precaución en pacientes con antecedentes patológicos de interés. Paliperidona debe utilizarse con precaución en pacientes con posibles tumores dependientes de prolactina.
Hipotensión ortostática
Paliperidona puede inducir hipotensión ortostática en algunos pacientes sobre la base de su actividad alfa-bloqueante.
Según los datos agrupados de los tres ensayos controlados con placebo, de dosis fijas y 6 semanas de duración con comprimidos orales de paliperidona de liberación prolongada (3, 6, 9 y 12 mg), el 2,5% de los pacientes tratados con paliperidona oral comunicaron hipotensión ortostática, en comparación con el 0,8% de los sujetos tratados con placebo. Xeplion debe utilizarse con precaución en pacientes con enfermedad cardiovascular conocida (p. ej., insuficiencia cardíaca, infarto de miocardio o isquemia, trastornos de la conducción), enfermedad cerebrovascular o afecciones que predispongan al paciente a la hipotensión (p. ej. deshidratación e hipovolemia).
Convulsiones
Xeplion debe utilizarse con precaución en pacientes con antecedentes de convulsiones u otros trastornos que potencialmente puedan reducir el umbral convulsivo.
Insuficiencia renal
Las concentraciones plasmáticas de paliperidona aumentan en pacientes con insuficiencia renal y por tanto, se recomienda un ajuste de la dosis en pacientes con insuficiencia renal leve. Xeplion no está recomendado en pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina <
50 ml/min) (ver secciones 4.2 y 5.2).
Insuficiencia hepática
No se dispone de datos en pacientes con insuficiencia hepática grave (clase C de Child-Pugh). Se recomienda precaución si se utiliza paliperidona en dichos pacientes.
Pacientes de edad avanzada con demencia
No se ha estudiado Xeplion en pacientes de edad avanzada con demencia. Xeplion se debe utilizar con precaución en pacientes de edad avanzada con demencia y con factores de riesgo de padecer ictus.
La experiencia con risperidona citada más adelante se considera válida también para paliperidona.
Mortalidad global
En un metanálisis de 17 ensayos clínicos controlados, los pacientes de edad avanzada con demencia tratados con otros antipsicóticos atípicos, tales como risperidona, aripiprazol, olanzapina y quetiapina, tenían un mayor riesgo de mortalidad en comparación con placebo. Entre los pacientes tratados con risperidona, la mortalidad fue del 4% frente al 3,1% con placebo.
Reacciones adversas cerebrovasculares
Se ha observado un aumento de aproximadamente 3 veces del riesgo de reacciones adversas cerebrovasculares en los ensayos clínicos aleatorizados controlados con placebo en la población con demencia al utilizar algunos antipsicóticos atípicos, tales como risperidona, aripiprazol y olanzapina. Se desconoce el mecanismo de este aumento del riesgo.
Enfermedad de Parkinson y demencia con cuerpos de Lewy
Los médicos deben sopesar los riesgos y los beneficios de prescribir Xeplion a los pacientes con enfermedad de Parkinson o Demencia con Cuerpos de Lewy (DCL), ya que ambos grupos pueden tener mayor riesgo de padecer Síndrome Neuroléptico Maligno, así como tener una mayor sensibilidad a los antipsicóticos. Las manifestaciones de este aumento de la sensibilidad pueden incluir confusión, obnubilación, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
Priapismo
Se ha notificado que los medicamentos antipsicóticos (incluida risperidona) con efectos de bloqueo alfa adrenérgico inducen priapismo. Durante la vigilancia post-comercialización, también se han notificado casos de priapismo con paliperidona oral, que es el metabolito activo de risperidona. Se ha de informar a los pacientes de la necesidad de acudir al médico urgentemente en caso de que el priapismo no haya sido resuelto en el transcurso de 3 a 4 horas.
Regulación de la temperatura del organismo
Se ha atribuido a los medicamentos antipsicóticos la interrupción de la capacidad del organismo para reducir la temperatura corporal central. Se aconseja proceder con especial cautela cuando se prescriba Xeplion a pacientes que vayan a experimentar circunstancias que puedan contribuir a una elevación de la temperatura corporal central, p. ej. ejercicio físico intenso, exposición a calor extremo, que reciban medicamentos concomitantes con actividad anticolinérgica o que estén sujetos a deshidratación.
Tromboembolismo venoso
Se han notificado casos de tromboembolismo venoso (TEV) con medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos suelen presentar factores de riesgo adquiridos de TEV, se han de identificar todos los posibles factores de riesgo de TEV antes y durante el tratamiento con Xeplion y adoptar medidas preventivas.
Efecto antiemético
Se observó un efecto antiemético en los estudios preclínicos con paliperidona. Este efecto, si se produce en humanos, puede enmascarar los signos y síntomas de la sobredosis de determinados medicamentos o de enfermedades como la obstrucción intestinal, el síndrome de Reye y los tumores cerebrales.
Administración
Se debe tener cuidado para evitar la inyección involuntaria de Xeplion en un vaso sanguíneo. Síndrome del Iris Flácido Intraoperatorio
Se ha observado síndrome del iris flácido intraoperatorio (IFIS) durante la cirugía de cataratas en pacientes tratados con medicamentos con efecto antagonista alfa1a-adrenérgico, como Xeplion (ver sección 4.8).
El IFIS puede aumentar el riesgo de complicaciones oculares durante y después de la intervención. El oftalmólogo debe ser informado del uso actual o pasado de medicamentos con efecto antagonista alfa1a-adrenérgico antes de la cirugía. El beneficio potencial de la interrupción del tratamiento con bloqueantes alfa1 antes de la cirugía de cataratas no ha sido establecido y debe ser sopesado frente al riesgo de interrumpir el tratamiento antipsicótico.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se recomienda precaución al prescribir Xeplion con medicamentos que prolonguen el intervalo QT, p. ej. antiarrítmicos de clase IA (p. ej., quinidina, disopiramida) y antiarrítmicos de clase III (p. ej. amiodarona, sotalol), algunos antihistamínicos, algunos otros antipsicóticos y algunos antipalúdicos (p. ej. mefloquina). Esta lista es indicativa y no exhaustiva.
Posibilidad de que Xeplion afecte a otros medicamentos
No se espera que paliperidona produzca interacciones farmacocinéticas clínicamente relevantes con medicamentos que sean metabolizados por las isoenzimas del citocromo P-450.
Dado que los efectos principales de paliperidona se ejercen sobre el sistema nervioso central (SNC) (ver sección 4.8), Xeplion debe utilizarse con precaución en combinación con otros medicamentos de acción central, p. ej., ansiolíticos, la mayoría de los antipsicóticos, hipnóticos, opiáceos, etc. o con el alcohol.
Paliperidona puede antagonizar el efecto de levodopa y otros agonistas de dopamina. Si se considera necesario administrar esta combinación, sobre todo para la enfermedad de Parkinson terminal, se debe recetar la dosis mínima eficaz de cada tratamiento.
Debido a la posibilidad de que induzca hipotensión ortostática (ver sección 4.4), se puede observar un efecto aditivo si se administra Xeplion con otros tratamientos que también tengan esta posibilidad, p.ej., otros antipsicóticos, tricíclicos.
Se recomienda precaución cuando se coadministre paliperidona junto con otros medicamentos que disminuyan el umbral convulsivo (es decir, fenotiazinas o butirofenonas, tricíclicos o ISRS, tramadol, mefloquina, etc.).
La administración concomitante de comprimidos orales de paliperidona de liberación prolongada en estado estacionario (12 mg una vez al día) con comprimidos de divalproex sódico de liberación prolongada (de 500 mg a 2000 mg una vez al día) no afectó a la farmacocinética en estado estacionario de valproato.
No se ha realizado ningún estudio de interacción entre Xeplion y el litio, sin embargo, no es probable que se produzca una interacción farmacocinética.
Posibilidad de que otros medicamentos afecten a Xeplion
Los estudios in vitro indican que las enzimas CYP2D6 y CYP3A4 pueden tener una intervención mínima en el metabolismo de la paliperidona, pero no hay indicios in vitro ni in vivo de que esas isoenzimas desempeñen un papel significativo en el metabolismo de paliperidona. La administración conjunta de paliperidona oral con paroxetina, un potente inhibidor de la CYP2D6, no tuvo un efecto clínicamente significativo sobre la farmacocinética de paliperidona.
La administración concomitante de paliperidona oral de liberación prolongada una vez al día y carbamazepina 200 mg dos veces al día originó una disminución de aproximadamente un 37% de la media de la Cmax y del AUC en el estado estacionario de paliperidona. Esta disminución se debe en gran parte a un aumento de un 35% del aclaramiento renal de paliperidona, probablemente como resultado de la inducción de la P-gp renal por carbamazepina. Una disminución menor de la cantidad del principio activo inalterado excretado en la orina sugiere que durante la administración concomitante con carbamazepina, hubo un efecto mínimo en el metabolismo del CYP o en la biodisponibilidad de paliperidona. Con dosis más altas de carbamazepina, podrían aparecer disminuciones mayores de las concentraciones plasmáticas de paliperidona. Al inicio del tratamiento con carbamazepina, se debe reevaluar y aumentar la dosis de Xeplion, si es necesario. Por el contrario, en caso de interrupción del tratamiento con carbamazepina, se debe reevaluar y disminuir la dosis de Xeplion, si es necesario.
La administración concomitante de una sola dosis de un comprimido de paliperidona oral de liberación prolongada de 12 mg con comprimidos de divalproex sódico de liberación prolongada (dos comprimidos de 500 mg una vez al día) tuvo como resultado un aumento de aproximadamente el 50% en la Cmax y el AUC de paliperidona, probablemente como resultado de un aumento de la absorción oral. Dado que no se observó ningún efecto sobre el aclaramiento sistémico, no se espera que se produzca una interacción clínicamente significativa entre los comprimidos de divalproex sódico de liberación prolongada y la inyección intramuscular de Xeplion. Esta interacción no se ha estudiado con Xeplion.
Uso concomitante de Xeplion y risperidona o paliperidona oral
Debido a que paliperidona es el principal metabolito activo de risperidona, se debe tener precaución cuando Xeplion sea administrado de forma conjunta con risperidona o con paliperidona oral durante períodos prolongados de tiempo. Los datos de seguridad relacionados con el uso concomitante de Xeplion con otros antipsicóticos son limitados.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de paliperidona durante el embarazo. El palmitato de paliperidona inyectado por vía intramuscular y paliperidona administrada por vía oral no fueron teratógenos en estudios en animales, pero se observaron otros tipos de toxicidad reproductiva (ver sección 5.3). Los recién nacidos expuestos a paliperidona durante el tercer trimestre de embarazo están en peligro de sufrir reacciones adversas como síntomas extrapiramidales y/o síndromes de abstinencia que pueden variar en gravedad y duración tras la exposición. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias. Por consiguiente, se debe vigilar estrechamente a los recién nacidos. Xeplion no se debe utilizar durante el embarazo salvo que sea claramente necesario.
Lactancia
Paliperidona se excreta por la leche materna en tal medida que es probable que se produzcan efectos en el lactante si se administra en dosis terapéuticas a mujeres lactantes. Xeplion no debe utilizarse durante la lactancia.
Fertilidad
No se observaron efectos relevantes en estudios no clínicos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de paliperidona sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada debido a sus posibles efectos sobre el sistema nervioso y la vista, tales como sedación, somnolencia, síncope, visión borrosa (ver sección 4.8). Por tanto, se debe aconsejar a los pacientes que no conduzcan ni utilicen máquinas hasta conocer su sensibilidad individual a Xeplion.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas a medicamentos (RAMs) notificadas con más frecuencia en los ensayos clínicos fueron insomnio, cefalea, ansiedad, infección de las vías respiratorias altas, reacción en el lugar de la inyección, parkinsonismo, aumento de peso, acatisia, agitación, sedación/somnolencia, náuseas, estreñimiento, mareos, dolor musculoesquelético, taquicardia, temblor, dolor abdominal, vómitos, diarrea, fatiga y distonía. De estas, la acatisia y la sedación/somnolencia parecían estar relacionadas con la dosis.
Tabla de reacciones adversas
A continuación se recogen todas las RAMs notificadas con paliperidona en función de la frecuencia estimada de ensayos clínicos llevados a cabo con Xeplion. Se aplican los siguientes términos y frecuencias: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1000 a < 1/100), raras (> 1/10.000 a < 1/1000), muy raras (< 1/10.000), y frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Sistema de |
Reacción adversa al medicamento | ||||
|
clasificación de |
Frecuencia | ||||
|
órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
No conocidas |
|
Infecciones e infestaciones |
infección de las vías respiratorias superiores, infección del tracto urinario, gripe |
neumonía, bronquitis, infección del tracto respiratorio, sinusitis, cistitis, infección de oídos, infección de ojos, amigdalitis, celulitis, acarodermatitis, absceso subcutáneo |
onicomicosis | ||
|
Trastornos de la sangre y del sistema linfático |
disminución del recuento de glóbulos blancos, anemia, disminución del hematocrito, aumento del recuento de eosinófilos |
agranulocitosise, neutropenia, trombocitopenia | |||
|
Trastornos del sistema inmunológico |
hipersensibilidad |
reacción anafilácticae | |||
|
Trastornos endocrinos |
hiperprolactinemi aa |
secreción inapropiada de la hormona antidiurética |
presencia de glucosa en orina | ||
|
Trastornos del metabolismo y de la nutrición |
hiperglucemia, aumento de peso, disminución de peso, aumento de los triglicéridos en sangre |
diabetes mellitusc, hiperinsulinemia, aumento del apetito, anorexia, disminución del apetito, aumento del colesterol en sangre |
intoxicación por e agua , cetoacidosis diabética6, hipoglucemia, polidipsia | ||
|
Trastornos psiquiátricos |
insomniod |
agitación, depresión, ansiedad |
trastorno del sueño, manía, estado de confusión, disminución de la libido, nerviosismo, pesadillas |
embotamiento afectivoe, anorgasmia | |
|
Trastornos del sistema nervioso |
cefalea |
parkinsonismob, acatisiab, sedación/som- nolencia, distoniab, mareos, discinesiab, temblor |
discinesia tardía, convulsiónd, síncope, hiperactividad psicomotora, mareo postural, alteración de la atención, disartria, disgeusia, hipoestesia, parestesia |
síndrome neuroléptico maligno, isquemia cerebral, sin respuesta a estímulos, pérdida de la consciencia, disminución del nivel de consciencia, coma diabéticoe, trastorno del equilibrio, coordinación anormale, titubeo de la cabezae | |
|
Trastornos oculares |
visión borrosa, conjuntivitis, sequedad de ojos |
glaucomae, trastornos del movimiento del ojo, giros de los ojos, fotofobia, aumento del lagrimeo, hiperemia ocular | |||
|
Trastornos del oído y del laberinto |
vértigo, acúfenos, dolor de oído | ||||
|
Trastornos cardiacos |
bradicardia, taquicardia |
fibrilación auricular, bloqueo auriculoventricular, QT prolongado en el |
arritmia sinusal |
|
electrocardiograma, síndrome de taquicardia postural ortostática, anomalías del electrocardiograma, palpitaciones | |||||
|
Trastornos vasculares |
hipertensión |
hipotensión, hipotensión ortostática |
embolismo pulmonar6, trombosis venosa, isquemiae, rubor | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
tos, congestión nasal |
disnea, congestión pulmonar, sibilancias, dolor faringeolaríngeo, epistaxis |
síndrome de apnea del sueñoe, hiperventilacióne, neumonía por aspiración , congestión del tracto respiratorio, disfoníae | ||
|
Trastornos gastrointesti nales |
dolor abdominal, vómitos, náuseas, estreñimiento, diarrea, dispepsia, dolor de muelas |
malestar abdominal, gastroenteritis, sequedad de boca, flatulencia |
pancreatitis, obstrucción del intestinoe, íleo, hinchazón de la lengua, incontinencia fecal, fecaloma, disfagia, queilitise | ||
|
Trastornos hepatobiliares |
aumento de las transaminasas |
aumento de la gamma-glutamiltransfe-rasa, aumento de las enzimas hepáticas |
ictericia*5 | ||
|
Trastornos de la piel y del tejido subcutáneo |
erupción cutánea |
urticaria, prurito, alopecia, eccema, sequedad de la piel, eritema, acné |
angioedemae, erupción debida al medicamento, hiperqueratosis, decoloración de la piele, dermatitis seborreicae, caspa | ||
|
Trastornos musculoesque-léticos y del tejido conjuntivo |
dolor musculoesque-lético, dolor de espalda |
espasmos musculares, rigidez en las articulaciones, dolor de cuello, artralgia |
rabdomiólisise, aumento de la creatina fosfoquinasa en sangre, anomalía posturale, inflamación de las articulaciones, debilidad muscular | ||
|
Trastornos renales y urinarios |
incontinencia urinaria, polaquiuria, disuria |
retención urinaria | |||
|
Embarazo, puerperio y enfermedades perinatales |
síndrome de abstinencia neonatal (ver sección 4.6)e | ||||
|
Trastornos del aparato reproductor y de la mama |
disfunción eréctil, trastorno de la eyaculación, amenorrea, retraso en la menstruación, |
priapismoe, dolor de las mamas, malestar de las mamas, congestión de las |
|
trastornos menstrualesd, ginecomastia, galactorrea, disfunción sexual, secreción vaginal |
mamas, aumento de las mamas, secreción mamaria | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
pirexia, astenia, fatiga, reacción en el lugar de la inyección |
edema facial, edemad, alteración de la marcha, dolor de pecho, malestar de pecho, malestar, endurecimiento |
hipotermia, disminución de la temperatura corporale, escalofríos, aumento de la temperatura corporal, sed, síndrome de abstinencia a medicamentos*5, absceso en el lugar de la inyección, celulitis en el lugar de la inyección, quiste en el lugar de la inyeccióne, hematoma en el lugar de la inyección | ||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimien tos terapéuticos |
caídas |
a Referido a “Hiperprolactinemia” a continuación. b Referido a “Síntomas extrapiramidales” a continuación.
c En ensayos controlados con placebo, se notificó diabetes mellitus en un 0,32% de los pacientes tratados con Xeplion comparado con un 0,39% del grupo placebo. En general, la incidencia en todos los ensayos clínicos fue de un 0,47% en todos los pacientes tratados con Xeplion. d Insomnio incluye: insomnio inicial, insomnio medio; Convulsión incluye: convulsión del gran mal; Edema incluye: edema generalizado, edema periférico, edema con fóvea. Trastornos menstruales incluyen: menstruación irregular, oligomenorrea. e Observado en la experiencia tras la comercialización con paliperidona.
Reacciones adversas notificadas con las formulaciones de risperidona
Paliperidona es el metabolito activo de risperidona, por lo tanto, los perfiles de las reacciones adversas de estos compuestos (incluyendo ambas formulaciones la oral y la inyectable) son relevantes entre sí. Además de las reacciones adversas anteriormente mencionadas, se han notificado las siguientes reacciones adversas con el uso de risperidona, las cuales se espera que aparezcan con Xeplion. Trastornos del sistema nervioso: trastorno cerebrovascular Trastornos oculares: síndrome del iris flácido (intraoperatorio)
Trastornos respiratorios, torácicos y mediastínicos: estertores
Trastornos generales y alteraciones en el lugar de administración (observadas con la formulación inyectable de risperidona): necrosis en el lugar de la inyección, úlcera en el lugar de la inyección.
Descripción de algunas reacciones adversas
Reacción anafiláctica
Durante la experiencia post comercialización, en raras ocasiones se han notificado casos de una reacción anafiláctica después de la inyección de Xeplion en pacientes que previamente han tolerado risperidona oral o paliperidona oral (ver sección 4.4).
Reacciones en el lugar de la inyección
La reacción adversa relacionada con el lugar de la inyección notificada con mayor frecuencia fue el dolor. La mayoría de estas reacciones se notificaron con gravedad de leve a moderada. Las evaluaciones del dolor en el sitio de la inyección en los sujetos, basada en una escala analógica visual, indican que el dolor tiende a disminuir en frecuencia e intensidad con el tiempo en todos los estudios de fase 2 y 3. Las inyecciones en el músculo deltoides se perciben como un poco más dolorosas que las correspondientes inyecciones en el glúteo. Otras reacciones en el lugar de la inyección fueron en su mayoría de intensidad leve e incluyeron induración (frecuente), prurito (poco frecuente) y nódulos (raro).
Síntomas extrapiramidales (SEP)
SEP incluye un análisis agrupado de los siguientes términos: parkinsonismo (incluye hipersecreción salival, rigidez musculoesquelética, parkinsonismo, babeo, rigidez en rueda dentada, bradicinesia, hipocinesia, facies en máscara, tensión muscular, acinesia, rigidez de la nuca, rigidez muscular, modo de andar parkinsoniano y reflejo de la glabella anormal, temblor en reposo parkinsoniano), acatisia (incluye acatisia, inquietud, hipercinesia y síndrome de las piernas inquietas), discinesia (discinesia, calambres musculares, coreatetosis, atetosis y mioclonía), distonía (incluye distonía, hipertonía, tortícolis, contracciones musculares involuntarias, contracturas musculares, blefarospasmo, giro ocular, parálisis lingual, espasmo facial, laringoespasmo, miotonía, opistótonos, espasmo orofaríngeo, pleurotótonos, espasmo lingual y trismo) y temblor. Hay que destacar que se incluye un espectro más amplio de síntomas que no tienen forzosamente su origen en el trastorno extrapiramidal.
Aumento de peso
En el estudio de 13 semanas de duración que incluyó un régimen de dosificación inicial de 150 mg, la proporción de sujetos con un aumento anormal de peso > 7% mostró una tendencia relacionada con la dosis, con una tasa de incidencia del 5% en el grupo placebo, en comparación con tasas del 6%, 8%, y 13% en los grupos tratados con 25 mg, 100 mg y 150 mg de Xeplion, respectivamente.
Durante el período abierto de transición/mantenimiento de 33 semanas de duración del ensayo de prevención de recidivas a largo plazo, el 12% de los pacientes tratados con Xeplion cumplieron este criterio (aumento de peso de > 7% desde la fase doble ciego hasta el final del estudio); la media (DE) del cambio de peso desde el nivel basal del periodo abierto fue de + 0,7 (4,79) kg.
Hiperprolactinemia
En ensayos clínicos, se observaron medianas de aumento de la prolactina sérica en sujetos de ambos sexos que recibieron Xeplion. Las reacciones adversas que pueden sugerir un aumento de los niveles de prolactina (p. ej., amenorrea, galactorrea, alteraciones de la menstruación, ginecomastia) se notificaron en < 1% de los sujetos.
Efectos de clase
Con antipsicóticos puede aparecer prolongación del QT, arritmias ventriculares (fibrilación ventricular, taquicardia ventricular), muerte súbita inexplicable, parada cardíaca y Torsades de pointes. Se han notificado casos de tromboembolismo venoso, incluidos casos de embolismo pulmonar y de trombosis venosa profunda, con el uso de medicamentos antipsicóticos (frecuencia no conocida).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Síntomas
En general, los signos y síntomas previstos son los resultantes de la exageración de los efectos farmacológicos conocidos de paliperidona, es decir, somnolencia y sedación, taquicardia e hipotensión, prolongación del intervalo QT y síntomas extrapiramidales. Se han notificado Torsades de pointes y fibrilación ventricular en un paciente en relación con la sobredosis de paliperidona oral. En caso de sobredosis aguda, se debe tener en cuenta la posibilidad de que estén implicados varios medicamentos.
Administración
Al evaluar el tratamiento necesario y la recuperación hay que tener en cuenta la naturaleza de liberación prolongada del medicamento y la prolongada vida media de eliminación de paliperidona. No hay ningún antídoto específico para paliperidona. Se utilizarán medidas de apoyo generales. Hay que establecer y mantener una vía respiratoria despejada y garantizar que la oxigenación y la ventilación sean adecuadas.
El control cardiovascular debe empezar inmediatamente e incluir un control electrocardiográfico continuo para controlar posibles arritmias. La hipotensión y el fracaso circulatorio deben tratarse con las medidas terapéuticas adecuadas, como administración de líquidos por vía intravenosa y/o de simpaticomiméticos. En caso de síntomas extrapiramidales intensos, se administrará medicación anticolinérgica. Se debe mantener una supervisión y un control estrictos hasta que el paciente se recupere.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicolépticos, otros antipsicóticos. Código ATC: N05AX13 Xeplion contiene una mezcla racémica de paliperidona (+) y (-).
Mecanismo de acción
Paliperidona es un agente bloqueante selectivo de los efectos de las monoaminas, cuyas propiedades farmacológicas son diferentes de las de los neurolépticos tradicionales. Paliperidona se une firmemente a los receptores serotoninérgicos 5-HT2 y dopaminérgicos D2. Paliperidona también bloquea los receptores adrenérgicos alfa1 y bloquea, en menor medida, los receptores histaminérgicos H1 y los adrenérgicos alfa2. La actividad farmacológica de los enantiómeros (+) y (-) de paliperidona es similar desde el punto de vista cualitativo y cuantitativo.
Paliperidona no se une a los receptores colinérgicos. Aunque paliperidona es un antagonista D2 potente, motivo por el que se cree que alivia los síntomas positivos de la esquizofrenia, produce menos catalepsia y reduce las funciones motrices en menor medida que los neurolépticos tradicionales. La preponderancia del antagonismo central de la serotonina puede reducir la tendencia de paliperidona a producir efectos secundarios extrapiramidales.
Eficacia clínica
Tratamiento agudo de la esquizofrenia
La eficacia de Xeplion en el tratamiento agudo de la esquizofrenia fue establecida en cuatro ensayos doble ciego, aleatorizados, controlados con placebo, de dosis fija, a corto plazo (uno de 9 semanas y tres de 13 semanas de duración) en pacientes adultos ingresados con recidiva aguda que cumplían los criterios para la esquizofrenia del DSM-IV. Las dosis fijas de Xeplion en estos estudios se administraron en los días 1, 8, y 36 en el estudio de 9 semanas de duración, y, además, el día 64 en los estudios de 13 semanas de duración. No fue necesario administrar suplementos antipsicóticos orales adicionales durante el tratamiento agudo de la esquizofrenia con Xeplion. El criterio principal de eficacia del estudio se definió como una reducción de las puntuaciones totales de la Escala de los Síndromes Positivo y Negativo (PANSS), como se muestra en la siguiente tabla. La PANSS es un inventario multi-elemento validado compuesto por cinco factores destinados a evaluar los síntomas positivos, los síntomas negativos, el pensamiento desorganizado, la hostilidad/excitación incontrolada y la ansiedad/depresión. La función se evaluó mediante la escala de Funcionamiento Personal y Social (PSP). La PSP es una escala homologada que mide la capacidad del paciente para desempeñar sus actividades personales y sociales en cuatro áreas del comportamiento: las actividades socialmente útiles (incluidos el trabajo y el estudio), las relaciones personales y sociales, el cuidado personal y los comportamientos disruptivos y agresivos.
En un estudio de 13 semanas de duración (n = 636) que comparó tres dosis fijas de Xeplion (inyección inicial en el deltoides de 150 mg seguida por tres dosis en el glúteo o en el deltoides de cualquiera de 25 mg/4 semanas, 100 mg/4 semanas o 150 mg/4 semanas) con placebo, las tres dosis de Xeplion fueron superiores a placebo en términos de la mejoría de la puntuación total de la PANSS. En este estudio, tanto los grupos de tratamiento con 100 mg/4 semanas como con 150 mg/4 semanas, pero no el 25 mg/4 semanas, demostraron una superioridad estadística respecto a placebo en cuanto a la puntuación de PSP. Estos resultados respaldan la eficacia a lo largo de toda la duración del tratamiento y la mejoría de la PANSS, que se observaron ya en el día 4, con una separación significativa respecto a placebo en los grupos tratados con 25 mg y 150 mg de Xeplion en el día 8.
Los resultados de los otros estudios arrojaron resultados estadísticamente significativos a favor de Xeplion, a excepción de la dosis de 50 mg en un estudio (ver tabla siguiente).
|
Puntuación total de la escala de los síndromes positivo y negativo de la esquizofrenia (PANSS). Variación entre el momento basal y el final del estudio-LOCF para los estudios R092670-SCH-201, R092670-PSY-3003, R092670-PSY-3004 y R092670-PSY-3007: Grupo de análisis del criterio principal de valoración de la eficacia | |||||
|
Placebo |
25 mg |
50 mg |
100 mg |
150 mg | |
|
R092670-PSY-3007* Media basal (DE) Variación media (DE) Valor p (frente a placebo) |
n = 160 86,8 (10,31) -2,9 (19,26) |
n = 155 86,9 (11,99) -8,0 (19,90) 0,034 |
-- |
n = 161 86,2 (10,77) -11,6 (17,63) <0,001 |
n = 160 88,4 (11,70) -13,2 (18,48) <0,001 |
|
R092670-PSY-3003 Media basal (DE) Variación media (DE) Valor p (frente a placebo) |
n = 132 92,4 (12,55) -4,1 (21,01) |
-- |
n = 93 89,9 (10,78) -7,9 (18,71) 0,193 |
n = 94 90,1 (11,66) -11,0 (19,06) 0,019 |
n = 30 92,2 (11,72) -5,5 (19,78) |
|
R092670-PSY-3004 Media basal (DE) Variación media (DE) Valor p (frente a placebo) |
n = 125 90,7 (12,22) -7,0 (20,07) |
n = 129 90,7 (12,25) -13,6 (21,45) 0,015 |
n = 128 91,2 (12,02) -13,2 (20,14) 0,017 |
n = 131 90,8 (11,70) -16,1 (20,36) <0,001 |
-- |
|
R092670-SCH-201 Media basal (DE) Variación media (DE) Valor p (frente a placebo) |
n=66 87,8 (13,90) 6,2 (18,25) |
-- |
n=63 88,0 (12,39) -5,2 (21,52) 0,001 |
n=68 85,2 (11,09) -7,8 (19,40) <0,0001 |
-- |
*En el estudio R092670-PSY-3007, se administró una dosis de iniciación de 150 mg a todos los sujetos de los grupos de tratamiento con Xeplion el día 1 y, a partir de entonces, la dosis asignada.
Nota: un cambio negativo de la puntuación denota mejoría.
Mantenimiento del control de los síntomas y retraso de la recidiva de la esquizofrenia La eficacia de Xeplion en el mantenimiento del control de los síntomas y el retraso de la recidiva de la esquizofrenia se determinó en un estudio doble ciego, controlado con placebo, de dosis flexible, con un plazo más largo, en el que participaron 849 sujetos adultos no ancianos que cumplían los criterios para la esquizofrenia del DSM-IV. Este estudio incluyó un tratamiento abierto agudo de 33 semanas de duración y una fase de estabilización, una fase aleatorizada, doble ciego, controlada con placebo para observar la recidiva, y un período de extensión abierto de 52 semanas. En este estudio, las dosis de Xeplion fueron 25, 50, 75 y 100 mg administrados mensualmente; la dosis de 75 mg solamente estaba permitida en la extensión abierta de 52 semanas. Inicialmente, los sujetos recibieron dosis flexibles (25-100 mg) de Xeplion durante un período de transición de 9 semanas de duración, seguido de un período de mantenimiento de 24 semanas, en el que los sujetos debían tener una puntuación PANSS < 75. Los ajustes de la dosis solo se permitieron en las primeras 12 semanas del período de mantenimiento. Se realizó la asignación aleatoria de un total de 410 pacientes estabilizados a Xeplion (mediana de la duración de 171 días [intervalo de 1 día a 407 días]) o a placebo (mediana de la duración de 105 días [intervalo de 8 días a 441 días]) hasta que experimentaran una recidiva de los síntomas de la esquizofrenia en la fase doble ciego de duración variable. El ensayo se suspendió antes de tiempo por motivos de eficacia, dado que se observó un tiempo significativamente más largo hasta la recidiva (p < 0,0001, Figura 1) en los pacientes tratados con Xeplion en comparación con el placebo (cociente de riesgos = 4,32; IC 95%: 2,4-7,7).
80 -
£
60 -
o
1)
¡3
40 -
c
u
o
—
u
Plh
|
20 - |
....... Placebo N=156 (3) |
Log-rank test, P-value<0.0001 (5) | ||
|
--XEPLION N=156 (4) | ||||
t3
1)
w
0
-1-1-1-1-1-1-1-1-1-1-1-1-1-1-1
20 40 60 80 100 120 140 160 180 200 220 240 260 280 300
Days since Randomisation (2)
Figura 1: Gráfico de Kaplan-Meier del tiempo hasta la recidiva. Análisis intermedio (grupo de análisis intermedio por intención de tratar)
(1) Porcentaje estimado de sujetos sin recidiva
(2) Días desde la aleatorización
(3) Placebo N= 156
(4) Xeplion N= 156
(5) Test de rangos logarítmicos, valor p < 0,0001 Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Xeplion en los diferentes grupos de la población pediátrica en esquizofrenia. Ver sección 4.2 para consultar la información sobre el uso en población pediátrica.
5.2 Propiedades farmacocinéticas
Absorción y distribución
Palmitato de paliperidona es el profármaco en forma de éster de palmitato de la paliperidona. Debido a su hidrosolubilidad extremadamente baja, el palmitato de la paliperidona se disuelve lentamente después de la inyección intramuscular antes de ser hidrolizado a paliperidona y se absorbe en la circulación sistémica. Después de una dosis única por vía intramuscular, las concentraciones plasmáticas de paliperidona se elevan gradualmente hasta alcanzar las concentraciones plasmáticas máximas a una mediana de Tmax de 13 días. La liberación de la sustancia activa se inicia desde el día 1 y tiene una duración de al menos 4 meses.
Después de la inyección intramuscular de dosis únicas (de 25 mg a 150 mg) en el músculo deltoides, en promedio, se observó una Cmax un 28% superior en comparación con la inyección en el músculo glúteo. Las dos inyecciones iniciales intramusculares en el deltoides de 150 mg el día 1 y 100 mg en el día 8 contribuyen a alcanzar concentraciones terapéuticas rápidamente. El perfil de liberación y el régimen de dosificación de Xeplion se traducen en concentraciones terapéuticas mantenidas. La exposición total de paliperidona tras la administración de Xeplion fue proporcional a la dosis en un rango de dosis de 25 mg a 150 mg, y menos que proporcional a la dosis en el caso de la Cmax para dosis superiores a 50 mg. El promedio del pico en el estado estacionario: a través del ratio para una dosis de 100 mg de Xeplion fue de 1,8 después de la administración en el glúteo y de 2,2 después de la administración en el deltoides. La mediana de la vida media aparente de paliperidona tras la administración de Xeplion a lo largo del rango de dosis de 25 mg a 150 mg osciló entre 25 y 49 días.
La biodisponibilidad absoluta del palmitato de paliperidona tras la administración de Xeplion es del 100%.
Tras la administración de palmitato de paliperidona, los enantiómeros (+) y (-) de paliperidona se interconvierten, de modo que se alcanza un cociente de AUC (+) a (-) de aproximadamente 1,6-1,8.
La unión a proteínas plasmáticas de paliperidona racémica es del 74%.
Biotransformación y eliminación
Una semana después de la administración de una sola dosis oral de 1 mg de paliperidona de liberación inmediata marcada con C14, el 59% de la dosis fue eliminada intacta por la orina, lo que indica que paliperidona no experimenta un intenso metabolismo por el hígado. Se recuperó aproximadamente el 80% de la radiactividad administrada en la orina y el 11% en las heces. Se han identificado cuatro vías metabólicas in vivo, ninguna de las cuales representó más del 6,5% de la dosis: desalquilación, hidroxilación, deshidrogenación y escisión de benzisoxazol. Aunque en estudios in vitro se señaló que las enzimas CYP2D6 y CYP3A4 pueden intervenir en el metabolismo de paliperidona, no hay datos in vivo que demuestren que estas isoenzimas desempeñen un papel significativo en el metabolismo de paliperidona. En los análisis de farmacocinética de la población no se observó ninguna diferencia apreciable del aclaramiento aparente de paliperidona tras la administración de paliperidona oral entre los metabolizadores rápidos y lentos de los sustratos de la CYP2D6. En estudios in vitro realizados con microsomas hepáticos humanos se demostró que la paliperidona no inhibe sustancialmente el metabolismo de los medicamentos metabolizados por las isoenzimas del citocromo P450, como CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5.
En estudios in vitro se ha demostrado que paliperidona es un sustrato de la P-gp y un inhibidor débil de la P-gp a altas concentraciones. No existen datos de estudios in vivo y se desconoce la importancia clínica.
Inyección de palmitato de paliperidona de acción prolongada en comparación con paliperidona oral de liberación prolongada
Xeplion está diseñado para liberar paliperidona a lo largo de un período mensual, mientras que la paliperidona oral de liberación prolongada se administra a diario. El régimen de iniciación de Xeplion (150 mg/100 mg en el músculo deltoides en el día 1 /día 8) ha sido diseñado para alcanzar rápidamente las concentraciones de estado estacionario de paliperidona al iniciar el tratamiento sin necesidad de administrar suplementos orales.
En términos generales, los niveles plasmáticos globales de iniciación con Xeplion se encontraron dentro del intervalo de exposición observado con entre 6 y 12 mg de paliperidona oral de liberación prolongada. El uso del régimen de iniciación de Xeplion permitió a los pacientes permanecer dentro de este margen de exposición de entre 6 y 12 mg de paliperidona oral de liberación prolongada incluso en los días de concentración mínima previos a la dosis (días 8 y 36). Debido a la diferencia en la mediana de los perfiles farmacocinéticos entre los dos medicamentos, se debe tener precaución al realizar una comparación directa de sus propiedades farmacocinéticas.
Insuficiencia hepática
Paliperidona no se metaboliza ampliamente en el hígado. Aunque Xeplion no se ha estudiado en pacientes con insuficiencia hepática, no es preciso ajustar las dosis en los pacientes con insuficiencia hepática leve o moderada. En un estudio con paliperidona oral en pacientes con insuficiencia hepática moderada (Child-Pugh clase B), las concentraciones plasmáticas de paliperidona libre fueron similares a los de individuos sanos. Paliperidona no se ha estudiado en pacientes con insuficiencia hepática grave.
Insuficiencia renal
La eliminación de una sola dosis de un comprimido de 3 mg de paliperidona de liberación prolongada se estudió en sujetos con diversos grados de función renal. La eliminación de la paliperidona disminuye si lo hace el aclaramiento de creatinina estimado. El aclaramiento total de la paliperidona disminuyó un promedio del 32% en sujetos con insuficiencia renal leve (CrCl = 50 a <80 ml/min), un 64% en sujetos con insuficiencia renal moderada (CrCl = 30 a <50 ml/min) y un 71% en sujetos con insuficiencia renal grave (CrCl =10 a <30 ml/min), lo que corresponde con un aumento promedio de la exposición (AUCinf) de 1,5, 2,6 y 4,8 veces, respectivamente, en comparación con los sujetos sanos. Sobre la base del número limitado de observaciones con Xeplion en sujetos con insuficiencia renal leve y de los resultados de las simulaciones farmacocinéticas, se recomienda administrar una dosis reducida (ver sección 4.2).
Población de edad avanzada
No se recomienda ajustar la dosis únicamente en función de la edad. Sin embargo, puede ser necesario realizar el ajuste de la dosis debido a las disminuciones en el aclaramiento de creatinina relacionadas con la edad (ver Insuficiencia renal más arriba y la sección 4.2).
Peso
Los estudios farmacocinéticos con palmitato de paliperidona han demostrado unas concentraciones plasmáticas de paliperidona algo menores (entre el 10% y el 20%) en pacientes con sobrepeso u obesidad en comparación con los pacientes con un peso normal (ver sección 4.2).
Raza
En el análisis farmacocinético de los datos de la población procedentes de los ensayos con paliperidona oral, no se observaron indicios de que existan diferencias relacionadas con la raza en la farmacocinética de la paliperidona tras la administración de Xeplion.
Sexo
No se han observado diferencias clínicamente significativas entre hombres y mujeres.
Tabaquismo
Según estudios in vitro realizados con enzimas hepáticas humanas, paliperidona no es sustrato de la CYP1A2; por lo tanto, el consumo de tabaco no debería afectar a la farmacocinética de paliperidona. Un análisis farmacocinético de la población basado en los datos obtenidos con comprimidos orales de paliperidona de liberación prolongada mostró una exposición ligeramente más baja a paliperidona en fumadores en comparación con los no fumadores. No obstante, se cree que es poco probable que la diferencia tenga relevancia clínica. No se evaluó el tabaquismo con Xeplion.
5.3 Datos preclínicos sobre seguridad
Los estudios de toxicidad a dosis repetidas de palmitato de paliperidona inyectado por vía intramuscular y paliperidona administrada por vía oral en ratas y perros mostraron efectos principalmente farmacológicos, como sedación y efectos mediados por la prolactina, en las glándulas mamarias y en los genitales. En los animales tratados con palmitato de paliperidona, se observó una reacción inflamatoria en el lugar de la inyección intramuscular. Se produjo la formación ocasional de abscesos.
En estudios sobre la reproducción de las ratas utilizando risperidona oral, que se convierte masivamente a paliperidona en ratas y en seres humanos, se observaron efectos adversos en el peso al nacer y de la supervivencia de las crías. No se observó embriotoxicidad ni malformaciones tras la administración intramuscular de palmitato de paliperidona a ratas preñadas a la dosis más alta (160 mg/kg/día), correspondiente a 4,1 veces el nivel de exposición en humanos a la dosis máxima recomendada de 150 mg. Otros antagonistas de la dopamina han tenido efectos negativos en el desarrollo motor y del aprendizaje en las crías cuando se administraron a animales preñados.
Palmitato de paliperidona y paliperidona no fueron genotóxicos. En estudios sobre el poder carcinógeno de risperidona oral en ratas y ratones se observaron aumentos de los adenomas hipofisarios (ratón), de los adenomas del páncreas endocrino (rata) y los de adenomas de las glándulas mamarias (en ambas especies). Se evaluó el potencial carcinogénico de palmitato de paliperidona inyectado por vía intramuscular en ratas. Se constató un aumento estadísticamente significativo en los adenocarcinomas de las glándulas mamarias en las ratas hembras a dosis de 10, 30 y 60 mg/kg/mes. Las ratas macho mostraron un aumento estadísticamente significativo de los adenomas y carcinomas de las glándulas mamarias a las dosis de 30 y 60 mg/kg/mes, que equivalen a 1,2 y 2,2 veces el nivel de exposición en humanos a la dosis máxima recomendada de 150 mg. Estos tumores pueden estar relacionados con el antagonismo prolongado de la dopamina D2 y con la hiperprolactinemia. Se desconoce la trascendencia de estos hallazgos tumorales en roedores para el riesgo en seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polisorbato 20 Polietilenglicol 4000 Ácido cítrico monohidrato Fosfato ácido disódico anhidro
Fosfato diácido de sodio monohidratado Hidróxido de sodio (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez
2 años
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Jeringa precargada (cídico-olefina-copolímero) con un tapón de tipo émbolo, tope trasero y un protector para la punta (goma de bromobutilo) con una aguja de seguridad del calibre 22 de 1% pulgadas (0,72 mm x 38,1 mm) y una aguja de seguridad del calibre 23 de 1 pulgada (0,64 mm x 25,4 mm).
Tamaños de envase:
El envase contiene 1 jeringa precargada y 2 agujas
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/001 (25 mg)
EU/1/11/672/002 (50 mg)
EU/1/11/672/003 (75 mg)
EU/1/11/672/004 (100 mg)
EU/1/11/672/005 (150 mg)
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 04 de marzo de 2011 Fecha de la última revalidación: 16 de diciembre de 2015
DD/mes/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Xeplion 150 mg y Xeplion 100 mg suspensión inyectable de liberación prolongada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada jeringa precargada contiene 234 mg de palmitato de paliperidona equivalentes a 150 mg de paliperidona.
Cada jeringa precargada contiene 156 mg de palmitato de paliperidona equivalentes a 100 mg de paliperidona.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión inyectable de liberación prolongada.
La suspensión es de color blanco a blanquecino. La suspensión tiene un pH neutro (aproximadamente 7,0).
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Xeplion está indicado para el tratamiento de mantenimiento de la esquizofrenia en pacientes adultos estabilizados con paliperidona o risperidona.
En determinados pacientes adultos con esquizofrenia y respuesta previa a paliperidona o risperidona oral, Xeplion puede ser utilizado sin necesidad de estabilización previa con tratamiento oral si los síntomas psicóticos son leves o moderados y es necesario un tratamiento con un inyectable de acción prolongada.
4.2 Posología y forma de administración
Posología
Se recomienda iniciar Xeplion con una dosis de 150 mg en el día 1 de tratamiento y 100 mg una semana después (día 8), ambos administrados en el músculo deltoides para alcanzar concentraciones terapéuticas rápidamente (ver sección 5.2). La tercera dosis se debe administrar un mes después de la segunda dosis de inicio. La dosis de mantenimiento mensual recomendada es de 75 mg; algunos pacientes pueden beneficiarse de dosis inferiores o superiores dentro del rango recomendado de 25 a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente. Los pacientes con sobrepeso u obesos pueden requerir dosis situadas en la parte superior del intervalo (ver sección 5.2). Después de la segunda dosis de inicio, las dosis de mantenimiento mensuales se pueden administrar tanto en el músculo deltoides como en el glúteo.
El ajuste de la dosis de mantenimiento se puede hacer mensualmente. Al realizar ajustes de la dosis, se deben tener en cuenta las características de liberación prolongada de Xeplion (ver sección 5.2), dado que el pleno efecto de las dosis de mantenimiento puede no resultar evidente durante varios meses.
Cambio desde paliperidona oral o risperidona oral
El tratamiento recibido previamente con paliperidona oral o risperidona oral puede ser interrumpido en el momento de iniciar el tratamiento con Xeplion. Algunos pacientes se pueden beneficiar de una retirada gradual. Xeplion debe iniciarse según se describe al principio de la sección 4.2 anterior.
Al realizar el cambio de tratamiento de los pacientes desde risperidona inyectable de acción prolongada, inicie el tratamiento con Xeplion en lugar de la siguiente inyección programada. A partir de entonces, Xeplion se debe continuar en intervalos mensuales. No es necesario seguir el régimen de dosificación inicial de una semana incluyendo las inyecciones intramusculares (día 1 y 8, respectivamente) según se describe en la sección 4.2 anterior. Los pacientes previamente estabilizados con diferentes dosis de risperidona inyectable de acción prolongada pueden alcanzar una exposición similar a paliperidona en estado estacionario durante el tratamiento de mantenimiento con dosis mensuales de Xeplion según se describe a continuación:
Dosis de risperidona inyectable de acción prolongada y Xeplion necesaria para alcanzar una exposición a paliperidona similar en estado estacionario
|
Dosis previa de risperidona inyectable de acción prolongada |
Inyección de Xeplion |
|
25 mg cada 2 semanas |
50 mg mensualmente |
|
37,5 mg cada 2 semanas |
75 mg mensualmente |
|
50 mg cada 2 semanas |
100 mg mensualmente |
La interrupción de los medicamentos antipsicóticos debe realizarse de acuerdo a una apropiada información de prescripción. En caso de interrupción de Xeplion, se deben considerar sus características de liberación prolongada. Se ha de reevaluar periódicamente la necesidad de continuar con la administración de los medicamentos actuales para el tratamiento de los síntomas extrapiramidales (SEP).
Dosis omitidas
Medidas para evitar la omisión de dosis
Se recomienda que la segunda dosis de iniciación de Xeplion se administre una semana después de la primera dosis. Para evitar la omisión de esta dosis, los pacientes pueden recibir la segunda dosis 4 días antes o después del momento de administración semanal (día 8). Del mismo modo, se recomienda administrar mensualmente la tercera inyección y las siguientes después del régimen de iniciación. Para evitar la omisión de la dosis mensual, los pacientes pueden recibir la inyección hasta 7 días antes o después del momento de administración mensual.
Si se omite la fecha límite para la segunda inyección de Xeplion (día 8 ± 4 días), el momento de reinicio recomendado depende del tiempo que haya transcurrido desde la primera inyección del paciente.
Omisión de la segunda dosis de iniciación (<4 semanas desde la primera inyección)
Si han transcurrido menos de 4 semanas desde la primera inyección, se le debe administrar al paciente la segunda inyección de 100 mg en el músculo deltoides tan pronto como sea posible. Se debe administrar una tercera inyección de Xeplion de 75 mg en el músculo deltoides o en el glúteo 5 semanas después de la primera inyección (independientemente del momento en el que se haya administrado la segunda inyección). A partir de entonces, se debe seguir el ciclo normal de inyecciones mensuales, ya sea en el músculo deltoides o en el glúteo, de 25 mg a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente.
Omisión de la segunda dosis de iniciación (entre 4 y 7 semanas desde la primera inyección)
Si han transcurrido entre 4 y 7 semanas desde la primera inyección de Xeplion, reanude la administración con dos inyecciones de 100 mg de la siguiente manera:
1. una inyección en el deltoides tan pronto como sea posible,
2. otra inyección en el deltoides una semana más tarde,
3. reanudación del ciclo normal de inyecciones mensuales, ya sea en el músculo deltoides o en el glúteo, de 25 mg a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente.
Omisión de la segunda dosis de iniciación (>7 semanas desde la primera inyección)
Si han transcurrido más de 7 semanas desde la primera inyección de Xeplion, inicie la administración según las pautas recomendadas para la iniciación de Xeplion recogidas anteriormente.
Omisión de la dosis de mantenimiento mensual (1 mes a 6 semanas)
Tras la iniciación, el ciclo de inyección recomendado de Xeplion es mensual. Si han transcurrido menos de 6 semanas desde la última inyección, entonces se debe administrar la dosis previamente estabilizada tan pronto como sea posible, seguida de inyecciones a intervalos mensuales.
Omisión de la dosis de mantenimiento mensual (> 6 semanas a 6 meses)
Si han transcurrido más de 6 semanas desde la última inyección de Xeplion, la recomendación es la siguiente:
Para los pacientes estabilizados con dosis de 25 a 100 mg
1. una inyección en el deltoides tan pronto como sea posible, de la misma dosis en la que el paciente se estabilizó previamente
2. otra inyección en el deltoides (misma dosis) una semana más tarde (día 8)
3. reanudación del ciclo normal de inyecciones mensuales, ya sea en el músculo deltoides o en el
glúteo, de 25 mg a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente
Para los pacientes estabilizados con 150 mg
1. una inyección en el deltoides tan pronto como sea posible, de una dosis de 100 mg
2. otra inyección en el deltoides una semana más tarde (día 8) de una dosis de 100 mg
3. reanudación del ciclo normal de inyecciones mensuales, ya sea en el músculo deltoides o en el
glúteo, de 25 mg a 150 mg en función de la tolerabilidad y/o eficacia individual del paciente
Omisión de la dosis de mantenimiento mensual (> 6 meses)
Si han transcurrido más de 6 meses desde la última inyección de Xeplion, inicie la administración según las pautas recomendadas para la iniciación de Xeplion recogidas anteriormente.
Poblaciones especiales
Población de edad avanzada
No se ha establecido la eficacia y la seguridad en la población de edad avanzada > 65 años.
En general, la dosis recomendada de Xeplion en los pacientes de edad avanzada con función renal normal es la misma que para los pacientes adultos más jóvenes con función renal normal. Sin embargo, ya que los pacientes de edad avanzada pueden tener disminuida la función renal, puede ser necesario ajustar la dosis (ver Insuficiencia renal más adelante para conocer las recomendaciones de dosificación en pacientes con insuficiencia renal).
Insuficiencia renal
No se ha estudiado Xeplion sistemáticamente en los pacientes con insuficiencia renal (ver sección 5.2). En los pacientes con insuficiencia renal leve (aclaramiento de creatinina > 50 a < 80 ml/min), se recomienda iniciar Xeplion con una dosis de 100 mg el día 1 del tratamiento y 75 mg una semana después, ambos administrados en el músculo deltoides. La dosis de mantenimiento mensual recomendada es de 50 mg con un rango de 25 a 100 mg, en función de la tolerabilidad y/o eficacia individual del paciente.
Xeplion no está recomendado en pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina < 50 ml/min) (ver sección 4.4).
Insuficiencia hepática
Basándose en la experiencia con paliperidona oral, no es preciso ajustar las dosis en los pacientes con insuficiencia hepática leve o moderada. Dado que paliperidona no se ha estudiado en pacientes con insuficiencia hepática grave, se recomienda precaución en estos pacientes.
Población pediátrica
No se ha establecido la seguridad y la eficacia de Xeplion en niños y adolescentes <18 años de edad. No hay datos disponibles.
Forma de administración
Xeplion se utiliza únicamente para uso intramuscular. Se debe inyectar lentamente, profundamente en el músculo. Cada inyección debe ser administrada por un profesional sanitario. La administración debe realizarse en una sola inyección. La dosis no se debe administrar en inyecciones divididas. La dosis no se debe administrar por vía intravascular o subcutánea.
Las dosis de iniciación del día 1 y del día 8 se deben administrar ambas en el músculo deltoides para alcanzar concentraciones terapéuticas rápidamente (ver sección 5.2). Después de la segunda dosis de inicio, las dosis de mantenimiento mensuales se pueden administrar tanto en el músculo deltoides como en el glúteo. Se debe cambiar del glúteo al deltoides (y viceversa) en caso de dolor en el lugar de inyección si no se tolera bien el malestar en el lugar de inyección (ver sección 4.8). También se recomienda alternar entre los lados izquierdo y derecho (ver más adelante).
Para consultar las instrucciones de uso y manipulación de Xeplion, ver prospecto (información destinada únicamente a médicos o profesionales del sector sanitario).
Administración en el músculo deltoides
El tamaño de la aguja recomendado para la administración inicial y de mantenimiento de Xeplion en el músculo deltoides viene determinada por el peso del paciente. En los pacientes > 90 kg, se recomienda la aguja de calibre 22 de 1% pulgadas (38,1 mm x 0,72 mm). En los pacientes < 90 kg, se recomienda la aguja de calibre 23 de 1 pulgada (25,4 mm x 0,64 mm). Las inyecciones en el deltoides se deben alternar entre los dos músculos deltoides.
Administración en el músculo glúteo
El tamaño de la aguja recomendado para la administración de mantenimiento de Xeplion en el músculo glúteo es el de una aguja de calibre 22 de 1% pulgadas (38,1 mm x 0,72 mm). La administración se debe realizar en el cuadrante superior externo de la zona glútea. Las inyecciones en el glúteo se deben alternar entre los dos músculos glúteos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a risperidona o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Uso en pacientes que se encuentran en un estado sumamente agitado o psicótico grave
Xeplion no se debe utilizar para el tratamiento de estados agitados agudos o psicóticos graves cuando esté justificado el control inmediato de los síntomas.
Intervalo QT
Se debe tener precaución al recetar paliperidona a pacientes con enfermedad cardiovascular conocida o antecedentes familiares de prolongación del intervalo QT, y en caso de uso concomitante con otros medicamentos que prolonguen el intervalo QT.
Síndrome neuroléptico maligno
Se han notificado casos del Síndrome Neuroléptico Maligno (SNM), que se caracteriza por hipertermia, rigidez muscular, inestabilidad autonómica, alteración de la consciencia y elevación de los niveles séricos de creatina fosfocinasa relacionados con paliperidona. Otros signos clínicos pueden ser mioglobinuria (rabdomiólisis) e insuficiencia renal aguda. Si un paciente desarrolla signos o síntomas indicativos del SNM, se debe interrumpir la administración de todos los antipsicóticos, incluido paliperidona.
Discinesia tardía
Los medicamentos con propiedades antagonistas del receptor de la dopamina se han asociado con la inducción de discinesia tardía, caracterizada por movimientos rítmicos involuntarios, predominantemente de la lengua y/o la cara. Si aparecen signos y síntomas de discinesia tardía, se debe considerar la interrupción de la administración de todos los antipsicóticos, incluido paliperidona.
Leucopenia, neutropenia y agranulocitosis
Se han notificado casos de leucopenia, neutropenia y agranulocitosis con Xeplion. La agranulocitosis ha sido notificada en muy raras ocasiones (<1/10.000 pacientes) durante la experiencia postcomercialización. Pacientes con un historial de un bajo recuento de glóbulos blancos clínicamente significativo (GB) o una leucopenia/neutropenia inducida por el medicamento deben ser monitorizados durante los primeros meses de tratamiento y se considerará discontinuar el tratamiento con Xeplion si aparecen los primeros signos de disminución clínicamente significativa de GB, en ausencia de otros factores causales. Pacientes con neutropenia clínicamente significativa deben ser cuidadosamente monitorizados por la fiebre u otros síntomas o signos de infección y se deben tratar inmediatamente en caso de aparecer estos síntomas o signos. En pacientes con neutropenia grave (recuento total de neutrófilos <1x109/L) se debe discontinuar el tratamiento con Xeplion y controlar los niveles de GB hasta la recuperación.
Reacciones de hipersensibilidad
Durante la experiencia pos-comercialización se han notificado raramente reacciones anafilácticas en pacientes que previamente han tolerado risperidona oral y paliperidona oral (ver las secciones 4.1 y 4.8).
Si ocurren reacciones de hipersensibilidad, interrumpir el tratamiento con Xeplion, iniciar medidas generales de soporte clínicamente apropiadas y vigilar al paciente hasta que los signos y síntomas se resuelvan (ver las secciones 4.3 y 4.8).
Hiperglucemia y diabetes mellitus
Se ha notificado hiperglucemia, diabetes mellitus y exacerbación de diabetes pre-existente durante el tratamiento con paliperidona. En algunos casos, se ha notificado un aumento de peso previo que puede ser un factor de predisposición. Se ha notificado en muy raras ocasiones la asociación con cetoacidosis y en raras ocasiones con coma diabético. Se recomienda una monitorización clínica adecuada de acuerdo con las guías antispicóticas utilizadas. A los pacientes tratados con antipsicóticos atípicos, incluido Xeplion, se les deben monitorizar los síntomas de la hiperglucemia (tales como polidipsia, poliuria, polifagia y debilidad) y a los pacientes con diabetes mellitus se les debe monitorizar regularmente el empeoramiento del control de glucosa.
Aumento de peso
Se ha notificado un aumento de peso significativo con el uso de Xeplion. El peso debe controlarse regularmente.
Hiperprolactinemia
Los estudios de cultivo de tejidos sugieren que la prolactina puede estimular el crecimiento de células en los tumores de mama humanos. Aunque hasta ahora los estudios clínicos y epidemiológicos no han demostrado la existencia de una asociación clara con la administración de antipsicóticos, se recomienda precaución en pacientes con antecedentes patológicos de interés. Paliperidona debe utilizarse con precaución en pacientes con posibles tumores dependientes de prolactina.
Hipotensión ortostática
Paliperidona puede inducir hipotensión ortostática en algunos pacientes sobre la base de su actividad alfa-bloqueante.
Según los datos agrupados de los tres ensayos controlados con placebo, de dosis fijas y 6 semanas de duración con comprimidos orales de paliperidona de liberación prolongada (3, 6, 9 y 12 mg), el 2,5% de los pacientes tratados con paliperidona oral comunicaron hipotensión ortostática, en comparación con el 0,8% de los sujetos tratados con placebo. Xeplion debe utilizarse con precaución en pacientes con enfermedad cardiovascular conocida (p. ej., insuficiencia cardíaca, infarto de miocardio o isquemia, trastornos de la conducción), enfermedad cerebrovascular o afecciones que predispongan al paciente a la hipotensión (p. ej. deshidratación e hipovolemia).
Convulsiones
Xeplion debe utilizarse con precaución en pacientes con antecedentes de convulsiones u otros trastornos que potencialmente puedan reducir el umbral convulsivo.
Insuficiencia renal
Las concentraciones plasmáticas de paliperidona aumentan en pacientes con insuficiencia renal y por tanto, se recomienda un ajuste de la dosis en pacientes con insuficiencia renal leve. Xeplion no está recomendado en pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina <
50 ml/min) (ver secciones 4.2 y 5.2).
Insuficiencia hepática
No se dispone de datos en pacientes con insuficiencia hepática grave (clase C de Child-Pugh). Se recomienda precaución si se utiliza paliperidona en dichos pacientes.
Pacientes de edad avanzada con demencia
No se ha estudiado Xeplion en pacientes de edad avanzada con demencia. Xeplion se debe utilizar con precaución en pacientes de edad avanzada con demencia y con factores de riesgo de padecer ictus.
La experiencia con risperidona citada más adelante se considera válida también para paliperidona.
Mortalidad global
En un metanálisis de 17 ensayos clínicos controlados, los pacientes de edad avanzada con demencia tratados con otros antipsicóticos atípicos, tales como risperidona, aripiprazol, olanzapina y quetiapina, tenían un mayor riesgo de mortalidad en comparación con placebo. Entre los pacientes tratados con risperidona, la mortalidad fue del 4% frente al 3,1% con placebo.
Reacciones adversas cerebrovasculares
Se ha observado un aumento de aproximadamente 3 veces del riesgo de reacciones adversas cerebrovasculares en los ensayos clínicos aleatorizados controlados con placebo en la población con demencia al utilizar algunos antipsicóticos atípicos, tales como risperidona, aripiprazol y olanzapina.
Se desconoce el mecanismo de este aumento del riesgo.
Enfermedad de Parkinson y demencia con cuerpos de Lewy
Los médicos deben sopesar los riesgos y los beneficios de prescribir Xeplion a los pacientes con enfermedad de Parkinson o Demencia con Cuerpos de Lewy (DCL), ya que ambos grupos pueden tener mayor riesgo de padecer Síndrome Neuroléptico Maligno, así como tener una mayor sensibilidad a los antipsicóticos. Las manifestaciones de este aumento de la sensibilidad pueden incluir confusión, obnubilación, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
Priapismo
Se ha notificado que los medicamentos antipsicóticos (incluida risperidona) con efectos de bloqueo alfa adrenérgico inducen priapismo. Durante la vigilancia post-comercialización, también se han notificado casos de priapismo con paliperidona oral, que es el metabolito activo de risperidona. Se ha de informar a los pacientes de la necesidad de acudir al médico urgentemente en caso de que el priapismo no haya sido resuelto en el transcurso de 3 a 4 horas.
Regulación de la temperatura del organismo
Se ha atribuido a los medicamentos antipsicóticos la interrupción de la capacidad del organismo para reducir la temperatura corporal central. Se aconseja proceder con especial cautela cuando se prescriba Xeplion a pacientes que vayan a experimentar circunstancias que puedan contribuir a una elevación de la temperatura corporal central, p. ej. ejercicio físico intenso, exposición a calor extremo, que reciban medicamentos concomitantes con actividad anticolinérgica o que estén sujetos a deshidratación.
Tromboembolismo venoso
Se han notificado casos de tromboembolismo venoso (TEV) con medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos suelen presentar factores de riesgo adquiridos de TEV, se han de identificar todos los posibles factores de riesgo de TEV antes y durante el tratamiento con Xeplion y adoptar medidas preventivas.
Efecto antiemético
Se observó un efecto antiemético en los estudios preclínicos con paliperidona. Este efecto, si se produce en humanos, puede enmascarar los signos y síntomas de la sobredosis de determinados medicamentos o de enfermedades como la obstrucción intestinal, el síndrome de Reye y los tumores cerebrales.
Administración
Se debe tener cuidado para evitar la inyección involuntaria de Xeplion en un vaso sanguíneo. Síndrome del Iris Flácido Intraoperatorio
Se ha observado síndrome del iris flácido intraoperatorio (IFIS) durante la cirugía de cataratas en pacientes tratados con medicamentos con efecto antagonista alfa1a-adrenérgico, como Xeplion (ver sección 4.8).
El IFIS puede aumentar el riesgo de complicaciones oculares durante y después de la intervención. El oftalmólogo debe ser informado del uso actual o pasado de medicamentos con efecto antagonista alfa1a-adrenérgico antes de la cirugía. El beneficio potencial de la interrupción del tratamiento con bloqueantes alfal antes de la cirugía de cataratas no ha sido establecido y debe ser sopesado frente al riesgo de interrumpir el tratamiento antipsicótico.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se recomienda precaución al prescribir Xeplion con medicamentos que prolonguen el intervalo QT, p. ej. antiarrítmicos de clase IA (p. ej., quinidina, disopiramida) y antiarrítmicos de clase III (p. ej. amiodarona, sotalol), algunos antihistamínicos, algunos otros antipsicóticos y algunos antipalúdicos (p. ej. mefloquina). Esta lista es indicativa y no exhaustiva.
Posibilidad de que Xeplion afecte a otros medicamentos
No se espera que paliperidona produzca interacciones farmacocinéticas clínicamente relevantes con medicamentos que sean metabolizados por las isoenzimas del citocromo P-450.
Dado que los efectos principales de paliperidona se ejercen sobre el sistema nervioso central (SNC) (ver sección 4.8), Xeplion debe utilizarse con precaución en combinación con otros medicamentos de acción central, p. ej., ansiolíticos, la mayoría de los antipsicóticos, hipnóticos, opiáceos, etc. o con el alcohol.
Paliperidona puede antagonizar el efecto de levodopa y otros agonistas de dopamina. Si se considera necesario administrar esta combinación, sobre todo para la enfermedad de Parkinson terminal, se debe recetar la dosis mínima eficaz de cada tratamiento.
Debido a la posibilidad de que induzca hipotensión ortostática (ver sección 4.4), se puede observar un efecto aditivo si se administra Xeplion con otros tratamientos que también tengan esta posibilidad, p.ej., otros antipsicóticos, tricíclicos.
Se recomienda precaución cuando se coadministre paliperidona junto con otros medicamentos que disminuyan el umbral convulsivo (es decir, fenotiazinas o butirofenonas, tricíclicos o ISRS, tramadol, mefloquina, etc.).
La administración concomitante de comprimidos orales de paliperidona de liberación prolongada en estado estacionario (12 mg una vez al día) con comprimidos de divalproex sódico de liberación prolongada (de 500 mg a 2000 mg una vez al día) no afectó a la farmacocinética en estado estacionario de valproato.
No se ha realizado ningún estudio de interacción entre Xeplion y el litio, sin embargo, no es probable que se produzca una interacción farmacocinética.
Posibilidad de que otros medicamentos afecten a Xeplion
Los estudios in vitro indican que las enzimas CYP2D6 y CYP3A4 pueden tener una intervención mínima en el metabolismo de la paliperidona, pero no hay indicios in vitro ni in vivo de que esas isoenzimas desempeñen un papel significativo en el metabolismo de paliperidona. La administración conjunta de paliperidona oral con paroxetina, un potente inhibidor de la CYP2D6, no tuvo un efecto clínicamente significativo sobre la farmacocinética de paliperidona.
La administración concomitante de paliperidona oral de liberación prolongada una vez al día y carbamazepina 200 mg dos veces al día originó una disminución de aproximadamente un 37% de la media de la Cmax y del AUC en el estado estacionario de paliperidona. Esta disminución se debe en gran parte a un aumento de un 35% del aclaramiento renal de paliperidona, probablemente como resultado de la inducción de la P-gp renal por carbamazepina. Una disminución menor de la cantidad del principio activo inalterado excretado en la orina sugiere que durante la administración concomitante con carbamazepina, hubo un efecto mínimo en el metabolismo del CYP o en la biodisponibilidad de paliperidona. Con dosis más altas de carbamazepina, podrían aparecer disminuciones mayores de las concentraciones plasmáticas de paliperidona. Al inicio del tratamiento con carbamazepina, se debe reevaluar y aumentar la dosis de Xeplion, si es necesario. Por el contrario, en caso de interrupción del tratamiento con carbamazepina, se debe reevaluar y disminuir la dosis de Xeplion, si es necesario.
La administración concomitante de una sola dosis de un comprimido de paliperidona oral de liberación prolongada de 12 mg con comprimidos de divalproex sódico de liberación prolongada (dos comprimidos de 500 mg una vez al día) tuvo como resultado un aumento de aproximadamente el 50% en la Cmax y el AUC de paliperidona, probablemente como resultado de un aumento de la absorción oral. Dado que no se observó ningún efecto sobre el aclaramiento sistémico, no se espera que se produzca una interacción clínicamente significativa entre los comprimidos de divalproex sódico de liberación prolongada y la inyección intramuscular de Xeplion. Esta interacción no se ha estudiado con Xeplion.
Uso concomitante de Xeplion y risperidona o paliperidona oral
Debido a que paliperidona es el principal metabolito activo de risperidona, se debe tener precaución cuando Xeplion sea administrado de forma conjunta con risperidona o con paliperidona oral durante períodos prolongados de tiempo. Los datos de seguridad relacionados con el uso concomitante de Xeplion con otros antipsicóticos son limitados.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de paliperidona durante el embarazo. El palmitato de paliperidona inyectado por vía intramuscular y paliperidona administrada por vía oral no fueron teratógenos en estudios en animales, pero se observaron otros tipos de toxicidad reproductiva (ver sección 5.3). Los recién nacidos expuestos a paliperidona durante el tercer trimestre de embarazo están en peligro de sufrir reacciones adversas como síntomas extrapiramidales y/o síndromes de abstinencia que pueden variar en gravedad y duración tras la exposición. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias. Por consiguiente, se debe vigilar estrechamente a los recién nacidos. Xeplion no se debe utilizar durante el embarazo salvo que sea claramente necesario.
Lactancia
Paliperidona se excreta por la leche materna en tal medida que es probable que se produzcan efectos en el lactante si se administra en dosis terapéuticas a mujeres lactantes. Xeplion no debe utilizarse durante la lactancia.
Fertilidad
No se observaron efectos relevantes en estudios no clínicos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de paliperidona sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada debido a sus posibles efectos sobre el sistema nervioso y la vista, tales como sedación, somnolencia, síncope, visión borrosa (ver sección 4.8). Por tanto, se debe aconsejar a los pacientes que no conduzcan ni utilicen máquinas hasta conocer su sensibilidad individual a Xeplion.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas a medicamentos (RAMs) notificadas con más frecuencia en los ensayos clínicos fueron insomnio, cefalea, ansiedad, infección de las vías respiratorias altas, reacción en el
lugar de la inyección, parkinsonismo, aumento de peso, acatisia, agitación, sedación/somnolencia, náuseas, estreñimiento, mareos, dolor musculoesquelético, taquicardia, temblor, dolor abdominal, vómitos, diarrea, fatiga y distonía. De estas, la acatisia y la sedación/somnolencia parecían estar relacionadas con la dosis.
Tabla de reacciones adversas
A continuación se recogen todas las RAMs notificadas con paliperidona en función de la frecuencia estimada de ensayos clínicos llevados a cabo con Xeplion. Se aplican los siguientes términos y frecuencias: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1000 a < 1/100), raras (> 1/10.000 a < 1/1000), muy raras (< 1/10.000), y frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Sistema de clasificación de órganos |
Reacción adversa al medicamento | ||||
|
Frecuencia | |||||
|
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
No conocidas | |
|
Infecciones e infestaciones |
infección de las vías respiratorias superiores, infección del tracto urinario, gripe |
neumonía, bronquitis, infección del tracto respiratorio, sinusitis, cistitis, infección de oídos, infección de ojos, amigdalitis, celulitis, acarodermatitis, absceso subcutáneo |
onicomicosis | ||
|
Trastornos de la sangre y del sistema linfático |
disminución del recuento de glóbulos blancos, anemia, disminución del hematocrito, aumento del recuento de eosinófilos |
agranulocitosise, neutropenia, trombocitopenia | |||
|
Trastornos del sistema inmunológico |
hipersensibilidad |
reacción anafilácticae | |||
|
Trastornos endocrinos |
hiperprolacti- nemiaa |
secreción inapropiada de la hormona antidiurética |
presencia de glucosa en orina | ||
|
Trastornos del metabolismo y de la nutrición |
hiperglucemia, aumento de peso, disminución de peso, aumento de los triglicéridos en sangre |
diabetes mellitusc, hiperinsulinemia, aumento del apetito, anorexia, disminución del apetito, aumento del colesterol en sangre |
intoxicación por e agua , cetoacidosis diabéticae, hipoglucemia, polidipsia | ||
|
Trastornos psiquiátricos |
insomniod |
agitación, depresión, ansiedad |
trastorno del sueño, manía, estado de confusión, disminución de la líbido, nerviosismo, |
embotamiento afectivoe, anorgasmia | |
|
pesadillas | |||||
|
Trastornos del sistema nervioso |
cefalea |
parkinsonismo^ acatisiab, sedación/somno- lencia, distoniab, mareos, discinesiab, temblor |
discinesia tardía, convulsiónd, síncope, hiperactividad psicomotora, mareo postural, alteración de la atención, disartria, disgeusia, hipoestesia, parestesia |
síndrome neuroléptico maligno, isquemia cerebral, sin respuesta a estímulos, pérdida de la consciencia, disminución del nivel de consciencia, coma diabético6, trastorno del equilibrio, coordinación anormale, titubeo de la cabezae | |
|
Trastornos oculares |
visión borrosa, conjuntivitis, sequedad de ojos |
glaucomae, trastornos del movimiento del ojo, giros de los ojos, fotofobia, aumento del lagrimeo, hiperemia ocular | |||
|
Trastornos del oído y del laberinto |
vértigo, acúfenos, dolor de oído | ||||
|
Trastornos cardiacos |
bradicardia, taquicardia |
fibrilación auricular, bloqueo auriculoventri-cular, QT prolongado en el electrocardiogram a, síndrome de taquicardia postural ortostática, anomalías del electrocardiograma, palpitaciones |
arritmia sinusal | ||
|
Trastornos vasculares |
hipertensión |
hipotensión, hipotensión ortostática |
embolismo pulmonare, trombosis venosa, isquemiae, rubor | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
tos, congestión nasal |
disnea, congestión pulmonar, sibilancias, dolor faringeolaríngeo, epistaxis |
síndrome de apnea del sueñoe, hiperventilacióne, neumonía por aspiración , congestión del tracto respiratorio, disfoníae | ||
|
Trastornos gastrointestina les |
dolor abdominal, vómitos, náuseas, estreñimiento, diarrea, dispepsia, dolor de muelas |
malestar abdominal, gastroenteritis, sequedad de boca, flatulencia |
pancreatitis, obstrucción del intestinoe, íleo, hinchazón de la lengua, incontinencia fecal, fecaloma, disfagia, queilitise |
|
Trastornos hepatobiliares |
aumento de las transaminasas |
aumento de la gamma-glutamiltransfe-rasa, aumento de las enzimas hepáticas |
ictericia6 | ||
|
Trastornos de la piel y del tejido subcutáneo |
erupción cutánea |
urticaria, prurito, alopecia, eccema, sequedad de la piel, eritema, acné |
angioedemae, erupción debida al medicamento, hiperqueratosis, decoloración de la piele, dermatitis seborreicae, caspa | ||
|
Trastornos musculoesquelé-ticos y del tejido conjuntivo |
dolor musculoesque-lético, dolor de espalda |
espasmos musculares, rigidez en las articulaciones, dolor de cuello, artralgia |
rabdomiólisise, aumento de la creatina fosfoquinasa en sangre, anomalía posturale, inflamación de las articulaciones, debilidad muscular | ||
|
Trastornos renales y urinarios |
incontinencia urinaria, polaquiuria, disuria |
retención urinaria | |||
|
Embarazo, puerperio y enfermedades perinatales |
síndrome de abstinencia neonatal (ver sección 4.6)e | ||||
|
Trastornos del aparato reproductor y de la mama |
disfunción eréctil, trastorno de la eyaculación, amenorrea, retraso en la menstruación, trastornos menstrualesd, ginecomastia, galactorrea, disfunción sexual, secreción vaginal |
priapismoe, dolor de las mamas, malestar de las mamas, congestión de las mamas, aumento de las mamas, secreción mamaria | |||
|
Trastornos generales y alteraciones en el lugar de administración |
pirexia, astenia, fatiga, reacción en el lugar de la inyección |
edema facial, edemad, alteración de la marcha, dolor de pecho, malestar de pecho, malestar, endurecimiento |
hipotermia, disminución de la temperatura corporale, escalofríos, aumento de la temperatura corporal, sed, síndrome de abstinencia a medicamentos*5, absceso en el lugar de la inyección, celulitis en el lugar de la inyección, quiste en el lugar de la inyeccióne, hematoma en el |
|
lugar de la inyección | |||||
|
Lesiones traumáticas, intoxicacio nes y complicacio nes de procedimien tos terapéuticos |
caídas |
a
b
Referido a “Hiperprolactinemia” a continuación. Referido a “Síntomas extrapiramidales” a continuación.
c En ensayos controlados con placebo, se notificó diabetes mellitus en un 0,32% de los pacientes tratados con Xeplion comparado con un 0,39% del grupo placebo. En general, la incidencia en todos los ensayos clínicos fue de un 0,47% en todos los pacientes tratados con Xeplion.
d Insomnio incluye: insomnio inicial, insomnio medio; Convulsión incluye: convulsión del gran mal; Edema incluye:
edema generalizado, edema periférico, edema con fóvea. Trastornos menstruales incluyen: menstruación irregular, oligomenorrea.
e Observado en la experiencia tras la comercialización con paliperidona.
Reacciones adversas notificadas con las formulaciones de risperidona
Paliperidona es el metabolito activo de risperidona, por lo tanto, los perfiles de las reacciones adversas de estos compuestos (incluyendo ambas formulaciones la oral y la inyectable) son relevantes entre sí. Además de las reacciones adversas anteriormente mencionadas, se han notificado las siguientes reacciones adversas con el uso de risperidona, las cuales se espera que aparezcan con Xeplion. Trastornos del sistema nervioso: trastorno cerebrovascular Trastornos oculares: síndrome del iris flácido (intraoperatorio)
Trastornos respiratorios, torácicos y mediastínicos: estertores
Trastornos generales y alteraciones en el lugar de administración (observadas con la formulación inyectable de risperidona): necrosis en el lugar de la inyección, úlcera en el lugar de la inyección.
Descripción de algunas reacciones adversas
Reacción anafiláctica
Durante la experiencia post comercialización, en raras ocasiones se han notificado casos de una reacción anafiláctica después de la inyección de Xeplion en pacientes que previamente han tolerado risperidona oral o paliperidona oral (ver sección 4.4).
Reacciones en el lugar de la inyección
La reacción adversa relacionada con el lugar de la inyección notificada con mayor frecuencia fue el dolor. La mayoría de estas reacciones se notificaron con gravedad de leve a moderada. Las evaluaciones del dolor en el sitio de la inyección en los sujetos, basada en una escala analógica visual, indican que el dolor tiende a disminuir en frecuencia e intensidad con el tiempo en todos los estudios de fase 2 y 3. Las inyecciones en el músculo deltoides se perciben como un poco más dolorosas que las correspondientes inyecciones en el glúteo. Otras reacciones en el lugar de la inyección fueron en su mayoría de intensidad leve e incluyeron induración (frecuente), prurito (poco frecuente) y nódulos (raro).
Síntomas extrapiramidales (SEP)
SEP incluye un análisis agrupado de los siguientes términos: parkinsonismo (incluye hipersecreción salival, rigidez musculoesquelética, parkinsonismo, babeo, rigidez en rueda dentada, bradicinesia, hipocinesia, facies en máscara, tensión muscular, acinesia, rigidez de la nuca, rigidez muscular, modo de andar parkinsoniano y reflejo de la glabella anormal, temblor en reposo parkinsoniano), acatisia (incluye acatisia, inquietud, hipercinesia y síndrome de las piernas inquietas), discinesia (discinesia, calambres musculares, coreatetosis, atetosis y mioclonía), distonía (incluye distonía, hipertonía, tortícolis, contracciones musculares involuntarias, contracturas musculares, blefarospasmo, giro ocular, parálisis lingual, espasmo facial, laringoespasmo, miotonía, opistótonos, espasmo orofaríngeo,
pleurotótonos, espasmo lingual y trismo) y temblor. Hay que destacar que se incluye un espectro más amplio de síntomas que no tienen forzosamente su origen en el trastorno extrapiramidal.
Aumento de peso
En el estudio de 13 semanas de duración que incluyó un régimen de dosificación inicial de 150 mg, la proporción de sujetos con un aumento anormal de peso > 7% mostró una tendencia relacionada con la dosis, con una tasa de incidencia del 5% en el grupo placebo, en comparación con tasas del 6%, 8%, y 13% en los grupos tratados con 25 mg, 100 mg y 150 mg de Xeplion, respectivamente.
Durante el período abierto de transición/mantenimiento de 33 semanas de duración del ensayo de prevención de recidivas a largo plazo, el 12% de los pacientes tratados con Xeplion cumplieron este criterio (aumento de peso de > 7% desde la fase doble ciego hasta el final del estudio); la media (DE) del cambio de peso desde el nivel basal del periodo abierto fue de + 0,7 (4,79) kg.
Hiperprolactinemia
En ensayos clínicos, se observaron medianas de aumento de la prolactina sérica en sujetos de ambos sexos que recibieron Xeplion. Las reacciones adversas que pueden sugerir un aumento de los niveles de prolactina (p. ej., amenorrea, galactorrea, alteraciones de la menstruación, ginecomastia) se notificaron en < 1% de los sujetos.
Efectos de clase
Con antipsicóticos puede aparecer prolongación del QT, arritmias ventriculares (fibrilación ventricular, taquicardia ventricular), muerte súbita inexplicable, parada cardíaca y Torsades de pointes. Se han notificado casos de tromboembolismo venoso, incluidos casos de embolismo pulmonar y de trombosis venosa profunda, con el uso de medicamentos antipsicóticos (frecuencia no conocida).
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Apéndice V.
4.9 Sobredosis
Síntomas
En general, los signos y síntomas previstos son los resultantes de la exageración de los efectos farmacológicos conocidos de paliperidona, es decir, somnolencia y sedación, taquicardia e hipotensión, prolongación del intervalo QT y síntomas extrapiramidales. Se han notificado Torsades de pointes y fibrilación ventricular en un paciente en relación con la sobredosis de paliperidona oral. En caso de sobredosis aguda, se debe tener en cuenta la posibilidad de que estén implicados varios medicamentos.
Administración
Al evaluar el tratamiento necesario y la recuperación hay que tener en cuenta la naturaleza de liberación prolongada del medicamento y la prolongada vida media de eliminación de paliperidona. No hay ningún antídoto específico para paliperidona. Se utilizarán medidas de apoyo generales. Hay que establecer y mantener una vía respiratoria despejada y garantizar que la oxigenación y la ventilación sean adecuadas.
El control cardiovascular debe empezar inmediatamente e incluir un control electrocardiográfico continuo para controlar posibles arritmias. La hipotensión y el fracaso circulatorio deben tratarse con las medidas terapéuticas adecuadas, como administración de líquidos por vía intravenosa y/o de simpaticomiméticos. En caso de síntomas extrapiramidales intensos, se administrará medicación anticolinérgica. Se debe mantener una supervisión y un control estrictos hasta que el paciente se recupere.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicolépticos, otros antipsicóticos. Código ATC: N05AX13 Xeplion contiene una mezcla racémica de paliperidona (+) y (-).
Mecanismo de acción
Paliperidona es un agente bloqueante selectivo de los efectos de las monoaminas, cuyas propiedades farmacológicas son diferentes de las de los neurolépticos tradicionales. Paliperidona se une firmemente a los receptores serotoninérgicos 5-HT2 y dopaminérgicos D2. Paliperidona también bloquea los receptores adrenérgicos alfa1 y bloquea, en menor medida, los receptores histaminérgicos H1 y los adrenérgicos alfa2. La actividad farmacológica de los enantiómeros (+) y (-) de paliperidona es similar desde el punto de vista cualitativo y cuantitativo.
Paliperidona no se une a los receptores colinérgicos. Aunque paliperidona es un antagonista D2 potente, motivo por el que se cree que alivia los síntomas positivos de la esquizofrenia, produce menos catalepsia y reduce las funciones motrices en menor medida que los neurolépticos tradicionales. La preponderancia del antagonismo central de la serotonina puede reducir la tendencia de paliperidona a producir efectos secundarios extrapiramidales.
Eficacia clínica
Tratamiento agudo de la esquizofrenia
La eficacia de Xeplion en el tratamiento agudo de la esquizofrenia fue establecida en cuatro ensayos doble ciego, aleatorizados, controlados con placebo, de dosis fija, a corto plazo (uno de 9 semanas y tres de 13 semanas de duración) en pacientes adultos ingresados con recidiva aguda que cumplían los criterios para la esquizofrenia del DSM-IV. Las dosis fijas de Xeplion en estos estudios se administraron en los días 1, 8, y 36 en el estudio de 9 semanas de duración, y, además, el día 64 en los estudios de 13 semanas de duración. No fue necesario administrar suplementos antipsicóticos orales adicionales durante el tratamiento agudo de la esquizofrenia con Xeplion. El criterio principal de eficacia del estudio se definió como una reducción de las puntuaciones totales de la Escala de los Síndromes Positivo y Negativo (PANSS), como se muestra en la siguiente tabla. La PANSS es un inventario multi-elemento validado compuesto por cinco factores destinados a evaluar los síntomas positivos, los síntomas negativos, el pensamiento desorganizado, la hostilidad/excitación incontrolada y la ansiedad/depresión. La función se evaluó mediante la escala de Funcionamiento Personal y Social (PSP). La PSP es una escala homologada que mide la capacidad del paciente para desempeñar sus actividades personales y sociales en cuatro áreas del comportamiento: las actividades socialmente útiles (incluidos el trabajo y el estudio), las relaciones personales y sociales, el cuidado personal y los comportamientos disruptivos y agresivos.
En un estudio de 13 semanas de duración (n = 636) que comparó tres dosis fijas de Xeplion (inyección inicial en el deltoides de 150 mg seguida por tres dosis en el glúteo o en el deltoides de cualquiera de 25 mg/4 semanas, 100 mg/4 semanas o 150 mg/4 semanas) con placebo, las tres dosis de Xeplion fueron superiores a placebo en términos de la mejoría de la puntuación total de la PANSS. En este estudio, tanto los grupos de tratamiento con 100 mg/4 semanas como con 150 mg/4 semanas, pero no el 25 mg/4 semanas, demostraron una superioridad estadística respecto a placebo en cuanto a la puntuación de PSP. Estos resultados respaldan la eficacia a lo largo de toda la duración del tratamiento y la mejoría de la PANSS, que se observaron ya en el día 4, con una separación significativa respecto a placebo en los grupos tratados con 25 mg y 150 mg de Xeplion en el día 8.
Los resultados de los otros estudios arrojaron resultados estadísticamente significativos a favor de Xeplion, a excepción de la dosis de 50 mg en un estudio (ver tabla siguiente).
|
Puntuación total de la escala de los síndromes positivo y negativo de la esquizofrenia (PANSS). Variación entre el momento basal y el final del estudio-LOCF para los estudios R092670-SCH-201, R092670-PSY-3003, R092670-PSY-3004 y R092670-PSY-3007: Grupo de análisis del criterio principal de valoración de la eficacia | |||||
|
Placebo |
25 mg |
50 mg |
100 mg |
150 mg | |
|
R092670-PSY-3007* Media basal (DE) Variación media (DE) Valor p (frente a placebo) |
n = 160 86,8 (10,31) -2,9 (19,26) |
n = 155 86,9 (11,99) -8,0 (19,90) 0,034 |
-- |
n = 161 86,2 (10,77) -11,6 (17,63) <0,001 |
n = 160 88,4 (11,70) -13,2 (18,48) <0,001 |
|
R092670-PSY-3003 Media basal (DE) Variación media (DE) Valor p (frente a placebo) |
n = 132 92,4 (12,55) -4,1 (21,01) |
-- |
n = 93 89,9 (10,78) -7,9 (18,71) 0,193 |
n = 94 90,1 (11,66) -11,0 (19,06) 0,019 |
n = 30 92,2 (11,72) -5,5 (19,78) |
|
R092670-PSY-3004 Media basal (DE) Variación media (DE) Valor p (frente a placebo) |
n = 125 90,7 (12,22) -7,0 (20,07) |
n = 129 90,7 (12,25) -13,6 (21,45) 0,015 |
n = 128 91,2 (12,02) -13,2 (20,14) 0,017 |
n = 131 90,8 (11,70) -16,1 (20,36) <0,001 |
-- |
|
R092670-SCH-201 Media basal (DE) Variación media (DE) Valor p (frente a placebo) |
n=66 87,8 (13,90) 6,2 (18,25) |
-- |
n=63 88,0 (12,39) -5,2 (21,52) 0,001 |
n=68 85,2 (11,09) -7,8 (19,40) <0,0001 |
-- |
* En el estudio R092670-PSY-3007, se administró una dosis de iniciación de 150 mg a todos los sujetos de los grupos de tratamiento con Xeplion el día 1 y, a partir de entonces, la dosis asignada.
Nota: un cambio negativo de la puntuación denota mejoría.
Mantenimiento del control de los síntomas y retraso de la recidiva de la esquizofrenia La eficacia de Xeplion en el mantenimiento del control de los síntomas y el retraso de la recidiva de la esquizofrenia se determinó en un estudio doble ciego, controlado con placebo, de dosis flexible, con un plazo más largo, en el que participaron 849 sujetos adultos no ancianos que cumplían los criterios para la esquizofrenia del DSM-IV. Este estudio incluyó un tratamiento abierto agudo de 33 semanas de duración y una fase de estabilización, una fase aleatorizada, doble ciego, controlada con placebo para observar la recidiva, y un período de extensión abierto de 52 semanas. En este estudio, las dosis de Xeplion fueron 25, 50, 75 y 100 mg administrados mensualmente; la dosis de 75 mg solamente estaba permitida en la extensión abierta de 52 semanas. Inicialmente, los sujetos recibieron dosis flexibles (25-100 mg) de Xeplion durante un período de transición de 9 semanas de duración, seguido de un período de mantenimiento de 24 semanas, en el que los sujetos debían tener una puntuación PANSS < 75. Los ajustes de la dosis solo se permitieron en las primeras 12 semanas del período de mantenimiento. Se realizó la asignación aleatoria de un total de 410 pacientes estabilizados a Xeplion (mediana de la duración de 171 días [intervalo de 1 día a 407 días]) o a placebo (mediana de la duración de 105 días [intervalo de 8 días a 441 días]) hasta que experimentaran una recidiva de los síntomas de la esquizofrenia en la fase doble ciego de duración variable. El ensayo se suspendió antes de tiempo por motivos de eficacia, dado que se observó un tiempo significativamente más largo hasta la recidiva (p < 0,0001, Figura 1) en los pacientes tratados con Xeplion en comparación con el placebo (cociente de riesgos = 4,32; IC 95%: 2,4-7,7).
80
60 -
O
1)
iH1
¡3
<yi
40
a
u
o
—
1)
Plh
t3
1)
3
B
20 -
Placebo N=156 (3) XEPLION N=156 (4)
Log-rank test, P-value<0.0001 (5)
0
—i-1-1-1-1-1-1-1-1-1-1-1-1-1-1
20 40 60 80 100 120 140 160 180 200 220 240 260 280 300
Days since Randomisation (2)
Figura 1: Gráfico de Kaplan-Meier del tiempo hasta la recidiva. Análisis intermedio (grupo de análisis intermedio por intención de tratar)
(1) Porcentaje estimado de sujetos sin recidiva
(2) Días desde la aleatorización
(3) Placebo N= 156
(4) Xeplion N = 156
(5) Test de rangos logarítmicos, valor p < 0,0001 Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Xeplion en los diferentes grupos de la población pediátrica en esquizofrenia. Ver sección 4.2 para consultar la información sobre el uso en población pediátrica.
5.2 Propiedades farmacocinéticas
Absorción y distribución
Palmitato de paliperidona es el profármaco en forma de éster de palmitato de la paliperidona. Debido a su hidrosolubilidad extremadamente baja, el palmitato de la paliperidona se disuelve lentamente después de la inyección intramuscular antes de ser hidrolizado a paliperidona y se absorbe en la circulación sistémica. Después de una dosis única por vía intramuscular, las concentraciones plasmáticas de paliperidona se elevan gradualmente hasta alcanzar las concentraciones plasmáticas máximas a una mediana de Tmax de 13 días. La liberación de la sustancia activa se inicia desde el día 1 y tiene una duración de al menos 4 meses.
Después de la inyección intramuscular de dosis únicas (de 25 mg a 150 mg) en el músculo deltoides, en promedio, se observó una Cmax un 28% superior en comparación con la inyección en el músculo glúteo. Las dos inyecciones iniciales intramusculares en el deltoides de 150 mg el día 1 y 100 mg en el día 8 contribuyen a alcanzar concentraciones terapéuticas rápidamente. El perfil de liberación y el
régimen de dosificación de Xeplion se traducen en concentraciones terapéuticas mantenidas. La exposición total de paliperidona tras la administración de Xeplion fue proporcional a la dosis en un rango de dosis de 25 mg a 150 mg, y menos que proporcional a la dosis en el caso de la Cmax para dosis superiores a 50 mg. El promedio del pico en el estado estacionario: a través del ratio para una dosis de 100 mg de Xeplion fue de 1,8 después de la administración en el glúteo y de 2,2 después de la administración en el deltoides. La mediana de la vida media aparente de paliperidona tras la administración de Xeplion a lo largo del rango de dosis de 25 mg a 150 mg osciló entre 25 y 49 días.
La biodisponibilidad absoluta del palmitato de paliperidona tras la administración de Xeplion es del 100%.
Tras la administración de palmitato de paliperidona, los enantiómeros (+) y (-) de paliperidona se interconvierten, de modo que se alcanza un cociente de AUC (+) a (-) de aproximadamente 1,6-1,8.
La unión a proteínas plasmáticas de paliperidona racémica es del 74%.
Biotransformación y eliminación
Una semana después de la administración de una sola dosis oral de 1 mg de paliperidona de liberación inmediata marcada con C14, el 59% de la dosis fue eliminada intacta por la orina, lo que indica que paliperidona no experimenta un intenso metabolismo por el hígado. Se recuperó aproximadamente el 80% de la radiactividad administrada en la orina y el 11% en las heces. Se han identificado cuatro vías metabólicas in vivo, ninguna de las cuales representó más del 6,5% de la dosis: desalquilación, hidroxilación, deshidrogenación y escisión de benzisoxazol. Aunque en estudios in vitro se señaló que las enzimas CYP2D6 y CYP3A4 pueden intervenir en el metabolismo de paliperidona, no hay datos in vivo que demuestren que estas isoenzimas desempeñen un papel significativo en el metabolismo de paliperidona. En los análisis de farmacocinética de la población no se observó ninguna diferencia apreciable del aclaramiento aparente de paliperidona tras la administración de paliperidona oral entre los metabolizadores rápidos y lentos de los sustratos de la CYP2D6. En estudios in vitro realizados con microsomas hepáticos humanos se demostró que la paliperidona no inhibe sustancialmente el metabolismo de los medicamentos metabolizados por las isoenzimas del citocromo P450, como CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5.
En estudios in vitro se ha demostrado que paliperidona es un sustrato de la P-gp y un inhibidor débil de la P-gp a altas concentraciones. No existen datos de estudios in vivo y se desconoce la importancia clínica.
Inyección de palmitato de paliperidona de acción prolongada en comparación con paliperidona oral de liberación prolongada
Xeplion está diseñado para liberar paliperidona a lo largo de un período mensual, mientras que la paliperidona oral de liberación prolongada se administra a diario. El régimen de iniciación de Xeplion (150 mg/100 mg en el músculo deltoides en el día 1 /día 8) ha sido diseñado para alcanzar rápidamente las concentraciones de estado estacionario de paliperidona al iniciar el tratamiento sin necesidad de administrar suplementos orales.
En términos generales, los niveles plasmáticos globales de iniciación con Xeplion se encontraron dentro del intervalo de exposición observado con entre 6 y 12 mg de paliperidona oral de liberación prolongada. El uso del régimen de iniciación de Xeplion permitió a los pacientes permanecer dentro de este margen de exposición de entre 6 y 12 mg de paliperidona oral de liberación prolongada incluso en los días de concentración mínima previos a la dosis (días 8 y 36). Debido a la diferencia en la mediana de los perfiles farmacocinéticos entre los dos medicamentos, se debe tener precaución al realizar una comparación directa de sus propiedades farmacocinéticas.
Insuficiencia hepática
Paliperidona no se metaboliza ampliamente en el hígado. Aunque Xeplion no se ha estudiado en pacientes con insuficiencia hepática, no es preciso ajustar las dosis en los pacientes con insuficiencia hepática leve o moderada. En un estudio con paliperidona oral en pacientes con insuficiencia hepática moderada (Child-Pugh clase B), las concentraciones plasmáticas de paliperidona libre fueron similares a los de individuos sanos. Paliperidona no se ha estudiado en pacientes con insuficiencia hepática grave.
Insuficiencia renal
La eliminación de una sola dosis de un comprimido de 3 mg de paliperidona de liberación prolongada se estudió en sujetos con diversos grados de función renal. La eliminación de la paliperidona disminuye si lo hace el aclaramiento de creatinina estimado. El aclaramiento total de la paliperidona disminuyó un promedio del 32% en sujetos con insuficiencia renal leve (CrCl = 50 a <80 ml/min), un 64% en sujetos con insuficiencia renal moderada (CrCl = 30 a <50 ml/min) y un 71% en sujetos con insuficiencia renal grave (CrCl =10 a <30 ml/min), lo que corresponde con un aumento promedio de la exposición (AUCinf) de 1,5, 2,6 y 4,8 veces, respectivamente, en comparación con los sujetos sanos. Sobre la base del número limitado de observaciones con Xeplion en sujetos con insuficiencia renal leve y de los resultados de las simulaciones farmacocinéticas, se recomienda administrar una dosis reducida (ver sección 4.2).
Población de edad avanzada
No se recomienda ajustar la dosis únicamente en función de la edad. Sin embargo, puede ser necesario realizar el ajuste de la dosis debido a las disminuciones en el aclaramiento de creatinina relacionadas con la edad (ver Insuficiencia renal más arriba y la sección 4.2).
Peso
Los estudios farmacocinéticos con palmitato de paliperidona han demostrado unas concentraciones plasmáticas de paliperidona algo menores (entre el 10% y el 20%) en pacientes con sobrepeso u obesidad en comparación con los pacientes con un peso normal (ver sección 4.2).
Raza
En el análisis farmacocinético de los datos de la población procedentes de los ensayos con paliperidona oral, no se observaron indicios de que existan diferencias relacionadas con la raza en la farmacocinética de la paliperidona tras la administración de Xeplion.
Sexo
No se han observado diferencias clínicamente significativas entre hombres y mujeres.
Tabaquismo
Según estudios in vitro realizados con enzimas hepáticas humanas, paliperidona no es sustrato de la CYP1A2; por lo tanto, el consumo de tabaco no debería afectar a la farmacocinética de paliperidona. Un análisis farmacocinético de la población basado en los datos obtenidos con comprimidos orales de paliperidona de liberación prolongada mostró una exposición ligeramente más baja a paliperidona en fumadores en comparación con los no fumadores. No obstante, se cree que es poco probable que la diferencia tenga relevancia clínica. No se evaluó el tabaquismo con Xeplion.
5.3 Datos preclínicos sobre seguridad
Los estudios de toxicidad a dosis repetidas de palmitato de paliperidona inyectado por vía intramuscular y paliperidona administrada por vía oral en ratas y perros mostraron efectos principalmente farmacológicos, como sedación y efectos mediados por la prolactina, en las glándulas mamarias y en los genitales. En los animales tratados con palmitato de paliperidona, se observó una reacción inflamatoria en el lugar de la inyección intramuscular. Se produjo la formación ocasional de abscesos.
En estudios sobre la reproducción de las ratas utilizando risperidona oral, que se convierte masivamente a paliperidona en ratas y en seres humanos, se observaron efectos adversos en el peso al nacer y de la supervivencia de las crías. No se observó embriotoxicidad ni malformaciones tras la administración intramuscular de palmitato de paliperidona a ratas preñadas a la dosis más alta (160 mg/kg/día), correspondiente a 4,1 veces el nivel de exposición en humanos a la dosis máxima recomendada de 150 mg. Otros antagonistas de la dopamina han tenido efectos negativos en el desarrollo motor y del aprendizaje en las crías cuando se administraron a animales preñados.
Palmitato de paliperidona y paliperidona no fueron genotóxicos. En estudios sobre el poder carcinógeno de risperidona oral en ratas y ratones se observaron aumentos de los adenomas hipofisarios (ratón), de los adenomas del páncreas endocrino (rata) y los de adenomas de las glándulas mamarias (en ambas especies). Se evaluó el potencial carcinogénico de palmitato de paliperidona inyectado por vía intramuscular en ratas. Se constató un aumento estadísticamente significativo en los adenocarcinomas de las glándulas mamarias en las ratas hembras a dosis de 10, 30 y 60 mg/kg/mes. Las ratas macho mostraron un aumento estadísticamente significativo de los adenomas y carcinomas de las glándulas mamarias a las dosis de 30 y 60 mg/kg/mes, que equivalen a 1,2 y 2,2 veces el nivel de exposición en humanos a la dosis máxima recomendada de 150 mg. Estos tumores pueden estar relacionados con el antagonismo prolongado de la dopamina D2 y con la hiperprolactinemia. Se desconoce la trascendencia de estos hallazgos tumorales en roedores para el riesgo en seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polisorbato 20
Polietilenglicol 4000
Ácido cítrico monohidrato
Fosfato ácido disódico anhidro
Fosfato diácido de sodio monohidratado
Hidróxido de sodio (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez
2 años
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Jeringa precargada (cíclico-olefina-copolímero) con un tapón de tipo émbolo, tope trasero y un protector para la punta (goma de bromobutilo) con una aguja de seguridad del calibre 22 de 1/ pulgadas (0,72 mm x 38,1 mm) y una aguja de seguridad del calibre 23 de 1 pulgada (0,64 mm x
25,4 mm).
Tamaños de envase:
El envase contiene 1 jeringa precargada y 2 agujas Envase de inicio de tratamiento:
Cada envase de inicio de tratamiento contiene 1 envase de Xeplion 150 mg y 1 envase de Xeplion 100 mg.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 04 de marzo de 2011 Fecha de la última revalidación: 16 de diciembre de 2015
10. FECHA DE LA REVISIÓN DEL TEXTO
DD/mes/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DEL LOTE
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DEL LOTE
Nombre y dirección del fabricante responsable de la liberación de los lotes
Janssen Pharmaceutica N.V.
Turnhoutseweg 30 B-2340 Beerse Bélgica
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y cualquier
actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos;
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Xeplion 25 mg suspensión inyectable de liberación prolongada Paliperidona
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 25 mg de paliperidona.
Excipientes: Polisorbato 20, Polietilenglicol 4000, Ácido cítrico monohidrato, Fosfato ácido disódico anhidro, Fosfato diácido de sodio monohidratado, Hidróxido de sodio, Agua para preparaciones inyectables.
Suspensión inyectable de liberación prolongada.
1 jeringa precargada
2 agujas
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xeplion 25 mg_
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Xeplion 25 mg inyección
Paliperidona
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
25 mg
6. OTROS
Xeplion 50 mg suspensión inyectable de liberación prolongada Paliperidona
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 50 mg de paliperidona.
Excipientes: Polisorbato 20, Polietilenglicol 4000, Ácido cítrico monohidrato, Fosfato ácido disódico anhidro, Fosfato diácido de sodio monohidratado, Hidróxido de sodio, Agua para preparaciones inyectables.
Suspensión inyectable de liberación prolongada.
1 jeringa precargada
2 agujas
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xeplion 50 mg17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Xeplion 50 mg inyección
Paliperidona
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
50 mg
6. OTROS
Xeplion 75 mg suspensión inyectable de liberación prolongada Paliperidona
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 75 mg de paliperidona.
Excipientes: Polisorbato 20, Polietilenglicol 4000, Ácido cítrico monohidrato, Fosfato ácido disódico anhidro, Fosfato diácido de sodio monohidratado, Hidróxido de sodio, Agua para preparaciones inyectables.
Suspensión inyectable de liberación prolongada.
1 jeringa precargada
2 agujas
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xeplion 75 mg17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Xeplion 75 mg inyección
Paliperidona
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
75 mg
6. OTROS
Xeplion 100 mg suspensión inyectable de liberación prolongada Paliperidona
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 100 mg de paliperidona.
Excipientes: Polisorbato 20, Polietilenglicol 4000, Ácido cítrico monohidrato, Fosfato ácido disódico anhidro, Fosfato diácido de sodio monohidratado, Hidróxido de sodio, Agua para preparaciones inyectables.
Suspensión inyectable de liberación prolongada.
1 jeringa precargada
2 agujas
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xeplion 100 mg17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Xeplion 100 mg inyección
Paliperidona
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
100 mg
6. OTROS
Xeplion 150 mg suspensión inyectable de liberación prolongada Paliperidona
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 150 mg de paliperidona.
Excipientes: Polisorbato 20, Polietilenglicol 4000, Ácido cítrico monohidrato, Fosfato ácido disódico anhidro, Fosfato diácido de sodio monohidratado, Hidróxido de sodio, Agua para preparaciones inyectables.
Suspensión inyectable de liberación prolongada.
1 jeringa precargada
2 agujas
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/005
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xeplion 150 mg17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
<Incluido el código de barras 2D que lleva el identificador único.>
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Xeplion 150 mg inyección
Paliperidona
IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
150 mg
6. OTROS
Xeplion 150 mg XeplionN 100 mg
suspensión inyectable de liberación prolongada Paliperidona
Xeplion 150 mg: Cada jeringa precargada contiene palmitato de paliperidona equivalente a 150 mg de paliperidona.
Xeplion 100 mg: Cada jeringa precargada contiene palmitato de paliperidona equivalente a 100 mg de paliperidona.
Excipientes: Polisorbato 20, Polietilenglicol 4000, Ácido cítrico monohidrato, Fosfato ácido disódico anhidro, Fosfato diácido de sodio monohidratado, Hidróxido de sodio, Agua para preparaciones inyectables.
Suspensión inyectable de liberación prolongada.
Envase de inicio de tratamiento
Cada envase de inicio del tratamiento contiene 2 jeringas precargadas: 1 jeringa precargada de 150 mg de paliperidona y 2 agujas 1 jeringa precargada de 100 mg de paliperidona y 2 agujas
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No conservar a temperatura superior a 30oC.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
|
16. |
INFORMACIÓN EN BRAILLE | |
|
xeplion 150 mg xeplion 100 mg | ||
|
17. |
IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
Incluido el código de barras 2D que lleva el identificador único. | ||
|
18. |
IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
PC:
SN:
NN:
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
CAJA DE CARTÓN (JERINGA PRECARGADA DE 150 MG, COMPONENTE DEL ENVASE DE INICIO DE TRATAMIENTO - SIN BLUE BOX)
Xeplion 150 mg suspensión inyectable de liberación prolongada Paliperidona
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 150 mg de paliperidona.
Excipientes: Polisorbato 20, Polietilenglicol 4000, Ácido cítrico monohidrato, Fosfato ácido disódico anhidro, Fosfato diácido de sodio monohidratado, Hidróxido de sodio, Agua para preparaciones inyectables.
Suspensión inyectable de liberación prolongada. Día 1
1 jeringa precargada
2 agujas
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
No conservar a temperatura superior a 30oC.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xeplion 150 mgINFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
CAJA DE CARTÓN (JERINGA PRECARGADA DE 100 MG, COMPONENTE DEL ENVASE DE INICIO DE TRATAMIENTO - SIN BLUE BOX)_
1. NOMBRE DEL MEDICAMENTO
Xeplion 100 mg suspensión inyectable de liberación prolongada Paliperidona
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 100 mg de paliperidona.
Excipientes: Polisorbato 20, Polietilenglicol 4000, Ácido cítrico monohidrato, Fosfato ácido disódico anhidro, Fosfato diácido de sodio monohidratado, Hidróxido de sodio, Agua para preparaciones inyectables.
Suspensión inyectable de liberación prolongada. Día 8
1 jeringa precargada
2 agujas
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
No conservar a temperatura superior a 30oC.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Janssen-Cilag International NV Turnhoutseweg 30
B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/11/672/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
xeplion 100 mg
B. PROSPECTO
Prospecto: Información para el usuario
Xeplion 25 mg suspensión inyectable de liberación prolongada Xeplion 50 mg suspensión inyectable de liberación prolongada Xeplion 75 mg suspensión inyectable de liberación prolongada Xeplion 100 mg suspensión inyectable de liberación prolongada Xeplion 150 mg suspensión inyectable de liberación prolongada
Paliperidona
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Xeplion y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Xeplion
3. Cómo usar Xeplion
4. Posibles efectos adversos
5. Conservación de Xeplion
6. Contenido del envase e información adicional
1. Qué es Xeplion y para qué se utiliza
Xeplion contiene el principio activo paliperidona que pertenece a la clase de medicamentos antipsicóticos y se utiliza como tratamiento de mantenimiento para los síntomas de esquizofrenia en pacientes adultos estabilizados con paliperidona o risperidona.
Si usted ha mostrado respuesta a paliperidona o risperidona en el pasado y tiene síntomas leves o moderados, su médico puede iniciar el tratamiento con Xeplion sin una estabilización previa con paliperidona o risperidona.
La esquizofrenia es un trastorno con síntomas "positivos" y "negativos". Positivo significa un exceso de síntomas que normalmente no están presentes. Por ejemplo, una persona con esquizofrenia puede escuchar voces o ver cosas que no existen (denominadas alucinaciones), tener creencias erróneas (denominadas delirios) o tener una desconfianza en los demás fuera de lo normal. Negativo se refiere a la falta de conductas o sentimientos que normalmente están presentes. Por ejemplo, una persona con esquizofrenia puede encerrarse en sí misma y no responder a ningún estímulo emocional o pueden tener problemas para hablar de una manera clara y lógica. Las personas que padecen este trastorno también pueden sentirse deprimidas, ansiosas, culpables o tensas.
Xeplion puede ayudar a aliviar los síntomas de su enfermedad y evitar que reaparezcan.
2. Qué necesita saber antes de empezar a usar Xeplion No use Xeplion
- si es alérgico a paliperidona o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a cualquier otro medicamento antipsicótico, incluida la risperidona.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Xeplion.
Este medicamento no ha sido estudiado en pacientes de edad avanzada con demencia. Sin embargo, los pacientes de edad avanzada con demencia que están siendo tratados con otros medicamentos similares, pueden ver aumentado el riesgo de ataque cerebral o muerte (ver sección 4, posibles efectos adversos).
Todos los medicamentos tienen efectos secundarios y algunos de los efectos secundarios de este medicamento pueden empeorar los síntomas de otras patologías. Por esa razón, es importante que comente con su médico cualquiera de las siguientes enfermedades, que podrían empeorar durante el tratamiento con este medicamento.
- si tiene la enfermedad de Parkinson
- si alguna vez ha sido diagnosticado de una enfermedad cuyos síntomas incluyan temperatura elevada y rigidez muscular (también conocida como Síndrome Neuroléptico Maligno)
- si alguna vez ha experimentado movimientos anómalos de la lengua o cara (Discinesia Tardía)
- si ha tenido en el pasado niveles bajos de células blancas de la sangre (que puede o no haber sido causado por otros medicamentos)
- si es diabético o tiene tendencia a la diabetes
- si ha tenido cáncer de mama o un tumor en la hipófisis del cerebro
- si padece alguna enfermedad cardiaca o si recibe tratamiento para enfermedades cardiacas que pueden hacerle más propenso a una reducción de la tensión arterial
- si tiene la tensión arterial baja cuando se pone de pie o se incorpora de forma repentina
- si padece epilepsia
- si tiene problemas de riñón
- si tiene problemas de hígado
- si tiene una erección prolongada y/o dolorosa
- si tiene dificultades para el control de la temperatura corporal o está acalorado
- si tiene un nivel anormalmente alto de la hormona prolactina en sangre o si tiene un tumor que posiblemente sea dependiente de la prolactina
- si usted o alguien en su familia tiene antecedentes de coágulos sanguíneos, dado que los antipsicóticos se han asociado con la formación de coágulos de sangre
Si tiene alguna de estas enfermedades, por favor consulte con su médico ya que podría ser necesario un ajuste de su dosis o mantenerle en observación durante un tiempo.
Debido a que en muy raras ocasiones se ha observado en pacientes tratados con este medicamento un número peligrosamente bajo de un tipo de células blancas necesarias para combatir las infecciones en la sangre, su médico puede comprobar el número de células blancas de la sangre.
Incluso si usted ha tolerado previamente paliperidona oral o risperidona, raramente ocurren reacciones alérgicas después de recibir inyecciones de Xeplion. Solicite ayuda médica inmediatamente si experimenta una erupción cutánea, hinchazón de la garganta, picor o problemas de la respiración, ya que éstos pueden ser signos de una reacción alérgica grave.
Este medicamento puede hacerle aumentar de peso. Un aumento de peso significativo puede afectar negativamente a su salud. Su médico realizará regularmente un seguimiento de su peso.
En pacientes tratados con este medicamento se ha observado diabetes mellitus o empeoramiento de diabetes mellitus preexistente, su médico debe comprobar los signos de un aumento de azúcar en sangre. En pacientes con diabetes mellitus preexistente se debe monitorizar regularmente el azúcar en sangre.
Dado que este medicamento puede reducir el impulso de vomitar, existe la posibilidad de que pueda enmascarar la respuesta normal del organismo ante la ingestión de sustancias tóxicas u otras patologías.
Durante la intervención en el ojo por turbidez de las lentes (cataratas), la pupila (el círculo negro situado en medio del ojo), puede no aumentar de tamaño como se necesita. Además, el iris (la parte coloreada del ojo) puede ponerse flácido durante la cirugía y esto puede causar daño en el ojo. Si usted está pensando en ser operado de los ojos, asegúrese de informar a su oftalmólogo que está usando este medicamento.
Niños y adolescentes
No utilizar este medicamento en menores de 18 años.
Uso de Xeplion con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
La toma de este medicamento junto con carbamazepina (un anti-epiléptico y estabilizador del ánimo) puede hacer necesario el cambio de su dosis de este medicamento.
Dado que este medicamento actúa principalmente en el cerebro, la interacción con otros medicamentos (o alcohol) que también actúen sobre él puede causar una exageración de los efectos secundarios, tales como somnolencia u otros efectos sobre el cerebro tales como otros medicamentos psiquiátricos, opioides, antihistamínicos y medicamentos para dormir.
Dado que este medicamento puede reducir la tensión arterial, deberá tener cuidado si usa este medicamento con otros medicamentos que también la reduzcan.
Este medicamento puede reducir el efecto de los medicamentos para la enfermedad de Parkinson y el síndrome de piernas inquietas (p. ej., levodopa).
Este medicamento puede causar una anomalía en el electrocardiograma (ECG) que pone de manifiesto que es necesario un período prolongado para que un impulso eléctrico viaje a través de una cierta parte del corazón (conocido como "prolongación del intervalo QT"). Otros medicamentos que tienen este efecto incluyen algunos medicamentos usados para tratar el ritmo cardíaco o para tratar las infecciones, además de otros antipsicóticos. Es importante que informe a su médico de cualquier medicamento que esté tomando para tratar estas afecciones.
Si es propenso a desarrollar convulsiones, es posible que este medicamento aumente sus probabilidades de experimentarlas. Otros medicamentos que tienen este efecto incluyen algunos medicamentos usados para tratar la depresión o para tratar las infecciones, además de otros antipsicóticos. Es importante que informe a su médico de cualquier medicamento que esté tomando para tratar estas afecciones.
Embarazo y lactancia
Si está embarazada o en período de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. No debe usar este medicamento durante el embarazo a menos que lo haya comentado con su médico. Se pueden producir los siguientes síntomas en bebés recién nacidos, de madres que han sido tratadas con paliperidona en el último trimestre de embarazo (últimos tres meses de su embarazo): temblor, rigidez y/o debilidad muscular, somnolencia, agitación, problemas al respirar y dificultad en la alimentación.
Si su bebé desarrolla cualquiera de estos síntomas se debe poner en contacto con su médico.
Este medicamento puede pasar de madre a hijo por la leche materna y puede dañar al bebé. Por consiguiente, no debe dar el pecho mientras esté usando este medicamento.
Conducción y uso de máquinas
Durante el tratamiento con este medicamento pueden aparecer mareos, cansancio extremo y problemas de la visión (ver sección 4). Esto debe tenerse en cuenta cuando se requiera una atención máxima, p. ej., cuando conduzca o maneje máquinas.
Información importante sobre algunos de los componentes de Xeplion
El rango de dosis normal de este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio".
3. Cómo usar Xeplion
Su médico u otro profesional sanitario le administrará este medicamento. Su médico le indicará cuándo se debe administrar la siguiente inyección. Es importante que no omita ninguna de las dosis programadas. Si no puede asistir a su cita con el médico, asegúrese de llamarle de inmediato para concertar otra cita tan pronto como sea posible.
Recibirá la primera inyección (150 mg) y la segunda inyección (100 mg) de este medicamento en la parte superior del brazo aproximadamente con una semana de diferencia. A partir de entonces, recibirá una inyección (de entre 25 mg y 150 mg) en la parte superior del brazo o en las nalgas una vez al mes.
Si su médico le está cambiando de risperidona inyectable de larga duración a este medicamento, recibirá la primera inyección de este medicamento (de entre 25 mg y 150 mg) en la parte superior del brazo o en las nalgas en la próxima inyección programada. A partir de entonces, recibirá una inyección (de entre 25 mg y 150 mg) en la parte superior del brazo o en las nalgas una vez al mes.
Dependiendo de sus síntomas, el médico puede aumentar o disminuir la cantidad de medicamento que recibe en un nivel de dosis en el momento de la inyección mensual programada.
Pacientes con problemas de riñón
Su médico puede ajustar la dosis de este medicamento de acuerdo a su función renal.Si usted tiene problemas leves de riñón, su médico le puede dar una dosis menor. No deberá usar este medicamento si usted tiene problemas de riñón moderados o graves.
Pacientes de edad avanzada
Su médico puede reducir la dosis de este medicamento si la función de su riñón está disminuída.
Si recibe más Xeplion del que debiera
Recibirá este medicamento bajo supervisión médica; es, por tanto, poco probable que reciba una dosis excesiva.
Los pacientes que hayan recibido un exceso de paliperidona pueden experimentar los síntomas siguientes: somnolencia o sedación, frecuencia cardiaca rápida, tensión arterial baja, anomalías en el electrocardiograma (trazado eléctrico del corazón), o movimientos lentos o anómalos de la cara, el cuerpo, los brazos o las piernas.
Si interrumpe el tratamiento con Xeplion
Si deja de recibir sus inyecciones, se perderán los efectos del medicamento. No debe dejar de usar este medicamento a menos que se lo indique su médico ya que podrían aparecer de nuevo los síntomas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Informe inmediatamente a su médico si:
• Presenta coágulos sanguíneos en las venas, especialmente en las piernas (los síntomas incluyen hinchazón, dolor y enrojecimiento de la pierna), que pueden circular a través de los vasos
sanguíneos a los pulmones causando dolor en el pecho y dificultad al respirar. Si usted nota alguno de estos síntomas pida consejo médico inmediatamente
• Tiene demencia y presenta un cambio repentino de su estado mental o debilidad repentina o entumecimiento de la cara, brazos o piernas especialmente en uno de los lados, o le cuesta hablar incluso durante un periodo corto de tiempo. Pueden ser signos de un infarto cerebral
• Presenta fiebre, rigidez muscular, sudoración o una disminución del nivel de consciencia (trastorno conocido como “Síndrome Neuroléptico Maligno”). Puede necesitar tratamiento médico inmediato
• Es hombre y presenta una erección prolongada o dolorosa. Se conoce como priapismo. Puede necesitar tratamiento médico inmediato
• Presenta movimientos rítmicos involuntarios de la lengua, boca y cara. Puede ser necesario la retirada de paliperidona
• Presenta una reacción alérgica grave caracterizada por fiebre, hinchazón de la boca, la cara, los labios o la lengua, dificultad respiratoria, picores, erupción cutánea y algunas veces descenso de la tensión arterial (es decir, una "reacción anafiláctica"). Incluso si previamente ha tolerado risperidona oral o paliperidona oral, en raras ocasiones han aparecido reacciones alérgicas después de recibir las inyecciones de Xeplion.
Pueden aparecer los siguientes efectos adversos:
Efectos adversos muy frecuentes: pueden afectar a más de 1 de cada 10 pacientes
• dificultad para quedarse o permanecer dormido
• dolor de cabeza
Efectos adversos frecuentes: pueden afectar hasta 1 de cada 10 pacientes
• síntomas de resfriado común, infección del tracto urinario, sentir como si tuviese gripe
• Xeplion puede aumentar los niveles de una hormona llamada “prolactina” que se detecta en los análisis de sangre (lo cual puede o no causar síntomas). Cuando aparecen los síntomas del aumento de la prolactina, pueden incluir (en hombres) hinchazón de los pechos, dificultad en tener o mantener erecciones u otras disfunciones sexuales; (en mujeres) malestar de las mamas, secreción de leche por las mamas, pérdida de períodos menstruales u otros problemas con el ciclo
• aumento del azúcar en sangre, aumento de peso, pérdida de peso, aumento de los triglicéridos en sangre (grasa)
• irritabilidad, depresión, ansiedad
• parkinsonismo: Esta enfermedad puede incluir movimiento lento o alterado, sensación de rigidez o tirantez de los músculos (haciendo movimientos bruscos) y algunas veces una sensación de “congelación” del movimiento que después se reinicia. Otros signos del parkinsonismo incluyen caminar despacio arrastrando los pies, temblor mientras descansa, aumento de la saliva y/o babear y pérdida de expresividad de la cara
• inquietud, sentirse somnoliento o menos atento
• distonía: Es un trastorno que implica contracción involuntaria lenta o continua de los músculos. Aunque puede estar afectada cualquier parte del cuerpo (y puede originar posturas anormales), la distonía afecta con frecuencia a los músculos de la cara, incluyendo movimientos anormales de los ojos, boca, lengua o mandíbula
• mareos
• discinesia: Este trastorno implica movimientos musculares involuntarios y puede incluir movimientos repetitivos, espasmódicos o de retorcimiento, o espasmos
• temblor (agitación)
• latido lento del corazón, latido rápido del corazón
• aumento de la presión arterial
• tos, congestión nasal
• dolor abdominal, vómitos, náuseas, estreñimiento, diarrea, indigestión, dolor de muelas
• aumento de las transaminasas del hígado en sangre
• erupción cutánea
• dolor de huesos o músculos, dolor de espalda
fiebre, debilidad, fatiga (cansancio)
una reacción en el lugar de la inyección, incluyendo picor, dolor o hinchazón
Efectos adversos poco frecuentes: pueden afectar hasta 1 de cada 100 pacientes
• neumonía, infección de pecho (bronquitis), infección de las vías respiratorias, infección de nariz, infección de vejiga, infección de oídos, infección de ojos, amigdalitis, infección de la piel, inflamación de la piel causada por ácaros, absceso bajo la piel
• disminución del número de células blancas de la sangre, anemia, disminución del número de células rojas de la sangre, aumento de eosinófilos (un tipo de célula blanca de la sangre) en la sangre
• reacción alérgica
• diabetes o empeoramiento de la diabetes, aumento de la insulina (una hormona que controla los niveles de azúcar en sangre) en sangre
• aumento de apetito, disminución de apetito, pérdida de apetito que causa malnutrición y disminución del peso corporal
• aumento del colesterol en sangre
• trastorno del sueño, euforia (manía), confusión, disminución del deseo sexual, nerviosismo, pesadillas
• discinesia tardía (espasmos o movimientos espasmódicos que no se pueden controlar en la cara, lengua u otras partes del cuerpo). Informe a su médico inmediatamente si experimenta movimientos rítmicos involuntarios de la lengua, boca o cara. Puede ser necesaria la retirada de este medicamento
• convulsiones (crisis epilépticas), desmayo, una inquietud que provoca el movimiento de partes del cuerpo, mareos al ponerse de pie, alteración de la atención, problemas con el habla, pérdida o alteraciones del gusto, disminución de la sensibilidad de la piel al dolor o al tacto, sensación de hormigueo, pinchazos o entumecimiento de la piel
• visión borrosa, infección de ojos u “ojo rojo”, sequedad de ojos
• sensación de que todo gira (vértigo), pitidos en los oídos, dolor de oídos
• fibrilación auricular (ritmo cardíaco anormal), interrupción de la conducción entre las partes superiores e inferiores del corazón, anomalía en la actividad eléctrica del corazón, prolongación del intervalo QT en el corazón, latido rápido del corazón al ponerse de pie, anomalías en el trazado eléctrico del corazón (electrocardiograma o ECG), sensación de aleteo o de golpeteo en el pecho (palpitaciones)
• disminución de la presión arterial, presión arterial baja al ponerse de pie (por lo tanto, algunas personas que toman este medicamento pueden sentirse débiles, mareadas o pueden desmayarse cuando se levantan o se sientan de repente)
• respiración entrecortada, congestión pulmonar, jadeo, dolor de garganta, sangrados nasales
• malestar abdominal, infección de estómago o de intestino, sequedad de boca, exceso de gas o flatulencia
• aumento de la GGT (una enzima del hígado llamada gamma-glutamiltransferasa) en sangre, aumento de las enzimas del hígado en sangre
• ronchas ( o “urticaria”), picor, caída del pelo, eccema, sequedad de la piel, enrojecimiento de la piel, acné
• espasmos musculares, rigidez de las articulaciones, dolor de cuello, dolor de las articulaciones
• incontinencia (pérdida de control) urinaria, orinar con frecuencia, dolor al orinar
• disfunción eréctil, trastorno de la eyaculación, pérdida de períodos menstruales, retraso de los períodos menstruales, ausencia de períodos menstruales u otros problemas con el ciclo (mujeres), desarrollo de senos en los hombres, fugas de leche de los pechos, disfunción sexual, secreción vaginal
• hinchazón de la cara, boca, ojos o labios, hinchazón del cuerpo, brazos o piernas
• cambio en la forma de andar
• dolor de pecho, malestar de pecho, sensación de malestar
• endurecimiento de la piel
• caídas
Efectos adversos raros: pueden afectar hasta 1 de cada y 1.000 pacientes
• infección de las uñas por hongos
• número peligrosamente bajo de un tipo células blancas de la sangre necesarias para combatir infecciones
• disminución de un tipo de células blancas de la sangre que ayudan a combatir las infecciones, disminución de las plaquetas (células de la sangre que ayudan a detener las hemorragias)
• reacción alérgica grave caracterizada por fiebre, hinchazón de la boca, cara, labios o lengua, dificultad respiratoria, picores, erupción cutánea y algunas veces descenso de la presión arterial
• secreción inadecuada de la hormona que controla el volumen de orina
• ingesta de agua peligrosamente excesiva, complicaciones de la diabetes incontrolada, con peligro para la vida
• disminución del azúcar en sangre, ingesta excesiva de agua
• ausencia de emociones
• incapacidad para conseguir el orgasmo
• síndrome neuroléptico maligno (confusión, disminución o pérdida de consciencia, fiebre alta y rigidez muscular grave), pérdida repentina del riego de sangre al cerebro (ictus o “mini” ictus), sin respuesta a estímulos, pérdida de la consciencia, disminución del nivel de consciencia, trastorno del equilibrio
• problemas en los vasos sanguíneos del cerebro, coma debido a diabetes incontrolada, coordinación anormal, agitación de la cabeza
• glaucoma (aumento de la presión del globo ocular), problemas de movimientos de los ojos, giro de los ojos, hipersensibilidad de los ojos a la luz, aumento del lagrimeo, enrojecimiento de los ojos
• latido irregular del corazón
• coágulos de sangre en las venas especialmente en las piernas (los síntomas incluyen hinchazón, dolor y enrojecimiento de la pierna), que pueden dirigirse a través de los vasos sanguíneos a los pulmones provocando dolor en el pecho y dificultad respiratoria. Si usted sufre alguno de estos síntomas solicite ayuda médica inmediatamente
• disminución del oxígeno en partes del cuerpo (debido a la disminución del flujo sanguíneo), rubor
• problemas en la respiración durante el sueño (apnea del sueño), respiración rápida, superficial, neumonía causada por aspiración de alimentos, congestión de las vías respiratorias, trastorno de la voz
• inflamación del páncreas, obstrucción intestinal, hinchazón de la lengua, incontinencia fecal, heces muy duras, dificultad al tragar, labios agrietados, ausencia del movimiento del intestino que provoca obstrucción
• color amarillo de la piel y los ojos (ictericia)
• reacción alérgica grave con hinchazón que puede afectar a la garganta, causando dificultad respiratoria
• erupción en la piel relacionada con el medicamento, decoloración de la piel, engrosamiento de la piel, piel o cuero cabelludo escamoso y con picor, caspa
• rotura de las fibras musculares y dolor muscular (rabdomiólisis), anomalía en la postura
• aumento de la CPK (creatina fosfoquinasa) en sangre, una enzima que algunas veces se libera con la degradación muscular, hinchazón de las articulaciones, debilidad muscular
• incapacidad para orinar
• priapismo (una erección prolongada que puede requerir tratamiento quirúrgico)
• dolor en las mamas, malestar en las mamas, crecimiento de las glándulas de las mamas, crecimiento de la mama, secreción por las mamas
• temperatura corporal muy baja, disminución de la temperatura corporal, escalofríos, aumento de la temperatura corporal, sensación de sed, síntomas de abstinencia al medicamento
• acumulación de pus debido a una infección en el lugar de la inyección, infección profunda de la piel, quiste en el lugar de la inyección, moratón en el lugar de la inyección
Frecuencia no conocida: no puede estimarse a partir de los datos disponibles
• azúcar en la orina
Los siguientes efectos adversos han aparecido con el uso de otro medicamento llamado risperidona que es muy similar a paliperidona, por tanto, también se espera que aparezcan con este medicamento: otros tipos de problemas de los vasos sanguíneos en el cerebro, ruidos crepitantes de los pulmones, muerte de las células de la piel en el lugar de la inyección y úlcera en el lugar de la inyección.
También pueden aparecer problemas oculares durante la cirugía de cataratas. Durante la cirugía de cataratas puede darse una alteración llamada síndrome del iris flácido intraoperatorio (IFIS) si está tomando o ha tomado Xeplion. Si necesita someterse a cirugía de cataratas asegúrese de informar a su oftalmólogo si está tomando o ha tomado este medicamento.
Comunicación de efectos adversos
Si experimenta cualquier efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Xeplion
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Xeplion
El principio activo es paliperidona.
Cada jeringa precargada de Xeplion 25 mg contiene 39 mg de palmitato de paliperidona.
Cada jeringa precargada de Xeplion 50 mg contiene 78 mg de palmitato de paliperidona.
Cada jeringa precargada de Xeplion 75 mg contiene 117 mg de palmitato de paliperidona.
Cada jeringa precargada de Xeplion 100 mg contiene 156 mg de palmitato de paliperidona.
Cada jeringa precargada de XeplionN 150 mg contiene 234 mg de palmitato de paliperidona.
Los demás componentes son:
Polisorbato 20
Polietilenglicol 4000
Ácido cítrico monohidrato
Fosfato ácido disódico anhidro
Fosfato diácido de sodio monohidratado
Hidróxido de sodio (para ajuste del pH)
Agua para preparaciones inyectables
Aspecto del producto y contenido del envase
Xeplion es una suspensión inyectable de liberación prolongada de color blanco a blanquecino, que viene en una jeringa precargada.
Cada envase contiene 1 jeringa precargada y 2 agujas.
Envase de inicio del tratamiento:
Cada envase contiene 1 envase de Xeplion 150 mg y 1 envase de Xeplion 100 mg. Puede que solamente estén comercializados algunos tamaños de envase.
Titular de la autorización de comercialización
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
Responsable de la fabricación
Janssen Pharmaceutica N.V.
Turnhoutseweg 30 B-2340 Beerse Bélgica
medicamento dirigiéndose al representante local del
Pueden solicitar más información respecto a este titular de la autorización de comercialización. Authorisation Holder.
Lietuva
UAB "JOHNSON & JOHNSON" Tel: +370 5 278 68 88
Luxembourg/Luxemburg
Janssen-Cilag NV Tél/Tel: +32 14 64 94 11
Magyarország JANSSEN-CILAG Kft.
Tel.:+36 1 884 2858
Malta
AM MANGION LTD Tel: +356 2397 6000
Nederland
JANSSEN-CILAG B.V.
Tel: +31 13 583 73 73
Norge
JANSSEN-CILAG AS Tlf: + 47 24 12 65 00
Osterreich
Janssen-Cilag Pharma GmbH Tel: +43 1 610 300
Polska
JANSSEN-CILAG Polska Sp. z o.o. Tel.: + 48 22 -237 6000
Belgie/Belgique/Belgien
Janssen-Cilag NV Tel/Tél: +32 14 64 94 11
Bt^rapnn
"fl^OHCBH & fl^OHCtH Etarapna” EOOfl Tea.:+359 2 489 9400
Ceská republika JANSSEN-CILAG s.r.o.
Tel:+420 227 012 227
Danmark
JANSSEN-CILAG A/S Tlf: +45 45 94 82 82
Deutschland
JANSSEN-CILAG GmbH Tel: +49 2137-955-955
Eesti
UAB "JOHNSON & JOHNSON" Eesti filiaal Tel.: + 372 617 7410
EXXáSa
JANSSEN-CILAG Oap^aKenriK^ A.E.B.E T^: +30 210 80 90 000
España
JANSSEN-CILAG, S.A.
Tel: +34 91 722 81 00
France
JANSSEN-CILAG
Tel: 0800 25 50 75 / + 33 1 55 00 40 03
Hrvatska
Johnson & Johnson S.E. d.o.o. Tel: +385 1 6610 700
Ireland
JANSSEN-CILAG Ltd.
Tel: +44 1494 567 444
Ísland
JANSSEN-CILAG C/o Vistor hf Sími: +354 535 7000
Portugal
JANSSEN-CILAG FARMACEUTICA, LDA
Tel: +351 21 43 68 835 Romanía
Johnson & Johnson Romanía SRL Tel: +40 21 207 1800
Slovenija
Johnson & Johnson d.o.o.
Tel: + 386 1401 18 30
Slovenská republika
Johnson & Johnson s.r.o.
Tel: +421 232 408 400
Italia
Janssen-Cilag SpA Tel: +39 02/2510.1
Kúnpoq
BapváPag Xar^nnavay^g AxS T^: +357 22 207 700
Suomi/Finland
JANSSEN-CILAG OY Puh/Tel: +358 207 531 300
Sverige
JANSSEN-CILAG AB Tel: +46 8 626 50 00
Latvija United Kingdom
UAB "JOHNSON & JOHNSON" filíale Latvija JANSSEN-CILAG Ltd. Tel: +371 6789 3561 Tel: +44 1494 567 444
Fecha de la última revisión de esde prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Esta información está destinada únicamente a médicos o profesionales sanitarios y deben leerla junto con la información de prescripción completa (Resumen de las Características del Producto).
La suspensión inyectable es para un solo uso. Se debe examinar visualmente para detectar cualquier partícula extraña antes de la administración. No use el producto si la jeringa no se encuentra visualmente libre de partículas extrañas.
El envase contiene una jeringa precargada y dos agujas de seguridad (una aguja del calibre 22 de 1% pulgadas [38,1 mm x 0,72 mm] y una aguja del calibre 23 de 1 pulgada [25,4 mm x 0,64 mm]) para inyección intramuscular. Xeplion también está disponible en forma de un Kit de iniciación del tratamiento que contienen una segunda jeringa precargada y dos agujas de seguridad adicionales.

(1) Calibre 22 x 11/2” (Eje de color gris)
(2) Calibre 23 x 1” (Eje de color azul)
(3) Jeringa precargada
(4) Eje
(5) Protector de la punta
1. Agite la jeringa vigorosamente como mínimo durante 10 segundos para asegurar una suspensión homogénea.
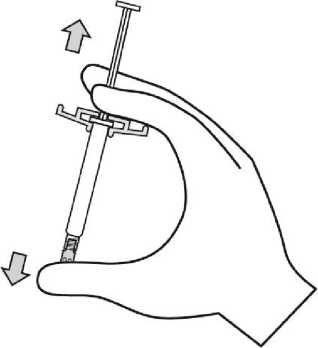
2. Seleccione la aguja adecuada.
La primera dosis de inicio de Xeplion (150 mg) se administra el Día 1 en el músculo DELTOIDES utilizando la aguja para la inyección en el DELTOIDES. La segunda dosis de inicio de Xeplion (100 mg) se administra también en el músculo DELTOIDES una semana más tarde (Día 8) utilizando la aguja para la inyección en el DELTOIDES.
Si al paciente se le cambia de risperidona inyectable de acción prolongada a Xeplion, la primera inyección de Xeplion (rango de dosis de 25 mg a 150 mg) se puede administrar en el músculo DELTOIDES o en el GLÚTEO, utilizando la aguja apropiada para el lugar de la inyección, en el momento de la siguiente inyección programada.
Posteriormente, las inyecciones de mantenimiento mensuales se pueden administrar tanto en el músculo DELTOIDES como en el GLÚTEO utilizando la aguja adecuada para el lugar de la inyección.
En el caso de la inyección en el DELTOIDES, si el paciente pesa < 90 kg, utilice una aguja del calibre 23 de 1 pulgada (25,4 mm x 0,64 mm) (aguja con eje de color azul); si el paciente pesa > 90 kg, utilice la aguja del calibre 22 de 1% pulgadas (38,1 mm x 0,72 mm) (aguja con eje de color gris).
En el caso de la inyección en el GLÚTEO, utilice una aguja del calibre 22 de 1% pulgadas (38,1 mm x 0,72 mm) (aguja con eje de color gris).
3. Mientras sostiene la jeringa en posición vertical, quite el protector de goma de la punta con un movimiento de giro.
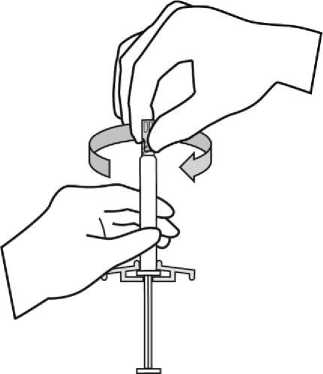
4. Abra hasta la mitad la bolsa del blíster de la aguja de seguridad. Sujete la cubierta de la aguja mediante el papel de plástico de la bolsa que acaba de abrir. Acople la aguja de seguridad a la conexión luer de la jeringa con un sencillo movimiento de giro en el sentido de las agujas del reloj.
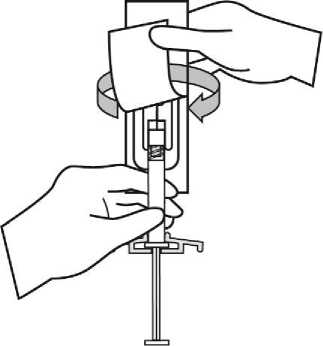
5. Tire de la funda para separarla de la aguja siguiendo una línea recta. No gire la funda, dado que la aguja podría soltarse de la jeringa.
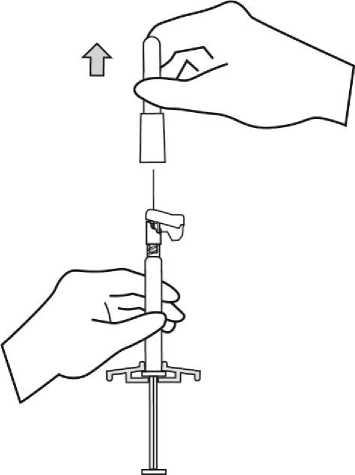
6. Sitúe la jeringa con la aguja colocada en posición vertical para proceder a la eliminación del aire. Elimine el aire de la jeringa empujando el émbolo cuidadosamente hacia delante.
7. Inyecte todo el contenido por vía intramuscular lentamente, profundamente en el músculo deltoides o glúteo seleccionado del paciente. No se debe administrar por vía intravascular o subcutánea.
8. Una vez completada la inyección, utilice el pulgar u otro dedo de la mano (8a, 8b) o una superficie plana (8c) para activar el sistema de protección de la aguja. El sistema está completamente activado cuando se oye un chasquido. Deseche la jeringa con la aguja de forma adecuada.
8a

8b
8c
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
85