Xeomin 100 Unidades Polvo Para Solucion Inyectable
Prospecto: información para el paciente XEOMIN 100 unidades polvo para solución inyectable
Neurotoxina de Clostridium botulinum tipo A (150 kD), sin proteínas complejantes
Lea todo el prospecto detenidamente antes de empezar ausareste medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
• Este medicamento se le ha recetado solamente a usted,y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico,ofarmacéuticoo enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es XEOMIN y para qué se utiliza
2. Qué necesita saber antes de empezar a usar XEOMIN
3. Cómo usar XEOMIN
4. Posibles efectos adversos
5. Conservación de XEOMIN
6. Contenido del envase e información adicional
1. Qué es XEOMIN y para qué se utiliza
XEOMIN pertenece al grupo de medicamentos denominados relajantes musculares.
XEOMIN está indicado en el tratamiento de los siguientes trastornos en adultos:
• espasmo de los párpados (blefarospasmo)
• torsión del cuello (tortícolis espasmódica)
• incremento de la tensión muscular/ rigidez muscular incontrolable en brazos o manos tras sufrir un ictus (espasticidad del miembro superior secundaria a un ictus, manifestada con un patrón clínico de flexión de muñeca y puño cerrado)
2. Qué necesita saber antes de empezar a usar XEOMIN No use XEOMIN
• Si es alérgico a la neurotoxina botulínica de tipo A o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
• Si padece un trastorno generalizado de la actividad muscular (por ejemplo, miastenia grave, síndrome de Lambert-Eaton)
• Si presenta infección o inflamación en el lugar propuesto para la inyección Advertencias y precauciones
Los efectos adversos pueden ocurrir por inyecciones mal colocadas de neurotoxina botulínica de tipo A que paralizan temporalmente grupos de músculos próximos. Se han producido informes muy raros de efectos adversos que pueden estar relacionados con la diseminación de la toxina botulínica lejos del lugar de inyección (por ejemplo, debilidad muscular excesiva, dificultades para tragar o ingesta accidental de
alimento o bebida en las vías respiratorias). Los pacientes que reciben las dosis recomendadas pueden experimentar debilidad muscular excesiva.
Si la dosis es demasiado alta o las inyecciones demasiado frecuentes, el riesgo de formación de anticuerpos puede aumentar. La formación de anticuerpos puede hacer que fracase el tratamiento con la toxina botulínica de tipo A, independientemente de la indicación para la que se pretenda utilizar.
Dígale a su médico antes de utilizar XEOMIN:
• si padece algún tipo de trastorno hemorrágico
• si recibe sustancias que impiden la coagulación de la sangre (por ejemplo, cumarina, heparina, ácido acetil salicílico, clopidogrel)
• si los músculos que van a recibir la inyección muestran una debilidad pronunciada (disminución del volumen muscular)
• si padece esclerosis lateral amiotrófica (ELA), que puede conducir a una pérdida del tejido muscular
• si padece cualquier enfermedad que altere la interacción entre nervios y músculos esqueléticos (trastorno neuromuscular periférico)
• si tiene o ha tenido dificultades para tragar
• si ha tenido problemas con inyecciones de toxina botulínica de tipo A en el pasado
• si va a sufrir alguna intervención quirúrgica
Inyecciones repetidas con XEOMIN
Si recibe inyecciones repetidas con XEOMIN, el efecto puede aumentar o disminuir. Las posibles razones son:
• su médico puede seguir un procedimiento diferente cuando prepare la solución para inyección
• diferentes intervalos de tratamiento
• inyecciones en otro músculo
• variación marginal de la eficacia del principio activo de XEOMIN
• ausencia de respuesta/fracaso de la terapia durante el tratamiento.
Si ha llevado una vida inactiva durante un largo periodo de tiempo, deberá reanudar gradualmente la actividad después de la inyección de XEOMIN.
En caso de que experimente alguno de los siguientes síntomas, póngase en contacto con su médico y busque atención médica inmediatamente:
• dificultad para respirar, tragar o hablar
• urticaria, hinchazón incluyendo hinchazón de la cara o la garganta, respiración sibilante, sensación de desmayo y dificultad para respirar (posibles síntomas de reacciones alérgicas graves)
Espasmo de los párpados (blefarospasmo)
Dígale a su médico antes de utilizar XEOMIN si:
• ha sido sometido previamente a cirugía ocular. Su médico tomará las debidas precauciones
• presenta riesgo de desarrollar una enfermedad llamada glaucoma de ángulo estrecho. Esta enfermedad puede causar una elevación de la presión interna del ojo y puede conducir a una lesión en el nervio óptico. Su médico sabrá si está en riesgo.
Durante el tratamiento pueden producirse pequeñas manchas hemorrágicas en los tejidos blandos del párpado. Su médico puede limitar este riesgo mediante la aplicación inmediata de una compresión suave en el punto de inyección.
Después de recibir una inyección de XEOMIN en el músculo del ojo se puede producir una disminución del parpadeo, que puede llevar a una exposición prolongada de la parte delantera transparente del ojo (córnea). Esta exposición puede producir una lesión de la superficie y una inflamación (ulceración de la córnea). Esto puedo ocurrir con más frecuencia si sufre trastornos de los nervios faciales.
Torsión del cuello (tortícolis espasmódica)
Después de la inyección puede desarrollar dificultades para tragar de grado leve a intenso, lo que puede llevar a problemas con la respiración y puede presentar un riesgo mayor de inhalar líquidos o sustancias extrañas. Las sustancias extrañas en sus pulmones pueden producir una inflamación o infección (neumonía). Su médico le dará un tratamiento especial si lo necesita (por ejemplo, nutrición artificial).
La dificultad para tragar puede durar de dos a tres semanas después de la inyección, pero se ha descrito un caso en el que duró hasta cinco meses.
Incremento de la tensión muscular y/o rigidez muscular incontrolable en brazos o manos tras sufrir un ictus (espasticidad del miembro superior secundaria a un ictus)
XEOMIN puede utilizarse para tratar la tensión muscular y la rigidez en diferentes partes del miembro superior, por ejemplo, codo, antebrazo o mano. XEOMIN es efectivo en combinación con los métodos de tratamiento habituales. XEOMIN debería utilizarse junto con estos otros métodos.
No es probable que este medicamento pueda aumentar el arco de movimiento de las articulaciones donde el músculo que lo rodea ha perdido su capacidad de estiramiento.
Niños y adolescentes
No administre este medicamento a niños entre 0 y 17 años porque no se ha investigado todavía el uso de XEOMIN en niños y adolescentes y, por lo tanto, no se recomienda.
Otros medicamentos y XEOMIN
Comunique a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
En teoría, el efecto de XEOMIN puede potenciarse por:
• medicamentos utilizados para tratar ciertas enfermedades infecciosas (espectinomicina o antibióticos aminoglucósidos [p.e. neomicina, kanamicina, tobramicina])
• otros medicamentos que relajan los músculos (por ejemplo, los relajantes musculares de tipo tubocurarina) Estos medicamentos se utilizan, por ejemplo, para anestesia general. Antes de someterse a una operación, comente a su anestesista si ha recibido XEOMIN.
En estos casos, XEOMIN debe utilizarse cuidadosamente.
El efecto de XEOMIN puede verse reducido por el uso de determinados medicamentos para la malaria y el reumatismo (conocidos como 4-aminoquinolinas).
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de que le administren este medicamento.
No debe utilizar XEOMIN durante el embarazo, a no ser que su médico decida que la necesidad y que el potencial beneficio justifican el posible riesgo en el feto.
No se recomienda XEOMIN en periodo de lactancia.
Conducción y uso de máquinas
No debe conducir ni realizar otras actividades potencialmente peligrosas si presenta caída de párpados, debilidad (astenia), debilidad muscular, mareo o trastorno de la visión.
Si tiene alguna duda, consulte a su médico.
3. Cómo usar XEOMIN
XEOMIN sólo puede ser administrado por profesionales sanitarios con experiencia en la aplicación de la toxina botulínica.
Su médico elegirá la mejor dosificación para usted y el número óptimo de puntos de inyección en el músculo tratado. El resultado del tratamiento inicial con XEOMIN deberá ser evaluado, pudiendo dar lugar a un ajuste de la dosis hasta alcanzarse el efecto terapéutico deseado.
Si usted tiene la impresión de que el efecto de XEOMIN es demasiado intenso o demasiado débil, dígaselo a su médico. En los casos en que no se observe efecto terapéutico, deberán plantearse otros tratamientos alternativos.
Espasmo de los párpados (blefarospasmo)
Generalmente, el efecto inicial suele manifestarse a los cuatro días de de la inyección. El efecto de cada tratamiento dura aproximadamente de 3 a 4 meses; sin embargo, la duración puede ser significativamente más larga o más corta. Si es necesario, el tratamiento puede repetirse. La dosis inicial recomendada es de hasta 25 unidades por ojo, y la dosis total recomendada en las siguientes sesiones de tratamiento es de hasta 100 unidades por sesión.
Normalmente, el tratamiento usado con una frecuencia superior a cada tres meses no confiere ningún efecto beneficioso adicional.
Torsión del cuello (tortícolis espasmódica)
El efecto inicial suele manifestarse a los siete días de la inyección. El efecto de cada tratamiento dura aproximadamente de 3 a 4 meses; sin embargo, la duración puede ser significativamente más larga o más corta. El periodo entre cada sesión de tratamiento deberá ser por lo menos de 10 semanas. La dosis recomendada por cada lugar de inyección es de hasta 50 unidades y la dosis máxima para la primera sesión de tratamiento es de 200 unidades. Su médico le puede administrar dosis de hasta 300 unidades en las siguientes sesiones dependiendo de la respuesta.
Incremento de la tensión muscular y/o rigidez muscular incontrolable en brazos o manos tras sufrir un ictus (espasticidad del miembro superior secundaria a un ictus)
Los pacientes informaron del inicio del efecto a los 4 días del comienzo del tratamiento. Se observó una mejoría del tono muscular a las 4 semanas. La mejora máxima del tono muscular se alcanzó a las 4 semanas. En general, el efecto del tratamiento duró 12 semanas. La dosis recomendada no debe exceder las 400 unidades por sesión de tratamiento. El periodo entre cada sesión de tratamiento debe ser de al menos 12 semanas.
XEOMIN disuelto está indicado para ser inyectado en el músculo.
Si le inyectan más XEOMIN del que necesita
Síntomas de sobredosis
Los síntomas de sobredosis no se observan inmediatamente después de la inyección y pueden consistir en debilidad general, caída del párpado, visión doble, dificultades para respirar, tragar o para hablar, y parálisis de los músculos respiratorios o dificultades para tragar que podrían causar neumonía.
Medidas a seguir en casos de sobredosis
En el caso de que presente síntomas de sobredosis, busque atención médica de urgencia inmediatamente o pida a sus familiares que lo hagan, y procure que lo ingresen en el hospital. Puede ser necesaria la supervisión médica durante varios días y el uso de ventilación asistida.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, XEOMIN puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos tales como debilidad muscular excesiva o dificultades para tragar están causados por la relajación de los músculos distantes al punto de inyección de XEOMIN. Las dificultades para tragar pueden causar la inhalación de cuerpos extraños que dan lugar a inflamación pulmonar y en algunos casos, a la muerte.
Se puede producir una reacción alérgica con XEOMIN. Se han notificado raramente reacciones alérgicas inmediatas graves (anafilaxia) o reacciones alérgicas al suero del producto (enfermedad del suero), que causan, por ejemplo, dificultad para respirar (disnea), habones (urticaria) o inflamación del tejido blando (edema). Algunas de estas reacciones se han observado después del uso del complejo convencional de toxina botulínica de tipo A. Se produjeron cuando la toxina fue administrada sola o en combinación con otros productos que se sabe que causan reacciones similares. Una reacción alérgica puede causar cualquiera de los síntomas siguientes:
• dificultad para respirar, tragar o hablar debido a la inflamación de la cara, labios, boca o garganta
• inflamación de las manos, pies o tobillos
Si observa cualquiera de estos efectos adversos, por favor, informe a su médico inmediatamente o pida a sus familiares que lo hagan y acuda al servicio de urgencias de su hospital más próximo.
Por lo general, los efectos adversos se observan en la primera semana después del tratamiento y son transitorios. Estos efectos pueden estar relacionados con el medicamento, técnica de inyección o ambos.
Los efectos adversos pueden restringirse a la zona circundante al punto de inyección (por ejemplo, debilidad muscular localizada, dolor local, inflamación, parestesia, sensación reducida al tacto (hipoestesia), dolor a la palpación, inflamación (general), inflamación del tejido blando (edema), rojez (eritema), picor, infección localizada, hematoma, hemorragia y/o cardenales).
La inyección de la aguja puede causar dolor. Este dolor o la ansiedad producida por las agujas pueden dar lugar a desmayos o una bajada de la presión arterial.
Espasmo de los párpados (blefarospasmo)
Se han notificado los siguientes efectos adversos con XEOMIN:
Muy Frecuentes (pueden afectar a más de 1 de cada 10personas):
Caída del párpado (ptosis), ojos secos
Frecuentes (pueden afectar hasta a 1 de cada 10personas):
Visión borrosa, dificultad de visión, visión doble (diplopía), aumento de las lágrimas, sequedad de boca, dificultades para tragar (disfagia), dolor de cabeza, dolor en el lugar de inyección, fatiga, debilidad muscular, debilidad del músculo facial (parálisis facial), urticaria
Torsión del cuello (tortícolis espasmódica)
Se han comunicado los siguientes efectos adversos con XEOMIN:
Muy Frecuentes (pueden afectar a más de 1 de cada 10personas):
Dificultad para tragar (disfagia)
Frecuentes (pueden afectar hasta a 1 de cada 10personas):
Dolor de cuello, debilidad muscular, dolor musculoesquelético (mialgia), rigidez musculoesquelética, espasmo muscular, dolor de cabeza, mareo, dolor en el lugar de inyección, debilidad (astenia), sequedad de boca, nausea, aumento de sudoración (hiperhidrosis), infección del tracto respiratorio superior, sensación de desmayo (presíncope)
Poco frecuentes (pueden afectar hasta a 1 de cada 100 personas):
Trastornos del habla (disfonía), dificultades para respirar (disnea), urticaria
El tratamiento de la torsión del cuello puede causar dificultad para tragar, con distintos grados de intensidad. Esto puede llevar a la inhalación de materiales extraños, que pueden requerir la intervención médica. La dificultad para tragar puede persistir de dos a tres semanas después de la inyección, pero en un caso se ha notificado que duró cinco meses. La dificultad para tragar parece depender de la dosis.
Incremento de la tensión muscular y/o rigidez muscular incontrolable en brazos o manos tras sufrir un ictus (espasticidad del miembro superior secundaria a un ictus)
Se han notificado los siguientes efectos adversos con XEOMIN:
Frecuentes (pueden afectar hasta a 1 de cada 10personas):
Dolor de cabeza, disminución de sensibilidad o sensación anormal de la piel incluyendo pérdida parcial de sensibilidad o sensación de calor, (disestesia, hipoestesia), debilidad muscular, sensación de calor, dolor en el lugar de inyección, dolor en extremidades, dificultades para tragar (disfagia)
Poco frecuentes (pueden afectar hasta a 1 de cada 100 personas):
Debilidad (astenia), mialgia
Algunos de estos efectos secundarios pueden estar relacionados con la enfermedad.
Experiencia después de la comercialización
Se han comunicado casos de síntomas similares a los de la gripe y reacciones de hipersensibilidad como hinchazón, inflamación de los tejidos blandos (edema), enrojecimiento, picor, sarpullido (local y generalizado) y dificultad para respirar.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de XEOMIN
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta del vial después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Vial sin abrir: No conservar a temperatura superior a 25 °C.
Solución reconstituida: Se ha demostrado la estabilidad química y física en uso durante 24 horas, a una temperatura de 2 a 8 °C.
Desde un punto de vista microbiológico, el producto debe ser utilizado inmediatamente. Si no se utiliza inmediatamente, los tiempos de conservación en uso y las condiciones previas al uso son responsabilidad del usuario y normalmente no deberían ser superiores a 24 horas a 2°C a 8°C, a menos que la reconstitución haya sido realizada en condiciones asépticas controladas y validadas.
Su médico no debe utilizar XEOMIN si el vial reconstituido según las instrucciones tiene un aspecto turbio o si contiene material floculado o en partículas.
Para consultar instrucciones sobre eliminación, ver información para profesionales sanitarios al final de este prospecto.
6. Contenido del envase e información adicional
Composición de XEOMIN
- El principio activo es neurotoxina de Clostridium Botulinum de tipo A (150 kD), sin proteínas complejantes.
Un vial contiene 100 unidades de neurotoxina de Clostridium Botulinum tipo A (150kD), sin proteínas complejantes. Debido a las diferencias en el ensayo de potencia, estas unidades son específicas de XEOMIN y no son aplicables a otras preparaciones de la toxina botulínica.
- Los demás componentes son: albúmina humana, sacarosa.
Aspecto del producto y contenido del envase
XEOMIN se presenta en forma de polvo para solución inyectable. El polvo es blanco.
Cuando está disuelto, XEOMIN es una solución transparente e incolora, que no contiene partículas.
Envases de 1, 2, 3, 4 ó 6 viales
Puede que solamente estén comercializados algunos formatos.
Titular de la autorización de comercialización
Merz Pharma España S.L.
Avenida de Bruselas 5 28108 Alcobendas - Madrid Teléfono: +34 91 657 47 84 Fax: +34 91 662 94 10
Fabricante
Merz Pharma GmbH & Co. KGaA Eckenheimer LandstraBe 100 60318 Frankfurt/Main P.O. Box 11 13 53 60048 Frankfurt/Main Alemania
Teléfono: +49-69/15 03-1 Fax: +49-69/15 03-200
Este medicamento está autorizado en los Estados Miembros del Espacio Económico Europeo con los siguientes nombres:
XEOMIN: Austria, Bulgaria, Chipre, Croacia, Republica checa, Dinamarca, Estonia,
Alemania, Grecia, Finlandia, Francia, Hungría, Irlanda, Islandia, Italia, Latvia, Liechtenstein, Lituania, Luxemburgo, Malta, Holanda, Noruega, Polonia,
Portugal, Rumania, Eslovaquia, Eslovenia, España, Suecia, Reino Unido XEOMEEN: Bélgica
Fecha de la última revisión de este prospecto: Diciembre 2015
La información detallada y actualizada de este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es
Esta información está destinada únicamente a profesionales del sector sanitario:
Instrucciones para la reconstitución de la solución inyectable:
XEOMIN se reconstituye antes de usar con solución inyectable de cloruro de sodio, a una concentración de 9 mg/ml (0,9%).
XEOMIN sólo se puede aplicar para su uso pretendido de tratar un paciente en una sesión.
Se recomienda llevar a cabo la reconstitución del vial y la preparación de la jeringa sobre toallas de papel con recubrimiento plástico, para recoger cualquier posible material vertido. Con una jeringa, se extrae una cantidad adecuada de disolvente (ver el cuadro de dilución). Después de la inserción vertical de la aguja a través del tapón de goma, el solvente inyectarse con cuidado en el vial con el fin de evitar la formación de espuma. Se recomienda para la reconstitución una aguja de calibre 20-27G. El vial debe desecharse si el vacío no aspira el disolvente hacia el interior del vial. Separar la jeringa del vial y mezclar XEOMIN con el solvente removiendo cuidadosamente e invirtiendo el vial, no agitar con energía. Si es preciso, la aguja para reconstitución debe permanecer en el vial y la cantidad requerida de solución debe extraerse con una nueva aguja estéril adecuada para la inyección.


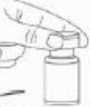

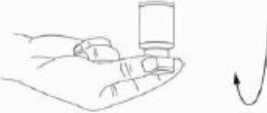
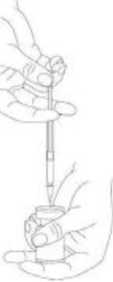
XEOMIN reconstituido es una solución transparente e incolora, libre de partículas.
XEOMIN no debe utilizarse si la solución reconstituida (preparada como se menciona anteriormente) tiene un aspecto turbio o contiene partículas.
Las posibles diluciones se indican en el siguiente cuadro:
|
Disolvente añadido (cloruro de sodio 9 mg/ml (0,9%) solución inyectable) |
Dosis resultante en unidades por 0,1 ml | |
|
0,5 ml |
20,0 U | |
|
1,0ml |
10,0 |
U |
|
2,0ml |
5,0 |
U |
|
4,0 ml |
2,5 |
U |
|
8,0 ml |
1,25 |
U |
Instrucciones para la eliminación
Deberá desecharse cualquier solución inyectable que se haya conservado más de 24 horas y cualquier solución inyectable sin usar.
Procedimiento a seguir para una eliminación segura de viales, jeringas y materiales utilizados
Cualquier vial no usado, solución reconstituida residual en el vial y/o jeringas deben ser sometidos a autoclave. Alternativamente, el XEOMIN restante puede ser inactivado añadiendo una de las siguientes soluciones: etanol 70%, isopropanol 50%, SDS (detergente aniónico) 0,1%, solución de hidróxido de sodio diluida (NaOH 0,1 N) o solución de hipoclorito de sodio diluida (NaOCl al menos 0 1%).
Después de la inactivación, los viales, jeringas y materiales utilizados no deben vaciarse, sino que deben desecharse en contenedores apropiados y eliminarse de acuerdo con los procedimientos locales.
Recomendaciones ante cualquier incidente que pueda producirse durante la manipulación con toxina botulínica
• Se debe limpiar cualquier resto del producto, ya sea usando material absorbente impregnado con cualquiera de las soluciones mencionadas anteriormente en caso del polvo, o con material absorbente seco, si se trata del producto reconstituido.
• Las superficies contaminadas se deben limpiar con material absorbente empapado en cualquiera de las soluciones anteriores y secar posteriormente.
• Si se rompe un vial, proceda como se menciona anteriormente, recogiendo con cuidado los pedazos de vidrio rotos y limpiando el producto vertido, evitando cortes en la piel.
• Si el producto entra en contacto con la piel, enjuague el área afectada con abundante agua.
• Si el producto entra en contacto con los ojos, enjuague con abundante agua o con una solución oftálmica de lavado.
• Si el producto entra en contacto con una herida, corte o piel no intacta, enjuague con abundante agua y tome las medidas médicas apropiadas de acuerdo a la dosis inyectada.
Estas instrucciones de uso, manipulación y eliminación deben seguirse estrictamente.
9 de 9