Wilate 500 Ui Fviii/500 Ui Fvw Polvo Y Disolvente Para Solucion Inyectable
Información obsoleta, busque otroFICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1 NOMBRE DEL MEDICAMENTO
Wilate, 500 UI FvW/500 UI FVIII, polvo y disolvente para solución inyectable Wilate, 1000 UI FvW/1000 UI FVIII, polvo y disolvente para solución inyectable
2 COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Wilate, producido a partir de plasma de donantes humanos, se presenta como polvo y disolvente para solución inyectable, con un contenido nominal de 500 UI/1000 UI de factor de von Willebrand humano (FvW) y factor VIII de coagulación humano (FVIII) por vial.
El producto contiene aproximadamente 100 UI/ml de factor de von Willebrand humano cuando se reconstituye con 5 ml/10 ml de agua para preparaciones inyectables con un 0,1 % de polisorbato 80.
La actividad específica de Wilate es >67 UI FvW :RCo/mg proteína.
La potencia del FVW (UI) se mide teniendo en cuenta la actividad del cofactor de ristocetina (FvW:RCo) comparado con el Estándar Internacional del Concentrado del Factor de von Willebrand (OMS).
El producto contiene aproximadamente 100 UI/ml de factor VIII de coagulación humano cuando se reconstituye con 5 ml/10 ml de agua para preparaciones inyectables con un 0,1% de polisorbato 80.
La potencia del FVIII (UI) se determina usando el ensayo cromogénico de la Farmacopea Europea. La actividad específica de Wilate es >67 UI FVIII:C/mg proteína.
Para consultar la lista completa de excipientes ver sección 6.1.
3 FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
Polvo liofilizado: polvo blanco o amarillo pálido ó sólido quebradizo.
4 DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Enfermedad de von Willebrand (EvW)
Tratamiento y profilaxis de la hemorragia o sangrados en cirugías en pacientes con EvW, cuando el tratamiento con desmopresina (DDAVP) es ineficaz o está contraindicado.
Hemofilia A
Tratamiento y profilaxis de las hemorragias en pacientes con hemofilia A (deficiencia congénita de FVIII).
. .. .
1/16 r:. "c-
an
4.2 Posología y forma de administración
El tratamiento debe realizarse bajo la supervisión de un médico especialista en el tratamiento de trastornos de la coagulación. El producto es de un solo uso y hay que administrar todo el contenido del vial. En caso de que quede algo de contenido, éste debe eliminarse de acuerdo con las normativas locales.
Enfermedad de von Willebrand (EvW)
La relación entre FvW:RCo y FVIII:C es 1:1. Generalmente, 1 UI/kg PC FvW:RCo y FVIII:C aumenta el nivel plasmático 1,5-2% de la actividad normal de la proteína respectiva. Normalmente, se necesita alrededor de 20 a 50 UI Wilate/kg PC para alcanzar una hemostasis adecuada. Esto aumentará el FvW:RCo y FVIII:C en los pacientes aproximadamente de un 30 a un 100%.
Puede requerirse una dosis inicial de 50 a 80 UI Wilate/kg PC, especialmente en pacientes con EvW tipo 3, en los que para mantener los niveles adecuados de plasma pueden ser necesarias dosis más altas que para otros tipos de EvW.
Población pediátrica
Los datos para recomendar el uso de Wilate en niños menores de 6 años son insuficientes. Prevención de la hemorragia en caso de cirugía o trauma grave:
Para la prevención de la hemorragia en caso de cirugía debe administrarse Wilate 1-2 horas antes de comenzar el procedimiento quirúrgico. Deben alcanzarse niveles de FvW:RCo > 60 UI/dl (> 60%) y los niveles de FVIII:C > 40 UI/dl (> 40%).
Hay que volver a administrar una dosis adecuada cada 12-24 horas de tratamiento. La dosis y la duración del tratamiento depende del estado clínico del paciente, el tipo y la gravedad de la hemorragia, así como de los niveles de FvW:RCo y FVIII:C.
En pacientes tratados con productos de FvW que contienen FVIII, hay que monitorizar los niveles plasmáticos de FVIII:C para revelar los niveles plasmáticos excesivos y sostenidos de FVIII:C, los cuales pueden incrementar el riesgo de episodios trombóticos, especialmente en pacientes con factores de riesgo conocidos clínicos o de laboratorio. En caso de observarse niveles plasmáticos excesivos de FVIII:C, hay que considerar la reducción de las dosis y/o prolongar el intervalo de administración o el uso de un producto de FvW que contenga un nivel bajo de FVIII.
Profilaxis:
Para una profilaxis antihemorrágica a largo plazo en pacientes EvW, deben administrarse dosis de 20-40 UI/kg de peso corporal 2 ó 3 veces por semana. En algunos casos, como en pacientes con sangrado gastrointestinal, pueden ser necesarias dosis más altas.
Hemofilia A
La dosis y la duración de la terapia de sustitución dependen de la gravedad de la deficiencia de FVIII, de la localización y de la intensidad de la hemorragia, así como del estado clínico del paciente.
T^IODE )
SOCIAL E IGUALDAD
Agenca española óe mcácamenos y
¿m
El número de unidades de FVIII administradas se expresa en Unidades Internacionales (UI), que están relacionadas con el estándar actual de la OMS para productos de FVIII. La actividad del FVIII en plasma se expresa en porcentaje (respecto al plasma humano normal) ó en UI (respecto a un Estándar Internacional para el FVIII en plasma).
Una UI de actividad del FVIII es equivalente a esa cantidad de FVIII en un mililitro de plasma humano normal.
Tratamiento a demanda:
El cálculo de la dosis requerida de FVIII se basa en la observación empírica de que 1 UI FVIII:C/kg PC aumenta el nivel plasmático en un 1,5-2% de la actividad normal. La dosis requerida se determina utilizando la siguiente fórmula:
UI requeridas = PC (kg) x aumento deseado del FVIII (%) (UI/dl) x 0,5 Ul/kg
La cantidad a administrar y la frecuencia de administración debe estar siempre orientada a la eficacia clínica en cada caso individual. En caso de los siguientes episodios hemorrágicos, la actividad del factor VIII no debe caer por debajo del nivel de la actividad plasmática dada (en % del plasma normal o en UI/dl) en el periodo correspondiente.
Se puede utilizar la siguiente tabla como guía de dosificación para episodios hemorrágicos y cirugía.
Pautas de tratamiento en hemorragias y cirugía
|
Grado de hemorragia/ Tipo de procedimiento quirúrgico |
Nivel de FVIII requerido (%) (UI/dl) |
Frecuencia de administración/Duración de la terapia (días) |
|
Hemorragia | ||
|
Hemartrosis temprana, hemorragia muscular u oral. |
20 - 40 |
Repetir cada 12 a 24 horas. Al menos 1 día, hasta que el episodio hemorrágico, como indica el dolor se resuelva o se consiga la cicatrización |
|
Hemartrosis más extensa, hemorragia muscular o hematoma |
30 - 60 |
Repetir la perfusión cada 12 a 24 horas durante 3 ó 4 días ó más hasta que el dolor y la discapacidad se hayan resuelto. |
|
Hemorragia amenazante para la vida |
60 - 100 |
Repetir la perfusión cada 8 a 24 horas hasta que remita el peligro. |
|
Cirugía | ||
|
Menor incluyendo extracción dental |
30 - 60 |
Cada 24 horas, al menos 1 día, hasta que se consiga la cicatrización. |
|
Mayor |
80 - 100 (pre- y postoperatorio) |
Repetir la perfusión cada 8 a 24 horas hasta que la herida cicatrice adecuadamente, después continuar la terapia al menos durante otros 7 días para mantener la actividad |
7/1 ¿ DDE 3/16 r:. "c-
Agenca española óe mcácamenos y
|
Grado de hemorragia/ Tipo de procedimiento quirúrgico |
Nivel de FVIII requerido (%) (UI/dl) |
Frecuencia de administración/Duración de la terapia (días) |
|
del FVIII del 30% al 60% (UI/dl). |
Profilaxis'.
Para la profilaxis a largo plazo frente a las hemorragias en pacientes con hemofilia A grave, deben administrarse dosis de 20 a 40 UI Wilate/kg PC a intervalos de 2 a 3 días. En algunos casos, especialmente en pacientes más jóvenes, pueden ser necesarios intervalos de administración más cortos o dosis más elevadas.
Perfusión continua:
Antes de una operación quirúrgica, hay que realizar un análisis farmacocinético para obtener una estimación del aclaramiento. La velocidad inicial de perfusión puede calcularse de la siguiente manera:
Velocidad de perfusión (Ul/kg/h) = aclaramiento (mL/kg/h) x nivel deseado en estado estacionario (UI/mL)
Después de las primeras 24 horas de perfusión continua, debe calcularse de nuevo el aclaramiento cada día usando la ecuación del estado estacionario con el nivel que se ha determinado y la velocidad de perfusión conocida.
Durante el curso del tratamiento, se recomienda una determinación adecuada de los niveles de FVIII:C para poder orientar la dosis a administrar y la frecuencia de las perfusiones repetidas. En el caso particular de intervenciones quirúrgicas mayores, es indispensable una monitorización precisa de la terapia de sustitución mediante pruebas de coagulación (FVIII:C). Puede variar la respuesta individual de los pacientes al tratamiento con FVIII, consiguiendo diferentes semividas y recuperaciones.
Pacientes no tratados anteriormente
Los datos actualmente disponibles están descritos en la sección 4.8.
Población pediátrica
Los datos para recomendar el uso de Wilate para la hemofilia A en niños menores de 6 años son insuficientes.
Forma de administración Vía intravenosa
La velocidad de inyección o de perfusión no debe superar los 2-3 ml por minuto.
TJRK) DE )
SOCIAL E IGUALDAD
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Al igual que con cualquier producto proteico derivado del plasma para administración intravenosa, es posible que se produzcan reacciones de hipersensibilidad de tipo alérgico. Hay que monitorizar estrechamente a los pacientes y observar cuidadosamente cualquier síntoma durante todo el periodo de perfusión.
Se informará a los pacientes de los primeros signos de las reacciones de hipersensibilidad que incluyen erupciones cutáneas, urticaria generalizada, opresión en el pecho, dificultad para respirar, hipotensión y anafilaxis. Si aparecen estos síntomas, los pacientes deben interrumpir la administración inmediatamente y ponerse en contacto con su médico.
En caso de shock, se deberán aplicar los estándares médicos vigentes para el tratamiento del shock.
Para prevenir la transmisión de enfermedades infecciosas cuando se administran medicamentos derivados de la sangre o plasma humanos, se toman medidas estándar como la selección de los donantes, cribaje de las donaciones individuales y mezclas de plasma para marcadores específicos de infección, así como la inclusión de procedimientos efectivos para la inactivación/eliminación viral en el proceso de producción. A pesar de ello, cuando se administran medicamentos derivados de sangre o plasma humano, no se puede descartar por completo la posibilidad de transmisión de enfermedades infecciosas. Esto también es aplicable a virus desconocidos o emergentes y otros patógenos.
Estos procedimientos se consideran efectivos para virus envueltos como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), así como para el virus sin cubierta de la hepatitis A. Estos procedimientos pueden tener un valor limitado frente a los virus sin cubierta tales como parvovirus B19.
La infección por parvovirus B19 puede resultar seria en mujeres embarazadas (infección fetal) y en pacientes con inmunodeficiencia o con eritropoyesis incrementada (p.e. en anemia hemolítica).
Es altamente recomendable que cada vez que se administre Wilate se registre el nombre y el número de lote del producto con objeto de mantener una trazabilidad entre el paciente y el lote del producto.
Se deberá considerar una vacunación adecuada (hepatitis A y B) para los pacientes que estén recibiendo de forma regular/repetida concentrados de FvW/FVIII derivado de plasma.
Enfermedad de von Willebrand (EvW)
Cuando se usa un producto de FvW que contiene FVIII, hay que advertir al médico que el tratamiento continuado puede producir un aumento excesivo de FVIII:C. En pacientes tratados con productos FvW que contienen FVIII, hay que monitorizar los niveles plasmáticos
TJRK) DE )
SOCIAL E IGUALDAD
Agenca española óe mcácamenos y
¿m
de FVIII:C para evitar niveles excesivos y sostenidos de FVIII:C, que pueden incrementar el riesgo de episodios trombóticos.
Existe un riesgo de aparición de episodios trombóticos cuando se administran productos FvW que contienen FVIII, en especial en pacientes con factores de riesgo conocidos clínicos o de laboratorio. Por tanto, hay que monitorizar a los pacientes de riesgo para observar la presencia de cualquier signo precoz de trombosis. Debe instituirse una profilaxis contra la tromboembolia venosa, de acuerdo con las recomendaciones actuales.
Los pacientes con EvW, especialmente los pacientes tipo 3, pueden desarrollar anticuerpos neutralizantes (inhibidores) del FvW. Si no se alcanzan los niveles previstos de actividad plasmática de FvW:Rco, o si no se controla la hemorragia con una dosis adecuada, habrá que llevar a cabo un análisis adecuado para determinar la posible presencia de un inhibidor FvW.
En pacientes con niveles elevados de inhibidor, la terapia FvW puede no ser eficaz y hay que considerar otras opciones terapéuticas. El tratamiento de estos pacientes debe estar dirigido por un médico con experiencia en el cuidado de pacientes con alteraciones hemostáticas.
Hemofilia A Hipersensibilidad
Es posible que se den reacciones de hipersensibilidad de tipo alérgico con Wilate. Este medicamento contiene trazas de proteínas humanas distintas al FVIII. Si se producen síntomas de hipersensibilidad, se debe recomendar a los pacientes que interrumpan el uso del medicamento inmediatamente y contacten con su médico. Los pacientes deben ser informados acerca de los signos iniciales de las reacciones de hipersensibilidad, que incluyen habón urticarial, urticaria generalizada, opresión en el pecho, sibilancias, hipotensión y anafilaxia.
En caso de shock, debe aplicarse el tratamiento médico habitual para el shock.
Inhibidores
La formación de anticuerpos neutralizantes (inhibidores) del FVIII es una complicación conocida en el tratamiento de individuos con hemofilia A. Estos inhibidores suelen ser inmunoglobulinas IgG dirigidas contra la actividad procoagulante del FVIII, que se cuantifica en Unidades Bethesda (UB) por ml de plasma utilizando el análisis modificado. El riesgo de desarrollar inhibidores está relacionado con la exposición a FVIII, siendo el mayor riesgo dentro de los 20 primeros días de exposición. En raras ocasiones los inhibidores pueden desarrollarse después de los 100 primeros días de exposición.
Se han observado casos de inhibidores recurrentes (de bajo título) tras el cambio de un producto con factor VIII a otro, en pacientes previamente tratados con más de 100 días de exposición con una historia clínica previa de desarrollo de inhibidores. Por tanto, se recomienda monitorizar a todos los pacientes cuidadosamente para la aparición de inhibidores tras cualquier cambio de producto.
En general, todos los pacientes tratados con productos de factor de coagulación VIII deben ser vigilados cuidadosamente, de cara al desarrollo de inhibidores, mediante las observaciones clínicas y pruebas de laboratorio adecuadas. Si no se alcanzan los niveles plasmáticos de actividad del FVIII esperados o si no se controla la hemorragia mediante una dosis adecuada, se debe realizar una prueba de presencia de inhibidor del FVIII. En pacientes con altos niveles de inhibidor, es posible que el tratamiento con FVIII no resulte eficaz y se deban considerar otras opciones terapéuticas. El tratamiento de esos pacientes debe ser dirigido por médicos con experiencia en el tratamiento de la hemofilia y de los inhibidores del FVIII.
6/16 r:. "c-
Agenca española óe mcácamenos y
an
Este medicamento contiene hasta 2,55 mmol de sodio (58,7 mg) por vial para 500 UI FvW y FVIII /vial y hasta 5,1 mmol sodio (117,3 mg) por vial para 1000 UI FvW y FVIII /vial. Lo que deberá tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se conocen interacciones con otros medicamentos.
4.6 Fertilidad, embarazo y lactancia
No se han llevado a cabo estudios de reproducción en animales con FvW/FVIII.
Enfermedad de von Willebrand (EvW)
No se dispone de experiencia en el tratamiento de mujeres embarazadas o en periodo de lactancia.
Wilate solo debe administrarse a mujeres embarazadas o en periodo de lactancia con deficiencia de FvW si está claramente indicado, teniendo en cuenta que el parto aumenta el riesgo de episodios hemorrágicos en estas pacientes.
Hemofilia A
Debido a la escasa frecuencia de hemofilia A en mujeres, no se dispone de experiencia sobre el tratamiento durante el embarazo y la lactancia. Por tanto, Wilate solo debe utilizarse durante el embarazo y la lactancia si está claramente indicado.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Wilate no influye sobre la capacidad para conducir y utilizar máquinas.
4.8_Reacciones adversas
Resumen del perfil de seguridad
Rara vez se han observado reacciones de hipersensibilidad o alérgicas (que pueden incluir angioedema, sensación de irritación y escozor en el punto de la perfusión, escalofríos, rubor, urticaria generalizada, cefaleas, habón urticarial, hipotensión, letargia, náuseas, cansancio, taquicardia, opresión en el pecho, hormigueo, vómitos y disnea), y en algunos casos pueden progresar a anafilaxis severa (incluyendo shock). En raras ocasiones, se ha observado fiebre.
Enfermedad de von Willebrand (EvW)
TEJIO DE /i6 POLITTCi
Los pacientes con EvW, especialmente los pacientes tipo 3, en muy raras ocasiones pueden desarrollar anticuerpos neutralizantes del FvW. Si aparecen estos inhibidores, la enfermedad se manifestará en si misma como una respuesta clínica inadecuada. Tales anticuerpos aparecen de forma estrechamente relacionada con las reacciones anafilácticas. Por tanto, debe evaluarse la presencia de un inhibidor en aquellos pacientes que sufran reacciones anafilácticas.
En todos esos casos, se recomienda contactar con un centro especializado en hemofilia.
No se han notificado casos de inhibidores para el factor von Willebrand en los ensayos clínicos ni tras su comercialización.
Existe riesgo de aparición de episodios trombóticos, en particular en pacientes con factores de riesgo conocidos clínicos o de laboratorio. Debe instituirse una profilaxis frente a la tromboembolia venosa, de acuerdo con las recomendaciones actuales.
En pacientes tratados con productos FvW que contienen FVIII los niveles plasmáticos excesivos y sostenidos de FVIII:C pueden incrementar el riesgo de episodios trombóticos.
Hemofilia A
Los pacientes con hemofilia A pueden desarrollar anticuerpos neutralizantes (inhibidores) del FVIII. La presencia de tales inhibidores se manifestará como una respuesta clínica insuficiente. En ese caso, se recomienda contactar con un centro especializado en hemofilia.
La experiencia con Wilate en pacientes no tratados previamente (PnTP) es limitada. En un ensayo clínico con 24 PnTP con un mínimo de 50 días de exposición tratados con Wilate, solo tres pacientes con un inhibidor mayor a 5 UB/ml persistente y clínicamente manifiesto fueron detectados. Tres pacientes desarrollaron bajos títulos sin ninguna manifestación clínica y dos pacientes tuvieron un bajo título de inhibidor en una sola ocasión sin resultados en el seguimiento.
Ver también la sección 4.2. No se observaron desarrollo de inhibidores en los pacientes tratados previamente.
Para información sobre seguridad frente a agentes transmisibles, ver sección 4.4 Tabla de reacciones adversas
La tabla que se presenta a continuación sigue la clasificación por órganos y sistemas MedDRA (SOC y nivel de términos preferentes).
Las frecuencias se han evaluado conforme a la convención siguiente: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación de oréanos del sistema |
Poco frecuentes |
Raras |
Muy raras |
|
(SOC) | |||
|
Trastornos del sistema inmunológico |
reacción de hipersensibilidad |
shock anafiláctico |
8/16 r:. "c-
Agenca española óe mcácamenos y
|
Trastornos generales y alteraciones en el lugar de administración |
fiebre | ||
|
Investigaciones |
inhibidores del FVIII |
inhibidores del FvW |
Descripción de reacciones adversas seleccionadas
Para consultar la descripción de las reacciones adversas seleccionadas, ver sección 4.4. Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaRAM.es.
4.8 Sobredosis
No se han notificado casos de sobredosis con FvW o FVIII humanos. En caso de sobredosis mayor pueden producirse episodios tromboembólicos.
5 PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antihemorrágicos: factores de coagulación: factor de Von Willebrand y factor VIII de coagulación en combinación Código ATC: B02BD06
Enfermedad de von Willebrand (EvW)
El FvW (del concentrado) es un componente normal del plasma humano y se comporta de la misma manera que el FvW endógeno.
La administración de FvW permite la corrección de los trastornos hemostáticos presentes en pacientes que sufren deficiencia de FvW (EvW) a dos niveles:
- El FvW restablece la adhesión plaquetaria al subendotelio vascular en el lugar del daño vascular (ya que se une tanto al subendotelio como a la membrana plaquetaria), proporcionando hemostasis primaria como muestra el acortamiento del tiempo de sangrado. Este efecto se produce inmediatamente y se sabe que depende en gran medida del nivel de polimerización de la proteína;
- FvW produce una corrección retardada de la deficiencia asociada al FVIII. El FvW administrado por vía intravenosa se une al FVIII endógeno (que normalmente es producido por el paciente) y estabilizando este factor, evita su rápida degradación.
9/16 r:. "c-
SOCIALE IGUALDAD Agenca española óe mece amenos y productos sari tares
Debido a esto, la administración de FvW puro (producto FvW con un bajo nivel de FVIII) restablece el nivel de FVIII:C a la normalidad como un efecto secundario tras la primera perfusión.
La administración de una preparación de FvW que contiene FVIII restablece el nivel FVIII:C a la normalidad inmediatamente después de la primera perfusión.
Además de este papel como una proteína protectora del FVIII, el FvW media la adhesión plaquetaria en las zonas del daño vascular y juega un papel en la agregación plaquetaria.
Hemofilia A
El complejo FVIII/FvW consiste en dos moléculas (FVIII y FvW) con diferentes funciones fisiológicas. Cuando se administra a un paciente hemofílico, el FVIII se une al FvW en la circulación del paciente. El FVIII activado (FVIIIa) actúa como un cofactor del factor IX activado (FIXa), acelerando la conversión del factor X a factor X activado (FXa). El FXa convierte la protrombina a trombina. Luego la trombina convierte el fibrinógeno en fibrina y se puede formar un coágulo.
La hemofilia A es un trastorno de la coagulación hereditario ligado al sexo debido a bajos niveles de FVIII:C y da como resultado un sangrado excesivo en las articulaciones, los músculos ó los órganos internos, producido de forma espontánea o como resultado de un trauma accidental o quirúrgico. Los niveles plasmáticos de FVIII son restituidos con la terapia de sustitución, consiguiéndose así corregir temporalmente la deficiencia del factor y las tendencias hemorrágicas.
5.2 Propiedades farmacocinéticas
Enfermedad de von Willebrand (EvW)
FvW (del concentrado) es un componente normal del plasma humano y actúa como el FvW endógeno.
Se observaron los siguientes resultados basados en el meta análisis de tres estudios farmacocinéticos que incluían a 24 pacientes evaluables con EvW de todos los tipos.
|
Todos los tipos EvW |
EvW tipo 1 |
EvW tipo 2 |
EvW tipo 3 | |||||||||||||||||
|
Parámetro |
N |
Media |
SD |
Min. |
Max. |
N |
Media |
SD |
Min. |
Max. |
N |
Media |
SD |
Min. |
Max. |
N |
Media |
SD |
Min. |
Max. |
|
Recuperación(%/IU/kg) |
24 |
1.56 |
0.48 |
0.90 |
2.93 |
2 |
1.19 |
0.07 |
1.14 |
1.24 |
5 |
1.83 |
0.86 |
0.98 |
2.93 |
17 |
1.52 |
0.32 |
0.90 |
2.24 |
|
AUC (0-inf) (h*%) |
23 |
1981 |
960 |
593 |
4831 |
2 |
2062 |
510 |
1701 |
2423 |
5 |
2971 |
1383 |
1511 |
4831 |
16 |
1662 |
622 |
593 |
2606 |
|
Semivida (h) |
24 |
23.3 |
12.6 |
7.4 |
58.4 |
2 |
39.7 |
18.3 |
26.7 |
52.7 |
5 |
34.9 |
16 |
17.5 |
58.4 |
17 |
18 |
6.2 |
7.4 |
30.5 |
|
MRT (h) |
24 |
33.1 |
19 |
10.1 |
89.7 |
2 |
53.6 |
25.9 |
35.3 |
71.9 |
5 |
53.5 |
24.6 |
27.8 |
89.7 |
17 |
24.7 |
8.5 |
10.1 |
37.7 |
|
Aclaramiento (mL/h/kg) |
24 |
3.29 |
1.67 |
0.91 |
7.41 |
2 |
2.66 |
0.85 |
2.06 |
3.27 |
5 |
1.95 |
1.02 |
0.91 |
3.31 |
17 |
3.76 |
1.69 |
1.83 |
7.41 |
Clave: AUC = área bajo la curva; MRT = tiempo medio de residencia
Hemofilia A
es-spc-500-1000-tc aemps var 23+rev.doc rev 19-05-2014 =I0'/16oliti;;a
— SOCIAL E IGUALDAD
Agencia española óe medícamenos y productos saltaros
¿m
El FVIII (del concentrado) es un componente normal del plasma humano y actúa como el FVIII endógeno. Tras la inyección del producto, aproximadamente entre dos terceras partes y tres cuartas partes del FVIII permanecen en la circulación. El nivel de FVIII:C alcanzado en el plasma debe estar entre un 80-120% del FVIII:C previsto.
FVIII:C disminuye de modo exponencial en dos fases. En las fase inicial, la distribución entre el compartimiento intravascular y otros compartimentos (fluidos corporales) se produce con una semivida de eliminación del plasma de 3 a 6 horas. En la siguiente fase más lenta, la semivida varía entre 8 a 18 horas, con una media de 15 horas, Esto se corresponde con la semivida biológica.
Se observaron los siguientes resultados en un estudio clínico en 12 pacientes (ensayo cromogénico, doble medición):
|
Parámetro |
Visita basal |
Visita a los 6 meses | ||
|
Media |
SD |
Media |
SD | |
|
Recuperación %/IU/kg |
FVIII:C 2.27 |
1.20 |
FVIII:C 2.26 |
1.19 |
|
AUCnorm % * h/IU/kg |
FVIII:C 31.3 |
7.31 |
FVIII:C 33.8 |
10.9 |
|
Semivida (h) |
FVIII:C 11.2 |
2.85 |
FVIII:C 11.8 |
3.37 |
|
MRT (h) |
FVIII:C 15.3 |
3.5 |
FVIII:C 16.3 |
4.6 |
|
Aclarameinto mL/h/kg |
FVIII:C 3.37 |
0.86 |
FVIII:C 3.24 |
1.04 |
Clave: AUC = área bajo la curva; MRT = tiempo medio de residencia; SD = desviación estándar
5.3 Datos preclínicos sobre seguridad
El FvW y el FVIII en Wilate son componentes normales del plasma humano y actúan como el FvW/FVIII endógenos.
Los análisis convencionales de seguridad de este tipo de compuestos en animales de laboratorio no aportan información útil a la experiencia clínica, y por tanto, no son requeridos.
6 Datos farmacéuticos 6.1 Lista de excipientes
Polvo: cloruro de sodio, glicina, sacarosa, citrato de sodio y cloruro de calcio Disolvente: agua para preparaciones inyectables con un 0,1 % de polisorbato 80
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, Wilate no debe mezclarse con otros medicamentos ni administrarse simultáneamente con otros preparados intravenosos en el mismo equipo de perfusión.
es-spc-500-1000-tc aemps var 23+rev.doc rev 19-05-2014 ^1¡¿Í6politisa
— SOCIAL E IGUALDAD
Agenca española Oe medcamcntosy productos santeros
an
Solo debe utilizarse el equipo de inyección/perfusión que se proporciona ya que puede fracasar el tratamiento como consecuencia de la adsorción de FVIII/FvW en la superficie interna de algunos equipos de perfusión.
6.3 Periodo de validez
3 años
Se ha demostrado que la solución reconstituida tiene una estabilidad de 4 horas a temperatura ambiente (max. +25°C). No obstante, para evitar la contaminación microbiológica, la solución reconstituida debe utilizarse inmediatamente.
6.4 Precauciones especiales de conservación
Conservar el polvo y el vial del disolvente en nevera (2-8°C). Conservar los viales en el embalaje exterior para protegerlos de la luz. No congelar.
El producto puede conservarse a temperatura ambiente (max. +25°C) durante 2 meses. En este caso el periodo de validez finaliza 2 meses después de que el producto ha sido sacado de la nevera por primera vez. El paciente debe anotar el nuevo periodo de validez en el embalaje exterior. La solución reconstituida debe utilizarse solo en una ocasión. Se eliminará la solución que sobra.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Tamaños de envase:
Wilate 500, 500 UI FvWy 500 UI FVIII 1 caja contiene:
1 vial de polvo, de vidrio tipo I, cerrado con un tapón (bromobutilo) y sellado con una cápsula
flip off.
1 vial con disolvente (5 ml agua para preparaciones inyectables con un 0,1% polisorbato 80), vidrio tipo I, cerrado con un tapón (clorobutilo) y sellado con una cápsula flip off
1 caja con los dispositivos de administración (1 jeringa desechable, 1 equipo de transferencia Mix2Vial®, 1 equipo de perfusión)
2 apósitos con alcohol
Wilate 1000, 1000 UI FvW y 1000 UI FVIII 1 caja contiene:
1 vial de polvo, de vidrio tipo I, cerrado con un tapón (bromobutilo) y sellado con una cápsula
flv off.
1 vial con disolvente (10 ml de agua para preparaciones inyectables con un 0,1% polisorbato 80), vidrio tipo I, cerrado con un tapón (clorobutilo) y sellado con una cápsula flip off
es-spc-500-1000-tc aemps var 23+rev.doc rev 19-05-2014 sH/S6ram;A
— SOCIAL E IGUALDAD
Agenca es parióla óe medicamentos y productos saltaros
an
1 caja con los dispositivos de administración (1 jeringa desechable, 1 equipo de transferencia [ Mix2Vial®], 1 equipo de perfusión)
2 apósitos con alcohol
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
• Lea todas las instrucciones y sígalas cuidadosamente.
• No utilice Wilate después de la fecha de caducidad que aparece en el envase.
• Durante el procedimiento descrito a continuación, debe mantenerse la esterilidad.
• La solución de la jeringa debe ser límpida o ligeramente nacarada. No inyectar soluciones turbias o que contengan sedimentos.
• Utilizar inmediatamente la solución preparada, para evitar una contaminación microbiana.
• Utilizar únicamente el equipo que se incluye. El uso de otro equipo de inyección/perfusión puede ocasionar un riesgo adicional y el fracaso del tratamiento.
Instrucciones para preparar la solución:
1. No utilizar el producto directamente de la nevera. Dejar el disolvente y el polvo en los viales cerrados hasta alcanzar la temperatura ambiente.
2. Quitar las cápsulas flip-off de ambos viales y limpiar los tapones de goma con uno de los algodones impregnados en alcohol que se incluyen.
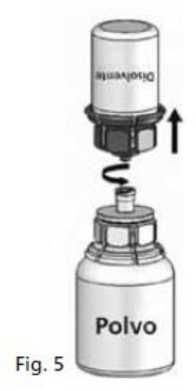
3. Colocar el vial de disolvente sobre una superficie plana y sujetarlo con firmeza. Coger el Mix2vial® (Fig. 1) y darle la vuelta. Colocar la parte azul del Mix2vial® sobre la parte superior del vial del disolvente y presionar con firmeza hasta que se oiga un chasquido (Fig. 2+3).
es-spc-500-1000-tc aemps var 23+rev.doc rev 19-05-2014 =T3"/Í6oliti;;a
— SOCIAL E IGUALDAD
Agenca es parióla óe medícamenos y productos saltaros
4. Colocar el vial del polvo sobre una superficie plana y sujetarlo con firmeza. Coger el vial de disolvente con el Mix2Vial® acoplado y darle la vuelta. Colocar la parte transparente sobre la parte superior del vial del polvo y presionar con firmeza hasta que se oiga un chasquido (Fig. 4). El disolvente fluye automáticamente al interior del vial del polvo.

Fig. 1
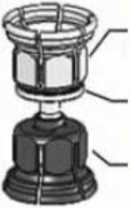
Adaptador del vial de polvo (transparente)
Filtro Integrado
Adaptador del vial de disolvente (azul)

5. Con ambos viales todavía acoplados, agitar suavemente el vial del polvo hasta que el producto se haya disuelto.
La disolución es completa en menos de 10 minutos a temperatura ambiente. Podría aparecer una ligera espuma durante la preparación. Desenroscar las dos partes del Mix2Vial® (Fig. 5). Desaparecerá la espuma.
Desechar el vial de disolvente vacío con la parte azul del Mix2Vial®.
Instrucciones para la Inyección:
Como precaución debe tomarse la velocidad del pulso antes y durante la inyección. Si se produce un marcado incremento en la velocidad del pulso, reducir la velocidad de la inyección o interrumpir la administración durante un breve periodo de tiempo.
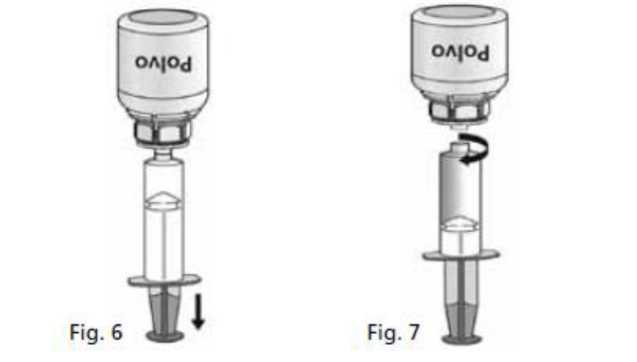
1. Acoplar la jeringa a la parte transparente del Mix2Vial®. Darle la vuelta al vial y extraer la solución al interior de la jeringa (Fig. 6). La solución en la jeringa debe ser límpida o
es-spc-500-1000-tc aemps var 23+rev.doc rev 19-05-2014 sH/S6reurcA
— SOCIAL E IGUALDAD
Agenca es parióla óe medicamentos y productos saltaros
íük
ligeramente nacarada. Una vez que la solución ha sido transferida, sujetar con firmeza el émbolo de la jeringa (manteniéndolo hacia abajo) y extraer la jeringa del Mix2Vial® (Fig.
7). Desechar el Mix2Vial® y el vial vacío.
2. Limpiar la zona donde se va a poner la inyección con uno de los apósitos con alcohol que se incluyen.
3. Acoplar la aguja de inyección que se incluye a la jeringa.
4. Insertar la aguja de inyección en la vena escogida. Si ha empleado un torniquete para ver la vena con más facilidad, este torniquete debe ser liberado antes de empezar a inyectar Wilate.
No debe fluir sangre al interior de la jeringa debido al riesgo de formación de coágulos de fibrina.
5. Inyectar la solución dentro de la vena a una velocidad lenta, no superior a 2-3 ml por minuto.
Si usa más de un vial de polvo de Wilate para un tratamiento, puede utilizar la misma aguja de inyección y la misma jeringa. El Mix2Vial® es para un solo uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7 TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Octapharma S.A.
Avda. Castilla, 2. (P.E. San Fernando)
Ed. Berlín, bajo
28830 San Fernando de Henares Madrid
8 NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
es-spc-500-1000-tc aemps var 23+rev.doc rev 19-05-2014 =^5í/16olitisa
— SOCIAL E IGUALDAD
Agenca es parióla óe medicamentos y productos s altanos
¿m
Wilate 500 UI FVIII/500 UI FvW: 75625 Wilate 1000 UI FVIII/1000 UI FvW: 75648
9 FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
Abril 2012
10 FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2014
16/16
SOCIAL E IGUALDAD Agenca española óe mece amenos y productos sananos
es-spc-500-1000-tc_aemps var 23+rev.doc rev 19-05-2014