Volibris 5 Mg Comprimidos Recubiertos Con Pelicula
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Volibris 5 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido contiene 5 mg de ambrisentan.
Excipiente(s) con efecto conocido:
Cada comprimido contiene aproximadamente 95 mg de lactosa monohidrato, aproximadamente 0,25 mg de lecitina (soja) (E322) y aproximadamente 0,11 mg de rojo Allura AC Aluminio Lake (E129).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película (comprimido).
Los comprimidos recubiertos con película son de color rosa pálido, cuadrados, convexos, con "GS" grabado en un lado y "K2C" en el otro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Volibris está indicado para el tratamiento de la hipertensión arterial pulmonar (HAP) en pacientes adultos clasificados como clase funcional (CF) II a III de la Organización Mundial de la Salud (OMS), incluyendo el uso en tratamiento de combinación (ver sección 5.1). Se ha demostrado la eficacia de este medicamento en HAP idiopática (HAPI) y en HAP asociada a enfermedad del tejido conectivo.
4.2 Posología y forma de administración
El tratamiento debe ser iniciado por un médico experimentado en el tratamiento de HAP.
Posología
Ambrisentan en monoterapia
Volibris se debe tomar por vía oral, se debe comenzar con una dosis de 5 mg una vez al día que se podrá aumentar a 10 mg diarios, dependiendo de la respuesta clínica y la tolerabilidad.
Ambrisentan en combinación con tadalafilo
Cuando se utiliza en combinación con tadalafilo, la dosis de Volibris se debe ajustar hasta alcanzar una dosis de 10 mg una vez al día.
En el ensayo AMBITION, los pacientes recibieron 5 mg de ambrisentan diariamente durante las primeras 8 semanas antes de ajustar a 10 mg, dependiendo de la tolerabilidad (ver sección 5.1). Cuando se utilizó en combinación con tadalafilo, los pacientes comenzaron con 5 mg de ambrisentan y 20 mg de tadalafilo. Dependiendo de la tolerabilidad, la dosis de tadalafilo se aumentó a 40 mg después de 4 semanas y la dosis de ambrisentan se aumentó a 10 mg después de 8 semanas. Más del 90% de los pacientes alcanzaron estas dosis. Dependiendo de la tolerabilidad, las dosis también se podrían haber disminuido .
Los escasos datos disponibles sugieren que la interrupción brusca del tratamiento con ambrisentan no está asociada con un empeoramiento rebote de la HAP.
Cuando se co-administra con ciclosporina A, la dosis de ambrisentan debe ser limitada a 5 mg una vez al día y el paciente debe ser cuidadosamente monitorizado (ver secciones 4.5 y 5.2).
Pacientes de edad avanzada
No es necesario realizar ajuste de la dosis en pacientes mayores de 65 años (ver sección 5.2).
Pacientes con insuficiencia renal
No es necesario realizar ajuste de la dosis en pacientes con insuficiencia renal (ver sección 5.2). Existe experiencia limitada con ambrisentan en individuos con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min); se debe iniciar el tratamiento con cautela en este subgrupo, y prestar especial cuidado si la dosis se incrementa hasta los 10 mg de ambrisentan.
Pacientes con insuficiencia hepática
No se ha estudiado el efecto de ambrisentan en pacientes con insuficiencia hepática (con o sin cirrosis). Debido a que las principales rutas metabólicas de ambrisentan son la glucuronidación y oxidación con posterior eliminación por vía biliar, se podría esperar que la insuficiencia hepática incremente la exposición (Cmax y AUC) a ambrisentan. Por lo tanto, no se debe iniciar el tratamiento con ambrisentan en pacientes con insuficiencia hepática grave, ni en aquellos con elevación de los valores de aminotransferasas hepáticas clínicamente significativa (más de 3 veces el límite superior de la normalidad (>3xLSN); ver secciones 4.3 y 4.4).
Población pediátrica
No se ha establecido la seguridad y eficacia de ambrisentan en niños y adolescentes menores de 18 años. No hay datos disponibles.
Forma de administración
Los comprimidos pueden tomarse con o sin alimentos y se recomienda tragarlos enteros. Se recomienda no fracturar, machacar o masticar el comprimido.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a la soja o a alguno de los excipientes incluidos en la sección 6.1. Embarazo (ver sección 4.6).
Mujeres en edad fértil que no utilicen un método anticonceptivo fiable (ver secciones 4.4 y 4.6).
Lactancia materna (ver sección 4.6).
Insuficiencia hepática grave (con o sin cirrosis) (ver sección 4.2).
Valores basales de aminotransferasas hepáticas, es decir, aspartato aminotransferasa (AST) y/o alanina aminotransferasa (ALT) >3xLSN (ver secciones 4.2 y 4.4).
Fibrosis pulmonar idiopática (FPI), con o sin hipertensión pulmonar secundaria (ver sección 5.1).
4.4 Advertencias y precauciones especiales de empleo
Ambrisentan no se ha estudiado en un número suficiente de pacientes que permita establecer el balance beneficio/riesgo en pacientes con HAP clasificados como clase funcional I de la OMS.
No se ha establecido la eficacia de ambrisentan en monoterapia en pacientes con HAP clasificados como clase funcional IV de la OMS. Si el estado clínico empeora, se debe considerar el cambio a un tratamiento recomendado en el estadío grave de la enfermedad (p. ej. epoprostenol).
Función hepática
La HAP se ha asociado con anomalías de la función hepática. Se han observado casos de hepatitis autoinmune, incluyendo una posible exacerbación de una hepatitis autoinmune subyacente, lesión hepática y elevaciones de las enzimas hepáticas potencialmente relacionadas con el tratamiento con ambrisentan (ver secciones 4.8 y 5.1). Por lo tanto, se deben evaluar los niveles de aminotransferasas hepáticas (ALT y AST) antes de iniciar el tratamiento con ambrisentan, no debiéndose iniciar el tratamiento en pacientes con valores basales de ALT y/o AST >3xLSN (ver sección 4.3).
Se recomienda controlar a los pacientes para detectar signos de daño hepático y hacerles un seguimiento mensual de los niveles de ALT y AST. Si los pacientes desarrollan un incremento inexplicable y sostenido de los niveles de ALT y/o AST clínicamente significativo, o si el incremento de ALT y/o AST va acompañado de signos o síntomas de daño hepático (p. ej. ictericia), se debe interrumpir el tratamiento con ambrisentan.
En aquellos pacientes que no presenten síntomas clínicos de daño hepático o de ictericia, se puede considerar el reinicio del tratamiento con ambrisentan, una vez se hayan resuelto las anormalidades en los valores de enzimas hepáticas. Se recomienda el consejo de un hepatólogo.
Concentración de hemoglobina
El uso de antagonistas de los receptores de endotelina (AREs), incluido ambrisentan, se ha asociado con una reducción en la concentración de hemoglobina y hematocrito. La mayor parte de estas disminuciones fueron detectadas durante las primeras 4 semanas de tratamiento, estabilizándose generalmente los niveles de hemoglobina pasado este periodo. Las disminuciones medias desde los valores basales (que van desde 0,9 hasta 1,2 g/dL) en las concentraciones de hemoglobina continuaron hasta los 4 años de tratamiento con ambrisentan, en la extensión a largo plazo de los ensayos clínicos abiertos en fase 3 pivotales. En el período posterior a su comercialización, se han notificado casos de anemia que requirieron transfusiones de glóbulos sanguíneos (ver sección 4.8).
No se recomienda iniciar el tratamiento con ambrisentan en pacientes con anemia clínicamente significativa. Se recomienda medir los niveles de hemoglobina y/o hematocrito durante el tratamiento con ambrisentan, por ejemplo en 1 mes, 3 meses y después periódicamente, de acuerdo con la práctica clínica. Si se observa una disminución en la hemoglobina o hematocrito clínicamente relevante, y se han descartado otras posibles causas, se debe considerar la reducción de dosis o la interrupción del tratamiento con Volibris. La incidencia de anemia se incrementó cuando ambrisentan fue dosificado en combinación con tadalafilo (frecuencia del evento adverso del 15%), en comparación con la incidencia de anemia cuando ambrisentan y tadalafilo fueron administrados como monoterapia (7% y 11%, respectivamente).
Retención de fluidos
Se ha observado aparición de edema periférico con el tratamiento con AREs, incluido ambrisentan. La mayoría de los casos de edema periférico observados durante los ensayos clínicos con ambrisentan fueron de gravedad entre leve y moderada, aunque parece que puede ocurrir con mayor frecuencia e intensidad en pacientes > 65 años. El edema periférico fue notificado más frecuentemente con ambrisentan 10 mg en ensayos clínicos a corto plazo (ver sección 4.8).
Se han notificado algunos casos post-comercialización de retención de fluidos, que ocurrieron semanas después de comenzar el tratamiento con ambrisentan y que, en algunos casos, han requerido la utilización de un diurético o la hospitalización para controlar los fluidos o la insuficiencia cardíaca descompensada.
Si los pacientes tienen sobrecarga de fluidos preexistente, se debe controlar clínicamente antes de comenzar el tratamiento con ambrisentan.
Si la retención de fluidos es clínicamente relevante durante el tratamiento con ambrisentan, con o sin aumento de peso asociado, se debe llevar a cabo una evaluación adicional para determinar la causa, que podría ser o bien ambrisentan o bien una insuficiencia cardiaca subyacente, y valorar la necesidad de iniciar un tratamiento específico o de interrumpir el tratamiento con ambrisentan. La incidencia de edema periférico se incrementó cuando ambrisentan fue dosificado en combinación con tadalafilo (frecuencia del evento adverso del 45%), en comparación con la incidencia de edema periférico cuando ambrisentan y tadalafilo fueron administrados como monoterapia (38% y 28%, respectivamente). La ocurrencia de edema periférico fue mayor dentro del primer mes tras el inicio del tratamiento.
Mujeres en edad fértil
El tratamiento con Volibris no debe ser iniciado en mujeres en edad fértil, a menos que el resultado de la prueba de embarazo pre-tratamiento sea negativo y se utilicen medidas anticonceptivas fiables. En caso de duda acerca del método anticonceptivo más aconsejable para cada paciente, se recomienda consultar a un ginecólogo. Se recomienda realizar pruebas de embarazo mensuales durante el tratamiento con ambrisentan (ver secciones 4.3 y 4.6).
Enfermedad veno-oclusiva pulmonar
Se han notificado casos de edema pulmonar con medicamentos vasodilatadores, como AREs, cuando se usa en pacientes con enfermedad veno-oclusiva pulmonar. Consecuentemente, si los pacientes con HAP desarrollan edema pulmonar agudo cuando son tratados con ambrisentan, se debe considerar la posibilidad de enfermedad veno-oclusiva pulmonar.
Uso concomitante con otros medicamentos
Los pacientes tratados con ambrisentan deben ser estrechamente vigilados al comenzar el tratamiento con rifampicina (ver secciones 4.5 y 5.2).
Excipientes
Los comprimidos de Volibris contienen lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento.
Los comprimidos de Volibris contienen el colorante azoico 'rojo Allura AC aluminio Lake' (E129), que puede causar reacciones alérgicas.
Los comprimidos de Volibris contienen lecitina derivada de soja. Si un paciente fuera hipersensible a la soja, no debe utilizarse ambrisentan (ver sección 4.3).
4.5 Interacción con otros medicamentos y otras formas de interacción
En estudios no clínicos in vitro e in vivo, ambrisentan, a concentraciones clínicamente relevantes, no inhibe ni induce la fase I ni II de las enzimas que metabolizan el fármaco, lo que sugiere que ambrisentan tiene un bajo potencial para alterar los niveles de medicamentos metabolizados por estas rutas.
Se ha estudiado la posible capacidad de ambrisentan de inducir la actividad del CYP3A4 en voluntarios sanos, y los resultados obtenidos sugieren que ambrisentan no tiene un efecto inductor sobre la isoenzima CYP3A4.
Ciclosporina A
La co-administración de ambrisentan y ciclosporina A en estado estacionario tuvo como resultado un aumento de 2 veces en la exposición a ambrisentan en voluntarios sanos. Esto puede ser debido a la inhibición por la ciclosporina A de los transportadores y las enzimas metabólicas implicadas en la farmacocinética de ambrisentan. Por lo tanto, se debe limitar la dosis de ambrisentan a 5 mg una vez al día cuando se co-administra con ciclosporina A (ver sección 4.2). Dosis múltiples de ambrisentan no tuvieron efecto en la exposición a ciclosporina A, por lo que no está justificado el ajuste de dosis de ciclosporina A.
Rifampicina
La administración conjunta de rifampicina (un inhibidor de la bomba transportadora de aniones orgánicos [OATP], un potente inductor de CYP3A y 2C19, y un inductor de P-gp y uridina difosfato glucuronosiltransferasas [UGTs]) se asoció con un aumento transitorio (aproximadamente 2 veces) en la exposición a ambrisentan tras las dosis iniciales en voluntarios sanos. Sin embargo, en el día 8, la administración en estado estacionario de rifampicina no tuvo efecto clínicamente relevante en la exposición de ambrisentan. Los pacientes tratados con ambrisentan deben ser estrechamente vigilados al comenzar el tratamiento con rifampicina (ver secciones 4.4 y 5.2).
Inhibidores de la fosfodiesterasa
La administración conjunta de ambrisentan con un inhibidor de la fosfodiesterasa, como sildenafilo o tadalafilo (ambos sustratos del CYP3A4) en voluntarios sanos, no afectó de manera significativa a la farmacocinética del inhibidor de la fosfodiesterasa ni de ambrisentan (ver sección 5.2).
Otros medicamentos para el tratamiento de la HAP
La eficacia y seguridad de ambrisentan cuando se administra de forma conjunta con otros medicamentos para el tratamiento de la HAP (p. ej. prostanoides y estimuladores de la guanilato ciclasa soluble) no ha sido específicamente estudiada en ensayos clínicos controlados en pacientes con HAP (ver sección 5.1). No se prevén interacciones farmacológicas específicas con estimuladores de la guanilato ciclasa soluble o con prostanoides de acuerdo a los datos conocidos de biotransformación (ver sección 5.2). Sin embargo, no se han realizado estudios específicos de interacciones farmacológicas con estos fármacos. Por lo tanto, se recomienda precaución en el caso de administración conjunta.
Anticonceptivos orales
En un ensayo clínico realizado en voluntarios sanos, los niveles en estado estacionario alcanzados con ambrisentan 10 mg administrado una vez al día, no afectaron significativamente a la farmacocinética de una dosis única de etinilestradiol y noretindrona, componentes de un anticonceptivo oral combinado (ver sección 5.2). Según los datos obtenidos en este estudio farmacocinético, no se espera que ambrisentan afecte de manera significativa la exposición a anticonceptivos que contengan estrógenos o progestágenos.
Warfarina
En un ensayo en voluntarios sanos, ambrisentan no tuvo efectos sobre la farmacocinética en estado estacionario, ni sobre la actividad anti-coagulante de la warfarina (ver sección 5.2). La warfarina tampoco tuvo efectos clínicamente significativos sobre la farmacocinética de ambrisentan. Además, la administración de ambrisentan no afectó de forma general a la dosis semanal de anticoagulantes tipo warfarina, al tiempo de protrombina (PT), ni al Índice Internacional Normalizado (IIN o INR).
Ketoconazol
La administración de ketoconazol (un potente inhibidor del CYP3A4) en estado estacionario no produjo un aumento clínicamente relevante en la exposición a ambrisentan (ver sección 5.2).
Efecto de ambrisentan sobre los transportadores xenobióticos
Se ha observado que ambrisentan, in vitro, y a concentraciones clínicamente relevantes, no tiene efecto inhibitorio sobre los transportadores humanos, incluyendo la glicoproteína-P (Pgp), la proteína de resistencia de cáncer de mama (BCRP), la proteína 2 relacionada con resistencia a múltiples fármacos (MRP2), la bomba exportadora de sales biliares (BSEP), los polipéptidos trasportadores de aniones orgánicos (OATP1B1 y OATP1B3) y el polipéptido cotransportador del taurocolato dependiente de sodio (NTCP).
Ambrisentan es un sustrato del eflujo mediado por Pgp.
Los estudios in vitro en hepatocitos de rata, también mostraron que ambrisentan no induce la expresión de las proteínas Pgp, BSEP o MRP2.
La administración en estado estacionario de ambrisentan a voluntarios sanos no tuvo efectos clínicamente relevantes sobre la farmacocinética de digoxina, un sustrato de la Pgp, administrada en dosis única (ver sección 5.2).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
El tratamiento con ambrisentan no debe ser iniciado en mujeres en edad fértil, a menos que el resultado de la prueba de embarazo pre-tratamiento sea negativo y se utilicen medidas anticonceptivas fiables. Se recomienda hacer pruebas de embarazo mensuales durante el tratamiento con ambrisentan.
Embarazo
Ambrisentan está contraindicado durante el embarazo (ver sección 4.3). Estudios en animales han mostrado que ambrisentan es teratogénico. No hay experiencia en humanos.
Las mujeres que reciben ambrisentan deben ser informadas del riesgo de daño fetal y del tratamiento alternativo que deben iniciar si se quedan embarazadas (ver secciones 4.3, 4.4 y 5.3).
Lactancia materna
Se desconoce si ambrisentan se excreta en la leche materna humana. No se ha estudiado en animales la excreción de ambrisentan en la leche. Por lo tanto, la lactancia materna está contraindicada en pacientes que toman ambrisentan (ver sección 4.3).
Fertilidad masculina
El desarrollo de atrofia tubular testicular en animales macho ha sido asociado a la administración crónica de ERAs, incluyendo ambrisentan (ver sección 5.3). Aunque en el estudio ARIES-E no se encontró una evidencia clara de un efecto perjudicial de la exposición a largo plazo a ambrisentan sobre el recuento de espermatozoides, la administración crónica de ambrisentan se asoció con cambios en los marcadores de la espermatogénesis. Se observó una disminución en la concentración plasmática de inhibina-B y un aumento en la concentración plasmática de la hormona folículo estimulante (FSH). Se desconoce el efecto sobre la fertilidad masculina en humanos, pero no puede excluirse un deterioro de la espermatogénesis. En ensayos clínicos la administración crónica de ambrisentan, no fue asociada con un cambio en los niveles plasmáticos de testosterona.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de ambrisentan sobre la capacidad para conducir y utilizar máquinas es pequeña a moderada. Al examinar a los pacientes su capacidad para realizar tareas que requieran atención, habilidad motora o cognitiva, se debe tener en cuenta el estado clínico del paciente y el perfil de reacciones adversas de ambrisentan (como hipotensión, mareos, astenia, fatiga) (ver sección 4.8). Los pacientes deben ser conscientes de cómo puede afectarles ambrisentan antes de conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La seguridad de ambrisentan en monoterapia y/o en combinación se ha evaluado en ensayos clínicos con más de 1.200 pacientes con HAP (ver sección 5.1). A continuación se incluye, por frecuencia y clasificación por órganos y sistemas, las reacciones adversas recogidas de los datos de un ensayo clínico controlado con placebo de 12 semanas. También se incluye información de estudios no controlados con placebo a largo plazo (ARIES-E y AMBITION (combinación con tadalafilo)). No se identificaron reacciones adversas previamente desconocidas con el tratamiento a largo plazo o para ambrisentan en combinación con tadalafilo. Con una evaluación más larga en estudios no controlados (observación media de 79 semanas), el perfil de seguridad fue semejante al observado en estudios a corto plazo. También se presentan datos de farmacovigilancia rutinaria.
Las reacciones adversas más frecuentemente observadas con ambrisentan fueron edema periférico, retención de líquidos y dolor de cabeza (incluyendo el dolor de cabeza sinusal, migraña). La dosis más alta (10 mg) se asoció con una mayor incidencia de estas reacciones adversas, y el edema periférico tendió a ser más grave en pacientes > 65 años en ensayos clínicos a corto plazo (ver sección 4.4).
Tabla de reacciones adversas
Las frecuencias se definen como: muy frecuentes (> 1/10); frecuentes (> 1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Para las reacciones adversas relacionadas con la dosis, la categoría de frecuencia refleja la dosis más alta de ambrisentan. Las categorías de frecuencia no tienen en cuenta otros factores, como la variación en la duración del estudio, las condiciones pre-existentes y las características iniciales del paciente. Las categorías de frecuencia de las reacciones adversas, asignadas conforme a la experiencia obtenida en los ensayos clínicos, pueden no reflejar la frecuencia con que aparecen estas reacciones adversas en la práctica clínica habitual. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Ambrisentan (ARIES-C y poscomercialización) |
Ambrisentan (AMBITION y ARIES-E) |
Combinación con tadalafilo (AMBITION) | |
|
Trastornos de la sangre y del sistema linfático | |||
|
Anemia (disminución de hemoglobina, disminución de hematocrito) |
Frecuentes1 |
Muy frecuentes |
Muy frecuentes |
|
Trastornos del sistema inmunológico | |||
|
Reacciones de hipersensibilidad (por ejemplo, angioedema, erupción, prurito) |
Poco frecuentes |
Frecuentes |
Frecuentes |
|
Trastornos del sistema nervioso | |||
|
Cefalea (incluyendo cefalea sinusal, migraña) |
Muy frecuentes2 |
Muy frecuentes |
Muy frecuentes |
|
Mareo |
Frecuentes3 |
Muy frecuentes |
Muy frecuentes |
|
Trastornos oculares | |||
|
Visión borrosa, alteración visual |
Frecuencia no conocida4 |
Frecuentes |
Frecuentes |
|
Trastornos del oído y del laberinto | |||
|
Tinnitus |
NR |
NR |
Frecuentes |
|
Sordera súbita |
NR |
NR |
Poco frecuentes |
|
Trastornos cardíacos | |||
|
Fallo cardíaco |
Frecuentes5 |
Frecuentes |
Frecuentes |
|
Palpitación |
Frecuentes |
Muy frecuentes |
Muy frecuentes |
|
Trastornos vasculares | |||
|
Hipotensión |
Frecuentes3 |
Frecuentes |
Frecuentes |
|
Rubefacción |
Frecuentes |
Frecuentes |
Muy frecuentes |
|
Síncope |
Poco frecuentes3 |
Frecuentes |
Frecuentes |
|
Trastornos respiratorios, torácicos y mediastínicos | |||
|
Epistaxis |
Frecuentes1 |
Frecuentes |
Frecuentes |
|
Disnea |
Frecuentes3,6 |
Muy frecuentes |
Muy frecuentes |
|
Congestión del tracto respiratorio superior (p. ej. nasal, senos), sinusitis, nasofaringitis, rinitis |
Frecuentes7 | ||
|
Nasofaringitis |
Muy frecuentes |
Muy frecuentes | |
|
Sinusitis, rinitis |
Frecuentes |
Frecuentes | |
|
Congestión nasal |
Muy frecuentes |
Muy frecuentes | |
|
Trastornos gastrointestinales | |||
|
Náuseas, vómitos, diarrea |
Frecuentes3 | ||
|
Náuseas |
Muy frecuentes |
Muy frecuentes | |
|
Vómitos |
Frecuentes |
Muy frecuentes | |
|
Diarrea |
Muy frecuentes |
Muy frecuentes | |
|
Dolor abdominal |
Frecuentes |
Frecuentes |
Frecuentes |
|
Estreñimiento |
Frecuentes |
Frecuentes |
Frecuentes |
|
Trastornos hepatobiliares | |||
|
Daño hepático (ver sección 4.4) |
Poco frecuentes3, 8 |
NR |
NR |
|
Hepatitis autoinmune (ver sección 4.4) |
Poco frecuentes3,8 |
NR |
NR |
|
Incremento de las transaminasas hepáticas |
Frecuentes3 |
NR |
NR |
|
Trastornos de la piel y del tejido subcutáneo | |||
|
Erupción cutánea |
NR |
Frecuentes9 |
Muy frecuentes9 |
|
Trastornos generales y alteraciones en el lugar de administración | |||
|
Edema periférico, retención de fluidos |
Muy frecuentes |
Muy frecuentes |
Muy frecuentes |
|
Dolor/malestar torácico |
Frecuentes |
Frecuentes |
Muy frecuentes |
|
Astenia |
Frecuentes3 |
Frecuentes |
Frecuentes |
|
Fatiga |
Frecuentes3 |
Muy frecuentes |
Muy frecuentes |
NR - No reportado
1 Consulte la sección "Descripción de las reacciones adversas seleccionadas"
2 La frecuencia de aparición de cefalea fue mayor con 10 mg de ambrisentan.
3 Datos derivados de la farmacovigilancia rutinaria y frecuencias basadas en la experiencia de ensayos clínicos controlados con placebo.
4 Datos derivados de la farmacovigilancia rutinaria
5 La mayoría de los casos de fallo cardíaco notificados estaban asociados con la retención de fluidos. Datos derivados de la farmacovigilancia rutinaria, frecuencias basadas en modelos estadísticos de datos de ensayos clínicos controlados con placebo.
6 Se han notificado casos de empeoramiento de la disnea de etiología poco clara poco después de iniciar el tratamiento con ambrisentan.
7 La incidencia de congestión nasal durante el tratamiento con ambrisentan estuvo relacionada con la dosis.
8Se han notificado casos de hepatitis autoinmune, incluyendo casos de exacerbación de hepatitis autoinmune, y daño hepático, durante el tratamiento con ambrisentan.
9 Erupción cutánea: incluye erupción eritematosa, erupción generalizada, erupción papular y erupción prurítica
Descripción de las reacciones adversas seleccionadas
Descenso de hemoglobina
En el período posterior a la comercialización, se han notificado casos de anemia que requieren transfusiones de glóbulos sanguíneos (ver sección 4.4). La frecuencia del descenso en hemoglobina (anemia) fue mayor con 10 mg de ambrisentan. A lo largo de ensayos clínicos en Fase 3 de 12 semanas de duración controlados con placebo, las concentraciones medias de hemoglobina disminuyeron en los grupos de pacientes tratados con ambrisentan y se detectaron en la 4a semana (descenso de 0,83 g/dL); los cambios medios de la situación inicial parecieron estabilizarse a lo largo de las 8 semanas siguientes. Un total de 17 pacientes (6,5%) en los grupos de tratamiento con ambrisentan tuvieron disminuciones en la hemoglobina >15% de la situación inicial y cayeron por debajo del límite de normalidad.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional de
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay experiencia en pacientes HAP tratados con ambrisentan a dosis diarias superiores a 10 mg. En voluntarios sanos, dosis únicas de 50 y 100 mg (de 5 a 10 veces la dosis máxima recomendada) se asociaron con cefaleas, rubefacción, mareo, náuseas y congestión nasal.
Debido al mecanismo de acción, una sobredosis de ambrisentan podría potencialmente dar origen a un cuadro de hipotensión (ver sección 5.3). En el caso de hipotensión pronunciada, se puede necesitar soporte cardiovascular activo. No se encuentra disponible ningún antídoto específico. 1
Mecanismo de acción
Ambrisentan es un principio activo que se administra por vía oral, perteneciente a la clase del ácido propanóico, que actúa como antagonista selectivo del receptor de endotelina (ARE) de tipo A (ETA). La endotelina desempeña un papel fundamental en la fisiopatología de la HAP.
• Ambrisentan es un potente antagonista ETA (Ki 0,016 nM) y altamente selectivo (aproximadamente 4.000 veces más selectivo para ETA que para ETB).
• Ambrisentan bloquea el subtipo ETA, del receptor que se localiza mayoritariamente en las células musculares lisas vasculares y miocitos cardiacos. De este modo se previene la activación de sistemas de segundos mensajeros mediada por la endotelina y que origina vasoconstricción y la proliferación de las células musculares lisas.
• Se espera que la selectividad de ambrisentan por el receptor ETA en lugar de por el receptor ETB conserve la producción mediada por el receptor ETB de los vasodilatadores óxido nítrico y prostaciclina.
Eficacia clínica y seguridad
Se realizaron dos ensayos clínicos pivotales de Fase 3 multicéntricos, aleatorizados, doble ciego y controlados con placebo (ARIES-1 y ARIES-2). ARIES-1 incluyó 201 pacientes y comparó ambrisentan 5 mg y 10 mg con placebo. ARIES-2 incluyó 192 pacientes y comparó ambrisentan 2,5 mg y 5 mg con placebo. En ambos ensayos, ambrisentan fue añadido a la medicación de soporte/previa del paciente, que podía incluir una combinación de digoxina, anticoagulantes, diuréticos, oxígeno y vasodilatadores (bloqueantes de los canales de calcio, IECAs). Los pacientes reclutados padecían HAPI o HAP asociada a enfermedad del tejido conectivo. La mayoría de los pacientes tenían síntomas propios de la clase funcional II de la Organización Mundial de la Salud (OMS) (38,4%) o de la clase III (55,0%). Los pacientes con enfermedad hepática pre-existente (cirrosis o elevación clínicamente significativa de aminotransferasas) y los pacientes que estaban recibiendo otros tratamientos específicos para la HAP (p. ej. prostanoides) fueron excluidos. En estos ensayos no se evaluaron parámetros hemodinámicos.
El criterio de valoración principal de eficacia definido para los estudios en Fase 3 fue la mejoría en la capacidad del ejercicio valorada por el cambio, a las 12 semanas, frente a la situación basal, en la distancia recorrida en el test de la marcha de los 6 minutos (TM6M). En ambos ensayos, el tratamiento con ambrisentan tuvo como resultado una mejoría significativa en el TM6M, para cada una de las dosis de ambrisentan.
La mejoría, corregida por placebo, en la media del TM6M en la semana 12 comparada con la situación basal fue de 30,6 m (IC 95%: 2,9 a 58,3; p=0,008) y 59,4 m (IC 95%: 29,6 a 89,3; p<0,001) para el grupo de 5 mg, en ARIES 1 y 2 respectivamente. La mejoría, corregida por placebo, en la media del TM6M en la semana 12 en el grupo de pacientes de 10 mg en ARIES-1 fue 51,4 m (IC 95%: 26,6 a 76,2; p <0,001).
Se realizó un análisis combinado pre-especificado de los ensayos de Fase 3 (ARIES-C). La mejoría media, corregida por placebo, en el TM6M fue de 44,6 m (IC 95%: 24,3 a 64,9; p<0,001) para la dosis de 5 mg, y de 52,5 m (IC 95%: 28,8 a 76,2; p<0,001) para la dosis de 10 mg.
En el ensayo ARIES-2, la administración de ambrisentan (grupo de dosis combinada) retrasó significativamente el tiempo transcurrido hasta el empeoramiento clínico de la HAP en comparación con placebo (p<0,001); el valor de hazard ratio (índice de riesgo) mostró una reducción del 80% (IC 95%:
47% a 92%). La medida incluyó: muerte, transplante pulmonar, hospitalización por HAP, septostomía atrial, adición de otros agentes terapéuticos para el tratamiento de la HAP y criterios de abandono temprano. Se observó un incremento estadísticamente significativo (3,41 ± 6,96) para el grupo de dosis combinadas en la escala de función física de la encuesta de SF-36 Health Survey comparado con placebo (-0,20 ± 8,14; p=0,005). El tratamiento con ambrisentan produjo una mejoría estadísticamente significativa en la Escala de Disnea de Borg (BDI) en la semana 12 (BDI corregido por placebo de -1,1 (IC 95%: -1,8 a -0,4; p=0,019; grupo de dosis combinadas)).
Datos a largo plazo
Los pacientes reclutados en los ensayos ARIES 1 y 2 fueron elegibles para entrar en una fase abierta de extensión a largo plazo, el ensayo ARIES-E (n=383). La exposición media combinada fue aproximadamente 145 ± 80 semanas, y la exposición máxima fue aproximadamente 295 semanas. Las principales variables primarias de este ensayo fueron la incidencia y gravedad de los acontecimientos adversos asociados con la exposición prolongada a ambrisentan, incluyendo pruebas de función hepática (PFH) en suero. Los hallazgos de seguridad observados en este ensayo con exposición a largo plazo a ambrisentan fueron generalmente consistentes con los observados en los ensayos controlados con placebo de 12 semanas.
La probabilidad de supervivencia observada para los sujetos que recibieron ambrisentan (grupo de dosis combinada de ambrisentan) a 1, 2 y 3 años fue 93%, 85% y 79% respectivamente.
En un ensayo abierto (AMB222) se administró ambrisentan a 36 pacientes para evaluar la incidencia de niveles séricos elevados de aminotransferasas en pacientes que habían interrumpido previamente otro tratamiento con un ARE debido a anormalidades en las aminotransferasas. Durante la duración media del tratamiento con ambrisentan, que fue de 53 semanas, ninguno de los pacientes reclutados presentó niveles séricos de ALT > 3xLSN que requirieran una interrupción permanente del tratamiento. El cincuenta por ciento de pacientes había aumentado de 5 mg a 10 mg de ambrisentan durante este tiempo.
La incidencia acumulada de anormalidades en las aminotransferasas séricas > 3xLSN en todos los estudios Fase 2 y 3 (incluyendo sus correspondientes fases abiertas de extensión) fue de 17 en 483 sujetos para una duración media de exposición de 79,5 semanas. Esto equivale a una tasa de acontecimientos de 2,3 acontecimientos por 100 pacientes año de exposición a ambrisentan. En el ensayo abierto a largo plazo ARIES-E, el riesgo a los 2 años de desarrollar un aumento de los niveles séricos de aminotransferasas >3xLSN en pacientes tratados con ambrisentan fue 3,9%.
Otra, información clínica.
En un estudio en Fase 2 (AMB220), se observó una mejoría en los parámetros hemodinámicos en pacientes con HAP, después de 12 semanas (n=29). El tratamiento con ambrisentan tuvo como resultado un incremento en el índice cardiaco medio, una disminución en la presión arterial pulmonar media, y una disminución en la resistencia vascular pulmonar media.
Durante el tratamiento con ambrisentan se han notificado disminuciones en las presiones arteriales sistólica y diastólica. En ensayos clínicos controlados con placebo de 12 semanas de duración, la reducción media de las presiones arteriales sistólicas y diastólicas desde los valores basales hasta el final del tratamiento fueron 3 mm Hg y 4,2 mm Hg respectivamente. Las disminuciones medias de las presiones arteriales sistólica y diastólica continuaron hasta los 4 años de tratamiento con ambrisentan en el ensayo ARIES E abierto a largo plazo.
Durante un estudio de interacción fármaco-fármaco en voluntarios sanos, no se observaron efectos clínicamente relevantes en la farmacocinética de ambrisentan ni de sildenafilo, y la combinación fue bien tolerada. El número de pacientes que recibieron ambrisentan y sildenafilo de forma concomitante durante los ensayos ARIES-E y AMB222 fue 22 pacientes (5.7%) y 17 pacientes (47%), respectivamente. En estos pacientes no se identificaron aspectos de seguridad adicionales.
Eficacia clínica en combinación con tadalafílo
Se realizó un estudio (AMB112565/AMBITION) de fase 3 multicéntrico, doble ciego, con comparador activo, dirigido por eventos, para evaluar la eficacia de la combinación inicial de ambrisentan y tadalafilo vs la monoterapia sólo de ambrisentan o tadalafilo, en 500 pacientes con HAP sin tratamiento previo, aleatorizados 2:1:1 respectivamente. Ningún paciente recibió sólo placebo. El análisis primario comparó el grupo con combinación vs al grupo con la monoterapia agrupada. También se realizaron comparaciones complementarias del grupo con tratamiento combinado vs los grupos de monoterapia individuales. Se excluyeron los pacientes con anemia importante, retención de fluidos o enfermedades raras de la retina, según los criterios de los investigadores. También se excluyeron los pacientes con valores basales de ALT y AST por encima de dos veces el límite superior de la normalidad (>2xLSN).
Al inicio del estudio, el 96% de los pacientes no habían sido tratados previamente con ningún tratamiento específico para la HAP, y la mediana de tiempo desde el diagnóstico hasta la inclusión en el estudio fue de 22 días. Los pacientes comenzaron con 5 mg de ambrisentan y 20 mg de tadalafilo y se fue aumentando la dosis hasta los 40 mg de tadalafilo en la semana 4 y hasta los 10 mg de ambrisentan en la semana 8, a menos que hubiera problemas de tolerabilidad. La mediana de duración del tratamiento doble ciego para el tratamiento combinado fue superior a 1,5 años.
La variable primaria fue el tiempo hasta la primera aparición de un evento de fracaso clínico, definido como:
- muerte, o
- hospitalización por empeoramiento de la HAP,
- progresión de la enfermedad,
- respuesta clínica insatisfactoria a largo plazo.
La edad media de todos los pacientes fue de 54 años (SD 15; rango de edad 18-75 años). La clase funcional (OMS) de los pacientes al inicio fue CF II (31%) y CF III (69%). La HAP hereditaria o idiopática fue la etiología más común en la población de estudio (56%), seguida por HAP debido a trastornos del tejido conectivo (37%), la HAP asociada a fármacos y toxinas (3%), la cardiopatía congénita simple corregida (2%) y el VIH (2%). Los pacientes con CF II y III de la OMS recorrieron una distancia basal media en el test de la marcha de los 6 minutos (TM6M) de 353 metros.
Variables resultantes
El tratamiento con terapia combinada resultó en una reducción del riesgo del 50% (hazard ratio [HR] 0,502; IC 95%: 0,384 a 0,724; p=0,0002) de la variable compuesta de evaluación del fracaso clínico hasta la visita de evaluación final, en comparación con el grupo de las monoterapias agrupadas [Figura 1 y Tabla 1]. El efecto del tratamiento combinado fue impulsado por una reducción del 63% en las hospitalizaciones, se estableció temprano y fue mantenido. La eficacia de la terapia de combinación en la variable primaria fue coherente en la comparación con las monoterapias individuales y en los subgrupos de edad, etnia, región geográfica, etiología (HAPI/HAPH e HAP- ETC). El efecto fue significativo tanto para pacientes en CF II como en CF III.
Figura 1
1 year 88.9%
2 year 79.7%
I
3 year 67.6%
1 year 75.5%
2 year 63.2%
i -
3 year 56.1%
Combination therapy
- - Pooled monotherapy
HR: 0.502
95% Cl 0.348, 0.724)
p=0.0002
Time (weeks)
Numberat risk
Combination:
Pooled monotherapy: 247 209 155 108 77
Tabla 1
|
Ambrisentan + Tadalafilo (N=253) |
Monoterapia Agrupada (N=247) |
Monoterapia con ambrisentan (N=126) |
Monoterapia con tadalafilo (N=121) | |
|
Tiempo hasta el primer evento de fracaso clínico (Adjudicado) | ||||
|
Fracaso clínico, n°. (%) |
46 (18%) |
77 (31%) |
43 (34%) |
34 (28%) |
|
Hazard ratio (IC 95%) |
0,502 (0,348; 0,724) |
0,477 (0,314; 0,723) |
0,528 (0,338; 0,827) | |
|
Valor-P, test de Log-rank |
0,0002 |
0,0004 |
0.0045 | |
|
Componente como primer evento de fracaso clínico (Adjudicado) | ||||
|
Muerte (todas las causas) |
9 (4%) |
8 (3%) |
2 (2%) |
6 (5%) |
|
Hospitalización por empeoramiento de la HAP |
10 (4%) |
30 (12%) |
18 (14%) |
12 (10%) |
|
Progresión de la enfermedad |
10 (4%) |
16 (6%) |
12 (10%) |
4 (3%) |
|
Respuesta clínica insatisfactoria a largo plazo |
17 (7%) |
23 (9%) |
11 (9%) |
12 (10%) |
|
Tiempo hasta primera hospitalización por empeoramiento de la HAP (Adjudicado) | ||||
|
Primera hospitalización, n°. (%) |
19 (8%) |
44 (18%) |
27 (21%) |
17 (14%) |
|
Hazard ratio (IC 95%) |
0,372 |
0,323 |
0,442 | |
|
Valor-P, test de Log-rank |
0,0002 |
<0,0001 |
0,0124 | |
Variables secundarias
Se analizaron las variables secundarias:
Tabla 2
|
Variables secundarias (cambio desde el inicio a la semana 24) |
Ambrisentan + Tadalafilo |
Monoterapia agrupada |
Diferencia e intervalo de confianza |
Valor p |
|
NT-proBNP (% reducción) |
-67,2 |
-50,4 |
% diferencia -33,8; IC 95%: -44,8; -20,7 |
p<0,0001 |
|
% de sujetos que consiguieron una respuesta clínica satisfactoria en la semana 24 |
39 |
29 |
Oportunidad relativa 1,56; IC 95%: 1,05; 2,32 |
p=0,026 |
|
TM6M (metros, mediana de cambio) |
49,0 |
23,8 |
22,75m; IC 95%: 12,00; 33,50 |
p<0,0001 |
Fibrosis pulmonar idiopática
Un estudio que se estaba realizando en 492 pacientes (ambrisentan N=329, placebo N=163) con fibrosis pulmonar idiopática (FPI), de los cuales un 11% tenían hipertensión pulmonar secundaria (Grupo 3 de la OMS), tuvo que concluir anticipadamente cuando se determinó que la variable de eficacia primaria no podía ser cumplida (estudio ARTEMIS-IPF). En el grupo de ambrisentan se observaron noventa acontecimientos (27%) de progresión de FPI (incluyendo las hospitalizaciones respiratorias) o muerte, comparado con 28 acontecimientos (17%) en el grupo placebo. Por lo tanto, ambrisentan está contraindicado en pacientes con FPI con o sin hipertensión pulmonar secundaria (ver sección 4.3).
5.2 Propiedades farmacocinéticas
Absorción
Ambrisentan se absorbe rápidamente en humanos. Después de la administración oral, las concentraciones plasmáticas máximas (Cmax) de ambrisentan se alcanzan normalmente alrededor de 1,5 horas después de la dosis, tanto en condiciones de ayuno como con alimentos. La Cmax y el área bajo la curva de concentración-tiempo plasmática (AUC) aumentan proporcionalmente con la dosis en el intervalo de dosis terapéutico. El estado estacionario normalmente se consigue a los 4 días de administración repetida.
En un estudio sobre el efecto de la comida, en el que se administró ambrisentan a voluntarios sanos en condiciones de ayuno y tras una comida con alto contenido en grasas, se observó una disminución del 12% en la Cmax mientras que el AUC permaneció inalterado. Esta disminución en el pico de concentración no es clínicamente significativa, y por tanto ambrisentan puede ser tomado con o sin alimentos.
Distribución
Ambrisentan presenta una elevada unión a proteínas plasmáticas. La unión a proteínas plasmáticas in vitro de ambrisentan fue, de media, 98,8% e independiente de la concentración en el rango de 0,2 - 20 microgramos/ml. Ambrisentan se fija principalmente a la albúmina (96,5%) y en menor grado a la alfa1-glicoproteína ácida.
La distribución de ambrisentan en los glóbulos rojos es baja, con una proporción media sangre:plasma de 0,57 y 0,61 en hombres y mujeres, respectivamente.
Biotransformación
Ambrisentan es un ARE de tipo no sulfonamida (perteneciente a la clase del ácido propanóico).
Ambrisentan es glucuronizado por varias isoenzimas UGT (UGT1A9S, UGT2B7S y UGT1A3S) para formar un glucurónido de ambrisentan (13%). Ambrisentan también sufre metabolismo oxidativo principalmente por el CYP3A4 y en menor grado por el CYP3A5 y el CYP2C19 para formar 4-hidroximetil ambrisentan (21%), que es posteriormente glucuronizado para dar el 4-hidroximetil ambrisentan glucurónido (5%). La afinidad del 4-hidroximetil ambrisentan por el receptor de endotelina humano es 65 veces menor que la de ambrisentan. Por lo tanto, para las concentraciones plasmáticas observadas (aproximadamente el 4% se corresponde con ambrisentan inalterado), no se espera que el 4-hidroximetil ambrisentan contribuya a la actividad farmacológica de ambrisentan.
Los datos in vitro indican que ambrisentan a concentraciones de 300 pM produjo una inhibición de menos del 50 % sobre UGT1A1, UGT1A6, UGT1A9, UGT2B7 (hasta el 30 %), o sobre las enzimas del citocromo P450 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A4 (hasta el 25 %). Ambrisentan, in vitro, y a concentraciones clínicamente relevantes, no tiene efecto inhibidor sobre los transportadores humanos, incluyendo Pgp, BCRP, MRP2, BSEP, OATP1B1, OATP1B3 y NTCP. Además, ambrisentan, en hepatocitos de ratas, no indujo la expresión de las proteínas MPR2, Pgp o BSEP. Teniendo en cuenta los datos in vitro, no es de esperar que ambrisentan a concentraciones clínicamente relevantes (Cmax en plasma de hasta 3,2 pM), tenga efecto sobre UGT1A1, UGT1A6, UGT1A9, UGT2B7, o sobre las enzimas del citrocromo P450 1A2, 2A6, 2B6, 2C8, 2C9, 2C19. 2D6, 2E1, 3A4, o sobre transportadores de la vía BSEP, BCRP, Pgp, MRP2, OATP1B1/3, o NTCP.
Los efectos de ambrisentan en estado estacionario (10 mg una vez al día) sobre las propiedades farmacocinéticas y farmacodinámicas de una dosis única de warfarina (25 mg), medidos como TP e INR, se investigaron en 20 voluntarios sanos. Ambrisentan no tuvo ningún efecto clínicamente relevante en las propiedades farmacocinéticas y farmacodinámicas de warfarina. De igual modo, la administración conjunta con warfarina no afectó a las propiedades farmacocinéticas de ambrisentan (ver sección 4.5).
Los efectos de administrar sildenafilo durante 7 días (20 mg tres veces al día) sobre las propiedades farmacocinéticas de una dosis única de ambrisentan, y los efectos de administrar ambrisentan durante 7 días (10 mg una vez al día) en las propiedades farmacocinéticas de una dosis única de sildenafilo, fueron investigados en 19 voluntarios sanos. Con la excepción de un aumento del 13% en la Cmax de sildenafilo, tras la administración conjunta de ambrisentan, no hubo ningún otro cambio en los parámetros farmacocinéticos de sildenafilo, N-desmetil sildenafilo y ambrisentan. Este leve incremento en la Cmax de sildenafilo no se considera clínicamente relevante (ver sección 4.5).
Los efectos de los niveles de ambrisentan en estado estacionario (10 mg una vez al día) sobre la farmacocinética de una dosis única de tadalafilo, así como los efectos de los niveles de tadalafilo en estado estacionario (40 mg una vez al día) sobre la farmacocinética de una dosis única de ambrisentan fueron estudiados en 23 voluntarios sanos. Ambrisentan no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de tadalafilo. Asimismo, la coadministración con tadalafilo no afectó a la farmacocinética de ambrisentan (ver sección 4.5).
Los efectos de la administración repetida de ketoconazol (400 mg una vez al día) en las propiedades farmacocinéticas de una dosis única de 10 mg de ambrisentan fueron investigados en 16 voluntarios sanos. Las exposiciones de ambrisentan medidas como AUC(0-inf) y Cmax se incrementaron en un 35% y un 20%, respectivamente. Es improbable que este cambio en la exposición tenga alguna relevancia clínica y por lo tanto ambrisentan puede ser administrado junto con ketoconazol.
Los efectos de la administración repetida de ciclosporina A (100 - 150 mg dos veces al día) sobre la farmacocinética de ambrisentan en estado estacionario (5 mg una vez al día), y los efectos de la administración repetida de ambrisentan (5 mg una vez al día) sobre la farmacocinética de ciclosporina A en estado estacionario (100 - 150 mg dos veces al día), fueron estudiados en voluntarios sanos. La Cmax y el AUC(0-t) de ambrisentan se incrementaron en un 48% y 121%, respectivamente en presencia de dosis múltiples de ciclosporina A. Basado en estos cambios, la dosis de ambrisentan debe ser limitada a 5 mg una vez al día cuando se co-administra con ciclosporina A (ver sección 4.2). Sin embargo, dosis múltiples de ambrisentan no tuvieron efecto clínicamente significativo en la exposición a ciclosporina A, por lo que no está justificado el ajuste de dosis de ciclosporina A.
Los efectos de administrar dosis únicas y repetidas de rifampicina (600 mg una vez al día) sobre las propiedades farmacocinéticas de ambrisentan en estado estacionario (10 mg una vez al día) fueron estudiados en voluntarios sanos. Tras las dosis iniciales de rifampicina, se observó un aumento transitorio de ambrisentan AUC(0-T)(121% y 116% después de la primera y segunda dosis de rifampicina, respectivamente), presumiblemente debido a una inhibición de la OATP mediada por rifampicina. Sin embargo, en el día 8 no hubo un efecto clínicamente relevante en la exposición a ambrisentan, tras la administración de dosis múltiples de rifampicina. Los pacientes tratados con ambrisentan deben ser estrechamente vigilados al comenzar el tratamiento con rifampicina (ver secciones 4.4 y 4.5).
Los efectos de la administración repetida de ambrisentan (10 mg) sobre las propiedades farmacocinéticas de una dosis única de digoxina fueron estudiados en 15 voluntarios sanos. La administración de dosis múltiples de ambrisentan produjo leves aumentos en el AUC0-last, en las concentraciones mínimas, y un aumento del 29% en la Cmax de digoxina. El aumento en la exposición a digoxina observada tras la administración de ambrisentan en dosis múltiples no se consideró clínicamente relevante, y por lo tanto no es necesario realizar un ajuste de dosis de digoxina (ver sección 4.5).
Los efectos de la administración de ambrisentan durante 12 días (10 mg una vez al día) sobre la farmacocinética de una dosis única de un anticonceptivo oral que contenía etinilestradiol (35 qg) y noretindrona (1 mg) fueron estudiados en un grupo de mujeres voluntarias sanas. La Cmax y el AUC(0-<X)) disminuyeron ligeramente para el etinilestradiol (8% y 4% respectivamente) y aumentaron ligeramente para la noretindrona (13% y 14 % respectivamente). Estos cambios en la exposición a etinilestradiol o noretindrona fueron pequeños y es poco probable que sean clínicamente relevantes (ver sección 4.5).
Eliminación
Ambrisentan y sus metabolitos son eliminados principalmente por vía biliar tras sufrir metabolismo hepático y/o extra-hepático. Tras la administración oral, aproximadamente un 22% de la dosis administrada es eliminada en la orina, siendo un 3,3% ambrisentan inalterado. La semivida de eliminación plasmática en humanos esta entre 13,6 y 16,5 horas.
Poblaciones especiales
De acuerdo con los resultados de un análisis farmacocinético poblacional realizado en voluntarios sanos y en pacientes con HAP, las propiedades farmacocinéticas de ambrisentan no se ven influenciadas significativamente ni en función del género ni de la edad (ver sección 4.2).
Insuficiencia renal
Ambrisentan no experimenta un metabolismo renal o aclaramiento renal (excreción) significativo. En un análisis farmacocinético poblacional, el aclaramiento de creatinina resultó ser una covariable estadísticamente significativa que afecta al aclaramiento oral de ambrisentan. Sin embargo, la magnitud de la disminución en el aclaramiento oral es moderada (20-40%) en pacientes con insuficiencia renal moderada y por lo tanto es improbable que sea clínicamente relevante. En cualquier caso, se debe tener precaución en pacientes con insuficiencia renal grave (ver sección 4.2).
Insuficiencia hepática
Las principales rutas de metabolización de ambrisentan son la glucuronidación y la oxidación con la subsiguiente eliminación en la bilis, por lo tanto se podría esperar que la insuficiencia hepática aumente la exposición (Cmax y AUC) a ambrisentan. En un análisis farmacocinético poblacional, el aclaramiento oral disminuyó como consecuencia de los crecientes niveles de bilirrubina. Sin embargo, la magnitud del efecto de la bilirrubina es moderada (comparado con un paciente típico, con una bilirrubina de 0,6 mg/dl, un paciente con una bilirrubina elevada de 4,5 mg/dl tendría aproximadamente un 30% menos de aclaramiento oral de ambrisentan). No se han estudiado las propiedades farmacocinéticas de ambrisentan en pacientes con insuficiencia hepática (con o sin cirrosis). Por lo tanto, el tratamiento con ambrisentan no debe ser iniciado en pacientes con insuficiencia hepática grave o que presenten una elevación de las aminotransferasas clínicamente relevante (>3xLSN) (ver secciones 4.3 y 4.4).
5.3 Datos preclínicos sobre seguridad
Debido al efecto farmacológico principal de clase de medicamentos, una dosis única elevada de ambrisentan (es decir una sobredosis) podría provocar un descenso en la presión arterial y por tanto tener el potencial para causar un cuadro de hipotensión y síntomas relacionados con la vasodilatación.
No se ha observado que ambrisentan inhiba el transportador de ácidos biliares, ni que provoque hepatotoxicidad sintomática.
Después de la administración crónica en roedores se ha apreciado inflamación y cambios en el epitelio de la cavidad nasal a exposiciones por debajo de los niveles terapéuticos en humanos. En perros, se observaron respuestas inflamatorias leves tras la administración prolongada de altas dosis de ambrisentan a exposiciones 20 veces superiores a las observadas en pacientes.
Se ha observado hiperplasia del hueso nasal de los cornetes etmoidales de la cavidad nasal en ratas tratadas con ambrisentan, a niveles de exposición 3 veces superiores al AUC terapéutico. No se ha observado hiperplasia del hueso nasal con ambrisentan en ratones ni perros. En ratas, la hiperplasia del cornete nasal es una respuesta conocida a la inflamación nasal, según la experiencia obtenida con otros compuestos.
Ambrisentan fue clastogénico cuando fue probado a altas concentraciones en células de mamíferos in vitro. No se han observado efectos mutagénicos ni genotóxicos para ambrisentan en bacterias ni en dos estudios in vivo realizados en roedores.
No hubo evidencia de potencial carcinogénico en estudios orales a 2 años en ratas y ratones. Hubo un pequeño aumento en fibroadenomas mamarios, un tumor benigno, en ratas macho, únicamente a la dosis más alta. La exposición sistémica a ambrisentan en ratas macho a esta dosis (basado en el AUC en estado estacionario) fue 6 veces mayor que la alcanzada con la dosis clínica de 10 mg/día.
La atrofia tubular testicular, que fue asociada ocasionalmente con aspermia, fue observada en los estudios de toxicidad con dosis orales repetidas y en estudios de fertilidad en ratas macho y en ratones sin margen de seguridad. Los cambios testiculares no fueron completamente reversibles durante los períodos de descanso evaluados. Sin embargo, no se observó ningún cambio testicular en estudios con perros de hasta 39 semanas de duración a una exposición 35 veces el AUC visto en humanos. En ratas macho, ambrisentan no tuvo efecto sobre la motilidad de los espermatozoides en todas las dosis ensayadas (hasta 300 mg/kg/día). Se observó una leve disminución (<10%) en el porcentaje de espermatozoides morfológicamente normales a 300 mg/kg/día, pero no a 100 mg/kg/día (> 9 veces la exposición clínica en 10 mg/día). Se desconoce el efecto de ambrisentan sobre la fertilidad humana masculina.
Ambrisentan ha mostrado ser teratogénico en ratas y conejos. Se han observado anormalidades en la mandíbula inferior, lengua y/o paladar para todas las dosis ensayadas. Además, el estudio en ratas mostró un aumento en la incidencia de defectos en el septo interventricular, defectos en el tronco vascular, anormalidades en el tiroides y timo, osificación del basiesfenoides, y la aparición de la arteria umbilical localizada en la parte izquierda de la vejiga urinaria en lugar de en el lado derecho. Se sospecha que la teratogenicidad es un efecto de clase de los AREs.
La administración de ambrisentan en ratas hembra desde la última fase del embarazo hasta la lactancia causó acontecimientos adversos sobre la conducta de la madre, supervivencia reducida de las crías y deterioro de la capacidad reproductora de la descendencia (con observación de pequeños testículos en la necroscopia), a una exposición de 3 veces el AUC para la dosis máxima recomendada en humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido Lactosa monohidrato Celulosa microcristalina Croscarmelosa sódica Estearato de magnesio
Recubrimiento
Alcohol polivinílico (parcialmente hidrolizado) Talco (E553b)
Dióxido de titanio (E171)
Macrogol / PEG 3350 Lecitina (soja) (E322)
Rojo Allura AC Aluminio Lake (E129)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase Blíster PVC/PVDC/aluminio.
Tamaños de envases con blísteres unidosis de 10x1 ó 30x1 comprimidos recubiertos con película. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Glaxo Group Ltd
980 Great West Road
Brentford
Middlesex
TW8 9GS
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/451/001
EU/1/08/451/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 21 de abril de 2008 Fecha de la última renovación: 24 de abril de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
1. NOMBRE DEL MEDICAMENTO
Volibris 10 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido contiene 10 mg de ambrisentan.
Excipiente(s) con efecto conocido:
Cada comprimido contiene aproximadamente 90 mg de lactosa monohidrato, aproximadamente 0,25 mg de lecitina (soja) (E322) y aproximadamente 0,45 mg de rojo Allura AC Aluminio Lake (E129).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película (comprimido).
Los comprimidos recubiertos con película son de color rosa oscuro, ovalados, convexos, con "GS" grabado en un lado y "KE3" en el otro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Volibris está indicado para el tratamiento de la hipertensión arterial pulmonar (HAP) en pacientes adultos clasificados como clase funcional (CF) II a III de la Organización Mundial de la Salud (OMS), incluyendo el uso en tratamiento de combinación (ver sección 5.1). Se ha demostrado la eficacia de este medicamento en HAP idiopática (HAPI) y en HAP asociada a enfermedad del tejido conectivo.
4.2 Posología y forma de administración
El tratamiento debe ser iniciado por un médico experimentado en el tratamiento de HAP.
Posología
Ambrisentan en monoterapia
Volibris se debe tomar por vía oral, se debe comenzar con una dosis de 5 mg una vez al día se que podrá aumentar a 10 mg diarios, dependiendo de la respuesta clínica y la tolerabilidad.
Ambrisentan en combinación con tadalafilo
Cuando se utiliza en combinación con tadalafilo, la dosis de Volibris se debe ajustar hasta alcanzar una dosis de 10 mg una vez al día.
En el ensayo AMBITION, los pacientes recibieron 5 mg de ambrisentan diariamente durante las primeras 8 semanas antes de ajustar a 10 mg, dependiendo de la tolerabilidad (ver sección 5.1). Cuando se utilizó en combinación con tadalafilo, los pacientes comenzaron con 5 mg de ambrisentan y 20 mg de tadalafilo. Dependiendo de la tolerabilidad, la dosis de tadalafilo se aumentó a 40 mg después de 4 semanas y la dosis de ambrisentan se aumentó a 10 mg después de 8 semanas. Más del 90% de los pacientes alcanzaron estas dosis. Dependiendo de la tolerabilidad, las dosis también se podrían haber disminuido.
Los escasos datos disponibles sugieren que la interrupción brusca del tratamiento con ambrisentan no está asociada con un empeoramiento rebote de la HAP.
Cuando se co-administra con ciclosporina A, la dosis de ambrisentan debe ser limitada a 5 mg una vez al día y el paciente debe ser cuidadosamente monitorizado (ver secciones 4.5 y 5.2).
Pacientes de edad avanzada
No es necesario realizar ajuste de la dosis en pacientes mayores de 65 años (ver sección 5.2).
Pacientes con insuficiencia renal
No es necesario realizar ajuste de la dosis en pacientes con insuficiencia renal (ver sección 5.2). Existe experiencia limitada con ambrisentan en individuos con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min); se debe iniciar el tratamiento con cautela en este subgrupo, y prestar especial cuidado si la dosis se incrementa hasta los 10 mg de ambrisentan.
Pacientes con insuficiencia hepática
No se ha estudiado el efecto de ambrisentan en pacientes con insuficiencia hepática (con o sin cirrosis). Debido a que las principales rutas metabólicas de ambrisentan son la glucuronidación y oxidación con posterior eliminación por vía biliar, se podría esperar que la insuficiencia hepática incremente la exposición (Cmax y AUC) a ambrisentan. Por lo tanto, no se debe iniciar el tratamiento con ambrisentan en pacientes con insuficiencia hepática grave, ni en aquellos con elevación de los valores de aminotransferasas hepáticas clínicamente significativa (más de 3 veces el límite superior de la normalidad (>3xLSN); ver secciones 4.3 y 4.4).
Población _ pediátrica
No se ha establecido la seguridad y eficacia de ambrisentan en niños y adolescentes menores de 18 años. No hay datos disponibles.
Forma de administración
Los comprimidos pueden tomarse con o sin alimentos y se recomienda tragarlos enteros. Se recomienda no fracturar, machacar o masticar el comprimido.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a la soja o a alguno de los excipientes incluidos en la sección 6.1. Embarazo (ver sección 4.6).
Mujeres en edad fértil que no utilicen un método anticonceptivo fiable (ver secciones 4.4 y 4.6).
Lactancia materna (ver sección 4.6).
Insuficiencia hepática grave (con o sin cirrosis) (ver sección 4.2).
Valores basales de aminotransferasas hepáticas, es decir, aspartato aminotransferasa (AST) y/o alanina aminotransferasa (ALT) >3xLSN (ver secciones 4.2 y 4.4).
Fibrosis pulmonar idiopática (FPI), con o sin hipertensión pulmonar secundaria (ver sección 5.1).
4.4 Advertencias y precauciones especiales de empleo
Ambrisentan no se ha estudiado en un número suficiente de pacientes que permita establecer el balance beneficio/riesgo en pacientes con HAP clasificados como clase funcional I de la OMS.
No se ha establecido la eficacia de ambrisentan en monoterapia en pacientes con HAP clasificados como clase funcional IV de la OMS. Si el estado clínico empeora, se debe considerar el cambio a un tratamiento recomendado en el estadío grave de la enfermedad (p. ej. epoprostenol).
Función hepática
La HAP se ha asociado con anomalías de la función hepática. Se han observado casos de hepatitis autoinmune, incluyendo una posible exacerbación de una hepatitis autoinmune subyacente, lesión hepática y elevaciones de las enzimas hepáticas potencialmente relacionadas con el tratamiento con ambrisentan (ver secciones 4.8 y 5.1). Por lo tanto, se deben evaluar los niveles de aminotransferasas hepáticas (ALT y AST) antes de iniciar el tratamiento con ambrisentan, no debiéndose iniciar el tratamiento en pacientes con valores basales de ALT y/o AST >3xLSN (ver sección 4.3).
Se recomienda controlar a los pacientes para detectar signos de daño hepático y hacerles un seguimiento mensual de los niveles de ALT y AST. Si los pacientes desarrollan un incremento inexplicable y sostenido de los niveles de ALT y/o AST clínicamente significativo, o si el incremento de ALT y/o AST va acompañado de signos o síntomas de daño hepático (p. ej. ictericia), se debe interrumpir el tratamiento con ambrisentan.
En aquellos pacientes que no presenten síntomas clínicos de daño hepático o de ictericia, se puede considerar el reinicio del tratamiento con ambrisentan, una vez se hayan resuelto las anormalidades en los valores de enzimas hepáticas. Se recomienda el consejo de un hepatólogo.
Concentración de hemoglobina
El uso de antagonistas de los receptores de endotelina (AREs), incluido ambrisentan, se ha asociado con una reducción en la concentración de hemoglobina y hematocrito. La mayor parte de estas disminuciones fueron detectadas durante las primeras 4 semanas de tratamiento, estabilizándose generalmente los niveles de hemoglobina pasado este periodo. Las disminuciones medias desde los valores basales (que van desde 0,9 hasta 1,2 g/dL) en las concentraciones de hemoglobina continuaron hasta los 4 años de tratamiento con ambrisentan, en la extensión a largo plazo de los ensayos clínicos abiertos en fase 3 pivotales. En el período posterior a su comercialización, se han notificado casos de anemia que requirieron transfusiones de glóbulos sanguíneos (ver sección 4.8).
No se recomienda iniciar el tratamiento con ambrisentan en pacientes con anemia clínicamente significativa. Se recomienda medir los niveles de hemoglobina y/o hematocrito durante el tratamiento con ambrisentan, por ejemplo en 1 mes, 3 meses y después periódicamente, de acuerdo con la práctica clínica. Si se observa una disminución en la hemoglobina o hematocrito clínicamente relevante, y se han descartado otras posibles causas, se debe considerar la reducción de dosis o la interrupción del tratamiento con Volibris. La incidencia de anemia se incrementó cuando ambrisentan fue dosificado en combinación con tadalafilo (frecuencia del evento adverso del 15%), en comparación con la incidencia de anemia cuando ambrisentan y tadalafilo fueron administrados como monoterapia (7% y 11%, respectivamente).
Retención de fluidos
Se ha observado aparición de edema periférico con el tratamiento con AREs, incluido ambrisentan. La mayoría de los casos de edema periférico observados durante los ensayos clínicos con ambrisentan fueron de gravedad entre leve y moderada, aunque parece que puede ocurrir con mayor frecuencia e intensidad en pacientes > 65 años. El edema periférico fue notificado más frecuentemente con ambrisentan 10 mg en ensayos clínicos a corto plazo (ver sección 4.8).
Se han notificado algunos casos post-comercialización de retención de fluidos, que ocurrieron semanas después de comenzar el tratamiento con ambrisentan y que, en algunos casos, han requerido la utilización de un diurético o la hospitalización para controlar los fluidos o la insuficiencia cardíaca descompensada.
Si los pacientes tienen sobrecarga de fluidos preexistente, se debe controlar clínicamente antes de comenzar el tratamiento con ambrisentan.
Si la retención de fluidos es clínicamente relevante durante el tratamiento con ambrisentan, con o sin aumento de peso asociado, se debe llevar a cabo una evaluación adicional para determinar la causa, que podría ser o bien ambrisentan o bien una insuficiencia cardiaca subyacente, y valorar la necesidad de iniciar un tratamiento específico o de interrumpir el tratamiento con ambrisentan. La incidencia de edema periférico se incrementó cuando ambrisentan fue dosificado en combinación con tadalafilo (frecuencia del evento adverso del 45%), en comparación con la incidencia de edema periférico cuando ambrisentan y tadalafilo fueron administrados como monoterapia (38% y 28%, respectivamente). La ocurrencia de edema periférico fue mayor dentro del primer mes tras el inicio del tratamiento.
Mujeres en edad fértil
El tratamiento con Volibris no debe ser iniciado en mujeres en edad fértil, a menos que el resultado de la prueba de embarazo pre-tratamiento sea negativo y se utilicen medidas anticonceptivas fiables. En caso de duda acerca del método anticonceptivo más aconsejable para cada paciente, se recomienda consultar a un ginecólogo. Se recomienda realizar pruebas de embarazo mensuales durante el tratamiento con ambrisentan (ver secciones 4.3 y 4.6).
Enfermedad veno-oclusiva pulmonar
Se han notificado casos de edema pulmonar con medicamentos vasodilatadores, como AREs, cuando se usa en pacientes con enfermedad veno-oclusiva pulmonar. Consecuentemente, si los pacientes con HAP desarrollan edema pulmonar agudo cuando son tratados con ambrisentan, se debe considerar la posibilidad de enfermedad veno-oclusiva pulmonar.
Uso concomitante con otros medicamentos
Los pacientes tratados con ambrisentan deben ser estrechamente vigilados al comenzar el tratamiento con rifampicina (ver secciones 4.5 y 5.2).
Excipientes
Los comprimidos de Volibris contienen lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp (insuficiencia observada en ciertas poblaciones de Laponia) o malabsorción de glucosa o galactosa no deben tomar este medicamento.
Los comprimidos de Volibris contienen el colorante azoico 'rojo Allura AC aluminio Lake' (E129), que puede causar reacciones alérgicas.
Los comprimidos de Volibris contienen lecitina derivada de soja. Si un paciente fuera hipersensible a la soja, no debe utilizarse ambrisentan (ver sección 4.3).
4.5 Interacción con otros medicamentos y otras formas de interacción
En estudios no clínicos in vitro e in vivo, ambrisentan, a concentraciones clínicamente relevantes, no inhibe ni induce la fase I ni II de las enzimas que metabolizan el fármaco, lo que sugiere que ambrisentan tiene un bajo potencial para alterar los niveles de medicamentos metabolizados por estas rutas.
Se ha estudiado la posible capacidad de ambrisentan de inducir la actividad del CYP3A4 en voluntarios sanos, y los resultados obtenidos sugieren que ambrisentan no tiene un efecto inductor sobre la isoenzima CYP3A4.
Ciclosporina A
La co-administración de ambrisentan y ciclosporina A en estado estacionario tuvo como resultado un aumento de 2 veces en la exposición a ambrisentan en voluntarios sanos. Esto puede ser debido a la inhibición por la ciclosporina A de los transportadores y las enzimas metabólicas implicadas en la farmacocinética de ambrisentan. Por lo tanto, se debe limitar la dosis de ambrisentan a 5 mg una vez al día cuando se co-administra con ciclosporina A (ver sección 4.2). Dosis múltiples de ambrisentan no tuvieron efecto en la exposición a ciclosporina A, por lo que no está justificado el ajuste de dosis de ciclosporina A.
Rifampicina
La administración conjunta de rifampicina (un inhibidor de la bomba transportadora de aniones orgánicos [OATP], un potente inductor de CYP3A y 2C19, y un inductor de P-gp y uridina difosfato glucuronosiltransferasas [UGTs]) se asoció con un aumento transitorio (aproximadamente 2 veces) en la exposición a ambrisentan tras las dosis iniciales en voluntarios sanos. Sin embargo, en el día 8, la administración en estado estacionario de rifampicina no tuvo efecto clínicamente relevante en la exposición de ambrisentan. Los pacientes tratados con ambrisentan deben ser estrechamente vigilados al comenzar el tratamiento con rifampicina (ver secciones 4.4 y 5.2).
Inhibidores de la fosfodiesterasa
La administración conjunta de ambrisentan con un inhibidor de la fosfodiesterasa, como sildenafilo o tadalafilo (ambos sustratos del CYP3A4) en voluntarios sanos, no afectó de manera significativa a la farmacocinética del inhibidor de la fosfodiesterasa ni de ambrisentan (ver sección 5.2).
Otros medicamentos para el tratamiento de la HAP
La eficacia y seguridad de ambrisentan cuando se administra de forma conjunta con otros medicamentos para el tratamiento de la HAP (p. ej. prostanoides y estimuladores de la guanilato ciclasa soluble) no ha sido específicamente estudiada en ensayos clínicos controlados en pacientes con HAP (ver sección 5.1). No se prevén interacciones farmacológicas específicas con estimuladores de la guanilato ciclasa soluble o con prostanoides de acuerdo a los datos conocidos de biotransformación (ver sección 5.2). Sin embargo, no se han realizado estudios específicos de interacciones farmacológicas con estos fármacos. Por lo tanto, se recomienda precaución en el caso de administración conjunta.
Anticonceptivos orales
En un ensayo clínico realizado en voluntarios sanos, los niveles en estado estacionario alcanzados con ambrisentan 10 mg administrado una vez al día, no afectaron significativamente a la farmacocinética de una dosis única de etinilestradiol y noretindrona, componentes de un anticonceptivo oral combinado (ver sección 5.2). Según los datos obtenidos en este estudio farmacocinético, no se espera que ambrisentan afecte de manera significativa la exposición a anticonceptivos que contengan estrógenos o progestágenos.
Warfarina
En un ensayo en voluntarios sanos, ambrisentan no tuvo efectos sobre la farmacocinética en estado estacionario, ni sobre la actividad anti-coagulante de la warfarina (ver sección 5.2). La warfarina tampoco tuvo efectos clínicamente significativos sobre la farmacocinética de ambrisentan. Además, la administración de ambrisentan no afectó de forma general a la dosis semanal de anticoagulantes tipo warfarina, al tiempo de protrombina (PT), ni al Índice Internacional Normalizado (IIN o INR).
Ketoconazol
La administración de ketoconazol (un potente inhibidor del CYP3A4) en estado estacionario no produjo un aumento clínicamente relevante en la exposición a ambrisentan (ver sección 5.2).
Efecto de ambrisentan sobre los transportadores xenobióticos
Se ha observado que ambrisentan, in vitro, y a concentraciones clínicamente relevantes, no tiene efecto inhibitorio sobre los transportadores humanos, incluyendo la glicoproteína-P (Pgp), la proteína de resistencia de cáncer de mama (BCRP), la proteína 2 relacionada con resistencia a múltiples fármacos (MRP2), la bomba exportadora de sales biliares (BSEP), los polipéptidos trasportadores de aniones orgánicos (OATP1B1 y OATP1B3) y el polipéptido cotransportador del taurocolato dependiente de sodio (NTCP).
Ambrisentan es un sustrato del eflujo mediado por Pgp.
Los estudios in vitro en hepatocitos de rata, también mostraron que ambrisentan no induce la expresión de las proteínas Pgp, BSEP o MRP2.
La administración en estado estacionario de ambrisentan a voluntarios sanos no tuvo efectos clínicamente relevantes sobre la farmacocinética de digoxina, un sustrato de la Pgp, administrada en dosis única (ver sección 5.2).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil
El tratamiento con ambrisentan no debe ser iniciado en mujeres en edad fértil, a menos que el resultado de la prueba de embarazo pre-tratamiento sea negativo y se utilicen medidas anticonceptivas fiables. Se recomienda hacer pruebas de embarazo mensuales durante el tratamiento con ambrisentan.
Embarazo
Ambrisentan está contraindicado durante el embarazo (ver sección 4.3). Estudios en animales han mostrado que ambrisentan es teratogénico. No hay experiencia en humanos.
Las mujeres que reciben ambrisentan deben ser informadas del riesgo de daño fetal y del tratamiento alternativo que deben iniciar si se quedan embarazadas (ver secciones 4.3, 4.4 y 5.3).
Lactancia materna
Se desconoce si ambrisentan se excreta en la leche materna humana. No se ha estudiado en animales la excreción de ambrisentan en la leche. Por lo tanto, la lactancia materna está contraindicada en pacientes que toman ambrisentan (ver sección 4.3).
Fertilidad masculina
El desarrollo de atrofia tubular testicular en animales macho ha sido asociado a la administración crónica de ERAs, incluyendo ambrisentan (ver sección 5.3). Aunque en el estudio ARIES-E no se encontró una evidencia clara de un efecto perjudicial de la exposición a largo plazo a ambrisentan sobre el recuento de espermatozoides, la administración crónica de ambrisentan se asoció con cambios en los marcadores de la espermatogénesis. Se observó una disminución en la concentración plasmática de inhibina-B y un aumento en la concentración plasmática de la hormona folículo estimulante (FSH). Se desconoce el efecto sobre la fertilidad masculina en humanos, pero no puede excluirse un deterioro de la espermatogénesis. En ensayos clínicos la administración crónica de ambrisentan, no fue asociada con un cambio en los niveles plasmáticos de testosterona.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de ambrisentan sobre la capacidad para conducir y utilizar máquinas es pequeña a moderada. Al examinar a los pacientes su capacidad para realizar tareas que requieran atención, habilidad motora o cognitiva, se debe tener en cuenta el estado clínico del paciente y el perfil de reacciones adversas de ambrisentan (como hipotensión, mareos, astenia, fatiga) (ver sección 4.8). Los pacientes deben ser conscientes de cómo puede afectarles ambrisentan antes de conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
La seguridad de ambrisentan en monoterapia y/o en combinación se ha evaluado en ensayos clínicos con más de 1.200 pacientes con HAP (ver sección 5.1). A continuación se incluye, por frecuencia y clasificación por órganos y sistemas, las reacciones adversas recogidas de los datos de un ensayo clínico controlado con placebo de 12 semanas. También se incluye información de estudios no controlados con placebo a largo plazo (ARIES-E y AMBITION (combinación con tadalafilo)). No se identificaron reacciones adversas previamente desconocidas con el tratamiento a largo plazo o para ambrisentan en combinación con tadalafilo.Con una evaluación más larga en estudios no controlados (observación media de 79 semanas), el perfil de seguridad fue semejante al observado en estudios a corto plazo. También se presentan datos de farmacovigilancia rutinaria.
Las reacciones adversas más frecuentemente observadas con ambrisentan fueron edema periférico, retención de líquidos y dolor de cabeza (incluyendo el dolor de cabeza sinusal, migraña). La dosis más alta (10 mg) se asoció con una mayor incidencia de estas reacciones adversas, y el edema periférico tendió a ser más grave en pacientes > 65 años en ensayos clínicos a corto plazo (ver sección 4.4).
Tabla de reacciones adversas
Las frecuencias se definen como: muy frecuentes (> 1/10); frecuentes (> 1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Para las reacciones adversas relacionadas con la dosis, la categoría de frecuencia refleja la dosis más alta de ambrisentan. Las categorías de frecuencia no tienen en cuenta otros factores, como la variación en la duración del estudio, las condiciones pre-existentes y las características iniciales del paciente. Las categorías de frecuencia de las reacciones adversas, asignadas conforme a la experiencia obtenida en los ensayos clínicos, pueden no reflejar la frecuencia con que aparecen estas reacciones adversas en la práctica clínica habitual. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Ambrisentan (ARIES-C y poscomercialización) |
Ambrisentan (AMBITION y ARIES-E) |
Combinación con tadalafilo (AMBITION) | |
|
Trastornos de la sangre y del sistema linfático | |||
|
Anemia (disminución de hemoglobina, disminución de hematocrito) |
Frecuentes1 |
Muy frecuentes |
Muy frecuentes |
|
Trastornos del sistema inmunológico | |||
|
Reacciones de hipersensibilidad (por ejemplo, angioedema, erupción, prurito) |
Poco frecuentes |
Frecuentes |
Frecuentes |
|
Trastornos del sistema nervioso | |||
|
Cefalea (incluyendo cefalea sinusal, migraña) |
Muy frecuentes2 |
Muy frecuentes |
Muy frecuentes |
|
Mareo |
Frecuentes3 |
Muy frecuentes |
Muy frecuentes |
|
Trastornos oculares | |||
|
Visión borrosa, alteración visual |
Frecuencia no conocida4 |
Frecuentes |
Frecuentes |
|
Trastornos del oído y del laberinto | |||
|
Tinnitus |
NR |
NR |
Frecuentes |
|
Sordera súbita |
NR |
NR |
Poco frecuentes |
|
Trastornos cardíacos | |||
|
Fallo cardíaco |
Frecuentes5 |
Frecuentes |
Frecuentes |
|
Palpitación |
Frecuentes |
Muy frecuentes |
Muy frecuentes |
|
Trastornos vasculares | |||
|
Hipotensión |
Frecuentes3 |
Frecuentes |
Frecuentes |
|
Rubefacción |
Frecuentes |
Frecuentes |
Muy frecuentes |
|
Síncope |
Poco frecuentes3 |
Frecuentes |
Frecuentes |
|
Trastornos respiratorios, torácicos y mediastínicos | |||
|
Epistaxis |
Frecuentes3 |
Frecuentes |
Frecuentes |
|
Disnea |
Frecuentes3,6 |
Muy frecuentes |
Muy frecuentes |
|
Congestión del tracto respiratorio superior (p. ej. nasal, senos), sinusitis, nasofaringitis, rinitis |
Frecuentes7 | ||
|
Nasofaringitis |
Muy frecuentes |
Muy frecuentes | |
|
Sinusitis, rinitis |
Frecuentes |
Frecuentes | |
|
Congestión nasal |
Muy frecuentes |
Muy frecuentes | |
|
Trastornos gastrointestinales | |||
|
Náuseas, vómitos, diarrea |
Frecuentes3 | ||
|
Náuseas |
Muy frecuentes |
Muy frecuentes | |
|
Vómitos |
Frecuentes |
Muy frecuentes | |
|
Diarrea |
Muy frecuentes |
Muy frecuentes | |
|
Dolor abdominal |
Frecuentes |
Frecuentes |
Frecuentes |
|
Estreñimiento |
Frecuentes |
Frecuentes |
Frecuentes |
|
Trastornos hepatobiliares | |||
|
Daño hepático (ver sección 4.4) |
Poco frecuentes3, 8 |
NR |
NR |
|
Hepatitis autoinmune (ver sección 4.4) |
Poco frecuentes3,8 |
NR |
NR |
|
Incremento de las transaminasas hepáticas |
Frecuentes3 |
NR |
NR |
|
Trastornos de la piel y del tejido subcutáneo | |||
|
Erupción cutánea |
NR |
Frecuentes9 |
Muy frecuentes9 |
|
Trastornos generales y alteraciones en el lugar de administración | |||
|
Edema periférico, retención de fluidos |
Muy frecuentes |
Muy frecuentes |
Muy frecuentes |
|
Dolor/malestar torácico |
Frecuentes |
Frecuentes |
Muy frecuentes |
|
Astenia |
Frecuentes3 |
Frecuentes |
Frecuentes |
|
Fatiga |
Frecuentes3 |
Muy frecuentes |
Muy frecuentes |
NR - No reportado
1 Consulte la sección "Descripción de las reacciones adversas seleccionadas"
2 La frecuencia de aparición de cefalea fue mayor con 10 mg de ambrisentan.
3 Datos derivados de la farmacovigilancia rutinaria y frecuencias basadas en la experiencia de ensayos clínicos controlados con placebo.
4 Datos derivados de la farmacovigilancia rutinaria
5 La mayoría de los casos de fallo cardíaco notificados estaban asociados con la retención de fluidos. Datos derivados de la farmacovigilancia rutinaria, frecuencias basadas en modelos estadísticos de datos de ensayos clínicos controlados con placebo.
6 Se han notificado casos de empeoramiento de la disnea de etiología poco clara poco después de iniciar el tratamiento con ambrisentan.
7 La incidencia de congestión nasal durante el tratamiento con ambrisentan estuvo relacionada con la dosis.
8Se han notificado casos de hepatitis autoinmune, incluyendo casos de exacerbación de hepatitis autoinmune, y daño hepático, durante el tratamiento con ambrisentan.
9 Erupción cutánea: incluye erupción eritematosa, erupción generalizada, erupción papular y erupción prurítica
Descripción de las reacciones adversas seleccionadas Descenso de hemoglobina.
En el período posterior a la comercialización, se han notificado casos de anemia que requieren transfusiones de glóbulos sanguíneos (ver sección 4.4). La frecuencia del descenso en hemoglobina (anemia) fue mayor con 10 mg de ambrisentan. A lo largo de ensayos clínicos en Fase 3 de 12 semanas de duración controlados con placebo, las concentraciones medias de hemoglobina disminuyeron en los grupos de pacientes tratados con ambrisentan y se detectaron en la 4a semana (descenso de 0,83 g/dL); los cambios medios de la situación inicial parecieron estabilizarse a lo largo de las 8 semanas siguientes. Un total de 17 pacientes (6,5%) en los grupos de tratamiento con ambrisentan tuvieron disminuciones en la hemoglobina >15% de la situación inicial y cayeron por debajo del límite de normalidad.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional de
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay experiencia en pacientes HAP tratados con ambrisentan a dosis diarias superiores a 10 mg. En voluntarios sanos, dosis únicas de 50 y 100 mg (de 5 a 10 veces la dosis máxima recomendada) se asociaron con cefaleas, rubefacción, mareo, náuseas y congestión nasal.
Debido al mecanismo de acción, una sobredosis de ambrisentan podría potencialmente dar origen a un cuadro de hipotensión (ver sección 5.3). En el caso de hipotensión pronunciada, se puede necesitar soporte cardiovascular activo. No se encuentra disponible ningún antídoto específico.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Anti-hipertensivos, otros anti-hipertensivos, código ATC: C02KX02 Mecanismo de acción
Ambrisentan es un principio activo que se administra por vía oral, perteneciente a la clase del ácido propanóico, que actúa como antagonista selectivo del receptor de endotelina (ARE) de tipo A (ETA). La endotelina desempeña un papel fundamental en la fisiopatología de la HAP.
• Ambrisentan es un potente antagonista ETA (Ki 0,016 nM) y altamente selectivo (aproximadamente 4.000 veces más selectivo para ETA que para ETB).
• Ambrisentan bloquea el subtipo ETA, del receptor que se localiza mayoritariamente en las células musculares lisas vasculares y miocitos cardiacos. De este modo se previene la activación de sistemas de segundos mensajeros mediada por la endotelina y que origina vasoconstricción y la proliferación de las células musculares lisas.
• Se espera que la selectividad de ambrisentan por el receptor ETA en lugar de por el receptor ETB conserve la producción mediada por el receptor ETB de los vasodilatadores óxido nítrico y prostaciclina.
Eficacia clínica y seguridad
Se realizaron dos ensayos clínicos pivotales de Fase 3 multicéntricos, aleatorizados, doble ciego y controlados con placebo (ARIES-1 y ARIES-2). ARIES-1 incluyó 201 pacientes y comparó ambrisentan 5 mg y 10 mg con placebo. ARIES-2 incluyó 192 pacientes y comparó ambrisentan 2,5 mg y 5 mg con placebo. En ambos ensayos, ambrisentan fue añadido a la medicación de soporte/previa del paciente, que podía incluir una combinación de digoxina, anticoagulantes, diuréticos, oxígeno y vasodilatadores (bloqueantes de los canales de calcio, IECAs). Los pacientes reclutados padecían HAPI o HAP asociada a enfermedad del tejido conectivo. La mayoría de los pacientes tenían síntomas propios de la clase funcional II de la Organización Mundial de la Salud (OMS) (38,4%) o de la clase III (55,0%). Los pacientes con enfermedad hepática pre-existente (cirrosis o elevación clínicamente significativa de aminotransferasas) y los pacientes que estaban recibiendo otros tratamientos específicos para la HAP (p. ej. prostanoides) fueron excluidos. En estos ensayos no se evaluaron parámetros hemodinámicos.
El criterio de valoración principal de eficacia definido para los estudios en Fase 3 fue la mejoría en la capacidad del ejercicio valorada por el cambio, a las 12 semanas, frente a la situación basal, en la distancia recorrida en el test de la marcha de los 6 minutos (TM6M). En ambos ensayos, el tratamiento con ambrisentan tuvo como resultado una mejoría significativa en el TM6M, para cada una de las dosis de ambrisentan.
La mejoría, corregida por placebo, en la media del TM6M en la semana 12 comparada con la situación basal fue de 30,6 m (IC 95%: 2,9 a 58,3; p=0,008) y 59,4 m (IC 95%: 29,6 a 89,3; p<0,001) para el grupo de 5 mg, en ARIES 1 y 2 respectivamente. La mejoría, corregida por placebo, en la media del TM6M en la semana 12 en el grupo de pacientes de 10 mg en ARIES-1 fue 51,4 m (IC 95%: 26,6 a 76,2; p <0,001).
Se realizó un análisis combinado pre-especificado de los ensayos de Fase 3 (ARIES-C). La mejoría media, corregida por placebo, en el TM6M fue de 44,6 m (IC 95%: 24,3 a 64,9; p<0,001) para la dosis de 5 mg, y de 52,5 m (IC 95%: 28,8 a 76,2; p<0,001) para la dosis de 10 mg.
En el ensayo ARIES-2, la administración de ambrisentan (grupo de dosis combinada) retrasó significativamente el tiempo transcurrido hasta el empeoramiento clínico de la HAP en comparación con placebo (p<0,001); el valor de hazard ratio (índice de riesgo) mostró una reducción del 80% (IC 95%:
47% a 92%). La medida incluyó: muerte, transplante pulmonar, hospitalización por HAP, septostomía atrial, adición de otros agentes terapéuticos para el tratamiento de la HAP y criterios de abandono temprano. Se observó un incremento estadísticamente significativo (3,41 ± 6,96) para el grupo de dosis combinadas en la escala de función física de la encuesta de SF-36 Health Survey comparado con placebo (-0,20 ± 8,14; p=0,005). El tratamiento con ambrisentan produjo una mejoría estadísticamente significativa en la Escala de Disnea de Borg (BDI) en la semana 12 (BDI corregido por placebo de -1,1 (IC 95%: -1,8 a -0,4; p=0,019; grupo de dosis combinadas)).
Datos a largo plazo
Los pacientes reclutados en los ensayos ARIES 1 y 2 fueron elegibles para entrar en una fase abierta de extensión a largo plazo, el ensayo ARIES-E (n=383). La exposición media combinada fue aproximadamente 145 ± 80 semanas, y la exposición máxima fue aproximadamente 295 semanas. Las principales variables primarias de este ensayo fueron la incidencia y gravedad de los acontecimientos adversos asociados con la exposición prolongada a ambrisentan, incluyendo pruebas de función hepática (PFH) en suero. Los hallazgos de seguridad observados en este ensayo con exposición a largo plazo a ambrisentan fueron generalmente consistentes con los observados en los ensayos controlados con placebo de 12 semanas.
La probabilidad de supervivencia observada para los sujetos que recibieron ambrisentan (grupo de dosis combinada de ambrisentan) a 1, 2 y 3 años fue 93%, 85% y 79% respectivamente.
En un ensayo abierto (AMB222) se administró ambrisentan a 36 pacientes para evaluar la incidencia de niveles séricos elevados de aminotransferasas en pacientes que habían interrumpido previamente otro tratamiento con un ARE debido a anormalidades en las aminotransferasas. Durante la duración media del tratamiento con ambrisentan, que fue de 53 semanas, ninguno de los pacientes reclutados presentó niveles séricos de ALT> 3xLSN que requirieran una interrupción permanente del tratamiento. El cincuenta por ciento de pacientes había aumentado de 5 mg a 10 mg de ambrisentan durante este tiempo.
La incidencia acumulada de anormalidades en las aminotransferasas séricas > 3xLSN en todos los estudios Fase 2 y 3 (incluyendo sus correspondientes fases abiertas de extensión) fue de 17 en 483 sujetos para una duración media de exposición de 79,5 semanas. Esto equivale a una tasa de acontecimientos de 2,3 acontecimientos por 100 pacientes año de exposición a ambrisentan. En el ensayo abierto a largo plazo ARIES E, el riesgo a los 2 años de desarrollar un aumento de los niveles séricos de aminotransferasas >3xLSN en pacientes tratados con ambrisentan fue 3,9%.
Otra, información clínica.
En un estudio en Fase 2 (AMB220), se observó una mejoría en los parámetros hemodinámicos en pacientes con HAP, después de 12 semanas (n=29). El tratamiento con ambrisentan tuvo como resultado un incremento en el índice cardiaco medio, una disminución en la presión arterial pulmonar media, y una disminución en la resistencia vascular pulmonar media.
Durante el tratamiento con ambrisentan se han notificado disminuciones en las presiones arteriales sistólica y diastólica. En ensayos clínicos controlados con placebo de 12 semanas de duración, la reducción media de las presiones arteriales sistólicas y diastólicas desde los valores basales hasta el final del tratamiento fueron 3 mm Hg y 4,2 mm Hg respectivamente. Las disminuciones medias de las presiones arteriales sistólica y diastólica continuaron hasta los 4 años de tratamiento con ambrisentan en el ensayo ARIES E abierto a largo plazo.
Durante un estudio de interacción fármaco-fármaco en voluntarios sanos, no se observaron efectos clínicamente relevantes en la farmacocinética de ambrisentan ni de sildenafilo, y la combinación fue bien tolerada. El número de pacientes que recibieron ambrisentan y sildenafilo de forma concomitante durante los ensayos ARIES-E y AMB222 fue 22 pacientes (5.7%) y 17 pacientes (47%), respectivamente. En estos pacientes no se identificaron aspectos de seguridad adicionales.
Eficacia clínica en combinación con tadalafilo
Se realizó un estudio (AMB112565/AMBITION) de fase 3 multicéntrico, doble ciego, con comparador activo, dirigido por eventos, para evaluar la eficacia de la combinación inicial de ambrisentan y tadalafilo vs la monoterapia sólo de ambrisentan o tadalafilo, en 500 pacientes con HAP sin tratamiento previo, aleatorizados 2:1:1 respectivamente. Ningún paciente recibió sólo placebo. El análisis primario comparó el grupo con combinación vs al grupo con la monoterapia agrupada. También se realizaron comparaciones complementarias del grupo con tratamiento combinado vs los grupos de monoterapia individuales. Se excluyeron los pacientes con anemia importante, retención de fluidos o enfermedades raras de la retina, según los criterios de los investigadores. También se excluyeron los pacientes con valores basales de ALT y AST por encima de dos veces el límite superior de la normalidad (>2xLSN).
Al inicio del estudio, el 96% de los pacientes no habían sido tratados previamente con ningún tratamiento específico para la HAP, y la mediana de tiempo desde el diagnóstico hasta la inclusión en el estudio fue de 22 días. Los pacientes comenzaron con 5 mg de ambrisentan y 20 mg de tadalafilo y se fue aumentando la dosis hasta los 40 mg de tadalafilo en la semana 4 y hasta los 10 mg de ambrisentan en la semana 8, a menos que hubiera problemas de tolerabilidad. La mediana de duración del tratamiento doble ciego para el tratamiento combinado fue superior a 1,5 años.
La variable primaria fue el tiempo hasta la primera aparición de un evento de fracaso clínico, definido como:
- muerte, o
- hospitalización por empeoramiento de la HAP,
- progresión de la enfermedad,
- respuesta clínica insatisfactoria a largo plazo.
La edad media de todos los pacientes fue de 54 años (SD 15; rango de edad 18-75 años). La clase funcional (OMS) de los pacientes al inicio fue CF II (31%) y CF III (69%). La HAP hereditaria o idiopática fue la etiología más común en la población de estudio (56%), seguida por HAP debido a trastornos del tejido conectivo (37%), la HAP asociada a fármacos y toxinas (3%), la cardiopatía congénita simple corregida (2%) y el VIH (2%). Los pacientes con CF II y III de la OMS recorrieron una distancia basal media en el test de la marcha de los 6 minutos (TM6M) de 353 metros.
Variables resultantes
El tratamiento con terapia combinada resultó en una reducción del riesgo del 50% (hazard ratio [HR] 0,502; IC 95%: 0,384 a 0,724; p=0,0002) de la variable compuesta de evaluación del fracaso clínico hasta la visita de evaluación final, en comparación con el grupo de las monoterapias agrupadas [Figura 1 y Tabla 1]. El efecto del tratamiento combinado fue impulsado por una reducción del 63% en las hospitalizaciones, se estableció temprano y fue mantenido. La eficacia de la terapia de combinación en la variable primaria fue coherente en la comparación con las monoterapias individuales y en los subgrupos de edad, etnia, región geográfica, etiología (HAPI/HAPH e HAP- ETC). El efecto fue significativo tanto para pacientes en CF II como en CF III.
Figura 1
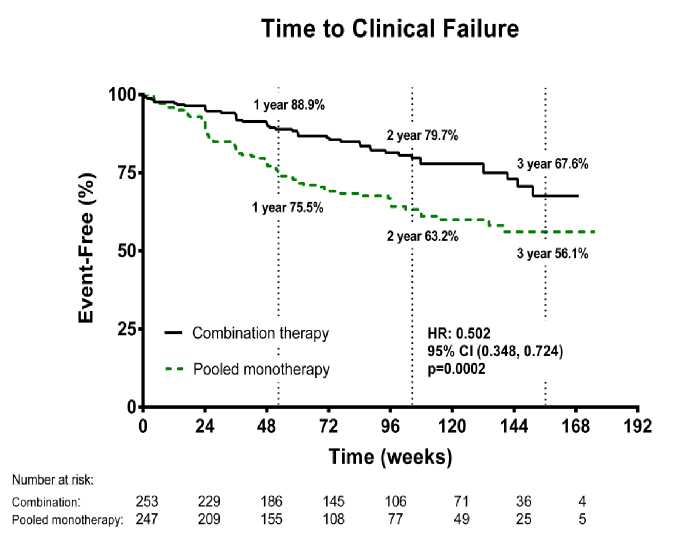
Tabla 1
|
Ambrisentan + Tadalafilo (N=253) |
Monoterapia Agrupada (N=247) |
Monoterapia con ambrisentan (N=126) |
Monoterapia con tadalafilo (N=121) | |
|
Tiempo hasta el primer evento de fracaso clínico (Adjudicado) | ||||
|
Fracaso clínico, n°. (%) |
46 (18%) |
77 (31%) |
43 (34%) |
34 (28%) |
|
Hazard ratio (IC 95%) |
0,502 (0,348; 0,724) |
0,477 (0,314; 0,723) |
0,528 (0,338; 0,827) | |
|
Valor-P, test de Log-rank |
0,0002 |
0,0004 |
0.0045 | |
|
Componente como primer evento de fracaso clínico (Adjudicado) | ||||
|
Muerte (todas las causas) |
9 (4%) |
8 (3%) |
2 (2%) |
6 (5%) |
|
Hospitalización por empeoramiento de la HAP |
10 (4%) |
30 (12%) |
18 (14%) |
12 (10%) |
|
Progresión de la enfermedad |
10 (4%) |
16 (6%) |
12 (10%) |
4 (3%) |
|
Respuesta clínica insatisfactoria a largo plazo |
17 (7%) |
23 (9%) |
11 (9%) |
12 (10%) |
|
Tiempo hasta primera hospitalización por empeoramiento de la HAP (Adjudicado) | ||||
|
Primera hospitalización, n°. (%) |
19 (8%) |
44 (18%) |
27 (21%) |
17 (14%) |
|
Hazard ratio (IC 95%) |
0,372 |
0,323 |
0,442 | |
|
Valor-P, test de Log-rank |
0,0002 |
<0,0001 |
0,0124 | |
Variables secundarias
Se analizaron las variables secundarias:
Tabla 2
|
Variables secundarias (cambio desde el inicio a la semana 24) |
Ambrisentan + Tadalafilo |
Monoterapia agrupada |
Diferencia e intervalo de confianza |
Valor p |
|
NT-proBNP (% reducción) |
-67,2 |
-50,4 |
% diferencia -33,8; IC 95%: -44,8, -20,7 |
p<0,0001 |
|
% de sujetos que consiguieron una respuesta clínica satisfactoria en la semana 24 |
39 |
29 |
Oportunidad relativa 1,56; IC 95%: 1,05, 2,32 |
p=0,026 |
|
TM6M (metros, mediana de cambio) |
49.0 |
23.8 |
22.75m; IC 95%: 12,00; 33,50 |
p<0,0001 |
Fibrosis pulmonar idiopática
Un estudio que se estaba realizando en 492 pacientes (ambrisentan N=329, placebo N=163) con fibrosis pulmonar idiopática (FPI), de los cuales un 11% tenían hipertensión pulmonar secundaria (Grupo 3 de la OMS), tuvo que concluir anticipadamente cuando se determinó que la variable de eficacia primaria no podía ser cumplida (estudio ARTEMIS-IPF). En el grupo de ambrisentan se observaron noventa acontecimientos (27%) de progresión de FPI (incluyendo las hospitalizaciones respiratorias) o muerte, comparado con 28 acontecimientos (17%) en el grupo placebo. Por lo tanto, ambrisentan está contraindicado en pacientes con FPI con o sin hipertensión pulmonar secundaria (ver sección 4.3).
5.2 Propiedades farmacocinéticas
Absorción
Ambrisentan se absorbe rápidamente en humanos. Después de la administración oral, las concentraciones plasmáticas máximas (Cmax) de ambrisentan se alcanzan normalmente alrededor de 1,5 horas después de la dosis, tanto en condiciones de ayuno como con alimentos. La Cmax y el área bajo la curva de concentración-tiempo plasmática (AUC) aumentan proporcionalmente con la dosis en el intervalo de dosis terapéutico. El estado estacionario normalmente se consigue a los 4 días de administración repetida.
En un estudio sobre el efecto de la comida, en el que se administró ambrisentan a voluntarios sanos en condiciones de ayuno y tras una comida con alto contenido en grasas, se observó una disminución del 12% en la Cmax mientras que el AUC permaneció inalterado. Esta disminución en el pico de concentración no es clínicamente significativa, y por tanto ambrisentan puede ser tomado con o sin alimentos.
Distribución
Ambrisentan presenta una elevada unión a proteínas plasmáticas. La unión a proteínas plasmáticas in vitro de ambrisentan fue, de media, 98,8% e independiente de la concentración en el rango de 0,2 - 20 microgramos/ml. Ambrisentan se fija principalmente a la albúmina (96,5%) y en menor grado a la alfai-glicoproteína ácida.
La distribución de ambrisentan en los glóbulos rojos es baja, con una proporción media sangre:plasma de 0,57 y 0,61 en hombres y mujeres, respectivamente.
Biotransformación
Ambrisentan es un ARE de tipo no sulfonamida (perteneciente a la clase del ácido propanóico).
Ambrisentan es glucuronizado por varias isoenzimas UGT (UGT1A9S, UGT2B7S y UGT1A3S) para formar un glucurónido de ambrisentan (13%). Ambrisentan también sufre metabolismo oxidativo principalmente por el CYP3A4 y en menor grado por el CYP3A5 y el CYP2C19 para formar 4-hidroximetil ambrisentan (21%), que es posteriormente glucuronizado para dar el 4-hidroximetil ambrisentan glucurónido (5%). La afinidad del 4-hidroximetil ambrisentan por el receptor de endotelina humano es 65 veces menor que la de ambrisentan. Por lo tanto, para las concentraciones plasmáticas observadas (aproximadamente el 4% se corresponde con ambrisentan inalterado), no se espera que el 4-hidroximetil ambrisentan contribuya a la actividad farmacológica de ambrisentan.
Los datos in vitro indican que ambrisentan a concentraciones de 300 pM produjo una inhibición de menos del 50 % sobre UGT1A1, UGT1A6, UGT1A9, UGT2B7 (hasta el 30 %), o sobre las enzimas del citocromo P450 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A4 (hasta el 25 %). Ambrisentan, in vitro, y a concentraciones clínicamente relevantes, no tiene efecto inhibidor sobre los transportadores humanos, incluyendo Pgp, BCRP, MRP2, BSEP, OATP1B1, OATP1B3 y NTCP. Además, ambrisentan, en hepatocitos de ratas, no indujo la expresión de las proteínas MPR2, Pgp o BSEP. Teniendo en cuenta los datos in vitro, no es de esperar que ambrisentan a concentraciones clínicamente relevantes (Cmax en plasma de hasta 3,2 pM), tenga efecto sobre UGT1A1, UGT1A6, UGT1A9, UGT2B7, o sobre las enzimas del citrocromo P450 1A2, 2A6, 2B6, 2C8, 2C9, 2C19. 2D6, 2E1, 3A4, o sobre transportadores de la vía BSEP, BCRP, Pgp, MRP2, OATP1B1/3, o NTCP.
Los efectos de ambrisentan en estado estacionario (10 mg una vez al día) sobre las propiedades farmacocinéticas y farmacodinámicas de una dosis única de warfarina (25 mg), medidos como TP e INR, se investigaron en 20 voluntarios sanos. Ambrisentan no tuvo ningún efecto clínicamente relevante en las propiedades farmacocinéticas y farmacodinámicas de warfarina. De igual modo, la administración conjunta con warfarina no afectó a las propiedades farmacocinéticas de ambrisentan (ver sección 4.5).
Los efectos de administrar sildenafilo durante 7 días (20 mg tres veces al día) sobre las propiedades farmacocinéticas de una dosis única de ambrisentan, y los efectos de administrar ambrisentan durante 7 días (10 mg una vez al día) en las propiedades farmacocinéticas de una dosis única de sildenafilo, fueron investigados en 19 voluntarios sanos. Con la excepción de un aumento del 13% en la Cmax de sildenafilo, tras la administración conjunta de ambrisentan, no hubo ningún otro cambio en los parámetros farmacocinéticos de sildenafilo, N-desmetil sildenafilo y ambrisentan. Este leve incremento en la Cmax de sildenafilo no se considera clínicamente relevante (ver sección 4.5).
Los efectos de los niveles de ambrisentan en estado estacionario (10 mg una vez al día) sobre la farmacocinética de una dosis única de tadalafilo, así como los efectos de los niveles de tadalafilo en estado estacionario (40 mg una vez al día) sobre la farmacocinética de una dosis única de ambrisentan fueron estudiados en 23 voluntarios sanos. Ambrisentan no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de tadalafilo. Asimismo, la coadministración con tadalafilo no afectó a la farmacocinética de ambrisentan (ver sección 4.5).
Los efectos de la administración repetida de ketoconazol (400 mg una vez al día) en las propiedades farmacocinéticas de una dosis única de 10 mg de ambrisentan fueron investigados en 16 voluntarios sanos. Las exposiciones de ambrisentan medidas como AUC(0-inf) y Cmax se incrementaron en un 35% y un 20%, respectivamente. Es improbable que este cambio en la exposición tenga alguna relevancia clínica y por lo tanto ambrisentan puede ser administrado junto con ketoconazol.
Los efectos de la administración repetida de ciclosporina A (100 - 150 mg dos veces al día) sobre la farmacocinética de ambrisentan en estado estacionario (5 mg una vez al día), y los efectos de la administración repetida de ambrisentan (5 mg una vez al día) sobre la farmacocinética de ciclosporina A en estado estacionario (100 - 150 mg dos veces al día), fueron estudiados en voluntarios sanos. La Cmax y el AUC(0-t) de ambrisentan se incrementaron en un 48% y 121%, respectivamente en presencia de dosis múltiples de ciclosporina A. Basado en estos cambios, la dosis de ambrisentan debe ser limitada a 5 mg una vez al día cuando se co-administra con ciclosporina A (ver sección 4.2). Sin embargo, dosis múltiples de ambrisentan no tuvieron efecto clínicamente significativo en la exposición a ciclosporina A, por lo que no está justificado el ajuste de dosis de ciclosporina A.
Los efectos de administrar dosis únicas y repetidas de rifampicina (600 mg una vez al día) sobre las propiedades farmacocinéticas de ambrisentan en estado estacionario (10 mg una vez al día) fueron estudiados en voluntarios sanos. Tras las dosis iniciales de rifampicina, se observó un aumento transitorio de ambrisentan AUC(0-T)(121% y 116% después de la primera y segunda dosis de rifampicina, respectivamente), presumiblemente debido a una inhibición de la OATP mediada por rifampicina. Sin embargo, en el día 8 no hubo un efecto clínicamente relevante en la exposición a ambrisentan, tras la administración de dosis múltiples de rifampicina. Los pacientes tratados con ambrisentan deben ser estrechamente vigilados al comenzar el tratamiento con rifampicina (ver secciones 4.4 y 4.5).
Los efectos de la administración repetida de ambrisentan (10 mg) sobre las propiedades farmacocinéticas de una dosis única de digoxina fueron estudiados en 15 voluntarios sanos. La administración de dosis múltiples de ambrisentan produjo leves aumentos en el AUC0-last, en las concentraciones mínimas, y un aumento del 29% en la Cmax de digoxina. El aumento en la exposición a digoxina observada tras la administración de ambrisentan en dosis múltiples no se consideró clínicamente relevante, y por lo tanto no es necesario realizar un ajuste de dosis de digoxina (ver sección 4.5).
Los efectos de la administración de ambrisentan durante 12 días (10 mg una vez al día) sobre la farmacocinética de una dosis única de un anticonceptivo oral que contenía etinilestradiol (35 pg) y noretindrona (1 mg) fueron estudiados en un grupo de mujeres voluntarias sanas. La Cmax y el AUC(0-<X)) disminuyeron ligeramente para el etinilestradiol (8% y 4% respectivamente) y aumentaron ligeramente para la noretindrona (13% y 14 % respectivamente). Estos cambios en la exposición a etinilestradiol o noretindrona fueron pequeños y es poco probable que sean clínicamente relevantes (ver sección 4.5).
Eliminación
Ambrisentan y sus metabolitos son eliminados principalmente por vía biliar tras sufrir metabolismo hepático y/o extra-hepático. Tras la administración oral, aproximadamente un 22% de la dosis administrada es eliminada en la orina, siendo un 3,3% ambrisentan inalterado. La semivida de eliminación plasmática en humanos esta entre 13,6 y 16,5 horas.
Poblaciones especiales
De acuerdo con los resultados de un análisis farmacocinético poblacional realizado en voluntarios sanos y en pacientes con HAP, las propiedades farmacocinéticas de ambrisentan no se ven influenciadas significativamente ni en función del género ni de la edad (ver sección 4.2).
Insuficiencia renal
Ambrisentan no experimenta un metabolismo renal o aclaramiento renal (excreción) significativo. En un análisis farmacocinético poblacional, el aclaramiento de creatinina resultó ser una covariable estadísticamente significativa que afecta al aclaramiento oral de ambrisentan. Sin embargo, la magnitud de la disminución en el aclaramiento oral es moderada (20-40%) en pacientes con insuficiencia renal moderada y por lo tanto es improbable que sea clínicamente relevante. En cualquier caso, se debe tener precaución en pacientes con insuficiencia renal grave (ver sección 4.2).
Insuficiencia hepática
Las principales rutas de metabolización de ambrisentan son la glucuronidación y la oxidación con la subsiguiente eliminación en la bilis, por lo tanto se podría esperar que la insuficiencia hepática aumente la exposición (Cmax y AUC) a ambrisentan. En un análisis farmacocinético poblacional, el aclaramiento oral disminuyó como consecuencia de los crecientes niveles de bilirrubina. Sin embargo, la magnitud del efecto de la bilirrubina es moderada (comparado con un paciente típico, con una bilirrubina de 0,6 mg/dl, un paciente con una bilirrubina elevada de 4,5 mg/dl tendría aproximadamente un 30% menos de aclaramiento oral de ambrisentan). No se han estudiado las propiedades farmacocinéticas de ambrisentan en pacientes con insuficiencia hepática (con o sin cirrosis). Por lo tanto, el tratamiento con ambrisentan no debe ser iniciado en pacientes con insuficiencia hepática grave o que presenten una elevación de las aminotransferasas clínicamente relevante (>3xLSN) (ver secciones 4.3 y 4.4).
5.3 Datos preclínicos sobre seguridad
Debido al efecto farmacológico principal de clase de medicamentos, una dosis única elevada de ambrisentan (es decir una sobredosis) podría provocar un descenso en la presión arterial y por tanto tener el potencial para causar un cuadro de hipotensión y síntomas relacionados con la vasodilatación.
No se ha observado que ambrisentan inhiba el transportador de ácidos biliares, ni que provoque hepatotoxicidad sintomática.
Después de la administración crónica en roedores se ha apreciado inflamación y cambios en el epitelio de la cavidad nasal a exposiciones por debajo de los niveles terapéuticos en humanos. En perros, se observaron respuestas inflamatorias leves tras la administración prolongada de altas dosis de ambrisentan a exposiciones 20 veces superiores a las observadas en pacientes.
Se ha observado hiperplasia del hueso nasal de los cornetes etmoidales de la cavidad nasal en ratas tratadas con ambrisentan, a niveles de exposición 3 veces superiores al AUC terapéutico. No se ha observado hiperplasia del hueso nasal con ambrisentan en ratones ni perros. En ratas, la hiperplasia del cornete nasal es una respuesta conocida a la inflamación nasal, según la experiencia obtenida con otros compuestos.
Ambrisentan fue clastogénico cuando fue probado a altas concentraciones en células de mamíferos in vitro. No se han observado efectos mutagénicos ni genotóxicos para ambrisentan en bacterias ni en dos estudios in vivo realizados en roedores.
No hubo evidencia de potencial carcinogénico en estudios orales a 2 años en ratas y ratones. Hubo un pequeño aumento en fibroadenomas mamarios, un tumor benigno, en ratas macho, únicamente a la dosis más alta. La exposición sistémica a ambrisentan en ratas macho a esta dosis (basado en el AUC en estado estacionario) fue 6 veces mayor que la alcanzada con la dosis clínica de 10 mg/día.
La atrofia tubular testicular, que fue asociada ocasionalmente con aspermia, fue observada en los estudios de toxicidad con dosis orales repetidas y en estudios de fertilidad en ratas macho y en ratones sin margen de seguridad. Los cambios testiculares no fueron completamente reversibles durante los períodos de descanso evaluados. Sin embargo, no se observó ningún cambio testicular en estudios con perros de hasta 39 semanas de duración a una exposición 35 veces el AUC visto en humanos. En ratas macho, ambrisentan no tuvo efecto sobre la motilidad de los espermatozoides en todas las dosis ensayadas (hasta 300 mg/kg/día). Se observó una leve disminución (<10%) en el porcentaje de espermatozoides morfológicamente normales a 300 mg/kg/día, pero no a 100 mg/kg/día (> 9 veces la exposición clínica en 10 mg/día). Se desconoce el efecto de ambrisentan sobre la fertilidad humana masculina.
Ambrisentan ha mostrado ser teratogénico en ratas y conejos. Se han observado anormalidades en la mandíbula inferior, lengua y/o paladar para todas las dosis ensayadas. Además, el estudio en ratas mostró un aumento en la incidencia de defectos en el septo interventricular, defectos en el tronco vascular, anormalidades en el tiroides y timo, osificación del basiesfenoides, y la aparición de la arteria umbilical localizada en la parte izquierda de la vejiga urinaria en lugar de en el lado derecho. Se sospecha que la teratogenicidad es un efecto de clase de los AREs.
La administración de ambrisentan en ratas hembra desde la última fase del embarazo hasta la lactancia causó acontecimientos adversos sobre la conducta de la madre, supervivencia reducida de las crías y deterioro de la capacidad reproductora de la descendencia (con observación de pequeños testículos en la necroscopia), a una exposición de 3 veces el AUC para la dosis máxima recomendada en humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido Lactosa monohidrato Celulosa microcristalina Croscarmelosa sódica Estearato de magnesio
Recubrimiento
Alcohol polivinílico (parcialmente hidrolizado) Talco (E553b)
Dióxido de titanio (E171)
Macrogol / PEG 3350 Lecitina (soja) (E322)
Rojo Allura AC Aluminio Lake (E129)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase Blíster PVC/PVDC/aluminio.
Tamaños de envases con blísteres unidosis de 10x1 ó 30x1 comprimidos recubiertos con película. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Glaxo Group Ltd
980 Great West Road
Brentford
Middlesex
TW8 9GS
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/451/003
EU/1/08/451/004
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 21 de abril de 2008 Fecha de la última renovación: 24 de abril de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
ANEXO II
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Aspen Bad Oldesloe GmbH Industriestrasse 32-36 D-23843 Bad Oldesloe Alemania
o
Glaxo Operations UK Ltd
(operando como Glaxo Wellcome Operations)
Harmire Road Barnard Castle Co. Durham DL12 8DT Reino Unido
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior, publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o
como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Medidas adicionales de minimización de riesgos
El TAC acordará con las Autoridades Nacionales competentes los detalles de un sistema de distribución controlado y lo implementará nacionalmente, para asegurar que antes de que se prescriba (y cuando proceda de acuerdo con la Autoridad Nacional competente, se dispense), todos los profesionales sanitarios que tengan intención de prescribir (y cuando proceda, dispensar) Volibris, hayan recibido la siguiente documentación:
• Información del producto (Resumen de las Características del Producto (FT) y prospecto)
• Información al profesional sanitario con respecto a Volibris
• Listado de factores a considerar por el médico antes de la prescripción (check-list)
• Información sobre el estudio de farmacovigilancia post-comercialización
• Folletos informativos para pacientes
• Folletos informativos para las parejas masculinas de pacientes femeninas en edad fértil
• Tarjetas recordatorio para pacientes
• Formularios de notificación de embarazo
• Formularios de notificación de reacciones adversas
Información para el profesional sanitario
La información para el profesional sanitario relativa a Volibris, debe contener los siguientes elementos clave:
Obligaciones del profesional sanitario en relación con la prescripción de Volibris:
• Los pacientes deben ser capaces de cumplir con los requerimientos para el uso seguro de Volibris.
• Proporcionar consejos comprensibles y asesoramiento a los pacientes.
• Proporcionar a los pacientes el/los folleto(s) informativo(s) apropiado(s) y la tarjeta recordatorio.
• Debe considerar una prescripción mensual para 30 días, con el fin de asegurar que los pacientes y los resultados de las pruebas clave son revisados antes de una siguiente prescripción.
• Debe conocer que la base de datos de la seguridad de Volibris es limitada y que se alienta a los médicos a reclutar pacientes para un estudio de farmacovigilancia post-comercialización.
• Notificar sospechas de reacciones adversas y embarazo.
Volibris es teratogénico
• Volibris está contraindicado durante el embarazo y en mujeres en edad fértil que no estén utilizando métodos anticonceptivos fiables.
• Las mujeres que reciben Volibris deben ser advertidas del riesgo de daño fetal.
• Guía para identificar a mujeres que potencialmente pueden quedarse embarazadas y las acciones que el médico debe tomar si sospecha.
Para mujeres en edad fértil:
• Descartar el embarazo antes del inicio del tratamiento y pruebas de embarazo mensuales durante el tratamiento.
• Aconsejar a las mujeres (incluso si una mujer tiene amenorrea) sobre la necesidad de utilizar métodos anticonceptivos fiables durante el tratamiento y hasta un mes después de abandonarlo definitivamente.
• Definición de anticoncepción fiable y la necesidad de buscar el asesoramiento de un experto, si se sospecha que puede ser conveniente para una paciente individual.
• Si una mujer en edad fértil necesita cambiar o dejar su método anticonceptivo, deberá informar al médico que le ha prescrito su anticonceptivo, que está tomando Volibris.
• Si una mujer en edad fértil necesita cambiar o dejar su método anticonceptivo, debe informar al médico que le ha prescrito Volibris.
• La paciente debe contactar inmediatamente con su médico si sospecha que está embaraza y debe saber que deberá iniciar un tratamiento alternativo si se confirma el embarazo.
• Necesidad de remitir a las pacientes que queden embarazadas a un médico especializado o experimentado en teratología y su diagnóstico para la evaluación y asesoramiento.
• Notificar todos los casos de embarazo ocurridos durante el tratamiento.
Volibris es potencialmente hepatotóxico
• Contraindicación en pacientes con insuficiencia hepática grave (con o sin cirrosis) en pacientes con valores basales de aminotransferasas hepáticas (AST y/o ALT) > 3X LSN.
• Antes de iniciar el tratamiento con ambrisentan se deben evaluar las aminotransferasas hepáticas (ALT y/o AST).
• Durante el período de tratamiento se recomienda llevar a cabo un control mensual de los niveles de ALT y AST.
• Discontinuar el tratamiento con ambrisentan si el paciente presenta un incremento inexplicable y sostenido de ALT y/o AST o si el incremento de ALT y/o AST va acompañado de signos y síntomas de daño hepático (por ej. ictericia).
• En pacientes sin síntomas clínicos de daño hepático o de ictericia, se puede considerar el reinicio del tratamiento con ambrisentan, una vez que se hayan resuelto las anormalidades de las enzimas hepáticas. Se recomienda el consejo de un hepatólogo.
El tratamiento con Volibris causa a menudo una disminución de la concentración de hemoglobina y del hematocrito
• No se recomienda iniciar el tratamiento con Volibris en pacientes con anemia clínicamente significativa.
• Los pacientes que tomen Volibris deben medirse sus niveles de hemoglobina y/o hematocrito de forma regular.
• Si se observa una disminución en la hemoglobina o hematocrito clínicamente relevantes, y se han descartado otras posibles causas, se debería considerar la reducción de dosis o la interrupción del tratamiento con Volibris.
El tratamiento con Volibris causa edema periférico y retención de fluidos
• Si un paciente desarrolla edema periférico clínicamente relevante, con o sin aumento de peso asociado, se debe realizar una evaluación adicional para determinar la causa y si es conveniente se interrumpirá el tratamiento con Volibris.
La administración crónica de Volibris en animales se ha relacionado con atrofia tubular testicular y alteración de la fertilidad. Se desconoce el efecto de Volibris sobre la función testicular y fertilidad masculina en humanos.
El tratamiento con Volibris se debe iniciar con precaución en pacientes con insuficiencia renal grave.
Se han notificado reacciones de hipersensibilidad con Volibris (por ej. angioedema, erupción cutánea), aunque poco frecuentes en ensayos clínicos a corto plazo y frecuentes en los estudios a más largo plazo y en combinación con tadalafilo.
Listado de factores a considerar por el médico antes de la prescripción (check-list)
El listado de factores a considerar por el médico antes de la prescripción debe destacar las contraindicaciones de uso de ambrisentan y las evaluaciones más relevantes que se deben realizar antes de la prescripción, y que deben incluir:
• Pruebas de función hepática.
• Determinación del potencial de las pacientes para quedarse embarazadas.
• Prueba de embarazo si la paciente está en edad fértil.
• Confirmación de que las pacientes con probabilidad de quedarse embarazas utilizan métodos anticonceptivos fiables.
Información para el paciente
Los folletos para los pacientes deben incluir la siguiente información:
• Que Volibris puede causar defectos graves de nacimiento, en fetos concebidos antes, durante, o hasta un mes después de finalizar el tratamiento.
• Que no se puede iniciar el tratamiento con Volibris si la paciente está embarazada.
• Las mujeres en edad fértil deben realizarse una prueba de embarazo inmediatamente antes de la primera prescripción y a intervalos mensuales mientras tomen Volibris.
• La necesidad de asegurar que las mujeres en edad fértil utilizan métodos anticonceptivos fiables y que las pacientes deben informar a sus médicos de cualquier posibilidad del embarazo antes de que se realice una nueva prescripción.
• Si una mujer en edad fértil necesita cambiar o dejar su método anticonceptivo, debe informar al médico que le ha prescrito su anticonceptivo, que está tomando Volibris.
• Si una mujer en edad fértil necesita cambiar o dejar su método anticonceptivo, debe informar al médico que le ha prescrito Volibris.
• La necesidad de que las pacientes contacten inmediatamente con el médico que las trata, si sospechan que pueden estar embarazadas.
• La necesidad de que, si la paciente está planeando quedarse embarazada lo comente antes con su médico.
• Que Volibris puede causar daño hepático.
• Que debido al riesgo de sufrir daño hepático y anemia, los pacientes deben realizarse análisis de sangre de forma regular y también informar a sus médicos, si han experimentando cualquier síntoma de daño hepático.
• Que el paciente no debe dar Volibris a ninguna otra persona.
• Que el paciente debe informar a su médico si sufre cualquier reacción adversa.
Folletos informativos para las parejas masculinas de mujeres en edad fértil
La información para las parejas masculinas de mujeres en edad fértil debe incluir la siguiente información:
• Que Volibris puede causar defectos graves de nacimiento, en fetos concebidos antes, durante, o hasta un mes después de finalizar el tratamiento.
• La necesidad de asegurar que las mujeres con probabilidad de quedarse embarazas utilizan métodos anticonceptivos fiables.
• Que no se puede tomar Volibris si una mujer está o puede estar embarazada.
Tarjetas recordatorio para pacientes
Estas deben incluir los mensajes claves con respecto a la necesidad de realizar análisis periódicos de sangre y pruebas de embarazo, y proporcionar espacio suficiente para apuntar las fechas de revisión y los resultados de las pruebas.
• Obligación de realizar medidas postautorización
No aplica
ANEXO III
1. NOMBRE DEL MEDICAMENTO
Volibris 5 mg comprimidos recubiertos con película ambrisentan
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 5 mg de ambrisentan
3. LISTA DE EXCIPIENTES
Contiene lactosa, lecitina (soja) (E322) y rojo Allura AC aluminio Lake (E129). Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
10x1 comprimidos recubiertos con película 30x1comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Glaxo Group Ltd 980 Great West Road Brentford
Middlesex TW8 9GS Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/451/001 10 comprimidos recubiertos con película EU/1/08/451/002 30 comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
volibris 5 mg
1. NOMBRE DEL MEDICAMENTO
Volibris 10 mg comprimidos recubiertos con película ambrisentan
2. PRINCIPIO(S) ACTIVO(S)_
Cada comprimido contiene 10 mg de ambrisentan
3. LISTA DE EXCIPIENTES
Contiene lactosa, lecitina (soja) (E322) y rojo Allura AC aluminio Lake (E129). Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
10x1 comprimidos recubiertos con película 30x1 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Glaxo Group Ltd 980 Great West Road Brentford
Middlesex TW8 9GS Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/451/003 10 comprimidos recubiertos con película EU/1/08/451/004 30 comprimidos recubiertos con película
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
volibris 10 mg
Blíster_
1. NOMBRE DEL MEDICAMENTO
Volibris 5 mg comprimidos ambrisentan
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Glaxo Group Ltd
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5 OTROS
Blíster_
1. NOMBRE DEL MEDICAMENTO
Volibris 10 mg comprimidos ambrisentan
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Glaxo Group Ltd
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5 OTROS
B. PROSPECTO
Prospecto: información para el usuario
Volibris 5 mg comprimidos recubiertos con película Volibris 10 mg comprimidos recubiertos con película
ambrisentan
Lea todo el prospecto detenidamente antes de empezara tomar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
• Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Volibris y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Volibris
3. Cómo tomar Volibris
4. Posibles efectos adversos
5. Conservación de Volibris
6. Contenido del envase e información adicional
1. Qué es Volibris y para qué se utiliza
Volibris contiene la sustancia activa ambrisentan. Pertenece a un grupo de medicamentos llamados otros antihipertensivos (usados para tratar la presión arterial alta).
Está indicado para el tratamiento de la hipertensión arterial pulmonar (HAP) en adultos. La HAP consiste en una presión sanguínea elevada de los vasos (las arterias pulmonares) que llevan la sangre del corazón a los pulmones. En personas con HAP, estas arterias se hacen más estrechas, por lo que el corazón tiene que trabajar más para bombear sangre hacia los pulmones. Esto hace que las personas se sientan cansadas, mareadas y con dificultad para respirar.
Volibris ensancha las arterias pulmonares, facilitando la labor del corazón en bombear sangre a través de ellas. Esto reduce la tensión arterial y alivia los síntomas.
Volibris puede utilizarse también en combinación con otros medicamentos utilizados para tratar la HAP.
2. Qué necesita saber antes de empezar a tomar Volibris No tome Volibris
• si es alérgico a ambrisentan, a la soja o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• si está embarazada, si está planeando quedarse embarazada, o si puede quedarse embarazada
porque no está utilizando un método fiable de control de la natalidad (anticonceptivo). Por favor lea la información del apartado "Embarazo".
• si está dando el pecho lea la información bajo el epígrafe “Lactancia materna”.
• si padece una enfermedad hepática. Consulte con su médico, quien decidirá si este medicamento es o no adecuado para usted.
si tiene fibrosis de los pulmones, de causa desconocida (fibrosis pulmonar idiopática).
Advertencias y precauciones
Consulte a su médico antes de empezar a tomar este medicamento si tiene:
• problemas hepáticos
• anemia (reducción del número de glóbulos rojos)
• hinchazón de las manos, tobillos o pies causadas por una retención de líquido (edema periférico)
• enfermedad pulmonar donde las venas en los pulmones están bloqueados (enfermedad venooclusiva pulmonar).
^ Su médico decidirá si Volibris es o no adecuado para usted.
Necesitará hacerse análisis de sangre de forma regular
Antes de empezar a tomar Volibris, y periódicamente mientras lo esté tomando, su médico le realizará análisis de sangre para verificar:
• si tiene anemia
• si su hígado funciona correctamente.
^ Es importante que usted se haga estos análisis de sangre de forma regular mientras tome Volibris.
Los signos de que su hígado puede no estar funcionando adecuadamente incluyen:
• pérdida de apetito
• malestar (náuseas)
• vómitos
• temperatura elevada (fiebre)
• dolor de estómago (abdomen)
• coloración amarillenta de la piel o de los ojos (ictericia)
• oscurecimiento de la orina
• picor de la piel.
Si nota alguna de estas circunstancias:
^ Informe a su médico inmediatamente.
Niños y adolescentes
Volibris no está recomendado para los niños y adolescentes menores de años 18 años, ya que se desconoce la seguridad y la eficacia en este grupo de edad.
Toma de Volibris con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Su médico puede necesitar ajustar su dosis de Volibris si usted comienza a tomar ciclosporina A (un medicamento utilizado después de un trasplante o para tratar la psoriasis).
Si está tomando rifampicina (un antibiótico usado para tratar infecciones graves) su médico le supervisará cuando empiece a tomar Volibris.
Si está tomando otros medicamentos utilizados para tratar la HAP (iloprost, epoprostenol, sildenafil) su médico puede necesitar monitolizarle.
^ Informe a su médico o farmacéutico si usted está tomando este medicamento.
Embarazo
Volibris puede dañar al feto concebido antes, durante o poco después del tratamiento.
^•Si existe posibilidad de que se pueda quedar embarazada, use un método anticonceptivo fiable
mientras este tomando Volibris. Consulte a su médico sobre esto.
^ No tome Volibris si usted está embarazada o planea quedarse embarazada.
^ Si se queda embarazada o piensa que pueda estar embarazada mientras está tomando Volibris, consulte a su médico inmediatamente.
Si es mujer y está en edad fértil, su médico le pedirá que se haga una prueba de embarazo antes de empezar a tomar Volibris y periódicamente mientras esté tomando este medicamento.
Lactancia materna
Se desconoce si ambrisentan pasa a la leche materna humana.
^ No dé el pecho mientras esté tomando Volibris. Consulte a su médico sobre esto.
Fertilidad
Si es hombre y está tomando Volibris, es posible que este medicamento disminuya su cantidad de esperma. Hable con su médico si tiene alguna pregunta o duda al respecto.
Conducción y uso de máquinas
Volibris puede causar efectos adversos como hipotensión arterial, mareos, cansancio (ver sección 4) que pueden afectar a su capacidad para conducir y usar máquinas. Los síntomas propios de su enfermedad también pueden hacer disminuir su capacidad para conducir o usar máquinas
^ No conduzca ni use máquinas si no se encuentra bien.
Volibris contiene lactosa, lecitina (soja) y rojo Allura AC aluminio Lake (E129)
Los comprimidos de Volibris contienen pequeñas cantidades de un azúcar llamado lactosa. Si su médico le ha indicado que padece una intolerancia a ciertos azúcares:
^ Consulte a su médico antes de tomar Volibris.
Los comprimidos de Volibris contienen lecitina derivada de soja. Si es alérgico a la soja, no use este medicamento (ver sección 2 “no tome Volibris”).
Los comprimidos de Volibris contienen un colorante azoico llamado rojo Allura AC aluminio Lake (E129), que puede causar reacciones alérgicas (ver sección 4).
3. Cómo tomar Volibris
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cuánto Volibris tomar
La dosis habitual es de un comprimido de 5 mg, una vez al día. Su médico puede decidir aumentarle la dosis a 10 mg, una vez al día.
Si usted toma ciclosporina A, no tome más de un comprimido de 5 mg de Volibris, una vez al día.
Cómo tomar Volibris
Lo mejor es tomar el comprimido siempre a la misma hora del día. Trague el comprimido entero, con un vaso de agua; no divida, aplaste o mastique el comprimido. Puede tomar Volibris con o sin alimentos.
Cómo sacar el comprimido
Estos comprimidos vienen en un embalaje especial para prevenir que los niños los puedan sacar.
1. Separar un comprimido: rasgue por las líneas de corte para separar un "alvéolo" de la tira.
2. Abrir la lámina exterior: comenzando por la esquina coloreada, abra y separe la lámina a lo largo del alvéolo.
3. Sacar el comprimido: empuje suavemente por un lado el comprimido a través de la lámina.
Si toma más Volibris del que debe
Si toma demasiados comprimidos, puede ser más propenso a tener efectos adversos, como dolor de cabeza, sofocos, mareos, náuseas (malestar), o bajada de la presión arterial lo que pueden causar una leve sensación de mareo:
^ Pida consejo a su médico o farmacéutico si toma mas comprimidos de los prescritos.
Si olvidó tomar Volibris
Si olvida tomar una dosis de Volibris, tómela tan pronto como se acuerde y luego continúe como antes. ^ No tome una dosis doble para compensar las dosis olvidadas.
No deje de tomar Volibris sin el consejo de su médico
Volibris es un tratamiento que usted necesitará seguir tomando para controlar su HAP.
^No deje de tomar Volibris a no ser que su médico se lo indique.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Condiciones a las que usted y su médico deben estar atentos:
Reacciones alérgicas
Se trata de un efecto adverso frecuente que puede afectar hasta 1 de cada 10 personas tratadas. Puede notar que aparece una erupción o picor e hinchazón (generalmente de la cara, labios, lengua o garganta), que puede causar dificultad para respirar o tragar.
Hinchazón (edema), especialmente de los tobillos y los pies
Este es un efecto adverso muy frecuente que puede afectar a más de 1 de cada 10 personas tratadas. Insuficiencia cardíaca
Esto es debido a que el corazón no bombea suficiente sangre, causando dificultad para respirar, cansancio extremo e hinchazón en los tobillos y en las piernas. Este es un efecto adverso frecuente que puede afectar hasta 1 de cada 10 personas tratadas.
Anemia (número reducido de glóbulos rojos)
Se trata de un trastorno de la sangre que puede causar cansancio, debilidad, dificultad para respirar y malestar general. A veces esto requiere una transfusión de sangre. Este es un efecto adverso muy frecuente que puede afectar a más de 1 de cada 10 personas tratadas.
Hipotensión (presión arterial baja)
Esto puede causar mareos. Este es un efecto adverso frecuente que puede afectar hasta 1 de cada 10 personas tratadas.
^Informe a su médico inmediatamente si sufre estos efectos o si suceden de repente después de tomar Volibris.
Es importante realizar análisis de sangre periódicos, para controlar si tiene anemia y que su hígado funciona correctamente. Asegúrese de que también ha leído la información de la sección 2 sobre "la necesidad de hacerse análisis de sangre de forma regular" y "los signos de que su hígado puede no estar funcionando adecuadamente".
Otros efectos adversos incluyen Efectos adversos muy frecuentes:
• dolor de cabeza
• mareos
• palpitaciones (latidos rápidos o irregulares del corazón)
• empeoramiento de la dificultad para respirar poco después de comenzar a tomar Volibris
• rinorrea o nariz taponada, congestión o dolor en los senos nasales
• náuseas
• diarrea
• sensación de cansancio.
En combinación con tadalafilo (otro medicamento para la HAP)
Además de lo anterior:
• rubor (enrojecimiento de la piel)
• vómitos
• erupción cutánea
• dolor de pecho/malestar.
Efectos adversos frecuentes:
• visión borrosa u otros cambios en la visión
• desmayos
• resultados anormales en los análisis de sangre para la función hepática
• aumento de la secreción nasal
• estreñimiento
• dolor de estómago (abdomen)
• dolor o malestar torácico
• rubor (enrojecimiento de la piel)
• vómitos
• sensación de debilidad
• sangrado de nariz
• erupción cutánea.
En combinación con tadalafilo
Además de lo anterior, excepto las anomalías en los resultados de los análisis de sangre para la función hepática:
• zumbido en los oídos (tinnitus o acúfenos) sólo cuando se toma el tratamiento combinado. Efectos adversos poco frecuentes:
• daño hepático
• inflamación del hígado causada por las propias defensas del organismo (hepatitis autoinmune).
En combinación con tadalafilo
• pérdida repentina de la audición.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Volibris
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y blíster después de CAD.
La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Volibris
El principo activo es ambrisentan
Cada comprimidos recubierto con película contiene 5 ó 10 mg.
Los demás componentes son: lactosa monohidrato, celulosa microcristalina, croscarmelosa sódica, estearato de magnesio, alcohol polivinílico, talco (E553b), dióxido de titanio (E171), macrogol/polietilenglicol 3350, lecitina (soja) (E322) y rojo Allura AC aluminio Lake (E129).
Aspecto del producto y contenido del envase
El comprimido de Volibris 5 mg comprimidos recubiertos con película es un comprimido rosa pálido, cuadrado, convexo, con "GS" grabado en un lado y "K2C" en el otro lado.
El comprimido de Volibris 10 mg comprimidos recubiertos con película es un comprimido rosa oscuro, ovalado, convexo, con "GS" grabado en un lado y "KE3" en el otro lado.
Volibris se suministra en blíster unidosis como comprimidos recubiertos con película de 5 mg y 10 mg, en envases de 10x1 ó 30x1 comprimidos.
Puede que no todos los tamaños de envases estén comercializados.
Titular de la autorización de comercialización
Glaxo Group Ltd 980 Great West Road Brentford
Middlesex TW8 9GS Reino Unido
Responsable de la fabricación
Aspen Bad Oldesloe GmbH Industriestrasse 32-36 D-23843 Bad Oldesloe Alemania
Glaxo Operations UK Ltd
(operando como Glaxo Wellcome Operations)
Harmire Road Barnard Castle Co. Durham DL12 8DT Reino Unido
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 (0) 10 85 52 00 |
Lietuva GlaxoSmithKline Lietuva UAB Tel: + 370 5 264 90 00 info.lt@gsk.com |
|
Bt^rapnn rnaKcoCMHTKaaHH EOOfl Ten.: + 359 2 953 10 34 |
Luxembourg/Luxemburg GlaxoSmithKline Pharmaceuticals s.a./n.v. Belgique/Belgien Tél/Tel: + 32 (0) 10 85 52 00 |
|
Ceská republika GlaxoSmithKline s.r.o. Tel: + 420 222 001 111 cz.info@gsk.com |
Magyarország GlaxoSmithKline Kft. Tel.: + 36 1 225 5300 |
|
Danmark GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com |
Malta GlaxoSmithKline (Malta) Limited Tel: + 356 21 238131 |
|
Deutschland GlaxoSmithKline GmbH & Co. KG Tel.: + 49 (0)89 36044 8701 produkt.info@gsk.com |
Nederland GlaxoSmithKline BV Tel: + 31 (0)30 6938100 nlinfo@gsk.com |
|
Eesti GlaxoSmithKline Eesti OÜ Tel: + 372 6676 900 estonia@gsk.com |
Norge GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no |
|
EXXáda GlaxoSmithKline A.E.B.E. Tr(k: + 30 210 68 82 100 España GlaxoSmithKline, S.A. Tel: + 34 902 202 700 es-ci@gsk.com |
Osterreich GlaxoSmithKline Pharma GmbH Tel: + 43 (0)1 97075 0 at.info@gsk.com Polska GSK Services Sp. z o.o. Tel.: + 48 (0)22 576 9000 |
|
France Laboratoire GlaxoSmithKline Tél: + 33 (0)1 39 17 84 44 diam@gsk.com |
Portugal GlaxoSmithKline - Produtos Farmacéuticos, Lda. Tel: + 351 21 412 95 00 |
|
Hrvatska GlaxoSmithKline d.o.o. Tel: + 385 1 6051 999 |
Romania GlaxoSmithKline (GSK) S.R.L. Tel: + 4021 3028 208 |
|
Ireland GlaxoSmithKline (Ireland) Limited Tel: + 353 (0)1 4955000 |
Slovenija GlaxoSmithKline d.o.o. Tel: + 386 (0)1 280 25 00 medical.x.si@gsk.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika GlaxoSmithKline Slovakia s. r. o. Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk .com |
|
Italia GlaxoSmithKline S.p.A. Tel: + 39 (0)45 9218 111 |
Suomi/Finland GlaxoSmithKline Oy Puh/Tel: + 358 (0)10 30 30 30 Finland.tuoteinfo@gsk.com |
|
Kúnpoq GlaxoSmithKline (Cyprus) Ltd TpL + 357 22 39 70 00 gskcyprus@gsk.com |
Sverige GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com |
|
Latvija GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com |
United Kingdom GlaxoSmithKline UK Ltd Tel: + 44 (0)800 221441 customercontactuk@gsk.com |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/. También presenta enlaces con otras páginas web sobre enfermedades raras y medicamentos huérfanos.
65
PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Anti-hipertensivos, otros anti-hipertensivos, código ATC: C02KX02