Virirec 2Mg/G Crema
Información obsoleta, busque otroFICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Virirec 2 mg/g crema Virirec 3 mg/g crema
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada envase de un solo uso contiene 200 pg de alprostadilo en 100 mg de crema (2 mg/g).
Cada envase de un solo uso contiene 300 pg de alprostadilo en 100 mg de crema (3 mg/g).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Crema
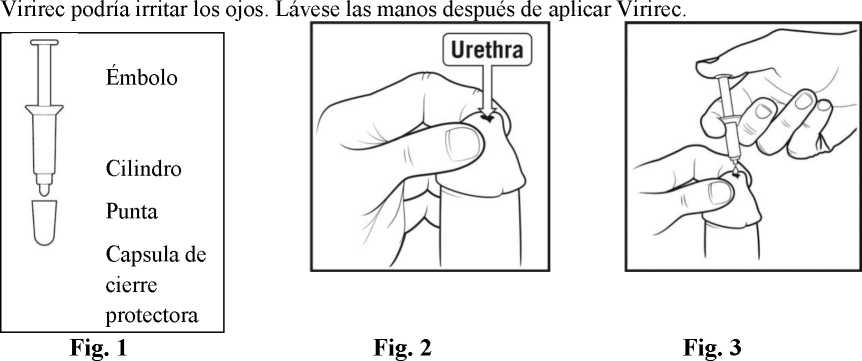
Virirec es una crema de color blanco a blanco mate suministrada en AccuDose, un envase monodosis. AccuDose es un envase que consta de un émbolo, un cilindro y una cápsula de cierre protectora y va contenido en un sobre protector.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de hombres > 18 años de edad con disfunción eréctil, incapaces de lograr o mantener una erección peneana adecuada para un desempeño sexual satisfactorio.
4.2 Posología y forma de administración
Posología
Virirec se aplica en la punta del pene.
Virirec está disponible en dosis de 200 y 300 pg de alprostadilo en 100 mg de crema. Virirec debe usarse cuando sea necesario para lograr una erección. Cada envase AccuDose de Virirec es de un solo uso y se debe eliminar de forma apropiada después del mismo. El comienzo del efecto ocurre en el plazo de 5 a 30 minutos tras la administración. La duración del efecto es de aproximadamente entre 1 y 2 horas. Sin embargo, la duración real será variable entre los pacientes. Un profesional médico deberá instruir a cada paciente acerca de la técnica adecuada para la administración de Virirec antes de la autoadministración. La máxima frecuencia de uso no debe exceder de 2 a 3 veces por semana y solamente una vez por cada periodo de 24 horas.
Un médico debe recomendar la dosis inicial. Una dosis inicial de 300 pg puede considerarse especialmente en pacientes con disfunción eréctil grave, comorbilidad o fracaso a los inhibidores de PDE-5. En aquellos pacientes que no toleran una dosis de 300 pg debido a reacciones adversas, puede valorarse el uso de la dosis más baja de 200 pg.
Los pacientes deben recibir las instrucciones sobre la técnica de administración adecuada, información sobre posibles efectos adversos, p. ej., mareos, desfallecimientos, y la necesidad de evitar el manejo de maquinaria hasta que están seguros de su tolerancia al fármaco. En el ensayo clínico hubo una tasa de retirada más alta en el grupo tratado con 300 pg en comparación con el grupo de 200 pg, 30% en comparación con 20%, respectivamente.
Forma de administración
Aplique Virirec en la punta del pene (meato) en el plazo de 5 y 30 minutos antes de intentar el coito
siguiendo las instrucciones indicadas a continuación:
1 Lávese las manos antes de aplicar Virirec. Retirar el envase AccuDose del sobre rasgando completamente el cierre desde el centro hasta el borde superior. Retirar el envase AccuDose del sobre. Guardar el sobre para eliminar posteriormente el envase de AccuDose utilizado. Retirar la cápsula del cierre de la punta del envase Ver Fig. 1.
2 Tomar la punta del pene con una mano y manipularlo ligeramente para ampliar el orificio del pene. Ver Fig. 2 (nota: si usted no está circuncidado, primeramente retirar y mantener retraído el prepucio antes de ampliar el orificio del pene).
3 Sostener el cilindro del envase AccuDose entre sus dedos y colocar la punta del envase sobre la apertura del pene y cuidadosamente empujar el émbolo con el pulgar hasta que salga toda la crema del cilindro del envase AccuDose y se encuentre en el orificio y en la piel circundante (Fig. 3). Nota: no insertar la cápsula del cierre de la punta del envase AccuDose en el orificio del pene.
4 Mantener el pene en una posición erecta durante aproximadamente 30 segundos para permitir la penetración de la crema. Es probable que haya un poco de crema que no quepa en el orificio del pene. La cantidad de crema adicional será variable dependiendo del paciente y no es inusual que la mitad de la dosis se quede en la orilla del orificio. No utilizar un segundo envase AccuDose para compensar la crema no dispensada dentro del orificio del pene. Cualquier exceso de crema que cubra el orificio del pene se puede frotar suavemente con la punta de un dedo hacia el interior del propio orificio y sobre la piel que rodea el lugar de aplicación.
5 Recordar que cada dosis de Virirec es adecuada solo para una administración. Colocar nuevamente la cápsula de cierre en el envase AccuDose y depositar dentro del sobre abierto, envolver y eliminar de acuerdo con la normativa local.
4.3 Contraindicaciones
Virirec no debe usarse en pacientes con alguno de los siguientes trastornos:
- Trastornos subyacentes como hipotensión ortostática, infarto de miocardio y síncope.
- Hipersensibilidad conocida a alprostadilo o a cualquiera de los ingredientes de Virirec.
- Enfermedades que podrían predisponer a priapismo, como anemia o rasgo de células falciformes, trombocitopenia, policitemia o mieloma múltiple, o leucemia.
- Anatomía anormal del pene como hipospadias graves, en pacientes con deformación anatómica del pene, como curvatura y en pacientes con uretritis y balanitis (inflamación/infección de del glande del pene).
- Propensión a la trombosis venosa o antecedentes de síndrome de hiperviscosidad y que, por lo tanto, tienen un riesgo incrementado de priapismo (erección rígida con duración de 4 horas o más).
- Virirec no debe usarse en pacientes en quienes no se recomienda la actividad sexual, como en hombres con enfermedades cardiovasculares o cerebrovasculares inestables.
Virirec no debe utilizarse durante el coito con una mujer potencialmente fértil a menos que la pareja utilice un condón.
4.4 Advertencias y precauciones especiales de empleo
Efectos locales:
En casos raros, se han observado erecciones prolongadas con una duración > 4 horas (priapismo). Se observó priapismo en los dos estudios de 3 meses en 1 paciente (0,06%) y en el estudio > 6 meses en 5 (0,4%) pacientes, incluidos 4 pacientes (0,3%) en el grupo de 200 pg y en 1 paciente (0,1%) en el grupo de 300 pg. Si ocurre priapismo, el paciente deberá buscar ayuda médica de inmediato. Si el priapismo no se trata de inmediato, se podría ocasionar daño al tejido peneano y una pérdida permanente de potencia.
Durante la dosificación en los estudios de fase III, la hipotensión sintomática (mareos) y síncope ocurrieron en un pequeño porcentaje de los pacientes (2 de 459 (0,4%), 6 de 1.591 (0,4%) y 6 de 1.280 (0,5%) pacientes con las dosis de 100, 200 y 300 pg de alprostadilo, respectivamente. Se debe advertir a los pacientes que deben evitar actividades como la conducción de vehículos o las tareas peligrosas, donde podrían presentarse lesiones si ocurre hipotensión o síncope después de la administración de Virirec.
Antes del inicio del tratamiento con Virirec, las causas tratables de la disfunción eréctil deberán excluirse a través de métodos adecuados de diagnóstico.
Además, los pacientes con trastornos subyacentes, como hipotensión ortostática, infarto de miocardio y síncope no deberán usar Virirec (ver CONTRAINDICACIONES, sección 4.3).
No se han realizado estudios clínicos en pacientes con antecedentes de enfermedades neurológicas o lesiones de la médula espinal.
No se ha estudiado formalmente la farmacocinética de Virirec en pacientes con insuficiencia hepática y/o renal. Se podría necesitar una reducción de la dosis en estas poblaciones debido a la alteración del metabolismo.
Precauciones generales:
Virirec debe aplicarse según las instrucciones anteriores. La exposición intrauretral inadvertida podría ocasionar ardor en el pene o sensación de hormigueo y dolor. No se conoce la exposición intrauretral repetida a largo plazo de Virirec.
Se debe informar a los pacientes que Virirec no ofrece protección frente a las enfermedades de transmisión sexual. Se debe aconsejar a los pacientes y las parejas que utilizan Virirec acerca de las medidas necesarias de seguridad para la protección contra la diseminación de los agentes transmitidos sexualmente, incluido el virus de la inmunodeficiencia humana (VIH).
Los profesionales sanitarios deben recomendar a sus pacientes informar a sus parejas sexuales que están utilizando Virirec. Las parejas de los usuarios de Virirec pueden experimentar efectos adversos, con mayor frecuencia irritación vaginal. Por lo tanto, se recomienda el uso de un condón.
No se han estudiado los efectos de Virirec sobre la mucosa oral o anal. Se deberá utilizar un condón para el sexo oral (felación) o el sexo anal.
Virirec no tiene propiedades anticonceptivas. Se recomienda que las parejas que utilizan Virirec usen anticonceptivos adecuados si la pareja femenina está en edad fértil.
No existe información sobre los efectos de alprostadilo en el embarazo prematuro en los niveles que reciben las parejas femeninas. Se debe utilizar un condón durante las relaciones sexuales con una mujer en edad fértil, embarazada o en lactancia.
Solamente se ha investigado el uso del medicamento con condones basados en material de látex; en otros materiales no se podría excluir el posible riesgo de que se deteriore el condón.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción farmacocinética o farmacodinámica con Virirec. Dada la naturaleza del metabolismo (ver "Farmacocinética") las interacciones farmacológicas se consideran improbables.
Efecto de interacción
No se ha estudiado la toxicidad ni la eficacia de Virirec en combinación con otros tratamientos para la disfunción eréctil, especialmente para el tratamiento con inhibidores de fosfodiesterasa 5 (PDE-5) o sildenafilo, tadalafilo y vardenafilo. Por lo tanto, Virirec no debe usarse en combinación con los inhibidores de PDE-5. Puesto que tanto Virirec como los inhibidores de PDE-5 tienen efectos cardiovasculares, no puede excluirse un riesgo cardiovascular aumentado.
No se han realizado estudios de interacción de Virirec en combinación con implantes peneanos o relajantes del músculo liso, como papaverina, fármacos usados para inducir erecciones, como los fármacos alfa bloqueadores (p. ej., fentolamina, timoxamina por vía intracavernosa). Existe un riesgo de priapismo (erección dolorosa anormal prolongada) cuando se usa en combinación.
No se han realizado estudios de interacción de Virirec en combinación con simpaticomiméticos, descongestivos y supresores del apetito. Cuando se usa en combinación, podría haber un efecto disminuido de alprostadilo (inhibición por interacción farmacológica).
No se han realizado estudios de interacción de Virirec en combinación con anticoagulantes e inhibidores de la agregación plaquetaria. Cuando se usa en combinación, podría haber un riesgo incrementado de sangrado uretral, hematuria.
Los pacientes tratados de forma concomitante con fármacos antihipertensivos y medicamentos vasoactivos, podrían mostrar un riesgo incrementado de hipotensión, especialmente en los pacientes de edad avanzada.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de alprostadilo en mujeres embarazadas. La exposición indirecta de alprostadilo en mujeres es probablemente baja.
Los datos en animales con dosis más altas de alprostadilo mostraron toxicidad para la reproducción (ver sección 5.3).
Las mujeres embarazadas no deben exponerse a Virirec.
Lactancia
No se sabe si la exposición indirecta a alprostadilo mediante Virirec pueda conducir a una excreción significativa en la leche materna. No se recomienda el uso de Virirec durante la lactancia.
Fertilidad
En conejos machos, se observó la atrofia de los túbulos seminíferos de los testículos tras la dosificación repetida. No se conoce si Virirec tiene un efecto sobre la fertilidad masculina humana
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios relativos a los efectos sobre la capacidad para conducir y utilizar máquinas. Debido a que en raras ocasiones se ha informado de mareos y síncopes (desfallecimientos) en los ensayos clínicos con Virirec, los pacientes deberán evitar actividades como la conducción de vehículos o las tareas peligrosas, donde pueden presentarse lesiones si ocurre un síncope dentro del plazo de 1 a 2 horas tras la administración de Virirec.
4.8 Reacciones adversas
Lista tabulada de reacciones adversas
Las reacciones adversas informadas con mayor frecuencia en el tratamiento con Virirec se presentan en la siguiente tabla (Muy frecuentes > 1/10; frecuentes > 1/100, <1/10; poco frecuentes >1/1.000, <1/100; raras >1/10.000, <1/1.000; muy raras <1/10.000).
El priapismo (una erección que dura más de 4 horas) es un trastorno grave que requiere tratamiento médico inmediato.
Tabla 1 Reacciones adversas
|
Clasificación de órganos del sistema (MedDRA) |
Frecuencia |
Reacción adversa |
|
Trastornos del sistema nervioso |
Poco frecuentes |
Hiperestesia |
|
Trastornos vasculares* |
Poco frecuentes |
Mareos Síncope Hipotensión |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes |
Erupción cutánea |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes |
Dolor en una extremidad |
|
Trastornos renales y urinarios |
Frecuentes |
Dolor uretral |
|
Poco frecuentes |
Estenosis uretral Inflamación del tracto urinario | |
|
Trastornos del aparato reproductor y de la mama |
Frecuentes |
Escozor peneano Dolor de pene Eritema peneano Dolor genital Eritema peneano Molestias genitales Eritema genital Erección aumentada Prurito genital Edema de pene Balanitis Hormigueo peneano Pulsaciones en el pene Entumecimiento peneano |
|
En las parejas femeninas: | ||
|
Sensación de escozor vulvovaginal Vaginitis | ||
|
Poco frecuentes |
Prurito peneano Erupción genital Dolor de escroto Plenitud genital Rigidez excesiva Falta de sensación del pene |
|
Erección prolongada/priapismo En las parejas femeninas: | ||
|
Prurito vulvovaginal | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Poco frecuentes |
Dolor de la zona de aplicación |
Poblaciones especiales
* No existe una indicación clara de que alprostadilo aumente el riesgo de efectos cardiovasculares, distintos a los efectos vasodilatadores, pero no puede excluirse que los pacientes con enfermedad subyacente/factores de riesgo presenten un riesgo aumentado en combinación con el aumento de la actividad sexual/física asociada con el uso de alprostadilo (ver 4.3 y 4.4)
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es
4.9 Sobredosis
No se ha informado sobredosis que requiera tratamiento con Virirec. La sobredosis con Virirec puede provocar hipotensión, síncope, mareos, dolor de pene y posible priapismo (erección rígida con duración> 4 horas). El priapismo puede provocar un deterioro permanente de la función eréctil. Los pacientes con sospecha de sobredosis que desarrollan estos síntomas deberán estar bajo supervisión médica hasta que los síntomas generalizados o locales se hayan resuelto.
Si se presenta una erección prolongada con duración de 4 o más horas, se debe aconsejar al paciente buscar ayuda médica. Se deben tomar las siguientes medidas:
- El paciente debe estar en posición supina o acostarse de lado. Aplicar una bolsa de hielo alternando durante dos minutos en cada una de las caras internas de los muslos superiores (esto produce un reflejo que ocasiona la apertura de las válvulas venosas). Si no hay una respuesta después de 10 minutos, interrumpa el tratamiento.
- Si este tratamiento es ineficaz y la rigidez de la erección ha durado más de 6 horas, se deberá realizar una aspiración peneana. Mediante el uso de una técnica aséptica, insertar una aguja mariposa de medida estándar 19-21 dentro del cuerpo cavernoso y aspirar entre 20-50 mililitros de sangre. Esto deberá desentumecer el pene. En caso necesario, el procedimiento podrá repetirse sobre el lado opuesto del pene.
- Si aún no se tiene éxito, se recomienda la inyección intracavemosa de un medicamento a-adrenérgico. Aunque la contraindicación general para la administración intrapeneana de un vasoconstrictor no se aplica en el tratamiento de priapismo, se aconseja tener precaución cuando se pone en práctica esta opción. La presión arterial y el pulso deben comprobarse de forma continua durante este procedimiento. Se requiere precaución extrema en los pacientes con enfermedad cardíaca coronaria, hipertensión no controlada, isquemia cerebral y en los sujetos que toman inhibidores de monoaminooxidasa. En este último caso, se deben tener instalaciones disponibles para manejar una crisis hipertensiva.
- Se debe preparar una solución de 200 pg/ml de fenilefrina y se deben inyectar 0,5 a 1,0 ml de la solución cada 5-10 minutos. Como alternativa, se puede utilizar una solución de 20 pg de adrenalina. En caso necesario, después de esto último se debe continuar además con una aspiración de la sangre a través de la misma aguja mariposa. La dosis máxima de fenilefrina debe ser de 1 mg o de 100 pg de adrenalina (5 ml de la solución).
Como alternativa, se puede utilizar metaraminol, pero debe tenerse en cuenta que se han comunicado crisis hipertensivas mortales. Si esto aún fracasa para resolver el priapismo, se debe remitir de inmediato al paciente para su manejo quirúrgico.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos usados en la disfunción eréctil Código ATC: G04BE01 Mecanismo de acción:
El alprostadilo es químicamente idéntico a la prostaglandina Ei, cuyas acciones incluyen la vasodilatación de los vasos sanguíneos en los tejidos eréctiles del cuerpo cavernoso y el aumento en el flujo sanguíneo arterial venoso, que ocasiona la rigidez peneana.
Tras la aplicación de Virirec, el comienzo de la erección ocurre en el plazo de 5 a 30 minutos. El alprostadilo tiene una semivida corta en el hombre y la mejora de las erecciones puede durar entre 1 y 2 horas tras la administración.
Eficacia
La eficacia de Virirec se evaluó en pacientes con disfunción eréctil en dos estudios pivotales de fase 3. Con respecto al placebo, se observó una mejora global estadísticamente significativa en los grupos de tratamiento con 100, 200 y 300 pg de alprostadilo en cada una de las variables primarias de eficacia, es decir, el dominio de la función eréctil (EF, por sus siglas en inglés) de la escala IIEF (International Index of Erectile Function) y aumentaron el éxito en la penetración vaginal y la eyaculación. Además, hubo también mejoría global y significación estadística de los grupos de tratamiento en comparación con el placebo en muchas de las variables secundarias de eficacia, incluidos los otros dominios de la escala IIEF (función orgásmica, satisfacción coital y satisfacción global), Patient Self-Assessment of Erection (PSAE) y Global Assessment Questionnaire (GAQ).
Eficacia en la subpoblaciones
En general, en las subpoblaciones se observaron mejoría similares a las del total de pacientes (pacientes diabéticos, cardíacos, prostatectomizados, hipertensos y pacientes que habían fracasado anteriormente en la terapia con Viagra) y dos grupos etarios (< 65 y > 65 años) en el dominio EF de la escala IIEF.
5.2 Propiedades farmacocinéticas
Absorción
No se ha determinado la biodisponibilidad absoluta de la vía tópica. En un estudio farmacocinético, los pacientes con disfunción eréctil recibieron tratamiento con Virirec crema 100 mg en dosis de 100, 200 y 300 pg de alprostadilo. Los niveles plasmáticos de PEG1 y de su metabolito, PEG0, fueron bajos o indetectables en muchos de los sujetos en la mayoría de los tiempos de muestreo sanguíneo posteriores a la dosis y los parámetros farmacocinéticos no pudieron estimarse. Los valores de Cmax y de AUC de la 15-ceto-PGE0 fueron bajos y mostraron un aumento menor del proporcional a la dosis en el intervalo entre 100 y 300 pg. Las concentraciones plasmáticas máximas de la 15-ceto-PGE0 se alcanzaron en el plazo de una hora tras la administración.
Tabla 2: Parámetros farmacocinéticos medios (DE) para 15-ceto-PGE0
|
Parámetro |
Placebo (N=5) |
Virirec 100 pg (N=5) |
Virirec 200 pg (N=5) |
Virirec 300 pg (N=5) |
|
AUCa (pg*h/mL) |
388 (256) |
439 (107) |
504 (247) |
960 (544) |
|
Cmax (pg/mL) |
23 (19) |
202 (229) |
120 (103) |
332 (224) |
|
Tmax (h) |
6 (8) |
0,6 (0,4) |
1 (0,7) |
0,7 (0,3) |
|
11/2 (h) |
5 (3) |
3 (1)c |
6 (6) | |
|
a AUC es el área bajo la curva de concentración plasmática desde el tiempo cero hasta 24 horas b Solamente 1 sujeto tuvo suficientes datos para la estimación de la semivida. c Solamente 3 sujetos tuvieron suficientes datos para la estimación de la semivida. | ||||
|
DE = desviación estándar | ||||
Distribución
Tras la administración de alprostadilo en el meato y el glande, el alprostadilo se absorbe rápidamente en el cuerpo esponjoso y el cuerpo cavernoso a través de los vasos colaterales. La cantidad restante pasa hacia la circulación pélvica venosa a través de las venas que drenan el cuerpo esponjoso.
Biotransformación
Tras la administración tópica, la PGE1 se metaboliza rápidamente a 15-ceto-PGE1 de forma local mediante la oxidación enzimática del grupo 15-hidroxilo. La 15-ceto-PGE1 retiene solamente entre el 1% y el 2% de la actividad biológica de la PGE1 y se reduce rápidamente a la forma del metabolito inactivo más abundante, 13, 14-dihidro, 15-ceto-PGE, que se depura principalmente en el riñón y el hígado.
Eliminación
Tras la administración intravenosa de alprostadilo marcado con tritio en hombres, el fármaco marcado desapareció rápidamente de la sangre en los primeros 10 minutos y tras una hora solo quedó en sangre una radiactividad de bajo nivel .Los metabolitos de alprostadilo se eliminan principalmente en los riñones con aproximadamente el 90% de la dosis administrada por vía intravenosa eliminada en la orina dentro del plazo de 24 horas tras la administración. El resto se elimina en las heces. No hay evidencia de la retención tisular de alprostadilo o de sus metabolitos tras la administración intravenosa.
Farmacocinética en _poblaciones especiales Enfermedad pulmonar
Los pacientes con enfermedad pulmonar podrían tener una capacidad disminuida para la depuración del fármaco. En pacientes con síndrome de distress respiratorio del adulto, la extracción pulmonar de PEG1 administrado por vía intravenosa se redujo en aproximadamente 15% en comparación con un grupo control de pacientes con función respiratoria normal.
Género
No se han estudiado los efectos del género sobre la farmacocinética de Virirec ni se han realizado estudios farmacocinéticos en las parejas femeninas.
Población geriátrica, pediátrica
No se han estudiado los efectos etarios sobre la farmacocinética de alprostadilo tópico. Virirec no está indicado para su uso en niños o en individuos menores de 18 años de edad.
5.3 Datos preclínicos sobre seguridad
Alprostadilo, DDAIP y Virirec (incluido DDAIP) no han mostrado potencial genotóxico.
No se han realizado estudios de carcinogenicidad con alprostadilo o Virirec. Las evaluaciones de carcinogenicidad del excipiente, DDAIP, no encontraron formación de tumores con la administración tópica a ratones y la administración subcutánea en ratas. En el modelo de administración de DDAIP en ratones transgénicos Tg.AC se indujeron papilomas a una concentración de 1,0% y 2,5% en hembras y machos, respectivamente. Es probable que este efecto no sea relevante en seres humanos, ya que probablemente es causado por irritación.
Alprostadilo no tiene efectos sobre el recuento o la morfología de los espermatozoides. Sin embargo, el excipiente DDAIP ocasionó atrofia de los túbulos seminíferos de los testículos en conejos cuando se
administró localmente a una concentración del 5%. No se pudo evaluar un efecto espermatotóxico directo del DDAIP y, por lo tanto, se no se conoce la relevancia relativa a una posible reducción en la fertilidad masculina en seres humanos. El DDAIP administrado subcutáneamente a ratas no tuvo efecto sobre la fertilidad.
Se ha demostrado que alprostadilo es embriotóxico (peso fetal disminuido) cuando se administró como bolo subcutáneo en ratas preñadas en dosis bajas. En dosis altas provocó un incremento en las resorciones, redujo el número de fetos vivos, aumentó las incidencias de variaciones viscerales y esqueléticas, y malformaciones, y de la toxicidad materna. La administración intravaginal de la PGE1 en conejos preñados no ocasionó daños en los fetos.
Se realizaron estudios de toxicidad para reproducción con DDAIP tras la administración subcutánea en ratas y conejos. No se observaron efectos en ratas, pero en conejos se observó fetotoxicidad, incluyendo malformaciones, con dosis altas, probablemente atribuidas a toxicidad materna. No hubo efectos evidentes sobre el desarrollo posnatal en ratas.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Agua purificada Etanol, anhidro Etillaureato
Hidroxipropil goma guar
Hidrocloruro de dodecil-2-N,N-dimetilaminopropionato Dihidrogenofosfato de potasio Hidróxido de sodio, para el ajuste del pH Ácido fosfórico, para el ajuste del pH
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
9 meses para Virirec 2 mg/g crema 18 meses para Virirec 3 mg/g crema
Una vez abierto, usar de inmediato, eliminar cualquier porción no utilizada.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
El paciente puede mantener los sobres no abiertos fuera de la nevera, a una temperatura por debajo de 25 °C hasta 3 días antes del uso.
Al final de este periodo, el producto debe eliminarse si no se utiliza.
Conservar en el sobre original para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
Virirec se suministra en sobres individuales que contienen un (1) envase AccuDose. Cada envase individual contiene 100 mg de crema. Virirec está disponible en cajas unitarias que contienen cuatro (4) envases. Los sobres se componen de laminado/película de aluminio. Los componentes del envase son polipropileno y polietileno.
6.6 Precauciones especiales de eliminación .
Cada envase AccuDose de Virirec es de un solo uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Recordati Ireland Ltd.
Raheens East Rengaskiddy Co. Cork.
Irlanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Abril 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
Agosto 2014
10 de 10