Vidaza 25 Mg/Ml Polvo Para Suspension Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Vidaza 25 mg/ml polvo para suspensión inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 100 mg de azacitidina. Después de la reconstitución, cada ml de la suspensión contiene 25 mg de azacitidina.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para suspensión inyectable. Polvo liofilizado blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Vidaza está indicado para el tratamiento de pacientes adultos que no se consideran candidatos a trasplante de células madre hematopoyéticas (TCMH) y que padecen:
• Síndromes mielodisplásicos (SMD) intermedios 2 y de alto riesgo, según el sistema internacional de puntuación pronóstica (IPSS).
• Leucemia mielomonocítica crónica (LMMC) con el 10 al 29 % de blastos medulares sin trastorno mieloproliferativo.
• Leucemia mieloide aguda (LMA) con 20 al 30 % de blastos y displasia multilínea, según la clasificación de la Organización Mundial de la Salud (OMS).
• LMA con >30 % de blastos medulares según la clasificación de la OMS.
4.2 Posología y forma de administración
El tratamiento con Vidaza debe iniciarse y monitorizarse bajo la supervisión de un médico con experiencia en el uso de fármacos quimioterapéuticos. Los pacientes deben ser tratados previamente con antieméticos para las náuseas y los vómitos.
Posología
La dosis inicial recomendada para el primer ciclo de tratamiento, para todos los pacientes, independientemente de los valores hematológicos iniciales, es de 75 mg/m2 de superficie corporal, inyectada por vía subcutánea, diariamente, durante siete días, seguido de un periodo de reposo de 21 días (ciclo de tratamiento de 28 días).
Se recomienda que los pacientes reciban tratamiento durante un mínimo de seis ciclos. El tratamiento debe continuarse mientras el paciente siga beneficiándose o hasta la progresión de la enfermedad.
Se deben vigilar la respuesta/toxicidad hematológica y la toxicidad renal de los pacientes (ver sección 4.4); puede ser necesario un retraso en el inicio del siguiente ciclo o una disminución de una dosis, como se explica más adelante.
Análisis de laboratorio
Antes de iniciar el tratamiento y antes de cada ciclo de tratamiento, deben realizarse pruebas de función hepática y determinarse la creatinina sérica y el bicarbonato sérico. Deben efectuarse recuentos sanguíneos completos antes del inicio del tratamiento y cuando sea necesario para monitorizar la respuesta y la toxicidad, pero como mínimo, antes de cada ciclo de tratamiento.
Ajuste de la dosis debido a toxicidad hematológica
La toxicidad hematológica se define como el recuento sanguíneo más bajo alcanzado en un ciclo determinado (nadir), si el recuento de plaquetas es <50,0 x 109/l o el recuento absoluto de neutrófilos (RAN) es <1 x l09/l.
La recuperación se define como un aumento de la/s línea/s celular/es en las que se observó una toxicidad hematológica, como mínimo, igual a la mitad de la diferencia entre el nadir y el recuento inicial, más el recuento nadir; es decir, recuento sanguíneo en la recuperación frecuento nadir +
(0,5 x [recuento inicial - recuento nadir]).
Pacientes sin una disminución de los recuentos sanguíneos iniciales (es decir, leucocitos >3,0 x 1C?/l y RAN >1,5 x l0/l, y recuento plaquetario >75,0 x l0/l) antes del primer tratamiento Si se observa toxicidad hematológica después del tratamiento con Vidaza, el siguiente ciclo de tratamiento debe retrasarse hasta que el recuento plaquetario y el RAN se hayan recuperado. Si la recuperación se alcanza en un plazo de 14 días, no es necesario un ajuste de la dosis. Sin embargo, si la recuperación no se ha alcanzado en un plazo de 14 días, la dosis debe reducirse según la siguiente tabla. Después de las modificaciones de la dosis, la duración del ciclo debe volver a ser de 28 días.
|
Recuentos nadir |
% de la dosis en el siguiente ciclo, si la recuperación* no se alcanza en un plazo de 14 días | |
|
RAN (x 109/l) |
Plaquetas (x 109/l) | |
|
<1,0 |
<50,0 |
50% |
|
>1,0 |
>50,0 |
100 % |
*Recuperación = recuentos frecuento nadir + (0,5 x [recuento inicial - recuento nadir]).
Pacientes con recuentos sanguíneos iniciales reducidos (es decir, leucocitos <3,0 x l0/l o RAN <1,5 x icP/l o recuento plaquetario <75,0 x l0/l) antes del primer tratamiento Después del tratamiento con Vidaza, si la disminución del recuento leucocitario del RAN o del recuento plaquetario con respecto al recuento antes del tratamiento es <50 % o superior al 50 %, pero con una mejoría en la diferenciación de cualquier línea celular, el siguiente ciclo no debe retrasarse y no debe efectuarse ningún ajuste de la dosis.
Si la disminución del recuento leucocitario del RAN o del recuento plaquetario es superior al 50 % con respecto al recuento antes del tratamiento, y no hay mejoría en la diferenciación de líneas celulares, el siguiente ciclo de tratamiento con Vidaza debe retrasarse hasta que el recuento plaquetario y el RAN se hayan recuperado. Si la recuperación se alcanza en un plazo de 14 días, no es necesario un ajuste de la dosis. Sin embargo, si la recuperación no se ha alcanzado en un plazo de 14 días, debe determinarse la celularidad de la médula ósea. Si la celularidad de la médula ósea es >50 %, no debe efectuarse un ajuste de la dosis. Si la celularidad de la médula ósea es <50 %, el tratamiento debe retrasarse y la dosis debe disminuirse, según la siguiente tabla:
|
Celularidad de la médula ósea |
% de la dosis en el siguiente ciclo, si la recuperación no se alcanza en un plazo de 14 días | |
|
Recuperación* <21 días |
Recuperación* >21 días | |
|
15-50 % |
100 % |
50% |
|
<15 % |
100 % |
33 % |
*Recuperación = recuentos frecuento nadir + (0,5 x [recuento inicial - recuento nadir]).
Después de las modificaciones de la dosis, la duración del ciclo debe volver a ser de 28 días.
Poblaciones especiales:
Pacientes de edad avanzada
No se recomienda ningún ajuste específico de la dosis en los pacientes de edad avanzada. Puesto que es más probable que los pacientes de edad avanzada presenten un deterioro de la función renal, puede ser conveniente vigilar la función renal.
Insuficiencia renal
Se puede administrar azacitidina a pacientes con insuficiencia renal sin la necesidad de ajustar la dosis inicial (ver sección 5.2). Si se producen disminuciones inexplicadas de los niveles de bicarbonato sérico a menos de 20 mmol/l, la dosis deberá disminuirse en un 50 % en el siguiente ciclo. Si se producen aumentos inexplicados de la creatinina sérica o del nitrógeno ureico en sangre (NUS) a >2 veces superiores a los valores iniciales y superiores al límite superior de la normalidad (LSN), el siguiente ciclo deberá retrasarse hasta que los valores vuelvan a la normalidad o a los valores iniciales, y la dosis deberá disminuirse en un 50 % en el siguiente ciclo de tratamiento (ver sección 4.4).
Insuficiencia hepática
No se han realizado estudios formales en pacientes con insuficiencia hepática (ver sección 4.4). Se deben vigilar atentamente las reacciones adversas en los pacientes con insuficiencia orgánica hepática grave. Antes del tratamiento inicial, no se recomienda ninguna modificación específica de la dosis inicial en los pacientes con insuficiencia hepática; las modificaciones posteriores de la dosis deben basarse en los valores hematológicos. Vidaza está contraindicado en los pacientes con tumores hepáticos malignos avanzados (ver secciones 4.3 y 4.4).
Población pediátrica
No se ha establecido la seguridad y eficacia de Vidaza en niños de 0 a 17 años. No se dispone de datos.
Forma de administración
Vidaza reconstituido debe inyectarse por vía subcutánea en el brazo, el muslo o el abdomen. Los lugares de inyección deben someterse a rotación. Las nuevas inyecciones deben administrarse como mínimo a 2,5 cm de distancia del lugar anterior y nunca en zonas sensibles, con equimosis, enrojecidas o endurecidas.
Después de la reconstitución, no se debe filtrar la suspensión. Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Tumores hepáticos malignos avanzados (ver sección 4.4).
Lactancia (ver sección 4.6).
4.4 Advertencias y precauciones especiales de empleo
Toxicidad hematológica
El tratamiento con azacitidina se asocia con anemia, neutropenia y trombocitopenia, especialmente en los dos primeros ciclos (ver sección 4.8). Deben efectuarse recuentos sanguíneos completos cuando sea necesario para vigilar la respuesta y la toxicidad, pero por lo menos, antes de cada ciclo de tratamiento. Después de la administración de la dosis recomendada para el primer ciclo, la dosis para los ciclos posteriores debe reducirse o su administración debe retrasarse según sean el recuento nadir y la respuesta hematológica (ver sección 4.2). Se debe advertir a los pacientes que comuniquen inmediatamente episodios febriles. Se aconseja a los pacientes y a los médicos que estén atentos a la presencia de signos y síntomas de hemorragia.
Insuficiencia hepática
No se han realizado estudios formales en pacientes con insuficiencia hepática. Se han notificado casos de coma hepático progresivo y muerte durante el tratamiento con azacitidina en los pacientes con una carga tumoral amplia debido a enfermedad metastásica, especialmente en los pacientes con niveles de albúmina sérica inicial <30 g/l. Azacitidina está contraindicada en los pacientes con tumores hepáticos malignos avanzados (ver sección 4.3).
Insuficiencia renal
En los pacientes tratados con azacitidina por vía intravenosa en combinación con otros fármacos quimioterapéuticos, se han notificado anomalías renales que variaron entre un aumento de la creatinina sérica e insuficiencia renal y muerte. Además, cinco pacientes con leucemia mieloide crónica (LMC), tratados con azacitidina y etopósido, desarrollaron acidosis tubular renal, definida como una disminución del bicarbonato sérico a <20 mmol/l, asociada a orina alcalina e hipopotasemia (potasio sérico <3 mmol/l). Si se producen disminuciones inexplicadas del bicarbonato sérico (<20 mmol/l) o aumentos de la creatinina sérica o del NUS, la dosis debe disminuirse o la administración debe retrasarse (ver sección 4.2).
Se debe informar a los pacientes que notifiquen inmediatamente la oliguria y la anuria al médico.
Aunque no se observaron diferencias clínicamente relevantes en la frecuencia de las reacciones adversas entre los sujetos con la función renal normal en comparación con los que presentaban insuficiencia renal, se debe vigilar atentamente la toxicidad en los pacientes con insuficiencia renal, puesto que azacitidina y/o sus metabolitos se excretan principalmente por el riñón (ver sección 4.2).
Análisis de laboratorio
Antes de iniciar el tratamiento y antes de cada ciclo de tratamiento, deben realizarse pruebas de función hepática y determinarse la creatinina sérica y el bicarbonato sérico. Deben efectuarse recuentos sanguíneos completos antes del inicio del tratamiento y cuando sea necesario para vigilar la respuesta y la toxicidad, pero como mínimo, antes de cada ciclo de tratamiento, ver también sección 4.8.
Cardiopatía y enfermedad pulmonar
Los pacientes con antecedentes de insuficiencia cardiaca congestiva grave, cardiopatía clínicamente inestable o enfermedad pulmonar fueron excluidos de los estudios pivotales de registro (AZA PH GL 2003 CL 001 y AZA-AML-001); por lo tanto, no se han establecido la seguridad ni la eficacia de azacitidina en estos pacientes. Los datos recientes de un ensayo clínico en pacientes con antecedentes conocidos de enfermedad cardiovascular o pulmonar mostraron un aumento significativo de la incidencia de acontecimientos cardiacos con azacitidina (ver sección 4.8). Por lo tanto, se aconseja precaución al prescribir azacitidina a estos pacientes. Se debe considerar una evaluación cardiopulmonar antes y durante el tratamiento.
Fascitis necrosante
Se han notificado casos de fascitis necrosante, incluyendo casos mortales, en pacientes tratados con Vidaza. Se debe suspender el tratamiento con Vidaza en los pacientes que desarrollen fascitis necrosante y se debe iniciar inmediatamente el tratamiento adecuado.
Síndrome de lisis tumoral
Los pacientes con riesgo de sufrir dicho síndrome son aquellos que presentan una carga tumoral elevada antes del tratamiento. Se debe monitorizar estrechamente a estos pacientes y se deben adoptar las precauciones adecuadas.
4.5 Interacción con otros medicamentos y otras formas de interacción
A partir de la información obtenida in vitro, aparentemente, el metabolismo de azacitidina no está mediado por las isoenzimas del citocromo P450 (CYP), las UDP-glucuronosiltransferasas (UGT), sulfotransferasas (SULT) y glutatión transferasas (GST); por lo tanto, las interacciones relacionadas con estas enzimas metabolizantes in vivo se consideran improbables.
Los efectos inhibitorios o inductores clínicamente significativos de azacitidina sobre las enzimas del citocromo P450 son improbables (ver sección 5.2).
No se han realizado estudios formales de interacción farmacológica clínica con azacitidina.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil / Anticoncepción en hombres y mujeres
Las mujeres en edad fértil y los hombres deben utilizar métodos anticonceptivos efectivos durante y hasta tres meses tras finalizar el tratamiento.
Embarazo
No existen datos suficientes sobre la utilización de azacitidina en mujeres embarazadas. Los estudios en ratones han mostrado toxicidad para la reproducción (ver sección 5.3). Se desconoce el riesgo en seres humanos. A partir de los resultados de los estudios en animales y de su mecanismo de acción, azacitidina no debe utilizarse durante el embarazo, especialmente durante el primer trimestre, a menos que sea claramente necesario. Las ventajas del tratamiento deben sopesarse frente al posible riesgo para el feto en cada caso concreto.
Lactancia
Se desconoce si azacitidina o sus metabolitos se excretan en la leche humana. Debido a las posibles reacciones adversas graves en el niño lactante, la lactancia está contraindicada durante el tratamiento con azacitidina.
Fertilidad
No hay información acerca del efecto de azacitidina sobre la fecundidad en humanos. En los animales se han documentado reacciones adversas con el uso de azacitidina sobre la fecundidad masculina (ver sección 5.3). Se debe aconsejar a los hombres que no conciban un hijo mientras reciben tratamiento, debiendo utilizar un método anticonceptivo eficaz durante el tratamiento y hasta tres meses después del mismo. Antes de iniciar el tratamiento, debe aconsejarse a los pacientes varones que pidan asesoramiento sobre la conservación de esperma.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de azacitidina sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada. Se ha notificado fatiga con el uso de azacitidina. Por lo tanto, se recomienda precaución al conducir un vehículo o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Población adulta con SMD, LMMCy LMA (20-30 % de blastos medulares)
En el 97 % de los pacientes se han producido reacciones adversas consideradas posible o probablemente relacionadas con la administración de Vidaza.
Las reacciones adversas graves más frecuentes observadas en el ensayo pivotal (AZA PH GL 2003 CL 001) fueron neutropenia febril (8,0 %) y anemia (2,3 %), que también se describieron en los ensayos complementarios (CALGB 9221 y CALGB 8921). Otras reacciones adversas graves de estos 3 estudios fueron infecciones tales como sepsis neutropénica (0,8 %) y neumonía (2,5 %) (algunas con desenlace mortal), trombocitopenia (3,5 %), reacciones de hipersensibilidad (0,25 %) y reacciones hemorrágicas (por ejemplo, hemorragia cerebral [0,5 %], hemorragia gastrointestinal [0,8 %] y hemorragia intracraneal [0,5 %]).
Las reacciones adversas notificadas con mayor frecuencia con el tratamiento con azacitidina fueron reacciones hematológicas (71,4 %), incluyendo trombocitopenia, neutropenia y leucopenia (generalmente de grado 3 o 4); reacciones gastrointestinales (60,6 %), incluyendo náuseas, vómitos (generalmente de grado 1 o 2), o reacciones en el lugar de la inyección (77,1 %; generalmente de grado 1 o 2).
Población adulta de 65 años o más con LMA con >30% de blastos medulares Las reacciones adversas graves más frecuentes (>10 %) observadas en el grupo de tratamiento con azacitidina del estudio AZA-AML-001 fueron neutropenia febril (25,0 %), neumonía (20,3 %) y pirexia (10,6 %). Otras reacciones adversas graves notificadas con menor frecuencia en el grupo de tratamiento con azacitidina fueron sepsis (5,1 %), anemia (4,2 %), sepsis neutropénica (3,0 %), infección de las vías urinarias (3,0 %), trombocitopenia (2,5 %), neutropenia (2,1 %), celulitis (2,1 %), mareos (2,1 %) y disnea (2,1 %).
Las reacciones adversas notificadas con mayor frecuencia (>30 %) con el tratamiento con azacitidina fueron reacciones gastrointestinales, incluyendo estreñimiento (41,9 %), náuseas (39,8 %) y diarrea (36,9 %), (generalmente de grado 1 o 2), trastornos generales y alteraciones en el lugar de la administración incluyendo pirexia (37,7 %; generalmente de grado 1 o 2) y reacciones hematológicas, incluyendo neutropenia febril (32,2 %) y neutropenia (30,1 %), (generalmente de grado 3 o 4).
Tabla de reacciones adversas
La Tabla 1 incluida a continuación contiene las reacciones adversas asociadas al tratamiento con azacitidina, obtenidas de los ensayos clínicos principales en pacientes con SMD y LMA y de la experiencia poscomercialización.
Las frecuencias se definen como: Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las reacciones adversas se enumeran en la tabla siguiente según la mayor frecuencia observada en cualquiera de los ensayos clínicos principales.
Tabla 1: Reacciones adversas medicamentosas (RAM) notificadas en pacientes con SMD o LMA tratados con azacitidina (ensayos clínicos y experiencia poscomercialización)
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Infecciones e infestaciones |
Neumonía* (incluye bacteriana, vírica y micótica), nasofaringitis |
Sepsis* (incluye bacteriana, vírica y micótica), sepsis neutropénica*, infección de las vías respiratorias (incluye las vías respiratorias altas y bronquitis), infección de las vías urinarias, celulitis, diverticulitis, infección micótica oral, sinusitis, faringitis, rinitis, herpes simple, infección cutánea |
Fascitis necrosante* | ||
|
Trastornos de la sangre y del sistema linfático |
Neutropenia febril*, neutropenia, leucopenia, trombocitopenia, anemia |
Pancitopenia*, insuficiencia medular |
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilida d | ||||
|
Trastornos del metabolismo y de la nutrición |
Anorexia, pérdida de apetito, hipopotasemia |
Deshidratación |
Síndrome de lisis tumoral | ||
|
Trastornos psiquiátricos |
Insomnio |
Estado de confusión, ansiedad | |||
|
Trastornos del sistema nervioso |
Mareos, cefalea |
Hemorragia intracraneal*, síncope, somnolencia, letargo | |||
|
Trastornos oculares |
Hemorragia ocular, hemorragia conjuntival | ||||
|
Trastornos vasculares |
Hipotensión*, hipertensión, hipotensión ortostática, hematoma | ||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea, epistaxis |
Derrame pleural, disnea de esfuerzo, dolor faringolaríngeo |
Enfermedad pulmonar intersticial | ||
|
Trastornos gastrointestinal es |
Diarrea, vómitos, estreñimiento, náuseas, dolor abdominal (incluye dolor abdominal superior y molestias abdominales) |
Hemorragia gastrointestinal* (incluye hemorragia bucal), hemorragia hemorroidal, estomatitis, hemorragia gingival, dispepsia | |||
|
Trastornos hepatobiliares |
Insuficiencia hepática*, coma hepático progresivo | ||||
|
Trastornos de la piel y del tejido subcutáneo |
Petequias, prurito (incluye prurito generalizado), exantema, equimosis |
Púrpura, alopecia, urticaria, eritema, exantema macular |
Dermatosis neutrofílica febril aguda, pioderma gangrenoso | ||
|
Trastornos musculoesquelé ticos y del tejido conjuntivo |
Artralgia, dolor musculoesque-lético (incluye dolor de espalda, de huesos y de las extremidades) |
Espasmos musculares, mialgia | |||
|
Trastornos renales y urinarios |
Insuficiencia renal*, hematuria, elevación de la creatinina sérica |
Acidosis tubular renal |
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos generales y alteraciones en el lugar de administración |
Pirexia*, fatiga, astenia, dolor torácico, eritema en el lugar de la inyección, dolor en el lugar de la inyección, reacción (no especificada) en el lugar de la inyección |
Equimosis, hematoma, induración, exantema, prurito, inflamación, decoloración, nódulo y hemorragia (en el lugar de la inyección), malestar, escalofríos, hemorragia en el lugar del catéter |
Necrosis en el lugar de inyección (en el lugar de la inyección) | ||
|
Exploraciones complementan as |
Disminución del peso |
* = rara vez se han notificado casos mortales
Descripción de las reacciones adversas seleccionadas
Reacciones adversas hematológicas
Las reacciones adversas hematológicas notificadas con mayor frecuencia (>10 %), asociadas al tratamiento con azacitidina, incluyen anemia, trombocitopenia, neutropenia, neutropenia febril y leucopenia, generalmente de grado 3 o 4. Hay un mayor riesgo de que estas reacciones se produzcan en los dos primeros ciclos, después de los cuales se producen con menor frecuencia y los pacientes restablecen la función hematológica. La mayoría de las reacciones adversas hematológicas se controlaron mediante la vigilancia rutinaria de los recuentos sanguíneos completos y retrasando la administración de azacitidina en el siguiente ciclo, antibióticos profilácticos y/o apoyo con factor de crecimiento (p. ej., G-CSF) para la neutropenia, y transfusiones para la anemia o la trombocitopenia, según fuera necesario.
Infecciones
La mielosupresión puede llevar a neutropenia y a un aumento del riesgo de infección. En los pacientes que han recibido azacitidina se han notificado reacciones adversas graves como sepsis, incluyendo sepsis neutropénica y neumonía, algunas con desenlace mortal. Las infecciones pueden tratarse con el empleo de un antiinfeccioso y refuerzo con factor del crecimiento (p. ej., G-CSF) para la neutropenia.
Hemorragias
Puede producirse hemorragia en los pacientes que reciben azacitidina. Se han notificado reacciones adversas graves, como hemorragia digestiva y hemorragia intracraneal. Se debe vigilar la presencia de signos y síntomas de hemorragia en los pacientes, sobre todo en los que presentan trombocitopenia preexistente o relacionada con el tratamiento.
Hipersensibilidad
Se han notificado reacciones de hipersensibilidad graves en los pacientes que recibían azacitidina. En caso de reacción anafiláctica, el tratamiento con azacitidina debe suspenderse inmediatamente y debe iniciarse el tratamiento sintomático adecuado.
Reacciones adversas de la piel y del tejido subcutáneo
La mayoría de las reacciones adversas cutáneas y del tejido subcutáneo se relacionaron con el lugar de la inyección. En los ensayos pivotales, ninguna de estas reacciones adversas llevó a la suspensión del tratamiento con azacitidina, ni a la disminución de la dosis de azacitidina. La mayoría de las reacciones adversas se produjeron en los dos primeros ciclos de tratamiento y tendieron a disminuir en los ciclos posteriores. Las reacciones adversas del tejido subcutáneo, como exantema, inflamación y prurito en el lugar de la inyección, exantema, eritema y lesión cutánea pueden precisar el tratamiento con un medicamento concomitante, como antihistamínicos, corticoesteroides y medicamentos antiinflamatorios no esteroideos (AINE). Estas reacciones cutáneas se deben diferenciar de las infecciones en los tejidos blandos, que algunas veces ocurren en el lugar de la inyección. Se han notificado casos de infección en tejidos blandos, incluyendo celulitis y fascitis necrosante, que en raras ocasiones condujeron a la muerte, en pacientes tratados con azacitidina en el ámbito poscomercialización. Para el manejo clínico de las reacciones adversas infecciosas, ver sección 4.8 Infecciones.
Reacciones adversas gastrointestinales
Las reacciones adversas gastrointestinales notificadas con mayor frecuencia, relacionadas con el tratamiento con azacitidina, incluyeron estreñimiento, diarrea, náuseas y vómitos. Estas reacciones adversas se trataron sintomáticamente con antieméticos para las náuseas y los vómitos, antidiarreicos para la diarrea, y laxantes y/o ablandadores de las heces para el estreñimiento.
Reacciones adversas renales
En pacientes tratados con azacitidina se notificaron anomalías renales que abarcaron desde la elevación de la creatinina sérica y hematuria hasta acidosis tubular renal, insuficiencia renal y muerte (ver sección 4.4).
Reacciones adversas hepáticas
En pacientes con una gran carga tumoral por enfermedad metastásica se han notificado aparición de insuficiencia hepática, coma hepático progresivo y muerte durante el tratamiento con azacitidina (ver sección 4.4).
Acontecimientos cardiacos
Los datos de un ensayo clínico que permitió la inclusión de pacientes con antecedentes conocidos de enfermedad cardiovascular o pulmonar mostraron un aumento estadísticamente significativo de los acontecimientos cardiacos en pacientes con LMA recién diagnosticada tratados con azacitidina (ver sección 4.4).
Pacientes de edad avanzada
Se dispone de información limitada sobre la seguridad de azacitidina en pacientes > 85 años (con 14 [5,9 %] pacientes >85 años en el estudio AZA-AML-001).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Se notificó un caso de sobredosis con azacitidina durante los ensayos clínicos. Un paciente sufrió diarrea, náuseas y vómitos después de recibir una dosis única por vía intravenosa de aproximadamente 290 mg/m2, casi el cuádruple de la dosis inicial recomendada.
En caso de sobredosis, se deben vigilar en el paciente los recuentos sanguíneos adecuados y debe recibir el tratamiento de apoyo que sea necesario. No existe un antídoto específico conocido para la sobredosis de azacitidina.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agente antineoplásico, análogos de la pirimidina; código ATC: L01BC07 Mecanismo de acción
Se cree que azacitidina ejerce sus efectos antineoplásicos mediante diversos mecanismos, que incluyen citotoxicidad sobre las células hematopoyéticas anormales en la médula ósea e hipometilación del ADN. Los efectos citotóxicos de azacitidina pueden deberse a diversos mecanismos, que incluyen la inhibición del ADN, el ARN y la síntesis de proteínas, la incorporación en el ARN y en el ADN, y la activación de las vías que causan daño en el ADN. Las células no proliferativas son relativamente insensibles a azacitidina. La incorporación de azacitidina en el ADN produce la inhibición de las metiltransferasas de ADN, lo que lleva a la hipometilación del ADN. La hipometilación del ADN de genes metilados aberrantemente, que intervienen en las vías de regulación normal del ciclo celular, diferenciación y muerte puede producir la re-expresión de genes y el restablecimiento de funciones supresoras del cáncer en las células cancerosas. No se ha establecido la importancia relativa de la hipometilación del ADN frente a la citotoxicidad u otras actividades de azacitidina con los desenlaces clínicos.
Eficacia y seguridad clínicas
Población adulta (SMD, LMMCy LMA [20-30 % de blastos medulares])
Se estudiaron la eficacia y la seguridad de Vidaza en un ensayo comparativo internacional, multicéntrico, controlado, abierto, aleatorizado, con grupos paralelos y de fase III (AZA PH GL 2003 CL 001), en pacientes adultos con: SMD intermedio 2 y de alto riesgo, según el sistema internacional de puntuación pronóstica (IPSS), anemia refractaria con exceso de blastos (RAEB), anemia refractaria con exceso de blastos en transformación (RAEB-T) y leucemia mielomonocítica crónica modificada (LMMCm) según el sistema de clasificación franco-americano-británico (FAB). Actualmente, en el sistema vigente de clasificación de la OMS, se considera que los pacientes con RAEB-T (del 21 al 30 % de blastos) son pacientes con LMA. Se comparó el tratamiento con azacitidina más el mejor tratamiento de soporte (BSC) (n = 179) con pautas de cuidados convencionales (PCC). Las PCC consistieron en el BSC solo (n = 105), citarabina a dosis bajas más el BSC (n = 49) o quimioterapia de inducción estándar más el BSC (n = 25). Antes de la asignación aleatoria, los pacientes fueron preseleccionados por su médico para una de las tres PCC. Los pacientes recibieron esta pauta preseleccionada si no fueron asignados aleatoriamente para recibir Vidaza. Como parte de los criterios de inclusión, se exigió a los pacientes que tuvieran un estado funcional de 0 a 2 del Grupo Oncológico Cooperativo del Este (Eastern Cooperative Oncology Group, ECOG). Se excluyó del ensayo a los pacientes con SMD secundarios. El criterio principal de valoración del ensayo fue la supervivencia global. Vidaza se administró a una dosis por vía subcutánea de 75 mg/m2 diarios, durante siete días, seguido de un periodo de reposo de 21 días (ciclo de tratamiento de 28 días), durante una mediana de nueve ciclos (intervalo = 1-39), y una media de 10,2 ciclos. Dentro de la población con intención de tratar (ITT), la mediana de edad fue de 69 años (intervalo de 38 a 88 años).
En el análisis ITT de 358 pacientes (179 que recibieron azacitidina y 179 PCC), el tratamiento con Vidaza se asoció a una mediana de supervivencia de 24,46 meses, en comparación con 15,02 meses en el caso de los que recibieron el tratamiento de PCC, una diferencia de 9,4 meses, con un valor de p de rangos logarítmicos estratificados de 0,0001. La razón de riesgos para el efecto del tratamiento fue 0,58 (IC 95 %: 0,43-0,77). Las tasas de supervivencia a los dos años fueron del 50,8 % en el caso de los pacientes tratados con azacitidina, en comparación con el 26,2 % de los pacientes que recibieron PCC (p <0,0001).
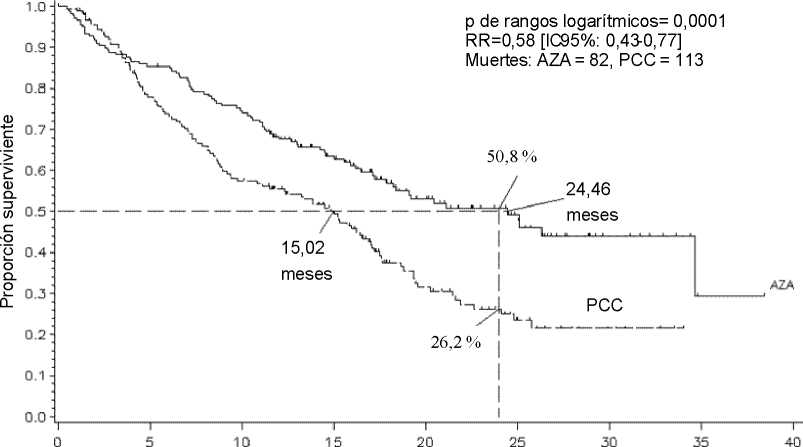
Tiempo (meses desde la aleatorización)
Número en riesgo
AZA 179 152 130 B5 52 20 10 1 O
CCR 179 1 32 9 5 69 32 14 5 O O
LEYENDA: AZA = azacitidina; IC = intervalo de confianza; PCC = pautas de cuidados convencionales; RR = razón de riesgos.
Los beneficios de Vidaza en cuanto a la supervivencia fueron constantes, independientemente de la opción de tratamiento de PCC (BSC solo, citarabina a dosis baja más BSC o quimioterapia de inducción estándar más BSC) utilizados en el grupo control.
Cuando se analizaron los subgrupos citogenéticos de IPSS, se observaron resultados similares en cuanto a la mediana de la supervivencia global en todos los grupos (citogenético bueno, intermedio, deficiente, incluida la monosomía 7).
En los análisis de los subgrupos de edad, se observó un aumento de la mediana de supervivencia global en todos los grupos (<65 años, >65 años y >75 años).
El tratamiento con Vidaza se asoció a una mediana del tiempo hasta la muerte o la transformación en LMA de 13,0 meses, en comparación con 7,6 meses en los pacientes que recibieron tratamiento de PCC, una mejoría de 5,4 meses con un valor de p de rangos logarítmicos estratificados de 0,0025.
El tratamiento con Vidaza también se asoció a una disminución de las citopenias y de sus síntomas relacionados. El tratamiento con Vidaza llevó a una disminución de la necesidad de transfusiones de hematíes y de plaquetas. De los pacientes del grupo tratado con azacitidina que eran dependientes de la transfusión de hematíes al inicio, el 45,0 % de estos pacientes pasaron a ser independientes de la transfusión de hematíes durante el periodo de tratamiento, en comparación con el 11,4 % de los pacientes de los grupos combinados tratados con pautas de cuidados convencionales (una diferencia estadísticamente significativa [p <0,0001] del 33,6 % [IC 95 %: 22,4-44,6]). En los pacientes que dependían de transfusión de hematíes al inicio y que se convirtieron en independientes, la mediana de la duración de la independencia de la transfusión de hematíes fue de 13 meses en el grupo que recibió azacitidina.
La respuesta fue evaluada por el investigador o por un comité de revisión independiente (CRI). La respuesta total (remisión completa [RC] + remisión parcial [RP]) determinada por el investigador fue del 29 % en el grupo tratado con azacitidina y del 12 % en el grupo combinado con pautas de cuidados convencionales (p = 0,0001). La respuesta total (RC + RP) determinada por el CRI en el ensayo AZA PH GL 2003 CL 001 fue del 7 % (12/179) en el grupo tratado con azacitidina, en comparación con el 1 % (2/179) en el grupo combinado con pautas de cuidados convencionales (p = 0,0113). Las diferencias entre las evaluaciones de la respuesta por el CRI y por el investigador se produjeron a consecuencia de los criterios del Grupo Internacional de Trabajo (IWG, International Working Group), que requieren mejoría en los recuentos en sangre periférica y en el mantenimiento de estas mejorías durante un mínimo de 56 días. Se demostró también un beneficio en cuanto a la supervivencia en los pacientes que no habían logrado una respuesta completa o parcial después del tratamiento con azacitidina. Se alcanzó una mejoría hematológica (mayor o menor), como la determina el CRI, en el 49 % de los pacientes que recibieron azacitidina, en comparación con el 29 % de los pacientes combinados tratados con pautas de cuidados convencionales (p <0,0001).
En los pacientes con una o más anomalías citogenéticas al inicio, el porcentaje de pacientes con una respuesta citogenética mayor fue similar al de los grupos tratados con azacitidina y con pautas combinadas de cuidados convencionales. La respuesta citogenética menor fue estadísticamente significativamente (p = 0,0015) más alta en el grupo tratado con azacitidina (34 %), en comparación con el grupo combinado con pautas de cuidados convencionales (10 %).
Población adulta de 65 años o más con LMA con >30% de blastos medulares
Los resultados que se muestran a continuación se refieren a la población por intención de tratar del
estudio AZA-AML-001 (ver sección 4.1 para la indicación aprobada).
Se estudiaron la eficacia y la seguridad de Vidaza en un ensayo de fase III internacional, multicéntrico, controlado, abierto y con grupos paralelos en pacientes de 65 años y más que padecían LMA de novo o secundaria, recientemente diagnosticada, con >30 % de blastos medulares según la clasificación de la OMS y que no eran candidatos a TCMH. Se comparó Vidaza más el mejor tratamiento de soporte (BSC) (n = 241) con las pautas de cuidados convencionales (PCC). Las PCC consistieron en el BSC solo (n = 45), citarabina a dosis bajas más el BSC (n = 158) o quimioterapia intensiva estándar con citarabina y antraciclina más el BSC (n = 44). Antes de la aleatorización, los pacientes fueron preseleccionados por su médico para una de las tres PCC. Los pacientes recibieron la pauta preseleccionada si no fueron aleatorizados para recibir Vidaza. Como parte de los criterios de inclusión, se exigió a los pacientes que tuvieran un estado funcional de 0 a 2 del ECOG y anomalías citogenéticas de riesgo intermedio o desfavorable. El criterio principal de valoración del ensayo fue la supervivencia global.
Vidaza se administró por vía subcutánea a una dosis de 75 mg/m2 al día durante 7 días, seguido de un periodo de reposo de 21 días (ciclo de tratamiento de 28 días), durante una mediana de 6 ciclos (intervalo: 1 a 28). Los pacientes solo con BSC durante una mediana de 3 ciclos (intervalo: 1 a 20), los pacientes con citarabina a dosis bajas durante una mediana de 4 ciclos (intervalo: 1 a 25) y los pacientes con quimioterapia intensiva estándar durante una mediana de 2 ciclos (intervalo: 1 a 3, ciclo de inducción más 1 o 2 ciclos de consolidación).
Los parámetros individuales al inicio eran comparables entre los grupos de tratamiento con Vidaza y con las PCC. La mediana de edad de los sujetos fue de 75,0 años (intervalo: 64 a 91 años), el 75,2 % eran caucásicos y el 59,0 % eran de sexo masculino. Al inicio y según la clasificación de la OMS, la LMA del 60,7 % de los pacientes fue clasificada como LMA sin especificar, del 32,4 % como LMA con cambios relacionados con la mielodisplasia, del 4,1 % como neoplasias mieloides relacionadas con el tratamiento y del 2,9 % como LMA con anomalías genéticas recurrentes.
En el análisis ITT de 488 pacientes (241 con Vidaza y 247 con PCC), el tratamiento con Vidaza se asoció a una mediana de supervivencia de 10,4 meses y el tratamiento con PCC a una mediana de 6,5 meses, una diferencia de 3,8 meses, con un valor de p de rangos logarítmicos estratificados de 0,1009 (bilateral). La razón de riesgos para el efecto del tratamiento fue 0,85 (IC 95 % = 0,69, 1,03). Las tasas de supervivencia al año fueron del 46,5 % en los pacientes tratados con Vidaza y del 34,3 % en los pacientes que recibieron las PCC.
*T3
T3
c3
*T3
1.0
0.9
0.7
Tto
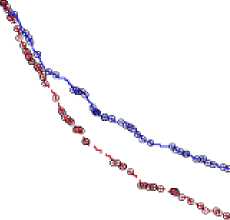
Azacitidina---CCR
Censura
Rango logarítmico no estratificado = 0,0829, Rango logarítmico estratificado p = 0,1009 Mediana de sup.: Azacitidina = 10,4 (8,0, 12,7), PCC = 6,5 (5,0, 8,6)
Acontecimientos N(%): Azacitidina = 193(80,1), PCC = 201(81,4)
Censurado N(%): Azacitidina = 48(19,9), PCC = 46(18,6)
Razón de riesgos no estratificada = 0,84 [IC 95 %: 0,69 - 1,02], Razón de riesgos estratificada = 0,85 [IC 95 %: 0,69 - 1,03]
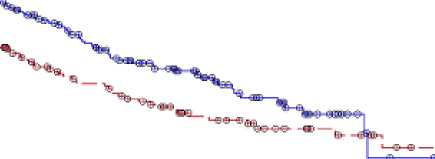
12
20
24
23
02
05
Número en riesgo
A .CCR Azacitidina
128
167
61
117
Tiempo (meses) desde la aleatorización
54
33
39
56
24
31
14
15
El modelo de regresión de COX ajustado para los factores pronósticos iniciales previamente especificados determinó una razón de riesgos para Vidaza del 0,80 (IC del 95 % = 0,66; 0,99; p = 0,0355) en comparación con las CCR.
Además, aunque el estudio no estaba diseñado con el suficiente poder estadístico para demostrar una diferencia estadísticamente significativa al comparar el tratamiento con azacitidina con los grupos de tratamiento de las PCC preseleccionadas, la supervivencia de los pacientes tratados con Vidaza fue mayor en comparación con las opciones de tratamiento de las PCC consistentes en BSC solo, citarabina a dosis bajas más BSC y fueron similares en comparación con la quimioterapia intensiva estándar más BSC.
En todos los subgrupos previamente especificados [edad (<75 años y >75 años), sexo, raza, estado funcional del ECOG [0 o, 1 y 2], riesgo citogenético inicial (intermedio y desfavorable), región geográfica, clasificación de la OMS de la LMA (incluyendo LMA con cambios relacionados con la mielodisplasia), recuento leucocitario inicial (<5 x 109/l y >5 x 109/l], blastos medulares iniciales (<50 % y >50 %) y antecedentes previos de SMD], hubo una tendencia a favor de Vidaza en cuanto al beneficio en la supervivencia global. En unos pocos subgrupos previamente especificados, la razón de riesgos para la supervivencia global fue estadísticamente significativa, incluyendo los subgrupos de pacientes con riesgo citogenético desfavorable, pacientes con LMA con cambios relacionados con la mielodisplasia, pacientes <75 años, pacientes del sexo femenino y pacientes caucásicos.
Las respuestas hematológicas y citogenéticas fueron evaluadas por el investigador y por el CRI con resultados similares. La tasa de respuesta global (remisión completa [RC] + remisión completa con recuperación incompleta del recuento sanguíneo [RCi]) determinada por el CRI fue del 27,8 % en el grupo tratado con Vidaza y del 25,1 % en los grupos combinados tratados con las PCC (p = 0,5384). En los pacientes que lograron una RC o una RCi, la mediana de la duración de la remisión fue de 10,4 meses (IC 95 % = 7,2, 15,2) en los sujetos tratados con Vidaza y de 12,3 meses (IC 95 % = 9,0, 17,0) en los sujetos tratados con las PCC. Se demostró también un beneficio en cuanto a la supervivencia en los pacientes que no habían logrado una respuesta completa con Vidaza en comparación con las PCC.
El tratamiento con Vidaza mejoró los recuentos en sangre periférica y llevó a una disminución de la necesidad de transfusiones de hematíes y de plaquetas. Se consideró que un paciente era dependiente de las transfusiones de hematíes o de plaquetas al inicio si el sujeto había recibido una o más transfusiones de hematíes o de plaquetas durante los 56 días (8 semanas) anteriores a la aleatorización.
Se consideró que un paciente era independiente de las transfusiones de hematíes o de plaquetas durante el periodo de tratamiento si el sujeto no había recibido transfusiones de hematíes o de plaquetas durante 56 días consecutivos durante el periodo de notificación, respectivamente.
De los pacientes del grupo tratado con Vidaza dependientes de las transfusiones de hematíes al inicio, el 38,5 % (IC 95 % = 31,1, 46,2) de estos pacientes pasaron a ser independientes de las transfusiones de hematíes durante el periodo de tratamiento, en comparación con el 27,6 % (IC 95 % = 20,9, 35,1) de los pacientes de los grupos combinados tratados con las PCC. En los pacientes dependientes de las transfusiones de hematíes al inicio y que se convirtieron en independientes durante el tratamiento, la mediana de la duración de la independencia de las transfusiones de hematíes fue de 13,9 meses en el grupo que recibió Vidaza, mientras que en el grupo tratado con las PCC no se alcanzó.
De los pacientes del grupo tratado con Vidaza dependientes de las transfusiones de plaquetas al inicio, el 40,6% (IC 95 % = 30,9, 50,8) de estos pacientes pasaron a ser independientes de las transfusiones de plaquetas durante el periodo de tratamiento, en comparación con el 29,3% (IC 95 % = 19,7, 40,4) de los pacientes de los grupos combinados tratados con las PCC. En los pacientes dependientes de las transfusiones de plaquetas al inicio y que alcanzaron independencia transfusional durante el tratamiento, la mediana de la duración de la independencia de las transfusiones de plaquetas fue de 10,8 meses en el grupo que recibió Vidaza y de 19,2 meses en el grupo tratado con las PCC.
La calidad de vida relacionada con la salud (CVRS) se evaluó utilizando el cuestionario genérico de la calidad de vida de la Organización Europea de Investigación y Tratamiento del Cáncer (EORTC QLQ-C30). Los datos de la CdVRS se pudieron analizar en un subgrupo de la población total del ensayo. Aunque el análisis tiene limitaciones, los datos disponibles sugieren que los pacientes no presentan un deterioro significativo en la calidad de vida durante el tratamiento con Vidaza.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración por vía subcutánea de una dosis única de 75 mg/m2, azacitidina se absorbió rápidamente; produciéndose concentraciones plasmáticas máximas de 750 ± 403 ng/ml a las 0,5 horas después de la administración (el primer punto de extracción de muestras). La biodisponibilidad absoluta de azacitidina después de la administración por vía subcutánea en relación con la intravenosa (dosis únicas de 75 mg/m2) fue de aproximadamente el 89 %, basado en el área bajo la curva (AUC).
El área bajo la curva y la concentración plasmática máxima (Cmáx) de la administración de azacitidina por vía subcutánea fueron aproximadamente proporcionales en el intervalo de dosis de 25 a 100 mg/m2.
Distribución
Después de la administración por vía intravenosa, el volumen medio de distribución fue de 76 ± 26 l, y el aclaramiento sistémico fue de 147 ± 47 l/h.
Biotransformación
A partir de la información obtenida in vitro, aparentemente, el metabolismo de azacitidina no está mediado por las isoenzimas del citocromo P450 (CYP), las UDP-glucuronosiltransferasas (UGT), sulfotransferasas (SULT) y glutatión transferasas (GST).
Azacitidina sufre hidrólisis espontánea y desaminación mediada por la citidina deaminasa. En fracciones S9 del hígado humano, la formación de metabolitos fue independiente del NADPH, lo que implica que el metabolismo de azacitidina no fue mediado por las isoenzimas del citocromo P450. Un estudio in vitro de azacitidina con hepatocitos humanos cultivados indica que, a concentraciones de
1,0 a 100 ^M (es decir, hasta concentraciones aproximadamente 30 veces más altas que las que se alcanzan clínicamente), azacitadina no induce al CYP 1A2, 2C19, 3A4 o 3A5. En estudios para evaluar la inhibición de una serie de isoenzimas del P450 (CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A4), azacitidina en concentraciones de hasta 100 ^M no produjo inhibición. Por lo tanto, es improbable la inducción o la inhibición enzimática del CYP por azacitidina a concentraciones plasmáticas clínicamente alcanzables.
Eliminación
Azacitidina se aclara rápidamente del plasma, con una semivida de eliminación (t/2) media de 41 ± 8 minutos, después de la administración por vía subcutánea. No se produce acumulación de azacitidina tras la administración subcutánea de 75 mg/m2 una vez al día durante 7 días. La excreción urinaria es la principal ruta de eliminación de azacitidina y/o de sus metabolitos. Después de la administración por vías intravenosa y subcutánea de 14C-azacitidina, el 85 % y 50 % de la radioactividad administrada se recuperó en la orina respectivamente, mientras que <1 % se recuperó en las heces.
Poblaciones especiales
No se han estudiado formalmente los efectos de la insuficiencia hepática (ver sección 4.2), del sexo, de la edad o de la raza sobre las propiedades farmacocinéticas de azacitidina.
Insuficiencia renal
La insuficiencia renal no tiene un efecto importante en la exposición farmacocinética de azacitidina tras administraciones únicas y múltiples por vía subcutánea. Tras la administración por vía subcutánea de una dosis única de 75 mg/m2, los valores de exposición medios (AUC y Cmáx) de los sujetos con insuficiencia renal leve, moderada y grave aumentaron en un 11-21 %, un 15-27 % y un 41-66 %, respectivamente, en comparación con los sujetos con la función renal normal. Sin embargo, la exposición estaba dentro del mismo rango general de exposiciones observado para los sujetos con la función renal normal. Azacitidina puede administrarse a pacientes con insuficiencia renal sin la necesidad de realizar un ajuste de la dosis inicial siempre que se monitorice la toxicidad en estos pacientes, puesto que azacitidina y/o sus metabolitos se excretan principalmente por el riñón.
Farmacogenómica
No se ha investigado formalmente el efecto de los polimorfismos conocidos de la citidina deaminasa sobre el metabolismo de azacitidina.
5.3 Datos preclínicos sobre seguridad
Azacitidina induce mutaciones de genes y aberraciones cromosómicas en sistemas bacterianos y de células de mamíferos in vitro. Se evaluó el potencial carcinogénico de azacitidina en ratones y ratas. Azacitidina indujo tumores del sistema hematopoyético en ratones hembra, cuando se administró por vía intraperitoneal, tres veces por semana, durante 52 semanas. En ratones tratados con azacitidina administrada por vía intraperitoneal, durante 50 semanas, se observó un aumento de la incidencia de tumores en el sistema linforreticular, los pulmones, las glándulas mamarias y la piel. Un estudio de tumorigenicidad en ratas reveló un aumento de la incidencia de tumores testiculares.
Estudios de embriotoxicidad precoz en ratones revelaron una frecuencia del 44 % de muerte embrionaria intrauterina (aumento de la resorción), después de una inyección única, por vía intraperitoneal, de azacitidina durante la organogénesis. Se detectaron anomalías del desarrollo del cerebro en ratones que recibieron azacitidina durante o antes del cierre del paladar duro. En ratas, azacitidina no causó ninguna reacción adversa cuando se administró antes de la implantación; sin embargo, fue claramente embriotóxica cuando se administró durante la organogénesis. Entre las anomalías fetales durante la organogénesis en ratas se encuentran las siguientes: anomalías del sistema nervioso central (exencefalia/encefalocele), anomalías de las extremidades (micromelia, pie zambo, sindactilia, oligodactilia) y otras (microftalmia, micrognatia, gastrosquisis, edema y anomalías de las costillas).
La administración de azacitidina a ratones macho antes del apareamiento con ratones hembra no tratadas produjo una disminución de la fecundidad y la pérdida de la progenie durante el desarrollo embrionario y posnatal posterior. El tratamiento de ratas macho produjo una disminución del peso de los testículos y de los epidídimos, disminución de los recuentos de espermatozoides, disminución de las tasas de preñez, aumento de embriones anormales y aumento de la pérdida de embriones en hembras apareadas (ver sección 4.4).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes Manitol (E421)
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
Vial de polvo sin abrir:
4 años.
Después de la reconstitución:
Cuando Vidaza se reconstituye con agua para preparaciones inyectables no refrigerada, se ha demostrado la estabilidad química y física, en uso, del medicamento reconstituido, a 25 °C, durante 45 minutos, y a una temperatura entre 2 °C y 8 °C, durante 8 horas.
El periodo de validez del medicamento reconstituido puede prolongarse reconstituyéndolo con agua para preparaciones inyectables refrigerada (entre 2 °C y 8 °C). Cuando Vidaza se reconstituye con agua para preparaciones inyectables refrigerada (entre 2 °C y 8 °C), se ha demostrado la estabilidad química y física, en uso, del medicamento reconstituido, a una temperatura entre 2 °C y 8 °C durante 22 horas.
Desde un punto de vista microbiológico, el producto reconstituido debe utilizarse inmediatamente. Si no se utiliza inmediatamente, los tiempos y las condiciones de conservación en uso antes de su empleo son responsabilidad del usuario y no deben ser superiores a 8 horas a una temperatura entre 2 °C y 8 °C cuando se reconstituye con agua para preparaciones inyectables no refrigerada, o no superiores a 22 horas cuando se reconstituye con agua para preparaciones inyectables refrigerada (entre 2 °C y 8 °C).
6.4 Precauciones especiales de conservación
Viales sin abrir
No requiere condiciones especiales de conservación.
Suspensión reconstituida
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de vidrio de tipo I, incoloro, sellado con tapón de cierre butil elastómero y precinto de aluminio con botón de plástico de polipropileno, que contiene 100 mg de azacitidina.
Tamaño del envase: 1 vial.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Recomendaciones para una manipulación segura
Vidaza es un medicamento citotóxico y, al igual que con otros compuestos potencialmente tóxicos, debe tenerse precaución al manipular y preparar suspensiones de azacitidina. Deben aplicarse los procedimientos para la manipulación y eliminación correctas de medicamentos contra el cáncer.
Si azacitidina reconstituida entra en contacto con la piel, la zona deberá lavarse inmediatamente y a fondo con agua y jabón. Si entra en contacto con membranas mucosas, debe lavarse a fondo con agua.
Procedimiento de reconstitución
Vidaza se debe reconstituir con agua para preparaciones inyectables. El periodo de validez del medicamento reconstituido puede prolongarse reconstituyéndolo con agua para preparaciones inyectables refrigerada (entre 2 °C y 8 °C). A continuación se facilita información sobre la conservación del medicamento reconstituido.
1. Deben montarse los siguientes elementos:
Vial/es de azacitidina; vial/es de agua para preparaciones inyectables; guantes quirúrgicos no estériles; toallitas humedecidas en alcohol; jeringas para inyección de 5 ml con agujas.
2. Deben extraerse 4 ml de agua para preparaciones inyectables en la jeringa, asegurándose de purgar el aire atrapado dentro de la jeringa.
3. La aguja de la jeringa que contiene los 4 ml de agua para preparaciones inyectables debe introducirse a través del tapón de goma del vial de azacitidina; a continuación, se inyecta en el vial el agua para preparaciones inyectables.
4. Después de extraer la jeringa y la aguja, el vial debe agitarse vigorosamente, hasta obtener una suspensión turbia uniforme. Después de la reconstitución, cada ml de suspensión contendrá 25 mg de azacitidina (100 mg/4 ml). El producto reconstituido es una suspensión turbia y homogénea, sin aglomerados. La suspensión debe desecharse si contiene partículas grandes o aglomerados. No filtrar la suspensión después de la reconstitución ya que esto podría eliminar el principio activo. Se debe tener en cuenta que algunos adaptadores, agujas para perfusión y sistemas cerrados contienen filtros; por lo tanto, no se deben utilizar dichos sistemas para la administración del medicamento después de la reconstitución.
5. El tapón de goma debe limpiarse y se introduce una jeringa nueva con una aguja en el vial. A continuación, el vial debe invertirse, asegurándose de que la punta de la aguja esté por debajo del nivel del líquido. Seguidamente, debe tirarse del émbolo hacia atrás para extraer la cantidad de medicamento necesaria para la dosis correcta, asegurándose de purgar el aire atrapado dentro de la jeringa. A continuación, debe extraerse del vial la jeringa con la aguja y la aguja debe desecharse.
6. Seguidamente, debe ajustarse firmemente a la jeringa una aguja subcutánea nueva (se recomienda el calibre 25) para inyectables. La aguja no debe purgarse antes de la inyección, a fin de reducir la incidencia de reacciones locales en el lugar de la inyección.
7. Si es necesario (dosis superiores a 100 mg), deben repetirse todos los pasos anteriores para la preparación de la suspensión. Para las dosis superiores a 100 mg (4 ml), la dosis debe dividirse en partes iguales, en dos jeringas (por ejemplo, dosis de 150 mg = 6 ml; dos jeringas con 3 ml en cada jeringa).
8. El contenido de la jeringa de dosificación debe volver a resuspenderse inmediatamente antes de la administración. Debe permitirse que la jeringa cargada con la suspensión reconstituida alcance una temperatura de aproximadamente 20 °C a 25 °C durante un tiempo máximo de
30 minutos antes de la administración. Si el tiempo transcurrido es superior a 30 minutos, la suspensión debe desecharse correctamente y debe prepararse una dosis nueva. Para volver a suspender, haga rodar vigorosamente la jeringa entre las palmas de las manos, hasta obtener una suspensión uniforme y turbia. La suspensión debe desecharse si contiene partículas grandes o aglomerados.
Conservación del medicamento reconstituido
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3
Cálculo de una dosis individual
La dosis total, según la superficie corporal (SC), puede calcularse de la siguiente manera:
Dosis total (mg) = dosis (mg/m2) x SC (m2)
La siguiente tabla se presenta sólo como un ejemplo para calcular dosis individuales de azacitidina, basadas en un valor promedio de SC de 1,8 m2.
|
Dosis, mg/m2 (% de la dosis inicial recomendada) |
Dosis total basada en un valor de SC de 1,8 m2 |
Número de viales necesarios |
Volumen total de suspensión reconstituida reauerida |
|
75 mg/m2 (100 %) |
135 mg |
2 viales |
5,4 ml |
|
37,5 mg/m2 (50 %) |
67,5 mg |
1 vial |
2,7 ml |
|
25 mg/m2 (33 %) |
45 mg |
1 vial |
1,8 ml |
Forma de administración
Vidaza reconstituido debe inyectarse por vía subcutánea (introduzca la aguja con un ángulo de 45 a 90°), con una aguja de calibre 25, en el brazo, el muslo o el abdomen.
Las dosis superiores a 4 ml deben inyectarse en dos lugares separados.
Los lugares de inyección deben someterse a rotación. Las nuevas inyecciones deben administrarse como mínimo a 2,5 cm de distancia del lugar anterior y nunca en zonas sensibles, con equimosis, enrojecidas o endurecidas.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Celgene Europe Ltd 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Reino Unido
8. NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/488/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN / RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 17 de diciembre de 2008 Fecha de la última renovación: 17 de diciembre de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa. eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricante(s) responsable(s) de la liberación de los lotes
Baxter Oncology GmbH Kantstrasse 2 33790 Halle/Westfalen Alemania
Celgene Europe Ltd 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Reino Unido
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de un hito importante (farmacovigilancia o minimización de riesgos)
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
zz
oavxanOxxa v
Vidaza 25 mg/ml polvo para suspensión inyectable Azacitidina
Cada vial contiene 100 mg de azacitidina. Después de la reconstitución, cada ml de la suspensión contiene 25 mg de azacitidina.
También contiene manitol.
Polvo para suspensión inyectable. 1 vial - 100 mg
Leer el prospecto antes de utilizar este medicamento.
Para un solo uso. Agite vigorosamente la suspensión antes de la administración. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Citotóxico
CAD
Leer el prospecto para el periodo de validez del medicamento reconstituido.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
La eliminación de cualquier producto no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Celgene Europe Ltd 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/488/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DEL VIAL
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Vidaza 25 mg/ml polvo para suspensión inyectable
Azacitidina
Vía subcutánea.
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
100 mg
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Vidaza 25 mg/ml polvo para suspensión inyectable
Azacitidina
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Vidaza y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Vidaza
3. Cómo usar Vidaza
4. Posibles efectos adversos
5 Conservación de Vidaza
6. Contenido del envase e información adicional
1. Qué es Vidaza y para qué se utiliza Qué es Vidaza
Vidaza es un agente anticancerígeno que pertenece a un grupo de medicamentos llamados “antimetabolitos”. Vidaza contiene el principio activo “azacitidina”.
Para qué se utiliza Vidaza
Vidaza se utiliza en adultos que no pueden recibir un trasplante de células madre para tratar:
• Síndromes mielodisplásicos (SMD) de mayor riesgo.
• Leucemia mielomonocítica crónica (LMMC).
• Leucemia mieloide aguda (LMA).
Estas enfermedades afectan a la médula ósea y pueden causar problemas en la producción normal de células de la sangre.
Cómo actúa Vidaza
Vidaza actúa impiendo el crecimiento de las células cancerosas. Azacitidina se incorpora al material genético de las células (ácido ribonucleico [ARN] y ácido desoxirribonucleico [ADN]). Se cree que actúa alterando la forma en que las células activan o desactivan los genes al interferir en la producción de nuevo ARN y DNA. Se cree que estas acciones corrigen los problemas de maduración y crecimiento de las células sanguíneas sanas en la médula ósea que causan los trastornos mielodisplásicos, y que matan las células cancerosas en la leucemia.
Consulte a médico o enfermero si tiene alguna pregunta acerca de cómo actúa Vidaza o por qué se le ha recetado este medicamento. 1
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Vidaza en los siguientes casos:
• Si tiene una disminución del recuento de plaquetas, glóbulos rojos o glóbulos blancos.
• Si tiene una enfermedad de los riñones.
• Si tiene una enfermedad del hígado.
• Si alguna vez ha tenido una enfermedad cardiaca o un infarto de miocardio, o tiene antecedentes de enfermedad pulmonar
Análisis de sangre
Antes de empezar el tratamiento con Vidaza y al inicio de cada periodo de tratamiento (llamado “ciclo”) le harán análisis de sangre. Esto se hace para comprobar que usted tiene una cantidad suficiente de células sanguíneas y que su hígado y riñones funcionan correctamente.
Niños y adolescentes
No se recomienda el uso de Vidaza en niños y adolescentes menores de 18 años.
Uso de Vidaza con otros medicamentos
Informe a su médico, farmacéutico o enfermero si está utilizando o ha utilizado recientemente cualquier otro medicamento. Esto se debe a que Vidaza puede afectar a la manera en que otros medicamentos actúan. Asimismo, otros medicamentos pueden afectar a la manera en que Vidaza actúa.
Embarazo
No debe usar Vidaza durante el embarazo porque puede ser perjudicial para el bebé.
Utilice un método anticonceptivo eficaz durante el tratamiento y hasta tres meses después del mismo. Informe inmediatamente a su médico si se queda embarazada durante el tratamiento.
Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Lactancia
Vidaza no debe utilizarse durante la lactancia. Se desconoce si este medicamento se excreta en la leche materna.
Fertilidad
Los varones no deben concebir un niño mientras reciben tratamiento con Vidaza. Utilice un método anticonceptivo eficaz durante el tratamiento y hasta tres meses después del tratamiento con este medicamento.
Consulte a su médico si desea preservar sus espermatozoides antes de que le administren este tratamiento.
Conducción y uso de máquinas
No conduzca ni utilice herramientas o máquinas si experimenta efectos adversos, tales como cansancio.
3. Cómo usar Vidaza
Antes de administrarle Vidaza, su médico le administrará otro medicamento para evitar las náuseas y los vómitos al principio de cada ciclo de tratamiento.
• La dosis recomendada es de 75 mg/m1 de superficie corporal. Su médico decidirá su dosis de
este medicamento dependiendo de su estado general, su estatura y su peso. Su médico controlará su progreso y, si es necesario, puede cambiarle la dosis.
• Vidaza se administra todos los días durante una semana, seguido de un periodo de reposo de tres semanas. Este “ciclo de tratamiento” se repetirá cada cuatro semanas. Usted recibirá, por lo general, al menos seis ciclos de tratamiento.
Un médico o enfermero le administrará este medicamento en forma de inyección debajo de la piel (vía subcutánea). Se puede administrar debajo de la piel del muslo, el abdomen o el brazo (por encima del codo).
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Informe inmediatamente a su médico si observa alguno de los siguientes efectos adversos:
• Somnolencia, temblores, ictericia, abotargamiento abdominal y facilidad para que salgan moratones. Pueden ser síntomas de insuficiencia hepática y pueden ser potencialmente mortal.
• Hinchazón de piernas y pies, dolor de espalda, disminución de la orina expulsada, aumento de la sed, pulso rápido, mareos y náuseas, vómitos o disminución del apetito y sensación de confusión, inquietud o fatiga. Pueden ser síntomas de insuficiencia renal y pueden ser potencialmente mortal.
• Fiebre. Podría deberse a una infección como consecuencia de tener cantidades bajas de glóbulos blancos, lo que puede ser potencialmente mortal.
• Dolor torácico o dificultad para respirar que puede acopañarse de fiebre. Puede deberse a una infección del pulmón conocida como “neumonía” y puede ser potencialmente mortal.
• Sangrado. Por ejemplo sangre en las heces, debido a un sangrado en el estómago o los intestinos, o sangrado en el interior de la cabeza. Estos pueden ser síntomas de tener niveles bajos de plaquetas en la sangre.
• Dificultad para respirar, hinchazón de los labios, picor o erupción cutánea. Pueden deberse a una reacción alérgica (hipersensibilidad).
Otros efectos adversos incluyen:
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
• Disminución del recuento de glóbulos rojos (anemia). Puede sentirse cansado y pálido.
• Disminución del recuento de glóbulos blancos. Puede acompañarse de fiebre. Usted tiene
también una mayor probabilidad de sufrir infecciones.
• Recuento bajo de plaquetas en la sangre (trombocitopenia). Usted es más propenso a las hemorragias y a los moratones.
• Estreñimiento, diarrea, náuseas, vómitos.
• Neumonía.
• Dolor en el pecho, dificultad para respirar.
• Cansancio (fatiga).
• Reacción en el lugar de la inyección, que incluye enrojecimiento, dolor o una reacción cutánea.
• Pérdida del apetito.
• Dolores de las articulaciones.
• Moratones.
• Erupción cutánea.
• Manchas rojas o moradas debajo de la piel.
• Dolor en el abdomen.
• Picor.
• Fiebre.
• Dolor de nariz y garganta.
• Mareos.
• Dolor de cabeza.
• Problemas para conciliar el sueño (insomnio).
• Hemorragia nasal (epistaxis).
• Dolores musculares.
• Debilidad (astenia).
• Pérdida de peso.
• Concentraciones bajas de potasio en la sangre.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas)
• Sangrado en el interior de la cabeza.
• Infección de la sangre causada por bacterias (sepsis). Puede deberse a cantidades bajas de glóbulos blancos en la sangre.
• Insuficiencia de médula ósea. Puede causar cantidades bajas de glóbulos rojos y blancos, y de plaquetas.
• Un tipo de anemia en la que hay disminución de los glóbulos rojos y blancos, y de las plaquetas.
• Infección de orina.
• Una infección vírica que causa lesiones de tipo herpes.
• Sangrado de las encías, sangrado del estómago o el intestino, sangrado en la zona inferior de la espalda debido a sangrado hemorroidal, sangrado en los ojos, sangrado debajo de la piel o dentro de la piel (hematoma).
• Sangre en la orina.
• Úlceras en la boca o la lengua.
• Cambios en la piel, en el lugar de la inyección. Éstos pueden ser hinchazón, un bulto duro, moratón, sangrado hacia la piel (hematoma), erupción cutánea, picor y cambios en el color de la piel.
• Enrojecimiento de la piel.
• Infección de la piel (celulitis).
• Infección de nariz y garganta, o dolor de garganta.
• Dolor o secreción abundante de la nariz o los senos (sinusitis).
• Presión arterial alta o baja (hipertensión o hipotensión).
• Dificultad para respirar cuando se mueve.
• Dolor en la garganta y la laringe.
• Indigestión.
• Somnolencia (letargo).
• Sensación de malestar.
• Ansiedad.
• Sensación de confusión.
• Pérdida de pelo.
• Insuficiencia renal.
• Deshidratación.
• Capa blanca que cubre la lengua, el interior de las mejillas y, a veces, el paladar, las encías y las
amígdalas (infección por hongos en la boca).
• Desmayo.
• Disminución de la tensión arterial al ponerse de pie (hipotensión ortostática) que produce mareos al ponerse de pie o sentarse.
• Sueño, modorra (somnolencia).
• Sangrado debido a la vía de un catéter.
• Una enfermedad que afecta al intestino que puede producir fiebre, vómitos y dolor de estómago (diverticulitis).
• Líquido alrededor de los pulmones (derrame pleural).
• Tiritera (escalofríos).
• Espasmos musculares.
• Erupción en la piel con picor (urticaria).
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
• Reacción alérgica (hipersensibilidad).
• Temblores.
• Insuficiencia hepática.
• Manchas dolorosas, grandes y abultadas, de color ciruela en la piel y fiebre.
• Úlceras dolorosas en la piel (pioderma gangrenoso).
Efectos adversos raros (pueden afectar hasta 1 de cada 1000 personas)
• Tos seca.
• Hinchazón sin dolor de las yemas de los dedos (dedos en palillos de tambor).
• Síndrome de lisis tumoral - se pueden producir complicaciones metabólicas durante el tratamiento del cáncer y algunas veces incluso sin tratamiento. Estas complicaciones se producen como consecuencia del producto de las células tumorales que mueren y pueden incluir: cambios en la bioquímica sanguínea, niveles altos de potasio, fósforo, ácido úrico y niveles bajos de calcio que, por tanto, generan cambios en la función renal y el ritmo cardiaco, crisis convulsivas y, algunas veces, la muerte.
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
• Infección de las capas profundas de la piel, que se extiende con rapidez dañando la piel y el tejido, lo que puede ser potencialmente mortal (fascitis necrosante).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero,
incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede
comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información
sobre la seguridad de este medicamento.
5. Conservación de Vidaza
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del vial y en la caja. La fecha de caducidad es el último día del mes que se indica.
Su médico, farmacéutico o enfermero es responsable de la conservación de Vidaza. También es responsable de la preparación y eliminación correctas del Vidaza que no se utilice.
Los viales sin abrir de este medicamento no requieren condiciones especiales de conservación.
Si se utiliza inmediatamente
La suspensión debe administrarse en un plazo de 45 minutos a partir de su preparación.
Si se utiliza posteriormente
Si la suspensión de Vidaza se prepara usando agua para preparaciones inyectables no refrigerada, la suspensión debe colocarse en la nevera (entre 2 °C y 8 °C) inmediatamente después de su preparación y debe mantenerse en la nevera durante 8 horas como máximo.
Si la suspensión de Vidaza se prepara usando agua para preparaciones inyectables refrigerada (entre 2 °C y 8 °C), la suspensión debe colocarse en la nevera (entre 2 °C y 8 °C) inmediatamente después de su preparación y debe mantenerse en la nevera durante 22 horas como máximo.
Debe permitirse que la suspensión alcance una temperatura ambiente de 20 °C a 25 °C antes de su administración.
La suspensión debe desecharse si contiene partículas grandes.
Contenido del envase e información adicional
6.
Composición de Vidaza
• El principio activo es azacitidina. Un vial contiene 100 mg de azacitidina. Después de la reconstitución con 4 ml de agua para preparaciones inyectables, la suspensión reconstituida contiene 25 mg/ml de azacitidina.
• El otro componente es manitol (E421).
Aspecto del producto y contenido del envase
Vidaza es un polvo blanco para suspensión inyectable y se entrega en un vial de vidrio que contiene 100 mg de azacitidina. Cada envase contiene un vial de Vidaza.
Titular de la autorización de comercialización y responsable de la fabricación
Celgene Europe Ltd 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Reino Unido O:
Titular de la autorización de comercialización
Celgene Europe Ltd 1 Longwalk Road Stockley Park Uxbridge UB11 1DB Reino Unido
Responsable de la fabricación
Baxter Oncology GmbH Kantstrasse 2 33790 Halle/Westfalen Alemania
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
Esta información está destinada únicamente a profesionales del sector sanitario:
Recomendaciones para una manipulación segura
Vidaza es un medicamento citotóxico y, al igual que con otros compuestos potencialmente tóxicos, debe tenerse precaución al manipular y preparar suspensiones de azacitidina. Deben aplicarse los procedimientos para la manipulación y eliminación correctas de medicamentos contra el cáncer.
Si azacitidina reconstituida entra en contacto con la piel, la zona deberá lavarse inmediatamente y a fondo con agua y jabón. Si entra en contacto con membranas mucosas, debe lavarse a fondo con agua.
Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos excepto los mencionados más adelante (ver “Procedimiento de reconstitución”).
Procedimiento de reconstitución
Vidaza se debe reconstituir con agua para preparaciones inyectables. El periodo de validez del medicamento reconstituido puede prolongarse reconstituyéndolo con agua para preparaciones inyectables refrigerada (entre 2 °C y 8 °C). A continuación se facilita información sobre la conservación del medicamento reconstituido.
1. Deben montarse los siguientes elementos:
Vial/es de azacitidina; vial/es de agua para preparaciones inyectables; guantes quirúrgicos no estériles; toallitas humedecidas en alcohol; jeringas para inyección de 5 ml con agujas.
2. Deben extraerse 4 ml de agua para preparaciones inyectables en la jeringa, asegurándose de purgar el aire atrapado dentro de la jeringa.
3. La aguja de la jeringa que contiene los 4 ml de agua para preparaciones inyectables debe introducirse a través del tapón de goma del vial de azacitidina; a continuación, se inyecta en el vial el agua para preparaciones inyectables.
4. Después de extraer la jeringa y la aguja, el vial debe agitarse vigorosamente, hasta obtener una suspensión turbia uniforme. Después de la reconstitución, cada ml de suspensión contendrá 25 mg de azacitidina (100 mg/4 ml). El producto reconstituido es una suspensión turbia y homogénea, sin aglomerados. La suspensión debe desecharse si contiene partículas grandes o aglomerados. No filtrar la suspensión después de la reconstitución ya que esto podría eliminar el principio activo. Se debe tener en cuenta que algunos adaptadores, agujas para perfusión y sistemas cerrados contienen filtros; por lo tanto, no deben utilizarse dichos sistemas para la administración del medicamento después de la reconstitución.
5. El tapón de goma debe limpiarse y se introduce una jeringa nueva con una aguja en el vial. A continuación, el vial debe invertirse, asegurándose de que la punta de la aguja esté por debajo del nivel del líquido. Seguidamente, debe tirarse del émbolo hacia atrás para extraer la cantidad de medicamento necesaria para la dosis correcta, asegurándose de purgar el aire atrapado dentro de la jeringa. A continuación, debe extraerse del vial la jeringa con la aguja y la aguja debe desecharse.
6. Seguidamente, debe ajustarse firmemente a la jeringa una aguja subcutánea nueva (se recomienda el calibre 25) para inyectables. La aguja no debe purgarse antes de la inyección, a fin de reducir la incidencia de reacciones locales en el lugar de la inyección.
7. Si es necesario (dosis superiores a 100 mg), deben repetirse todos los pasos anteriores para la preparación de la suspensión. Para las dosis superiores a 100 mg (4 ml), la dosis debe dividirse en partes iguales, en dos jeringas (por ejemplo, dosis de 150 mg = 6 ml; dos jeringas con 3 ml en cada jeringa).
8. El contenido de la jeringa de dosificación debe volver a resuspenderse inmediatamente antes de la administración. La temperatura de la suspensión en el momento de la inyección debe ser de aproximadamente 20 °C a 25 °C. Para volver a suspender, haga rodar vigorosamente la jeringa entre las palmas de las manos, hasta obtener una suspensión uniforme y turbia. La suspensión debe desecharse si contiene partículas grandes o aglomerados.
Conservación del medicamento reconstituido
Para uso inmediato
La suspensión de Vidaza puede prepararse inmediatamente antes de su uso y la suspensión reconstituida debe administrarse en los siguientes 45 minutos. Si el tiempo transcurrido es superior a 45 minutos, la suspensión reconstituida debe desecharse correctamente y debe prepararse una dosis nueva.
Para uso _posterior
Cuando se reconstituye con agua para preparaciones inyectables no refrigerada, la suspensión reconstituida debe colocarse en una nevera (temperatura entre 2 °C y 8 °C) inmediatamente después de la reconstitución, y debe mantenerse en la nevera durante 8 horas como máximo. Si el tiempo transcurrido en la nevera es superior a 8 horas, la suspensión debe desecharse correctamente y debe prepararse una dosis nueva.
Cuando se reconstituye con agua para preparaciones inyectables refrigerada (entre 2 °C y 8 °C), la suspensión reconstituida debe colocarse en una nevera (entre 2 °C y 8 °C) inmediatamente después de la reconstitución, y debe mantenerse en la nevera durante 22 horas como máximo. Si el tiempo transcurrido en la nevera es superior a 22 horas, la suspensión debe desecharse correctamente y debe prepararse una dosis nueva.
Debe permitirse que la jeringa cargada con la suspensión reconstituida alcance una temperatura de aproximadamente 20 °C a 25 °C durante un tiempo máximo de 30 minutos antes de la administración. Si el tiempo transcurrido es superior a 30 minutos, la suspensión debe desecharse correctamente y debe prepararse una dosis nueva.
Cálculo de una dosis individual
La dosis total, según la superficie corporal (SC), puede calcularse de la siguiente manera:
Dosis total (mg) = dosis (mg/m2) x SC (m2)
La siguiente tabla se presenta sólo como un ejemplo para calcular dosis individuales de azacitidina, basadas en un valor promedio de SC de 1,8 m2.
|
Dosis, mg/m2 (% de la dosis inicial |
Dosis total basada en un valor de SC de 1,8 m2 |
Número de viales necesarios |
Volumen total de suspensión reconstituida reauerida |
|
recomendada) | |||
|
75 mg/m2 (100 %) |
135 mg |
2 viales |
5,4 ml |
|
37,5 mg/m2 (50 %) |
67,5 mg |
1 vial |
2,7 ml |
|
25 mg/m2 (33 %) |
45 mg |
1 vial |
1,8 ml |
Forma de administración
No filtrar la suspensión después de la reconstitución.
Vidaza reconstituido debe inyectarse por vía subcutánea (introduzca la aguja con un ángulo de 45 a 90°), con una aguja de calibre 25, en el brazo, el muslo o el abdomen.
Las dosis superiores a 4 ml deben inyectarse en dos lugares separados.
Los lugares de inyección deben someterse a rotación. Las nuevas inyecciones deben administrarse como mínimo a 2,5 cm de distancia del lugar anterior y nunca en zonas sensibles, con equimosis, enrojecidas o endurecidas.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
35
Qué necesita saber antes de empezar a usar Vidaza No use Vidaza
• Si es alérgico a azacitidina o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
• Si padece cáncer avanzado del hígado.
• Durante el periodo de lactancia.