Vejicur Polvo Y Disolvente Para Suspension Intravesical
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Vejicur, polvo y disolvente para suspensión intravesical.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Su reconstitución un vial contiene:
BCG (bacilo de Calmette-Guérin) cepa RIVM derivada de la cepa 1173-P2
..........................................................................................................2 x 108 a 3 x 109 unidades viables
Para la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para suspensión intravesical
Polvo blanco y solución transparente incolora
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento del carcinoma urotelial no invasivo de vejiga:
• Tratamiento curativo del carcinoma in situ
• Tratamiento profiláctico de la recidiva de:
- Carcinoma urotelial limitado a la mucosa.
- Ta G1-G2 si el tumor es multifocal y/o recurrente
- Ta G3
- Carcinoma urotelial que infiltra la lamina propia pero no la muscular de la vejiga (T1)
- Carcinoma in situ
4.2 Posología y forma de administración
Dosis
El contenido de un vial es necesario para una instilación vesical. En la sección 6.6 se dan instrucciones para la reconstitución.
Duración Carcinoma in situ
Un esquema de tratamiento estándar consiste en una instilación intravesical de Vejicur por semana durante seis semanas consecutivas como terapia de inducción. El tratamiento con BCG no debe iniciarse hasta 2-3 semanas después de la resección transuretral (RTU). Después de un intervalo de 4 semanas sin tratamiento, la administración intravesical debe continuar siguiendo la pauta de mantenimiento durante al menos un año. Los esquemas de tratamiento de mantenimiento se describen a continuación.
Terapia de inducción (tratamiento profiláctico de las recidivas)
El tratamiento con BCG debe iniciarse aproximadamente 2-3 semanas después de la resección transuretral (RTU) o de la biopsia de vejiga, y sin cateterización traumática, repitiéndose a intervalos semanales durante 6 semanas. En los tumores de riesgo intermedio y alto, debe ir seguido de tratamiento de mantenimiento.
Terapia de mantenimiento
Un esquema de mantenimiento consiste en un tratamiento durante 12 meses con administración del medicamento a intervalos mensuales. Otro esquema de mantenimiento consiste en 3 instilaciones a intervalos semanales en los meses 3, 6, 12, 18, 24, 30 y 36. En este esquema, se administran un total de 27 instilaciones durante un período de tres años.
Los esquemas de tratamiento especificados con distintas cepas de BCG han sido probados en estudios clínicos realizados en un elevado número de pacientes. En la actualidad no es posible afirmar si uno u otro de estos regímenes es superior a los demás.
Administración
Vejicur debe administrase en las condiciones requeridas para endoscopia intravesical.
El paciente no debe beber nada durante el período comprendido entre las 4 horas anteriores a la instilación y las 2 horas posteriores a la misma. Antes de la instilación de BCG debe vaciarse la vejiga. Vejicur se introduce en la vejiga a baja presión por medio de un catéter. La suspensión de Vejicur instilada debe permanecer en la vejiga durante un período de 2 horas si es posible. Durante este período, la suspensión debe mantener el contacto suficiente con toda la superficie mucosa de la vejiga. Por tanto, el paciente debe ser movilizado lo más posible. Después de 2 horas, el paciente debe orinar para eliminar la suspensión instilada, preferiblemente en posición sentada.
En caso de ausencia de una contraindicación médica específica, se recomienda la hiperhidratación del paciente durante las 48 horas siguientes a cada instilación.
Vejicur no debe utilizarse en niños, puesto que no se ha establecido su seguridad ni su eficacia.
No hay instrucciones especiales para el uso en personas de edad avanzada.
4.3 Contraindicaciones
Hipersensibilidad a cualquiera de los componentes
Vejicur no debe utilizarse en pacientes inmunodeprimidos o personas con deficiencias inmunológicas congénitas o adquiridas, ya sea debido a una enfermedad concurrente (p. ej., serología positiva para HIV, leucemia, linfoma), a terapia oncológica (p. ej., medicamentos citostáticos, radiación) o a terapia inmunosupresora (p. ej., corticoesteroides).
Vejicur no debe administrarse a personas con tuberculosis activa. La tuberculosis activa debe descartarse mediante una anamnesis adecuada y, en caso de estar indicado, mediante pruebas diagnósticas de conformidad con las directrices locales.
Antecedentes de radioterapia vesical
El tratamiento con Vejicur está contraindicado en mujeres durante la lactancia (ver sección 4.6).
Vejicur no debe instilarse antes de 2 ó 3 semanas después de una RTU, una biopsia de vejiga o un cateterismo traumático.
Perforación de la vejiga (ver sección 4.4)
Infección aguda de las vías urinarias (ver sección 4.4)
4.4 Advertencias y precauciones especiales de empleo
Vejicur no puede utilizarse para administración subcutánea, intradérmica, intramuscular o intravenosa, ni para vacunación.
Tratamiento de síntomas, signos o síndromes.
Ver sección 4.8.
Número de instilaciones de BCG
Los efectos secundarios del tratamiento con BCG son frecuentes, pero generalmente leves y transitorios. Las reacciones adversas suelen aumentar con el número de instilaciones de BCG.
Infección/reacción sistémica grave por BCG
Los informes sobre infecciones/reacciones sistémicas al BCG son raros y se describen como fiebre >39,5°C durante al menos 12 horas, fiebre >38,5°C durante al menos 48 horas, neumonía miliar, hepatitis granulomatosa, alteraciones en las pruebas de función hepática, disfunción orgánica (distinta a la del aparato genitourinario) con inflamación granulomatosa en la biopsia, síndrome de Reiter.
La posibilidad de infecciones sistémicas graves por BCG debe ser considerada antes de iniciar el tratamiento.
La instilación traumática puede promover episodios de sepsis por BCG con posible shock séptico y muertes potenciales.
Antes de cada instilación vesical con BCG debe excluirse la infección de las vías urinarias (la inflamación de la membrana mucosa vesical puede aumentar el riesgo de diseminación hematológica del BCG). Si se diagnostica una infección de las vías urinarias durante la terapia con BCG, ésta debe interrumpirse hasta que el análisis de orina se haya normalizado y el tratamiento con antibióticos haya terminado.
La infección de implantes e injertos ha sido descrita en pacientes con p. ej., aneurisma o prótesis.
Persistencia de BCG
Se han descrito casos individuales en los que han permanecido bacterias BCG en las vías urinarias durante más de 16 meses.
Fiebre o hematuria intensa
El tratamiento debe posponerse hasta la resolución de la fiebre concurrente o la hematuria intensa.
Baja capacidad vesical
El riesgo de contractura vesical puede aumentar en pacientes con baja capacidad vesical.
HLA-B27
Los pacientes con HLA-B27 positivo pueden sufrir un aumento de la incidencia de artritis reactiva o de síndrome de Reiter.
Precauciones para la manipulación
Vejicur no debe manipularse ni en la misma habitación, ni por el mismo personal que prepara medicamentos citotóxicos para administración intravenosa. Vejicur no debe ser manipulado por una persona que presente una inmunodeficiencia conocida. Debe evitarse el contacto de Vejicur con la piel y las mucosas. La contaminación puede dar lugar a una reacción de hipersensibilidad o a infección de la zona afectada.
Pacientes con inmunodeficiencia
Los pacientes con inmunodeficiencia conocida deben evitar el contacto con pacientes sometidos a tratamiento con BCG.
Pruebas cutáneas con tuberculina
El tratamiento intravesical con Vejicur podría inducir sensibilidad a la tuberculina y complicar la posterior interpretación de la prueba cutánea de la tuberculina para el diagnóstico de infecciones micobacterianas. Por tanto, la reactividad a la tuberculina podría realizarse antes de la administración de Vejicur.
Embarazo
Vejicur no se recomienda durante el embarazo (ver sección 4.6)
Transmisión sexual
Hasta el momento, no se ha descrito la transmisión sexual del BCG, pero se recomienda usar preservativo durante las relaciones sexuales mantenidas en la semana siguiente al tratamiento con BCG.
Higiene general
Se recomienda lavarse las manos y la zona de los genitales después de orinar. Esto es especialmente aplicable en las primeras micciones tras la instilación de BCG. Si las lesiones cutáneas se contaminan, se recomienda el uso de un desinfectante adecuado.
Derramamiento de Vejicur
El derramamiento de la suspensión de Vejicur debe tratarse con un desinfectante con actividad demostrada frente a micobacterias. Si se derrama sobre la piel, debe tratarse con un desinfectante adecuado.
4.5 Interacción con otros medicamentos y otras formas de interacción
Las bacterias BCG son sensibles a los fármacos antituberculosos (p. ej., etambutol, estreptomicina, ácido p-aminosalicílico (PAS), isoniazida (INH) y rifampicina), a los antibióticos, a los antisépticos y a los lubricantes. Se han descrito resistencias frente a la pirazinamida y la cicloserina.
Durante el tratamiento mediante instilación vesical de BCG, debe evitarse la administración concomitante de agentes antituberculosos y antibióticos como fluoroquinolonas, doxiciclina o gentamicina, debido a la sensibilidad del BCG a dichos medicamentos.
4.6 Fertilidad, embarazo y lactancia
Embarazo (ver sección 4.4)
No hay datos específicos sobre el uso de Vejicur en mujeres embarazadas. No se han realizado estudios sobre reproducción animal. Vejicur no se recomienda durante el embarazo.
Lactancia
¡m
No hay datos adecuados sobre la excreción de esta bacteria en la leche materna. Este tratamiento está contraindicado en mujeres en período de lactancia (ver sección 4.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Síntomas locales o sistémicos durante el tratamiento con Vejicur podrían afectar a la capacidad para conducir o utilizar maquinaria.
4.8 Reacciones adversas
Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada frecuencia.
|
Clasificación de órganos del sistema |
Frecuencia y reacción adversa |
|
Infecciones e infestaciones |
Muy frecuentes (>1/10): Cistitis y reacciones inflamatorias (granulomatosas) de la vejiga Poco frecuentes (>1/1.000, <1/100): Infección de las vías urinarias, orquitis, infección/reacción sistémica grave al BCG, sepsis por BCG, neumonitis miliar, absceso cutáneo, síndrome de Reiter (conjuntivitis, oligoartritis asimétrica y cistitis) Raras (>1/10.000, <1/1.000): Infección vascular (p. ej.: aneurisma infectado), absceso renal Muy raras (<1/10.000): Infección por BCG de los implantes y tejidos adyacentes (p. ej.: infección del injerto aórtico, desfibrilador cardiaco, artroplastia de cadera o rodilla), linfadenitis cervical, infección localizada de ganglios linfáticos, osteomielitis, infección de la médula ósea, absceso de psoas, infección del glande, orquitis o epididimitis resistente a la terapia antituberculosa |
|
Trastornos de la sangre y del sistema linfático |
Poco frecuentes (>1/1.000, <1/100): Citopenia, anemia |
|
Trastornos del sistema inmunológico |
Muy frecuentes (>1/10): Reacción sistémica transitoria al BCG (fiebre <38,5 C, malestar general, síntomas pseudogripales que incluyen malestar, fiebre, escalofríos) Muy raras (<1/10.000): Reacción de hipersensibilidad (p. ej.: edema palpebral, tos) |
|
Trastornos oculares |
Muy raras (<1/10.000): Coriorretinitis, conjuntivitis, uveítis |
|
Trastornos vasculares |
Muy raras (<1/10.000): Fístula vascular |
|
Trastornos respiratorios, torácicos y mediastínicos |
Poco frecuentes (>1/1.000, <1/100): Granuloma pulmonar |
|
Trastornos gastrointestinales |
Muy frecuentes (>1/10): Náuseas Muy raras (<1/10.000): |
|
Clasificación de órganos del sistema |
Frecuencia y reacción adversa |
|
Vómitos, fístula intestinal, peritonitis | |
|
Trastornos hepatobiliares |
Poco frecuentes (>1/1.000, <1/100): Hepatitis |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes (>1/1.000, <1/100): Erupción |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes (>1/1.000, <1/100): Artritis, artralgia |
|
Trastornos renales y urinarios |
Muy frecuentes (>1/10): Frecuencia miccional con molestias y dolor Poco frecuentes (>1/1.000, <1/100): Hematuria macroscópica, retracción vesical, obstrucción urinaria, contractura vesical |
|
Trastornos del aparato reproductor y de la mama |
Muy frecuentes (>1/10): Prostatitis granulomatosa asintomática Poco frecuentes (>1/1.000, <1/100): Epididimitis, prostatitis granulomatosa sintomática Frecuencia no conocida (no puede estimarse a partir de los datos |
|
disponibles): trastornos genitales (p. ej.: dolor vaginal, dispareunia) | |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes (>1/100, <1/10): Fiebre >38,5 C Poco frecuentes (>1/1.000, <1/100): Hipotensión |
Las reacciones adversas al tratamiento con BCG son frecuentes, pero generalmente leves y transitorias. Las reacciones adversas suelen aumentar con el número de instilaciones de BCG.
En casos raros, pueden producirse artritis/artralgias y erupciones cutáneas. En la mayoría de los casos de artritis, artralgias y erupción cutánea, éstas pueden atribuirse a reacciones de hipersensibilidad del paciente al BCG. Puede ser necesario en algunos casos interrumpir la administración de Vejicur.
Reacciones adversas locales:
Se producen molestias y dolor a la micción, así como frecuencia miccional hasta en el 90% de los pacientes. La cistitis y la reacción inflamatoria (granulomas) pueden ser una parte esencial de la actividad antitumoral.
Otras reacciones adversas locales que se observan con poca frecuencia son: hematuria macroscópica, infección de las vías urinarias, retracción vesical, obstrucción urinaria, contractura vesical, prostatitis granulomatosa sintomática, orquitis y epididimitis. Rara vez se observan abscesos renales. Con una frecuencia no conocida pueden producirse trastornos genitales (p. ej.: dolor vaginal, dispareunia).
Reacción sistémica transitoria al BCG:
Pueden producirse febrícula, síntomas pseudogripales y malestar general. Estos síntomas suelen remitir en 24-48 horas y deben tratarse mediante tratamiento sintomático habitual. Estas reacciones son signos del inicio de una reacción inmunitaria. Todos los pacientes a los que se administre el medicamento han de ser
vigilados estrechamente, y se les debe aconsejar que comuniquen todas las incidencias de fiebre y otros episodios no relacionados con las vías urinarias.
Infecciones/reacciones adversas sistémicas graves:
Las infecciones/reacciones adversas sistémicas se definen como: fiebre >39,5°C durante al menos 12 horas, fiebre >38,5°C durante al menos 48 horas, neumonía miliar producida por BCG, hepatitis granulomatosa, pruebas de la función hepática anormales, disfunción orgánica (distinta a la del aparato genitourinario) con inflamación granulomatosa en la biopsia, síndrome de Reiter. Las infecciones/reacciones sistémicas graves al BCG pueden dar lugar a sepsis por BCG que puede poner en peligro la vida.
Recomendaciones sobre el tratamiento, véase la tabla a continuación.
|
Tratamiento de síntomas, de signos y del síndrome | |
|
Síntomas, signos o síndrome |
Tratamiento |
|
1) Síntomas de irritación vesical de duración inferior a 48 horas |
Tratamiento sintomático |
|
2) Síntomas de irritación vesical de 48 horas de duración o superior. |
Interrumpir el tratamiento con Vejicur e iniciar tratamiento con quinolonas. Si después de 10 días no se ha observado la resolución completa, administrar isoniazida (INH)* durante 3 meses. En caso de tratamiento antituberculoso, el tratamiento con Vejicur deberá suspenderse definitivamente. |
|
3) Infección bacteriana concomitante en las vías urinarias. |
Posponer el tratamiento con Vejicur hasta que el análisis de orina sea normal y haya concluido el tratamiento con antibióticos. |
|
4) Otras reacciones adversas genitourinarias: prostatitis granulomatosa sintomática, epididimitis y orquitis, obstrucción uretral y absceso renal. |
Interrumpir el tratamiento con Vejicur. Administrar isoniazida (INH)* y rifampicina*, durante 3-6 meses según la gravedad. |
|
En caso de tratamiento antituberculoso, el tratamiento con Vejicur deberá suspenderse definitivamente. | |
|
5) Fiebre inferior a 38,5°C de duración inferior a 48 horas. |
Tratamiento sintomático con paracetamol. |
|
6) Erupción cutánea, artralgias o artritis, o síndrome de Reiter |
Suspender el tratamiento con Vejicur. Administrar antihistamínicos o antiinflamatorios no esteroideos. Si no hay respuesta, administrar isoniazida* durante 3 meses. |
|
En caso de tratamiento antituberculoso, el tratamiento con Vejicur deberá suspenderse definitivamente. | |
|
7) Reacción/infección sistémica** al BCG sin |
Suspender definitivamente el |
|
Tratamiento de síntomas, de signos y del síndrome | |
|
Síntomas, signos o síndrome |
Tratamiento |
|
signos de shock séptico ** ver definición de reacción sistémica al BCG |
tratamiento con Vejicur. Valorar consultar con un especialista en enfermedades infecciosas. Administrar tratamiento antituberculoso con tres fármacos* durante 6 meses. |
|
8) Reacción/infección sistémica al BCG con signos de shock séptico |
Suspender definitivamente el tratamiento con Vejicur. Administrar inmediatamente tratamiento antituberculoso* con 3 fármacos combinado con corticoesteroides de acción rápida a altas dosis. Consultar con un especialista en enfermedades infecciosas. |
* Precaución: Las bacterias BCG son sensibles a todos los medicamentos antituberculosos, actualmente utilizados, excepto a pirazinamida. Si es necesario un tratamiento antituberculoso con 3 fármacos, la combinación generalmente recomendada es isoniazida (INH), rifampicina y etambutol.
Notificación de sospechas de reaciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
Es improbable que se produzca una sobredosis, ya que un vial de Vejicur corresponde a una dosis.
No hay datos que indiquen que una sobredosis pueda producir otros síntomas distintos a las reacciones adversas descritas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agente inmunoestimulante Código ATC: L03AX03
Vejicur es una suspensión liofilizada de bacterias vivas del bacilo de Calmette-Guérin derivadas de Mycobacterium bovis, cepa RIVM.
Vejicur estimula el sistema inmunológico y tiene actividad antitumoral.
Datos procedentes de estudios señalan que BCG actúa como inmunopotenciador inespecífico, no mediante un solo mecanismo, sino por diversas acciones en las que intervienen células del sistema inmunológico. El BCG tiene un efecto estimulante sobre el bazo, potencia la función de los macrófagos en el bazo y activa las células asesinas naturales. La instilación de BCG estimula el aumento de granulocitos,
monocitos/macrófagos y linfocitos T, lo que indica activación local del sistema inmunológico. También aumentan las citoquinas IL-1, IL-2 e IL-6 y el TNFa.
5.2 Propiedades farmacocinéticas
La mayoría de los bacilos se excretan en la orina en las primeras horas siguientes a la instilación. Todavía se desconoce si las micobacterias pueden ser capaces de atravesar la pared urotelial intacta. Se han descrito casos individuales en los que han permanecido bacterias BCG en las vías urinarias durante más de 16 meses (ver sección 4.4).
5.3 Datos preclínicos sobre seguridad
El BCG, cepa RIVM, fue estudiado para determinar su toxicidad, propiedades inmunoestimulantes y actividad antitumoral en varios tipos de animales. Se ha observado que dosis altas de BCG produjeron retraso en la ganancia de peso y alteraciones hepáticas en ratones. La inyección intravenosa en conejos demostró efectos pirógenos. Instilaciones repetidas en cobayas produjeron reacciones inflamatorias en la pared vesical. A altas dosis, se observaron lesiones granulomatosas en hígado y pulmón como efectos secundarios no deseados. La aplicación intravesical en perros demostró lesiones mecánicas mínimas en urotelio, mientras que no se observaron signos de inflamación activa en el estroma suburotelial.
No se han realizado estudios de mutagenicidad, carcinogenicidad ni de reproducción.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo: poligelina, glucosa anhidra y polisorbato 80.
Disolvente: cloruro sódico y agua para inyectables.
6.2 Incompatibilidades
Vejicur es incompatible con soluciones hipotónicas e hipertónicas.
6.3 Periodo de validez
2 ó 3 años cuando el número de unidades viables a la liberación sea superior a 5 x 108 unidades formadoras de colonia/vial, en ningún caso superando los 4 años desde la fecha de obtención.
Después de la reconstitución, el producto debe utilizarse inmediatamente.
6.4 Precauciones especiales de conservación
Conservar en nevera (2°C - 8°C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Para las condiciones de conservación del medicamento reconstituido, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Polvo en vial (vidrio tipo I) con tapón de caucho + 50 ml de disolvente en una bolsa (PVC) con pieza conectora y catéter adaptador (adaptador cónico o adaptador Luer-Lock).
Tamaños de envases (adaptador cónico): 1, 3, 5 y 6 con/sin catéter.
Tamaños de envases (adaptador Luer-Lock): 1 y 3 con/sin catéter.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Instrucciones de uso/manipulación
Antes de usar el producto, tiene que resuspenderse en condiciones asépticas con solución estéril de cloruro sódico al 0,9 % (véase más adelante). Reconstituir la suspensión antes de su uso girándola suavemente. Evitar el contacto de la piel con Vejicur. Se recomienda el uso de guantes.
Las partículas macroscópicas visibles no afectan a la eficacia ni a la seguridad del producto.
Seguir las instrucciones de manipulación siguientes para el sistema con adaptador Luer-Lock o cónico.
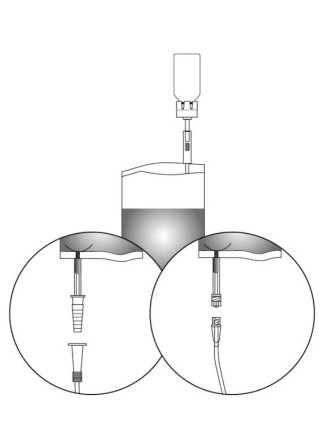
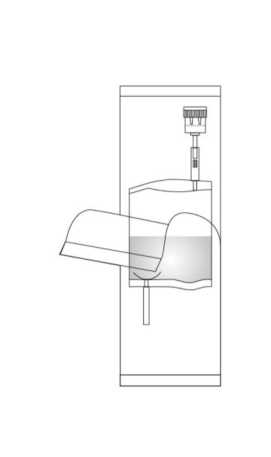
1. Separar la bolsa protectora, pero sin quitarla por completo. Así se protegerá la punta del sistema de instilación de la contaminación hasta el último momento.
3QB!
2. Quitar las tapas del vial y del sistema de instilación. Preparar una bolsa para desechables.
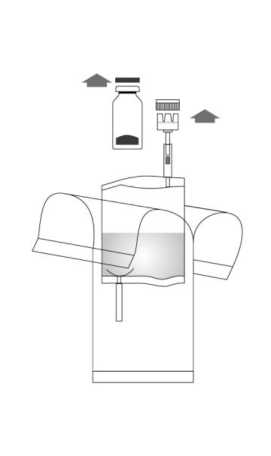
<jtj>
alga
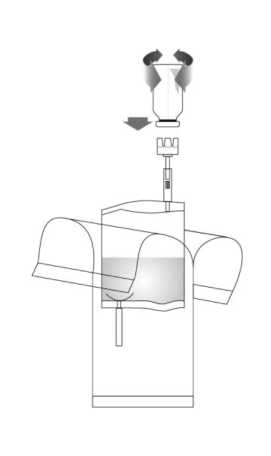
3. Presionar firmemente el vial de Vejicur en vertical sobre el adaptador del sistema de instilación. Girar el vial 3 ó 4 veces en ambos sentidos.
4. Romper el mecanismo del tubo del adaptador para abrirlo, doblándolo hacia ambos lados
repetidamente.- Con ello se establece la conexión. Durante este proceso se debe sujetar el tubo y no el vial.
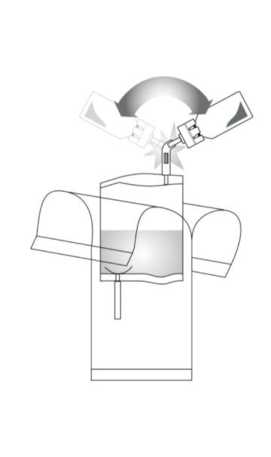
5. Bombear el líquido al vial. Asegúrese de no llenar totalmente el vial.
ÜE
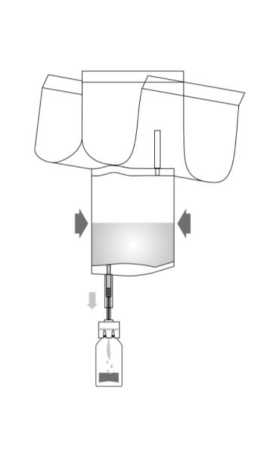
6. Invertir el sistema combinado; bombear aire al interior con el vial en la parte superior. Extraer la suspensión de BCG reconstituida al sistema de instilación. No retirar el vial.
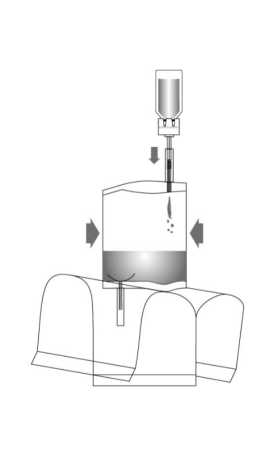
7. Mantener vertical el sistema de instilación. Retirar ahora completamente la bolsa protectora. Conectar el adaptador del catéter al catéter. Romper el mecanismo de cierre del tubo para abrirlo, doblándolo hacia ambos lados e instilar el fármaco. Al finalizar la instilación, liberar el catéter pasando aire a través de él. Mantener la bolsa de disolvente apretada y colocarla junto con el catéter en la bolsa para desechables.
ÜE
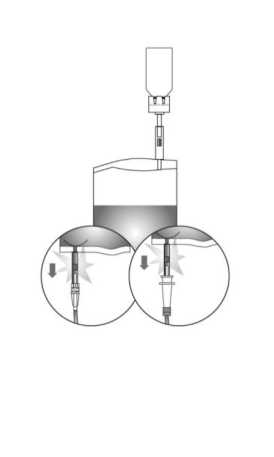
La eliminación de los productos no utilizados o de los envases se establecerá de acuerdo con las exigencias locales.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
medac
Gesellschaft für klinische Spezialpraparate mbH Theaterstr. 6 22880 Wedel Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
64.882
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 10.07.2002 Fecha de revalidación: 17.07.2006
10. FECHA DE LA REVISIÓN DEL TEXTO
05/2014
14 de 14 WINISTWIODE
SANIDAD, POLÍTICA SOCIALE IGUALDAD Agencia es parto» de medicamentos y Sfoouctos sarttanos