Varilrix 103,3 Ufp/0,5 Ml Polvo Y Disolvente Para Solución Inyectable
fila?
1. NOMBRE DEL MEDICAMENTO
Varilrix 103,3 UFP/0,5 ml polvo y disolvente para solución inyectable Vacuna antivaricela (virus vivos).
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Después de la reconstitución, 1 dosis (0,5 ml) contiene:
Virus vivos atenuados de la varicela-zóster (cepa Oka)1 no menos de 103,3 UFP2
Producidos en células diploides humanas (MRC-5)
2UFP = Unidades Formadoras de Placa
Excipiente con efecto conocido: contiene 6 mg de sorbitol (E-420) (ver sección 4.3).
Esta vacuna puede contener una cantidad residual de sulfato de neomicina, hasta un máximo de 25 microgramos/dosis (ver sección 4.3).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
El polvo es de color crema claro a amarillento o rosáceo y se presenta como una pastilla. El disolvente para la reconstitución es una solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Varilrix está indicada para la inmunización activa frente a la varicela en personas a partir de los 12 meses de edad (ver secciones 4.2 y 5.1).
Varilrix se puede administrar a niños a partir de los 9 meses de edad en circunstancias especiales, p.ej., para cumplir con los calendarios nacionales de vacunación o en situaciones de brote epidémico (ver secciones 4.2, 4.5 y 5.1).
En caso de profilaxis post-exposición al virus salvaje de la varicela-zóster o de una emergencia médica, se puede administrar una vacuna antivaricela viva atenuada (cepa Oka) dentro de los 3 días posteriores a la exposición a personas con historia negativa de varicela.
Varilrix está indicada para la inmunización activa frente a la varicela en pacientes con riesgo de varicela grave y sus contactos próximos sanos. Entre otros, se recomienda la vacunación en los siguientes casos:
Pacientes con leucemia aguda
Los pacientes leucémicos tienen especial riesgo de padecer una varicela grave y deben vacunarse si son seronegativos.
Cuando se vacunan pacientes durante la fase aguda de la leucemia, debe interrumpirse la quimioterapia de mantenimiento una semana antes y una semana después de la vacunación. Los pacientes sometidos a radioterapia no deberían vacunarse durante la fase de tratamiento.
an
Pacientes en tratamiento inmunosupresor
Los pacientes que reciben tratamiento inmunosupresor (incluida la terapia con corticoesteroides) para tumores sólidos malignos o enfermedades crónicas graves (tales como insuficiencia renal crónica, enfermedades autoinmunes, colagenosis, asma bronquial grave) están predispuestos a desarrollar una varicela grave.
En general debe vacunarse a los pacientes cuando están en remisión hematológica completa de la enfermedad. Es aconsejable que el recuento total de linfocitos no sea inferior a 1.200 por mm3, o no exista otra evidencia de deficiencia inmunitaria celular.
Pacientes con trasplante programado de órgano
En el caso de que se esté considerando un trasplante de órgano (p.ej., trasplante renal), la vacuna debe administrarse algunas semanas antes de la instauración del tratamiento inmunosupresor.
Pacientes con enfermedades crónicas
Otras enfermedades crónicas que puedan predisponer a una varicela grave, tales como enfermedades pulmonares crónicas y cardiovasculares, enfermedad cutánea diseminada y mucoviscidosis. Los niños en tratamiento crónico con salicilatos constituyen también un grupo de riesgo en el que el beneficio de la vacunación es superior al riesgo.
Contactos próximos sanos
Los contactos próximos sanos seronegativos de los pacientes que tienen riesgo de padecer una varicela grave deben vacunarse, para reducir el riesgo de transmisión del virus a los pacientes de alto riesgo.
Estos incluyen el personal sanitario en contacto con pacientes de alto riesgo.
Debe considerarse que la mayoría de los adultos con una historia incierta de varicela tienen anticuerpos frente al virus de la varicela-zóster. En principio, la administración de Varilrix a personas ya inmunes no ofrece beneficio adicional.
El uso de Varilrix debe estar basado en las recomendaciones oficiales.
4.2 Posología y forma de administración
Posología
Niños menores de 9 meses de edad
No se debe administrar Varilrix a niños menores de 9 meses de edad.
Niños entre 9 meses y 12 meses de edad
Los datos de los estudios realizados con Varilrix indican que, en los casos en los que la vacunación se inicie entre los 9 y 12 meses de edad, es necesaria una segunda dosis para garantizar una protección óptima frente a la varicela que debe ser administrada preferiblemente al menos 6 semanas después de la primera dosis. El intervalo entre dosis no debe ser inferior a 4 semanas bajo ninguna circunstancia (ver sección 5.1).
Niños entre 12 meses y 12 años de edad
Se deben administrar dos dosis de Varilrix para garantizar una protección óptima frente a la varicela (ver sección 5.1).
La segunda dosis se debe administrar preferiblemente al menos 6 semanas después de la primera dosis.
El intervalo entre dosis no debe ser inferior a 4 semanas bajo ninguna circunstancia.
Adolescentes a partir de los 13 años de edad y adultos Se deben administrar dos dosis de Varilrix.
La segunda dosis se debe administrar preferiblemente al menos 6 semanas después de la primera dosis.
El intervalo entre dosis no debe ser inferior a 4 semanas bajo ninguna circunstancia.
IBj an
No hay datos suficientes para determinar la eficacia protectora de la vacuna a largo plazo. Sin embargo, en la actualidad, no hay evidencias de que se requieran de forma sistemática dosis adicionales tras completar una pauta de dos dosis.
Ancianos
No se dispone de datos sobre la respuesta inmune a Varilrix en personas a partir de los 65 años de edad.
Pacientes inmunodeprimidos
Si es necesaria la administración de Varilrix a personas seronegativas antes de un periodo de inmunosupresión programada o posible en el futuro (como sucede con los pacientes en espera para un trasplante de órgano o pacientes con una enfermedad maligna en remisión), el momento de la vacunación debe tener en cuenta el tiempo que debe transcurrir desde la administración de la segunda dosis hasta el momento en que se espera alcanzar la máxima protección (ver también secciones 4.3,
4.4 y 5.1).
Intercambiabilidad
Se puede administrar una dosis de Varilrix a aquellas personas que ya hayan recibido una dosis de otra vacuna frente a la varicela.
Se puede administrar una dosis de Varilrix seguida de una dosis de otra vacuna frente a la varicela.
Forma de administración
Varilrix debe administrarse exclusivamente por vía subcutánea. El lugar preferible para la inyección es la parte superior del brazo (región tricipital).
Varilrix no debe administrarse por vía intravascular ni intradérmica.
Varilrix no debe mezclarse con otros medicamentos en la misma jeringa (ver también secciones 4.5 y 6.2).
Antes de administrar la vacuna se debe dejar evaporar el alcohol o cualquier otro antiséptico empleado sobre la piel, ya que podrían inactivar el virus vacunal.
Para consultar las instrucciones de reconstitución de la vacuna antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Varilrix está contraindicada en personas con historia de hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1 o a la neomicina o a cualquier otra vacuna antivaricela.
No obstante, una historia de dermatitis de contacto a la neomicina no constituye una contraindicación.
Varilrix está contraindicada durante el embarazo. Además, se debe evitar el embarazo durante 1 mes después de la vacunación (ver sección 4.6).
Varilrix está contraindicada durante la lactancia (ver sección 4.6).
Varilrix no debe administrarse a personas con inmunodeficiencia humoral o celular grave (primaria o adquirida), p.ej., inmunodeficiencia grave combinada, agammaglobulinemia y SIDA o infección por VIH sintomática, o con un porcentaje de linfocitos T CD4+ específicos de cada edad en niños menores de 12 meses: CD4+ <25%; niños entre 12-35 meses: CD4+ < 20%; niños entre 36-59 meses: CD4+
<15% (ver sección 4.4).
Varilrix contiene sorbitol. Los pacientes con intolerancia hereditaria a la fructosa no deben usar esta vacuna.
4.4 Advertencias y precauciones especiales de empleo
Sj
an
Como sucede con otras vacunas, se debe posponer la administración de Varilrix en personas que padezcan una enfermedad febril aguda y grave. En personas sanas la presencia de una infección leve no es una contraindicación para la vacunación.
Como sucede con todas las vacunas inyectables, debe existir una vigilancia médica y estar disponible un tratamiento en caso de cualquier reacción anafiláctica infrecuente tras la administración de la vacuna.
Después de cualquier vacunación, o incluso antes, se puede producir, especialmente en adolescentes, un síncope (desfallecimiento) como una reacción psicógena a la inyección de la aguja. Durante la recuperación, éste puede ir acompañado de varios signos neurológicos tales como déficit visual transitorio, parestesia y movimientos tónico clónicos en los miembros. Es importante que se disponga de procedimientos para evitar daños causados por las pérdidas de conocimiento.
Se puede considerar la vacunación en pacientes con determinadas inmunodeficiencias dónde los beneficios sobrepasan a los riesgos (p.ej., personas con VIH asintomáticas, deficiencias de subclases de IgG, neutropenia congénita, enfermedad granulomatosa crónica y enfermedades con déficit del complemento).
Los pacientes inmunocomprometidos que no tienen contraindicación para esta vacunación (ver secciones 4.1 y 4.3) pueden no responder tan bien como los individuos inmunocompetentes; por lo tanto, algunos de estos pacientes pueden adquirir varicela en caso de contacto, a pesar de la apropiada administración de la vacuna. En estos pacientes se deberá hacer un seguimiento cuidadoso de la aparición de signos de varicela.
Existen muy pocas notificaciones de varicela diseminada con afectación de órganos internos tras la vacunación con la vacuna antivaricela (cepa Oka), sobre todo en pacientes inmunocomprometidos.
Como sucede con todas las vacunas, puede que no se obtenga una respuesta inmunitaria protectora en todos los vacunados. Los estudios de eficacia y la experiencia post-comercialización indican que la vacuna no protege completamente a todas las personas frente a la varicela natural y que no cabe esperar una protección máxima frente al virus de la varicela-zóster hasta aproximadamente unas seis semanas después de completar el esquema de vacunación (ver sección 5.1).
La administración de Varilrix a personas durante el periodo de incubación de la infección no garantiza la protección frente a las manifestaciones clínicas de la varicela ni la modificación del curso de la enfermedad.
El exantema causado por la infección primaria debida al virus de la varicela- zóster salvaje puede ser más grave en personas con lesiones graves de la piel, incluidos los eccemas. Se desconoce si existe un incremento del riesgo de lesiones cutáneas asociado a la vacunación en estas personas, pero se debe tener en cuenta esta posibilidad antes de la vacunación.
Transmisión de la cepa vacunal
Se ha observado la transmisión de la cepa vacunal desde personas sanas vacunadas que desarrollan exantema post-vacunal a sus contactos, bien fuesen estas personas sanas, mujeres embarazadas o pacientes inmunodeprimidos. No obstante, tampoco se puede descartar la transmisión de la cepa vacunal a cualquiera de estos grupos en ausencia de exantema post-vacunal (ver sección 4.8).
En los contactos sanos de los vacunados, en ocasiones, se ha producido una seroconversión en ausencia de cualquier manifestación clínica de la infección. Las infecciones sintomáticas debidas a la transmisión de la cepa vacunal son normalmente leves, con un pequeño número de lesiones en la piel y mínimas manifestaciones sistémicas.
Sin embargo, si la persona vacunada desarrolla un exantema cutáneo que se cree relacionado con la vacunación (especialmente vesicular o papulovesicular) dentro de las cuatro o seis semanas tras la
zk$a
:m
administración de la primera o segunda dosis, debe evitarse el contacto con los siguientes grupos hasta que el exantema haya desaparecido completamente (ver también las secciones 4.6 y 5.1):
- Mujeres embarazadas susceptibles
- Individuos inmunocomprometidos (ver sección 4.3).
En ausencia de exantema en el vacunado, el riesgo de transmisión de la cepa vacunal a los grupos antes mencionados es extremadamente bajo. Sin embargo, los vacunados (p.ej., personal sanitario) que tengan una elevada probabilidad de entrar en contacto con los grupos arriba mencionados, deben evitar preferiblemente cualquier contacto durante las 4-6 semanas siguientes a la administración de cada dosis de Varilrix. Si ello no fuera posible, los vacunados deben estar atentos para informar de cualquier exantema cutáneo durante este periodo y deben tomarse las medidas antes citadas si éste apareciese.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se ha demostrado que la cepa vacunal Oka es sensible al aciclovir.
En personas que han recibido inmunoglobulinas o una transfusión sanguínea, debe retrasarse la vacunación durante al menos tres meses, debido a la probabilidad de fracaso vacunal por la presencia de anticuerpos frente al virus de la varicela-zóster adquiridos pasivamente.
Los receptores de la vacuna deben evitar el uso de salicilatos durante las seis semanas siguientes a la administración de cada dosis de Varilrix, ya que se ha notificado la aparición del síndrome de Reye después del uso de salicilatos durante la infección por el virus salvaje de la varicela-zóster.
Si se tiene que realizar la prueba de la tuberculina, ésta se debe realizar antes o simultáneamente a la administración de la vacuna, ya que se ha comunicado que las vacunas víricas vivas pueden producir una disminución temporal de la sensibilidad de la piel a la tuberculina. Dado que esta anergia puede durar hasta un máximo de 6 semanas, no debe realizarse la prueba de la tuberculina durante dicho periodo de tiempo para evitar resultados falsos negativos.
En un estudio en el que se administró Varilrix a niños simultáneamente con vacunas combinadas de parotiditis, sarampión y rubéola, aunque en diferentes lugares de inyección, no hubo evidencia de interferencia inmune significativa entre los antígenos virales vivos.
Si se considera necesario administrar otra vacuna de virus vivos al mismo tiempo que Varilrix, las vacunas deben administrarse como inyecciones separadas y en diferentes lugares del cuerpo.
Personas sanas
Las vacunas inactivadas pueden administrarse en cualquier relación temporal a Varilrix.
Si una vacuna frente al sarampión no se administra al mismo tiempo que Varilrix, se recomienda se mantenga un intervalo de al menos un mes, ya que se reconoce que la vacunación frente al sarampión puede conducir a una supresión de corta duración de la respuesta inmunitaria mediada por células.
Debe esperarse que la reactogenicidad de la administración conjunta de Varilrix con otras vacunas más reactogénicas venga determina por las reacciones de estas últimas.
Pacientes de alto riesgo
Varilrix no debe administrarse al mismo tiempo que otras vacunas vivas atenuadas.
Las vacunas inactivadas pueden administrarse en cualquier relación temporal a Varilrix, dado que no se ha establecido una contraindicación específica. Diferentes vacunas inyectables deben administrarse siempre en lugares de inyección distintos.
4.6 Fertilidad, embarazo y lactancia
Sj
an
Fertilidad
No se ha evaluado si Varilrix puede afectar a la fertilidad.
Embarazo
Las mujeres embarazadas no se deben vacunar con Varilrix.
Sin embargo, no se ha documentado daño fetal cuando se administran vacunas de varicela a mujeres embarazadas.
Se debe evitar el embarazo durante 1 mes después de la vacunación. Las mujeres que estén intentando un embarazo deben ser advertidas para que lo retrasen.
Lactancia
Los recién nacidos de mujeres seronegativas no han adquirido anticuerpos frente al virus de la varicela-zóster por vía transplacentaria. Por lo tanto, debido al riesgo teórico de transmisión de la cepa vacunal de madre a hijo, las mujeres no deben vacunarse durante la lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Varilrix sobre la capacidad para conducir y utilizar máquinas es baja.
4.8 Reacciones adversas
Ensayos clínicos
Las reacciones adversas que sucedieron durante las 4-6 semanas después de la vacunación se registraron mediante el empleo de listados de síntomas. Los acontecimientos adversos que se citan a continuación fueron notificados en relación temporal con la vacunación.
El perfil de seguridad que se presenta a continuación se basa en un total de 5.369 dosis de Varilrix administradas en monoterapia a niños, adolescentes y adultos.
Las reacciones adversas notificadas se listan de acuerdo con la siguiente frecuencia:
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a < 1/10)
Poco frecuentes (> 1/1.000 a < 1/100)
Raras (> 1/10.000 a < 1/1.000)
Muy raras (< 1/10.000)
Infecciones e infestaciones
Poco frecuentes: infección del tracto respiratorio superior, faringitis.
Trastornos de la sangre y del sistema linfático Poco frecuentes: linfadenopatía.
Trastornos psiquiátricos Poco frecuentes: irritabilidad.
Trastornos del sistema nervioso
Poco frecuentes: cefalea, somnolencia, mareo, migraña.
Trastornos oculares Raras: conjuntivitis.
Trastornos respiratorios, torácicos y mediastínicos Poco frecuentes: tos, rinitis.
Trastornos gastrointestinales Poco frecuentes: náuseas, vómitos.
Raras: dolor abdominal, diarrea.
zk$a
:m
Trastornos de la piel y del tejido subcutáneo Frecuentes: erupción cutánea.
Poco frecuentes: exantema papulovesicular, prurito.
Raras: urticaria.
Trastornos musculoesqueléticos y del tejido conjuntivo Poco frecuentes: artralgia, dolor de espalda, mialgia.
Trastornos generales y alteraciones en el lugar de administración Muy frecuentes: dolor y/o enrojecimiento en el lugar de la inyección.
Frecuentes: hinchazón en el lugar de la inyección*, fiebre (temperatura oral/axilar > 37,5° C o temperatura rectal > 38,0° C)*.
Poco frecuentes: fiebre (temperatura oral/axilar > 39,0° C o temperatura rectal > 39,5° C), cansancio, induración en el lugar de la inyección, dolor torácico, malestar.
Se observó una tendencia a una mayor incidencia de dolor, enrojecimiento e hinchazón en el lugar de la inyección tras la segunda dosis, en comparación con la primera.
*La hinchazón en el lugar de la inyección y la fiebre se notificaron muy frecuentemente en los estudios realizados en adolescentes y adultos. La hinchazón en el lugar de la inyección también fue notificada muy frecuentemente tras la segunda dosis en niños menores de 13 años.
Datos post-comercialización
Se ha observado muy infrecuentemente la transmisión del virus vacunal desde personas sanas vacunadas a sus contactos (personas sanas, mujeres embarazadas o pacientes inmunodeprimidos - ver sección 4.4).
Además, durante la vigilancia post-comercialización se han notificado las siguientes reacciones adversas tras la vacunación frente a la varicela:
Infecciones e infestaciones Raras: herpes zóster.
Trastornos de la sangre y del sistema linfático Raras: trombocitopenia.
Trastornos del sistema inmunológico
Raras: hipersensibilidad, reacción anafiláctica, reacción anafilactoide.
Trastornos del sistema nervioso
Raras: encefalitis, ictus, cerebelitis, síntomas parecidos a los de la cerebelitis (incluyendo: alteración de la marcha transitoria y ataxia transitoria), convulsiones.
Trastornos vasculares
Raras: vasculitis (incluyendo: púrpura de Henoch-Schonlein y síndrome de Kawasaki).
Trastornos de la piel y del tejido subcutáneo Raras: eritema multiforme.
Se han notificado casos aislados de mielitis en asociación temporal con la administración de Varilrix, sin que se haya establecido una relación de causalidad.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los
an
profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, https://www.notificaram.es
4.9 Sobredosis
La administración accidental de una dosis excesiva de Varilrix es muy poco probable dado que la vacuna se presenta en envases monodosis. Aún así, se han producido casos de administración accidental de una dosis de Varilrix superior a la recomendada. En algunos de los casos de sobredosificación se notificaron los siguientes acontecimientos adversos: letargia y convulsiones. En los demás casos no se notificaron acontecimientos adversos relacionados con la sobredosificación.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Vacunas contra la varicela, código ATC: J07BK01
La cepa Oka contenida en la vacuna Varilrix se obtuvo inicialmente a partir de un niño con varicela natural, atenuándose el virus mediante pases secuenciales consecutivos en cultivos celulares.
La infección natural induce una respuesta inmune humoral y celular frente al virus varicela-zóster que puede ser rápidamente detectada tras la infección. Normalmente, las IgG, IgM e IgA frente a las proteínas virales aparecen al mismo tiempo en que puede demostrarse la respuesta inmune celular, siendo difícil establecer la relativa contribución de la inmunidad humoral y celular en la progresión de la enfermedad. La vacunación ha mostrado inducción tanto de la inmunidad humoral como de la inmunidad mediada por células.
Eficacia
En un ensayo clínico aleatorizado en el que se utilizó Priorix (vacuna combinada viva atenuada de GlaxoSmithKline frente al sarampión, la parotiditis y la rubeola) como control, se evaluó la eficacia de Varilrix y de Priorix-Tetra (vacuna combinada viva atenuada de GlaxoSmithKline frente al sarampión, la parotiditis, la rubeola y la varicela) para prevenir la varicela. El estudio se realizó en países europeos en los que no está implementada la vacunación rutinaria frente a la varicela. Se administraron dos dosis de Priorix-Tetra (N = 2.279) con un intervalo de seis semanas o una dosis de Varilrix (N = 2.263) a niños de 12 a 22 meses y se les realizó un seguimiento durante un periodo de aproximadamente 35 meses post-vacunación (el estudio de seguimiento a largo plazo, a 10 años, sigue en marcha). La eficacia vacunal observada frente a cualquier forma de varicela (definida de acuerdo a una escala predeterminada) confirmada epidemiológicamente o mediante PCR (Reacción en Cadena de la Polimerasa) fue del 94,9% después de dos dosis de Priorix-Tetra y del 65,4 % después de una dosis de Varilrix. La eficacia vacunal observada frente a varicela confirmada moderada o grave fue del 99,5% después de dos dosis de Priorix-Tetra y del 90,7% después de una dosis de Varilrix.
Tabla 1 - Eficacia de Varilrix observada en un ensayo clínico multicéntrico en Europa
|
Ensayo clínico |
Población |
Rango de edad |
Edad media a la primera dosis |
Vacuna |
Pauta de vacunación |
Eficaciaf frente a cualquier forma de varicela confirmada tras 35 meses |
Eficaciaf frente a varicela moderada o grave confirmada tras 35 meses |
|
OKA-H-179 (100388) |
niños sanos (N= 5.803)1 |
11-31 meses |
14,2 meses |
Priorix Tetra |
2 dosis** |
94,9% (IC 97,5%: 92,4; 96,6%) |
99,5% (IC 97,5%: 97,5; 99,9%) |
|
Varilrix ASH(+) |
1 dosis* |
65,4% (IC 97,5%: 57,2; 72,1%) |
90,7% (IC 97,5%: 85,9; 93,9%) |
fEficacia vacunal observada frente a cualquier forma de varicela (definida de acuerdo a una escala predeterminada) confirmada epidemiológicamente o mediante PCR
úfe
an
Varilrix ASH (+): formulación conteniendo albúmina sérica humana
Priorix Tetra: vacuna combinada viva atenuada de GlaxoSmithKline frente al sarampión, la parotiditis, la rubeola y la varicela
'número total de sujetos incluidos en el estudio
**intervalo entre dosis = 6 semanas
*precedida de 1 dosis de Priorix (intervalo = 6 semanas)
En dos ensayos clínicos controlados con placebo realizados previamente con Varilrix, se evaluó la eficacia de la vacuna para prevenir la varicela en 513 niños sanos de 10 a 30 meses y en 1.002 adultos sanos de 17 a 28 años.
En el estudio en niños, realizado en Finlandia, se administró una dosis de Varilrix y se les realizó un seguimiento a los 29 meses y a los 4 años post-vacunación. La eficacia vacunal observada frente a cualquier forma de varicela (> 1 vesícula o pápula) confirmada serológicamente fue del:
- 88,2% a los 29 meses y del 77,0% a los 4 años cuando se utilizaron lotes de la vacuna con una potencia de 104 UFP*
- 54,8% a los 29 meses y del 46,0% a los 4 años cuando se administraron lotes de la vacuna envejecidos artificialmente con una potencia de 103,1 UFP* y 102,8 UFP*
La eficacia vacunal observada con una dosis frente a casos clínicos típicos de varicela (> 30 vesículas) fue del 100% en los sujetos que seroconvirtieron tras la vacunación. Los casos de varicela en sujetos que respondieron a la vacunación fueron leves (< 3 vesículas, como promedio).
En el estudio en adultos, realizado en Singapur, se administraron dos dosis de Varilrix. La eficacia vacunal observada frente a cualquier forma de varicela a los 22 meses post-vacunación se estimó en un 75,9%.
*Potencia mínima asegurada de Varilrix: > 104 UFP (en el momento de su puesta en el mercado) y 103,3 UFP (al final del periodo de validez).
Tabla 2 - Eficacia de Varilrix observada en dos ensayos clínicos previamente realizados
|
Ensayo clínico |
Población |
Rango de edad |
Edad media a la primera dosis |
Vacuna antivaricela |
Pauta de vacunación |
Eficacia en prevención de varicela de cualquier gravedad | |
|
OKA-H-024 (208133/100) Finlandia |
niños sanos (N= 513)1 |
10-30 meses |
17,1 meses |
Varilrix ASH(+) |
1 dosis |
Tras 29 meses: 88,2% (IC 95%: 71,0; 95,2%) |
Tras 4 años: 77,0% (IC 95%: 63; 86%) |
|
Varilrix ASH(+) envejecido artificialmente |
Tras 29 meses: 54,8% (IC 95%: 25,5; 72,5%) |
Tras 4 años: 46,0% (IC 95%: 26; 60%) | |||||
|
OKA-H-041 (208133/114) Singapur |
varones adultos sanos (N= 1.002)1 |
17-28 años |
18,8 años |
Varilrix ASH(+) |
2 dosi s* |
Tras 22 meses: 75,9% (IC 95%: 43,8; 89,7%) |
- |
Varilrix ASH(+): formulación con albúmina sérica humana 'número total de sujetos incluidos en el estudio *intervalo entre dosis = 12 semanas
No hay datos suficientes para valorar el nivel de protección frente a complicaciones de la varicela como encefalitis, hepatitis o neumonía.
Efectividad
El valor protector de la vacuna se ha confirmado en un estudio de efectividad, con un seguimiento a 2 años realizado en 159 profesionales sanitarios adultos. Dos de los 72 vacunados (3%) que notificaron contactos con casos de varicela natural tras la vacunación, experimentaron una varicela leve. Aproximadamente un tercio de los vacunados mostró un incremento en el título de anticuerpos durante el periodo de seguimiento, indicativo de contacto con el virus, sin evidencia clínica de infección por varicela.
La efectividad de una dosis de Varilrix, estimada a partir de diferentes escenarios (brotes, estudios de casos-control y de bases de datos), osciló entre un 20-92% frente a cualquier forma de varicela y entre un 86-100% frente a varicela moderada o grave.
El impacto de una dosis de Varilrix en la reducción de las hospitalizaciones y de las visitas ambulatorias por varicela en niños fue, de manera global, del 81% y del 87% respectivamente.
Los datos de efectividad sugieren que se obtienen un mayor nivel de protección y una disminución de la varicela breakthrough (varicela en sujetos vacunados) después de dos dosis de la vacuna que después de una dosis.
Inmunogenicidad
Personas sanas
En niños entre los 10 meses y los 21 meses de edad la tasa de seroconversión, determinada mediante ELISA (50 mUI/ml) seis semanas después de la vacunación, fue entre el 89,6% y 90,5% después de una dosis de la vacuna y del 100% después de la segunda dosis de la vacuna.
an
Tabla 3 - Datos comparativos de inmunogenicidad obtenidos en un estudio en el que se emplearon dos ^formulaciones diferentes de Varilrix_
|
Ensayo clínico |
Población: niños sanos Rango de edad: 10-21 meses Edad media a la primera dosis: 15,2 meses | |||
|
OKA-H-186 |
Vacuna y pauta de vacunación |
Vacuna y pauta de vacunación | ||
|
Varilrix ASH(-) 2 dosis Intervalo= 6-8 semanas |
Varilrix ASH(+) 2 dosis Intervalo= 6-8 semanas | |||
|
6 semanas post-dosis 1 |
6 semanas post-dosis 2 |
6 semanas post-dosis 1 |
6 semanas post-dosis 2 | |
|
Tasa de seroconversión (IFA) |
98,3% (IC 95%: 93,9; 99,8%) N = 116 |
100% (IC 95%: 96,8; 100%) N = 115 |
99,1% (IC 95%: 95,3; 100%) N = 115 |
100% (IC 95%: 96,8; 100%) N = 112 |
|
Tasa de serorespuesta (ELISA) |
90,5% (IC 95%: 83,7; 95,2%) N = 116 |
100% (IC 95%: 96,9; 100%) N = 116 |
89,6% (IC 95%: 82,5; 94,5%) N = 115 |
100% (IC 95%: 96,8; 100%) N = 114 |
Varilrix ASH(+): formulación con albúmina sérica humana Varilrix ASH(-): formulación sin albúmina sérica humana N= número de sujetos para los que existen resultados disponibles IFA: ensayo de inmunofluorescencia
En niños entre los 9 meses y los 6,9 años de edad la tasa de seroconversión, determinada mediante inmunofluorescencia (IFA) seis semanas después de la vacunación, fue del 100% después de una segunda dosis de la vacuna (ver tabla 3, arriba y tabla 4, a continuación). Se observó un marcado aumento de los títulos de anticuerpos después de la administración de una segunda dosis (aumento de la GMT entre 5 y 26 veces).
Tabla 4 - Tasas de seroconversión tras la primera y segunda dosis de una vacuna antivaricela obtenidas en tres estudios realizados en niños sanos
|
Ensayo clínico: MMRV-046 Población: niños sanos Rango de edad: 13-83 meses Edad media a la primera dosis: 30,9 meses |
Ensayo clínico: MMRV-047 Población: niños sanos previamente vacunados con cualquier vacuna antivaricela antes de entrar en el estudio Rango de edad: 15-75 meses Edad media a la primera dosis: 47,0 meses |
Ensayo clínico: MMRV-018 Población: niños sanos Rango de edad: 9-10 meses Edad media a la primera dosis: 9,3 meses | ||||||
|
Vacuna y pauta de |
Vacuna y pauta de |
Vacuna y pauta de |
Vacuna y pauta de | |||||
|
vacunación |
vacunación |
vacunación |
vacunación | |||||
|
Dosis 1 = Priorix + |
Dosis 1 = Priorix |
Dosis 1 = cualquier |
Priorix + Varilrix | |||||
|
Varilrix ASH(+) |
Tetra |
vacuna antivaricela |
ASH(+) | |||||
|
Dosis 2 = Varilrix |
Dosis 2 = Varilrix |
(antes de entrar en el | ||||||
|
ASH(+) |
ASH(+) |
estudio) |
2 dosis | |||||
|
Intervalo= 6-8 |
Intervalo= 6-8 |
Dosis 2 = Priorix + | ||||||
|
semanas |
semanas |
Varilrix ASH(+) |
Intervalo= 3 meses | |||||
|
6 |
6 |
6 |
6 |
Post- |
6 |
6 |
6 | |
|
semanas |
semanas |
semanas |
semanas |
dosis 1 |
semanas |
semanas |
semanas | |
|
post- |
post- |
post- |
post- |
post- |
post- |
post- | ||
|
dosis 1 |
dosis 2 |
dosis 1 |
dosis 2 |
dosis 2 |
dosis 1 |
dosis 2 | ||
|
N= 177 |
N= 177 |
N= 178 |
N= 176 |
N= 188 |
N= 188 |
N= 111 |
N= 118 | |
|
Tasa de |
98,3% |
100% |
97,8% |
100% |
99,5% |
100% |
99,1% |
100% |
|
serocon- |
(IC 95%: |
(IC 95%: |
(IC 95%: |
(IC 95%: |
(IC 95%: |
(IC 95%: |
(IC 95%: |
(IC 95%: |
|
versión |
95,1; |
97,9; |
94,3; |
97,9; |
97,1; |
98,1; |
95,1; |
96,9; |
|
(IFA) |
99,6%) |
100%) |
99,4%) |
100%) |
100%) |
100%) |
100%) |
100%) |
Varilrix ASH (+): formulación con albúmina sérica humana
Priorix Tetra: vacuna combinada viva atenuada de GlaxoSmithKline frente al sarampión, la parotiditis, la rubeola y la varicela
N = número de sujetos para los que existen resultados disponibles (sujetos seronegativos antes de la primera dosis en los estudios MMRV-046 y MMRV-018)
IFA: ensayo de inmunofluorescencia
Pacientes de alto riesgo
Los ensayos clínicos han demostrado la seguridad e inmunogenicidad de Varilrix en personas sanas y en pacientes de alto riesgo.
En pacientes de alto riesgo está indicada la determinación periódica de anticuerpos frente a varicela después de la vacunación, para identificar aquellos que puedan beneficiarse de la revacunación.
En personas susceptibles, Varilrix produce una infección atenuada, clínicamente asintomática.
En pacientes gravemente inmunocomprometidos se produjo varicela clínicamente evidente después de la vacunación y se aislaron virus vacunales de las vesículas.
Se ha demostrado la transmisión de la cepa Oka, mediante aislamiento e identificación, en cuatro casos de hermanos vacunados inmunocomprometidos que presentaron una erupción vesicular. En todos los casos desarrollaron una erupción post-exposición muy leve.
El porcentaje de vacunados que desarrollará herpes-zóster en el futuro debido a la reactivación de la cepa Oka es actualmente desconocido. En un estudio, la incidencia de herpes zóster en pacientes
zk$a
:m
leucémicos vacunados fue menor que la observada en pacientes leucémicos no vacunados infectados por el virus salvaje.
5.2 Propiedades farmacocinéticas
No se requiere la evaluación de las propiedades farmacocinéticas para las vacunas.
5.3 Datos preclínicos sobre seguridad
No existen aspectos preclínicos que se consideren relevantes para la seguridad clínica más allá de los datos incluidos en otras secciones de la Ficha Técnica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Lactosa Aminoácidos Sorbitol (E-420)
Manitol (E-421)
Para información sobre componentes residuales en cantidades traza, ver sección 2.
Disolvente:
Agua para preparaciones inyectables.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, Varilrix no debe mezclarse en la misma jeringa con otras vacunas.
6.3 Periodo de validez
Antes de la reconstitución:
Cuando se almacena en las condiciones establecidas, el periodo de validez es de 2 años.
Después de la reconstitución:
Se ha demostrado que la vacuna reconstituida se puede mantener hasta 90 minutos a 25°C y hasta 8 horas en nevera (entre 2°C y 8°C) antes de su uso. No congelar la vacuna una vez reconstituida.
6.4 Precauciones especiales de conservación
Antes de la reconstitución:
Conservar en nevera (entre 2°C y 8°C).
La vacuna liofilizada no se ve afectada por la congelación.
Conservar en el embalaje original para protegerla de la luz.
Después de la reconstitución:
Para las condiciones de conservación de la vacuna reconstituida, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial:
La vacuna liofilizada se presenta en un vial de vidrio de 3 ml (vidrio de tipo I) con un tapón (goma de bromobutilo) y una cápsula desechable (aluminio).
Jeringa precargada:
El disolvente para la reconstitución se presenta en una jeringa precargada de vidrio (vidrio neutro de tipo I) que cumple con los requisitos de la Farmacopea Europea.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Para reconstituir la vacuna, utilizar solamente el agua para preparaciones inyectables que se incluye en la jeringa precargada.
El disolvente, y la vacuna reconstituida antes de la administración, deben inspeccionarse visualmente para detectar la presencia de cualquier partícula extraña y/o cambio en el aspecto físico. En ese caso, el disolvente o la vacuna reconstituida deben desecharse.
Instrucciones para la reconstitución de la vacuna:
Varilrix se debe reconstituir añadiendo todo el contenido de la jeringa precargada al vial que contiene el polvo.
Para saber cómo insertar la aguja en la jeringa, véase el dibujo explicativo. No obstante, la jeringa facilitada con Varilrix puede ser ligeramente diferente (sin rosca de tornillo) a la jeringa descrita en el dibujo. En tal caso, la aguja deberá insertarse sin enroscar.

Émbolo de la jeringa
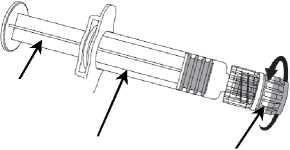
Protector de la jeringa
Cuerpo de la jeringa
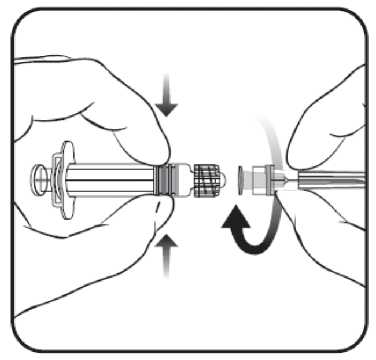

1. Sujetar el cuerpo de la jeringa con una mano (evitar sostener el émbolo de la jeringa) y con la otra, desenroscar el protector de la jeringa girándolo en sentido contrario a las agujas del reloj.
2. Insertar la aguja en la jeringa y a continuación, girar la aguja en el sentido de las agujas del reloj hasta que se bloquee (ver dibujo).
3. Retirar el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
úfe
an
Añadir el disolvente al polvo. Después de añadir el disolvente al polvo, se debe agitar bien la mezcla hasta que el polvo esté completamente disuelto.
Tras la reconstitución, la vacuna debe administrarse rápidamente.
Se debe utilizar una aguja nueva para administrar la vacuna.
Inyectar todo el contenido del vial.
Debido a pequeñas variaciones del pH, el color de la vacuna reconstituida puede variar de una solución color anaranjado claro a rosado.
Para información sobre la forma de administración ver sección 4.2.
La eliminación de la vacuna no utilizada y de todos los materiales que hayan estado en contacto con ella, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline, S.A.
PTM C/ Severo Ochoa 2 28760 - Tres Cantos Madrid
Teléfono: 902 202 700 Fax: 91 807 03 10 E-mail: es-ci@gsk.com
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
61.671
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 05/diciembre/1997 Fecha de la última renovación: 05/diciembre/2007
10. FECHA DE LA REVISIÓN DEL TEXTO Diciembre 2015
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/