Vancomicina Actavis 500 Mg Polvo Para Solucion Para Perfusion Efg
Información obsoleta, busque otroFICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Vancomicina Actavis 500 mg polvo para concentrado para solución para perfusión EFG Vancomicina Actavis 1.000 mg polvo para concentrado para solución para perfusión EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene:
Vancomicina Actavis 500 mg polvo para concentrado para solución para perfusión.
Cada vial contiene 500 mg de vancomicina (equivalentes a 525.000 UI) (como hidrocloruro de vancomicina).
Al ser reconstituido con 10 ml de agua para preparaciones inyectables, el concentrado resultante para solución para perfusión contiene 50 mg/ml de vancomicina
Vancomicina Actavis 1.000 mg polvo para concentrado para solución para perfusión.
Cada vial contiene 1.000 mg de vancomicina (equivalentes a 1.050.000 UI) (como hidrocloruro de vancomicina)
Al ser reconstituido con 20 ml de agua para preparaciones inyectables, el concentrado resultante para solución para perfusión contiene 50 mg/ml de vancomicina
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para concentrado para solución para perfusión.
Polvo blanco o casi blanco.
Tras la reconstitución se obtiene una solución con un pH comprendido entre 2,5-4,5.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
La vancomicina por vía intravenosa está indicada para las siguientes infecciones graves causadas por bacterias gram-positivas sensibles a la vancomicina que no pueden ser tratadas, ha fallado su respuesta o son resistentes a otros antibióticos como las penicilinas y cefalosporinas.
- Endocarditis
- Infecciones óseas (osteomielitis)
- Neumonía
- Infecciones de los tejidos blandos
La endocarditis causada por enterococos, Streptococcus viridans o Streptococcus bovis debe tratarse con una combinación de vancomicina y un aminoglucósido.
Vancomicina puede utilizarse en la profilaxis quirúrgica de la endocarditis bacteriana, en pacientes con un alto riesgo de desarrollar endocarditis bacteriana cuando deben estar sometidos a procedimientos quirúrgicos mayores (p.ej., procedimientos cardíacos y vasculares, etc.) y no pueden recibir un agente antibacteriano betalactámico adecuado.
1¡fe
on
Deben tenerse en cuenta las directrices oficiales referentes al uso y prescripción adecuados de los antibióticos.
4.2 Posología y forma de administración
Posología
La dosis y duración del tratamiento deben ajustarse individualmente y según el tipo y gravedad de la infección y las características propias del paciente como la edad y la función renal.
Pueden medirse los niveles de vancomicina como ayuda para los ajustes de dosis.
Medida de las concentraciones séricas
Tras dosis intravenosas múltiples, las concentraciones máximas en suero medidas dos horas después del final de la perfusión, oscilan entre 18-26 mg/l. Los niveles medidos inmediatamente antes de la próxima dosis deben ser de 5-10 mg/l. Se ha asociado la otoxicidad con niveles del fármaco en el suero de 80-100 mg/l, pero se observa raramente cuando los niveles en suero se mantienen en, o por debajo de, 30 mg/l.
Pacientes con una función renal normal Adultos y niños de más de 12 años:
La dosis intravenosa diaria recomendada es de 2.000 mg (2 g), administrada como 500 mg cada 6 horas o 1.000 mg (1 g) cada 12 horas. Normalmente se observa una mejora entre las 48 y 72 horas.
La duración total de la administración está determinada por el tipo y gravedad de la infección y la respuesta clínica del paciente.
Para la endocarditis bacteriana, el régimen generalmente aceptado es de 1.000 mg (1 g) de vancomicina por vía intravenosa cada 12 horas durante 4 semanas, ya sea sola o en combinación con otros antibióticos.
En función del patógeno involucrado, puede ser necesario un tratamiento más largo de hasta 6 semanas. Deben seguirse las recomendaciones nacionales.
En el caso de que la vancomicina se administre concomitantemente con un aminoglucósido (p.ej. gentamicina) los pacientes deben ser estrechamente vigilados en cuanto a la aparición de signos de neurotoxicidad y ototoxicidad. En el caso de aparecer trastornos renales, debe ajustarse la dosis (ver sección 4.5).
Profilaxis preoperatoria frente a la endocarditis bacteriana: antes de la cirugía, a los adultos se les administra por vía intravenosa 1.000 mg (1 g) de vancomicina (antes de la inducción de la anestesia) y dependiendo del tiempo y tipo de cirugía, puede administrarse una dosis de 1.000 mg (1 g) de vancomicina i.v. 12 horas después de la cirugía.
Población _ pediátrica
Niños de un mes a 12 años:
40 mg/kg/día: la dosis debe dividirse, y normalmente se hace en cuatro dosis (es decir, 10 mg/kg cada 6 horas). Cada dosis debe administrarse durante por lo menos 60 min.
Niños recién nacidos (a término):
0-7 días: una dosis inicial de 1 mg/kg, seguida por 10 mg/kg cada 12 horas.
7-30 días: una dosis inicial de 15 mg/kg, seguida por 10 mg/kg cada 8 horas.
Cada dosis debe administrarse durante por lo menos 60 minutos.
En estos pacientes, debe asegurarse un estrecho control de las concentraciones de vancomicina en suero.
5füfi
am
Población de edad avanzada:
Debido a la reducción en la función renal (ver posteriormente) por causa de la edad, puede ser necesaria una reducción de la dosis. Se debe controlar la función auditiva del paciente, ver sección 4.4.
Embarazo:
Se ha comunicado que en pacientes embarazadas pueden ser necesarias dosis significativamente superiores para conseguir las concentraciones terapéuticas en suero.
Pacientes con insuficiencia renal
En los pacientes con insuficiencia renal, debe ajustarse la dosis para evitar niveles tóxicos en suero. Deben controlarse de forma periódica los niveles de vancomicina en suero. Para la mayoría de pacientes con insuficiencia renal, puede utilizarse el siguiente normograma basado en el aclaramiento de creatinina para determinar la dosis necesaria.
La dosis de inicio debe ser siempre de por lo menos 15 mg/kg.
El normograma no es válido para pacientes anéfricos funcionales en diálisis.
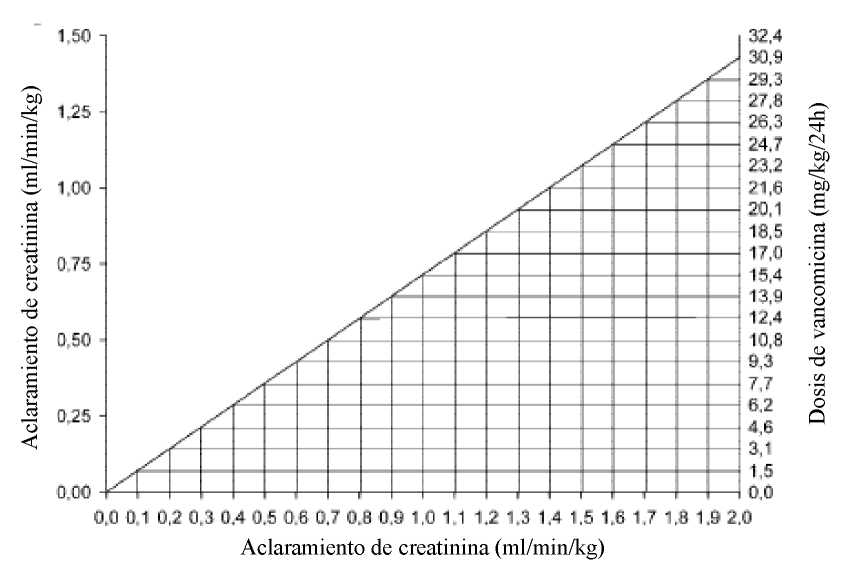
Si no se dispone del aclaramiento de creatinina, puede aplicarse la siguiente fórmula para calcular el aclaramiento de creatinina a partir de la edad, sexo y creatinina del paciente:
Hombres:
Peso (kg) x 140 — edad (años)
72 x creatinina en suero (mg/100 ml)
Mujeres: 0,85 x valor calculado en la fórmula anterior Siempre que sea posible, debe determinarse el aclaramiento de creatinina.
Pacientes en hemodiálisis
Deben controlarse de forma periódica las concentraciones de vancomicina en suero.
Para los pacientes anúricos (sin función renal) en diálisis, la dosis inicial es de 15 mg/kg y la dosis de mantenimiento es de aproximadamente 1,9 mg/kg/24 horas. Dado que son convenientes dosis de mantenimiento de 250 mg a 1 g, en los pacientes con una marcada insuficiencia renal, puede administrarse una dosis cada varios días, en vez de seguir una pauta diaria de administración. En el caso de anuria, se recomienda una dosis de 1 g cada 7-10 días.
IBj an
En caso de utilizar en la hemodiálisis membranas de polisulfonas (diálisis de alto flujo), se reduce la semivida de la vancomicina. Para los pacientes que se someten a hemodiálisis periódicamente, pueden ser necesarias dosis adicionales de mantenimiento.
Pacientes con insuficiencia hepática
Los datos de que se dispone con pacientes con insuficiencia hepática son limitados. Los datos de que se dispone indican que no es necesario efectuar ajustes de dosis en los casos de insuficiencia hepática leve o moderada.
Forma de administración
Solamente para uso intravenoso.
Para las instrucciones de reconstitución y dilución del medicamento antes de la administración, ver sección 6.6.
Se recomiendan concentraciones no superiores a 5 mg/ml. Puede utilizarse una concentración de hasta 10 mg/ml en pacientes concretos que necesiten una restricción de fluidos; la utilización de estas concentraciones elevadas puede aumentar el riesgo de efectos relacionados con la perfusión. Las perfusiones deben administrarse durante un período de tiempo no inferior a 60 minutos. En adultos, si las dosis utilizadas superan 500 mg, se recomienda una velocidad de perfusión no superior a los 10 mg/min. Sin embargo, los efectos relacionados con la perfusión pueden ocurrir a cualquier velocidad o concentración.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Advertencias
La administración en bolo rápido (es decir, durante algunos minutos) puede estar asociada con una acusada hipotensión, incluyendo shock y raramente paro cardíaco, respuestas tipo histamina y erupción maculopapular o eritematosa (“síndrome de hombre rojo” o “síndrome del cuello rojo”).
Vancomicina debe ser perfundida lentamente en una solución diluida a una velocidad no superior a 10 mg/min y durante un período de tiempo no inferior a 60 minutos, a fin de evitar reacciones relacionadas con la perfusión rápida. Estas reacciones normalmente cesan rápidamente al parar la perfusión (ver secciones 4.2 y 4.8).
En caso de reacciones de hipersensibilidad agudas graves (p.ej. anafilaxias), se debe parar inmediatamente el tratamiento con vancomicina e iniciar las medidas de urgencia apropiadas.
Vancomicina debe utilizarse con precaución en pacientes con reacciones alérgicas a la teicoplanina, dado que se han observado reacciones cruzadas de hipersensibilidad entre vancomicina y teicoplanina.
Vancomicina debe utilizarse con precaución en los pacientes con insuficiencia renal dado que la posibilidad de que se desarrollen efectos tóxicos es mucho más alta cuando se mantienen concentraciones sanguíneas altas durante un tiempo prolongado. La dosis debe reducirse según el grado de insuficiencia renal. Con concentraciones altas o tratamiento prolongado, se aumenta de forma apreciable el riesgo de toxicidad. Deben controlarse los niveles en sangre y la función renal de forma periódica.
Se ha observado ototoxicidad, que puede ser transitoria o permanente (ver sección 4.8), en pacientes que presentaban sordera previa y que habían recibido dosis intravenosas excesivas o un tratamiento concomitante con otros principios activos ototóxicos, como un aminoglucósido. La sordera puede estar precedida por tinnitus. La experiencia con otros antibióticos sugiere que la sordera puede ser progresiva aunque cese el tratamiento. A fin de reducir la ototoxicidad, se recomienda determinar de forma periódica los niveles en sangre y comprobar regularmente la función auditiva.
úfe
an
Debe evitarse el uso de vancomicina en pacientes con una pérdida de audición previa. En caso de utilizarse en estos pacientes, la dosis debe ser ajustada mediante la determinación periódica de los niveles de fármaco en sangre. Los pacientes de edad avanzada son más susceptibles a una lesión auditiva.
Población pediátrica
En prematuros y niños de corta edad, puede ser apropiado confirmar las concentraciones de vancomicina en suero. El uso concomitante en niños de vancomicina y agentes anestésicos se ha asociado con reacciones con eritema y rubor inducido por liberación de histamina (ver sección 4.5).
Población de edad avanzada
La disminución natural de la filtración glomerular que ocurre con la edad, puede provocar que se den concentraciones elevadas de vancomicina en suero en caso de que no se ajuste la dosificación (ver sección 4.2).
Precauciones especiales de empleo
Vancomicina es muy irritante para los tejidos y causa necrosis en el lugar de la inyección si se inyecta intramuscularmente. En la mayoría de pacientes tratados con vancomicina puede aparecer dolor y tromboflebitis que pueden ser ocasionalmente graves. Pueden minimizarse la frecuencia y gravedad de la tromboflebitis mediante la administración del medicamento de forma lenta y como solución diluida (ver sección 6.6) y cambiando de forma periódica los puntos de inyección de la perfusión.
La frecuencia de las reacciones relacionadas con la perfusión (hipotensión, rubor, eritema, urticaria y prurito) aumenta con la administración concomitante de agentes anestésicos. Éste hecho puede reducirse mediante la administración de la vancomicina mediante perfusión como mínimo 60 minutos antes de la inducción anestésica.
Las dosis deben ajustarse en base a los niveles en suero. Se deben controlar los niveles en sangre y la función renal periódicamente.
Como recomendación general, se controlarán las concentraciones 2-3 veces a la semana.
En la utilización durante largo plazo está indicada el control periódico de los niveles en sangre de vancomicina, en particular en los pacientes con trastorno renal o con la función auditiva alterada, así como cuando ocurre una administración concurrente de sustancias nefrotóxicas u ototóxicas, respectivamente.
Se deben hacer controles periódicos de la función auditiva y de los niveles de vancomicina en sangre a los pacientes con una función renal en el límite de la normalidad y en los de más de 60 años. A todos los pacientes que reciben el medicamento se les debe hacer análisis periódicos hematológicos, de orina y de la función renal.
Se han observado concentraciones en suero clínicamente significativas en algunos pacientes tratados para una colitis pseudomembranosa activa debida a C. difficile después de dosis orales múltiples de vancomicina. Por tanto, puede ser apropiado en estos pacientes el control periódico de las concentraciones en suero.
El uso prolongado de vancomicina puede dar lugar a un aumento en el crecimiento de organismos no sensibles. Es esencial la observación cuidadosa del paciente. En caso de ocurrir una sobreinfección durante el tratamiento, deben tomarse las medidas apropiadas. Raramente se han notificado casos de colitis pseudomembranosa producida por C. difficile, desarrollada en pacientes en tratamiento con vancomicina por vía intravenosa. Por tanto, es importante tener en consideración este diagnóstico en los pacientes que presenten diarrea con posterioridad a la administración de vancomicina. Los medicamentos antiperistálticos están contraindicados.
Excipientes
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por vial, por lo que se considera esencialmente “exento de sodio”.
Sj
an
4.5 Interacción con otros medicamentos y otras formas de interacción
Anestésicos
La administración concurrente de vancomicina y agentes anestésicos se ha asociado con eritema, rubor inducido por liberación de histamina y reacciones anafilactoides.
Los efectos relacionados con la perfusión pueden reducirse si la vancomicina se administra como perfusión 60 minutos antes de la inducción anestésica.
Otros medicamentos potencialmente neurotóxicos u ototóxicos
La administración sistémica concurrente o secuencial o la administración tópica de vancomicina con otros principios activos potencialmente neurotóxicos o nefrotóxicos, como gentamicina, anfotericina B, estreptomicina, neomicina, kanamicina, amikacina, tobramicina, bacitracina, polimixina B, colistina, viomicina o cisplatino puede potenciar la nefrotoxicidad y/u ototoxicidad de la vancomicina, por lo que se requiere en consecuencia, una vigilancia cuidadosa del paciente. Ver también la sección 4.2 respecto al ajuste de dosis en el caso del uso junto con un aminoglucósido.
Relajantes musculares
Si se administra vancomicina junto con bloqueantes neuromusculares, existe un potencial aumento del bloqueo neuromuscular.
4.6 Fertilidad, embarazo y lactancia
Embarazo:
No se dispone de suficiente experiencia sobre la seguridad respecto a la utilización de vancomicina durante el embarazo en humanos. Los estudios toxicológicos de reproducción llevados a cabo con animales no sugieren ningún efecto sobre el desarrollo del embrión, feto o del período de gestación (ver sección 5.3).
Sin embargo, la vancomicina penetra en la placenta y no se puede excluir un potencial riesgo de nefrotoxicidad y ototoxicidad embrionaria. En consecuencia, la vancomicina solamente debe administrarse durante el embarazo en caso de que sea claramente necesario y tras una cuidadosa evaluación sobre el riesgo/beneficio.
Lactancia:
La vancomicina se excreta en la leche humana. Vancomicina debe administrarse cuidadosamente a las mujeres en periodo de lactancia debido a la posibilidad de la aparición de efectos adversos en el niño (alteraciones en la flora intestinal con diarrea, colonización con hongos tipo levaduras y posible sensibilización).
Debe considerarse la decisión de suspender la lactancia teniendo en consideración la importancia de este medicamento para la madre.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de vancomicina sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Las reacciones adversas que a continuación se indican se definen utilizando la base de datos de
clasificación de órganos del sistema MedDRA:
muy frecuentes (>1/10);
frecuentes (>1/100 a <1/10);
poco frecuentes (>1/1.000 a <1/100);
raras (>1/10.000 a <1/1.000);
muy raras (<1/10.000),
úfe
an
frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas más frecuentes son flebitis y reacciones pseudoalérgicas relacionadas con una administración intravenosa demasiado rápida de la vancomicina.
Reacciones relacionadas con la perfusión:
Durante o poco después de una perfusión rápida pueden ocurrir reacciones anafilactoides, incluyendo hipotensión, disnea, urticaria o prurito. Puede ocurrir enrojecimiento de la piel de la parte superior del cuerpo (síndrome del hombre rojo), dolor y calambres en los músculos del pecho y espalda.
Las reacciones disminuyen al parar la administración, generalmente entre 20 minutos y 2 horas después de su finalización. Vancomicina debe ser perfundida lentamente (durante más de 60 minutos -ver sección 4.4).
La ototoxicidad se ha observado principalmente en los pacientes a los que se les administran altas dosis o los que siguen un tratamiento concomitante con otros medicamentos ototóxicos, o con una reducción preexistente de la función renal o de la audición.
Trastornos de la sangre y del sistema linfático:
Raras: trombocitopenia, neutropenia, agranulocitosis, eosinofilia.
Trastornos del sistema inmunitario:
Raras: reacciones anafilácticas, reacciones de hipersensibilidad.
Trastornos del oído y del laberinto:
Poco frecuentes: pérdida de audición transitoria o permanente.
Raras: tinnitus, mareos.
Trastornos cardíacos:
Muy raras: parada cardíaca.
Trastornos vasculares:
Frecuentes: disminución de la presión arterial, tromboflebitis.
Muy raras: vasculitis.
Trastornos respiratorios, torácicos y mediastínicos:
Frecuentes: disnea, estridor.
Trastornos gastrointestinales:
Raras: nauseas, diarrea.
Muy raras: enterocolitis pseudomembranosa.
Trastornos de la piel y del tejido subcutáneo:
Frecuentes: exantema e inflamación de las mucosas, prurito, urticaria.
Muy raras: dermatitis exfoliativa, síndrome de Stevens-Johnson, dermatosis bullosa IgA lineal,
síndrome de Lyell.
Trastornos renales y urinarios:
Frecuentes: insuficiencia renal manifestada principalmente por un aumento de la creatinina en
suero.
Raras: nefritis intersticial, fallo renal agudo.
Trastornos generales y alteraciones en el lugar de administración:
Frecuentes: flebitis, enrojecimiento de la parte superior del cuerpo y de la cara, dolor y espasmo
de los músculos del pecho y espalda.
Raras: fiebre medicamentosa, escalofríos.
an
Durante la experiencia post-comercialización se ha notificado erupción medicamentosa con eosinofilia y síntomas sistémicos (Síndrome DRESS).
4.9 Sobredosis
Se ha informado de toxicidad debida a sobredosis. La administración de 500 mg por vía IV a un niño de dos años dio lugar a una intoxicación letal. La administración de un total de 56 g durante 10 días a un adulto, ocasionó insuficiencia renal. En ciertas condiciones de alto riesgo (p.ej. en caso de insuficiencia renal grave) pueden darse niveles altos en suero y oto y nefrotoxicidad.
Medidas en caso de sobredosis
• Se desconoce un antídoto específico.
• Es necesario un tratamiento sintomático mientras se mantiene la función renal.
• La vancomicina se elimina lentamente de la sangre mediante hemodiálisis o diálisis peritoneal. Se ha utilizado la hemofiltración o la hemoperfusión con resinas de polisulfona con el fin de reducir las concentraciones en suero de vancomicina.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antibacterianos glucopéptidos, código ATC: J01XA01 Mecanismo de acción
La vancomicina es un antibiótico glucopéptido tricíclico que inhibe la síntesis de la pared celular de las bacterias sensibles mediante una unión de alta afinidad a la porción D-alanil-D-alanina de las unidades precursoras de la pared celular. El fármaco es bactericida para los microorganismos en división.
Relación PK/PD
Se considera que la actividad de la vancomicina es dependiente del tiempo - lo cual indica que su actividad antimicrobiana depende del tiempo durante el cual los niveles del fármaco superan la concentración mínima inhibitoria (CMI) de un organismo concreto.
Mecanismo de resistencia:
La resistencia adquirida a los glucopéptidos está basada en la adquisición de varios complejos genéticos Van y a la alteración de la D-alanil-D-alanina, diana de acción de los glucopéptidos, a D-alanil-D-lactato o D-alanil-D-serina que se unen débilmente a la vancomicina, debido a la falta del lugar crítico para la unión del hidrógeno. Esta forma de resistencia se observa especialmente en
Enterococcus faecium.
La sensibilidad disminuida o resistencia de Staphylococcus a la vancomicina no está bien definida. Se necesitan varios elementos genéticos y mutaciones múltiples.
Se ha observado resistencia cruzada con teicoplanina.
Sensibilidad:
Vancomicina es activa frente a las bacterias gram positivas. Las bacterias gram negativas son resistentes.
Los puntos de corte CMI que separan los organismos sensibles de los resistentes, son los siguientes:
Recomendaciones de EUCAST (European Committee on Antimicrobial Susceptibility Testing)
|
Sensibles |
Resistentes | |
|
Staphylococcus spp. |
< 2 mg/l |
> 2 mg/l |
|
Enterococcus spp. |
< 4 mg/l |
> 4 mg/l |
|
Streptococcus spp. |
< 2 mg/l |
> 2 mg/l |
5füfi
am
|
Streptococcus pneumoniae |
< 2 mg/l |
> 2 mg/l |
|
Anaerobios gram-positivos |
< 2 mg/l |
> 2 mg/l |
|
Puntos de corte no relacionados con especies específicas * |
< 2 mg/l |
> 4 mg/l |
* Los puntos de corte no relacionados con especies específicas se han determinado principalmente sobre la base de los datos PK/PD y son independientes de las distribuciones CMI de especies específicas. Son para su uso en solamente las especies para las que no se han dado puntos de corte específico y no para aquellas especies en las que no se recomienda realizar sensibilidad.
La prevalencia de la resistencia adquirida puede variar geográficamente y con el tiempo para especies concretas, siendo deseable conocer la información sobre la prevalencia local de resistencias, en particular cuando se están tratando infecciones graves. En el caso de dudas sobre la utilidad del agente en algunos tipos de infección, es necesario el consejo de un experto sobre la prevalencia local de resistencias.
Clases
Microorganismos frecuentemente sensibles Gram positivas
Enterococcus faecalis.
Staphylococcus aureus Staphylococcus coagulasa negativa Streptococcus spp.
Streptococcus pneumoniae
Clostridium spp._
Especies para las cuales la resistencia adquirida puede ser un problema
Enterococcus ^ faecium
Especies con resistencia intrínseca Bacterias Gram negativas
Chlamydia spp.
Mycobacteria Mycoplasma spp.
Rickettsia spp._
5.2 Propiedades farmacocinéticas
Distribución
La vancomicina aparece en varios fluidos corporales, incluyendo el líquido pleural, pericárdico, ascítico y sinovial.
En los adultos, una dosis intravenosa única de 1 g da lugar a concentraciones plasmáticas de 15 a 30 pg/ml 1 hora después de una perfusión de 1 a 2 horas.
El volumen de distribución es de 0,4-1 L/kg. En la bibliografía se cifra la unión de la vancomicina a las proteínas entre un 10% y un 50%. Los factores que afectan a la actividad general de la vancomicina incluyen su distribución en los tejidos, tamaño del inóculo y los efectos de unión a las proteínas.
Biotransformación
La vancomicina se metaboliza solamente en una pequeña proporción. Después de la administración parenteral, se elimina casi completamente como el principio microbiológicamente activo (aprox. 75-90% en 24 horas) a través de filtración glomerular. La eliminación biliar es insignificante (menos del 5% de una dosis).
Eliminación
Sj
an
La semivida de eliminación del suero es de aproximadamente 4-6 horas en adultos con una función renal normal y 2,2-3 horas en los niños. En los pacientes con insuficiencia renal, la semivida de eliminación en el suero puede estar considerablemente prolongada (hasta 7,5 días).
El aclaramiento renal y sistémico total de la vancomicina puede estar reducido en los pacientes de edad avanzada debido a la disminución de la filtración glomerular en este grupo de población.
5.3 Datos preclínicos de seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad y toxicidad a dosis repetidas.
Los escasos datos sobre los efectos mutagénicos muestran resultados negativos, no disponiéndose de estudios a largo plazo sobre el potencial carcinogénico realizados en animales.
No se observaron efectos teratógenos directos o indirectos en los estudios realizados con ratas y conejos en los cuales los animales recibieron dosis que correspondían aproximadamente a las dosis humanas en base a la superficie corporal (mg/m2).
No se dispone de estudios en animales en cuanto a los efectos sobre el uso durante el período perinatal/postnatal y sobre la fertilidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Hidróxido de sodio (para el ajuste del pH)
Ácido clorhídrico (para el ajuste del pH)
6.2 Incompatibilidades
Las soluciones de vancomicina tienen un valor de pH bajo. Esto puede ocasionar una inestabilidad física o química en el caso de que se mezcle con otras sustancias. Se debe evitar la mezcla con soluciones alcalinas. En consecuencia, cada solución parenteral, antes de su utilización, debe comprobarse visualmente en cuanto a la presencia de precipitados y decoloración.
Este medicamento no debe mezclarse con otros excepto con los mencionados en el epígrafe 6.6.
6.3 Periodo de validez
Período de validez del polvo tal y como está acondicionado para la comercialización: 2 años
Período de validez del concentrado reconstituido: el concentrado reconstituido debe ser diluido inmediatamente después de la preparación.
Período de validez del producto diluido:
Se ha demostrado la estabilidad de uso química y física del producto diluido durante 48 horas tanto a 2-8°C como a 25°C cuando ha estado diluido con solución para perfusión de cloruro de sodio 9 mg/ml (0,9%) o solución para perfusión glucosada al 5%.
Desde un punto de vista microbiológico, el medicamento debe utilizarse inmediatamente, a menos que la reconstitución y dilución se hayan llevado a cabo en condiciones asépticas controladas y validadas.
En caso de no utilizarse inmediatamente, los tiempos y condiciones de almacenamiento antes de su uso son responsabilidad del usuario, debiendo durante el almacenamiento, proteger al producto de la luz.
6.4 Precauciones especiales de conservación
Polvo en su envase para la comercialización No conservar a temperatura superior a 25°C.
an
Mantener el vial en el cartonaje exterior para protegerlo de la luz.
Para las condiciones de almacenamiento del medicamento reconstituido y diluido, ver sección 6.3.
6.5 Naturaleza y contenido del envase Hidrocloruro de vancomicina 500 mg:
Polvo en un vial de vidrio (tipo I) cerrado con un tapón de goma (goma de bromobutilo) y sellado con una cápsula de aluminio del tipo “flip off’.
Hidrocloruro de vancomicina 1.000 mg:
Polvo en un vial de vidrio (tipo I) cerrado con un tapón de goma (goma de bromobutilo) y sellado con una cápsula de aluminio del tipo “flip off’.
Tamaños de envase: 1 y 10 viales en una caja de cartón.
Puede que sólo estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
El polvo debe reconstituirse y el concentrado resultante debe diluirse posteriormente antes de su uso. Preparación del concentrado reconstituido
Disolver el contenido de cada vial de 500 mg en 10 ml de agua para preparaciones inyectables estéril.
Disolver el contenido de cada vial de 1.000 mg en 20 ml de agua para preparaciones inyectables estéril.
Un ml de la solución reconstituida contiene 50 mg de vancomicina. El pH de la solución reconstituida es 2,5 a 4,5.
Aspecto de la solución reconstituida
Transparente, de incolora a amarillo pálido, sin partículas visibles o fibras.
Para las condiciones de almacenamiento del medicamento reconstituido, ver sección 6.3.
Preparación de la solución diluida final para la perfusión
Las soluciones reconstituidas que contienen 50 mg/ml de vancomicina deben diluirse posteriormente según el método de administración.
Los diluyentes adecuados son:
Solución para perfusión glucosada al 5%
Solución para perfusión de cloruro de sodio 9 mg/ml (0,9%)
Perfusión intermitente:
La solución reconstituida que contiene 500 mg de vancomicina (50 mg/ml) debe diluirse posteriormente en al menos 100 ml de diluyente.
La solución reconstituida que contiene 1.000 mg de vancomicina (50 mg/ml) debe diluirse posteriormente en al menos 200 ml de diluyente.
La concentración de la solución para perfusión de vancomicina no debe superar los 5 mg/ml.
La dosis deseada debe administrarse de forma lenta por vía intravenosa a una velocidad no superior a los 10 mg/minuto, durante por lo menos 60 minutos o incluso más.
Para las condiciones de almacenamiento del medicamento diluido, ver sección 6.3.
úfe
an
Antes de la administración, las soluciones reconstituidas y diluidas deben ser inspeccionadas visualmente por si hay signos de decoloración y presencia de partículas. Solamente debe utilizarse una solución transparente, incolora o amarillo pálido y sin partículas.
Eliminación
Los viales son para un único uso. El medicamento sin utilizar debe ser eliminado.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Actavis Group PTC ehf.
Reykjavikurvegi 76-78 220 Hafnarfjórdur Islandia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Vancomicina Actavis 500 mg polvo para concentrado para solución para perfusión EFG: 73.205 Vancomicina Actavis 1.000 mg polvo para concentrado para solución para perfusión EFG: 73.228
9. FECHA DE LA PRIMERA AUTORIZACION / RENOVACIÓN DE LA AUTORIZACIÓN
Julio 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
Diciembre 2012