Twinject 0,15 Mg/0,15 Ml Solucion Inyectable En Jeringa Precargada
Información obsoleta, busque otro
agencia española de medicamentos y productos sanitarios
PROSPECTO: INFORMACIÓN PARA EL USUARIO
Twinject 0,15 mg/0,15 ml solución inyectable en jeringa precargada
Epinefrina
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
• Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Contenido del prospecto:
1. Qué es Twinject y para qué se utiliza.
2. Antes de usar Twinject
3. Cómo usar Twinject
4. Posibles efectos adversos
5. Conservación de Twinject
6. Información adicional
1. QUÉ ES TWINJECT Y PARA QUÉ SE UTILIZA
Twinject contiene epinefrina. La epinefrina permite tratar reacciones alérgicas potencialmente mortales reduciendo la hinchazón, relajando los músculos de los pulmones para poder respirar y reduciendo el tamaño de los vasos sanguíneos para aumentar la presión arterial.
Las reacciones alérgicas pueden ser provocadas por picaduras o mordeduras de insectos u otros animales, alimentos, medicamentos, el ejercicio físico o, en ocasiones, por causas desconocidas.
Las reacciones alérgicas potencialmente mortales pueden dificultar la respiración y provocar sibilancias, estornudos, ronquera, urticaria, picor, hinchazón, enrojecimiento cutáneo, taquicardia, pulso débil, una gran ansiedad, confusión, dolor estomacal, pérdida del control de la orina o de las deposiciones (incontinencia), desmayos o desvanecimiento.
La cantidad de epinefrina contenida en este Twinject es suficiente para tratar a un niño que pese entre 15 y 30 kg.
2. ANTES DE TOMAR TWINJECT No use Twinject
• si el paciente es alérgico (hipersensible) a la epinefrina, al sulfito ácido de sodio (E-222) o a cualquiera de los demás componentes de Twinject (ver la sección 6, «Composición de Twinject»).
Sin embargo, si la reacción alérgica que se va a tratar es potencialmente mortal, puede usarse Twinject.
Tenga especial cuidado con Twinject
Indíquele a su médico todas las enfermedades que padece el paciente, especialmente si sufre:
• Una cardiopatía o hipertensión
Correo electrúnicoI
C / CAMPEZO, 1 - EDIFICIO 8 28022 MADRID


• Aumento de la presión ocular (glaucoma)
• Concentraciones elevadas de calcio en la sangre
• Concentraciones reducidas de potasio en la sangre
• Un tumor en la glándula suprarrenal o la próstata
• Diabetes
• Hipertiroidismo
• Asma
• Problemas renales graves
• Enfermedad de Parkinson
O si la paciente está embarazada o es una persona anciana.
Informe a su médico si el paciente o el cuidador sufren alguna enfermedad que dificulte la correcta administración del medicamento, como artritis grave.
Suele transcurrir bastante tiempo entre la administración de Twinject y una reacción alérgica para la cual sea necesario administrar epinefrina. Por lo tanto, debe comprobar el Twinject regularmente y asegurarse de que se sustituye antes de que se supere la fecha de caducidad. Consulte la sección 5 para obtener más información.
Uso en deportistas:
Este medicamento contiene epinefrina que puede producir un resultado positivo en las pruebas de control de dopaje.
Uso de otros medicamentos
Informe a su médico o farmacéutico si el paciente está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
Existen determinados medicamentos que pueden afectar al modo en que el paciente reacciona a Twinject. Asegúrese de indicar a su médico todos los medicamentos que está tomando el paciente, incluso los siguientes:
Fármacos empleados para tratar
• El asma, como por ejemplo la teofilina.
• Las alergias (antihistamínicos), como la difenhidramina o la clorfeniramina.
• La depresión, como la venlafaxina, la selegilina o la amitriptilina.
• Los problemas tiroideos, como la tiroxina.
• La enfermedad de Parkinson, como la levodopa o la entacapona.
• La hipertensión, como el propanolol o el atenolol.
• Las anomalías de la frecuencia cardíaca, como la digital o la digoxina.
• La diabetes, como la insulina o la metformina. Es posible que sea necesario ajustar la dosis de los medicamentos para la diabetes o de la insulina de los pacientes diabéticos tras la utilización de Twinject.
También debe indicarle a su médico si el paciente está tomando oxitocina o si consume alcohol.
Conducción y uso de máquinas
Tras la utilización de Twinject, el paciente debe evitar actividades que pueden ser peligrosas, como conducir, manejar máquinas o ir en bicicleta.
Embarazo y lactancia
Unicamente debe utilizarse Twinject durante el embarazo si las ventajas compensan los riesgos que presenta este medicamento para el feto. Si la reacción alérgica que tiene lugar es potencialmente mortal, debe utilizarse Twinject.
Si está embarazada, en período de lactancia o si planea amamantar a la criatura, consulte a su médico antes de utilizar cualquier medicamento.
Información importante sobre algunos de los componentes de Twinject
Twinject contiene sulfito ácido de sodio (E-222), que puede producir reacciones alérgicas graves y broncoespasmo (sensación repentina de ahogo).
Twinject contiene menos de 23 mg (1 mmol) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
Puede utilizarse Twinject incluso si el paciente es alérgico a los sulfitos en caso de que la reacción alérgica sea potencialmente mortal.
3. CÓMO USAR TWINJECT
Su médico o farmacéutico pueden enseñarle a utilizar Twinject. Siga exactamente las instrucciones de administración de Twinject indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas.
Posología
Niños que pesan entre 15 y 30 kg:
La dosis habitual es de 0,15 mg de epinefrina por inyección en la cara externa del músculo del muslo (de uso intramuscular).
Para los niños que pesan entre más de 30 kg, puede ser más apropiado emplear el producto con la dosis más alta (0,3 mg/0,3 ml).
Tras utilizar Twinject siempre debe solicitar atención médica de urgencia. Dado que Twinject está diseñado exclusivamente para ser administrado como tratamiento de urgencia, siempre debe solicitar asistencia médica inmediatamente después de la utilización de Twinject notificándoselo al médico del paciente, acudiendo al hospital más cercano o llamando a una ambulancia. Asegúrese de indicarle al profesional sanitario que al paciente se le ha administrado una inyección de epinefrina y entregarle el Twinject utilizado para que lo deseche con seguridad.
¿Cómo y cuándo debe utilizar Twinject?
Con cada Twinject pueden administrarse dos inyecciones de epinefrina. El modo en que deben administrarse se indica en las instrucciones paso a paso que se describen a continuación.
Twinject debe inyectarse en la cara externa del muslo. No lo inyecte en los vasos sanguíneos, las manos, los pies o en la nalga. La inyección accidental del producto en las manos o los dedos puede provocar la reducción del riego sanguíneo en estas zonas. Si se inyecta accidentalmente el producto en estas zonas, debe acudir inmediatamente al servicio de urgencias del hospital más cercano para recibir el tratamiento adecuado.
PRIMERA DOSIS
PASO 1
Extraiga el Twinject de la maleta portadora verde.
• Retire el primer capuchón VERDE [con la etiqueta 1] y observará una punta ROJA. Nunca debe poner el pulgar, el dedo o la mano sobre la punta ROJA.

• Retire el segundo capuchón VERDE [con la etiqueta 2].

PASO 2
• Coloque la punta ROJA en la zona media de la cara externa del muslo (la parte superior de la pierna) como se indica en la ilustración. Twinject puede inyectarse por encima de la ropa, incluso de la más gruesa, como por ejemplo unos pantalones vaqueros.
• Presione fuerte hasta que la aguja se introduzca en el muslo (la parte superior de la pierna) atravesando la piel. Manténgala en esa posición mientras cuenta lentamente hasta diez.
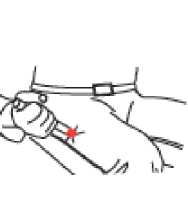
• Extraiga el Twinject del muslo.
• Compruebe la punta ROJA. Si la aguja sobresale, la dosis se ha recibido adecuadamente. Si la aguja no sobresale, repita el paso 2. Asegúrese de que ha extraído los dos capuchones verdes con las etiquetas 1 y 2 antes de repetir el paso 2.
Solicite asistencia médica en este momento.
Mientras espera, debe prepararse para recibir la segunda dosis de Twinject. En la etiqueta de Twinject encontrará las instrucciones.

SEGUNDA DOSIS PASO 1
• Desenrosque y extraiga la punta ROJA. No toque, doble ni rompa la aguja expuesta.
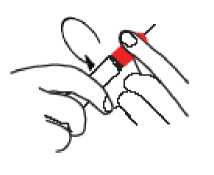
PASO 2
• Sostenga el plástico AZUL y extraiga la jeringa del tambor (no toque la aguja).
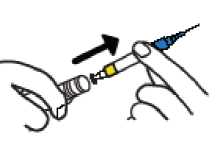
PASO 3
• Retire el precinto AMARILLO del émbolo. Tenga cuidado de no tirar del émbolo al retirar el precinto AMARILLO.
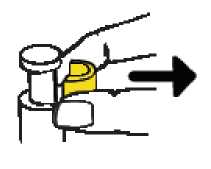
Coloque la jeringa en un lugar seguro y cercano en el cual la aguja quede protegida:
• Es muy importante que manipule la jeringa con mucho cuidado y que intente mantener limpia la aguja.
• También debe avisar a las personas próximas de que hay una aguja expuesta. Esta precaución reducirá el riesgo de inyección accidental.
Si los síntomas no mejoran en un período aproximado de cinco minutos tras la administración de la primera dosis, debe inyectarse la segunda dosis (paso 4).
PASO 4
• Introduzca la aguja en la zona media de la cara extema del muslo (la parte superior de la pierna) atravesando la piel, como se indica en la ilustración.
• Presione el émbolo hasta que alcance su recorrido completo.

Jeringa

Émbolo
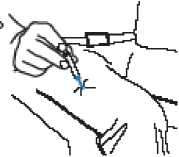
• Extraiga la jeringa del Twinject de la piel.
TRAS SU USO
Puede notar que queda una pequeña cantidad de líquido en la jeringa tras la administración de las dos dosis. Es normal.
Tras utilizar Twinject (ya se haya administrado la segunda dosis o no), no intente volver a colocar el capuchón que cubre la aguja, dado que puede pincharse.
Coloque la jeringa en la maleta de transporte con la aguja hacia abajo.
Coloque la otra mitad de la maleta de transporte y ciérrela.
Asegúrese de obtener un Twinject nuevo para sustituir el que se ha utilizado.
Si usa más Twinject del que debiera
Si cree que ha utilizado más Twinject del que debiera, acuda al médico inmediatamente para recibir un tratamiento adecuado. Una dosis demasiado grande de epinefrina (Twinject) puede provocar una hipertensión peligrosa, un ictus, una hemorragia cerebral, arritmia cardíaca, anomalías en la función renal, constricción de los vasos sanguíneos y líquido en los pulmones o incluso la muerte.
En caso de sobredosis o ingestión accidental, consulte inmediatamente a su médico o farmacéutico o llame al Servicio de Información Toxicológica, teléfono: 91 562 04 20, indicando el medicamento y la cantidad ingerida.
Si tiene cualquier otra duda sobre el uso de este producto, consulte a su médico o farmacéutico.
4. POSIBLES EFECTOS ADVERSOS
Al igual que todos los medicamentos, Twinject puede producir efectos adversos, aunque no todas las personas los sufran.
Twinject (epinefrina) puede provocar las siguientes reacciones adversas:
Sudoración, ansiedad, nerviosismo, temblores, dolor de cabeza, frecuencia cardíaca inusualmente elevada o reducida, mareos, frialdad de la piel y las extremidades, dificultades respiratorias o dolor torácico, líquido en los pulmones, náuseas, vómitos, debilidad, palidez, alucinaciones, tamaño anómalo de las pupilas, desfallecimiento, hipertensión, problemas renales o incapacidad para orinar.
También puede provocar una concentración elevada de glucosa o ácido en la sangre o una baja concentración de potasio en la sangre.
En ocasiones, en dosis altas o pacientes susceptibles, puede presentarse un aumento súbito de la presión arterial que puede causar una hemorragia cerebral, arritmia e infarto de miocardio y reducción del riego sanguíneo en la piel, los tejidos mucosos y los riñones.
Twinject contiene sulfito ácido de sodio que puede provocar reacciones alérgicas posiblemente graves o potencialmente mortales o causar crisis asmáticas graves en determinados pacientes susceptibles.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
5. CONSERVACIÓN DE TWINJECT
Manténgase fuera del alcance y de la vista de los niños.
No utilice Twinject después de la fecha de caducidad que aparece en el envase después de <CAD>. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a los 25 °C.
No refrigerar o congelar.
Conservar en el embalaje original para protegerlo de la luz.
Compruebe Twinject con regularidad para asegurarse de lo siguiente:
• Que no ha caducado.
• Que el medicamento que contiene Twinject no esté turbio o haya cambiado de color.
Si el Twinject está turbio, ha cambiado de color o ha caducado, pídale a su médico que le facilite uno nuevo.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. INFORMACIÓN ADICIONAL Composición de Twinject
El principio activo es la epinefrina. Una dosis contiene 0,15 mg (0,15 ml) de epinefrina. La jeringa precargada puede administrar dos dosis de 0,15 ml de epinefrina.
Los demás componentes son cloruro sódico, hemihidrato de clorobutanol, bisulfito sódico (E222), ácido clorhídrico, hidróxido de sodio y agua para inyectables.
Aspecto de Twinject y contenido del envase
Twinject es una solución inyectable en jeringas precargadas.
La solución es transparente e incolora y prácticamente no presenta partículas.
Twinject se presenta en:
• Una jeringa precargada en cada envase o
• Dos jeringas precargadas en un envase con una jeringa sin aguja para fines de demostración. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Shionogi Ireland Airside Business Park County Dublin Irlanda
Este medicamento está autorizado en los Estados miembro del Espacio Económico Europeo con los siguientes nombres:
Austria
Bélgica
Bulgaria
República Checa Chipre Dinamarca Finlandia
Francia
Alemania
Grecia
Italia
Luxemburgo
Malta
Países Bajos
Noruega
Polonia
Portugal
Rumanía
República Eslovaca Eslovenia España Reino Unido

Twinject 0,15 mg/0,15 ml Injektionslosung in einer Fertigspritze Twinject 0,15 mg/0,15 ml oplossing voor injectie in voorgevulde spuit Twinject 0,15mg/0,15 ml Injektionslosung in Fertigspritze Twinject 0,15 mg/0,15 ml, solution injectable en seringue préremplie Twinject 0,15 mg/0,15 ml HH^e^HOHeH pa3TBop b npegBapuTeaHO HanMHeHa
cnpHH^BKa
Twinject 0,15 mg/ 0,15 ml injekcní roztok v predplnené stnkacce Twinject 0,15 mg/0,15 ml Arákupa yra svson os npoyspropsvsg oópryysg Twinject 0,15 mg/0,15 ml injektionsv^ske, oplosning, i fyldt injektionssprojte Twinject 0,15 mg/0,15 ml injektioliuos esitaytetyssa ruiskussa Twinject 0,15 mg/0,15 ml injektionsvatska i forfylld spruta Twinject 0,15 mg /0,15 ml Solution injectable en seringue préremplie Twinject 0,15mg/0,15 ml Injektionslosung in Fertigspritze Twinject 0,15 mg/0,15 ml Arákupa yra svson os npoyspropsvsg oópryysg Twinject 0,15 mg/0,15 ml - Soluzione iniettabile in siringa preriempita Twinject 0,15 mg/0,15 ml oplossing voor injectie in voorgevulde spuit Twinject 0,15mg/0,15 ml Injektionslosung in Fertigspritze Twinject 0,15 mg/0,15 ml, solution injectable en seringue préremplie Twinject 0.15 mg/0.15 ml soluzzjoni ghal injezzjoni f siringa mimlija lesta Twinject 0,15 mg/0,15 ml oplossing voor injectie in voorgevulde spui Adrenalin Shionogi 0,15 mg/dose injeksjonsv^ske, opplosning i ferdigfylt Twinject 0,15 mg/0,15 ml roztwór do wstrzykiwan w ampulko-strzykaw Twinject 0,15 mg / 0,15 ml solu^ao injectável em seringa pré-cheia Twinject 0,15 mg/0,15 ml solutie injectabilá in seringa preumplutá Twinject 0,15 mg/0,15 ml roztoku na injekciu v predplnenej striekacke Twinject 0,15 mg/0,15 ml raztopina za injiciranje v napolnjeni injekcijski Twinject 0,15 mg/0,15 ml solución inyectables en una jeringa precargada Twinject 0.15 mg/0.15 ml solution for injection in pre-filled syringe
Este prospecto ha sido aprobado en Agosto de 2010
Agencia española de
medicamentos y
productos sanitarios