Tredaptive 1000 Mg/20 Mg Comprimidos De Liberacion Modificada
Información obsoleta, busque otro&
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
O*

1. NOMBRE DEL MEDICAMENTO
Tredaptive 1.000 mg/20 mg comprimidos de liberación modificada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido de liberación modificada contiene 1.000 mg de ácido nicotínico y 20 mg de laropiprant.
Excipiente con efecto conocido:
Cada comprimido de liberación modificada contiene 128,4 mg de lactosa monohidrato.
Para consultar la lista completa de excipientes, ver sección 6.1.
scrip
&
3. FORMA FARMACÉUTICA
Comprimido de liberación modificada (comprimido).
Comprimido con forma ovalada de color blanco a blanquecino y con la inscripción “552” en una cara.
4.1 Indicaciones terapéuticas
Tredaptive esta indicado para el tratamiento de la dislipidemia, especialmente en pacientes adultos con dislipidemia combinada mixta (caracterizada por unas concentraciones elevadas de colesterol LDL y de triglicéridos y por unas concentraciones bajas de colesterol HDL) y en pacientes
4
DATOS CLÍNICOS
adultos con hipercolesterolemia primaria (he
O
Tredaptive debe usarse en los paci (estatinas) cuando el efecto hipo HMG-CoA reductasa en mon en los que los inhibidores

conc
teroc
ocigótica familiar o no familiar).
es en combinación con inhibidores de la HMG-CoA reductasa erolemiante conseguido con los inhibidores de la ia es insuficiente. Sólo puede usarse en monoterapia en pacientes G-CoA reductasa no son tolerados o no están indicados. Durante
el tratamiento con Tredaptive debe seguirse una dieta y otros tratamientos no farmacológicos (p.ej.,
ejercicio, reducción de peso).
ía y fori
4.2 Posología y forma de administración
Posología
La dosis inicial es de un comprimido (1.000 mg de ácido nicotínico y 20 mg de laropiprant) una vez al día. Después de cuatro semanas, se recomienda que los pacientes empiecen a tomar la dosis de mantenimiento de 2.000 mg/40 mg en forma de dos comprimidos (1.000 mg/20 mg cada uno) una vez al día. No se han estudiado dosis diarias superiores a 2.000 mg/40 mg, por lo que no se recomiendan.
Si se deja de tomar Tredaptive durante menos de 7 días consecutivos, los pacientes pueden reanudar el tratamiento con la última dosis administrada. Si se deja de tomar Tredaptive durante 7 o más días consecutivos, el tratamiento debe reanudarse a la dosis de 1.000 mg/20 mg durante 1 semana antes de pasar a la dosis de mantenimiento de 2.000 mg/40 mg.
Los pacientes que estén tomando un medicamento de liberación prolongada con 2.000 mg o más de ácido nicotínico y cambien a Tredaptive, pueden iniciar el tratamiento con Tredaptive en la dosis de
2.000 mg/40 mg. Los pacientes que estén tomando un medicamento de liberación prolongada que contenga menos de 2.000 mg de ácido nicotínico y cambien a Tredaptive, deben iniciar el tratamiento en la dosis inicial de 1.000 mg/20 mg y después de cuatro semanas pasar a recibir la dosis de mantenimiento de 2.000 mg/40 mg. Los pacientes que estén tomando un medicamento de liberación inmediata con ácido nicotínico y cambien a Tredaptive, deben iniciar el tratamiento en la dosis de
1.000 mg/20 mg y después de cuatro semanas pasar a recibir la dosis de mantenimiento de
2.000 mg/40 mg.
Pacientes de edad avanzada
No es necesario ajustar la dosis en los pacientes de edad avanzada.
Población _ pediátrica
No se ha establecido la seguridad y la eficacia de Tredaptive en pacientes pediátricos menores de 18 años. No hay datos disponibles.
Pacientes con insuficiencia hepática o renal
No se ha estudiado el uso de Tredaptive en los pacientes con insuficiencia hepática o renal. Al igual que otros medicamentos que contienen ácido nicotínico, Tredaptive está contraindicado en los pacientes con disfunción hepática importante o inexplicable. Debe usarse con precaución en los pacientes con insuficiencia renal, porque el ácido nicotínico y sus metabolitos se excretan principalmente por los riñones (ver secciones 4.3, 4.4 y 5.2).
q>>
Tratamiento concomitante
El ácido acetilsalicílico no produce una reducción adicional de la rubefacción aparte de la conseguida con Tredaptive. Por tanto, el tratamiento con ácido acetilsalicílico para aliviar los síntomas de rubefacción no es necesario (ver sección 5.1).
dores d
&
Puesto que la administración concomitante con secuestradores de los ácidos biliares puede reducir la biodisponibilidad de medicamentos que contienen ácidos como el ácido nicotínico, se recomienda que Tredaptive se administre 1 hora antes o 4 horas después de la administración de un secuestrador de los ácidos biliares (ver sección 4.5).
•c\
Forma de administración
Los comprimidos deben ingerirse enteros, junto con alimentos, por la noche o a la hora de acostarse. Para mantener las propiedades de liberación modificada, no hay que partir, romper, machacar o
e ingerirlo. Para reducir la posibilidad de presentar rubefacción, no
masticar el comprimido antes de in deben tomarse bebidas alcohólicas ni bebidas calientes ni comer comidas picantes cuando se ingiera el medicamento.
&
Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección unción
6.1.
Disfunción hepática importante o inexplicable. Úlcera péptica activa.
Sangrado arterial.
4.4 Advertencias y precauciones especiales de empleo
Cuando Tredaptive se administre junto con una estatina, consulte la ficha técnica de dicho medicamento.
Efectos hepáticos
No se ha estudiado el cambio de ácido nicotínico de liberación inmediata (cristalino) a Tredaptive. Sin embargo, se han notificado casos de toxicidad hepática grave, como necrosis hepática fulminante, en pacientes que pasaron de tomar productos de ácido nicotínico de liberación inmediata a tomar productos de ácido nicotínico de acción prolongada en dosis equivalentes. Por tanto, en los pacientes que cambien de ácido nicotínico de liberación inmediata a Tredaptive, la dosis inicial de Tredaptive debe ser la de 1.000 mg/20 mg.
Tredaptive debe usarse con precaución en los pacientes que consumen grandes cantidades de alcohol y en los que tienen antecedentes de hepatopatías.
Al igual que otros tratamientos hipolipemiantes, los medicamentos con ácido nicotínico se han asociado a resultados anormales de las pruebas de la función hepática (ver sección 4.8). Los aumentos de las transaminasas fueron reversibles después de suspender el tratamiento.
Se recomienda hacer pruebas de la función hepática antes del inicio del tratamiento, cada 6 a 12 semanas durante el primer año de tratamiento y periódicamente (p.ej., dos veces al año) en los años siguientes. Hay que vigilar a los pacientes que presentan concentraciones elevadas de transaminasas hasta que las anomalías se resuelvan. Si un paciente presenta una concentración de alanina aminotransferasa (ALT) o de aspartato aminotransferasa (AST) > 3 X LSN y este valor elevado persiste, se recomienda reducir la dosis o suspender el tratamiento con Tredaptive.
Efecto sobre el músculo esauelético &
Se han asociado casos raros de miopatía/rabdomiolisis a la administración concomitante de ácido nicotínico en dosis que alteran los lípidos (> 1.000 mg/día) e inhibidores de la HMG-CoA reductasa (estatinas) (ver sección 4.8).
•’C^
Los médicos que se planteen prescribir un tratamiento de combinación con estatinas y Tredaptive deben sopesar detenidamente los efectos beneficiosos y los riesgos potenciales y deben vigilar estrechamente a los pacientes para poder detectar cualquier signo o síntoma de dolor muscular, dolor muscular a la palpación o debilidad muscular, especialme nte d urante los primeros meses de tratamiento y cuando se aumente la dosis de cualquiera de los medicamentos. En dichas situaciones hay que hacer análisis periódicos de la creatinina cinasa (CK) sérica, pero no hay ninguna garantía de que dicho control evite la aparición de miopatía grave.
Hay que actuar con precaución en pacientes con factores de predisposición a la rabdomiolisis.
Edad > 70 años Insuficiencia renal Hipotiroidismo no controlado
Antecedentes personales o familiares de trastornos musculares hereditarios Historia previa de toxicidad muscular con una estatina o un fibrato Alcoholismo.
Si aparece dolor muscular, debilidad o calambres mientras un paciente toma Tredaptive con una estatina, deberán medirse sus concentraciones de CK. Si, en ausencia de un esfuerzo extenuante, se encuentra que dichos niveles están significativamente elevados (> 5 x LSN), deberá detenerse el tratamiento.
Raza
En un análisis intermedio de un ensayo clínico actualmente en curso, un comité independiente de seguimiento de la seguridad, identificó una incidencia más alta a la esperada de miopatía en pacientes de raza china que tomaban Tredaptive y simvastatina 40 mg. Por tanto, se debe tener precaución cuando se traten pacientes de raza china con Tredaptive junto con simvastatina o ezetimiba/simvastatina (particularmente simvastatina a dosis de 40 mg o superiores). Puesto que el riesgo de miopatía con el uso de estatinas está relacionado con la dosis, no se recomienda el uso de Tredaptive junto con simvastatina 80 mg o ezetimiba/simvastatina 10/80 mg en pacientes de raza china. Se desconoce si existe un riesgo aumentado de miopatía en otros pacientes asiáticos tratados con Tredaptive en combinación con simvastatina o ezetimiba/simvastatina.
Dis función renal
Puesto que el ácido nicotínico y sus metabolitos se excretan por los riñones, Tredaptive debe usarse con precaución en los pacientes con disfunción renal.
Efecto sobre la glucosa
Los medicamentos con ácido nicotínico se han asociado a aumentos de las concentraciones sanguíneas de glucosa en ayunas (ver sección 4.8). Hay que vigilar estrechamente a los pacientes diabéticos o potencialmente diabéticos. Puede que sea necesario modificar la dieta o el tratamiento hipoglucemiante.
Síndrome coronario agudo
Al igual que otros medicamentos con ácido nicotínico, hay que tener precaución cuando Tredaptive se use en pacientes con angina inestable o que estén en la fase aguda de un infarto de miocardio (IM), especialmente si dichos pacientes reciben también medicamentos vasoactivos como nitratos, antagonistas del calcio o antagonistas de los receptores adrenérgicos.
Efectos hematológicos
e asoció a
Al igual que otros medicamentos con ácido nicotínico, Tredaptive (2.000 mg/40 mg) sí pequeñas reducciones del recuento de plaquetas (ver sección 4.8). Por tanto, hay que evaluar cuidadosamente a los pacientes sometidos a cirugía.
Efecto sobre el ácido úrico
Al igual que otros medicamentos con ácido nicotínico, Tredaptive (2.000 mg/40 mg) se asoció a pequeños aumentos de las concentraciones de ácido úrico (ver sección 4.8). Por tanto, Tredaptive debe usarse con precaución en los pacientes con gota o con predisposición a tener gota.
Hipofosfatemia
Al igual que otros medicamentos con ácido nicotínico, Tredaptive se asoció a pequeños descensos de las concentraciones de fósforo. Por tanto, hay que vigilar estrechamente a los pacientes con riesgo de hipofosfatemia.
r&
Otras informaciones
Al igual que otros medicamentos con ácido nicotínico, hay que vigilar estrechamente a los pacientes con antecedentes de ictericia, trastornos hepatobiliares o úlcera péptica (ver secciones 4.2 y 4.3).
Qr

Excipiente
os pacientes con intolerancia hereditaria a galactosa, de insuficiencia de n de glucosa o galactosa no deben tomar este medicamento.
Tredaptive contiene lact lactasa Lapp o malab
<*'
4.5 Interacción con otros medicamentos y otras formas de interacción
El consumo de bebidas alcohólicas o bebidas calientes o la ingestión de comidas picantes pueden potenciar los efectos de la rubefacción y por tanto deben evitarse cuando se tome Tredaptive.
Ácido nicotínico
Efectos del ácido nicotínico sobre otros medicamentos
Tratamiento antihipertensivo: El ácido nicotínico puede potenciar los efectos de medicamentos que bloquean los ganglios y de medicamentos vasoactivos como nitratos, antagonistas del calcio y antagonistas de los receptores adrenérgicos, y producir hipotensión postural.
Inhibidores de la HMG-CoA reductasa: Cuando simvastatina se combinó con ácido nicotínico se observó un aumento moderado del AUC y de la Cmáx del ácido de simvastatina (la forma activa de la simvastatina), que puede que no tenga relevancia clínica. La interacción farmacocinética de Tredaptive con estatinas se ha estudiado sólo con simvastatina (ver sección 4.4).
Efectos de otros medicamentos sobre el ácido nicotínico
Secuestradores de los ácidos biliares: Como la administración concomitante de secuestradores de los ácidos biliares puede reducir la biodisponibilidad de los medicamentos ácidos como el ácido nicotínico, se recomienda que Tredaptive se administre 1 hora antes o 4 horas después de la administración de un secuestrador de los ácidos biliares.
Suplementos que contienen ácido nicotínico: No se ha estudiado la administración concomitante de Tredaptive y polivitamínicos u otros suplementos nutricionales que contienen (> 50 mg/día) ácido nicotínico (o de nicotinamida). Los médicos deben tener en cuenta la ingesta de ácido nicotínico procedente de polivitamínicos y suplementos nutricionales a la hora de prescribir Tredaptive.
Interacciones entre el medicamento y análisis de laboratorio: El ácido nicotínico puede producir reacciones falsas positivas en los análisis de glucosa en la orina cuando se utiliza una solución de sulfato de cobre (reactivo de Benedict).

Laropiprant
Efectos de laropiprant sobre otros medicamentos
Midazolam: La administración de dosis múltiples de 40 mg de laropiprant no afectó a la farmacocinética de midazolam, que es un substrato sensible de la CYP3A4. Por tanto, laropiprant no es un inductor ni un inhibidor de la CYP3A4. Sin embargo, la concentración plasmática de 1'-hidroximidazolam, un metabolito de midazolam, aproximadamente se duplicó con la administración de dosis múltiples de laropiprant. Como 1'-hidroximidazolam es un metabolito activo, el efecto sedante de midazolam podría aumentar y hay que actuar con precaución cuando laropiprant se administre conjuntamente con midazolam.
laropip
Otros medicamentos: La administración concomitante de laropiprant 40 mg con midazolam incrementó el AUC0-<X) y la Cmáx de E-hidroximidazolam, un metabolito de midazolam, en un 98 % y un 59 %, respectivamente. E-hidroximidazolam es metabolizado predominantemente por las uridina difosfato-glucuronosiltransferasas (UGT) 2B4 y 2B7. Los resultados de ensayos clínicos y de estudios in vitro respaldan la conclusión de que laropiprant es un inhibidor de leve a moderado de la UGT2B4 y la UGT2B7. Muy pocos medicamentos son metabolizados predominantemente por la UGT2B4 o la UGT2B7. Hay que actuar con precaución cuando Tredaptive se administre conjuntamente con medicamentos metabolizados predominantemente por la UGT2B4 o la UGT2B7, como zidovudina.
En estudios de interacción, laropiprant no tuvo efectos clínicamente significativos sobre la farmacocinética de los siguientes medicamentos: simvastatina, warfarina, anticonceptivos orales, rosiglitazona y digoxina. Según estos datos, no cabe esperar que laropiprant interaccione con substratos de las isoenzimas 3A4, 2C9 y 2C8 del CYP ni con substratos de la glucoproteína P humana (P-gp). En estudios in vitro, laropiprant no inhibió las reacciones mediadas por la CYP1A2, la CYP2B6, la CYP2C19, la CYP2D6 o la CYP2E1.
el: En u
Clopidogrel: En un ensayo clínico, no se observó un efecto significativo de laropiprant sobre la inhibición de la agregación plaquetaria inducida por el adenosin difosfato (ADP) causada por clopidogrel, pero hubo un aumento moderado de la inhibición de la agregación plaquetaria inducida por el colágeno causada por clopidogrel. Este efecto es poco probable que sea clínicamente importante ya que laropiprant no aumentó el tiempo de sangrado cuando se administró conjuntamente con clopidogrel a lo largo del intervalo de dosificación.
Ácido acetilsalicílico: En un ensayo clínico, la administración concomitante de laropiprant y ácido acetilsalicílico no tuvo un efecto sobre la agregación plaquetaria inducida por el colágeno ni sobre el tiempo de sangrado en comparación con el tratamiento con ácido acetilsalicílico en monoterapia (ver sección 5.1).
Ácido acetilsalicílico y clopidogrel: En un ensayo clínico en pacientes dislipémicos que recibían tanto ácido acetilsalicílico (81 mg) como clopidogrel (75 mg), laropiprant produjo una inhibición transitoria (4 horas después de la dosis) de la función plaquetaria in vivo (evaluada mediante estudios de tiempo
de sangrado y de agregación plaquetaria), pero tuvo poco efecto sobre el intervalo de dosis. Los pacientes tratados con Tredaptive concomitantemente con ácido acetilsalicílico y clopidogrel deben estar estrechamente vigilados, tal como recomienda el Resumen de las Características del Producto de estos medicamentos y deben ser informados de que pueden tardar más de lo habitual en detener una hemorragia y de que deben comunicar a su médico cualquier hemorragia anómala (lugar o duración).
Efectos de otros medicamentos sobre laropiprant
Inhibidores de la CYP3A4: Claritromicina (un inhibidor potente de la CYP3A4 y de la P-gp) no tuvo un efecto clínicamente significativo sobre la farmacocinética de laropiprant. Laropiprant no es un substrato de la P-gp humana, por lo que tampoco cabe esperar que otros inhibidores de la CYP3A4 o de la P-gp tengan un efecto clínicamente significativo sobre la farmacocinética de laropiprant.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Tredaptive
No hay datos relativos al uso concomitante de ácido nicotínico y laropiprant en mu
&
embarazadas. desconoce el
riesgo potencial para los seres humanos. Por tanto, no debe utilizarse Tredaptive a no ser que sea claramente necesario.
Ácido nicotínico
No hay datos suficientes relativos al uso de ácido nicotínico a dosis altas en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para el desarrollo fetal con dosis altas de ácido nicotínico (ver sección 5.3).
Laropiprant
No hay datos relativos al uso de laropiprant en muj animales han mostrado toxicidad para el desarro
La combinación no se ha ensayado en estudios de toxicidad para la reproducción. Se
ve durante el embarazo
5.3).

es e
para el
&
mbarazadas. Los estudios realizados en tal con dosis altas de laropiprant (ver sección
Lactancia
Tredaptive
No se ha realizado ningún estudio con Tredaptive en animales en período de lactancia. La decisión de continuar o interrumpir el periodo de lactancia o de continuar o interrumpir el tratamiento debe tomarse teniendo en cuenta el efecto beneficioso de la lactancia materna para el niño y el efecto beneficioso de Tredaptive para la mujer.
Ácido nicotínico El ácido nico
&
cotínico
nt
se
excreta en la leche materna humana.
Laropiprant
Se desconoce si laropiprant se excreta en la leche materna humana. Estudios en animales han mostrado que laropiprant se excreta por la leche.
Fertilidad
Los estudios en animales son insuficientes para determinar el deterioro en la fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
A la hora de conducir vehículos o utilizar máquinas se debe tener en cuenta que se han notificado casos de mareo (ver sección 4.8).
4.8 Reacciones adversas
En los ensayos clínicos, más de 5.700 pacientes recibieron Tredaptive en monoterapia o en combinación con un inhibidor de la HMG-CoA reductasa.
Resumen del perfil de seguridad
La rubefacción es la reacción adversa más frecuente de Tredaptive. La rubefacción se observa sobre todo en la cabeza, el cuello y la parte superior del torso. Según un análisis agrupado de cuatro ensayos clínicos controlados con fármaco o con placebo (N = 4.747, n=2.548 tomando Tredaptive), se comunicó rubefacción en el 12,3 % de los pacientes que recibieron Tredaptive. En estos ensayos, los porcentajes de pacientes que se retiraron por un síntoma relacionado con la rubefacción (enrojecimiento, calor, prurito y hormigueo) y que recibieron Tredaptive, ácido nicotínico (formulaciones de liberación prolongada agrupadas) o placebo/simvastatina en combinación, fueron del 7,2 %, 16,6 % y 0,4 % respectivamente.
Lista tabulada de reacciones adversas x^
Con Tredaptive, (con o sin una estatina) se han notificado las siguientes reacciones adversas durante los ensayos clínicos y/o el uso post-comercialización.
Las frecuencias de las reacciones adversas se clasifican de la forma siguiente: Muy frecuentes (> 1/10), Frecuentes (> 1/100 a < 1/10), Poco frecuentes (> 1/1.000 a < 1/100),
Raras (> 1/10.000 a < 1/1.000), Muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Sistema de clasificación de órganos |
Reacción adversa -<V/ |
|
Infecciones e infestaciones |
Raras: rinitis |
|
Trastornos del sistema inmunológico |
Poco frecuentes: reacción de hipersensibilidad (ver más adelante) Raras: angioedema; hipersensibilidad tipo I Frecuencia no conocida: shock anafiláctico |
|
Trastornos del metabolismo y de la nutrición |
Poco frecuentes: gota Raras: alteración de la tolerancia a la glucosa |
|
Trastornos psiquiátricos |
Poco frecuentes: insomnio Raras: ansiedad |
|
Trastornos del sistema nervioso ¿y <$> |
Frecuentes: cefalea; parestesia Poco frecuentes: mareo Raras: migraña; síncope |
|
Trastornos cardiacos |
Poco frecuentes: palpitaciones Raras: fibrilación auricular y otras arritmias cardiacas; taquicardia |
|
Trastornos vasculares V' |
Muy frecuentes: rubefacción Poco frecuentes: hipotensión Raras: hipotensión ortostática |
|
Trastornos respiratorios, torácicos y mediastínicos |
Poco frecuentes: disnea |
|
Trastornos gastrointestinales |
Frecuentes: dolor abdominal; diarrea; dispepsia; náuseas; vómitos Raras: edema de la boca; eructos; úlcera péptica |
|
Trastornos hepatobiliares |
Frecuencia no conocida: ictericia |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes: eritema; prurito; erupción; urticaria Poco frecuentes: piel seca; erupción macular Raras: acanthosis nigricans; hiperpigmentación; sudoración (sudor por la noche o sudor frío) Frecuencia no conocida: erupción vesicular o vesicoampollar |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes: mialgia Raras: pérdida de fuerza muscular |
|
Sistema de clasificación de órganos |
Reacción adversa |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes: sensación de calor Poco frecuentes: escalofríos; dolor; edema periférico Raras: astenia; edema de la cara; edema generalizado |
|
Exploraciones complementarias |
Frecuentes: elevaciones de la ALT y/o la AST (consecutivas, > 3 X LSN), glucosa en ayunas (ver más adelante) Poco frecuentes: elevaciones de CK (> 10 X LSN), LDH, ácido úrico (ver más adelante) Raras: elevaciones de la bilirrubina total, amilasa; reducciones del fósforo y recuentos de plaquetas (ver más adelante) |
Reacciones de hipersensibilidad
Se ha notificado una reacción de hipersensibilidad aparente (en < 1 % de los pacientes). Se caracteriza por diversos síntomas, como angioedema, prurito, eritema, parestesia, pérdida de la conciencia, vómitos, urticaria, rubefacción, disnea, náuseas, incontinencia urinaria y fecal, sudor frío, temblores, escalofríos, aumento de la presión arterial, hinchazón de los labios, sensación de quemazón, erupción farmacológica, artralgia, hinchazón de las piernas y taquicardia.
Exploraciones complementarias
ransaminasas séricas (ver tos clínicamente relevantes
Se han notificado infrecuentemente aumentos notables y persistentes sección 4.4). En los ensayos clínicos controlados, la incidencia de au de las transaminasas séricas (valores de ALT y/o de AST > 3 X LSN en análisis consecutivos) fue del
1,0 % en los pacientes tratados con Tredaptive con o sin una estatina. Estos aumentos fueron generalmente asintomáticos y volvieron a los valores basales tanto si se suspende el tratamiento como si se continúa.
*s?
Se observaron aumentos clínicamente relevantes de la CK (valores > 10 X LSN) en el 0,3 % de los pacientes tratados con Tredaptive con o sin una estatina (ver sección 4.4).
Otros valores analíticos anormales notificados fueron aumentos de la LDH, la glucosa en ayunas, el ácido úrico, la bilirrubina total, la amilasa, reducciones del fósforo y de los recuentos de plaquetas (ver sección 4.4).
Al igual que otros medicamentos con ácido nicotínico, en ensayos clínicos controlados con Tredaptive (2.000 mg/40 mg) se notificaron elevaciones de la glucosa en ayunas (un aumento medio de aproximadamente 4 mg/dl) y del ácido úrico (cambio medio desde el inicio de +14,7 %) y reducciones de los recuentos de plaquetas (cambio medio desde el inicio de -14,0 %) (ver sección 4.4). En los pacientes diabéticos se observó un aumento medio de la HbA1c del 0,2 % (en los casos en que estaba permitido modificar el tratamiento hipoglucemiante).
Reacciones adversas adicionales notificadas con otros medicamentos con ácido nicotínico Se incluyen las siguientes reacciones adversas adicionales notificadas con otros medicamentos con ácido nicotínico (con o sin estatina) en el uso post-comercialización o en los ensayos clínicos:
Trastornos oculares: Edema macular cistoide, ambliopía tóxica.
4.9 Sobredosis
Tredaptive
En caso de sobredosis, es razonable emplear las medidas de apoyo habituales y tratar los síntomas. Se han notificado casos de sobredosis; la dosis máxima de Tredaptive tomada fue de 5.000 mg/100 mg. Todos los pacientes se recuperaron sin secuelas. Las reacciones adversas notificadas con más frecuencia en los sujetos que recibieron esta dosis tan alta fueron las esperadas para una dosis alta de ácido nicotínico y consistieron en: rubefacción, cefalea, prurito, náuseas, mareos, vómitos, diarrea, dolor o malestar epigástrico y abdominal y dolor de espalda. Las anomalías de laboratorio fueron aumentos de la amilasa y la lipasa, disminución del hematocrito y sangre oculta en las heces.
Acido nicotínico
En caso de una sobredosis de ácido nicotínico hay que emplear las medidas de apoyo.
Laropiprant
En los ensayos clínicos controlados realizados en sujetos sanos, se toleraron generalmente bien dosis únicas de hasta 900 mg y dosis múltiples de hasta 450 mg de laropiprant administradas una vez al día durante 10 días. No existe experiencia con dosis de más de 900 mg de laropiprant en los seres humanos. Se observó prolongación de la agregación plaquetaria inducida por el colágeno en sujetos que recibieron dosis múltiples de 300 mg o superiores (ver sección 5.1).
&
5. PROPIEDADES FARMACOLOGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos modificadores de lípidos, ácido nicotínico y derivados, código ATC: C10AD52.
Tredaptive contiene ácido nicotínico, el cual en dosis terapéuticas es un fármaco que modifica los lípidos, y laropiprant, que es un antagonista potente y selectivo de los receptores de prostaglandina D2 (PGD2) del subtipo 1 (DPi). El ácido nicotínico reduce las oonHntraciones de colesterol asociado a lipoproteínas de baja densidad (C-LDL), colesterol total (CT), colesterol asociado a lipoproteínas de muy baja densidad (C-VLDL), apolipoproteína B (apo B, la principal proteína LDL), triglicéridos (TG) y lipoproteína(a) (Lp(a), una partícula LDL modificada), e incrementa las concentraciones de colesterol asociado a lipoproteínas de alta densidad (C-HDL) y apolipoproteína A-I (apo A-I, el principal componente proteínico de las HDL). Laropiprant suprime la rubefacción mediada por la PGD2 asociados a la administración de ácido nicotínico. Laropiprant no afecta a las concentraciones de lípidos ni interfiere con los efectos del ácido nicotínico sobre los lípidos.
Acido nicotínico Mecanismo de acción
Los mecanismos por los cuales el ácido nicotínico modifica el perfil lipídico en el plasma no se conocen completamente. El ácido nicotínico inhibe la liberación de ácidos grasos libres (AGL) del tejido adiposo, lo que podría contribuir a las reducciones de las concentraciones plasmáticas de C-LDL, CT, C-VLDL, apo B, TG y Lp(a), así como a los incrementos del C-HDL y la apo A-I, todos los cuales se asocian a un menor riesgo cardiovascular. Otras explicaciones no relacionadas con la reducción de los AGL en el plasma como mecanismo principal de la modificación del perfil lipídico son la inhibición mediada por el ácido nicotínico de la lipogénesis de novo o la esterificación de ácidos grasos a TG en el hígado.
Efectos farmacodinámicos
El ácido nicotínico produce un cambio relativo en la distribución de las subclases de partículas LDL, de partículas LDL pequeñas y densas (las más aterogénicas) a partículas LDL de mayor tamaño. Además el ácido nicotínico aumenta en mayor medida la subfracción HDL2 que la subfracción HDL3, por lo que incrementa el cociente HDL2:HDL3, lo cual se asocia a un menor riesgo de enfermedad cardiovascular. Se ha planteado la hipótesis de que las HDL participan en el transporte del colesterol de los tejidos al hígado, para suprimir la inflamación vascular asociada a la aterosclerosis, y que tienen efectos antioxidantes y antitrombóticos.
Al igual que las LDL, las lipoproteínas ricas en triglicéridos y enriquecidas en colesterol, como las VLDL, las lipoproteínas de densidad intermedia (IDL) y los residuos, también pueden promover la aterosclerosis. Frecuentemente se observan concentraciones plasmáticas elevadas de TG junto con
concentraciones bajas de C-HDL y partículas LDL pequeñas, así como en combinación con factores de riesgo metabólicos no lipídicos de cardiopatía coronaria (CC).
El tratamiento con ácido nicotínico reduce el riesgo de muerte y de episodios cardiovasculares y retarda la progresión o promueve la regresión de las lesiones ateroscleróticas. El Coronary Drug Project, un estudio de cinco años de duración que finalizó en 1975, demostró que el ácido nicotínico tuvo un efecto beneficioso estadísticamente significativo, consistente en la disminución de la incidencia de infartos de miocardio (IM) recurrentes no mortales en varones de 30 a 64 años de edad con antecedentes de IM. Aunque la mortalidad total fue similar en los dos grupos al cabo de cinco años, en el período de seguimiento de quince años la incidencia acumulada de muertes fue un 11 % menor en el grupo de ácido nicotínico que en el grupo placebo.
Laropiprant Mecanismo de acción
La rubefacción inducida por el ácido nicotínico está mediada principalmente por la liberación de prostaglandina D2 (PGD2) en la piel. Estudios genéticos y farmacológicos realizados en modelos animales han aportado pruebas de que la PGD2, que actúa a través de los DP1 (uno de los dos subtipos de receptores de la PGD2), desempeña una función clave en la rubefacción inducida por el ácido nicotínico. Laropiprant es un antagonista potente y selectivo de los DPi. No cabe esperar que laropiprant inhiba la producción de prostaglandinas.
Efectos farmacodinámicos
Se ha demostrado que laropiprant es eficaz para reducir los síntomas de rubefacción inducidos por el ácido nicotínico. La reducción de los síntomas de rubefacción (evaluados mediante cuestionarios cumplimentados por los pacientes) se correlacionó con una reducción de la vasodilatación inducida por el ácido nicotínico (evaluada mediante la determinación del flujo sanguíneo en la piel). En sujetos sanos que recibieron Tredaptive, el tratamiento previ con
no tuvo efectos beneficiosos adicionales para reducir los síntomas de rubefacción inducidos por el ácido nicotínico en comparación con Tredaptive en monoterapia (ver sección 4.8)
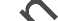
Laropiprant también tiene afinidad por los receptores del tromboxano A2 (TP) (aunque es sustancialmente menos potente en los TP que en los DPi). Los TP intervienen en la función plaquetaria; sin embargo, laropiprant en dosis terapéuticas no tuvo un efecto clínicamente relevante sobre el tiempo de sangrado ni sobre la agregación plaquetaria inducida por el colágeno (ver sección
4.5)

0'
Ensayos clínicos Efectos sobre los lípic
Tredaptive fue eficaz de modo consistente en todas las subpoblaciones de pacientes especificadas previamente y definidas por raza, sexo, concentraciones basales de C-LDL, C-HDL y TG, edad, y situación de diabetes.
En un ensayo multicéntrico, doble ciego, controlado con placebo de 24 semanas de duración, se observó que los pacientes que tomaban Tredaptive en dosis de 2.000 mg/40 mg, tanto en combinación con estatina como en monoterapia tenían, comparado con placebo, un menor nivel de C-LDL (-18,9 % frente a -0,5 %), TG (-21,7 % frente a 3,6 %), cociente C-LDL:C-HDL (-28,9 % frente a 2,3 %), C no HDL (-19,0 % frente a 0,8 %), apo B (-16,4 % frente a 2,5 %), CT (-9,2 % frente a -0,6 %), Lp(a) (-17,6 % frente a 1,1 %) y cociente CT:C-HDL (-21,2 % frente a 1,9 %), y también presentaban un aumento significativo de C-HDL (18,8 % frente a -1,2 %) y apo A-I (11,2 % frente a 4,3 %) medido como los cambios porcentuales con respecto a los valores basales. En general, los efectos del tratamiento sobre todos los parámetros lipídicos entre los grupos fueron similares en todos los subgrupos de pacientes examinados. Los pacientes que recibieron Tredaptive, ácido nicotínico (formulación de liberación prolongada) o placebo también tomaron estatinas (29 % atorvastatina [5-80 mg], 54 % simvastatina [10-80 mg], 17 % otras estatinas [2,5-180 mg] (pravastatina, fluvastatina, rosuvastatina, lovastatina)), y el 9 % también tomó ezetimiba [10 mg]. El efecto sobre los lípidos fue similar tanto cuando Tredaptive se administró en monoterapia como cuando se añadió al tratamiento en curso con una estatina con o sin ezetimiba.
Las respuestas del C-LDL, el C-HDL y los TG ajustadas al placebo fueron mayores en las mujeres que en los varones y mayores en los pacientes ancianos (> 65 años de edad) que en los pacientes más jóvenes (< 65 años de edad).
En un ensayo multicéntrico, doble ciego y factorial de 12 semanas de duración, Tredaptive en dosis de
1.000 mg/20 mg administrado en combinación con simvastatina, en comparación con simvastatina en monoterapia o con Tredaptive 1.000 mg/20 mg solo en monoterapia durante 4 semanas, redujo significativamente el C-LDL (-44,2 %, -37,4 %, -8,2 % respectivamente), los TG (-25,8 %, -15,7 %, -18,7 % respectivamente) y el CT (-27,9 %, -25,8 %, -4,9 % respectivamente) e incrementó significativamente el C-HDL (19,2 %, 4,2 %, 12,5 % respectivamente). Tredaptive en dosis de
2.000 mg/40 mg administrado conjuntamente con simvastatina, en comparación con simvastatina en monoterapia o Tredaptive 2.000 mg/40 mg en monoterapia durante 12 semanas, redujo significativamente el C-LDL (-47,9 %, -37,0 %, -17,0 % respectivamente), los TG (-33,3 %, -14,7 %, -21,6 % respectivamente), la apo B (-41,0 %, -28,8 %, -17,1 % respectivamente) y el CT (-29,6 %, -24,9 %, -9,1 % respectivamente), así como el cociente C-LDL:C-HDL (-57,1 %, -39,8 %, -31,2 % respectivamente), el C no HDL (-45,8 %, -33,4 %, -18,1 % respectivamente) y el cociente CT:C-HDL (-43,0 %, -28,0 %, -24,9 % respectivamente) e incrementó significativamente el C-HDL (27,5 %,
6.0 %, 23,4 % respectivamente). Un análisis más detallado mostró que Tredaptive 2.000 mg/40 mg

ite la apo A-I (8,6 %, 2,3 % espectivamente). En este tive en combinación con
administrado conjuntamente con simvastatina incrementó significat respectivamente) y redujo significativamente la Lp(a) (-19,8 %, estudio no se incluyeron los datos de eficacia y seguridad de T simvastatina en dosis > 40 mg.
Rubefacción
En tres ensayos clínicos extensos en los que se registraron los síntomas de rubefacción notificados por los pacientes, se observó que los pacientes que recibieron Tredaptive presentaron menos rubefacción que los que tomaron ácido nicotínico (formulaciones de liberación prolongada). En los pacientes que continuaron en el primer ensayo (24 semanas), la frecuencia de rubefacción de intensidad moderada o mayor en los pacientes tratados con Tredaptive disminuyó y se acercó a la de los pacientes que recibieron placebo (ver la Figura 1), mientras que en los pacientes tratados con ácido nicotínico (formulación de liberación prolongada) la frecuencia de rubefacción permaneció constante (después de la semana 6). &
e>
&
Figura 1. Número medio de días por semana con síntomas de rubefacción de intensidad moderada o mayor* durante las semanas 1-24
2
§
a
§
O
Oh
0
0 1 2 3 4 S1 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25
Semanas de tratamiento
&
•Tredaptive (1.000 mg/20 mg a 2.000 mg/40 mg en la semana 5)
▲ Ácido nicotínico (liberación prolongada, 1.000 mg a 2.000 mg en la semana 5) oPlacebo
*Incluye los pacientes con síntomas de rubefacción modera tLa dosis se aumentó en la semana 5
■ados, intensos o extremos
En el segundo ensayo (16 semanas), en el que se permitió el uso de ácido acetilsalicílico, los pacientes que recibieron Tredaptive presentaron rubefacción de intensidad moderada o mayor significativamente menos días por semana que los que recibieron ácido nicotínico (formulación de liberación prolongada; la dosis de 500 a 2.000 mg tomados gradualmente durante 12 semanas)
(p < 0,001).
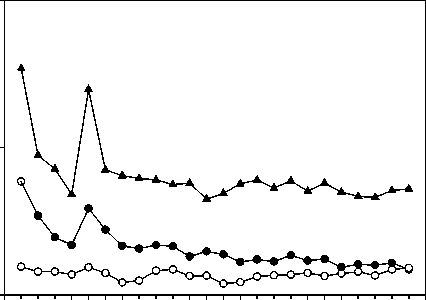
Un ensayo multicéntrico, aleatorizado, doble ciego, controlado con placebo y de 32 semanas de duración para evaluar los efectos de la retirada de laropiprant, demostró que los pacientes dislipémicos en los que laropiprant se retiró después de 20 semanas de tratamiento con Tredaptive, experimentaron significativamente más rubefacción que los pacientes que continuaron tomando
Tredaptive en cuanto a número di p<0,001, Figura 2. La inciden pacientes tratados con Tre
&
edaptiv

por semana con rubefacción de intensidad moderada o mayor, la frecuencia de rubefacción de intensidad moderada o mayor en durante el estudio disminuyeron.
Figura 2
Porcentaje de pacientes con síntomas de rubefacción de intensidad moderada o mayor durante las semanas 1-32
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Tredaptive en pacientes pediátricos entre 7 y 18 años de edad en hipercolesterolemia familiar heterocigota (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción Ácido nicotínico
Tras la administración de una dosis de 2.000 mg de ácido nicotínico por vía oral en forma de dos comprimidos de liberación modificada de ácido nicotínico/laropiprant junto con alimentos, el ácido nicotínico se absorbió, con una mediana del tiempo transcurrido hasta alcanzar la concentración plasmática máxima (Tmáx) de 4 horas, un valor medio del área bajo la curva de concentración plasmática-tiempo (AUC0_última) de aproximadamente 58,0 pMh y un valor medio de la concentración plasmática máxima (Cmáx) de aproximadamente 20,2 pM. La biodisponibilidad con o sin alimentos es de al menos el 72 %, según indica la cantidad de la dosis de ácido nicotínico recuperada en la orina. La biodisponibilidad oral del ácido nicotínico no varía cuando se toma junto con una comida rica en grasas.
Laropiprant
Tras la administración de una dosis de 40 mg de laropiprant por vía oral en forma de dos comprimidos de liberación modificada de ácido nicotínico/laropiprant junto con alimentos, laropiprant se absorbió rápidamente, con una mediana del Tmáx de 1 hora, un valor medio del AUC0-<X) de aproximadamente 13 pMh y un valor medio de la Cmáx de aproximadamente 1,6 pM. La velocidad de la absorción y la cantidad absorbida no varían cuando el fármaco se toma junto con una comida rica en grasas. La farmacocinética de laropiprant es lineal, con aumentos del AUC y la Cmáx aproximadamente proporcionales a la dosis, y sin indicios de que el aclaramiento dependa del tiempo.
La biodisponibilidad absoluta media de laropiprant es de aproximadamente el 71 % tras la administración de una dosis de 40 mg en forma de dos comprimidos de liberación modificada de ácido nicotínico/laropiprant tras una noche en ayunas.
Distribución Ácido nicotínico
Menos del 20 % del ácido nicotínico está unido a las proteínas del suero.
Laropiprant
El volumen medio de distribución en el estado estacionario tras la administración de una dosis única de 40 mg de laropiprant por vía intravenosa a sujetos sanos es de aproximadamente 70 litros. Laropiprant se une en un elevado porcentaje (> 99 %) a las proteínas plasmáticas y el grado de unión es independiente de la concentración. Laropiprant atraviesa la placenta en ratas y conejos.
Biotransformación &
Ácido nicotínico
El ácido nicotínico sufre un metabolismo de primer paso extenso a través de dos vías metabólicas que dependen de la dosis y de la velocidad de absorción. La primera vía da lugar a la formación de nicotinamida adenina dinucleótido (NAD) y nicotinamida. En los seres humanos, la nicotinamida se metaboliza de nuevo predominantemente a N-metilnicotinamida (MNA) y a N-metil-2-piridona-5-carboxamida (2PY). En la segunda vía, la glicina se conjuga con el ácido nicotínico para formar ácido nicotinúrico (NUA). La primera vía es la que predomina con dosis bajas o con velocidades de absorción bajas de ácido nicotínico. Con dosis altas o velocidades de absorción altas, la vía del NAD se satura y un porcentaje mayor de la dosis oral llega a la corriente sanguínea sin modificar en forma de ácido nicotínico. La vía de conjugación con la glicina no se satura en el rango de dosis clínicamente relevante, ya que el aumento de las concentraciones plasmáticas de NUA es proporcional a la dosis en el intervalo de dosis de 1.000 mg a 2.000 mg.
r&
En estudios in vitro, el ácido nicotínico y sus metabolitos no inhibieron las reacciones mediadas por la CYP1A2, la CYP2B6, la CYP2C9, la CYP2C19, la CYP2D6, la CYP2E1 o la CYP3A4 ni la 3-glucuronidación del estradiol mediada por la UGT1A1.
Qr
Laropiprant
Laropiprant es metabolizado principalmente por acil-glucuronidación y en menor medida por metabolismo oxidativo; luego el glucurónido se excreta por las heces (a través de la bilis) y por la orina. Laropiprant y su conjugado glucurónido acilo son los principales compuestos circulantes en el plasma humano. Estudios in vitro han demostrado que el conjugado glucurónido acilo de laropiprant tiene una afinidad por los DPi al menos 65 veces menor que laropiprant, por lo que no cabe esperar que contribuya a la actividad global de laropiprant en los DPi. El principal compuesto (73 % de la radiactividad) en las heces es laropiprant (en forma de principio activo no absorbido y el conjugado del ácido glucurónico hidrolizado). En la orina, el principal compuesto es el conjugado glucurónido acilo (64 % de la radiactividad) y en menor media el compuesto original (5 %). El metabolismo oxidativo de laropiprant está catalizado principalmente por la CYP3A4, mientras que varias isoformas de la UGT (1A1, 1A3, 1A9 y 2B7) catalizan la acil-glucuronidación.
Eliminación Ácido nicotínico
El ácido nicotínico se excreta predominantemente por la orina en forma de metabolitos.
Laropiprant
Laropiprant se elimina principalmente por acil-glucuronidación y luego el glucurónido se excreta por las heces (a través de la bilis) y por la orina. Tras la administración oral de laropiprant marcado con 14C a seres humanos, aproximadamente el 68 % de la dosis se recuperó en las heces (principalmente como el compuesto original, en forma de principio activo no absorbido y el conjugado del ácido glucurónico hidrolizado) y el 22 % se recuperó en la orina (principalmente en forma de metabolitos). La mayor parte de la dosis se excretó en un período de 96 horas. La semivida terminal aparente (t1/2) tras la administración de una dosis de 40 mg de laropiprant en forma de dos comprimidos de liberación modificada de ácido nicotínico/laropiprant junto con alimentos fue de aproximadamente 17 horas. El estado estacionario de la farmacocinética se alcanzó 2 días después de la administración una vez al día de laropiprant, con una acumulación mínima según el AUC (aproximadamente
1,3 veces) y según la Cmáx (aproximadamente 1,1 veces).
Características en _paciente Insuficiencia renal
Tredaptive: No se ha estudiado su uso en pacientes con insuficiencia renal.
Acido nicotínico: ver sección 4.4.
cia r
uficiencia hepática.
Laropiprant: Tras la administración de 40 mg de laropiprant, no se observaron cambie s clín icamente significativos entre los valores del AUC y la Cmáx de laropiprant registrados en pacientes con insuficiencia renal grave no sometidos a diálisis y en sujetos control sanos. Dado que no se observó ningún efecto de la insuficiencia renal grave sobre la farmacocinética de laropiprant, no cabe esperar que se produzca un efecto en los pacientes con insuficiencia renal leve o moderada; sin embargo, no se puede deducir de este estudio cuáles son los efectos de la insuficiencia renal en fase terminal y de la diálisis sobre la farmacocinética de laropiprant.
Insuficiencia hepática Tredaptive: No se ha estudiado su uso en pacientes con ins
Acido nicotínico: ver secciones 4.3 y 4.4.
Laropiprant. De acuerdo con las características de un medicamento que se elimina principalmente por metabolismo, la hepatopatía moderada tiene un efecto significativo sobre la farmacocinética de laropiprant, con unos aumentos del AUC y la Cmáx de aproximadamente 2,8 y 2,2 veces, respectivamente.
Sexo
Acido nicotínico: No es neces;
ecesano ajustar la dosis en función del sexo. El sexo no tiene un efecto clínicamente significativo sobre la farmacocinética del ácido nicotínico (formulación de liberación prolongada). La biodisponibilidad oral del ácido nicotínico es similar en los hombres y en las mujeres que reciben Tredaptive. Las concentraciones plasmáticas de ácido nicotinúrico y ácido nicotínico son algo más altas en las mujeres que en los varones.
&
Laropiprant: No es necesario ajustar la dosis en función del sexo. El sexo no tiene un efecto clínicamente significativo sobre la farmacocinética de laropiprant.
Pacientes de edad avanzada
Acido nicotínico: No existen datos farmacocinéticos en los pacientes de edad avanzada (personas de > 65 años). La edad no tiene un efecto clínicamente significativo sobre la farmacocinética del ácido nicotínico (formulación de liberación prolongada) según un análisis combinado de los datos obtenidos en sujetos de 18 a 65 años de edad. La biodisponibilidad oral del ácido nicotínico no cambia con la edad.
Laropiprant: No es necesario ajustar la dosis en los pacientes de edad avanzada. La edad no tiene un efecto clínicamente significativo sobre la farmacocinética de laropiprant.
Población pediátrica
Tredaptive: No se han realizado estudios en pacientes pediátricos.
Raza
Acido nicotínico: No es necesario ajustar la dosis en función de la raza. La raza no tiene un efecto clínicamente significativo sobre la farmacocinética del ácido nicotínico (formulación de liberación prolongada) según un análisis combinado de los datos farmacocinéticos obtenidos en sujetos hispanos, de raza blanca, raza negra y nativos americanos. Se debe tener precaución cuando se trate a pacientes de raza china con Tredaptive junto con simvastatina o ezetimiba/simvastatina (especialmente dosis de simvastatina de 40 mg o superiores). (Ver sección 4.4).
Laropiprant: No es necesario ajustar la dosis en función de la raza. La raza no tiene un efecto clínicamente significativo sobre la farmacocinética de laropiprant según un análisis combinado de los datos farmacocinéticos obtenidos en sujetos de raza blanca, hispanos, raza negra, asiáticos y nativos americanos.
5.3 Datos preclínicos sobre seguridad
Tredaptive x<
Únicamente se observaron reacciones en los estudios no clínicos con exposiciones consid superiores a la máxima humana, lo que indica poca relevancia para su uso clínico.
deradas
La seguridad de la administración concomitante de ácido nicotínico y laro piprant se evaluó en perros y en ratas. Los hallazgos toxicológicos observados en estos estudios de administración concomitante fueron similares a los obtenidos con ácido nicotínico y laropiprant administrados en monoterapia.
ry
Acido nicotínico
Se observaron degeneración estomacal y vacuolas en los hepatocitos en ratas tras 6 meses de administración con unos valores de exposición sistémica al menos 179 veces superiores a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos. Se observaron retinopatía y lesiones en la córnea en perros tras 6 meses de administración con unos valores de exposición sistémica al menos 240 veces superiores a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos.
rQ
en rato
El ácido nicotínico no fue carcinógeno en ratones cuando se les administró durante toda la vida. Los ratones de este estudio recibieron una dosis de ácido nicotínico aproximadamente 9 a 13 veces mayor que la dosis de ácido nicotínico en los seres humanos (2.000 mg/día) en términos de mg/m2. El ácido nicotínico no tuvo efectos mutágenos en los ensayos in vitro.
No fueron observados efectos adversos relacionados con el ácido nicotínico sobre la fertilidad en machos y hembras de rata a exposiciones de hasta aproximadamente 391 veces superiores al AUC del ácido nicotínico en los seres humanos basado en el AUC de la dosis diaria recomendada en los seres humanos. ver
El ácido nicotínico no fue teratogénico en ratas y conejos a niveles de exposición respectivamente de hasta 253 y 104 veces superiores al AUC del ácido nicotínico en los seres humanos a la dosis diaria recomendada en los seres humanos. En ratas, fueron observados efectos fetotóxicos (disminución significativa de los pesos corporales fetales asociada con una disminución en el número de vértebras sacrocaudales osificadas y una mayor incidencia de fetos con localizaciones de osificación incompleta) en ausencia de signos de toxicidad materna a niveles de exposición de aproximadamente 959 veces superiores al AUC del ácido nicotínico en los seres humanos a la dosis diaria recomendada en los seres humanos. Fueron observados cambios similares relacionados con el tratamiento en fetos de conejo, pero con presencia de toxicidad materna a niveles de exposición de aproximadamente 629 veces superiores al AUC del ácido nicotínico en seres humanos a la dosis diaria recomendada en los seres humanos.
Laropiprant
Se observaron cetonuria e hipertrofia hepatocelular centrilobular en ratas en estudios de toxicidad de dosis múltiples de hasta 6 meses de duración. La hipertrofia hepatocelular centrilobular es compatible
con la inducción de enzimas específicas de los roedores. El nivel sin efecto adverso observable (NOAEL) fue al menos 118 veces superior a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos.
Se observaron aumentos de las concentraciones séricas de alanina aminotransferasa (ALT) en todos los estudios realizados en perros, con unos valores de exposición sistémica al menos 14 veces superiores a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos. No se observaron otros efectos en los estudios en perros con exposiciones al menos 100 veces superiores a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos.
Laropiprant no fue carcinógeno en estudios de 2 años de duración realizados en ratones y ratas a las dosis más altas evaluadas, que fueron al menos 218 a 289 veces superiores a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos.
Laropiprant no fue mutágeno ni clastógeno en una serie de estudios de toxicología genética.
No se observaron efectos adversos sobre la fertilidad en ratas machos o hembras que recibieron laropiprant antes y durante el apareamiento, con unos valores de exposición sistémica al menos 289 veces superiores a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos.
Laropiprant no fue teratógeno en ratas ni en conejos a niveles de exposición sistémica de al menos 153 y 438 veces superiores a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos. En los estudios de toxicidad para la reproducción realizados en ratas se observaron ligeras disminuciones relacionadas c on el ratamiento del aumento de peso medio materno y del peso corporal de los fetos, ligeros aumentos de la mortalidad de las crías y una mayor incidencia de costillas supernumerarias y de osificación incompleta de las vértebras del esternón en los fetos con unos valores de exposición sistémica al menos 513 veces superiores a la exposición en los seres humanos basada en el AUC de la dosis diaria recomendada en los seres humanos.

OS
¿y
6
DATOS FARMACEUTICO
6.1 Lista de excipientes
Hipromelosa (E464)
Sílice coloidal anhidra (E551) Estearil fumarato de sodio Hidroxipropilcelulosa (E463) Celulosa microcristalina (E460) Croscarmelosa sódica Lactosa monohidrato Estearato de magnesio
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
Blister de PVC/Aclar: 2 años.
Blister de aluminio/aluminio: 18 meses.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C. Conservar en el embalaje original para protegerlo de la luz y la humedad.
6.5 Naturaleza y contenido del envase
Blister opaco de PVC/Aclar con una lámina de aluminio que se rompe al presionarla y que contiene 14 comprimidos. Envases de 14, 28, 56, 84, 98, 168, 196 comprimidos, envase múltiple conteniendo 196 (2 cajas de 98) comprimidos y envase de 49 x 1 comprimidos en blister precortado unidosis.
Blister de aluminio/aluminio con una lámina de aluminio que se rompe al presionarla y que contiene 7 comprimidos. Envases de 14, 28, 56, 168 comprimidos y envase de 32 x 1 comprimidos en blister precortado unidosis.
&
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7.
.v£\
TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Ltd. Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
/
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
<v-
&
EU/1/08/459/001 EU/1/08/459/002 EU/1/08/459/003 EU/1/08/459/004 EU/1/08/459/005 EU/1/08/459/006 EU/1/08/459/007 EU/1/08/459/008 EU/1/08/459/009 EU/1/08/459/010 EU/1/08/459/011 EU/1/08/459/012 EU/1/08/459/013 EU/1/08/459/014
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 3 de julio de 2008
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.

A.
B.
C.
ANEXO II
FABRICANTE(S) RESPONSABLE(S) DI DE LOS LOTES íP'
CONDICIONES O RESTR USO
ICCIO

&
E LA LIBERACION
ONES DE SUMINISTRO Y
OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACION DE COMERCIALIZACION
ION DE
Nombre y dirección del fabricante responsable de la liberación de los lotes
Merck, Sharp & Dohme Ltd. Shotton Lane Cramlington
Northumberland NE23 3JU Reino Unido
B.
CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
N DE
&
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓ COMERCIALIZACIÓN
Sistema de Farmacovigilancia
El Titular de la Autorización de Comercialización (TAC) debe asegurar que el Sistema de Farmacovigilancia, presentado en el Módulo 1.8.1 de la Autorización de Comercialización, esté instaurado y en funcionamiento antes de que el medicamento se comercialice y durante el tiempo que permanezca en el mercado.
Plan de Gestión de Riesgos (PGR)
o°
obre Sistema de Gestión de Riesgos para medicamentos de e presentar junto con el siguiente Informe Periódico de
El TAC realizará las actividades de farmacovigilancia detalladas en el Plan de Farmacovigilancia, de acuerdo con la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y cualquier actualización posterior del PGR acordada por el Comité de Medicamentos de Uso Humano (CHMP).
De acuerdo con la Directriz del C uso humano, el PGR actualizado Seguridad (IPS).
r un P
se d &
Además, se debe presentar un PGR actualizado:
• Cuando se reciba nueva información que pueda afectar a las especificaciones de seguridad vigentes, al Plan de Farmacovigilancia o a las actividades de minimización de riesgos
• Dentro : consecución de un hito importante (farmacovigilancia o
minimización de riesgos)
• A petición de la Agencia Europea de Medicamentos.
ANEXO III
ETIQUETADO Y PR
*P
3SPE<
CTO



A. ETIQUETADO
<y

1. NOMBRE DEL MEDICAMENTO
Tredaptive 1.000 mg/20 mg comprimidos de liberación modificada Ácido nicotínico/laropiprant

168 comprimidos de liberación modificada 32 x 1 comprimidos de liberación modificada
-;-Hp-;
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de ut ilizar este medicamento.
_ _
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS_
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la luz y la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN

ACIÓN
Merck Sharp & Dohme Ltd. Hertford Road, Hoddesdon Hertfordshire EN 11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZ
EU/1/08/459/009 14 comprimidos de liberación modificada EU/1/08/459/010 28 comprimidos de liberación modificada EU/1/08/459/011 56 comprimidos de liberación modificada EU/1/08/459/013 168 comprimidos de liberación moc ificada EU/1/08/459/014 32 x 1 comprimidos de liberación modificada
13. NÚMERO DE LOTE
- -^

16. INFORMACIÓN EN BRAILLE
Tredaptive 1.000 mg/20 mg
Tredaptive 1.000 mg/20 mg comprimidos de liberación modificada Ácido nicotínico/laropiprant

84 comprimidos de liberación modificada 98 comprimidos de liberación modificada 168 comprimidos de liberación modificada 196 comprimidos de liberación modificada
Envase múltiple conteniendo 196 (2 cajas de 98) comprimidos de liberación modificada 49 x 1 comprimidos de liberación modificada
VÍA
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN_
Vía oral. Leer el pro
specto
1. NOMBRE DEL MEDICAMENTO
e>
antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la luz y la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Ltd. Hertford Road, Hoddesdon Hertfordshire EN 11 9BU Reino Unido
&
£
ALIZ
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
&
EU/1/08/459/001 14 comprimidos de liberación modificada EU/1/08/459/002 28 comprimidos de liberación modificada EU/1/08/459/003 56 comprimidos de liberación modificada EU/1/08/459/004 84 comprimidos de liberación modificada EU/1/08/459/005 98 comprimidos de liberación modificada EU/1/08/459/006 168 comprimidos de liberación modificada EU/1/08/459/007 196 comprimidos de liberación modificada EU/1/08/459/008 49 x1 comprimidos de liberación modificada EU/1/08/459/012 196 (2 cajas de 98) comprimidos de liberación modificada
13. NÚMERO DE L
Lote
NDICI
&
OTE
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Tredaptive 1.000 mg/20 mg
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE INTERMEDIO
Envase múltiple de 196 (2 cajas de 98 comprimidos de liberación modificada) - sin blue box (para blister de PVC/Aclar)_
1. NOMBRE DEL MEDICAMENTO
Tredaptive 1.000 mg/20 mg comprimidos de liberación modificada Ácido nicotínico/laropiprant
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido de liberación modificada contiene 1.000 mg de ácido nicotínico y 20 mg de
_
3. LISTA DE EXCIPIENTES
Contiene lactosa monohidrato. Para más información, ver el prospecto.
DEL E
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
98 comprimidos de liberación modificada. Parte de un envase múltiple, no pueden venderse de forma separada.
-’-cP^
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
_/y_
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS

Mantener fuera d e la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la luz y la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Ltd. Hertford Road, Hoddesdon Hertfordshire EN 11 9BU Reino Unido
&
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/459/012
13. NÚMERO DE LOTE
Lote
SPENS
sP
.A}
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
O—
15. INSTRUCCIONES DE
Z3.
:ión en bra
USO
16. INFORMACIÓN EN BRAILLE
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS BLÍSTER
1. NOMBRE DEL MEDICAMENTO
Tredaptive 1000 mg/20 mg comprimidos de liberación modificada Ácido nicotínico/laropiprant
|
2. |
NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN | |
|
MSD | ||
|
3. |
FECHA DE CADUCIDAD |
¿y |
|
CAD |
:& | |
|
4. |
NÚMERO DE LOTE | |
|
Lote |
,/>_, | |
|
5. |
OTROS | |


Prospecto: información para el paciente
Tredaptive 1.000 mg/20 mg comprimidos de liberación modificada
ácido nicotínico/laropiprant
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.
Contenido del prospecto
1. Qué es Tredaptive y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Tredaptive
3. Cómo tomar Tredaptive
4. Posibles efectos adversos
5. Conservación de Tredaptive
6. Contenido del envase e información adicional
&
Qué es Tredaptive y para qué se utiliza
Jf
El nombre de este medicamento es Tredaptive. Contiene dos principios activos:
• ácido nicotínico, un medicamento que modifica los lípidos, y
• laropiprant, que reduce los síntomas de sofocos, un efecto adverso frecuente del ácido nicotínico.
Cómo funciona Tredaptive
Tredaptive se utiliza junto con la dieta:
• para reducir las concentraciones del colesterol LDL o “malo”. Esto lo consigue reduciendo las concentraciones de colesterol total, colesterol LDL, unas sustancias grasas llamadas triglicéridos y apo B (una parte de las LDL) en la sangre;
• para incrementar las concentraciones del colesterol “bueno” (colesterol HDL) y de apo A-I (una parte de las HDL).
¿Qué debo saber acerca del colesterol y los triglicéridos?
El colesterol es una de las diversas grasas que se encuentran en la sangre. Su nivel total de colesterol
colester rol LDL
incluye el cole sterol “ malo” (LDL) y el colesterol “bueno” (HDL).
Al colesterol LDL se le denomina el colesterol “malo” porque se acumula en las paredes de las arterias y forma placas. Con el tiempo, estas placas acumuladas pueden formar un coágulo en las arterias. Este coágulo puede retardar o bloquear el flujo sanguíneo a órganos vitales como el corazón o el cerebro. Cuando se bloquea el flujo sanguíneo, puede producirse un ataque al corazón o un accidente cerebrovascular.
Al colesterol HDL se le denomina el colesterol “bueno” porque evita que el colesterol “malo” se acumule en las arterias y porque protege al organismo frente a enfermedades cardíacas.
Los triglicéridos son otras grasas existentes en la sangre. Incrementan el riesgo de tener problemas cardíacos.
Al principio la mayoría de las personas con problemas de colesterol no presenta signos. Su médico puede determinar cuál es su nivel de colesterol con un sencillo análisis de sangre. Visite a su médico regularmente para llevar un control de su colesterol y consulte con él.
Tredaptive se utiliza, junto con la dieta y el ejercicio, en pacientes adultos con hipercolesterolemia primaria o dislipidemia mixta:
• cuando no puede controlar las concentraciones de colesterol con una estatina sola (una clase de medicamentos que reducen el colesterol y que actúan en el hígado);
• cuando no tolera las estatinas o no está recomendado que las tome.
Los pacientes con dislipidemia mixta combinada tienen en sangre elevados niveles de colesterol LDL "malo" y triglicéridos (un tipo de grasas) y bajos niveles de colesterol HDL "bueno". La hipercolesterolemia primaria se produce cuando los niveles de colesterol en la sangre son elevados. Primaria significa que la hipercolesterolemia no tiene ninguna causa identificable.
demás
2. Qué necesita saber antes de empezar a tomar Tredaptive No tome Tredaptive
• si es alérgico al ácido nicotínico, a laropiprant o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• si tiene actualmente problemas hepáticos.
• si tiene una úlcera de estómago. A>
• si presenta sangrado arterial.
¿ó/
No tome Tredaptive si le afecta cualquiera de las circunstancias anteriores. Si no está seguro, consulte con su médico o farmacéutico antes de tomar Tredaptive.
Advertencias y precauciones
Informe a su médico de todas las enfermedades que tiene y ha tenido. Consulte a su médico o farmacéutico antes de tomar este medicamento y mientras esté tomándolo:
si tiene alguna alergia.
si ha tenido alguna vez una enfermedad hepática, ictericia (un problema del hígado que provoca una coloración amarillenta de la piel y de los ojos) o una enfermedad hepatobiliar (hígado y conducto biliar). si tiene problemas de riñón. si tiene problemas de tiroides. si bebe grandes cantidades de alcohol.
si usted o un familiar cercano tiene un trastorno muscular hereditario, o usted ha tenido alguna vez problemas musculares durante el tratamiento con medicamentos reductores del colesterol conocidos como “estatinas” o fibratos.
si tiene dolor muscular, dolor muscular a la palpación o debilidad muscular inexplicables. Si
tiene estos síntomas, consulte a su médico inmediatamente.
si tiene los niveles de azúcar elevado en la sangre o diabetes.
si tiene problemas cardíacos.
si va a someterse a una operación.
si tiene gota.
si tiene concentraciones bajas de fósforo. si tiene más de 70 años.
si está tomando simvastatina (una estatina) o un medicamento que contiene simvastatina y es de raza china.
Si no está seguro de si le afecta alguna de las circunstancias anteriores, consulte con su médico o farmacéutico antes de tomar Tredaptive.
Análisis de sangre y vigilancia
• Visite a su médico regularmente para que le haga un análisis de las concentraciones de colesterol LDL (malo) y HDL (bueno) y de las de triglicéridos.
• Su médico debe hacerle un análisis de sangre antes de que empiece a tomar Tredaptive para comprobar lo bien que funciona su hígado.
• Puede que su médico también considere necesario hacerle periódicamente análisis de sangre después de que empiece a tomar Tredaptive para comprobar como funciona su hígado y para detectar otros posibles efectos adversos.
Niños y adolescentes
Tredaptive no se ha estudiado en niños y adolescentes de menos de 18 años. Por tanto, Tredaptive no debe utilizarse en niños y adolescentes menores de 18 años de edad.
Uso de Tredaptive con otros medicamentos
Informe a su médico o farmacéutico si está tomando o ha tomado recientemente cualquier otro medicamento, incluso los adquiridos sin receta, incluyendo las vitaminas y las plantas medicinales.
Es especialmente importante que comente con su médico si está tomando cualquiera de los medicamentos enumerados a continuación:
medicamentos utilizados para reducir la presión arterial. .. V .....
medicamentos utilizados para reducir el colesterol llamados secuestradores de los ácidos biliares”, como colestiramina.
zidovudina, un medicamento que se utiliza para la infección por el VIH. midazolam, un medicamento que se usa para sedar (adormecer) a los pacientes antes de someterlos a un procedimiento médico. vitaminas o suplementos que contengan ácido nicotínico.
clopidogrel y ácido acetilsalicílico (AAS), medicamentos que evitan la formación de coágulos de sangre perjudiciales.
• medicamentos utilizados para reducir el colesterol llamados “estatinas”.
Además, si es de raza china informe a su médico si está tomando simvastatina (una estatina) o medicamentos que contengan simvastatina.
Si no está seguro de si está tomando alguno de estos medicamentos, consulte a su médico o farmacéutico antes de tomar Tredaptive.
Toma de Tredaptive con alimentos, bebidas y alcohol
• Para reducir la posible aparición de sofocos, evite consumir bebidas alcohólicas o bebidas calientes o comer comidas picantes, poco antes de tomar la dosis de Tredaptive.
Es importante seguir los consejos que figuran en la sección 3 Cómo tomar Tredaptive.
Embarazo y lactancia
No se recomienda Tredaptive en el embarazo a menos que sea claramente necesario.
Consulte a su médico antes de tomar Tredaptive:
• Si está embarazada o tiene previsto quedarse embarazada. No se sabe si Tredaptive afecta al feto.
• Si está en periodo de lactancia o tiene intención de iniciar el periodo de lactancia. No se sabe si Tredaptive pasa a la leche materna. Sin embargo, se sabe que el ácido nicotínico, un componente de Tredaptive, pasa a la leche materna.
Consulte a su médico o farmacéutico antes de utilizar este medicamento. Su médico decidirá si es adecuado que tome Tredaptive.
Conducción y uso de máquinas
Algunas personas se marean después de tomar Tredaptive. Si se marea, no debe conducir ni utilizar máquinas después de tomar Tredaptive.
Tredaptive contiene lactosa
Tredaptive contiene un azúcar llamado lactosa. Si su médico le ha dicho que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo tomar Tredaptive
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cuánto hay que tomar
• Debe empezar tomando un comprimido al día
• Después de 4 semanas, puede que su médico le aumente la dosis a dos cor
• Si le cambian el tratamiento de un medicamento que contiene 2.000 mg o nicotínico de liberación prolongada a Tredaptive, su médico puede inic dos comprimidos de Tredaptive al día. Si le cambian el tratamiento de un medicamento que contiene menos de 2.000 mg de ácido nicotínico de liberación prolongada a Tredaptive, debe iniciar el tratamiento tomando un comprimido de Tredaptive al día. Después de 4 semanas, puede que su médico le aumente la dosis de Tredaptive a dos comprimidos al día.
Cómo hay que tomarlo
• Tome Tredaptive una vez al día, por la noche o a la hora de acostarse.
• Tome Tredaptive con alimentos.
• Trague cada comprimido entero. Para que su medicamento actúe como está previsto, no parta, rompa, machaque o mastique el comprimido antes de tragarlo.
• No tome bebidas alcohólicas ni bebidas calientes ni coma comidas picantes poco antes de tomar su dosis de Tredaptive. De esta manera se reduce la posibilidad de presentar sofocos (enrojecimiento de la piel, sensación de calor, picor u hormigueo, especialmente en la cabeza, el cuello, el pecho y la parte superior de la espalda).
• El uso de ácido acetilsalicílico antes de tomar Tredaptive no reduce los sofocos en mayor medida que tomar Tredaptive solo. Por tanto, no es necesario tomar ácido acetilsalicílico para reducir los síntomas de los sofocos. Si toma ácido acetilsalicílico por alguna otra razón, siga el

3>
os al día. de ácido tratamiento con
consejo de su
i médic°.
Si toma más Tr
ive del que debe
En caso de sobredosis, se han notificado los siguientes efectos adversos: sofocos, dolor de cabeza, prurito (picor), náusea, mareos, vómito, diarrea, dolor/malestar de estómago y dolor de espalda.
Si toma más Tredaptive del que debiera, consulte con su médico o farmacéutico inmediatamente.
Si olvidó tomar Tredaptive
• No tome una dosis doble para compensar las dosis olvidadas. Continúe tomando su dosis habitual a la noche siguiente o a la hora de acostarse. Sin embargo, si no toma Tredaptive durante 7 o más días seguidos, consulte a su médico antes de volver a tomar Tredaptive.
Si interrumpe el tratamiento con Tredaptive
No deje de tomar Tredaptive sin consultar antes con su médico. Puede que su problema de colesterol vuelva a aparecer.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Tredaptive puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos de Tredaptive son:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
• sofocos (consisten habitualmente en enrojecimiento de la piel, sensación de calor, picor u hormigueo, especialmente en la cabeza, el cuello, el pecho y la parte superior de la espalda). Cuando aparecen los sofocos, los síntomas generalmente se notan más al principio y disminuyen con el tiempo.
&
Frecuentes (pueden afectar hasta a 1 de cada 10 personas) dolor de cabeza
hormigueo o entumecimiento de las manos o los pies dolor abdominal diarrea
&
da 100 personas)
malestar o ardor de estómago náuseas (ganas de vomitar) vómitos prurito (picor) erupción sarpullidos
o°
palpitaciones (sentir el latido de su corazón) presión arterial baja dificultad para respirar piel seca
erupción con manchas lisas y rojas dolor muscular o dolor a la palpación escalofríos dolor ver
hinchazón de los dedos de las manos y de los pies o los tobillos
Poco frecuentes (pueden afectar hasta a 1 de ca gota
falta de sueño mareo
Además, se han notificado como parte de una reacción alérgica a Tredaptive uno o más de los siguientes síntomas.
• hinchazón de la cara, los labios, la lengua o la garganta que puede causar dificultad para respirar o para tragar (angioedema, que puede requerir un tratamiento inmediato)
• desmayos
• falta de aliento
• pérdida del control para orinar o defecar
• sudor frío
• temblores
• escalofríos
• aumento de la presión arterial
• hinchazón de los labios
• sensación de quemazón
• erupción en todo el cuerpo
• dolor en las articulaciones
• hinchazón de las piernas
• latidos cardíacos rápidos.
Raras (pueden afectar hasta a 1 de cada 1.000 personas) moqueo
tolerancia a la glucosa (azúcar) disminuida ansiedad migraña
desfallecimiento
latido del corazón rápido o irregular mareo al estar de pie eructos
úlcera de estómago
trastorno de la piel con placas oscuras aterciopeladas denominadas acanthosis ni zonas de la piel oscuras sudoración
nigricans
pérdida de fuerza muscular debilidad
hinchazón generalizada
Frecuencia no conocida: la frecuencia no puede estimarse a partir de los datos disponibles
Además, durante la experiencia post-comercialización con Tredaptive y/u otros productos con ácido
nicotínico (solo y/o con otros medicamentos para bajar el colesterol), se comunicaron las siguientes
reacciones adversas:
• una repentina reacción alérgica grave (shock anafiláctico). Los síntomas incluyen desmayos, falta de respiración, sibilancias o dificultad para respirar, hinchazón de la cara, labios, lengua, picor o sarpullido en la piel. Este trastorno requiere atención médica inmediata.
• trastornos del ojo denominados ambliopía tóxica y edema macular cistoide que pueden provocar visión borrosa, disminución de la visión o pérdida de la visión
• coloración amarillenta de la piel y/o los ojos (ictericia)
• erupción vesicular
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos
adversos que no aparecen en este prospecto.
5. Conservación de Tredaptive
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en el blister después de CAD.
No conservar a temperatura superior a 30°C. Conservar en el embalaje original para protegerlo de la luz y la humedad.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Tredaptive
• Los principios activos son ácido nicotínico y laropiprant. Cada comprimido contiene 1.000 mg de ácido nicotínico y 20 mg de laropiprant.
• Los demás componentes son: hipromelosa (E464), sílice coloidal anhidra (E551), estearil fumarato de sodio, hidroxipropilcelulosa (E463), celulosa microcristalina (E460), croscarmelosa sódica, lactosa monohidrato y estearato de magnesio.
El medicamento se presenta en forma de comprimidos de liberación modificada. Esto significa que
uno o más principios activos se liberan lentamente durante un periodo de tiempo.
Aspecto de Tredaptive y contenido del envase

ue se presenta 196 (2 cajas de
presionarla y que se comprimidos en blister
Cada comprimido de liberación modificada es un comprimido con forma ovalada de color blanco a blanquecino y con la inscripción “552” en una cara.
Blister opaco de PVC/Aclar con una lámina de aluminio que se rompe al presio: en envases de 14, 28, 56, 84, 98, 168, 196 comprimidos, envase múltiple conteni 98) comprimidos y en envase de 49 x 1 comprimidos en blister precortado u
Blister de aluminio/aluminio con una lámina de aluminio que se romp presenta en envases de 14, 28, 56, 168 comprimidos y en envase de precortado unidosis.
envases.
Puede que solamente estén comercializados algunos tamaños de en
Merck Sharp & Dohme Ltd. V e, Cramlington
Northumberland NE23 3 JU Reino Unido
Titular de la autorización de comercialización Fabricante Merck Sharp & Dohme Ltd.
Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
o a este medicamento dirigiéndose al representante local del zación:
Puede solicitar más información ri titular de la autorización de comercia
Belgique/Belgie/Belgien
MSD Belgium BVBA/SPRL
Tél/Tel: 0800 38 693 (+32 (0)27766211)
Etarapna
MepK fflapn u floyM Etarapua EOOfl Tea.: +359 2 819 3737 info-msdbg@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL
Tél/Tel: 0800 38 693 (+32 (0)27766211)
Magyarország
MSD Pharma Hungary Kft.
Tel.: +36 1 888 53 00 hungary_msd@merck.com
Ceská republika
Merck Sharp & Dohme s.r.o. Tel.: +420 233 010 111 msd_cr@merck.com
Danmark
MSD Danmark ApS Tlf: +45 4482 4000 dkmail@merck.com
Malta
Merck Sharp & Dohme Cyprus Limited Tel: +8007 4433 (+356 99917558) malta_info@merck.com
Nederland
Merck Sharp & Dohme BV
Tel: 0800 99 99 000 (+31 23 5153153)
Deutschland
Norge
MSD (Norge) AS Tlf: +47 32 20 73 00 msdnorge@msd.no
MSD SHARP & DOHME GMBH
Tel: 0800 673 673 673; (+49 (0) 89 4561 2612)
Eesti
Merck Sharp & Dohme OÜ Tel: +372 6144 200 msdeesti@merck.com
Osterreich
Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 msd-medizin@merck.com
•o*
*9
<v-
&

e Romania S.R.L.
España
Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 msd_info@merck.com
France
MSD France
Tél: + 33 (0) 1 80 46 40 40
Tel: +353 (0)1 2998700 medinfo_ireland@merck.com
Polska
MSD Polska Sp. z o.o. Tel.: +48 22 549 51 00 msdpolska@merck.com
Portugal
Merck Sharp & Dohme, Lda Tel: +351 21 4465808 clic@merck.com
Romania
Merck Sharp &
Tel: +4021 5
msdromania@ erck.com Slovenija
Merck Sharp & Dohme, inovativna zdravila d.o.o. Tel: + 386 1 5204201
Slovenská republika
Merck Sharp & Dohme, s. r. o. Tel.: +421 2 58282010 msd_sk@merck.com
Italia
MSD Italia S.r.l Tel: +39 06 36191 medicalinformation.it@
Kúnpoq
Merck Sharp & Dohme Cyprus Limited T@: 80000 673 (+357 22866700) cyprus_info@merck.com
Suomi/Finland
MSD Finland Oy Puh/Tel: +358 (0) 9 804650 info@msd.fi
Sverige
Merck Sharp & Dohme (Sweden) AB Tel: +46 77 5700488 medicinskinfo@merck.com
Latvija
SIA Merck Sharp & Dohme Latvija Tel: +371 67364 224 msd_lv@merck.com
United Kingdom
Merck Sharp and Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com
Lietuva
UAB Merck Sharp & Dohme Tel. +370 5 278 02 47 msd_lietuva@merck.com
Fecha de la última revisión de este prospecto: {mes/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.

41