Trangorex 150 Mg / 3 Ml Solucion Inyectable
Prospecto: información para el usuario
Trangorex 150 mg / 3 ml solución inyectable
Amiodarona clorhidrato
Lea todo el prospecto detenidamente antes de empezar usar este medicamento, porque contiene información importante para usted.
leerlo.
aunque
efectos
- Conserve este prospecto, ya que puede tener que volver a Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Trangorex y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Trangorex
3. Cómo usar Trangorex
4. Posibles efectos adversos
5. Conservación de Trangorex
6. Contenido del envase e información adicional
1. Qué es Trangorex y para qué se utiliza
Trangorex pertenece a un grupo de medicamentos conocidos como agentes antiarrítmicos (utilizados para controlar el ritmo cardiaco rápido o irregular).
Trangorex se utiliza para tratar alteraciones graves del ritmo cardiaco cuando el paciente no responda a otros antiarrítmicos o cuando los medicamentos alternativos no se toleren. Se administra en casos de:
- Taquiarritmias asociadas con el síndrome de Wolff-Parkinson-White.
- Prevención de la reaparición de la fibrilación y flutter auricular.
- Todos los tipos de taquiarritmias de naturaleza paroxística incluyendo: taquicardias supraventricular, nodal y ventricular, fibrilación ventricular.
La vía intravenosa se empleará cuando sea necesaria una respuesta rápida. Debe utilizarse en unidades con medios adecuados para la monitorización cardiaca y la reanimación cardiopulmonar.
2. Qué necesita saber antes de empezar a usar Trangorex No use Trangorex
- Si es alérgico al yodo, amiodarona o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- Si posee una frecuencia cardiaca baja (bradicardia sinusal) o padece otras alteraciones del ritmo o de la conducción cardiaca (bloqueo sino-auricular, enfermedad del nódulo sinusal, alteraciones graves de la conducción auriculo-ventricular), a menos de que un marcapasos sea implementado.
- Si padece enfermedad del seno del corazón y no se le ha implantado un marcapasos. Si sufre colapso cardiovascular o hipotensión arterial grave.
- Si padece alguna enfermedad relacionada con la glándula tiroides.
- Si está embarazada excepto en circunstancias especiales o en período de lactancia (ver apartado “Embarazo y lactancia”).
- En asociación con medicamentos que puedan producir “torsade de pointes” (problemas graves del ritmo cardiaco): ver apartado “Uso de Trangorex con otros medicamentos”.
- En niños prematuros, neonatos (menores de 1 mes de edad) o en niños menores de 3 años de edad.
Si padece hipotensión (tensión arterial baja), insuficiencia respiratoria grave, miocardiopatía, insuficiencia cardiaca o parada cardíaca, no debe administrarse este medicamento en forma de inyección intravenosa.
Todas las contraindicaciones arriba mencionadas no aplican cuando el médico utilice amiodarona para la resucitación cardiopulmonar (situación en la que el paciente ha sufrido una parada cardio-respiratoria) en el tratamiento de fíbrilación ventricular resistente a la desfíbrilación.
Advertencias y precauciones
y bajo demás
Amiodarona por vía inyectable debe ser empleada únicamente en medio hospitalario especializado control permanente (electrocardiograma, tensión arterial).
La administración intravenosa (directa) debe limitarse a las situaciones de urgencia cuando las alternativas terapéuticas fracasen.
La disminución del ritmo cardiaco puede ser más pronunciada en pacientes mayores de 65 años.
Hay casos en los que se pueden producir nuevas arritmias o agravarse las arritmias tratadas. Esto suele suceder cuando se asocia con otros medicamentos o con alteraciones de los electrolitos (como por ejemplo las alteraciones de los niveles de calcio en sangre). En estos casos debe valorarse la retirada del tratamiento con este medicamento.
Debe tomarse especial precaución en caso de hipotensión, insuficiencia respiratoria grave, insuficiencia cardiaca grave o miocardiopatía descompensada.
Cuando se toma Trangorex junto con medicamentos antivirales para tratar la hepatitis C (como sofosbuvir, daclatasvir, simeprevir o ledipasvir), podría aparecer bradicardia (reducción del ritmo cardiaco) y bloqueo cardiaco graves, por lo que su médico le controlará estrechamente. Si le indican que debe tomar medicamentos antivirales para tratar la hepatitis C, informe a su médico si está tomando Trangorex, o incluso si lo dejó de tomar hace tiempo (ver apartado “Uso de Trangorex con otros medicamentos”).
Durante el tratamiento, su médico puede indicar la realización de pruebas: radiografía de tórax (para descartar que se produzcan complicaciones respiratorias), determinación de las transaminasas mediante análisis de sangre (antes de iniciar el tratamiento y regularmente mientras dure el tratamiento, para controlar que su hígado funcione correctamente), y niveles en sangre de potasio.
Consulte a su médico en el caso de que aparezcan alteraciones de la vista: visión borrosa, disminución de la visión, visión de halos de color, sensación de niebla. Si apareciera alguno de estos problemas debe practicarse un examen completo de la vista.
Anestesia: antes de una intervención quirúrgica, debe advertirse al anestesista que al paciente se le está administrando amiodarona.
Durante el tratamiento, podrían aparecer alteraciones en la piel (reacciones bullosas graves) como el Síndrome de Stevens-Johnson o como la necrólisis epidérmica tóxica, que podrían ser muy graves o incluso
mortales (ver sección 4). Si apareciesen síntomas o signos del Síndrome de Stevens-Johnson o de la necrólisis epidérmica tóxica (erupción cutánea progresiva a menudo con ampollas o lesiones de las mucosas), el tratamiento con amiodarona debe interrumpirse de inmediato.
No se ha establecido la seguridad y eficacia de amiodarona en niños, por lo que no se recomienda la administración de amiodarona en niños.
Recientemente se han comunicado casos de toxicidad en hígado tras su administración intravenosa que pudieran deberse al disolvente (polisorbato 80) más que al propio medicamento.
Antes de iniciar el tratamiento con amiodarona, en el caso de que los niveles en sangre de potasio sean bajos, éstos deben corregirse.
Uso de Trangorex con otros medicamentos
Este medicamento puede alterar la respuesta de otros medicamentos; por tanto, debe informar a su médico
si está tomando o ha tomado recientemente cualquier otro medicamento, incluso los adquiridos sin receta.
Su médico decidirá qué medicación debe abandonar o si debe modificarse la dosis.
1- Medicamentos que puedan inducir torsades de pointes (problemas graves del ritmo cardiaco) o
prolongación del intervalo QT:
- Medicamentos que inducen torsades de pointes
Está contraindicado el tratamiento asociado con medicamentos que puedan inducir torsades de pointes:
• Medicamentos utilizados para controlar el ritmo irregular del corazón como los medicamentos antiarrítmicos de Clase la (quinidina, hidroquinidina, disopiramida), sotalol, bepridil.
• Medicamentos no antiarrítmicos como vincamina (utilizado para aumentar la cantidad de oxígeno en el cerebro), algunos medicamentos neurolépticos (medicamentos que tienen un efecto sedante y que disminuyen la ansiedad como la clorpromazina, levomepromazina, tioridazina, trifluoperazina, haloperidol, amisulprida, sulpirida, tiaprida, pimozida), cisaprida (utilizada para tratar el reflujo esofágico), eritromicina intravenosa (antibiótico), pentamidina (cuando este antibiótico se administra por vía parenteral), ya que hay mayor riesgo de torsades de pointes potencialmente fatales.
- Medicamentos que prolongan el intervalo QT
La administración de amiodarona junto con medicamentos que prolongan el intervalo QT debe basarse en una cuidadosa evaluación de los riesgos y beneficios para cada paciente, ya que el riesgo de torsades de pointes puede incrementarse. Debe monitorizarse la prolongación del intervalo QT.
También debe evitarse el uso de un tipo de antibióticos (fluorquinolonas) durante el tratamiento con
amiodarona.
2 - Medicamentos que reducen el ritmo cardiaco o producen automoticidad o trastornos de la conducción:
No se recomienda el tratamiento con los siguientes medicamentos:
• Con otros antiarrítmicos (para controlar el ritmo irregular del corazón) o medicamentos que pudieran producir arritmia (alteración del ritmo del corazón, como fenotiazinas, antidepresivos tricíclicos, terfenadina).
• Beta-bloqueantes e inhibidores de los canales de calcio que disminuyen la frecuencia cardiaca (verapamilo, diltiazem).
• Con medicamentos antivirales para tratar la hepatitis C (como sofosbuvir, daclatasvir, simeprevir o ledipasvir) debido a que puede producir bradicardia grave. Si no se puede evitar la administración conjunta, su médico le controlará estrechamente (ver apartado “Advertencias y precauciones”).
3- Agentes que pueden inducir hipopotasemia:
El tratamiento combinado con los siguientes medicamentos no está recomendado:
• Laxantes estimulantes que pueden inducir disminución de los niveles de potasio en sangre y por tanto aumentar el riesgo de torsades de pointes.
Se debe tener especial cuidado cuando amiodarona se combina con los siguientes medicamentos:
• Diuréticos que disminuyen los niveles de potasio en sangre solos o asociados, corticosteroides, tetracosactida (utilizado para diagnosticar problemas suprarrenales y para tratar la colitis ulcerosa), amfotericina B por vía intravenosa (antibiótico).
• Anticoagulantes orales: (acenocumarol, warfarina, dabigatran) ya que aumenta el riesgo de hemorragia.
• Digitálicos (utilizados para tratar la insuficiencia cardiaca), fenitoína (antiepiléptico), flecainida (para tratar problemas del ritmo del corazón), ciclosporina (antibiótico), fentanilo (para tratar el dolor), lidocaína (para tratar el dolor), tacrolimus (utilizado para disminuir las defensas), sildenafilo (para tratar problemas de erección del pene), midazolam (relajante muscular y antiepiléptico), triazolam (para tratar la ansiedad), dihidroergotamina (para tratar las migrañas), ergotamina (para tratar las migrañas), colchicina (para tratar la gota), ya que puede aparecer un incremento de las concentraciones en sangre de estos medicamentos.
• Estatinas como la simvastatina, atorvastatina y lovastatina (medicamentos utilizados para disminuir los niveles altos de grasas en sangre, principalmente colesterol y triglicéridos), ya que aumenta el riesgo de toxicidad en el músculo (por ejemplo rabdomiólisis, una enfermedad que se caracteriza por la descomposición del tejido muscular).
Anestesia general
Se han observado complicaciones potencialmente graves tras la asociación con anestésicos generales.
Amiodarona contiene yodo y puede interferir en la captación de yodo marcado. Sin embargo, las pruebas tiroideas (T3 libre, T4 libre y TSHus) siguen siendo interpretables.
Se recomienda evitar tomar zumo de pomelo durante el tratamiento con amiodarona, ya que se pueden incrementar los niveles de amiodarona.
Comunique a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Embarazo y lactancia
En caso de embarazo no debe administrarse Trangorex, salvo si los beneficios superan los riesgos, debido a que afecta a la glándula tiroidea del feto. Informe a su médico si está embarazada o cree que pudiera estarlo.
En caso de lactancia no debe administrarse Trangorex, debido a que pasa a la leche materna en cantidad significativa.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene la intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Trangorex contiene alcohol bencílico
Este medicamento no se debe administrar a niños prematuros ni recién nacidos porque contiene 60 mg por ampolla (20 mg/ml) de alcohol bencílico como conservante.
Podría provocar reacciones tóxicas y reacciones alérgicas en niños menores de 3 años de edad.
3. Cómo usar Trangorex
El tratamiento sólo se iniciará bajo supervisión del médico especialista. En caso de duda, consulte de nuevo a su médico.
La administración intravenosa directa en bolo está generalmente desaconsejada a causa de los riesgos hemodinámicos (hipotensión grave, colapso cardiovascular); por tanto, siempre que sea posible es preferible la administración mediante perfusión intravenosa. La administración intravenosa directa debe limitarse a situaciones de urgencia.
No añadir ningún otro producto en la misma jeringa. No administrar otras preparaciones en la misma línea. En caso de que el tratamiento deba prolongarse, iniciar una perfusión continua.
Los médicos o profesionales del sector sanitario deberán consultar el apartado “INFORMACIÓN PARA EL PERSONAL SANITARIO” al final de este prospecto.
En pacientes mayores de 65 años se recomienda comenzar con la dosis más baja teniendo en cuenta la función cardiaca, renal y hepática del paciente, así como cualquier otra enfermedad o medicación que se esté tomando.
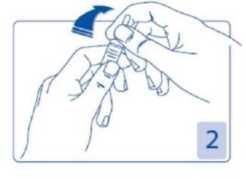
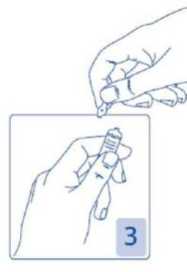
Apertura de la ampolla
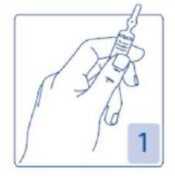
Sujetar firmemente la ampolla, con el punto coloreado mirando hacia usted (Figura 1).
Sujetar la cabeza de la ampolla entre el dedo pulgar e índice (el pulgar sobre el punto coloreado); después presionar hacia atrás (Figura 2 y 3).
Uso en niños y adolescentes
Los datos sobre la seguridad y eficacia en niños son limitados. Su médico decidirá la dosis apropiada.
Siga estas instrucciones a menos que su médico le haya dado otras indicaciones distintas.
Consulte a su médico o farmacéutico si tiene dudas.
Si usa más Trangorex del que debe
Si ha recibido más medicamento del que debiera, deberá recibir tratamiento sintomático. Ni amiodarona ni sus metabolitos se eliminan a través de diálisis.
En caso de sobredosis o ingestión accidental, consultar al Servicio de Información Toxicológica teléfono 91 562 04 20, indicando el medicamento y la cantidad tomada.
3E
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos observados según su frecuencia de presentación, muy frecuentes (pueden afectar a más de 1 de cada 10 personas); frecuentes (pueden afectar hasta 1 de cada 10 personas); poco frecuentes (pueden afectar hasta 1 de cada 100 personas); raros (pueden afectar hasta 1 de cada 1.000 personas); muy raros (pueden afectar hasta 1 de cada 10.000 personas); frecuencia no conocida (no se puede estimar la frecuencia a partir de los datos disponibles), han sido:
De la sangre y del sistema linfático:
• Frecuencia no conocida: Reducción en el número de neutrófilos de la sangre (neutropenia), reducción en el número de leucocitos de la sangre (agranulocitosis).
Cardiacos:
• Frecuentes: Ritmo cardiaco débil (bradicardia) de forma moderada que varía en función de la dosis administrada.
• Muy raros: Ritmo cardiaco débil (bradicardia) de forma acusada. En algunos casos, principalmente en pacientes con disfunción sinusal y/o mayores de 65 años, requiere la supresión del tratamiento. Aparición o empeoramiento de la arritmia (cambio en el ritmo cardiaco), a veces seguido de paro cardiaco. Estos efectos se producen con menor frecuencia que con la mayoría de los otros antiarrítmicos y se observan, generalmente, con ciertas asociaciones medicamentosas o trastornos electrolíticos. Alteraciones de la conducción del impulso nervioso del corazón.
• Frecuencia no conocida: Torsades de pointes.
Endocrinos:
• Muy raros: Sensación de malestar, confusión o debilidad, náuseas (ganas de vomitar), pérdida de apetito, irritabilidad. Éstos podrían ser síntomas inactivos de una enfermedad llamada “síndrome de secreción inadecuada de hormona antidiurética (SIADH)".
• Frecuencia no conocida: Hipertiroidismo (cuando las glándulas tiroides producen más hormona tiroidea que la que el cuerpo necesita).
Oculares:
• Muy raros: Inflamación del nervio óptico (neuritis óptica) que puede progresar a ceguera (ver sección 2 “Advertencias y precauciones”).
Gastrointestinales:
• Muy raros: Náuseas.
• Frecuencia no conocida: Inflamación repentina del páncreas (pancreatitis aguda).
Generales y en el lugar de administración:
• Frecuentes: En el punto de inyección puede aparecer dolor, manchas rojas (eritema), hinchazón de la piel por acumulación de líquido (edema), ennegrecimiento (necrosis), salida de líquido (extravasación), acumulación de líquido (infiltración), inflamación, endurecimiento (induración), inflamación de las venas (flebitis, tromboflebitis), celulitis, infección, cambios en la pigmentación. Puede evitarse con la colocación de un catéter central.
Hepatobiliares:
• Muy raros: Aumento de forma aislada y a menudo moderada de las transaminasas (relacionadas con la función del hígado) al inicio del tratamiento. Esto puede remitir al reducir las dosis o incluso de forma
espontánea. Alteraciones agudas del hígado con aumento en sangre de las transaminasas y/o coloración amarilla de la piel (ictericia), que pueden poner en peligro su vida.
La aparición de reacciones adversas con amiodarona es frecuente, particularmente a nivel cardiaco, pulmonar y hepático. En ocasiones, estas manifestaciones están relacionadas con la dosis y revierten tras una reducción de la dosis.
Sistema inmunológico:
• Muy raros: Reacción alérgica grave que puede poner en peligro su vida (shock anafiláctico).
• Frecuencia no conocida: También puede producirse hinchazón por acumulación de líquido bajo la piel (Edema de Quincke).
Musculares y esqueléticos:
• Frecuencia no conocida: Dolor de espalda.
Sistema nervioso:
• Muy raros: Aumento de la tensión craneal de tipo benigno, dolor de cabeza.
Psiquiátricos:
• Frecuencia no conocida: Estado de confusión (delirio), alucinaciones.
Aparato reproductor:
• Frecuencia no conocida: Disminución del apetito sexual (disminución de la libido).
Respiratorios:
• Muy raros: Neumonía o fibrosis (enfermedad pulmonar en la que se forma tejido fibroso), en ocasiones mortales (ver sección 2 “Advertencias y precauciones”), complicaciones respiratorias graves. Contracción de los músculos bronquiales (broncoespasmo) y/o falta de respiración (apnea) en caso de insuficiencia respiratoria grave, principalmente en pacientes asmáticos. Generalmente son reversibles tras finalizar el tratamiento.
De la piel y del tejido subcutáneo:
• Frecuentes: Rash pruriginoso enrojecido (eczema).
• Muy raros: Sudoración.
• Frecuencia no conocida: Urticaria, que se caracteriza por la aparición de ronchas, irritación y picor de la piel. Reacciones cutáneas amenazantes para la vida caracterizadas por erupción cutánea, ampollas, descamación y dolor (necrólisis epidérmica tóxica (NET)), síndrome de Stevens-Johnson (SSJ), dermatitis bullosa, reacción al medicamento con eosinofilia y síntomas sistémicos (DRESS).
Vasculares:
• Frecuentes: Disminución de la tensión de la sangre, generalmente moderada y de forma transitoria. En
caso de sobredosis o de una inyección demasiado rápida puede aparecer hipotensión grave o colapso.
• Muy raros: Sofocos.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier otro efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
Comunicación de efectos adversos:
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano:
https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Trangorex
No conservar a temperatura superior a 25°C.
Conservar las ampollas en el envase para protegerlas de la luz.
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en las ampollas. La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos
que no necesita en el Punto SIGRE de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Trangorex
- El principio activo es amiodarona clorhidrato.
- Los demás componentes son: alcohol bencílico (60 mg por ampolla), polisorbato 80 y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
La solución inyectable es un líquido de color amarillo pálido. Se presenta en ampollas de vidrio incoloro. Cada ampolla contiene 3 ml de solución inyectable.
Envase normal: contiene 6 ampollas.
Envase clínico: contiene 120 ampollas.
Titular de la autorización de comercialización y responsable de la fabricación Titular:
sanofi-aventis, S.A.
C/ Josep Pla 2 08019 - Barcelona
Responsable de la fabricación:
Delpharm Dijon 6, boulevard de l’Europe 21800 Quétigny (Francia)
Fecha de la última revisión de este prospecto: Febrero 2016.
INFORMACIÓN PARA EL PERSONAL SANITARIO
Esta información está destinada únicamente a médicos o profesionales del sector sanitario. Ver apartado "Advertencias y precauciones”.
Posología y forma de administración
Tratamiento de ataque o inicial, son posibles dos alternativas:
Perfusión intravenosa
• Dosis inicial o de ataque: la dosis habitual es de 5 mg/kg de peso administrada en 250 ml de dextrosa al 5 % exclusivamente, administrado en un período de 20 minutos a 2 horas. La perfusión puede repetirse de 2 a 3 veces en 24 horas. Se debe ajustar la velocidad de perfusión según la respuesta clínica.
• La acción se manifiesta desde los primeros minutos y va disminuyendo paulatinamente, por lo que
debe instaurarse una perfusión de mantenimiento.
• Dosis de mantenimiento: de 10 a 20 mg/kg de peso/24 horas (generalmente de 600 a 800 mg/24 horas, límite 1.200 mg/24 horas) en 250 ml de dextrosa al 5% durante varios días. Tomar el relevo de la administración oral desde el primer día de perfusión.
Inyección intravenosa (ver apartado “Tenga especial cuidado con Trangorex”).
La dosis es de 5 mg/kg de peso. La duración de la inyección no debe ser nunca inferior a 3 minutos. No debe mezclarse con otras preparaciones en la misma jeringa.
Resucitación cardiopulmonar en el tratamiento de fibrilación ventricular resistente a la desfibrilación: La dosis inicial IV es de 300 mg (o 5 mg/kg de peso) diluidos en 20 ml de dextrosa al 5%, e inyectados rápidamente. Se debe tener en cuenta una dosis IV adicional de 150 mg (o 2,5 mg/kg de peso) si la fibrilación ventricular persiste.
Excepto en resucitación cardiopulmonar, la amiodarona debe inyectarse en un tiempo nunca inferior a 3 minutos y no debe ser administrada una segunda inyección intravenosa directa antes de que pasen 15 minutos tras la primera inyección, aunque solamente se haya administrado una única ampolla (riesgo de colapso irreversible).
La utilización de equipo médico o productos que contengan material plástico de tipo DEHP (di-2-etilexil ftalato) en presencia de amiodarona puede producir la dilución de dicho material. Con el fin de minimizar la exposición de los pacientes al DEHP, la dilución final de amiodarona para perfusión debe administrarse preferiblemente con materiales que no contengan DEHP.
No añadir ningún otro producto en la misma jeringa. No administrar otras preparaciones en la misma línea. En caso de que el tratamiento deba prolongarse, iniciar una perfusión continua.
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
3E
¡y
taños
9 de 9