Tisseel Soluciones Para Adhesivo Tisular
Adhesivo tisular de fibrina VH S/D 500 congelado
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
TISSEEL Soluciones para adhesivo tisular
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Componente 1: Solución de proteína sellante
Fibrinógeno humano (como proteína coagulable) 91 mg'/ml
Aprotinina (sintética) 3000 UIC2/ml
Excipiente con efecto conocido:
Polisorbato 80 0,6-1,9 mg/ml
Componente 2: Solución de trombina
Trombina humana 500 UI3/ml
Cloruro de calcio 40 mmol/ml
1 ml, 2 ml ó 5 ml de solución de proteína sellante (con aprotinina sintética) y 1 ml, 2 ml ó 5 ml de solución de trombina (con cloruro de calcio) se combinan para dar lugar a 2, 4 ó 10 ml de una solución para adhesivo tisular de fibrina lista para su uso.
|
Después de la mezcla |
1 ml |
2 ml |
4 ml |
10 ml |
|
Componente 1: Solución de proteína sellante Fibrinógeno humano (como proteína coagulable) Aprotinina sintética |
45,5 mg 1500 UIC |
91 mg 3000 UIC |
182 mg 6000 UIC |
455 mg 15000 UIC |
|
Componente 2: Solución de trombina Trombina humana Cloruro de calcio |
250 UI 20 ^mol |
500 UI 40 ^mol |
1000 UI 80 ^mol |
2500 UI 200 ^mol |
TISSEEL contiene factor XIII humano copurificado con fibrinógeno humano en un rango de 0,6-5 UI/ml.
Para consultar la lista completa de excipientes, ver sección 6.1.
1
2 3
Contenido en una concentración total de proteína de 96-125 mg/ml
1 UFE (Unidad de Farmacopea Europea) corresponde a 1.800 UIC (Unidades Inactivador Calidinogenasa)
La actividad de la trombina se calculó utilizando el Estándar Internacional actual de la OMS para la trombina.
3. FORMA FARMACÉUTICA
Soluciones para adhesivo tisular
Las soluciones congeladas son de incoloras a amarillo pálido y opalescente. Después de la descongelación: son de incoloras a amarillo pálido.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de apoyo donde las técnicas quirúrgicas estándar no parecen suficientes (ver sección 5.1)
• Para la mejora de la hemostasia
• Como sellante de tejidos, para mejorar la cicatrización de las heridas o como refuerzo de suturas en cirugía vascular y anastomosis gastrointestinales.
• Para la adhesión tisular, para mejorar la adhesión del tejido separado (por ejemplo, colgajos de tejido, injertos, injertos de piel de espesor parcial [injertos mallados).
Se ha demostrado la eficacia en pacientes totalmente heparinizados.
4.2 Posología y forma de administración
El uso de TISSEEL se limita a cirujanos experimentados que hayan sido debidamente formados acerca del uso de TISSEEL.
Posología
Tanto la cantidad de TISSEEL que se debe aplicar como la frecuencia de aplicación deben estar siempre orientadas a las necesidades clínicas subyacentes del paciente.
La dosis que se debe aplicar depende de algunas variables como el tipo de intervención quirúrgica, el tamaño de la superficie afectada, el modo de aplicación y el número de aplicaciones.
El médico debe individualizar la aplicación del producto. En ensayos clínicos, las dosis individuales han oscilado normalmente entre 4 y 20 ml. Puede que sea necesario aplicar volúmenes mayores en algunos procedimientos (p. ej., lesiones hepáticas o sellado de grandes superficies quemadas).
Debe aplicarse una cantidad inicial de producto, en la zona anatómica o en la superficie destinada a ser tratada, suficiente para cubrir completamente el área de aplicación deseada. Si es necesario, la aplicación puede repetirse. Sin embargo, se debe evitar volver a aplicar TISSEEL en una zona que tenga TISSEEL polimerizado ya que el producto no puede adherirse a una capa polimerizada.
Como guía para el sellado de superficies, 1 envase de TISSEEL de 2 ml (1 ml de solución de proteína sellante más 1 ml de solución de trombina) será suficiente, como mínimo, para un área de 10 cm2.
Al aplicar TISSEEL con un equipo pulverizador, la misma cantidad será suficiente para cubrir áreas considerablemente mayores, dependiendo de la indicación y del caso concreto.
Para evitar la excesiva formación de tejido de granulación y para asegurar la absorción gradual del adhesivo tisular de fibrina solidificado, debe aplicarse una capa lo más fina posible de TISSEEL.
Población pediátrica
No se ha establecido la seguridad y eficacia de TISSEEL en pacientes pediátricos.
Forma de administración
Para uso epilesional.
Para garantizar un uso seguro y óptimo de TISSEEL por pulverización se deben seguir las siguientes recomendaciones:
En cirugía abierta: se debe utilizar un equipo con regulador de presión que proporcione una presión máxima que no supere los 2,0 bares (28,5 psi).
En procedimientos laparoscópicos o mínimamente invasivos: se debe utilizar un equipo con regulador de presión que proporcione una presión máxima que no supere los 1,5 bares (22 psi) y utilice como gas únicamente dióxido de carbono.
Antes de aplicar TISSEEL es necesario secar la superficie de la herida utilizando para ello una técnica estándar (por ejemplo, aplicación intermitente de compresas, torundas, el uso de dispositivos de succión). No utilice aire presurizado ni gas para secar la zona.
TISSEEL solo debe pulverizarse sobre zonas de aplicación que estén visibles.
TISSEEL se debe reconstituir y administrar exactamente como se especifica en las instrucciones y sólo con los equipos recomendados para este producto (ver sección 6.6).
Para la aplicación por pulverización, ver secciones 4.4 y 6.6 que incluyen recomendaciones específicas relativas a la presión y a la distancia del tejido adecuadas para cada procedimiento quirúrgico y longitud de la punta aplicadora.
En los procedimientos quirúrgicos que requieran el uso de volúmenes mínimos de adhesivo tisular de fibrina, es recomendable expulsar y desechar las primeras gotas del producto.
4.3 Contraindicaciones
No está indicado el tratamiento de hemorragias arteriales o venosas masivas e intensas únicamente con TISSEEL
TISSEEL no está indicado para reemplazar las suturas de la piel realizadas para cerrar una herida quirúrgica.
TISSEEL nunca debe aplicarse por vía intravascular. La aplicación intravascular puede resultar en eventos tromboembólicos que pueden poner en peligro la vida.
TISSEEL no se debe aplicar en caso de hipersensibilidad a los principios activos o a alguno de los excipientes.
4.4 Advertencias y precauciones especiales de empleo
Solamente para uso epilesional. No aplicar intravascularmente.
Pueden producirse complicaciones tromboembólicas perjudiciales para la vida si se aplica la preparación de forma intravascular por accidente.
Se debe tener precaución al aplicar un adhesivo tisular de fibrina utilizando gas presurizado.
Cualquier aplicación de gas presurizado está asociada con un riesgo potencial de embolia gaseosa (aire o gas), rotura de tejido o atrapamiento de gas con compresión, que pueden poner en peligro la vida.
Aplicar TISSEEL en capa fina. Un coágulo excesivamente grueso puede afectar negativamente a la eficacia del producto y al proceso de cicatrización de la herida.
Se han producido casos de embolia gaseosa (aire o gas) que pueden ser graves o poner en peligro la vida asociados al uso de equipos pulverizadores que incorporan un regulador de presión para aplicar los adhesivos tisulares de fibrina. Estos casos parecen estar relacionados con el uso de equipos pulverizadores a presiones superiores a las recomendadas y/o a una distancia muy próxima a la superficie tisular. El riesgo parece ser mayor cuando los adhesivos tisulares de fibrina se pulverizan con aire, en comparación con CO2 y, por lo tanto, no se puede excluir con TISSEEL cuando se pulveriza durante una intervención quirúrgica de una herida abierta.
Al aplicar TISSEEL con un equipo pulverizador, se debe asegurar de que la presión se encuentra en el intervalo de presión recomendado por el fabricante del equipo pulverizador (ver tabla en la sección 6.6 para conocer los valores de presión y distancia).
La aplicación de TISSEEL por pulverización solo se debe realizar si es posible determinar con precisión que la distancia de pulverización es la recomendada por el fabricante. No pulverizar a una distancia inferior a la recomendada.
Siempre que se pulverice TISSEEL,y debido a que cabe la posibilidad de que se produzca una embolia gaseosa (aire o gas), se deben monitorizar los cambios en la presión arterial, el pulso, la saturación de oxígeno y el nivel de CO2 al final de la espiración (ver también sección 4.2).
No se debe utilizar TISSEEL con el sistema Easy Spray/Spray Set en espacios anatómicos confinados.
Antes de la administración de TISSEEL, se debe tener la precaución de proteger/cubrir suficientemente las partes del cuerpo exteriores al área de aplicación para prevenir cualquier adhesión de tejido de áreas no deseadas.
Si se aplican los adhesivos tisulares de fibrina en espacios reducidos, por ejemplo el cerebro o la médula espinal, se debe tener en cuenta el riesgo de complicaciones debidas a la compresión.
Para garantizar una mezcla adecuada del componente de proteína sellante y del componente de trombina, las primeras gotas del producto de la cánula de aplicación se deben expulsar y desechar inmediatamente antes del uso.
Como con cualquier producto que contenga proteínas, se pueden producir reacciones de hipersensibilidad de tipo alérgico.
La aplicación intravascular podría aumentar la probabilidad y la gravedad de las reacciones de hipersensibilidad aguda en pacientes susceptibles.
Con el uso de TISSEEL se han notificado reacciones de hipersensibilidad y anafilácticas (incluyendo también las fatales, como shock anafiláctico). Los signos de las reacciones de hipersensibilidad incluyen ronchas, urticaria generalizada, opresión en el pecho, sibilancias e hipotensión. Si aparecen estos síntomas, debe interrumpirse inmediatamente la administración y se deben aplicar las medidas estándar actualmente válidas para el tratamiento del shock. El producto restante se debe retirar del lugar de la aplicación.
TISSEEL contiene una proteína sintética (aprotinina). Incluso si su aplicación es estrictamente local, existe un riesgo de reacción anafiláctica asociado a la presencia de aprotinina. El riesgo parece aumentar cuando ha habido exposiciones anteriores, aunque estas se hayan tolerado perfectamente.
Por tanto, cualquier uso de aprotinina o de productos que contengan aprotinina debe incluirse en el historial de los pacientes.
Debido a que la aprotinina sintética es estructuralmente idéntica a la aprotinina bovina, el uso de TISSEEL en pacientes con alergia a proteínas bovinas se debe evaluar cuidadosamente.
En dos estudios retrospectivos, no aleatorizados en cirugía de bypass coronario, los pacientes que recibieron adhesivo tisular de fibrina mostraron un incremento estadísticamente significativo del riesgo de mortalidad. Aunque estos estudios no proporcionaron una determinación de causalidad, no puede excluirse el incremento del riesgo asociado con el uso de TISSEEL en estos pacientes. Por tanto, se debe tener un cuidado especial para evitar la administración intravascular accidental de este producto.
La inyección en la mucosa nasal se debe evitar ya que pueden ocurrir complicaciones tromboembólicas en la zona de la arteria oftálmica.
La inyección de TISSEEL en el tejido conlleva el riesgo de daño tisular local.
Aplicar TISSEEL en capa fina. Un coágulo excesivamente grueso puede interferir negativamente a la eficacia del producto y en el proceso de cicatrización de la herida.
El polisorbato 80 puede causar irritaciones de la piel localizadas como dermatitis de contacto.
Para prevenir la transmisión de enfermedades infecciosas cuando se administran medicamentos derivados de sangre o plasma humanos se toman medidas estándar como la selección de donantes, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar/inactivar virus. A pesar de ésto, cuando se administran medicamentos derivados de sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no puede excluirse totalmente. Esto también se refiere a virus y agentes infecciosos emergentes o de naturaleza desconocida.
Las medidas adoptadas se consideran eficaces para los virus envueltos como el virus de la inmunodeficiencia humana (VIH), virus de la hepatitis B (VHB), virus de la hepatitis C (VHC) y para los no envueltos virus de la hepatitis A (VHA).
Los procedimientos de inactivación/eliminación pueden tener un valor limitado para virus no envueltos tales como el parvovirus B19. La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para sujetos con immunodeficiencias o con una producción aumentada de hematíes (p. ej., con anemia hemolítica).
Se debe considerar la vacunación adecuada (hepatitis A y B) en el caso de pacientes a los que se les administra de forma regular o repetida sellantes de fibrina derivados de plasma humano.
Se recomienda encarecidamente que cada vez que se administre ARTISS a un paciente, se deje constancia del nombre y el número de lote del producto, para poder mantener la trazabilidad entre el paciente y el lote del producto.
Las preparaciones que contienen oxicelulosa no deben ser utilizadas con TISSEEL (ver sección 6.2 Incompatibilidades).
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones. Como sucede con productos parecidos o soluciones de trombina, el producto puede desnaturalizarse si se expone a soluciones que contienen alcohol, yodo o metales pesados (p. ej., soluciones antisépticas). Esas sustancias deben eliminarse en la medida de lo posible antes de aplicar el producto.
Ver también la sección 6.2.
4.6 Fertilidad, embarazo y lactancia
No se ha establecido la seguridad de los adhesivos tisulares de fibrina/hemostáticos en mujeres embarazadas o en periodo de lactancia en ensayos clínicos controlados. Los estudios experimentales realizados en animales no son suficientes para evaluar la seguridad con respecto a la reproducción, el desarrollo del embrión o del feto, el curso de la gestación y el desarrollo peri y postnatal.
Por tanto, el producto no se debe administrar a mujeres embarazadas o en periodo de lactancia a no ser que sea estrictamente necesario.
Para información sobre infección por parvovirus B19, ver sección 4.4.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
En pacientes tratados con adhesivos tisulares de fibrina/hemostáticos pueden aparecer casos raros de hipersensibilidad o reacciones alérgicas (que pueden incluir, aunque no se limitan, angioedema, ardor y picor en el punto de aplicación, bradicardia, broncoespasmo, escalofríos, disnea, eritema transitorio (“sofocos”), urticaria generalizada, cefalea, ronchas, hipotensión, letargo, náuseas, prurito, inquietud, parestesia, taquicardia, opresión en el pecho, hormigueo, vómitos, sibilancias), las reacciones anafilácticas y shock anafiláctico han incluido los resultados fatales.
En casos aislados, estas reacciones han progresado a anafilaxia grave. Estas reacciones pueden ocurrir especialmente si la preparación se aplica de forma repetida o si se administra a pacientes con hipersensibilidad conocida a la aprotinina (ver sección 4.4) o a cualquiera de los componentes del producto.
Incluso si se toleró bien un tratamiento repetido con TISSEEL, una administración posterior de TISSEEL o una administración sistémica de aprotinina puede dar lugar a reacciones anafilácticas graves.
Raramente pueden producirse anticuerpos frente a los componentes del adhesivo tisular de fibrina/hemostático.
La inyección intravascular accidental puede producir eventos tromboembólicos y CID (Coagulación Intravascular Diseminada). También puede existir el riesgo de reacciones anafilácticas (ver sección 4.4).
Para información sobre seguridad de agentes transmisibles, ver sección 4.4.
Las reacciones adversas descritas en esta sección fueron notificadas durante los ensayos clínicos que investigaron la seguridad y eficacia de TISSEEL y durante la experiencia poscomercialización (señalados con una p en la tabla de reacciones adversas a continuación) con los adhesivos tisulares de fibrina de Baxter. En estos ensayos, TISSEEL se administró como complemento a la hemostasia en cirugía cardiaca, vascular y de sustitución total de cadera, así como en cirugía de hígado y de bazo. Otros ensayos clínicos incluyeron el sellado de los vasos linfáticos en pacientes sometidos a disección de ganglios axilares, el sellado de anastomosis de colon y el sellado de la duramadre en la fosa posterior. Dado que la frecuencia de los acontecimientos adversos observados en la experiencia postcomercialización no pueden ser calculados, en los casos en los que fue posible, se calculó el límite superior con un intervalo del 95% de confianza utilizando una “regla de tres” del siguiente modo: 3/1146=0,0026 o 0,26% que corresponde a “Poco frecuentes” (donde “1146” es el número total de sujetos que han recibido TISSEEL en los ensayos clínicos de los cuales se ha extraído la información incluida en esta Ficha Técnica).
Muy frecuentes (> 1/10)
Frecuentes (> 1/100 a <1/10)
Poco frecuentes (> 1/1.000 a <1/100)
Raras (> 1/10.000 a <1/1.000)
Muy raras (< 1/10.000)
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
|
Clasificación de órganos del sistema (SOC) |
Término preferido MedDRA |
Frecuencia |
|
Infecciones e infestaciones |
Infección postquirúrgica de la herida |
Frecuentes |
|
Trastornos de la sangre y del sistema linfático |
Aumento de los productos de degradación de la fibrina |
Poco frecuentes |
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidad*p |
Poco frecuentes |
|
Reacciones anafilácticas* p |
Poco frecuentes | |
|
Shock anafiláctico* p |
Poco frecuentes | |
|
Parestesia p |
Poco frecuentes | |
|
Broncoespasmo p |
Poco frecuentes | |
|
Sibilancias p |
Poco frecuentes | |
|
Prurito p |
Poco frecuentes | |
|
Eritema p |
Poco frecuentes | |
|
Trastornos del sistema nervioso |
Alteraciones sensoriales |
Frecuentes |
|
Trastornos cardiacos |
Bradicardia p |
Poco frecuentes |
|
Taquicardia p |
Poco frecuentes | |
|
Trastornos vasculares |
Trombosis de la vena axilar** |
Frecuentes |
|
Hipotensión |
Raros | |
|
Hematoma (NEOM) p |
Poco frecuentes | |
|
Embolia arterial p |
Poco frecuentes | |
|
Embolia gaseosa* ** p |
Frecuencia no conocida | |
|
Embolia de arteria cerebral p |
Poco frecuentes | |
|
Infarto cerebral** p |
Poco frecuentes | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea p |
Poco frecuentes |
|
Trastornos gastrointestinales |
Náuseas |
Poco frecuentes |
|
Obstrucción intestinal p |
Poco frecuentes | |
|
Trastornos de la piel y del tejido subcutáneo |
Erupción cutánea |
Frecuentes |
|
Urticaria p |
Poco frecuentes | |
|
Alteración de la cicatrización p |
Poco frecuentes | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor en una extremidad |
Frecuentes |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Dolor |
Frecuentes | |
|
Aumento de la temperatura corporal |
Frecuentes | |
|
Enroj ecimiento p |
Poco frecuentes | |
|
Edema p |
Poco frecuentes | |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
Dolor asociado al procedimiento |
Poco frecuentes |
|
Seroma |
Muy frecuentes | |
|
Angioedema p |
Poco frecuentes |
* Las reacciones anafilácticas y el shock anafiláctico incluyen resultados fatales.
** Como resultado de la aplicación intravascular en el seno petrosal superior.
***Como con otros sellantes de fibrina, se han producido casos de embolia gaseosa (aire o gas) que pueden poner en riesgo la vida o ser fatales cuando se utilizan equipos pulverizadores de aire o gas. Estos casos parecen estar relacionados con el uso inadecuado de los equipos pulverizadores ( p. ej., a presiones superiores a las recomendadas y a una distancia muy próxima a la superficie tisular). p Reacción adversa observada durante la experiencia postcomercialización.
Reacciones de clase
Otras reacciones adversas asociadas a la clase adhesivo tisular de fibrina/hemostático incluyen manifestaciones de hipersensibilidad que a su vez incluyen irritación de la zona de aplicación, malestar en el pecho, escalofríos, cefalea, letargo, inquietud y vómitos.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
No se han notificado casos de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hemostáticos locales, código ATC: B02BC; adhesivos tisulares, código ATC: V03AK
El sistema de adhesión de la fibrina imita la última fase de la coagulación sanguínea fisiológica. La conversión de fibrinógeno en fibrina se produce por la separación del fibrinógeno en monómeros de fibrina y fibrinopéptidos. Los monómeros de fibrina se agregan y forman un coágulo de fibrina. El factor XIIIa, generado a partir del factor XIII por mediación de la trombina e iones de calcio, estabiliza el coágulo mediante el enlace cruzado de fibras de fibrina.
A medida que avanza el proceso de cicatrización de la herida, se experimenta un aumento de la actividad fibrinolítica inducida por la acción de la plasmina, y la fibrina empieza a descomponerse en sus productos de degradación. La degradación proteolítica de la fibrina se inhibe mediante antifibrinolíticos. La aprotinina se encuentra presente en TISSEEL como antifibrinolítico para prevenir la degradación prematura del coágulo.
Para el estudio de su eficacia, se utilizaron estudios in vivo en cuatro modelos animales imitando al máximo la situación en pacientes. TISSEEL fue eficaz en relación a la hemostasia principal y secundaria así como en la cicatrización de la herida.
Se han llevado a cabo estudios clínicos que demuestran la hemostasia y el favorecimiento de la sutura en un total de 213 pacientes (120 recibieron TISSEEL, 93 en el grupo control) sometidos a cirugía vascular con conductos ePTFE , en un total de 70 pacientes (35 recibieron TISSEEL, 35 en el grupo control) sometidos a resección hepática y en un total de 317 pacientes (157 con TISSEEL, 160 con una forma predecesora del producto con una única inactivación viral como grupo control) sometidos a cirugía cardiaca con un bypass cardiopulmonar y esternotomía mediana.
La eficacia de TISSEEL como adyuvante a los métodos quirúrgicos convencionales en el sellado de la anastomosis colónica en pacientes con traumatismo sometidos al cierre de colostomías temporales, ha sido demostrada en un estudio clínico randomizado, controlado, prospectivo, unicéntrico llevado a cabo en 1986 en un total de 120 pacientes (61 recibieron TISSEEL, 59 en el grupo control).
5.2 Propiedades farmacocinéticas
TISSEEL está indicado solamente para uso epilesional. La administración intravascular está contraindicada. Por tanto, no se han realizado estudios farmacocinéticos intravasculares con personas.
No se han realizado estudios farmacocinéticos en diferentes especies animales de laboratorio.
Los adhesivos tisulares de fibrina/hemostáticos se metabolizan de la misma forma que la fibrina endógena: por fibrinólisis y fagocitosis.
5.3 Datos preclínicos sobre seguridad
Dada la naturaleza del producto y su especial método de aplicación (normalmente aplicación única y solo en casos excepcionales aplicación repetida de unos pocos ml) y mecanismo de acción (eficacia local sin exposición sistémica o distribución a otros órganos y tejidos), no se dispone de datos preclínicos sobre seguridad para TISSEEL en toxicidad crónica, carcinogenicidad, toxicidad reproductiva y del desarrollo o de estimulación inmunológica.
Los estudios de toxicidad a dosis única en ratas y conejos no indicaron toxicidad aguda de TISSEEL. Además, no se observó evidencia de mutagenicidad en los estudios in vitro apropiados. La solución de proteína sellante también se toleró bien in vitro, en cultivos in vitro de fibroblastos humanos, demostrando una excelente compatibilidad celular y la ausencia de citotoxicidad. Basándose en una revisión detallada de la literatura, puede excluirse cualquier influencia negativa o toxicidad generada por los reactivos residuales de S/D en TISSEEL.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Componente 1: Solución de proteína sellante:
Albúmina humana
L-histidina
Niacinamida
Citrato de sodio dihidratado Polisorbato 80 (Tween 80)
Agua para preparaciones inyectables
Componente 2: Solución de trombina: Albúmina humana
Cloruro de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades
Las preparaciones que contengan celulosa oxidada no se deben utilizar con TISSEEL porque el pH bajo interfiere en la actividad de la trombina.
Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
Conservar y transportar congelado (a < -20 °C) sin interrupción hasta su aplicación.
Conservar en el embalaje original para protegerlo de la luz.
El producto sin abrir, descongelado a 25 °C, puede conservarse hasta 72 horas a una temperatura que no exceda los 25 °C. Si la solución no se utiliza en un plazo de 72 horas tras la descongelación, TISSEEL debe desecharse.
La solución descongelada no se debe volver a congelar o refrigerar en ningún caso.
6.5 Naturaleza y contenido del envase
Contenido del envase con jeringa AST:
- 1ml, 2ml o 5 ml de solución de proteína sellante y 1ml, 2ml o 5 ml de solución de trombina en una jeringa (propileno) de doble cámara precargada, cerrada con un tapón de rosca y envasada en dos bolsas con un dispositivo con dos piezas de unión, 4 cánulas de aplicación y un émbolo de pistón doble.
O
Contenido del envase con el sistema de jeringa Duo:
- 1ml, 2ml o 5ml de solución de proteína sellante y 1ml, 2ml o 5ml de solución de trombina contenidas en dos jeringas precargadas (polipropileno) cerradas con un tapón de rosca, empaquetadas en dos bolsas y con un dispositivo con dos piezas de unión y 4 cánulas de aplicación.
Tamaños de envase:
TISSEEL está disponible en los siguientes tamaños de envase: 1 x 2 ml (1 ml + 1 ml), 1 x 4 ml (2 ml + 2 ml) y 1 x 10 ml (5 ml + 5 ml).
Puede que solamente estén comercializados algunos tamaños de envases.
Pueden obtenerse otros accesorios de BAXTER para la aplicación del producto.
6.6 Precauciones especiales de eliminación y otras manipulaciones General
Antes de la administración de TISSEEL, se debe tener la precaución de cubrir todas las partes del cuerpo exteriores a la superficie de aplicación para prevenir cualquier adhesión de tejido de áreas no deseadas.
Para evitar la adhesión de TISSEEL a guantes e instrumentos quirúrgicos, estos deben humedecerse con una solución de cloruro sódico antes de ponerlos en contacto.
La guía para el sellado de superficies es: un envase de TISSEEL 2 ml (1 ml de solución de proteína sellante más 1 ml de solución de trombina) es suficiente para una superficie de al menos 10 cm2.
La dosis dependerá del tamaño de la superficie que se debe sellar.
Se debe evitar la aplicación secuencial y separada de los dos componentes de TISSEEL.
TISSEEL no se debe exponer a temperaturas superiores a 37 °C y no se debe calentar en microondas. Instrucciones de manipulación y preparación:
Tanto la solución de proteína sellante como la solución de trombina están contenidas en una jeringa lista para usar. El producto está envasado en dos bolsas estériles bajo condiciones asépticas. La bolsa interior y su contenido son estériles siempre que la bolsa exterior esté intacta.
La jeringa lista para usar se puede descongelar mediante uno de los siguientes métodos:
Se recomienda descongelar y calentar los dos componentes del adhesivo tisular utilizando un baño de agua estéril a una temperatura de 33-37 °C. El baño de agua no debe exceder los 37 °C. (Para controlar el rango de temperatura especificado, se debe monitorizar la temperatura del agua utilizando un termómetro y cambiar el agua cuando sea necesario. Si se utiliza el baño de agua estéril para la descongelación y calentamiento, retire la jeringa precargada de las bolsas). Los tapones protectores de la jeringa se deben retirar solo cuando la descongelación se haya completado e, inmediatamente, se debe colocar la cánula de aplicación. No utilizar TISSEEL hasta que se haya descongelado totalmente.
1) Descongelación rápida (baño de agua estéril)
Colocar la bolsa interior en el campo estéril, sacar la jeringa lista para usar de la bolsa interior y colocarla directamente en el baño de agua estéril. Asegurar que el contenido de la jeringa lista para usar queda totalmente sumergido en el agua.
Tabla 1: Tiempos de descongelación y calentamiento con un baño de agua estéril a 33 °C hasta un máximo de 37 °C,
|
Tamaño del envase |
Tiempos de descongelación/calentamiento Baño de agua estéril de 33 °C a 37 °C Producto retirado de las bolsas | |
|
AST |
Sistema de jeringa Duo | |
|
2 ml |
5 minutos |
8 minutos |
|
4 ml |
5 minutos |
9 minutos |
|
10 ml |
12 minutos |
13 minutos |
2) Descongelación en un baño de agua no estéril
De forma alternativa, el producto se puede descongelar en un baño de agua no estéril fuera del campo estéril.
Para ello, mantener la jeringa lista para usar dentro de ambas bolsas y colocarla en un baño de agua fuera del campo estéril durante un período de tiempo adecuado. Asegurar que las bolsas permanezcan sumergidas en el agua durante todo el periodo de descongelación. Después de la descongelación, retirar las bolsas del baño de agua, secar la bolsa exterior y colocar la bolsa interior con la jeringa lista para usar en el campo estéril.
Tabla 2: Tiempos de descongelación y calentamiento fuera del campo estéril con un baño de agua no estéril a 33 °C hasta un máximo de 37 °C
|
Tamaño del envase |
Tiempos de descongelación/calentamiento Baño de agua no estéril de 33 °C a 37 °C Producto en bolsas | |
|
AST |
Sistema de jeringa Duo | |
|
2 ml |
30 minutos |
31 minutos |
|
4 ml |
40 minutos |
46 minutos |
|
10 ml |
80 minutos |
64 minutos |
3) Descongelación en un incubador
Una tercera alternativa es descongelar y calentar los componentes del adhesivo tisular en un incubador a 33 °C hasta un máximo de 37 °C.
Los tiempos de descongelación y calentamiento en un incubador se indican en la tabla 3. Los datos corresponden al producto en las bolsas.
Tabla 3: tiempos de descongelación y calentamiento en incubador a 33 °C hasta un máximo de 37 °C,
|
Tamaño del envase |
Tiempos de descongelación/calentamiento 33 °C a 37 °C, incubador Producto en bolsas | |
|
AST |
Sistema de jeringa Duo | |
|
2 ml |
40 minutos |
62 minutos |
|
4 ml |
85 minutos |
77 minutos |
|
10 ml |
105 minutos |
114 minutos |
4) Descongelación a temperatura ambiente (no superior a 25 °C)
El producto se puede descongelar a temperatura ambiente. En la tabla 4 se indican los tiempos mínimos de descongelación a temperatura ambiente. Después de la descongelación, el producto se debe conservar a temperatura ambiente y se debe utilizar en un plazo máximo de 72 horas.
Cuando se descongela a temperatura ambiente, el producto se debe calentar de forma adicional a 33 °C hasta un máximo de 37 °C poco antes de su utilización. Los tiempos de calentamiento correspondientes se indican también en la tabla 4.
Tabla 4: Tiempos de descongelación y calentamiento a temperatura ambiente (= TA) seguidos de calentamiento adicional, previo a su utilización, en incubador a 33 °C hasta un máximo de 37 °C
|
Tiempos de descongelación del producto a temperatura ambiente (no superior a 25 °C) seguidos de calentamiento adicional, previo a su utilización, en incubador a 33 °C hasta un máximo de 37 °C Producto en bolsas | ||||
|
Tamaño del envase |
AST |
Sistema de jeringa Duo | ||
|
Descongelación a temperatura ambiente (no superior a 25 °C) |
Calentamiento en incubador (33-37 °C) |
Descongelación a temperatura ambiente (no superior a 25 °C) |
Calentamiento en incubador (33-37 °C) | |
|
2 ml |
60 minutos |
+15 minutos |
82 minutos |
+28 minutos |
|
4 ml |
110 minutos |
+25 minutos |
117 minutos |
+30 minutos |
|
10 ml |
160 minutos |
+35 minutos |
167 minutos |
+44 minutos |
Nota: ¡No descongelar el producto sosteniéndolo con las manos!
No calentar TISSEEL en el microondas.
Una vez descongelado, no volver a congelar o refrigerar en ningún caso.
Estabilidad después de la descongelación
Después de una descongelación rápida (a temperaturas entre 33 °C y 37 °C), se ha demostrado la estabilidad química y física en uso durante 12 horas a 33-37 °C.
En el caso del producto descongelado a temperatura ambiente, en la bolsa sin abrir, se ha demostrado la estabilidad química y física en uso durante 72 horas a temperaturas no superiores a 25°C.
Desde un punto de vista microbiológico, a menos que el método de apertura/descongelación excluya el riesgo de contaminación microbiana, el producto debe ser utilizado inmediatamente.
De no usarse inmediatamente, los tiempos y condiciones de almacenamiento durante su uso son responsabilidad del usuario.
No refrigerar.
Manipulación después de la descongelación/antes de la aplicación
Para conseguir una mezcla óptima de las dos soluciones y la solidificación óptima del adhesivo tisular de fibrina, calentar los dos componentes del adhesivo tisular a 33-37 °C inmediatamente antes de la aplicación.
Las soluciones de proteína sellante y de trombina deben ser transparentes o ligeramente opalescentes. No utilizar soluciones que estén turbias o tengan depósitos. El producto descongelado debe inspeccionarse visualmente antes de su uso para descartar la presencia de partículas y decoloración o cualquier variación de su apariencia. Si observa alguna de estas circunstancias, las soluciones se deben desechar.
La solución de proteína sellante descongelada debe ser un líquido ligeramente viscoso. Si la solución tiene la consistencia de un gel solidificado, se debe asumir que se ha desnaturalizado (posiblemente debido a la interrupción de la cadena de conservación en frío o por exceso de calor durante el calentamiento). En este caso, TISSEEL no se debe utilizar de ninguna manera.
Sacar la jeringa de las bolsas poco antes de utilizarla. Retirar los tapones protectores de las jeringas inmediatamente antes de la aplicación. Utilizar TISSEEL solo cuando se haya descongelado y calentado totalmente (consistencia líquida).
Para más instrucciones sobre la preparación, consultar al personal de enfermería o al médico responsable.
Administración con jeringa AST:
Para su aplicación, la jeringa de doble cámara lista para usar con las soluciones de proteína sellante y de trombina se tiene que conectar a una boquilla de unión y a una cánula de aplicación que se proporcionan en el equipo de dispositivos de aplicación. El émbolo común de la jeringa de doble cámara lista para usar garantiza la aplicación de volúmenes iguales de los componentes del adhesivo tisular mediante una boquilla de unión a la cánula de aplicación en la que se mezclan antes de aplicarse.
Instrucciones de funcionamiento de AST:
Jeringa de doble cámara Boquilla de unión
Banda de anclaje
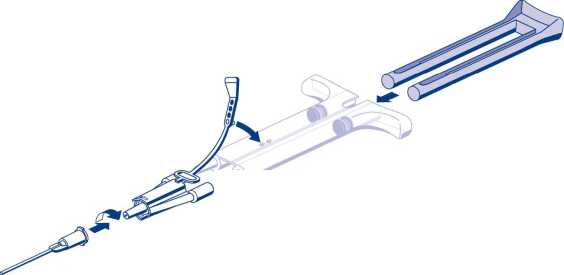
Doble émbolo
Cánula de aplicación
• Conectar las boquillas de la jeringa de doble cámara lista para usar a la boquilla de unión asegurándose de que ambas están firmemente fijadas. Asegurar la boquilla de unión fijando la banda de anclaje a la jeringa de doble cámara lista para usar. Si la banda de anclaje se desgarra, utilizar la boquilla de unión de repuesto. Si no hay ninguna disponible, todavía es posible utilizar el sistema si se tiene cuidado de que la conexión sea segura y a prueba de fugas.
• Ajustar una cánula de aplicación a la boquilla de unión.
No expulsar el aire que quede dentro de la boquilla de unión y en la cánula de aplicación hasta que se inicie la aplicación ya que la abertura de la cánula puede obstruirse.
• Aplicar la mezcla de solución de proteína sellante-solución de trombina sobre la superficie o superficies de las partes que se van a sellar.
O
Administración con sistema de jeringa Duo:
Para su aplicación, las dos jeringas de un solo uso con las soluciones de proteína sellante y de trombina se tienen que conectar a una boquilla de unión y a una cánula de aplicación que se proporcionan en el equipo de dispositivos que se suministra (DUPLOJECT COMBI). La pieza que une en el extremo los émbolos de las dos jeringas garantiza que, al ejercer presión sobre la misma, los dos émbolos se comportarán como si fueran solo uno de manera que de ambas jeringas saldrá la misma cantidad de volumen a través de la boquilla de unión hacia la cánula de aplicación donde se mezclarán antes de su aplicación.
Instrucciones de uso del sistema de jeringa Duo:
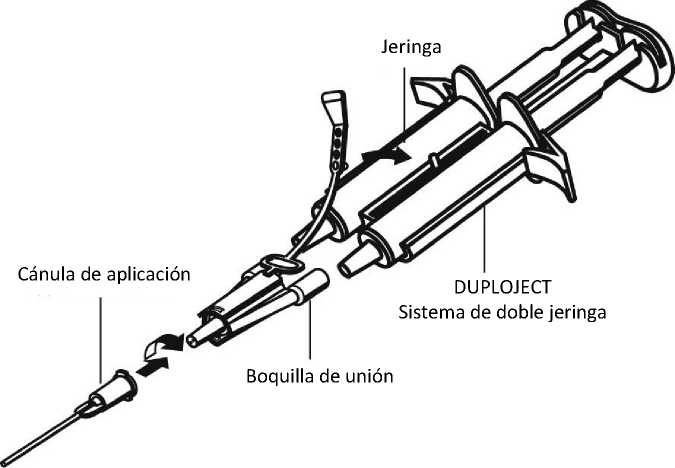
• Conectar las boquillas del sistema de jeringa Duo a la boquilla de unión asegurándose de que ambas están firmemente fijadas. Asegurar la boquilla de unión fijando las bandas de anclaje en el sistema de doble jeringa DUPLOJECT. Si la banda de anclaje se desgarra, utilizar la boquilla de unión de repuesto. Si no hay ninguna disponible, todavía es posible utilizar el sistema si se tiene cuidado de que la conexión sea segura y a prueba de fugas.
• Ajustar una cánula de aplicación a la boquilla de unión.
No expulsar el aire que quede dentro de la boquilla de unión y en la cánula de aplicación hasta que inicie la aplicación ya que la abertura de la cánula puede obstruirse.
• Aplicar la mezcla de solución de proteína sellante-solución de trombina sobre la superficie o superficies de las partes que se van a tratar.
Nota: Si la aplicación de los componentes del adhesivo tisular de fibrina se interrumpe,
inmediatamente se producirán coágulos en la cánula. En este caso, sustituir inmediatamente la cánula de aplicación por una nueva antes de reanudar la aplicación. Si la abertura de la boquilla de unión se obstruye, utilizar la boquilla de unión adicional proporcionada en el envase.
Después de mezclar los componentes del adhesivo tisular, el adhesivo tisular de fibrina empieza a asentarse en unos segundos dada la alta concentración de trombina (500 UI/ml).
El adhesivo tisular de fibrina también se puede aplicar con otros accesorios suministrados por BAXTER que son especialmente adecuados para, p. ej., uso endoscópico, cirugía mínimamente invasiva, aplicación en áreas grandes o de difícil acceso. Cuando se utilizan estos dispositivos de aplicación, deben seguirse estrictamente las instrucciones de uso.
Después de aplicar TISSEEL, esperar al menos 2 minutos para conseguir una polimerización suficiente.
En ciertas aplicaciones se utiliza material biocompatible, como láminas de colágeno, como material de soporte o para reforzar.
Aplicación por pulverización
Al aplicar TISSEEL con un equipo pulverizador, se debe asegurar de que la presión y la distancia al tejido se encuentran dentro de los intervalos recomendados por el fabricante, según se indica a continuación:
|
Presión, distancia y equipos recomendados para la aplicación por pulverización de TISSEEL | ||||||
|
Procedimiento quirúrgico |
Equipo pulverizador que se debe utilizar |
Puntas aplicadoras que se deben utilizar |
Regulador de presión que se debe utilizar |
Distancia del tejido de destino recomenda da |
Presión de pulverización recomendada | |
|
Herida abierta |
Equipo pulverizador TISSEEL/Arti ss |
n.a. |
EasySpray |
10-15 cm |
1,5-2,0 bares (21,5-28,5 psi). | |
|
Equipo pulverizador TISSEEL/Arti ss, envase de 10 |
n.a. |
EasySpray | ||||
|
Procedimientos laparoscópicos o mínimamente invasivos |
n.a. |
Aplicador Duplospray MIS 20 cm |
Regulador Duplospray MIS Regulador Duplospray MIS NIST B11 |
2-5 cm |
1,2-1,5 bares (18-22 psi) | |
|
Aplicador Duplospray MIS 30 cm |
Regulador Duplospray MIS Regulador Duplospray MIS NIST B11 | |||||
|
Aplicador Duplospray MIS 40 cm |
Regulador Duplospray MIS Regulador Duplospray MIS NIST B11 | |||||
|
Punta remplazable |
Regulador Duplospray MIS Regulador Duplospray MIS NIST B11 | |||||
Siempre que se pulverice TISSEEL, y debido a que cabe la posibilidad de que se produzca una embolia gaseosa (aire o gas), se deben monitorizar los cambios en la presión arterial, el pulso, la saturación de oxígeno y el nivel de CO2 al final de la espiración (ver secciones 4.2 y_44).
Para la aplicación de TISSEEL en espacios torácicos y abdominales cerrados se recomienda el sistema aplicador y regulador DuploSpray MIS. Consulte el manual de instrucciones del dispositivo DuploSpray MIS.
Eliminación
La eliminación del medicamento no utilizado y de todos los materiales de desecho se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BAXTER, S.L.
Pouet de Camilo, 2
46394 Ribarroja del Turia (Valencia)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
78896
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Diciembre 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
Marzo 2015
17/17