Tarceva 150 Mg Comprimidos Recubiertos Con Pelicula
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Tarceva 25 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un comprimido recubierto con película contiene 25 mg de erlotinib (como erlotinib clorhidrato).
Excipientes con efecto conocido: Cada comprimido recubierto con película contiene 27,43 mg de Lactosa monohidrato.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Comprimidos de color blanco a amarillento, redondos, biconvexos, con el grabado“T 25” en una cara.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Cáncer de Pulmón No Microcítico (CPNM):
Tarceva está indicado en el tratamiento de primera línea de pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con mutaciones activadoras de EGFR. Tarceva está también indicado como tratamiento de mantenimiento de pacientes con CPNM localmente avanzado o metastásico con mutaciones activadoras de EGFR y enfermedad estable después de un régimen quimioterápico de primera línea.
Tarceva también está indicado en el tratamiento de pacientes con CPNM localmente avanzado o metastásico tras fallo, al menos, a un tratamiento quimioterápico anterior.
Se deberían considerar los factores asociados con el aumento de la supervivencia cuando se prescriba Tarceva.
No se ha demostrado beneficio en la supervivencia u otros efectos clínicamente relevantes del tratamiento en pacientes con tumores que no expresen el Receptor del Factor de Crecimiento Epidérmico (EGFR) IHQ negativa (ver sección 5.1).
Cáncer de páncreas:
Tarceva en combinación con gemcitabina está indicado en el tratamiento de pacientes con cáncer de páncreas metastásico.
Se deberían considerar los factores asociados con el aumento de la supervivencia cuando se prescriba Tarceva (ver sección 4.2 y 5.1).
En pacientes con enfermedad localmente avanzada no se han podido observar ventajas en términos de supervivencia.
4.2 Posología y forma de administración
El tratamiento con Tarceva debe ser supervisado por un especialista con experiencia en el empleo de terapias anti-cancerosas.
Pacientes con Cáncer de Pulmón No Microcítico:
Se debe llevar a cabo el test de la mutación de EGFR antes de iniciar el tratamiento con Tarceva en pacientes con CPNM avanzado o metastásico, que no han sido tratados previamente con quimioterapia.
La dosis diaria recomendada de Tarceva es 150 mg administrada al menos una hora antes o dos después de la ingestión de alimentos.
Pacientes con cáncer de páncreas:
La dosis diaria recomendada de Tarceva es 100 mg administrada al menos una hora antes o dos horas después de la ingestión de alimentos, en combinación con gemcitabina (ver la ficha técnica de gemcitabina para la indicación de cáncer de páncreas).
Se debería reevaluar la continuación del tratamiento con Tarceva en pacientes que no desarrollen rash dentro de las primeras 4 - 8 semanas del tratamiento (ver sección 5.1).
Cuando sea necesario un ajuste de dosis, ésta se debe reducir en fracciones de 50 mg (ver sección 4.4). Tarceva está disponible en dosis de 25 mg, 100 mg y 150 mg.
El uso concomitante de sustratos y moduladores del citocromo CYP3A4 puede requerir un ajuste de dosis (ver sección 4.5).
Pacientes con insuficiencia hepática: Erlotinib se elimina por metabolismo hepático y excreción biliar. Aunque la exposición a erlotinib fue similar en pacientes con insuficiencia hepática moderada (valor Child - Pugh 7 - 9) en comparación con la de pacientes con buena función hepática, deberá tenerse precaución cuando se administre Tarceva a pacientes con insuficiencia hepática. Si aparecen reacciones adversas graves, debe considerarse la posibilidad de reducir la dosis o interrumpir la administración de Tarceva. La seguridad y eficacia de erlotinib no ha sido estudiada en pacientes con disfunción hepática grave (AST/SGOT y ALT/SGPT > 5x ULN). No se recomienda usar Tarceva en pacientes con disfunción hepática grave (ver sección 5.2).
Pacientes con insuficiencia renal: La seguridad y eficacia de erlotinib no ha sido estudiada en pacientes con insuficiencia renal (concentración sérica de creatinina > 1,5 veces el límite superior normal). En base a los datos farmacocinéticos, no parece necesario un ajuste de la dosis en pacientes con insuficiencia renal media o moderada (ver sección 5.2). No se recomienda el uso de Tarceva en pacientes con insuficiencia renal grave.
Población pediátrica: no se ha establecido la seguridad y eficacia de erlotinib en pacientes menores de 18 años. No está recomendado el uso de Tarceva en pacientes pediátricos.
Fumadores: Se ha demostrado que fumar cigarrillos reduce la exposición a erlotinib en un 50-60%. La dosis máxima tolerada de Tarceva en pacientes fumadores activos con CPNM fue de 300 mg. No se ha establecido la eficacia y seguridad a largo plazo de dosis mayores a las dosis iniciales recomendadas en pacientes que continúan fumando cigarrillos (ver sección 4.5 y 5.2). Por lo tanto se debe recomendar a los fumadores activos que dejen de fumar ya que las concentraciones plasmáticas de erlotinib en fumadores se reducen respecto a las que presentan los no fumadores.
4.3 Contraindicaciones
Hipersensibilidad a erlotinib o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Evaluación del estado mutacional del EGFR
Cuando se evalúa el estado mutacional del EGFR de un paciente, es importante elegir una metodología validada y robusta para evitar la obtención de falsos negativos o falsos positivos.
Fumadores:
Se deberá recomendar a los fumadores dejar de fumar ya que las concentraciones plasmáticas de erlotinib se reducen en fumadores en comparación con no fumadores. Es probable que el grado de reducción sea clínicamente significativo (ver sección 4.5).
Enfermedad pulmonar intersticial:
Se han observado casos poco frecuentes de reacciones semejantes a enfermedad pulmonar intersticial (EPI), incluyendo fallecimientos, en pacientes que fueron tratados con Tarceva para el cáncer de pulmón no microcítico (CPNM), cáncer de páncreas u otros tumores sólidos avanzados. En el ensayo pivotal BR.21 en CPNM, la incidencia de EPI (0,8%) fue la misma tanto en el grupo al que se le administró placebo como en el tratado con Tarceva. En el ensayo de cáncer de páncreas en combinación con gemcitabina, la incidencia de reacciones semejantes a EPI fue del 2,5% en el grupo de Tarceva y gemcitabina versus el 0,4% en el grupo tratado con placebo y gemcitabina. La incidencia global en los pacientes tratados con Tarceva de todos los ensayos (incluidos los ensayos no controlados y los ensayos con quimioterapia concurrente) es aproximadamente del 0,6% comparada con el 0,2% en los pacientes con placebo. Los diagnósticos realizados en los pacientes en los que hubo sospecha de que tuvieran reacciones semejantes a EPI incluyeron: neumonitis, neumonitis causada por radiación, neumonitis por hipersensibilidad, neumonía intersticial, enfermedad pulmonar intersticial, bronquiolitis obliterante, fibrosis pulmonar, Síndrome de Distrés Respiratorio Agudo (ARDS), alveolitis e infiltración pulmonar. Los síntomas se presentaron en un intervalo que fue desde unos pocos días tras iniciar la terapia con Tarceva hasta varios meses desde el inicio de ésta. Se dieron frecuentemente factores que pudieron contribuir o confundir el diagnóstico como pueden ser la quimioterapia concomitante o previa, radioterapia previa, enfermedad parenquimal pulmonar preexistente, enfermedad pulmonar metastásica o infecciones pulmonares. Se observó una mayor incidencia de EPI entre los pacientes de origen japonés (aproximadamente el 5% con una tasa de mortalidad del 1,5%).
En pacientes que presenten un comienzo agudo de síntomas pulmonares inexplicables, nuevos y/o progresivos, tales como disnea, tos y fiebre, se debe interrumpir la terapia con Tarceva hasta que se realice una evaluación diagnóstica. Los pacientes tratados con erlotinib y gemcitabina en combinación deberían ser monitorizados cuidadosamente por la posibilidad de desarrollar toxicidad semejante a EPI. Si se diagnostica EPI, se debe suspender el tratamiento con Tarceva e iniciar el tratamiento apropiado necesario (ver sección 4.8).
Diarrea, deshidratación, desequilibrio hidroelectrolítico e insuficiencia renal
Se ha observado diarrea (incluyendo casos muy raros con resultado de muerte) en aproximadamente el 50% de los pacientes en tratamiento con Tarceva. La diarrea moderada o grave debe ser tratada con, por ejemplo, loperamida. En algunos casos, puede ser necesaria una reducción de la dosis. En los ensayos clínicos, las dosis fueron reducidas en fracciones de 50 mg. No se han investigado reducciones de dosis en fracciones de 25 mg. En el caso de presentarse diarrea grave o persistente, náuseas, anorexia o vómitos asociados a deshidratación, el tratamiento con Tarceva debe ser interrumpido y deben tomarse las medidas apropiadas para tratar la deshidratación (ver sección 4.8). En raros casos, se ha observado hipopotasemia y fallo renal (incluidos fallecimientos). Algunos casos fueron secundarios a deshidratación grave debida a diarrea, vómitos y/o anorexia, mientras que otros fueron confundidos con la quimioterapia concomitante. La terapia con Tarceva deberá interrumpirse y se deberán adoptar medidas apropiadas para rehidratar por vía intravenosa a los pacientes en muchos casos de diarrea grave o persistente, o en casos que provoquen deshidratación, especialmente en grupos de pacientes con factores de riesgo agravantes (especialmente quimioterapia y otra medicación concomitante, síntomas o enfermedades u otras situaciones que pudieran predisponer, incluyendo la edad avanzada). Además, en los pacientes con riesgo de deshidratación, se deberá monitorizar la función renal y la determinación de electrolitos en suero, incluyendo el potasio.
Hepatitis, fallo hepático
Durante el uso de Tarceva, se han notificado casos raros de fallo hepático (incluidos fallecimientos). Entre los factores de confusión se ha incluido la existencia previa de enfermedad hepática o medicación concomitante hepatotóxica. Por lo tanto, en estos pacientes, se debe considerar la realización de un examen de la función hepática de forma periódica. El tratamiento con Tarceva debe interrumpirse si hay cambios graves en la función hepática (ver sección 4.8). No se recomienda el uso de Tarceva en pacientes con disfunción hepática grave.
Perforación gastrointestinal
Se ha observado con poca frecuencia que los pacientes en tratamiento con Tarceva tienen un mayor riesgo de aparición de perforación gastrointestinal (incluyendo algunos casos con resultado de muerte). El riesgo es mayor en los pacientes que reciben de forma concomitante agentes anti-angiogénicos, corticosteroides, AINEs y/o quimioterapia basada en taxanos, o que tengan antecedentes de úlcera péptica o enfermedad diverticular. El tratamiento con Tarceva debe suspenderse permanentemente en aquellos pacientes en los que aparezca perforación gastrointestinal (ver sección 4.8).
Trastornos vesiculares y exfoliativos de la piel
Se han notificado casos de alteraciones vesiculares, ampollosas y exfoliativas en la piel, incluyendo casos muy raros indicativos del síndrome de Stevens-Johnson/Necrolisis epidérmica tóxica, que en algunos casos fueron mortales. (ver sección 4.8). El tratamiento con Tarceva debe interrumpirse o suspenderse si en el paciente aparecen vesículas, ampollas o exfoliación de carácter grave. Los pacientes con trastornos vesiculares y exfoliativos de la piel, se deben hacer la prueba de infecciones de la piel y ser tratados de acuerdo con las directrices locales.
Trastornos oculares
Los pacientes que presenten signos y síntomas indicadores de queratitis, como una agudización o empeoramiento de: inflamación ocular, lagrimeo, fotosensibilidad ocular, visión borrosa, dolor ocular y/o ojos enrojecidos, deben ser remitidos inmediatamente a un especialista en oftalmología. Si el diagnóstico de queratitis ulcerativa se confirma, el tratamiento con Tarceva debe ser interrumpido o suspendido. Si se diagnostica queratitis, se deben evaluar cuidadosamente los beneficios y riesgos de continuar con el tratamiento. Tarceva debe ser utilizado con precaución en pacientes con antecedentes de queratitis, queratitis ulcerativa u ojo seco grave. El uso de lentes de contacto también es un factor de riesgo para la queratitis y ulceración. Durante el uso de Tarceva se han notificado casos muy raros de ulceración o perforación de la córnea (ver sección 4.8).
Interacciones con otros medicamentos:
Los inductores potentes del citocromo CYP3A4 pueden reducir la eficacia de erlotinib mientras que los inhibidores potentes del CYP3A4 pueden producir un aumento de la toxicidad. Debe evitarse el tratamiento concomitante con estos tipos de agentes (ver sección 4.5).
Otras formas de interacción:
Erlotinib se caracteriza por una disminución de su solubilidad a un pH superior a 5. Los medicamentos que modifican el pH del tracto Gastro-Intestinal (GI) superior, como los inhibidores de la bomba de protones, antagonistas H2 y antiácidos, pueden alterar la solubilidad de erlotinib y, por lo tanto, su biodisponibilidad. No es probable que un aumento de la dosis de Tarceva cuando se co-administre con tales agentes compense la pérdida de exposición. Deberá evitarse la combinación de erlotinib con inhibidores de la bomba de protones. Se desconocen los efectos de la administración concomitante de erlotinib con antagonistas H2 y antiácidos; no obstante, es probable que se reduzca su biodisponibilidad. Por consiguiente, deberá evitarse la administración concomitante de estas combinaciones (ver sección 4.5). Si se considera necesario el uso de antiácidos durante el tratamiento con Tarceva, deberían tomarse al menos 4 horas antes ó 2 horas después de la dosis diaria de Tarceva.
Los comprimidos contienen lactosa y no deben ser administrados a pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios de interacciones se han realizado sólo en adultos.
Erlotinib y otros sustratos del CYP
Erlotinib es un inhibidor potente del citocromo CYP1A1 y un inhibidor moderado del CYP3A4 y CYP2C8, y es también un inhibidor fuerte de la glucuronidación por UGT1A1 in vitro.
Se desconoce la relevancia fisiológica de la fuerte inhibición del CYP1A1 debido a que la expresión de CYP1A1 es muy limitada en tejidos humanos.
Cuando erlotinib se coadministró con ciprofloxacino, un inhibidor moderado del CYP1A2, la exposición a erlotinib [AUC] aumentó significativamente un 39%, aunque no produjo ningún cambio estadísticamente significativo en Cmáx. Del mismo modo, la exposición al metabolito activo aumentó alrededor de un 60% y un 48% para AUC y Cmáx, respectivamente. No se ha determinado la relevancia clínica de este aumento. Debe tenerse precaución cuando ciprofloxacino o inhibidores potentes del CYP1A2 (por ej. fluvoxamina) se combinen con erlotinib. Si se observan reacciones adversas relacionadas con erlotinib, la dosis de erlotinib puede reducirse.
El tratamiento previo o la co-administración de Tarceva no alteró el aclaramiento de midazolam y eritromicina, sustratos prototípicos del CYP3A4, pero parece que disminuyó la biodisponibilidad oral del midazolam hasta el 24%. En otro ensayo clínico, erlotinib no afectó a la farmacocinética de paclitaxel, sustrato del CYP3A4/2C8, al ser administrado concomitantemente. Por tanto, las interacciones significativas con el aclaramiento de otros sustratos del CYP3A4 son improbables.
La inhibición de la glucuronidación puede provocar interacciones con medicamentos que son sustratos de UGT1A1 y que sólo se eliminan por esta vía. Los pacientes con bajos niveles de expresión de UGT1A1 o alteraciones genéticas de la glucuronidación (por ej. enfermedad de Gilbert) pueden tener un aumento de la concentración de bilirrubina en suero y deben ser tratados con precaución.
En humanos, erlotinib es metabolizado en el hígado por los citocromos hepáticos, principalmente por CYP3A4 y en menor medida por CYP1A2. También contribuye potencialmente al aclaramiento metabólico de erlotinib, el metabolismo extrahepático por CYP3A4 en el intestino, CYP1A1 en pulmones y CYP1B1 en tejido tumoral. Pueden darse interacciones potenciales con sustancias activas que se metabolicen por esas enzimas o sean inhibidores o inductores de dichas enzimas.
Los inhibidores potentes de la actividad del CYP3A4 disminuyen el metabolismo de erlotinib y aumentan la concentración plasmática de erlotinib. En un ensayo clínico, el uso concomitante de erlotinib con ketoconazol (200 mg vía oral dos veces al día durante 5 días), un potente inhibidor del CYP3A4, condujo a un aumento de la exposición a erlotinib (86% del AUC y 69% de la Cmáx). Debe tenerse precaución cuando se combine erlotinib con un inhibidor potente del CYP3A4, como por ej. antifungicos azoles (como ketoconazol, itraconazol, voriconazol), inhibidores de la proteasa, eritromicina o claritromicina. Si es necesario se deberá reducir la dosis de erlotinib, particularmente si se observa toxicidad.
Los inductores potentes de la actividad del CYP3A4 aumentan el metabolismo de erlotinib y disminuyen significativamente las concentraciones plasmáticas de erlotinib. En un ensayo clínico, el uso concomitante de erlotinib y rifamicina (600 mg vía oral una vez al día durante 7 días), un inductor potente del CYP3A4, produjo una disminución de un 69% de la mediana del AUC de erlotinib. La coadministración de rifampicina con una sola dosis de Tarceva de 450 mg dio lugar a una exposición media de erlotinib (AUC) del 57,5% de la resultante tras una sola dosis de Tarceva de 150 mg sin rifampicina. Por lo tanto, debe evitarse la coadministración de Tarceva con inductores del CYP3A4.
Se debe considerar un aumento en la dosis hasta 300 mg en pacientes que requieren tratamiento concomitante de Tarceva con inductores potentes del CYP3A4 tales como rifampicina, siempre que su seguridad sea monitorizada estrechamente (incluyendo la función renal y hepática y los electrolitos séricos), y si ésta se tolera bien durante más de dos semanas, se podría considerar un aumento a 450 mg con una monitorización estrecha de seguridad. También puede darse una exposición reducida con otros inductores como por ej. fenitoína, carbamazepina, barbitúricos o Hipérico (hypericum perforatum, hierba de San Juan). Debe tenerse precaución cuando estas sustancias activas se combinen con erlotinib. Cuando sea posible, se deben considerar tratamientos alternativos evitando los inductores potentes de la actividad del CYP3A4.
Erlotinib y anticoagulantes derivados de la cumarina
En pacientes tratados con Tarcerva se han notificado casos de interacción con anticoagulantes derivados de la cumarina, incluyendo la warfarina, que produjeron aumentos en el Ratio Internacional Normalizado (INR) y hemorragias, que en algunos casos fueron mortales. Los pacientes a los que se les administre anticoagulantes derivados de la cumarina deben ser monitorizados regularmente para detectar cualquier cambio en el tiempo de protombina o en el INR.
Erlotinib y estatinas
La combinación de Tarceva y una estatina puede aumentar el riesgo de miopatía inducida por estatinas, incluyendo rabdomiolisis, que fue observada de forma rara.
Erlotinib y fumadores
Los resultados de un estudio de interacción farmacocinética indicaron que existe una reducción significativa en el AUCinf, Cmax y en la concentración plasmática a las 24 horas de 2,8 -, 1,5 - y 9-veces, respectivamente, tras la administración de Tarceva en fumadores en comparación con no fumadores (ver sección 5.2). Por tanto, se debería aconsejar a los pacientes fumadores que dejen de fumar lo antes posible antes de iniciar el tratamiento con Tarceva, puesto que, de lo contrario, la concentración plasmática de erlotinib será más reducida. El efecto clínico de la disminución de dicha exposición no ha sido evaluado de forma determinante pero es probable que sea clínicamente significativo.
Erlotinib e inhibidores de la P-glicoproteína
Erlotinib es sustrato de la P-glicoproteína (transportador de sustancias activas). La administración concomitante de inhibidores de la P-glicoproteína, como p. ej. ciclosporina y verapamilo, puede producir una alteración en la distribución y/o eliminación de erlotinib. No se ha establecido las consecuencias de esta interacción para, p. ej., la toxicidad a nivel del SNC. Deberá tenerse precaución en dichas situaciones.
Erlotinib y medicamentos que alteran el pH
Erlotinib se caracteriza por una disminución de su solubilidad a un pH superior a 5. Los medicamentos que alteran el pH del tracto Gastro-Intestinal (GI) superior pueden alterar la solubilidad de erlotinib y por lo tanto su biodisponibilidad. La coadministración de erlotinib con omeprazol, un inhibidor de la bomba de protones (IBP), disminuyó la exposición [AUC] y la concentración máxima (Cmáx) de erlotinib un 46% y 61%, respectivamente. No hubo cambio alguno del Tmáx o de la vida media. La administración concomitante de Tarceva con 300 mg de ranitidina, un antagonista de los receptores H2, disminuye la exposición de erlotinib (AUC) y las concentraciones máximas [Cmax] un 33% y 54% respectivamente. No es probable que un aumento de la dosis de Tarceva cuando se coadministre con tales agentes compense esta pérdida de exposición. Sin embargo, cuando Tarceva se administró de forma escalonada, 2 horas antes ó 10 horas después de la administración de 150 mg de ranitidina dos veces al día, la exposición de erlotinib [AUC] y las concentraciones máximas [Cmax] disminuyeron sólo un 15% y 17%, respectivamente. No se ha investigado el efecto de antiácidos sobre la absorción de erlotinib pero la absorción puede verse afectada produciendo una disminución de los niveles plasmáticos. En resumen deberá evitarse la combinación de erlotinib con inhibidores de la bomba de protones. . Si se considera necesario el uso de antiácidos durante el tratamiento con Tarceva, deberían tomarse al menos 4 horas antes ó 2 horas después de la dosis diaria de Tarceva. Si se considera necesario el uso de ranitidina, ésta debe administrarse de forma escalonada! es decir, se debe tomar Tarceva al menos 2 horas antes ó 10 horas después de la dosis de ranitidina.
Erlotinib y Gemcitabina
En un estudio Fase Ib, no se dieron efectos significativos de gemcitabina sobre la farmacocinética de erlotinib ni tampoco efectos significativos de erlonitib en la farmacocinética de gemcitabina.
Erlotinib y Carboplatino/Paclitaxel
Erlotinib incrementa las concentraciones de platino. En un ensayo clínico el uso concomitante de erlotinib con carboplatino y paclitaxel dio lugar a un incremento en el AUC0 - 48 total de platino del 10,6%. Aunque es estadísticamente significativa, la magnitud de esta diferencia no se considera que sea clínicamente relevante. En la práctica clínica puede haber otros factores que produzcan un aumento en la exposición al carboplatino como el trastorno renal. No hubo efectos significativos de carboplatino o placlitaxel en la farmacocinética de erlotinib.
Erlotinib y Capecitabina
Capecitabina puede incrementar la concentración de erlotinib. Al administrar erlotinib en combinación con capecitabina, se produjo un aumento estadísticamente significativo en la AUC de erlotinib y un aumento incierto en la Cmax en comparación con los valores observados en otro estudio en el cual se administro erlotinib como único agente. No hubo efectos significativos de erlotinib en la farmacocinética de capecitabina.
Erlotinib e inhibidores del proteasoma
Por su mecanismo de acción, los inhibidores del proteasoma, incluyendo el bortezomib pueden influir en el efecto de los inhibidores del EGFR, incluyendo el erlotinib. Esta influencia se apoya en datos clínicos limitados y en estudios preclínicos que muestran la degradación del EGFR mediante el proteasoma.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de erlotinib en mujeres embarazadas. Los estudios en animales no han mostrado evidencia de teratogenicidad o parto anormal. Sin embargo, no se puede excluir un efecto adverso en el embarazo, ya que los estudios llevados a cabo en ratas y conejos han mostrado un incremento de la letalidad embrio/fetal (ver sección 5.3). El riesgo potencial en humanos se desconoce.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil que eviten quedarse embarazadas mientras estén en tratamiento con Tarceva. Deberán emplearse métodos anticonceptivos adecuados durante el tratamiento y durante al menos las 2 semanas siguientes a su terminación. Sólo se continuará el tratamiento en mujeres embarazadas si el beneficio potencial para la madre supera al riesgo para el feto.
Lactancia
Se desconoce si erlotinib se excreta en la leche humana. Se debe desaconsejar a las madres la lactancia materna mientras sean tratadas con Tarceva por el daño potencial que se pueda causar al niño.
Fertilidad
Los estudios en animales no han mostrado evidencia de alteración de la fertilidad. Sin embargo, no se puede excluir un efecto adverso en la fertilidad, ya que los estudios con animales han mostrado efectos sobre los parámetros reproductivos (ver sección 5.3). No se conoce el riesgo potencial en humanos
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas. Sin embargo, no hay asociación entre erlotinib y la alteración de la habilidad mental.
Cáncer de pulmón no microcítico (Tarceva administrado en monoterapia):
En el ensayo aleatorizado doble-ciego (BR.21; Tarceva administrado como segunda línea de tratamiento), las reacciones adversas al medicamento observadas más frecuentemente fueron rash (75%) y diarrea (54%). La mayoría fueron de gravedad grado 1/2 y no necesitaron intervención. Se observaron rash y diarrea de grado 3/4 en un 9% y 6%, respectivamente, de los pacientes tratados con Tarceva y, en ambos casos, supuso el abandono del ensayo en el 1% de los pacientes. Fue necesaria la reducción de la dosis debido a rash y diarrea en un 6% y un 1% de los pacientes, respectivamente. En el ensayo BR.21, la mediana de tiempo que tardó en aparecer el rash fue 8 días y la de la diarrea, 12 días.
Generalmente, la aparición de rash se manifiesta en forma de una erupción eritematosa y papulopustular leve o moderada, que puede producirse o empeorar en las zonas expuestas al sol. Sería aconsejable que los pacientes expuestos al sol usen ropa para protegerse y/o protección solar (por ejemplo que contenga minerales).
En el ensayo pivotal BR.21, las reacciones adversas que se observaron con más frecuencia (>3%) en los pacientes tratados con Tarceva que en el grupo placebo, y que ocurren en al menos el 10% de los pacientes del grupo tratado con Tarceva, están resumidos en la Tabla 1 en función de los grados según los criterios comunes de toxicidad del Instituto Nacional del Cáncer de Estados Unidos (NCI-CTC).
Se han utilizado los siguientes términos para clasificar los efectos indeseables por frecuencia: muy frecuente (>1/10); frecuente (>1/100 a < 1/10); poco frecuente (>1/1.000 a < 1/100); raros (>1/10.000 a < 1/1.000); muy raros (< 1/10.000) incluyendo casos aislados.
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
|
Erlotinib N = 485 |
Placebo N = 242 | |||||
|
Grado del NCI - CTC |
Cualquier grado |
3 |
4 |
Cualquier grado |
3 |
4 |
|
Término MedDRA |
% |
% |
% |
% |
% |
% |
|
Total de pacientes con cualquier RA |
99 |
40 |
22 |
96 |
36 |
22 |
|
Infecciones e infestaciones | ||||||
|
Infección* |
24 |
4 |
0 |
15 |
2 |
0 |
|
Trastornos del metabolismo y de la nutrición | ||||||
|
Anorexia |
52 |
8 |
1 |
38 |
5 |
< 1 |
|
Trastornos oculares | ||||||
|
Queratoconjuntivitis seca |
12 |
0 |
0 |
3 |
0 |
0 |
|
Conjuntivitis |
12 |
< 1 |
0 |
2 |
< 1 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos | ||||||
|
Disnea |
41 |
17 |
11 |
35 |
15 |
11 |
|
Tos |
33 |
4 |
0 |
29 |
2 |
0 |
|
Trastornos gastrointestinales | ||||||
|
Diarrea** |
54 |
6 |
< 1 |
18 |
< 1 |
0 |
|
Náuseas |
33 |
3 |
0 |
24 |
2 |
0 |
|
Vómitos |
23 |
2 |
< 1 |
19 |
2 |
0 |
|
Estomatitis |
17 |
< 1 |
0 |
3 |
0 |
0 |
|
Dolor abdominal |
11 |
2 |
< 1 |
7 |
1 |
< 1 |
|
Trastornos de la piel y del tejido subcutáneo | ||||||
|
Rash*** |
75 |
8 |
< 1 |
17 |
0 |
0 |
|
Prurito |
13 |
< 1 |
0 |
5 |
0 |
0 |
|
Sequedad de la piel |
12 |
0 |
0 |
4 |
0 |
0 |
|
Trastornos generales y alteraciones en el lugar de administración | ||||||
|
Fatiga |
52 |
14 |
4 |
45 |
16 |
4 |
* Infecciones graves con o sin neutropenia, incluyeron neumonía sepsis y celulitis. ** Puede producir deshidratación, hipopotasemia y fallo renal.
*** Rash incluida dermatitis acneiforme.
En otros dos ensayos, doble-ciego, aleatorizados controlados con placebo, Fase III BO18192 (SATURN) y BO25460 (IUNO), Tarceva se administró como tratamiento de mantenimiento tras quimioterapia de primera línea. Estos ensayos se llevaron a cabo en 1.532 pacientes con CPNM avanzado, recurrente o metastásico, tras quimioterapia estándar en primera línea basada en compuestos de platino y no se identificaron nuevas señales de seguridad.
Las reacciones adversas observadas más frecuentemente en pacientes tratados con Tarceva, en los ensayos BO18192 y BO25460 fueron rash y diarrea (ver tabla 2). No se observaron rash o diarrea grado 4 en ninguno de los estudios. El rash y la diarrea supusieron el abandono del tratamiento con Tarceva en el 1% y en <1% de los pacientes respectivamente, en el estudio BO18192, mientras que ningún paciente abandonó el tratamiento por rash o diarrea en el estudio BO25460. Se requirieron modificaciones de dosis (interrupciones o reducciones) por el rash y la diarrea en el 8,3% y 3% de los
pacientes, respectivamente, en el estudio BO18192, y 5,6% y 2,8% de los pacientes, respectivamente, en el estudio BO25460.
Tabla 2 : Reacciones adversas más frecuentes en los Estudios BO18192 (SATURN) y BO25460
(IUNO)
|
BO18192 (SAT1 |
JRN)* |
BO25460 (IUNO)* | ||
|
Tarceva n=433 |
Placebo n=445 |
Tarceva n=322 |
Placebo n=319 | |
|
% |
% |
% |
% | |
|
Rash, todos los grados |
49,2 |
5,8 |
39,4 |
10,0 |
|
Grado 3 |
6,0 |
0 |
5,0 |
1,6 |
|
Diarrea, todos los grados |
20,3 |
4,5 |
24,2 |
4,4 |
|
Grado 3 |
1,8 |
0 |
2,5 |
0,3 |
*Análisis de seguridad de la población
En un estudio fase III, ML20650 abierto, aleatorizado, llevado a cabo en 154 pacientes, la seguridad de Tarceva en primera línea de tratamiento en CPNM con mutaciones activadoras de EGFR fue evaluada en 75 pacientes; no se han observado nuevas señales de seguridad en estos pacientes.
En el estudio ML20650, las RAs más frecuentes observadas en pacientes tratados con Tarceva fueron rash y diarrea (80% y 57% respectivamente, de cualquier grado), la mayoría fueron Grado 1/2 y se manejaron sin necesidad de intervención. Se observaron rash y diarrea de Grado 3 en un 9% y 4% de los pacientes, respectivamente. No se observó rash y diarrea Grado 4. Tanto el rash como la diarrea supusieron el abandono del tratamiento con Tarceva en el 1% de los pacientes. Se necesitaron modificaciones de la dosis (interrupciones o reducciones) por el rash y la diarrea en el 11% y 7% de los pacientes, respectivamente.
Cáncer de páncreas (Tarceva administrado en combinación con gemcitabina):
Las reacciones adversas más frecuentes que se observaron en el ensayo pivotal PA.3 en pacientes con cáncer de páncreas tratados con Tarceva 100 mg y gemcitabina, fueron fatiga, rash y diarrea. En el brazo tratado con Tarceva y gemcitabina, se observó rash Grado 3 - 4 y diarrea en un 5% de los pacientes, respectivamente. La mediana del tiempo de aparición de rash y diarrea fue de 10 y 15 días, respectivamente. Tanto el rash como la diarrea provocaron la reducción de las dosis en un 2% de los pacientes, y ocasionaron la interrupción del ensayo de hasta el 1% de los pacientes tratados con Tarceva y gemcitabina.
En el ensayo pivotal PA.3, las reacciones adversas que se presentaron con mayor frecuencia (>3%) en el grupo de pacientes tratados con Tarceva 100 mg y gemcitabina versus el grupo tratado con placebo y gemcitabina y, en al menos el 10% de los pacientes tratados con Tarceva 100 mg y gemcitabina, se resumen en la Tabla 3 siguiendo los criterios de clasificación por grados de toxicidad del Instituto Nacional del Cáncer (NCI - CTC).
Se han utilizado los siguientes términos para clasificar los efectos indeseables por frecuencia: muy frecuente (>1/10); frecuente (>1/100 a < 1/10); poco frecuente (>1/1.000 a < 1/100); raros (>1/10.000 a < 1/1.000); muy raros (< 1/10.000) incluyendo casos aislados.
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
Tabla 3 : Reacciones adversas (RA) muy frecuentes observadas en el ensayo PA.3 (grupo cohorte
tratado con 100 mg)
|
Erlotinib |
Placebo | |||||
|
N = 259 |
N = 256 | |||||
|
Cualquier |
Cualquier | |||||
|
Grado según NCI-CTC |
grado |
3 |
4 |
grado |
3 |
4 |
|
Término MedDRA |
% |
% |
% |
% |
% |
% |
|
Total de pacientes con cualquier RA |
99 |
48 |
22 |
97 |
48 |
16 |
|
Infecciones e infestaciones | ||||||
|
Infección* |
31 |
3 |
< 1 |
24 |
6 |
< 1 |
|
Trastornos del metabolismo y de la nutrición |
39 |
2 |
0 |
29 |
< 1 |
0 |
|
Pérdida de peso | ||||||
|
Trastornos psiquiátricos | ||||||
|
Depresión |
19 |
2 |
0 |
14 |
< 1 |
0 |
|
Trastornos del sistema nervioso | ||||||
|
Neuropatía Cefalea |
13 |
1 |
< 1 |
10 |
< 1 |
0 |
|
15 |
< 1 |
0 |
10 |
0 |
0 | |
|
Trastornos respiratorios, torácicos y mediastínicos | ||||||
|
Tos |
16 |
0 |
0 |
11 |
0 |
0 |
|
Trastornos gastrointestinales | ||||||
|
Diarrea** |
48 |
5 |
< 1 |
36 |
2 |
0 |
|
Estomatitis |
22 |
< 1 |
0 |
12 |
0 |
0 |
|
Dispepsia |
17 |
< 1 |
0 |
13 |
< 1 |
0 |
|
Flatulencia |
13 |
0 |
0 |
9 |
< 1 |
0 |
|
Trastornos de la piel y tejidos subcutáneos | ||||||
|
Rash*** |
69 |
5 |
0 |
30 |
1 |
0 |
|
Alopecia |
14 |
0 |
0 |
11 |
0 |
0 |
|
Trastornos generales y alteraciones en el lugar de administración | ||||||
|
Fatiga |
73 |
14 |
2 |
70 |
13 |
2 |
|
Fiebre |
36 |
3 |
0 |
30 |
4 |
0 |
|
Escalofríos |
12 |
0 |
0 |
9 |
0 |
0 |
* Las infecciones graves, con o sin neutropenia, incluyeron neumonía, sepsis y celulitis. ** Puede producir deshidratación, hipopotasemia y fallo renal.
*** Rash incluida dermatitis acneiforme.
Otras observaciones:
La evaluación de seguridad de Tarceva está basada en los datos obtenidos en más de 1.500pacientes tratados con, al menos, una dosis de 150 mg de Tarceva en monoterapia y en más de 300 pacientes que recibieron Tarceva 100 o 150 mg en combinación con gemcitabina.
Se han observado las siguientes reacciones adversas en pacientes tratados con Tarceva en monoterapia y en pacientes tratados con Tarceva en combinación con quimioterapia.
Las reacciones adversas observadas muy frecuentemente, en los estudios BR21 y PA 3, se describen en las Tablas 1 y 3 mientras que otras reacciones adversas, incluyendo las observadas en otros estudios, se resumen en la Tabla 4.
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
|
Sistema Corporal |
Muy F recuente (>1/10) |
Frecuente (>1/100 a < 1/10) |
Poco frecuente (>1/1.000 a < 1/100) |
Raros(>1/1 0.000 a < 1/1.000) |
Muy raros (< 1/10.000) |
|
Transtornos oculares |
-Queratitis -Conjuntivitis1 |
-Cambios en las pestañas2 |
-Perforación de la córnea -Ulceración de la córnea -Uveitis | ||
|
Transtornos respiratorios, torácicos y mediastínicos |
-Epistaxis - Enfermedad pulmonar intersticial grave (EPI)3 | ||||
|
Transtornos gastro intestinales |
-Diarrea7 |
-Hemorragias gastro-intestinales4, 7 |
-Perforación gastro-intestinal7 | ||
|
Transtornos hepatobiliares |
-Anormalidades en el test de función hepática5 |
-Fallo hepático6 | |||
|
Transtornos de la piel y el tejido subcutáneo |
-Alopecia -Piel seca1 -Paroniquia -Foliculitis -Acné/ Dermatitis acneiforme -Grietas en la piel |
-Hirsutismo -Cambios en las cejas -Uñas quebradizas y sueltas -Reacciones cutáneas leves como hiperpigmentación |
-Síndrome eritro- disestesia palmo- plantar |
-Síndrome Stevens-Johnson/necrólisis epidérmica tóxica7 | |
|
Trastornos renales y urinarios |
-Insuficiencia renal1 |
- Nefritis1 - Proteinuria1 |
1 En el ensayo clínico PA.3
2 Incluyendo crecimiento hacia el interior de las pestañas, crecimiento, y engrasamiento excesivo de las pestañas.
3 Incluye fallecimientos, en pacientes que recibieron T arceva para el tratamiento de CPNM u otros tumores sólidos avanzados (ver sección 4.4). Se ha observado una incidencia alta en pacientes de origen Japonés (ver sección 4.4).
4 En ensayos clínicos algunos casos se asociaros a la administración concomitante de warfarina y algunos a la administración concomitante de AINEs (ver sección 4.5)
5 Incluyendo niveles incrementados de alanina aminotransferasa [ALT], aspartamo aminotransferasa [AST] y bilirrubina. Estos fueron muy frecuentes en el ensayo clínico P A 3 y frecuentes en el ensayo clínico BR. 21. Los casos fueron principalmente de gravedad media o moderadaza, de naturaleza transitoria o asociadas a metástasis hepáticas.
6 Incluye fallecimientos. Entre los factores de confusión se ha incluido la existencia previa de enfermedad hepática o la medicación concomitante hepatotóxica (ver sección 4.4)
7 Incluye fallecimientos (ver sección 4.4)
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello
permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los
profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional
de notificación incluido en el Anexo V.
4.9 Sobredosis
Síntomas
Se han administrado dosis orales únicas de Tarceva de hasta 1.000 mg de erlotinib en sujetos sanos y hasta 1.600 mg en pacientes con cáncer y éstas se toleraron bien. Las dosis repetidas de 200 mg dos veces al día administradas a sujetos sanos fueron mal toleradas tras sólo unos pocos días de tratamiento. En base a los datos derivados de estos ensayos, por encima de la dosis recomendada podrían darse reacciones adversas graves tales como diarrea, rash y un posible aumento de la actividad de las aminotransferasas hepáticas.
Tratamiento
En caso de que exista sospecha de sobredosis, se debe interrumpir el tratamiento con Tarceva e iniciar un tratamiento sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agente antineoplásico inhibidor de la proteína quinasa, código ATC: L01XE03
Mecanismo de acción
Erlotinib es un inhibidor del receptor del factor de crecimiento epidérmico / de la tirosina quinasa del receptor del factor de crecimiento epidérmico humano tipo 1 (EGFR, también conocido como HER1). Erlotinib inhibe potentemente la fosforilación intracelular del EGFR. El EGFR se expresa en la superficie de células normales y cancerosas. En modelos no clínicos, la inhibición de la fosfotirosina del EGFR da lugar a que la célula quede en fase de equilibrio y/o conduce a la muerte celular.
Las mutaciones del EGFR pueden conducir a la activación constitutiva de rutas de señalización antiapoptóticas y de proliferación. La potente efectividad de erlotinib para bloquear la señal mediada por el EGFR en estos tumores con mutación positiva del EGFR, se atribuye a la estrecha unión de erlotinib al lugar de unión del ATP en el dominio quinasa mutado del EGFR. Debido al bloqueo de la cascada de señales por debajo del receptor, se detiene la proliferación celular y se induce la muerte celular a través de la ruta intrínseca de apoptosis. Se ha observado regresión tumoral en modelos de ratones con marcada expresión de mutaciones activadoras del EGFR.
Eficacia clínica
- Tratamiento en primera línea para pacientes con Cáncer de Pulmón No Microcítico (CPNM) con mutaciones activadoras del EGFR (Tarceva administrado en monoterapia):
La eficacia de Tarceva en el tratamiento en primera línea para los pacientes que presentan mutaciones activadoras del EGFR en CPNM, se demostró en un ensayo fase III, aleatorizado, abierto (ML20650, EURTAC). Este estudio se llevó acabo en pacientes caucásicos con CPNM metastásico o localmente avanzado (estadío IIIB y IV) que no habían recibido quimioterapia previa o cualquier terapia antitumoral sistémica para su enfermedad avanzada y que presentaban mutaciones en el dominio de la tirosina kinasa del EGFR (eliminación del exón 19 o mutación del exón 21). Los pacientes fueron aleatorizados 1:1 para ser tratados con Tarceva 150 mg o quimioterapia doble basada en platinos.
La SLP, variable principal del investigador. Los resultados de eficacia se resumen en la Tabla 5.
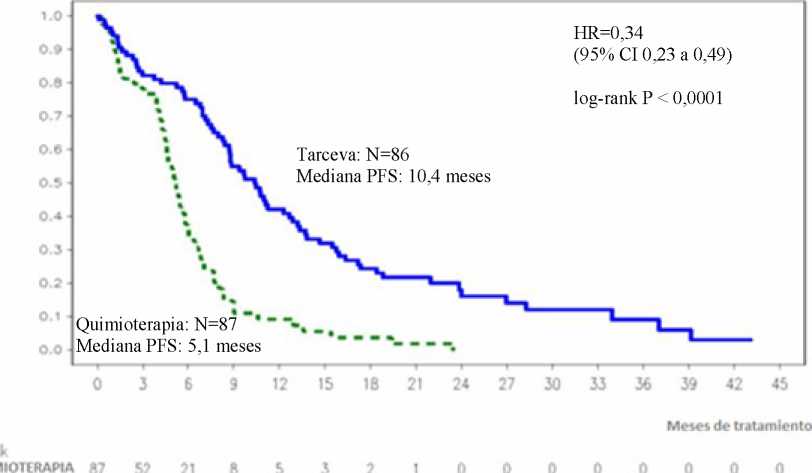
Figura 1: Curva Kaplan-Meier datos de SLP evaluada por el investigador en el ensayo ML20650 (EUTARC) (corte abril del 2012)
sip
ERIOTINIB 66 69 62 *3 31 25 19 14 6 1 6 * 3
Trdtjmlenlo rjirmlocnizjdo QUIMIOTERAPIA ERlOTINIB
|
T arceva |
Quimioterapia |
Hazard Ratio (95% CI) |
Valor- p | ||
|
Análisis intermedio pre planificado (n=153) Fecha de corte: Agosto 2010 |
n=77 |
n=76 | |||
|
Variable principal: Supervivencia Libre de Progresión ( mediana de SLP en meses)* Evaluación del investigador** Revisión independiente ** |
9.4 10.4 |
5,2 5,4 |
0,42 [0,27-0,64] 0,47 [0,27-0,78] |
p<0,0001 p=0,003 | |
|
Tasa respuesta objetiva (CR/PR) |
54,5% |
10,5% |
p<0,0001 | ||
|
Supervivencia global (SG) (meses) (35% de eventos) |
22,9 |
18,8 |
0,80 [0,47-1,37] |
p=0,4170 | |
|
Análisis exploratorio (n=173) Fecha de corte: Enero 2011 |
n=86 |
n=87 | |||
|
SLP (mediana en meses), Evaluación del investigador |
9,7 |
5,2 |
0,37 [0,27-0,54] |
p<0,0001 | |
|
Tasa respuesta objetiva (CR/PR) |
58,1% |
14,9% |
p<0,0001 | ||
|
SG (meses) (40% de eventos) |
19,3 |
19,5 |
1,04 [0,65-1,68] |
p=0,8702 | |
|
Actualización del análisis (n=173) Fecha de corte: Abril 2012 |
n=86 |
n=87 | |||
|
SLP (mediana en meses) |
10,4 |
5,1 |
0,34 [0,23-0,49] |
p<0,0001 | |
|
SG*** (meses) (62% de eventos) |
22,9 |
20,8 |
0,93 [0,64-1,36] |
p=0,7149 |
CR = respuesta completa, PR = respuesta parcial
* Se observó una reducción del 58% en el riesgo de progresión de la enfermedad o muerte ** La tasa global de concordancia entre el investigador y la evaluación del Comité Investigador Independiente fue del 70%
*** Se observó un elevado número de cruces en el tratamiento. El 82% de los pacientes en el brazo de quimioterapia recibieron en segunda línea un inhibidor de la tirosina quinasa del EGFR (todos menos 2 recibieron Tarceva).
- Tratamiento de mantenimiento de CPNM tras quimioterapia de primera línea (Tarceva administrado en monoterapia):
Se ha investigado la eficacia y la seguridad de Tarceva como mantenimiento tras una primera línea de quimioterapia, para pacientes con CPNM, en un ensayo (BO18192, SATURN) aleatorizado, doble-ciego, controlado con placebo. Este ensayo fue realizado en 889 pacientes con CPNM localmente avanzado o metastásico que no habían progresado tras 4 ciclos de un doblete de quimioterapia, basada en compuestos de platino. Los pacientes fueron aleatorizados 1:1 para ser tratados con Tarceva 150 mg o placebo por vía oral una vez al día, hasta progresión de la enfermedad. El objetivo primario del ensayo incluía Supervivencia Libre de Progresión (PFS) en todos los pacientes. Las características demográficas basales y de la enfermedad, estuvieron bien equilibradas en los dos brazos de tratamiento. No se incluyeron en el estudio pacientes con ECOG PS>1, con comorbilidad hepática o renal significativa.
En este estudio, la población total mostró un beneficio para la variable principal SLP (HR=0,71 p< 0,0001) y la variable secundaria SG (HR=0,81 p=0,0088). Sin embargo, el mayor beneficio se observó en un análisis exploratorio predefinido en pacientes con mutaciones activadoras de EGFR (n=49) demostrando un beneficio considerable de SLP (HR=0,10, 95% CI 0,04 a 0,25, p<0,0001) y un HR de la supervivencia global de 0,83 (95% CI 0,34 a 2,02). El 67% de los pacientes del subgrupo placebo con mutación EGFR positiva recibieron tratamiento de segunda o sucesivas líneas con EGFR-TKIs.
El estudio BO25460 (IUNO) se realizó en 643 pacientes con CPNM avanzado sin mutaciones activadoras de EGFR (deleción del exón 19 o mutación L858R del exón 21) y que no experimentaron progres ión de la enfermedad después de cuatro ciclos de quimioterapia basada en compuestos de platino.
El objetivo del estudio era comparar la supervivencia global del tratamiento de mantenimiento de primera línea con erlotinib versus erlotinib administrado en el momento de progresión de la enfermedad. Este estudio no alcanzó con su variable principal. La SG de Tarceva en el tratamiento de mantenimiento de primera línea no fue superior al tratamiento con Tarceva en segunda línea en pacientes cuyo tumor no albergó una mutación activadora de EGFR (HR=1,02, 95% CI 0,85 a 1,22, p=0,82). La variale secundaria de SLP no mostró ninguna diferencia entre Tarceva y placebo en el tratamiento de mantenimiento (HR=0,94, 95% CI 0,80 a 1,11, p=0,48).
Según los datos del estudio BO25460 (IUNO), el uso de Tarceva no está recomendado en el tratamiento de mantenimiento de primera línea en pacientes sin mutaciones activadoras de EGFR.
-Tratamiento de CPNM tras fallo de al menos un régimen quimioterápico anterior (Tarceva administrado en monoterapia):
La eficacia y seguridad de Tarceva en segunda/tercera línea han sido demostradas en un ensayo aleatorizado, doble ciego, controlado con placebo (BR.21) realizado en 731 pacientes con CPNM localmente avanzado o metastático tras el fallo de, al menos, un tratamiento quimioterápico. Los pacientes fueron aleatorizados 2:1 para ser tratados con Tarceva 150 mg o placebo por vía oral una vez al día. Los objetivos del ensayo incluyeron supervivencia global, supervivencia libre de progresión (PFS), índice de respuesta, duración de la respuesta, tiempo hasta el deterioro de los síntomas relacionados con el cáncer de pulmón (tos, disnea y dolor) y seguridad. El objetivo principal fue la supervivencia.
Las características demográficas estuvieron bien equilibradas en los dos grupos de tratamiento. Alrededor de dos tercios de los pacientes fueron hombres y aproximadamente un tercio presentaban un ECOG basal de 2 y un 9% tenían un ECOG basal de 3. El 93% y el 92% de todos los pacientes del grupo Tarceva y del grupo placebo respectivamente, habían sido tratados con una terapia anterior que contenía platino y un 36% y un 37% de todos los pacientes, respectivamente, habían sido tratados anteriormente con taxanos.
El índice de riesgo ajustado por muerte en el grupo tratado con Tarceva en relación con el grupo placebo fue 0,73 (95% CI, de 0,6 a 0,87) (p = 0,001). El porcentaje de pacientes vivos a los 12 meses fue del 31,2% y 21,5% para los grupos tratados con Tarceva y con placebo, respectivamente. La mediana de supervivencia global fue de 6,7 meses (95% CI, de 5,5 a 7,8 meses) en el grupo tratado con Tarceva en comparación con los 4,7 meses observados en el grupo placebo (95% CI, de 4,1 a 6,3 meses).
Se ha investigado el efecto sobre la supervivencia global en distintos subgrupos de pacientes. El efecto de Tarceva sobre la supervivencia global fue similar en pacientes con una ECOG basal de 2 - 3 (HR = 0,77, 95% CI 0,6 - 1,0) o de 0 - 1 (HR = 0,73, 95% CI 0,6 - 0,9), hombres (HR = 0,76, 95% CI 0,6 - 0,9) o mujeres (HR = 0,80, 95% CI 0,6 - 1,1), pacientes menores de 65 años (HR = 0,75, 95% CI 0,6 - 0,9) o mayores (HR = 0,79, 95% CI 0,6 - 1,0), pacientes con un tratamiento anterior (HR = 0,76, 95% CI 0,6 - 1,0) o con más de uno (HR = 0,75, 95% CI 0,6 - 1,0), caucasianos (HR = 0,79, 95% CI 0,6 - 1,0) o asiáticos (HR = 0,61, 95% CI 0,4 - 1,0), pacientes con adenocarcinoma (HR = 0,71, 95% CI 0,6 - 0,9) o carcinoma escamoso (HR = 0,67, 95% CI 0,5 - 0,9), pero no con otras histologías (HR = 1,04, 95% CI 0,7 - 1,5), pacientes con enfermedad en estadio IV diagnosticada (HR = 0,92,
95% CI 0,7 - 1,2) o en estadio < IV (HR = 0,65, 95% CI 0,5 - 0,8). Los pacientes que nunca habían fumado obtuvieron un beneficio mucho mayor con erlotinib (supervivencia HR = 0,42, 95% CI 0,28 -0,64) en comparación con los fumadores o los ex - fumadores (HR = 0,87, 95% CI 0,71 - 1,05).
La expresión del EGFR se determinó en el 45% de los pacientes, estableciéndose un índice de riesgo de 0,68 (95% CI 0,49 - 0,94) en los pacientes con tumores EGFR - positivos y de 0,93 (95% CI 0,63 -1,36) en aquellos con tumores EGFR - negativos (definidos mediante ICH empleando el kit EGFR pharmDx y definiendo EGFR - negativo como tinción de menos del 10% de las células tumorales). En el 55% restante, en el que se desconocía la expresión del EGFR, el índice de riesgo fue de 0,77 (95% CI 0,61 -0,98).
La mediana de PFS fue de 9,7 semanas en el grupo tratado con Tarceva (95% CI, 8,4 a 12,4 semanas) siendo de 8,0 semanas en el grupo placebo (95% CI, 7,9 a 8,1 semanas).
El índice de respuesta objetiva medido por RECIST fue del 8,9% en el grupo con Tarceva (95% CI,
6,4 a 12,0). Los primeros 330 pacientes que fueron evaluados centralmente (índice de respuesta: 6,2%) y 401 pacientes fueron evaluados por el investigador (índice de respuesta: 11,2%).
La mediana de duración de la respuesta fue de 34,3 semanas, con un rango entre 9,7 y 57,6+ semanas. La proporción de pacientes que presentaron respuesta completa, respuesta parcial o enfermedad estable en el grupo tratado con Tarceva y placebo fue del 44,0% y 27,5% (p = 0,004), respectivamente.
También se observó un beneficio en la supervivencia en pacientes tratados con Tarceva que no alcanzaron una respuesta objetiva tumoral (por RECIST). La evidencia de esta afirmación radica en que el índice de riesgo por muerte fue de 0,82 (95% CI, 0,68 a 0,99) en pacientes cuya mejor respuesta fue enfermedad estable o progresiva.
En el tratamiento con Tarceva se obtuvieron beneficios en los síntomas ya que se prolongó de forma significativa el tiempo hasta el deterioro de los síntomas en forma de tos, disnea y dolor versus placebo.
-Cáncer de páncreas (Tarceva administrado en combinación con gemcitabina en el ensayo PA.3):
La eficacia y seguridad de Tarceva en combinación con gemcitabina como tratamiento de primera línea fueron evaluadas en un ensayo aleatorizado, doble-ciego, controlado con placebo en pacientes con cáncer de páncreas localmente avanzado, no resecable o metastásico. Los pacientes fueron aleatorizados para ser tratados con Tarceva o placebo una vez al día de forma continua y gemcitabina IV (1000 mg/ m2, Ciclo 1 - Días 1, 8, 15, 22, 29, 36 y 43 de un ciclo de 8 semanas; Ciclo 2 y siguientes ciclos - Días 1, 8 y 15 de un ciclo de 4 semanas [ver la Ficha Técnica de gemcitabina para la dosis y posología autorizadas para el cáncer de páncreas]). Tanto Tarceva como el placebo fueron administrados por vía oral una vez al día hasta progresión de la enfermedad o toxicidad inaceptable. El objetivo principal del ensayo fue supervivencia global.
Las características demográficas y de enfermedad de los pacientes fueron similares entre los 2 grupos de tratamiento, Tarceva 100 mg y gemcitabina o placebo y gemcitabina, excepto por una ligera mayor proporción de mujeres en el brazo de erlotinib/gemcitabina en comparación con el brazo tratado con placebo/gemcitabina:
|
Situación a nivel basal |
Tarceva |
Placebo |
|
Mujeres |
51% |
44% |
|
ECOG performance status (PS) = 0 a nivel basal |
31% |
32% |
|
ECOG performance status (PS) = 1 a nivel basal |
51% |
51% |
|
ECOG performance status (PS) = 2 a nivel basal |
17% |
17% |
|
Enfermedad metastásica a nivel basal |
77% |
76% |
La supervivencia se evaluó en la población con intención de ser tratada (“Intend-to-treat population”) en base al seguimiento de los datos de supervivencia. Los resultados se muestran en la tabla siguiente (los datos de los grupos de pacientes con enfermedad metastásica o localmente avanzada se derivan del análisis exploratorio de los subgrupos).
|
Resultado |
Tarceva (meses) |
Placebo (meses) |
A (meses) |
CI del A |
HR |
CI del HR |
Valor de P |
|
Población Global | |||||||
|
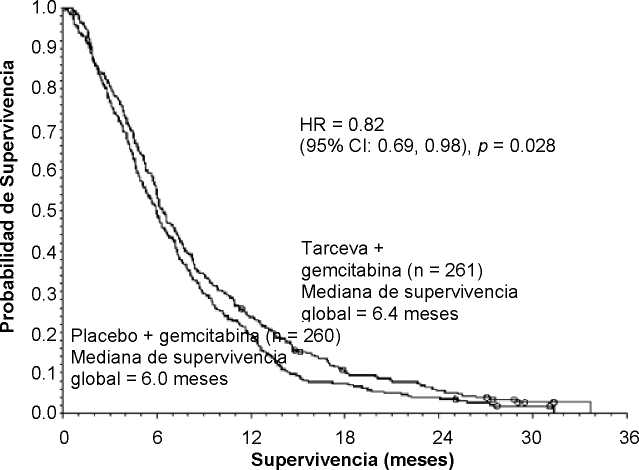
Mediana de supervivencia global |
6.4 |
6.0 |
0.41 |
-0,54-1,64 |
0,82 |
0,69-0,98 |
0,028 |
|
Media de supervivencia global |
8.8 |
7.6 |
1.16 |
-0,05-2,34 | |||
|
Población con enfermedad metastásica | |||||||
|
Mediana de supervivencia global |
5,9 |
5,1 |
0,87 |
-0,26-1,56 |
0,80 |
0,66-0,98 |
0,029 |
|
Media de supervivencia global |
8,1 |
6,7 |
1,43 |
0,17-2,66 | |||
|
Población con enfermedad localmente avanzada | |||||||
|
Mediana de supervivencia global |
8,5 |
8,2 |
0,36 |
-2,43-2,96 |
0,93 |
0,65-1,35 |
0,713 |
|
Media de supervivencia global |
10,7 |
10,5 |
0,19 |
-2,43-2,69 | |||
Supervivencia Global-Todos los pacientes
Supervivencia Global - Pacientes con metástasis a distancia
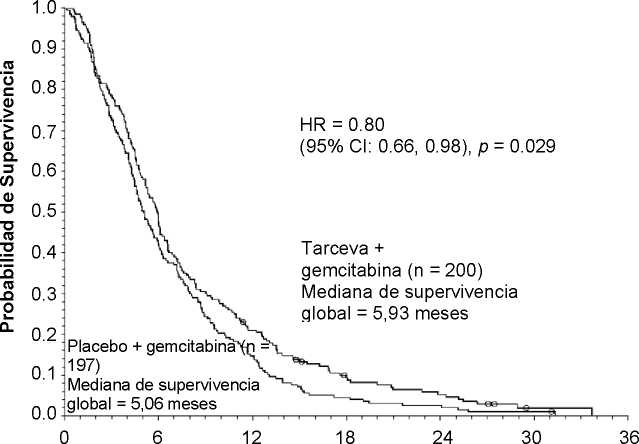
Supervivencia (meses)
En un análisis de los datos del estudio realizado a posteriori se observó que los pacientes con situación clínica favorable a nivel basal (baja intensidad de dolor, buena calidad de vida y buen PS) pueden obtener más beneficio del tratamiento con Tarceva. El beneficio se relaciona principalmente con la existencia de una puntuación baja de intensidad de dolor.
En un análisis de los datos del estudio realizado a posteriori se observó que los pacientes en tratamiento con Tarceva que desarrollaron rash, tuvieron una supervivencia global más larga comparada con los pacientes que no tuvieron rash (mediana de supervivencia global de 7,2 meses versus 5 meses, HR: 0,61). El 90% de los pacientes desarrollaron rash en los primeros 44 días de tratamiento. La mediana del tiempo de aparición de rash fue de 10 días.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Tarceva en los diferentes grupos de la población pediátrica, para las indicaciones de Cáncer de Pulmón No Microcítico y Cáncer Pancreático (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción: Tras la administración oral, los niveles plasmáticos máximos de erlotinib se obtienen a las 4 horas, aproximadamente, tras dicha administración. En un ensayo con voluntarios sanos se pudo estimar que la biodisponibilidad absoluta es del 59%. La exposición tras una dosis oral puede verse incrementada por los alimentos.
Distribución: Erlotinib tiene un volumen de distribución aparente medio de 232 l y se distribuye dentro del tejido tumoral en humanos. En un ensayo con 4 pacientes (3 con cáncer de pulmón no microcítico [CPNM] y 1 con cáncer de laringe) que fueron tratados con dosis orales diarias de 150 mg de Tarceva, se determinó los niveles de erlotinib en muestras de tumores obtenidas por extracciones quirúrgicas realizadas el Día 9 del tratamiento, obteniéndose concentraciones medias de erlotinib de 1.185 ng/g de tejido tumoral. Esto correspondía a una media global del 63% (rango 5 - 161%) de las concentraciones plasmáticas máximas en equilibrio que han sido determinadas. Los metabolitos activos principales estaban presentes en el tumor en concentraciones medias de 160 ng/g de tejido, lo que correspondía a un promedio global del 113% (rango 88 - 130%) de las concentraciones plasmáticas máximas en equilibrio que han sido determinadas. La unión a las proteínas plasmáticas es aproximadamente de un 95%. Erlotinib se une a la albúmina sérica y a la glicoproteína ácida alfal (AAG).
Biotran sformación: En humanos, erlotinib se metaboliza en el hígado por los citocromos hepáticos, principalmente por el CYP3A4 y en menor medida por el CYP1A2. También contribuye potencialmente al aclaramiento metabólico de erlotinib el metabolismo extrahepático por el CYP3A4 en el intestino, por el CYP1A1 en pulmones y por el CYP1B1 en tejido tumoral.
Se han identificado tres rutas metabólicas principales: 1) O-demetilación de cualquiera de las cadenas laterales o de ambas, seguida de la oxidación de los ácidos carboxílicos; 2) oxidación del grupo acetileno, seguida de la hidrólisis del ácido aril carboxílico y 3) hidroxilación aromática del grupo fenil-acetileno. Los metabolitos principales de erlotinib, OSI-420 y OSI-413, producidos por la O-demetilación de cualquiera de las cadenas laterales, tuvieron una potencia comparable a erlotinib en ensayos no clínicos in vitro y en modelos tumorales in vivo. Estos metabolitos están presentes en el plasma a niveles < 10% de erlotinib y muestran una farmacocinética similar a la de erlotinib.
Eliminación: Erlotinib se excreta predominantemente por las heces en forma de metabolitos (>90%) y una pequeña cantidad de una dosis oral se elimina por vía renal (aproximadamente el 9%). Menos del 2% de la dosis administrada oralmente se excreta como sustancia sin alterar. En un análisis farmacocinético poblacional realizado en 591 pacientes que recibieron Tarceva como medicamento único, se determinó un aclaramiento aparente medio de 4,47 l/hora con una mediana de semivida de
36,2 horas. Por lo tanto, el tiempo en alcanzar la concentración plasmática en equilibrio se espera que sea de 7-8 días aproximadamente.
Farmacocinética en poblaciones especiales:
En base a los análisis farmacocinéticos poblacionales, no se ha observado relación clínicamente significativa entre el aclaramiento aparente predicho y la edad, peso, sexo y raza del paciente. Los factores de los pacientes que se correlacionaban con la farmacocinética de erlotinib fueron la bilirrubina total sérica, AAG y fumar en la actualidad. Las concentraciones séricas elevadas de bilirrubina total y las concentraciones de AAG se asociaron con una reducción del aclaramiento de erlotinib. No está clara la relevancia clínica de estas diferencias. Sin embargo, los fumadores tuvieron un índice incrementado de aclaramiento de erlotinib. Esto fue confirmado en un estudio farmacocinético realizado en sujetos sanos que fumaban en el momento de realizar el estudio y en no fumadores, recibiendo ambos grupos una dosis oral única de 150 mg de erlotinib. La media geométrica de la Cmax fue 1056 ng/mL en no fumadores y 689 ng/mL en fumadores con una proporción media de fumadores versus no fumadores del 65.2% (95% CI: 44,3 a 95,9, p = 0,031). La media geométrica del AUC0-inf fue 18726 ng^h/mL en los no fumadores y 6718 ng^h/mL en los fumadores con una proporción media del 35,9% (95% CI: 23,7 a 54,3, p < 0,0001). La media geométrica de la C24h fue 288 ng/mL en no fumadores y 34,8 ng/mL en fumadores con una proporción media del 12,1% (95% CI: 4,82 a 30,2, p = 0,0001).
En un estudio pivotal fase III en fumadores activos con CPNM, se alcanzó una concentración plasmática en estado estacionario de 0,65 pg/mL (n=16), que fue aproximadamente 2 veces menor en aquellos que habían dejado de fumar o en pacientes que nunca habían fumado (1,28 pg/mL n=108). Este efecto se produjo junto a un aumento del 24% en el aclaramiento plasmático aparente de erlotinib. En un estudio fase I de escalada de dosis en pacientes que fueron fumadores activos con CPNM, el análisis de la farmacocinética indicó un aumento proporcional de la exposición a erlotinib en el estado de equilibrio, cuando la dosis de Tarceva se aumento de 150 mg a la dosis máxima tolerada de 300 mg. En este estudio, la concentración plasmática en estado estacionario para una dosis de 300 mg en fumadores activos fue de 1,22 pg/mL (n=17).
En base a los resultados de estudios farmacocinéticos, se debe aconsejar a los fumadores que dejen de fumar mientras estén en tratamiento con Tarceva, ya que, de lo contrario, las concentraciones plasmáticas podrían verse reducidas.
En base a los análisis farmacocinéticos poblacionales, la presencia de un opioide incrementó la exposición alrededor de un 11%.
Se llevó a cabo un segundo análisis farmacocinético poblacional incorporando los datos de erlotinib obtenidos de 204 pacientes con cáncer pancreático que fueron tratados con erlotinib y gemcitabina. Este análisis demostró que las covariantes que afectan al aclaramiento de erlotinib en los pacientes del estudio pancreático eran muy similares a los observados en el análisis farmacocinético previo en monoterapia. No se han identificado nuevos efectos covariantes. La co-administración de gemcitabina no tuvo efecto en el aclaramiento plasmático de erlotinib.
Población pediátrica: no se han realizado estudios específicos en pacientes pediátricos.
Población anciana: no se han realizado estudios específicos en pacientes ancianos.
Insuficiencia hepática: Erlotinib se aclara principalmente en el hígado. En pacientes con tumores sólidos y con insuficiencia hepática moderada (valor Child-Pugh 7 - 9) la media geométrica del AUC0-t y la Cmax de erlotinib fue 27000 ng^h/mL y 805 ng/mL, respectivamente, en comparación con 29300 ng^h/mL y 1090 ng/mL en pacientes con buena función hepática incluyendo pacientes con cáncer de hígado primario o metástasis hepáticas. Aunque la Cmax fue más baja de forma estadísticamente significativa en pacientes con insuficiencia hepática moderada, se consideró que esta diferencia no era clínicamente relevante. No hay datos disponibles respecto a la influencia de la disfunción hepática grave en la farmacocinética de erlotinib. En análisis farmacocinéticos poblacionales, el aumento de las concentraciones séricas de la bilirrubina total se asoció con un índice de aclaramiento de erlotinib más lento.
Insuficiencia renal: Erlotinib y sus metabolitos no se excretan significativamente vía renal ya que menos del 9% de una dosis única es excretada en la orina. En análisis farmacocinéticos poblacionales, no se observó una relación significativa entre el aclaramiento de erlotinib y el aclaramiento de creatinina, pero no hay datos disponibles en pacientes con aclaramiento de creatinina < 15 ml/min.
5.3 Datos preclínicos sobre seguridad
Los efectos debidos a dosis crónicas observados en al menos una especie animal o estudio incluyeron efectos en la córnea (atrofia, ulceración), piel (degeneración folicular e inflamación, enrojecimiento y alopecia), ovarios (atrofia), hígado (necrosis hepática), riñón (necrosis papilar renal y dilatación tubular), y tracto gastrointestinal (vaciado gástrico retardado y diarrea). Los parámetros de las células rojas sanguíneas disminuyeron y las células blancas sanguíneas, principalmente neutrófilos, aumentaron. Hubo aumentos en ALT, AST y bilirrubina relacionados con el tratamiento. Estos hallazgos se observaron para exposiciones muy por debajo de exposiciones clínicamente relevantes.
En base al mecanismo de acción, erlotinib puede ser potencialmente teratógeno. Los datos obtenidos en pruebas de toxicidad reproductiva realizadas a ratas y conejos a dosis cercanas a la dosis máxima tolerada y/o maternalmente tóxicas mostraron toxicidad reproductiva (embriotoxicidad en ratas, reabsorción del embrión y toxicidad fetal en conejos) y de desarrollo (disminución en el crecimiento de las crías y en la supervivencia en ratas) pero no resultó teratogénico y no dañó la fertilidad. Estos hallazgos fueron observados a exposiciones clínicamente relevantes.
El resultado de estudios de genotoxicidad convencionales con erlotinib fue negativo. Los resultados de carcinogenicidad realizados con erlotinib durante dos años en ratas y ratones expuestos hasta dosis superiores a la exposición terapéutica en humanos (hasta 2 veces y 10 veces más altas, respectivamente, basado en la Cmax y /o AUC) fueron negativos.
En ratas se ha observado una reacción fototóxica media en la piel tras irradiación UV.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Núcleo del comprimido'.
Lactosa monohidrato Celulosa microcristalina (E460)
Almidón glicolato sódico Tipo A Laurilsulfato sódico Estearato magnésico (E470 b)
Cubierta del comprimido:
Hidroxipropil celulosa (E463)
Dióxido de titanio (E171)
Macrogol
Hipromellosa (E464)
6.2 Incompatibilidades
No procede.
6.3 Período de validez
4 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Blister de PVC sellado con una lámina de aluminio que contiene 30 comprimidos.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Roche Registration Limited 6 Falcon Way Shire Park
Welwyn Garden City AL7 1TW Reino Unido.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/311/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 19 de Septiembre 2005 Fecha de la última renovación: 2 de Julio 2010
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
1. NOMBRE DEL MEDICAMENTO
Tarceva 100 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un comprimido recubierto con película contiene 100 mg de erlotinib (como erlotinib clorhidrato).
Excipientes con efecto conocido: Cada comprimido recubierto con película contiene 69,21 mg de Lactosa monohidrato.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Comprimidos de color blanco a amarillento, redondos, biconvexos, con el grabado “T 100”. en una cara.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Cáncer de Pulmón No Microcítico (CPNM):
Tarceva está indicado en el tratamiento de primera línea de pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con mutaciones activadoras de EGFR.
Tarceva está también indicado como tratamiento de mantenimiento de pacientes con CPNM localmente avanzado o metastásico con mutaciones activadoras de EGFR y enfermedad estable después de un régimen quimioterápico de primera línea.
Tarceva también está indicado en el tratamiento de pacientes con CPNM localmente avanzado o metastásico tras fallo, al menos, a un tratamiento quimioterápico anterior.
Se deberían considerar los factores asociados con el aumento de la supervivencia cuando se prescriba Tarceva.
No se ha demostrado beneficio en la supervivencia u otros efectos clínicamente relevantes del tratamiento en pacientes con tumores que no expresen el Receptor del Factor de Crecimiento Epidérmico (EGFR) IHQ negativa (ver sección 5.1).
Cáncer de páncreas:
Tarceva en combinación con gemcitabina está indicado en el tratamiento de pacientes con cáncer de páncreas metastásico.
Se deberían considerar los factores asociados con el aumento de la supervivencia cuando se prescriba Tarceva (ver sección 4.2 y 5.1).
En pacientes con enfermedad localmente avanzada no se han podido observar ventajas en términos de supervivencia.
4.2 Posología y forma de administración
El tratamiento con Tarceva debe ser supervisado por un especialista con experiencia en el empleo de terapias anti-cancerosas.
Pacientes con Cáncer de Pulmón No Microcítico:
Se debe llevar a cabo el test de la mutación de EGFR antes de iniciar el tratamiento con Tarceva en pacientes con CPNM avanzado o metastásico, que no han sido tratados previamente con quimioterapia.
La dosis diaria recomendada de Tarceva es 150 mg administrada al menos una hora antes o dos después de la ingestión de alimentos.
Pacientes con cáncer de páncreas:
La dosis diaria recomendada de Tarceva es 100 mg administrada al menos una hora antes o dos horas después de la ingestión de alimentos, en combinación con gemcitabina (ver la ficha técnica de gemcitabina para la indicación de cáncer de páncreas).
Se debería reevaluar la continuación del tratamiento con Tarceva en pacientes que no desarrollen rash dentro de las primeras 4-8 semanas del tratamiento (ver sección 5.1).
Cuando sea necesario un ajuste de dosis, ésta se debe reducir en fracciones de 50 mg (ver sección 4.4). Tarceva está disponible en dosis de 25 mg, 100 mg y 150 mg.
El uso concomitante de sustratos y moduladores del citocromo CYP3A4 puede requerir un ajuste de dosis (ver sección 4.5).
Pacientes con insuficiencia hepática: Erlotinib se elimina por metabolismo hepático y excreción biliar. Aunque la exposición a erlotinib fue similar en pacientes con insuficiencia hepática moderada (valor Child-Pugh 7-9) en comparación con la de pacientes con buena función hepática, deberá tenerse precaución cuando se administre Tarceva a pacientes con insuficiencia hepática. Si aparecen reacciones adversas graves, debe considerarse la posibilidad de reducir la dosis o interrumpir la administración de Tarceva. La seguridad y eficacia de erlotinib no ha sido estudiada en pacientes con disfunción hepática grave (AST/SGOT y ALT/SGPT > 5x ULN). No se recomienda usar Tarceva en pacientes con disfunción hepática grave (ver sección 5.2).
Pacientes con insuficiencia renal: La seguridad y eficacia de erlotinib no ha sido estudiada en pacientes con insuficiencia renal (concentración sérica de creatinina > 1,5 veces el límite superior normal). En base a los datos farmacocinéticos, no parece necesario un ajuste de la dosis en pacientes con insuficiencia renal media o moderada (ver sección 5.2). No se recomienda el uso de Tarceva en pacientes con insuficiencia renal grave.
Población pediátrica: no se ha establecido la seguridad y eficacia de erlotinib en pacientes menores de 18 años. No está recomendado el uso de Tarceva en pacientes pediátricos.
Fumadores: Se ha demostrado que fumar cigarrillos reduce la exposición a erlotinib en un 50-60%. La dosis máxima tolerada de Tarceva en pacientes fumadores activos con CPNM fue de 300 mg. No se ha establecido la eficacia y seguridad a largo plazo de dosis mayores a las dosis iniciales recomendadas en pacientes que continúan fumando cigarrillos (ver sección 4.5 y 5.2). Por lo tanto se debe recomendar a los fumadores activos que dejen de fumar ya que las concentraciones plasmáticas de erlotinib en fumadores se reducen respecto a las que presentan los no fumadores.
4.3 Contraindicaciones
Hipersensibilidad a erlotinib o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Evaluación del estado mutacional del EGFR
Cuando se evalúa el estado mutacional del EGFR de un paciente, es importante elegir una metodología validada y robusta para evitar la obtención de falsos negativos o falsos positivos.
Fumadores:
Se deberá recomendar a los fumadores dejar de fumar ya que las concentraciones plasmáticas de erlotinib se reducen en fumadores en comparación con no fumadores. Es probable que el grado de reducción sea clínicamente significativo (ver sección 4.5).
Enfermedad pulmonar intersticial:
Se han observado casos poco frecuentes de reacciones semejantes a enfermedad pulmonar intersticial (EPI), incluyendo fallecimientos, en pacientes que fueron tratados con Tarceva para el cáncer de pulmón no microcítico (CPNM), cáncer de páncreas u otros tumores sólidos avanzados. En el ensayo pivotal BR.21 en CPNM, la incidencia de EPI (0,8%) fue la misma tanto en el grupo al que se le administró placebo como en el tratado con Tarceva. En el ensayo de cáncer de páncreas en combinación con gemcitabina, la incidencia de reacciones semejantes a EPI fue del 2,5% en el grupo de Tarceva y gemcitabina versus el 0,4% en el grupo tratado con placebo y gemcitabina. La incidencia global en los pacientes tratados con Tarceva de todos los ensayos (incluidos los ensayos no controlados y los ensayos con quimioterapia concurrente) es aproximadamente del 0,6% comparada con el 0,2% en los pacientes con placebo. Los diagnósticos realizados en los pacientes en los que hubo sospecha de que tuvieran reacciones semejantes a EPI incluyeron: neumonitis, neumonitis causada por radiación, neumonitis por hipersensibilidad, neumonía intersticial, enfermedad pulmonar intersticial, bronquiolitis obliterante, fibrosis pulmonar, Síndrome de Distrés Respiratorio Agudo (ARDS), alveolitis e infiltración pulmonar. Los síntomas se presentaron en un intervalo que fue desde unos pocos días tras iniciar la terapia con Tarceva hasta varios meses desde el inicio de ésta. Se dieron frecuentemente factores que pudieron contribuir o confundir el diagnóstico como pueden ser la quimioterapia concomitante o previa, radioterapia previa, enfermedad parenquimal pulmonar preexistente, enfermedad pulmonar metastásica o infecciones pulmonares. Se observó una mayor incidencia de EPI entre los pacientes de origen japonés (aproximadamente el 5% con una tasa de mortalidad del 1,5%).
En pacientes que presenten un comienzo agudo de síntomas pulmonares inexplicables, nuevos y/o progresivos, tales como disnea, tos y fiebre, se debe interrumpir la terapia con Tarceva hasta que se realice una evaluación diagnóstica. Los pacientes tratados con erlotinib y gemcitabina en combinación deberían ser monitorizados cuidadosamente por la posibilidad de desarrollar toxicidad semejante a EPI. Si se diagnostica EPI, se debe suspender el tratamiento con Tarceva e iniciar el tratamiento apropiado necesario (ver sección 4.8).
Diarrea, deshidratación, desequilibrio hidroelectrolítico e insuficiencia renal
Se ha observado diarrea (incluyendo casos muy raros con resultado de muerte) en aproximadamente el 50% de los pacientes en tratamiento con Tarceva. La diarrea moderada o grave debe ser tratada con, por ejemplo, loperamida. En algunos casos, puede ser necesaria una reducción de la dosis. En los ensayos clínicos, las dosis fueron reducidas en fracciones de 50 mg. No se han investigado reducciones de dosis en fracciones de 25 mg. En el caso de presentarse diarrea grave o persistente, náuseas, anorexia o vómitos asociados a deshidratación, el tratamiento con Tarceva debe ser interrumpido y deben tomarse las medidas apropiadas para tratar la deshidratación (ver sección 4.8).
En raros casos, se ha observado hipopotasemia y fallo renal (incluidos fallecimientos). Algunos casos fueron secundarios a deshidratación grave debida a diarrea, vómitos y/o anorexia, mientras que otros fueron confundidos con la quimioterapia concomitante. La terapia con Tarceva deberá interrumpirse y se deberán adoptar medidas apropiadas para rehidratar por vía intravenosa a los pacientes en muchos casos de diarrea grave o persistente, o en casos que provoquen deshidratación, especialmente en grupos de pacientes con factores de riesgo agravantes (especialmente quimioterapia y otra medicación concomitante, síntomas o enfermedades u otras situaciones que pudieran predisponer, incluyendo la edad avanzada). Además, en los pacientes con riesgo de deshidratación, se deberá monitorizar la función renal y la determinación de electrolitos en suero, incluyendo el potasio.
Hepatitis, fallo hepático
Durante el uso de Tarceva, se han notificado casos raros de fallo hepático (incluidos fallecimientos). Entre lo s factores de confusión se ha incluido la existencia previa de enfermedad hepática o medicación concomitante hepatotóxica. Por lo tanto, en estos pacientes, se debe considerar la realización de un examen de la función hepática de forma periódica. El tratamiento con Tarceva debe interrumpirse si hay cambios graves en la función hepática (ver sección 4.8). No se recomienda el uso de Tarceva en pacientes con disfunción hepática grave.
Perforación gastrointestinal
Se ha observado con poca frecuencia que los pacientes en tratamiento con Tarceva tienen un mayor riesgo de aparición de perforación gastrointestinal (incluyendo algunos casos con resultado de muerte). El riesgo es mayor en los pacientes que reciben de forma concomitante agentes anti-angiogénicos, corticosteroides, AINEs y/o quimioterapia basada en taxanos, o que tengan antecedentes de úlcera péptica o enfermedad diverticular. El tratamiento con Tarceva debe suspenderse permanentemente en aquellos pacientes en los que aparezca perforación gastrointestinal (ver sección 4.8).
Trastornos vesiculares y exfoliativos de la piel
Se han notificado casos de alteraciones vesiculares, ampollosas y exfoliativas en la piel, incluyendo casos muy raros indicativos del síndrome de Stevens-Johnson/Necrolisis epidérmica tóxica, que en algunos casos fueron mortales. (ver sección 4.8). El tratamiento con Tarceva debe interrumpirse o suspenderse si en el paciente aparecen vesículas, ampollas o exfoliación de carácter grave. Los pacientes con trastornos vesiculares y exfoliativos de la piel, se deben hacer la prueba de infecciones de la piel y ser tratados de acuerdo con las directrices locales.
Trastornos oculares
Los pacientes que presenten signos y síntomas indicadores de queratitis, como una agudización o empeoramiento de: inflamación ocular, lagrimeo, fotosensibilidad ocular, visión borrosa, dolor ocular y/o ojos enrojecidos, deben ser remitidos inmediatamente a un especialista en oftalmología. Si el diagnóstico de queratitis ulcerativa se confirma, el tratamiento con Tarceva debe ser interrumpido o suspendido. Si se diagnostica queratitis, se deben evaluar cuidadosamente los beneficios y riesgos de continuar con el tratamiento. Tarceva debe ser utilizado con precaución en pacientes con antecedentes de queratitis, queratitis ulcerativa u ojo seco grave. El uso de lentes de contacto también es un factor de riesgo para la queratitis y ulceración. Durante el uso de Tarceva se han notificado casos muy raros de ulceración o perforación de la córnea (ver sección 4.8).
Interacciones con otros medicamentos:
Los inductores potentes del citocromo CYP3A4 pueden reducir la eficacia de erlotinib mientras que los inhibidores potentes del CYP3A4 pueden producir un aumento de la toxicidad. Debe evitarse el tratamiento concomitante con estos tipos de agentes (ver sección 4.5).
Otras formas de interacción:
Erlotinib se caracteriza por una disminución de su solubilidad a un pH superior a 5. Los medicamentos que modifican el pH del tracto Gastro-Intestinal (GI) superior, como los inhibidores de la bomba de protones, antagonistas H2 y antiácidos, pueden alterar la solubilidad de erlotinib y, por lo tanto, su biodisponibilidad. No es probable que un aumento de la dosis de Tarceva cuando se co-administre con tales agentes compense la pérdida de exposición. Deberá evitarse la combinación de erlotinib con inhibidores de la bomba de protones. Se desconocen los efectos de la administración concomitante de erlotinib con antagonistas H2 y antiácidos; no obstante, es probable que se reduzca su biodisponibilidad. Por consiguiente, deberá evitarse la administración concomitante de estas combinaciones (ver sección 4.5). Si se considera necesario el uso de antiácidos durante el tratamiento con Tarceva, deberían tomarse al menos 4 horas antes ó 2 horas después de la dosis diaria de Tarceva.
Los comprimidos contienen lactosa y no deben ser administrados a pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios de interacciones se han realizado sólo en adultos.
Erlotinib y otros sustratos del CYP
Erlotinib es un inhibidor potente del citocromo CYP1A1 y un inhibidor moderado del CYP3A4 y CYP2C8, y es también un inhibidor fuerte de la glucuronidación por UGT1A1 in vitro.
Se desconoce la relevancia fisiológica de la fuerte inhibición del CYP1A1 debido a que la expresión de CYP1A1 es muy limitada en tejidos humanos.
Cuando erlotinib se coadministró con ciprofloxacino, un inhibidor moderado del CYP1A2, la exposición a erlotinib [AUC] aumentó significativamente un 39%, aunque no produjo ningún cambio estadísticamente significativo en Cmáx. Del mismo modo, la exposición al metabolito activo aumentó alrededor de un 60% y un 48% para AUC y Cmáx, respectivamente. No se ha determinado la relevancia clínica de este aumento. Debe tenerse precaución cuando ciprofloxacino o inhibidores potentes del CYP1A2 (por ej. fluvoxamina) se combinen con erlotinib. Si se observan reacciones adversas relacionadas con erlotinib, la dosis de erlotinib puede reducirse.
El tratamiento previo o la co-administración de Tarceva no alteró el aclaramiento de midazolam y eritromicina, sustratos prototípicos del CYP3A4, pero parece que disminuyó la biodisponibilidad oral del midazolam hasta el 24%. En otro ensayo clínico, erlotinib no afectó a la farmacocinética de paclitaxel, sustrato del CYP3A4/2C8, al ser administrado concomitantemente. Por tanto, las interacciones significativas con el aclaramiento de otros sustratos del CYP3A4 son improbables.
La inhibición de la glucuronidación puede provocar interacciones con medicamentos que son sustratos de UGT1A1 y que sólo se eliminan por esta vía. Los pacientes con bajos niveles de expresión de UGT1A1 o alteraciones genéticas de la glucuronidación (por ej. enfermedad de Gilbert) pueden tener un aumento de la concentración de bilirrubina en suero y deben ser tratados con precaución.
En humanos, erlotinib es metabolizado en el hígado por los citocromos hepáticos, principalmente por CYP3A4 y en menor medida por CYP1A2. También contribuye potencialmente al aclaramiento metabólico de erlotinib, el metabolismo extrahepático por CYP3A4 en el intestino, CYP1A1 en pulmones y CYP1B1 en tejido tumoral. Pueden darse interacciones potenciales con sustancias activas que se metabolicen por esas enzimas o sean inhibidores o inductores de dichas enzimas.
Los inhibidores potentes de la actividad del CYP3A4 disminuyen el metabolismo de erlotinib y aumentan la concentración plasmática de erlotinib. En un ensayo clínico, el uso concomitante de erlotinib con ketoconazol (200 mg vía oral dos veces al día durante 5 días), un potente inhibidor del CYP3A4, condujo a un aumento de la exposición a erlotinib (86% del AUC y 69% de la Cmáx). Debe tenerse precaución cuando se combine erlotinib con un inhibidor potente del CYP3A4, como por ej. antifungicos azoles (como ketoconazol, itraconazol, voriconazol), inhibidores de la proteasa, eritromicina o claritromicina. Si es necesario se deberá reducir la dosis de erlotinib, particularmente si se observa toxicidad.
Los inductores potentes de la actividad del CYP3A4 aumentan el metabolismo de erlotinib y disminuyen significativamente las concentraciones plasmáticas de erlotinib. En un ensayo clínico, el uso concomitante de erlotinib y rifamicina (600 mg vía oral una vez al día durante 7 días), un inductor potente del CYP3A4, produjo una disminución de un 69% de la mediana del AUC de erlotinib. La coadministración de rifampicina con una sola dosis de Tarceva de 450 mg dio lugar a una exposición media de erlotinib (AUC) del 57,5% de la resultante tras una sola dosis de Tarceva de 150 mg sin rifampicina. Por lo tanto, debe evitarse la coadministración de Tarceva con inductores del CYP3A4.
Se debe considerar un aumento en la dosis hasta 300 mg en pacientes que requieren tratamiento concomitante de Tarceva con inductores potentes del CYP3A4 tales como rifampicina, siempre que su seguridad sea monitorizada estrechamente (incluyendo la función renal y hepática y los electrolitos séricos), y si ésta se tolera bien durante más de dos semanas, se podría considerar un aumento a 450 mg con una monitorización estrecha de seguridad. También puede darse una exposición reducida con otros inductores como por ej. fenitoína, carbamazepina, barbitúricos o Hipérico (hypericumperforatum, hierba de San Juan). Debe tenerse precaución cuando estas sustancias activas se combinen con erlotinib. Cuando sea posible, se deben considerar tratamientos alternativos evitando los inductores potentes de la actividad del CYP3A4.
Erlotinib y anticoagulantes derivados de la cumarina
En pacientes tratados con Tarcerva se han notificado casos de interacción con anticoagulantes derivados de la cumarina, incluyendo la warfarina, que produjeron aumentos en el Ratio Internacional Normalizado (INR) y hemorragias, que en algunos casos fueron mortales. Los pacientes a los que se les administre anticoagulantes derivados de la cumarina deben ser monitorizados regularmente para detectar cualquier cambio en el tiempo de protombina o en el INR.
Erlotinib y estatinas
La combinación de Tarceva y una estatina puede aumentar el riesgo de miopia inducida por estatinas, incluyendo rabdomiolisis, que fue observada de forma rara.
Erlotinib y fumadores
Los resultados de un estudio de interacción farmacocinética indicaron que existe una reducción significativa en el AUCinf, Cmax y en la concentración plasmática a las 24 horas de 2,8-, 1,5- y 9-veces, respectivamente, tras la administración de Tarceva en fumadores en comparación con no fumadores (ver sección 5.2). Por tanto, se debería aconsejar a los pacientes fumadores que dejen de fumar lo antes posible antes de iniciar el tratamiento con Tarceva, puesto que, de lo contrario, la concentración plasmática de erlotinib será más reducida. El efecto clínico de la disminución de dicha exposición no ha sido evaluado de forma determinante pero es probable que sea clínicamente significativo.
Erlotinib e inhibidores de la P-glicoproteína
Erlotinib es sustrato de la P-glicoproteína (transportador de sustancias activas). La administración concomitante de inhibidores de la P-glicoproteína, como p. ej. ciclosporina y verapamilo, puede producir una alteración en la distribución y/o eliminación de erlotinib. No se ha establecido las consecuencias de esta interacción para, p. ej., la toxicidad a nivel del SNC. Deberá tenerse precaución en dichas situaciones.
Erlotinib y medicamentos que alteran el pH
Erlotinib se caracteriza por una disminución de su solubilidad a un pH superior a 5. Los medicamentos que alteran el pH del tracto Gastro-Intestinal (GI) superior pueden alterar la solubilidad de erlotinib y por lo tanto su biodisponibilidad. La coadministración de erlotinib con omeprazol, un inhibidor de la bomba de protones (IBP), disminuyó la exposición [AUC] y la concentración máxima (Cmáx) de erlotinib un 46% y 61%, respectivamente. No hubo cambio alguno del Tmáx o de la vida media. La administración concomitante de Tarceva con 300 mg de ranitidina, un antagonista de los receptores H2, disminuye la exposición de erlotinib [AUC] y las concentraciones máximas [Cmax] un 33% y 54% respectivamente. No es probable que un aumento de la dosis de Tarceva cuando se coadministre con tales agentes compense esta pérdida de exposición. Sin embargo, cuando Tarceva se administró de forma escalonada, 2 horas antes ó 10 horas después de la administración de 150 mg de ranitidina dos veces al día, la exposición de erlotinib [AUC] y las concentraciones máximas [Cmax] disminuyeron sólo un 15% y 17% respectivamente. No se ha investigado el efecto de antiácidos sobre la absorción de erlotinib pero la absorción puede verse afectada produciendo una disminución de los niveles plasmáticos. En resumen deberá evitarse la combinación de erlotinib con inhibidores de la bomba de protones. Si se considera necesario el uso de antiácidos durante el tratamiento con Tarceva, deberían tomarse al menos 4 horas antes ó 2 horas después de la dosis diaria de Tarceva. Si se considera necesario el uso de ranitidina, ésta debe administrarse de forma escalonada, es decir, se debe tomar Tarceva al menos 2 horas antes ó 10 horas después de la dosis de ranitidina.
Erlotinib y Gemcitabina
En un estudio Fase Ib, no se dieron efectos significativos de gemcitabina sobre la farmacocinética de erlotinib ni tampoco efectos significativos de erlonitib en la farmacocinética de gemcitabina.
Erlotinib y Carboplatino/Paclitaxel
Erlotinib incrementa las concentraciones de platino. En un ensayo clínico el uso concomitante de erlotinib con carboplatino y paclitaxel dio lugar a un incremento en el AUC0-48 total de platino del 10,6%. Aunque es estadísticamente significativa, la magnitud de esta diferencia no se considera que sea clínicamente relevante. En la práctica clínica puede haber otros factores que produzcan un aumento en la exposición al carboplatino como el trastorno renal. No hubo efectos significativos de carboplatino o placlitaxel en la farmacocinética de erlotinib.
Erlotinib y Capecitabina
Capecitabina puede incrementar la concentración de erlotinib. Al administrar erlotinib en combinación con capecitabina, se produjo un aumento estadísticamente significativo en la AUC de erlotinib y un aumento incierto en la Cmax en comparación con los valores observados en otro estudio en el cual se administro erlotinib como único agente. No hubo efectos significativos de erlotinib en la farmacocinética de capecitabina.
Erlotinib e inhibidores del proteasoma
Por su mecanismo de acción, los inhibidores del proteasoma, incluyendo el bortezomib pueden influir en el efecto de los inhibidores del EGFR, incluyendo el erlotinib. Esta influencia se apoya en datos clínicos limitados y en estudios preclínicos que muestran la degradación del EGFR mediante el proteasoma.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de erlotinib en mujeres embarazadas. Los estudios en animales no han mostrado evidencia de teratogenicidad o parto anormal. Sin embargo, no se puede excluir un efecto adverso en el embarazo, ya que los estudios llevados a cabo en ratas y conejos han mostrado un incremento de la letalidad embrio/fetal (ver sección 5.3). El riesgo potencial en humanos se desconoce.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil que eviten quedarse embarazadas mientras estén en tratamiento con Tarceva. Deberán emplearse métodos anticonceptivos adecuados durante el tratamiento y durante al menos las 2 semanas siguientes a su terminación. Sólo se continuará el tratamiento en mujeres embarazadas si el beneficio potencial para la madre supera al riesgo para el feto.
Lactancia
Se desconoce si erlotinib se excreta en la leche humana. Se debe desaconsejar a las madres la lactancia materna mientras sean tratadas con Tarceva por el daño potencial que se pueda causar al niño.
Fertilidad
Los estudios en animales no han mostrado evidencia de alteración de la fertilidad. Sin embargo, no se puede excluir un efecto adverso en la fertilidad, ya que los estudios con animales han mostrado efectos sobre los parámetros reproductivos (ver sección 5.3). No se conoce el riesgo potencial en humanos
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas. Sin embargo, no hay asociación entre erlotinib y la alteración de la habilidad mental.
Cáncer de pulmón no microcítico (Tarceva administrado en monoterapia):
En el ensayo aleatorizado doble-ciego (BR.21; Tarceva administrado como segunda línea de tratamiento), las reacciones adversas al medicamento observadas más frecuentemente fueron rash (75%) y diarrea (54%). La mayoría fueron de gravedad grado 1/2 y no necesitaron intervención. Se observaron rash y diarrea de grado 3/4 en un 9% y 6%, respectivamente, de los pacientes tratados con Tarceva y, en ambos casos, supuso el abandono del ensayo en el 1% de los pacientes. Fue necesaria la reducción de la dosis debido a rash y diarrea en un 6% y un 1% de los pacientes, respectivamente. En el ensayo BR.21, la mediana de tiempo que tardó en aparecer el rash fue 8 días y la de la diarrea, 12 días.
Generalmente, la aparición de rash se manifiesta en forma de una erupción eritematosa y papulopustular leve o moderada, que puede producirse o empeorar en las zonas expuestas al sol. Sería aconsejable que los pacientes expuestos al sol usen ropa para protegerse y/o protección solar (por ejemplo que contenga minerales).
En el ensayo pivotal BR.21, las reacciones adversas que se observaron con más frecuencia (>3%) en los pacientes tratados con Tarceva que en el grupo placebo, y que ocurren en al menos el 10% de los pacientes del grupo tratado con Tarceva, están resumidos en la Tabla 1 en función de los grados según los criterios comunes de toxicidad del Instituto Nacional del Cáncer de Estados Unidos (NCI-CTC).
Se han utilizado los siguientes términos para clasificar los efectos indeseables por frecuencia: muy frecuente (>1/10); frecuente (>1/100 a < 1/10); poco frecuente (>1/1.000 a < 1/100); raros (>1/10.000 a < 1/1.000); muy raros (< 1/10.000) incluyendo casos aislados.
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
|
Erlotinib N = 485 |
Placebo N = 242 | |||||
|
Grado del NCI-CTC |
Cualquier grado |
3 |
4 |
Cualquier grado |
3 |
4 |
|
Término MedDRA |
% |
% |
% |
% |
% |
% |
|
Total de pacientes con cualquier RA |
99 |
40 |
22 |
96 |
36 |
22 |
|
Infecciones e infestaciones | ||||||
|
Infección* |
24 |
4 |
0 |
15 |
2 |
0 |
|
Trastornos del metabolismo y de la nutrición | ||||||
|
Anorexia |
52 |
8 |
1 |
38 |
5 |
< 1 |
|
Trastornos oculares | ||||||
|
Queratoconjuntivitis seca |
12 |
0 |
0 |
3 |
0 |
0 |
|
Conjuntivitis |
12 |
<1 |
0 |
2 |
<1 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos | ||||||
|
Disnea |
41 |
17 |
11 |
35 |
15 |
11 |
|
Tos |
33 |
4 |
0 |
29 |
2 |
0 |
|
Trastornos gastrointestinales | ||||||
|
Diarrea** |
54 |
6 |
< 1 |
18 |
< 1 |
0 |
|
Náuseas |
33 |
3 |
0 |
24 |
2 |
0 |
|
Vómitos |
23 |
2 |
< 1 |
19 |
2 |
0 |
|
Estomatitis |
17 |
< 1 |
0 |
3 |
0 |
0 |
|
Dolor abdominal |
11 |
2 |
< 1 |
7 |
1 |
< 1 |
|
Trastornos de la piel y del tejido subcutáneo | ||||||
|
Rash*** |
75 |
8 |
< 1 |
17 |
0 |
0 |
|
Prurito |
13 |
< 1 |
0 |
5 |
0 |
0 |
|
Sequedad de la piel |
12 |
0 |
0 |
4 |
0 |
0 |
|
Trastornos generales y alteraciones en el lugar de administración | ||||||
|
Fatiga |
52 |
14 |
4 |
45 |
16 |
4 |
* Infecciones graves con o sin neutropenia, incluyeron neumonía sepsis y celulitis. ** Puede producir deshidratación, hipopotasemia y fallo renal.
*** Rash incluida dermatitis acneiforme.
En otros dos ensayos, doble-ciego, aleatorizados controlados con placebo, Fase III BO18192 (SATURN) y BO25460 (IUNO), Tarceva se administró como tratamiento de mantenimiento tras quimioterapia de primera línea. Estos ensayos se llevaron a cabo en 1.532 pacientes con CPNM avanzado, recurrente o metastásico, tras quimioterapia estándar en primera línea basada en compuestos de platino y no se identificaron nuevas señales de seguridad.
Las reacciones adversas observadas más frecuentemente en pacientes tratados con Tarceva, en los ensayos BO18192 y BO25460 fueron rash y diarrea (ver tabla 2). No se observaron rash o diarrea grado 4 en ninguno de los estudios. El rash y la diarrea supusieron el abandono del tratamiento con Tarceva en el 1% y en <1% de los pacientes respectivamente, en el estudio BO018192, mientras que ningún paciente abandonó el tratamiento por rash o diarrea en el estudio BO25460. Se requirieron modificaciones de dosis (interrupciones o reducciones) por el rash y la diarrea en el 8,3% y 3% de los
pacientes, respectivamente, en el estudio BO18192, y 5,6% y 2,8% de los pacientes, respectivamente, en el estudio BO25460.
Tabla 2 : Reacciones adversas más frecuentes en los Estudios BO18192 (SATURN) y BO25460
(IUNO)
|
BO18192 (SAT1 |
JRN)* |
BO25460 (IUNO)* | ||
|
Tarceva n=433 |
Placebo n=445 |
Tarceva n=322 |
Placebo n=319 | |
|
% |
% |
% |
% | |
|
Rash, todos los grados |
49,2 |
5,8 |
39,4 |
10,0 |
|
Grado 3 |
6,0 |
0 |
5,0 |
1,6 |
|
Diarrea, todos los grados |
20,3 |
4,5 |
24,2 |
4,4 |
|
Grado 3 |
1,8 |
0 |
2,5 |
0,3 |
*Análisis de seguridad de la población
En un estudio fase III, ML20650 abierto, aleatorizado, llevado a cabo en 154 pacientes, la seguridad de Tarceva en primera línea de tratamiento en CPNM con mutaciones activadoras de EGFR fue evaluada en 75 pacientes; no se han observado nuevas señales de seguridad en estos pacientes.
En el estudio ML20650, las RAs más frecuentes observadas en pacientes tratados con Tarceva fueron rash y diarrea (80% y 57% respectivamente, de cualquier grado), la mayoría fueron Grado 1/2 y se manejaron sin necesidad de intervención. Se observaron rash y diarrea de Grado 3 en un 9% y 4% de los pacientes, respectivamente. No se observó rash y diarrea Grado 4. Tanto el rash como la diarrea supusieron el abandono del tratamiento con Tarceva en el 1% de los pacientes. Se necesitaron modificaciones de la dosis (interrupciones o reducciones) por el rash y la diarrea en el 11% y 7% de los pacientes, respectivamente.
Cáncer de páncreas (Tarceva administrado en combinación con gemcitabina):
Las reacciones adversas más frecuentes que se observaron en el ensayo pivotal PA.3 en pacientes con cáncer de páncreas tratados con Tarceva 100 mg y gemcitabina, fueron fatiga, rash y diarrea. En el brazo tratado con Tarceva y gemcitabina, se observó rash Grado 3-4 y diarrea en un 5% de los pacientes, respectivamente. La mediana del tiempo de aparición de rash y diarrea fue de 10 y 15 días, respectivamente. Tanto el rash como la diarrea provocaron la reducción de las dosis en un 2% de los pacientes, y ocasionaron la interrupción del ensayo de hasta el 1% de los pacientes tratados con Tarceva y gemcitabina.
En el ensayo pivotal PA.3, las reacciones adversas que se presentaron con mayor frecuencia (>3%) en el grupo de pacientes tratados con Tarceva 100 mg y gemcitabina versus el grupo tratado con placebo y gemcitabina y, en al menos el 10% de los pacientes tratados con Tarceva 100 mg y gemcitabina, se resumen en la Tabla 3 siguiendo los criterios de clasificación por grados de toxicidad del Instituto Nacional del Cáncer (NCI-CTC).
Se han utilizado los siguientes términos para clasificar los efectos indeseables por frecuencia: muy frecuente (>1/10); frecuente (>1/100 a < 1/10); poco frecuente (>1/1.000 a < 1/100); raros (>1/10.000 a < 1/1.000); muy raros (< 1/10.000) incluyendo casos aislados.
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
Tabla 3 : Reacciones adversas (RA) muy frecuentes observadas en el ensayo PA.3 (grupo cohorte
tratado con 100 mg)
|
Erlotinib |
Placebo | |||||
|
N = 259 |
N = 256 | |||||
|
Cualquier |
Cualquier | |||||
|
Grado según NCI-CTC |
grado |
3 |
4 |
grado |
3 |
4 |
|
Término MedDRA |
% |
% |
% |
% |
% |
% |
|
Total de pacientes con cualquier RA |
99 |
48 |
22 |
97 |
48 |
16 |
|
Infecciones e infestaciones | ||||||
|
Infección* |
31 |
3 |
< 1 |
24 |
6 |
< 1 |
|
Trastornos del metabolismo y de la nutrición |
39 |
2 |
0 |
29 |
< 1 |
0 |
|
Pérdida de peso | ||||||
|
Trastornos psiquiátricos | ||||||
|
Depresión |
19 |
2 |
0 |
14 |
< 1 |
0 |
|
Trastornos del sistema nervioso | ||||||
|
Neuropatía |
13 |
1 |
< 1 |
10 |
< 1 |
0 |
|
Cefalea |
15 |
<1 |
0 |
10 |
0 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos | ||||||
|
Tos |
16 |
0 |
0 |
11 |
0 |
0 |
|
Trastornos gastrointestinales | ||||||
|
Diarrea** |
48 |
5 |
< 1 |
36 |
2 |
0 |
|
Estomatitis |
22 |
< 1 |
0 |
12 |
0 |
0 |
|
Dispepsia |
17 |
< 1 |
0 |
13 |
< 1 |
0 |
|
Flatulencia |
13 |
0 |
0 |
9 |
< 1 |
0 |
|
Trastornos de la piel y tejidos subcutáneos | ||||||
|
Rash*** |
69 |
5 |
0 |
30 |
1 |
0 |
|
Alopecia |
14 |
0 |
0 |
11 |
0 |
0 |
|
Trastornos generales y alteraciones en el lugar de administración | ||||||
|
Fatiga |
73 |
14 |
2 |
70 |
13 |
2 |
|
Fiebre |
36 |
3 |
0 |
30 |
4 |
0 |
|
Escalofríos |
12 |
0 |
0 |
9 |
0 |
0 |
* Las infecciones graves, con o sin neutropenia, incluyeron neumonía, sepsis y celulitis. ** Puede producir deshidratación, hipopotasemia y fallo renal.
*** Rash incluida dermatitis acneiforme.
Otras observaciones:
La evaluación de seguridad de Tarceva está basada en los datos obtenidos en más de 1.500 pacientes tratados con, al menos, una dosis de 150 mg de Tarceva en monoterapia y en más de 300 pacientes que recibieron Tarceva 100 o 150 mg en combinación con gemcitabina.
Se han observado las siguientes reacciones adversas en pacientes tratados con Tarceva en monoterapia y en pacientes tratados con Tarceva en combinación con quimioterapia.
Las reacciones adversas observadas muy frecuentemente, en los estudios BR21 y PA 3, se describen en las Tablas 1 y 3 mientras que otras reacciones adversas, incluyendo las observadas en otros estudios, se resumen en la Tabla 4
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
|
Sistema Corporal |
Muy F recuente (>1/10) |
Frecuente (>1/100 a < 1/10) |
Poco frecuente (>1/1.000 a < 1/100) |
Raros (>1/10.000 a < 1/1.000) |
Muy raros (< 1/10.000) |
|
Transtornos oculares |
-Queratitis Conjuntivitis1 |
-Cambios en las pestañas2 |
-Perforación de la córnea -Ulceración de la córnea -Uveitis | ||
|
Transtornos respiratorios, torácicos y mediastínicos |
-Epistaxis -Enfermedad pulmonar intersticial grave (EPI)3 | ||||
|
Transtornos gastro intestinales |
-Diarrea7 |
-Hemorragias gastro-intestinales4, 7 |
-Perforación gastro-intestinal7 | ||
|
Transtornos hepatobiliares |
Anormalidades en el test de función hepática5 |
-Fallo hepático6 | |||
|
Transtornos de la piel y el tejido subcutáneo |
-Alopecia -Piel seca1 -Paroniquia Foliculitis -Acné/ Dermatitis acneiforme- Grietas en la piel |
-Hirsutismo -Cambios en las cejas -Uñas quebradizas y sueltas -Reacciones cutáneas leves como hiperpigmentación |
-Síndrome eritro- disestesia palmo- plantar |
-Síndrome Stevens- Johnson/necrólisis epidérmica tóxica7 | |
|
Trastornos renales y urinarios |
-Insuficiencia renal1 |
-Nefritisl -Proteinurial |
1 En el ensayo clínico PA.3
2 Incluyendo crecimiento hacia el interior de las pestañas, crecimiento, y engrasamiento excesivo de las pestañas.
3 Incluye fallecimientos, en pacientes que recibieron T arceva para el tratamiento de CPNM u otros tumores sólidos avanzados (ver sección 4.4). Se ha observado una incidencia alta en pacientes de origen Japonés (ver sección 4.4).
4 En ensayos clínicos algunos casos se asociaros a la administración concomitante de warfarina y algunos a la administración concomitante de AINEs (ver sección 4.5)
5 Incluyendo niveles incrementados de alanina aminotransferasa [ALT], aspartamo aminotransferasa [AST] y bilirrubina. Estos fueron muy frecuentes en el ensayo clínico P A 3 y frecuentes en el ensayo clínico BR. 21. Los casos fueron principalmente de gravedad media o moderadaza, de naturaleza transitoria o asociadas a metástasis hepáticas.
6 Incluye fallecimientos. Entre los factores de confusión se ha incluido la existencia previa de enfermedad hepática o la medicación concomitante hepatotóxica (ver sección 4.4)
7 Incluye fallecimientos (ver sección 4.4)
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello
permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los
profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Síntomas
Se han administrado dosis orales únicas de Tarceva de hasta 1.000 mg de erlotinib en sujetos sanos y hasta 1.600 mg en pacientes con cáncer y éstas se toleraron bien. Las dosis repetidas de 200 mg dos veces al día administradas a sujetos sanos fueron mal toleradas tras sólo unos pocos días de tratamiento. En base a los datos derivados de estos ensayos, por encima de la dosis recomendada podrían darse reacciones adversas graves tales como diarrea, rash y un posible aumento de la actividad de las aminotransferasas hepáticas.
Tratamiento
En caso de que exista sospecha de sobredosis, se debe interrumpir el tratamiento con Tarceva e iniciar un tratamiento sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agente antineoplásico inhibidor de la proteína quinasa, código ATC: L01XE03
Mecanismo de acción
Erlotinib es un inhibidor del receptor del factor de crecimiento epidérmico / de la tirosina quinasa del receptor del factor de crecimiento epidérmico humano tipo 1 (EGFR, también conocido como HER1). Erlotinib inhibe potentemente la fosforilación intracelular del EGFR. El EGFR se expresa en la superficie de células normales y cancerosas. En modelos no clínicos, la inhibición de la fosfotirosina del EGFR da lugar a que la célula quede en fase de equilibrio y/o conduce a la muerte celular.
Las mutaciones del EGFR pueden conducir a la activación constitutiva de rutas de señalización antiapoptóticas y de proliferación. La potente efectividad de erlotinib para bloquear la señal mediada por el EGFR en estos tumores con mutación positiva del EGFR, se atribuye a la estrecha unión de erlotinib al lugar de unión del ATP en el dominio quinasa mutado del EGFR. Debido al bloqueo de la cascada de señales por debajo del receptor, se detiene la proliferación celular y se induce la muerte celular a través de la ruta intrínseca de apoptosis. Se ha observado regresión tumoral en modelos de ratones con marcada expresión de mutaciones activadoras del EGFR.
Eficacia clínica
- Tratamiento en primera línea para pacientes con Cáncer de Pulmón No Microcítico (CPNM) con mutaciones activadoras del EGFR (Tarceva administrado en monoterapia):
La eficacia de Tarceva en el tratamiento en primera línea para los pacientes que presentan mutaciones activadoras del EGFR en CPNM, se demostró en un ensayo fase III, aleatorizado, abierto (ML20650, EURTAC). Este estudio se llevó acabo en pacientes caucásicos con CPNM metastásico o localmente avanzado (estadío IIIB y IV) que no habían recibido quimioterapia previa o cualquier terapia antitumoral sistémica para su enfermedad avanzada y que presentaban mutaciones en el dominio de la tirosina kinasa del EGFR (eliminación del exón 19 o mutación del exón 21). Los pacientes fueron aleatorizados 1:1 para ser tratados con Tarceva 150 mg o quimioterapia doble basada en platinos.
La SLP, variable principal del investigador. Los resultados de eficacia se resumen en la Tabla 5.
Figura 1: Curva Kaplan-Meier para los datos de SLP evaluada por el investigador en el ensayo ML20650 (EUTARC) (corte abril del 2012) ”
Uf
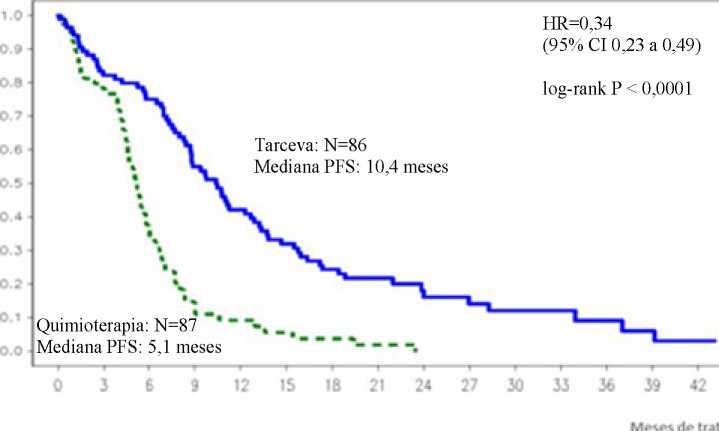
Ot n?k
Oujmiotf rapía &7 52 XI G 5 5 2 I 0 0 0 0 0 0 0
LRiOTiHiB Sí M 62 *1 5J 25 ¡9 Ít 6 7 $ * i 2 I
n jlJUlifrtf&f Jihdcníii f iií •••••••' QUI MI UT i RAP1A IKIÜIIN
|
T arceva |
Quimioterapia |
Hazard Ratio (95% CI) |
Valor- p | ||
|
Análisis intermedio pre planificado (n=153) Fecha de corte: Agosto 2010 |
n=77 |
n=76 | |||
|
Variable principal: Supervivencia Libre de Progresión ( mediana de SLP en meses)* Evaluación del investigador** Revisión independiente ** |
9.4 10.4 |
5,2 5,4 |
0,42 [0,27-0,64] 0,47 [0,27-0,78] |
p<0,0001 p=0,003 | |
|
Tasa respuesta objetiva (CR/PR) |
54,5% |
10,5% |
p<0,0001 | ||
|
Supervivencia global (SG) (meses) (35% de eventos) |
22,9 |
18,8 |
0,80 [0,47-1,37] |
p=0,4170 | |
|
Análisis exploratorio (n=173) Fecha de corte: Enero 2011 |
n=86 |
n=87 | |||
|
SLP (mediana en meses), Evaluación del investigador |
9,7 |
5,2 |
0,37 [0,27-0.54] |
p<0,0001 | |
|
Tasa respuesta objetiva (CR/PR) |
58,1% |
14,9% |
p<0,0001 | ||
|
SG (meses) (40% de eventos) |
19,3 |
19,5 |
1,04 [0,65-1,68] |
p=0,8702 | |
|
Actualización del análisis (n=173) Fecha de corte: Abril 2012 |
n=86 |
n=87 | |||
|
SLP (mediana en meses) |
10,4 |
5,1 |
0,34 [0,23-0,49] |
p<0,0001 | |
|
SG*** (meses) (62% de eventos) |
22,9 |
20,8 |
0,93 [0,64-1,36] |
p=0,7149 |
CR = respuesta completa, PR = respuesta parcial
* Se observó una reducción del 58% en el riesgo de progresión de la enfermedad o muerte
** La tasa global de concordancia entre el investigador y la evaluación del Comité Investigador Independiente fue del
70%
*** Se observó un elevado número de cruces en el tratamiento. El 82% de los pacientes en el brazo de quimioterapia recibieron en segunda línea un inhibidor de la tirosina quinasa del EGFR (todos menos 2 recibieron Tarceva).
- Tratamiento de mantenimiento de CPNM tras quimioterapia de primera línea (Tarceva administrado en monoterapia):
Se ha investigado la eficacia y la seguridad de Tarceva como mantenimiento tras una primera línea de quimioterapia, para pacientes con CPNM, en un ensayo (BO18192, SATURN) aleatorizado, doble-ciego, controlado con placebo. Este ensayo fue realizado en 889 pacientes con CPNM localmente avanzado o metastásico que no habían progresado tras 4 ciclos de un doblete de quimioterapia, basada en compuestos de platino. Los pacientes fueron aleatorizados 1:1 para ser tratados con Tarceva 150 mg o placebo por vía oral una vez al día, hasta progresión de la enfermedad. El objetivo primario del ensayo incluía Supervivencia Libre de Progresión (PFS) en todos los pacientes. Las características demográficas basales y de la enfermedad, estuvieron bien equilibradas en los dos brazos de tratamiento. No se incluyeron en el estudio pacientes con ECOG PS>1, con comorbilidad hepática o renal significativa.
En este estudio, la población total mostró un beneficio para la variable principal SLP (HR=0,71 p< 0,0001) y la variable secundaria SG (HR=0,81 p=0,0088). Sin embargo, el mayor beneficio se observó en un análisis exploratorio predefinido en pacientes con mutaciones activadoras de EGFR (n=49) demostrando un beneficio considerable de SLP (HR=0,10, 95% CI 0,04 a 0,25, p<0,0001) y un HR de la supervivencia global de 0,83 (95% CI 0,34 a 2,02). El 67% de los pacientes del subgrupo placebo con mutación EGFR positiva recibieron tratamiento de segunda o sucesivas líneas con EGFR-TKIs.
El estudio BO25460 (IUNO) se realizó en 643 pacientes con CPNM avanzado sin mutaciones activadoras de EGFR (deleción del exón 19 o mutación L858R del exón 21) y que no experimentaron
progres ión de la enfermedad después de cuatro ciclo de quimioterapia basada en compuestos de platino.
El objetivo del estudio era comparar la supervivencia global del tratamiento de mantenimiento de primera línea con erlotinib versus erlotinib administrado en el momento de progresión de la enfermedad. Este estudio no alcanzó con su variable principal. La SG de Tarceva en el tratamiento de mantenimiento de primera línea no fue superior al tratamiento con Tarceva en segunda línea en pacientes cuyo tumor no albergó una mutación activadora de EGFR (HR=1,02, 95% CI 0,85 a 1,22, p=0,82). La variable secundaria de SLP no mostró ninguna diferencia entre Tarceva y placebo en el tratamiento de mantenimiento (HR=0,94, 95% CI 0,80 a 1,11, p=0,48).
Según los datos del estudio BO25460 (IUNO), el uso de Tarceva no está recomendado en el tratamiento de mantenimiento de primera línea en pacientes sin mutaciones activadoras de EGFR.
-Tratamiento de CPNM tras fallo de al menos un régimen quimioterápico anterior (Tarceva administrado en monoterapia):
La eficacia y seguridad de Tarceva en segunda/tercera línea han sido demostradas en un ensayo aleatorizado, doble ciego, controlado con placebo (BR.21) realizado en 731 pacientes con CPNM localmente avanzado o metastático tras el fallo de, al menos, un tratamiento quimioterápico. Los pacientes fueron aleatorizados 2:1 para ser tratados con Tarceva 150 mg o placebo por vía oral una vez al día. Los objetivos del ensayo incluyeron supervivencia global, supervivencia libre de progresión (PFS), índice de respuesta, duración de la respuesta, tiempo hasta el deterioro de los síntomas relacionados con el cáncer de pulmón (tos, disnea y dolor) y seguridad. El objetivo principal fue la supervivencia.
Las características demográficas estuvieron bien equilibradas en los dos grupos de tratamiento. Alrededor de dos tercios de los pacientes fueron hombres y aproximadamente un tercio presentaban un ECOG basal de 2 y un 9% tenían un ECOG basal de 3. El 93% y el 92% de todos los pacientes del grupo Tarceva y del grupo placebo respectivamente, habían sido tratados con una terapia anterior que contenía platino y un 36% y un 37% de todos los pacientes, respectivamente, habían sido tratados anteriormente con taxanos.
El índice de riesgo ajustado por muerte en el grupo tratado con Tarceva en relación con el grupo placebo fue 0,73 (95% CI, de 0,6 a 0,87) (p = 0,001). El porcentaje de pacientes vivos a los 12 meses fue del 31,2% y 21,5% para los grupos tratados con Tarceva y con placebo, respectivamente. La mediana de supervivencia global fue de 6,7 meses (95% CI, de 5,5 a 7,8 meses) en el grupo tratado con Tarceva en comparación con los 4,7 meses observados en el grupo placebo (95% CI, de 4,1 a 6,3 meses).
Se ha investigado el efecto sobre la supervivencia global en distintos subgrupos de pacientes. El efecto de Tarceva sobre la supervivencia global fue similar en pacientes con una ECOG basal de 2 - 3 (HR = 0,77, 95% CI 0,6 - 1,0) o de 0 - 1 (HR = 0,73, 95% CI 0,6 - 0,9), hombres (HR = 0,76, 95% CI 0,6 - 0,9) o mujeres (HR = 0,80, 95% CI 0,6 - 1,1), pacientes menores de 65 años (HR = 0,75, 95% CI 0,6 - 0,9) o mayores (HR = 0,79, 95% CI 0,6 - 1,0), pacientes con un tratamiento anterior (HR = 0,76, 95% CI 0,6 - 1,0) o con más de uno (HR = 0,75, 95% CI 0,6 - 1,0), caucasianos (HR = 0,79, 95% CI 0,6 - 1,0) o asiáticos (HR = 0,61, 95% CI 0,4 - 1,0), pacientes con adenocarcinoma (HR = 0,71, 95% CI 0,6 - 0,9) o carcinoma escamoso (HR = 0,67, 95% CI 0,5 - 0,9), pero no con otras histologías (HR = 1,04, 95% CI 0,7 - 1,5), pacientes con enfermedad en estadio IV diagnosticada (HR = 0,92,
95% CI 0,7 - 1,2) o en estadio < IV (HR = 0,65, 95% CI 0,5 - 0,8). Los pacientes que nunca habían fumado obtuvieron un beneficio mucho mayor con erlotinib (supervivencia HR = 0,42, 95% CI 0,28 -0,64) en comparación con los fumadores o los ex - fumadores (HR = 0,87, 95% CI 0,71 - 1,05).
La expresión del EGFR se determinó en el 45% de los pacientes, estableciéndose un índice de riesgo de 0,68 (95% CI 0,49 - 0,94) en los pacientes con tumores EGFR - positivos y de 0,93 (95% CI 0,63 -1,36) en aquellos con tumores EGFR - negativos (definidos mediante ICH empleando el kit EGFR pharmDx y definiendo EGFR - negativo como tinción de menos del 10% de las células tumorales). En el 55% restante, en el que se desconocía la expresión del EGFR, el índice de riesgo fue de 0,77 (95% CI 0,61 -0,98).
La mediana de PFS fue de 9,7 semanas en el grupo tratado con Tarceva (95% CI, 8,4 a 12,4 semanas) siendo de 8,0 semanas en el grupo placebo (95% CI, 7,9 a 8,1 semanas).
El índice de respuesta objetiva medido por RECIST fue del 8,9% en el grupo con Tarceva (95% CI,
6,4 a 12,0). Los primeros 330 pacientes que fueron evaluados centralmente (índice de respuesta: 6,2%) y 401 pacientes fueron evaluados por el investigador (índice de respuesta: 11,2%).
La mediana de duración de la respuesta fue de 34,3 semanas, con un rango entre 9,7 y 57,6+ semanas. La proporción de pacientes que presentaron respuesta completa, respuesta parcial o enfermedad estable en el grupo tratado con Tarceva y placebo fue del 44,0% y 27,5% (p = 0,004), respectivamente.
También se observó un beneficio en la supervivencia en pacientes tratados con Tarceva que no alcanzaron una respuesta objetiva tumoral (por RECIST). La evidencia de esta afirmación radica en que el índice de riesgo por muerte fue de 0,82 (95% CI, 0,68 a 0,99) en pacientes cuya mejor respuesta fue enfermedad estable o progresiva.
En el tratamiento con Tarceva se obtuvieron beneficios en los síntomas ya que se prolongó de forma significativa el tiempo hasta el deterioro de los síntomas en forma de tos, disnea y dolor versus placebo.
-Cáncer de páncreas (Tarceva administrado en combinación con gemcitabina en el ensayo PA.3):
La eficacia y seguridad de Tarceva en combinación con gemcitabina como tratamiento de primera línea fueron evaluadas en un ensayo aleatorizado, doble-ciego, controlado con placebo en pacientes con cáncer de páncreas localmente avanzado, no resecable o metastásico. Los pacientes fueron aleatorizados para ser tratados con Tarceva o placebo una vez al día de forma continua y gemcitabina IV (1000 mg/ m2, Ciclo 1 - Días 1, 8, 15, 22, 29, 36 y 43 de un ciclo de 8 semanas; Ciclo 2 y siguientes ciclos - Días 1, 8 y 15 de un ciclo de 4 semanas [ver la Ficha Técnica de gemcitabina para la dosis y posología autorizadas para el cáncer de páncreas]). Tanto Tarceva como el placebo fueron administrados por vía oral una vez al día hasta progresión de la enfermedad o toxicidad inaceptable. El objetivo principal del ensayo fue supervivencia global.
Las características demográficas y de enfermedad de los pacientes fueron similares entre los 2 grupos de tratamiento, Tarceva 100 mg y gemcitabina o placebo y gemcitabina, excepto por una ligera mayor proporción de mujeres en el brazo de erlotinib/gemcitabina en comparación con el brazo tratado con placebo/gemcitabina:
|
Situación a nivel basal |
Tarceva |
Placebo |
|
Mujeres |
51% |
44% |
|
ECOG performance status (PS) = 0 a nivel basal |
31% |
32% |
|
ECOG performance status (PS) = 1 a nivel basal |
51% |
51% |
|
ECOG performance status (PS) = 2 a nivel basal |
17% |
17% |
|
Enfermedad metastásica a nivel basal |
77% |
76% |
La supervivencia se evaluó en la población con intención de ser tratada (“Intend-to-treat population”) en base al seguimiento de los datos de supervivencia. Los resultados se muestran en la tabla siguiente (los datos de los grupos de pacientes con enfermedad metastásica o localmente avanzada se derivan del análisis exploratorio de los subgrupos).
|
Resultado |
Tarceva (meses) |
Placebo (meses) |
A (meses) |
CI del A |
HR |
CI del HR |
Valor de P |
|
Población Global | |||||||
|
Mediana de supervivencia global |
6,4 |
6,0 |
0,41 |
-0,54-1,64 |
0,82 |
0,69-0,98 |
0,028 |
|
Media de supervivencia global |
8,8 |
7,6 |
1,16 |
-0,05-2,34 | |||
|
Población con enfermedad metastásica | |||||||
|
Mediana de supervivencia global |
5,9 |
5,1 |
0,87 |
-0,26-1,56 |
0,80 |
0,66-0,98 |
0,029 |
|
Media de supervivencia global |
8,1 |
6,7 |
1,43 |
0,17-2,66 | |||
|
Población con enfermedad localmente avanzada | |||||||
|
Mediana de supervivencia global |
8,5 |
8,2 |
0,36 |
-2,43-2,96 |
0,93 |
0,65-1,35 |
0,713 |
|
Media de supervivencia global |
10,7 |
10,5 |
0,19 |
-2,43-2,69 | |||
Supervivencia Global-Todos los pacientes
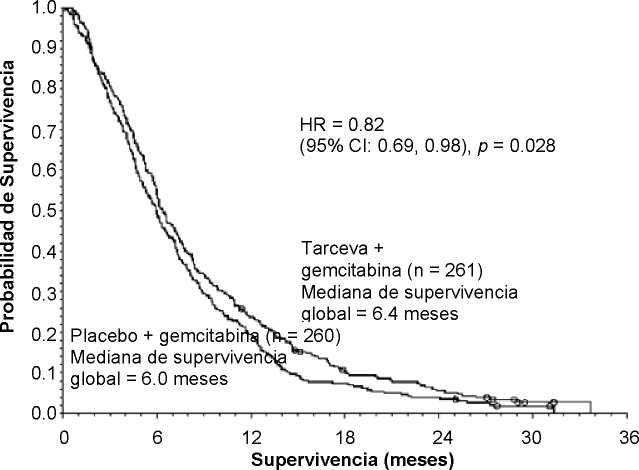
Supervivencia Global - Pacientes con metástasis a distancia
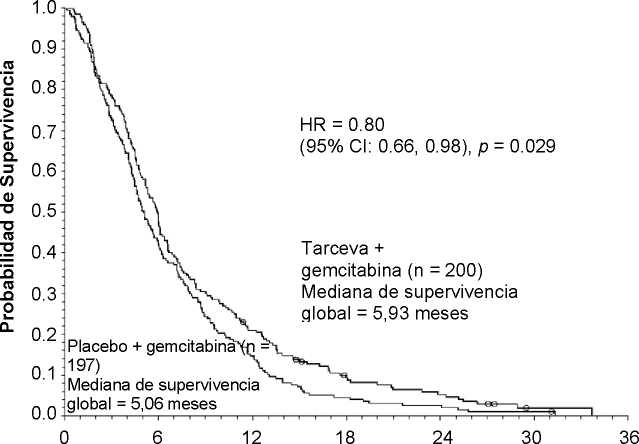
Supervivencia (meses)
En un análisis de los datos del estudio realizado a posteriori se observó que los pacientes con situación clínica favorable a nivel basal (baja intensidad de dolor, buena calidad de vida y buen PS) pueden obtener más beneficio del tratamiento con Tarceva. El beneficio se relaciona principalmente con la existencia de una puntuación baja de intensidad de dolor.
En un análisis de los datos del estudio realizado a posteriori se observó que los pacientes en tratamiento con Tarceva que desarrollaron rash, tuvieron una supervivencia global más larga comparada con los pacientes que no tuvieron rash (mediana de supervivencia global de 7,2 meses versus 5 meses, HR: 0,61). El 90% de los pacientes desarrollaron rash en los primeros 44 días de tratamiento. La mediana del tiempo de aparición de rash fue de 10 días.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Tarceva en los diferentes grupos de la población pediátrica para las indicaciones de Cáncer de Pulmón No Microcítico y Cáncer Pancreático (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción: Tras la administración oral, los niveles plasmáticos máximos de erlotinib se obtienen a las 4 horas, aproximadamente, tras dicha administración. En un ensayo con voluntarios sanos se pudo estimar que la biodisponibilidad absoluta es del 59%. La exposición tras una dosis oral puede verse incrementada por los alimentos.
Distribución: Erlotinib tiene un volumen de distribución aparente medio de 232 l y se distribuye dentro del tejido tumoral en humanos. En un ensayo con 4 pacientes (3 con cáncer de pulmón no microcítico [CPNM] y 1 con cáncer de laringe) que fueron tratados con dosis orales diarias de 150 mg de Tarceva, se determinó los niveles de erlotinib en muestras de tumores obtenidas por extracciones quirúrgicas realizadas el Día 9 del tratamiento, obteniéndose concentraciones medias de erlotinib de 1.185 ng/g de tejido tumoral. Esto correspondía a una media global del 63% (rango 5-161%) de las concentraciones plasmáticas máximas en equilibrio que han sido determinadas. Los metabolitos activos principales estaban presentes en el tumor en concentraciones medias de 160 ng/g de tejido, lo que correspondía a un promedio global del 113% (rango 88-130%) de las concentraciones plasmáticas máximas en equilibrio que han sido determinadas. La unión a las proteínas plasmáticas es aproximadamente de un 95%. Erlotinib se une a la albúmina sérica y a la glicoproteína ácida alfal (AAG).
Biotran sformación: En humanos, erlotinib se metaboliza en el hígado por los citocromos hepáticos, principalmente por el CYP3A4 y en menor medida por el CYP1A2. También contribuye potencialmente al aclaramiento metabólico de erlotinib el metabolismo extrahepático por el CYP3A4 en el intestino, por el CYP1A1 en pulmones y por el CYP1B1 en tejido tumoral.
Se han identificado tres rutas metabólicas principales: 1) O-demetilación de cualquiera de las cadenas laterales o de ambas, seguida de la oxidación de los ácidos carboxílicos; 2) oxidación del grupo acetileno, seguida de la hidrólisis del ácido aril carboxílico y 3) hidroxilación aromática del grupo fenil-acetileno. Los metabolitos principales de erlotinib, OSI-420 y OSI-413, producidos por la O-demetilación de cualquiera de las cadenas laterales, tuvieron una potencia comparable a erlotinib en ensayos no-clínicos in vitro y en modelos tumorales in vivo. Estos metabolitos están presentes en el plasma a niveles < 10% de erlotinib y muestran una farmacocinética similar a la de erlotinib.
Eliminación: Erlotinib se excreta predominantemente por las heces en forma de metabolitos (>90%) y una pequeña cantidad de una dosis oral se elimina por vía renal (aproximadamente el 9%). Menos del 2% de la dosis administrada oralmente se excreta como sustancia sin alterar. En un análisis farmacocinético poblacional realizado en 591 pacientes que recibieron Tarceva como medicamento único, se determinó un aclaramiento aparente medio de 4,47 l/hora con una mediana de semivida de
36,2 horas. Por lo tanto, el tiempo en alcanzar la concentración plasmática en equilibrio se espera que sea de 7-8 días aproximadamente.
Farmacocinética en poblaciones especiales:
En base a los análisis farmacocinéticos poblacionales, no se ha observado relación clínicamente significativa entre el aclaramiento aparente predicho y la edad, peso, sexo y raza del paciente. Los factores de los pacientes que se correlacionaban con la farmacocinética de erlotinib fueron la bilirrubina total sérica, AAG y fumar en la actualidad. Las concentraciones séricas elevadas de bilirrubina total y las concentraciones de AAG se asociaron con una reducción del aclaramiento de erlotinib. No está clara la relevancia clínica de estas diferencias.
Sin embargo, los fumadores tuvieron un índice incrementado de aclaramiento de erlotinib. Esto fue confirmado en un estudio farmacocinético realizado en sujetos sanos que fumaban en el momento de realizar el estudio y en no fumadores, recibiendo ambos grupos una dosis oral única de 150 mg de erlotinib. La media geométrica de la Cmax fue 1056 ng/mL en no fumadores y 689 ng/mL en fumadores con una proporción media de fumadores versus no fumadores del 65,2% (95% CI: 44,3 a 95,9, p = 0,031). La media geométrica del AUC0_inf fue 18726 ng^h/mL en los no fumadores y 6718 ng^h/mL en los fumadores con una proporción media del 35,9% (95% CI: 23,7 a 54,3, p < 0,0001). La media geométrica de la C24h fue 288 ng/mL en no fumadores y 34,8 ng/mL en fumadores con una proporción media del 12,1% (95% CI: 4,82 a 30,2, p = 0,0001).
En un estudio pivotal fase III en fumadores activos con CPNM, se alcanzó una concentración plasmática en estado estacionario de 0,65 pg/mL (n=16), que fue aproximadamente 2 veces menor en aquellos que habían dejado de fumar o en pacientes que nunca habían fumado (1,28 pg/mL n=108). Este efecto se produjo junto a un aumento del 24% en el aclaramiento plasmático aparente de erlotinib. En un estudio fase I de escalada de dosis en pacientes que fueron fumadores activos con CPNM, el análisis de la farmacocinética indicó un aumento proporcional de la exposición a erlotinib en el estado de equilibrio, cuando la dosis de Tarceva se aumento de 150 mg a la dosis máxima tolerada de 300 mg. En este estudio, la concentración plasmática en estado estacionario para una dosis de 300 mg en fumadores activos fue de 1,22 pg/mL (n=17).
En base a los resultados de estudios farmacocinéticos, se debe aconsejar a los fumadores que dejen de fumar mientras estén en tratamiento con Tarceva, ya que, de lo contrario, las concentraciones plasmáticas podrían verse reducidas.
En base a los análisis farmacocinéticos poblacionales, la presencia de un opioide incrementó la exposición alrededor de un 11%.
Se llevó a cabo un segundo análisis farmacocinético poblacional incorporando los datos de erlotinib obtenidos de 204 pacientes con cáncer pancreático que fueron tratados con erlotinib y gemcitabina. Este análisis demostró que las covariantes que afectan al aclaramiento de erlotinib en los pacientes del estudio pancreático eran muy similares a los observados en el análisis farmacocinético previo en monoterapia. No se han identificado nuevos efectos covariantes. La co-administración de gemcitabina no tuvo efecto en el aclaramiento plasmático de erlotinib.
Población pediátrica: no se han realizado estudios específicos en pacientes pediátricos.
Población anciana: no se han realizado estudios específicos en pacientes ancianos.
Insuficiencia hepática: Erlotinib se aclara principalmente en el hígado. En pacientes con tumores sólidos y con insuficiencia hepática moderada (valor Child-Pugh 7- 9) la media geométrica del AUC0-t y la Cmax de erlotinib fue 27000 ng^h/mL y 805 ng/mL, respectivamente, en comparación con 29300 ng^h/mL y 1090 ng/mL en pacientes con buena función hepática incluyendo pacientes con cáncer de hígado primario o metástasis hepáticas. Aunque la Cmax fue más baja de forma estadísticamente significativa en pacientes con insuficiencia hepática moderada, se consideró que esta diferencia no era clínicamente relevante. No hay datos disponibles respecto a la influencia de la disfunción hepática grave en la farmacocinética de erlotinib. En análisis farmacocinéticos poblacionales, el aumento de las concentraciones séricas de la bilirrubina total se asoció con un índice de aclaramiento de erlotinib más lento.
Insuficiencia renal: Erlotinib y sus metabolitos no se excretan significativamente vía renal ya que menos del 9% de una dosis única es excretada en la orina. En análisis farmacocinéticos poblacionales, no se observó una relación significativa entre el aclaramiento de erlotinib y el aclaramiento de creatinina, pero no hay datos disponibles en pacientes con aclaramiento de creatinina < 15 ml/min.
5.3 Datos preclínicos sobre seguridad
Los efectos debidos a dosis crónicas observados en al menos una especie animal o estudio incluyeron efectos en la córnea (atrofia, ulceración), piel (degeneración folicular e inflamación, enrojecimiento y alopecia), ovarios (atrofia), hígado (necrosis hepática), riñón (necrosis papilar renal y dilatación tubular), y tracto gastrointestinal (vaciado gástrico retardado y diarrea). Los parámetros de las células rojas sanguíneas disminuyeron y las células blancas sanguíneas, principalmente neutrófilos, aumentaron. Hubo aumentos en ALT, AST y bilirrubina relacionados con el tratamiento. Estos hallazgos se observaron para exposiciones muy por debajo de exposiciones clínicamente relevantes.
En base al mecanismo de acción, erlotinib puede ser potencialmente teratógeno. Los datos obtenidos en pruebas de toxicidad reproductiva realizadas a ratas y conejos a dosis cercanas a la dosis máxima tolerada y/o maternalmente tóxicas mostraron toxicidad reproductiva (embriotoxicidad en ratas, reabsorción del embrión y toxicidad fetal en conejos) y de desarrollo (disminución en el crecimiento de las crías y en la supervivencia en ratas) pero no resultó teratogénico y no dañó la fertilidad. Estos hallazgos fueron observados a exposiciones clínicamente relevantes.
El resultado de estudios de genotoxicidad convencionales con erlotinib fue negativo. Los resultados de carcinogenicidad realizados con erlotinib durante dos años en ratas y ratones expuestos hasta dosis superiores a la exposición terapéutica en humanos (hasta 2 veces y 10 veces más altas, respectivamente, basado en la Cmax y/o AUC) fueron negativos.
En ratas se ha observado una reacción fototóxica media en la piel tras irradiación UV.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Núcleo del comprimido'.
Lactosa monohidrato Celulosa microcristalina (E460)
Almidón glicolato sódico Tipo A Laurilsulfato sódico Estearato magnésico (E470 b)
Cubierta del comprimido:
Hidroxipropil celulosa (E463)
Dióxido de titanio (E171)
Macrogol
Hipromellosa (E464)
6.2 Incompatibilidades
No procede.
6.3 Período de validez
4 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Blister de PVC sellado con una lámina de aluminio que contiene 30 comprimidos.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Roche Registration Limited 6 Falcon Way Shire Park
Welwyn Garden City AL7 1TW Reino Unido.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/311/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 19 de Septiembre 2005 Fecha de la última renovación: 2 de Julio 2010
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea
de Medicamentos
1. NOMBRE DEL MEDICAMENTO
Tarceva 150 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un comprimido recubierto con película contiene 150 mg de erlotinib (como erlotinib clorhidrato).
Excipientes con efecto conocido: Cada comprimido recubierto con película contiene 103,82 mg de Lactosa monohidrato.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Comprimidos de color blanco a amarillento, redondos, biconvexos, con el grabado “T 150” en una cara.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Cáncer de Pulmón No Microcítico (CPNM):
Tarceva está indicado en el tratamiento de primera línea de pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con mutaciones activadoras de EGFR.
Tarceva está también indicado como tratamiento de mantenimiento de pacientes con CPNM localmente avanzado o metastásico con mutaciones activadoras de EGFR y enfermedad estable después de un régimen quimioterápico de primera línea.
Tarceva también está indicado en el tratamiento de pacientes con CPNM localmente avanzado o metastásico tras fallo, al menos, a un tratamiento quimioterápico anterior.
Se deberían considerar los factores asociados con el aumento de la supervivencia cuando se prescriba Tarceva.
No se ha demostrado beneficio en la supervivencia u otros efectos clínicamente relevantes del tratamiento en pacientes con tumores que no expresen el Receptor del Factor de Crecimiento Epidérmico (EGFR) IHQ negativa (ver sección 5.1).
Cáncer de páncreas:
Tarceva en combinación con gemcitabina está indicado en el tratamiento de pacientes con cáncer de páncreas metastásico.
Se deberían considerar los factores asociados con el aumento de la supervivencia cuando se prescriba Tarceva (ver sección 4.2 y 5.1).
En pacientes con enfermedad localmente avanzada no se han podido observar ventajas en términos de supervivencia.
4.2 Posología y forma de administración
El tratamiento con Tarceva debe ser supervisado por un especialista con experiencia en el empleo de terapias anti-cancerosas.
Pacientes con Cáncer de Pulmón No Microcítico:
Se debe llevar a cabo el test de la mutación de EGFR antes de iniciar el tratamiento con Tarceva en pacientes con CPNM avanzado o metastásico, que no han sido tratados previamente con quimioterapia.
La dosis diaria recomendada de Tarceva es 150 mg administrada al menos una hora antes o dos después de la ingestión de alimentos.
Pacientes con cáncer de páncreas:
La dosis diaria recomendada de Tarceva es 100 mg administrada al menos una hora antes o dos horas después de la ingestión de alimentos, en combinación con gemcitabina (ver la ficha técnica de gemcitabina para la indicación de cáncer de páncreas).
Se debería reevaluar la continuación del tratamiento con Tarceva en pacientes que no desarrollen rash dentro de las primeras 4-8 semanas del tratamiento (ver sección 5.1).
Cuando sea necesario un ajuste de dosis, ésta se debe reducir en fracciones de 50 mg (ver sección 4.4). Tarceva está disponible en dosis de 25 mg, 100 mg y 150 mg.
El uso concomitante de sustratos y moduladores del citocromo CYP3A4 puede requerir un ajuste de dosis (ver sección 4.5).
Pacientes con insuficiencia hepática: Erlotinib se elimina por metabolismo hepático y excreción biliar. Aunque la exposición a erlotinib fue similar en pacientes con insuficiencia hepática moderada (valor Child-Pugh 7-9) en comparación con la de pacientes con buena función hepática, deberá tenerse precaución cuando se administre Tarceva a pacientes con insuficiencia hepática. Si aparecen reacciones adversas graves, debe considerarse la posibilidad de reducir la dosis o interrumpir la administración de Tarceva. La seguridad y eficacia de erlotinib no ha sido estudiada en pacientes con disfunción hepática grave (AST/SGOT y ALT/SGPT > 5x ULN). No se recomienda usar Tarceva en pacientes con disfunción hepática grave (ver sección 5.2).
Pacientes con insuficiencia renal: La seguridad y eficacia de erlotinib no ha sido estudiada en pacientes con insuficiencia renal (concentración sérica de creatinina > 1,5 veces el límite superior normal). En base a los datos farmacocinéticos, no parece necesario un ajuste de la dosis en pacientes con insuficiencia renal media o moderada (ver sección 5.2). No se recomienda el uso de Tarceva en pacientes con insuficiencia renal grave.
Población pediátrica: no se ha establecido la seguridad y eficacia de erlotinib en pacientes menores de 18 años. No está recomendado el uso de Tarceva en pacientes pediátricos.
Fumadores: Se ha demostrado que fumar cigarrillos reduce la exposición a erlotinib en un 50-60%. La dosis máxima tolerada de Tarceva en pacientes fumadores activos con CPNM fue de 300 mg. No se ha establecido la eficacia y seguridad a largo plazo de dosis mayores a las dosis iniciales recomendadas en pacientes que continúan fumando cigarrillos (ver sección 4.5 y 5.2). Por lo tanto se debe recomendar a los fumadores activos que dejen de fumar ya que las concentraciones plasmáticas de erlotinib en fumadores se reducen respecto a las que presentan los no fumadores.
4.3 Contraindicaciones
Hipersensibilidad a erlotinib o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Evaluación del estado mutacional del EGFR
Cuando se evalúa el estado mutacional del EGFR de un paciente, es importante elegir una metodología validada y robusta para evitar la obtención de falsos negativos o falsos positivos.
Fumadores:
Se deberá recomendar a los fumadores dejar de fumar ya que las concentraciones plasmáticas de erlotinib se reducen en fumadores en comparación con no fumadores. Es probable que el grado de reducción sea clínicamente significativo (ver sección 4.5).
Enfermedad pulmonar intersticial:
Se han observado casos poco frecuentes de reacciones semejantes a enfermedad pulmonar intersticial (EPI), incluyendo fallecimientos, en pacientes que fueron tratados con Tarceva para el cáncer de pulmón no microcítico (CPNM), cáncer de páncreas u otros tumores sólidos avanzados. En el ensayo pivotal BR.21 en CPNM, la incidencia de EPI (0,8%) fue la misma tanto en el grupo al que se le administró placebo como en el tratado con Tarceva. En el ensayo de cáncer de páncreas en combinación con gemcitabina, la incidencia de reacciones semejantes a EPI fue del 2,5% en el grupo de Tarceva y gemcitabina versus el 0,4% en el grupo tratado con placebo y gemcitabina. La incidencia global en los pacientes tratados con Tarceva de todos los ensayos (incluidos los ensayos no controlados y los ensayos con quimioterapia concurrente) es aproximadamente del 0,6% comparada con el 0,2% en los pacientes con placebo. Los diagnósticos realizados en los pacientes en los que hubo sospecha de que tuvieran reacciones semejantes a EPI incluyeron: neumonitis, neumonitis causada por radiación, neumonitis por hipersensibilidad, neumonía intersticial, enfermedad pulmonar intersticial, bronquiolitis obliterante, fibrosis pulmonar, Síndrome de Distrés Respiratorio Agudo (ARDS), alveolitis e infiltración pulmonar. Los síntomas se presentaron en un intervalo que fue desde unos pocos días tras iniciar la terapia con Tarceva hasta varios meses desde el inicio de ésta. Se dieron frecuentemente factores que pudieron contribuir o confundir el diagnóstico como pueden ser la quimioterapia concomitante o previa, radioterapia previa, enfermedad parenquimal pulmonar preexistente, enfermedad pulmonar metastásica o infecciones pulmonares. Se observó una mayor incidencia de EPI entre los pacientes de origen japonés (aproximadamente el 5% con una tasa de mortalidad del 1,5%).
En pacientes que presenten un comienzo agudo de síntomas pulmonares inexplicables, nuevos y/o progresivos, tales como disnea, tos y fiebre, se debe interrumpir la terapia con Tarceva hasta que se realice una evaluación diagnóstica. Los pacientes tratados con erlotinib y gemcitabina en combinación deberían ser monitorizados cuidadosamente por la posibilidad de desarrollar toxicidad semejante a EPI. Si se diagnostica EPI, se debe suspender el tratamiento con Tarceva e iniciar el tratamiento apropiado necesario (ver sección 4.8).
Diarrea, deshidratación, desequilibrio hidroelectrolítico e insuficiencia renal
Se ha observado diarrea (incluyendo casos muy raros con resultado de muerte) en aproximadamente el 50% de los pacientes en tratamiento con Tarceva. La diarrea moderada o grave debe ser tratada con, por ejemplo, loperamida. En algunos casos, puede ser necesaria una reducción de la dosis. En los ensayos clínicos, las dosis fueron reducidas en fracciones de 50 mg. No se han investigado reducciones de dosis en fracciones de 25 mg. En el caso de presentarse diarrea grave o persistente, náuseas, anorexia o vómitos asociados a deshidratación, el tratamiento con Tarceva debe ser interrumpido y deben tomarse las medidas apropiadas para tratar la deshidratación (ver sección 4.8).
En raros casos, se ha observado hipopotasemia y fallo renal (incluidos fallecimientos) Algunos casos fueron secundarios a deshidratación grave debida a diarrea, vómitos y/o anorexia, mientras que otros fueron confundidos con la quimioterapia concomitante. La terapia con Tarceva deberá interrumpirse y se deberán adoptar medidas apropiadas para rehidratar por vía intravenosa a los pacientes en muchos casos de diarrea grave o persistente, o en casos que provoquen deshidratación, especialmente en grupos de pacientes con factores de riesgo agravantes (especialmente quimioterapia y otra medicación concomitante, síntomas o enfermedades u otras situaciones que pudieran predisponer, incluyendo la edad avanzada). Además, en los pacientes con riesgo de deshidratación, se deberá monitorizar la función renal y la determinación de electrolitos en suero, incluyendo el potasio.
Hepatitis, fallo hepático
Durante el uso de Tarceva, se han notificado casos raros de fallo hepático (incluidos fallecimientos). Entre lo s factores de confusión se ha incluido la existencia previa de enfermedad hepática o medicación concomitante hepatotóxica. Por lo tanto, en estos pacientes, se debe considerar la realización de un examen de la función hepática de forma periódica. El tratamiento con Tarceva debe interrumpirse si hay cambios graves en la función hepática (ver sección 4.8). No se recomienda el uso de Tarceva en pacientes con disfunción hepática grave.
Perforación gastrointestinal
Se ha observado con poca frecuencia que los pacientes en tratamiento con Tarceva tienen un mayor riesgo de aparición de perforación gastrointestinal (incluyendo algunos casos con resultado de muerte). El riesgo es mayor en los pacientes que reciben de forma concomitante agentes anti-angiogénicos, corticosteroides, AINEs y/o quimioterapia basada en taxanos, o que tengan antecedentes de úlcera péptica o enfermedad diverticular. El tratamiento con Tarceva debe suspenderse permanentemente en aquellos pacientes en los que aparezca perforación gastrointestinal (ver sección 4.8).
Trastornos vesiculares y exfoliativos de la piel
Se han notificado casos de alteraciones vesiculares, ampollosas y exfoliativas en la piel, incluyendo casos muy raros indicativos del síndrome de Stevens-Johnson/Necrolisis epidérmica tóxica, que en algunos casos fueron mortales. (ver sección 4.8). El tratamiento con Tarceva debe interrumpirse o suspenderse si en el paciente aparecen vesículas, ampollas o exfoliación de carácter grave. Los pacientes con trastornos vesiculares y exfoliativos de la piel, se deben hacer la prueba de infecciones de la piel y ser tratados de acuerdo con las directrices locales.
Trastornos oculares
Los pacientes que presenten signos y síntomas indicadores de queratitis, como una agudización o empeoramiento de: inflamación ocular, lagrimeo, fotosensibilidad ocular, visión borrosa, dolor ocular y/o ojos enrojecidos, deben ser remitidos inmediatamente a un especialista en oftalmología. Si el diagnóstico de queratitis ulcerativa se confirma, el tratamiento con Tarceva debe ser interrumpido o suspendido. Si se diagnostica queratitis, se deben evaluar cuidadosamente los beneficios y riesgos de continuar con el tratamiento. Tarceva debe ser utilizado con precaución en pacientes con antecedentes de queratitis, queratitis ulcerativa u ojo seco grave. El uso de lentes de contacto también es un factor de riesgo para la queratitis y ulceración. Durante el uso de Tarceva se han notificado casos muy raros de ulceración o perforación de la córnea (ver sección 4.8).
Interacciones con otros medicamentos:
Los inductores potentes del citocromo CYP3A4 pueden reducir la eficacia de erlotinib mientras que los inhibidores potentes del CYP3A4 pueden producir un aumento de la toxicidad. Debe evitarse el tratamiento concomitante con estos tipos de agentes (ver sección 4.5).
Otras formas de interacción:
Erlotinib se caracteriza por una disminución de su solubilidad a un pH superior a 5. Los medicamentos que modifican el pH del tracto Gastro-Intestinal (GI) superior, como los inhibidores de la bomba de protones, antagonistas H2 y antiácidos, pueden alterar la solubilidad de erlotinib y, por lo tanto, su biodisponibilidad. No es probable que un aumento de la dosis de Tarceva cuando se co-administre con tales agentes compense la pérdida de exposición. Deberá evitarse la combinación de erlotinib con inhibidores de la bomba de protones. Se desconocen los efectos de la administración concomitante de erlotinib con antagonistas H2 y antiácidos; no obstante, es probable que se reduzca su biodisponibilidad. Por consiguiente, deberá evitarse la administración concomitante de estas combinaciones (ver sección 4.5). Si se considera necesario el uso de antiácidos durante el tratamiento con Tarceva, deberían tomarse al menos 4 horas antes ó 2 horas después de la dosis diaria de Tarceva.
Los comprimidos contienen lactosa y no deben ser administrados a pacientes con intolerancia hereditaria a galactosa, de insuficiencia de lactasa de Lapp o problemas de absorción de glucosa o galactosa.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios de interacciones se han realizado sólo en adultos.
Erlotinib y otros sustratos del CYP
Erlotinib es un inhibidor potente del citocromo CYP1A1 y un inhibidor moderado del CYP3A4 y CYP2C8, y es también un inhibidor fuerte de la glucuronidación por UGT1A1 in vitro.
Se desconoce la relevancia fisiológica de la fuerte inhibición del CYP1A1 debido a que la expresión de CYP1A1 es muy limitada en tejidos humanos.
Cuando erlotinib se coadministró con ciprofloxacino, un inhibidor moderado del CYP1A2, la exposición a erlotinib [AUC] aumentó significativamente un 39%, aunque no produjo ningún cambio estadísticamente significativo en Cmáx. Del mismo modo, la exposición al metabolito activo aumentó alrededor de un 60% y un 48% para AUC y Cmáx, respectivamente. No se ha determinado la relevancia clínica de este aumento. Debe tenerse precaución cuando ciprofloxacino o inhibidores potentes del CYP1A2 (por ej. fluvoxamina) se combinen con erlotinib. Si se observan reacciones adversas relacionadas con erlotinib, la dosis de erlotinib puede reducirse.
El tratamiento previo o la co-administración de Tarceva no alteró el aclaramiento de midazolam y eritromicina, sustratos prototípicos del CYP3A4, pero parece que disminuyó la biodisponibilidad oral del midazolam hasta el 24%. En otro ensayo clínico, erlotinib no afectó a la farmacocinética de paclitaxel, sustrato del CYP3A4/2C8, al ser administrado concomitantemente. Por tanto, las interacciones significativas con el aclaramiento de otros sustratos del CYP3A4 son improbables.
La inhibición de la glucuronidación puede provocar interacciones con medicamentos que son sustratos de UGT1A1 y que sólo se eliminan por esta vía. Los pacientes con bajos niveles de expresión de UGT1A1 o alteraciones genéticas de la glucuronidación (por ej. enfermedad de Gilbert) pueden tener un aumento de la concentración de bilirrubina en suero y deben ser tratados con precaución.
En humanos, erlotinib es metabolizado en el hígado por los citocromos hepáticos, principalmente por CYP3A4 y en menor medida por CYP1A2. También contribuye potencialmente al aclaramiento metabólico de erlotinib, el metabolismo extrahepático por CYP3A4 en el intestino, CYP1A1 en pulmones y CYP1B1 en tejido tumoral. Pueden darse interacciones potenciales con sustancias activas que se metabolicen por esas enzimas o sean inhibidores o inductores de dichas enzimas.
Los inhibidores potentes de la actividad del CYP3A4 disminuyen el metabolismo de erlotinib y aumentan la concentración plasmática de erlotinib. En un ensayo clínico, el uso concomitante de erlotinib con ketoconazol (200 mg vía oral dos veces al día durante 5 días), un potente inhibidor del CYP3A4, condujo a un aumento de la exposición a erlotinib (86% del AUC y 69% de la Cmáx). Debe tenerse precaución cuando se combine erlotinib con un inhibidor potente del CYP3A4, como por ej. antifungicos azoles (como ketoconazol, itraconazol, voriconazol), inhibidores de la proteasa, eritromicina o claritromicina. Si es necesario se deberá reducir la dosis de erlotinib, particularmente si se observa toxicidad.
Los inductores potentes de la actividad del CYP3A4 aumentan el metabolismo de erlotinib y disminuyen significativamente las concentraciones plasmáticas de erlotinib. En un ensayo clínico, el uso concomitante de erlotinib y rifamicina (600 mg vía oral una vez al día durante 7 días), un inductor potente del CYP3A4, produjo una disminución de un 69% de la mediana del AUC de erlotinib. La coadministración de rifampicina con una sola dosis de Tarceva de 450 mg dio lugar a una exposición media de erlotinib (AUC) del 57,5% de la resultante tras una sola dosis de Tarceva de 150 mg sin rifampicina. Por lo tanto, debe evitarse la coadministración de Tarceva con inductores del CYP3A4.
Se debe considerar un aumento en la dosis hasta 300 mg en pacientes que requieren tratamiento concomitante de Tarceva con inductores potentes del CYP3A4 tales como rifampicina, siempre que su seguridad sea monitorizada estrechamente (incluyendo la función renal y hepática y los electrolitos séricos), y si ésta se tolera bien durante más de dos semanas, se podría considerar un aumento a 450 mg con una monitorización estrecha de seguridad. También puede darse una exposición reducida con otros inductores como por ej. fenitoína, carbamazepina, barbitúricos o Hipérico (hypericum perforatum, hierba de San Juan). Debe tenerse precaución cuando estas sustancias activas se combinen con erlotinib. Cuando sea posible, se deben considerar tratamientos alternativos evitando los inductores potentes de la actividad del CYP3A4.
Erlotinib y anticoagulantes derivados de la cumarina
En pacientes tratados con Tarcerva se han notificado casos de interacción con anticoagulantes derivados de la cumarina, incluyendo la warfarina, que produjeron aumentos en el Ratio Internacional Normalizado (INR) y hemorragias, que en algunos casos fueron mortales. Los pacientes a los que se les administre anticoagulantes derivados de la cumarina deben ser monitorizados regularmente para detectar cualquier cambio en el tiempo de protombina o en el INR.
Erlotinib y estatinas
La combinación de Tarceva y una estatina puede aumentar el riesgo de miopatía inducida por estatinas, incluyendo rabdomiolisis, que fue observada de forma rara.
Erlotinib y fumadores
Los resultados de un estudio de interacción farmacocinética indicaron que existe una reducción significativa en el AUCinf, Cmax y en la concentración plasmática a las 24 horas de 2,8-, 1,5- y 9-veces, respectivamente, tras la administración de Tarceva en fumadores en comparación con no fumadores (ver sección 5.2). Por tanto, se debería aconsejar a los pacientes fumadores que dejen de fumar lo antes posible antes de iniciar el tratamiento con Tarceva, puesto que, de lo contrario, la concentración plasmática de erlotinib será más reducida. El efecto clínico de la disminución de dicha exposición no ha sido evaluado de forma determinante pero es probable que sea clínicamente significativo.
Erlotinib e inhibidores de la P-glicoproteína
Erlotinib es sustrato de la P-glicoproteína (transportador de sustancias activas). La administración concomitante de inhibidores de la P-glicoproteína, como p. ej. ciclosporina y verapamilo, puede producir una alteración en la distribución y/o eliminación de erlotinib. No se ha establecido las consecuencias de esta interacción para, p. ej., la toxicidad a nivel del SNC. Deberá tenerse precaución en dichas situaciones.
Erlotinib y medicamentos que alteran el pH
Erlotinib se caracteriza por una disminución de su solubilidad a un pH superior a 5. Los medicamentos que alteran el pH del tracto Gastro-Intestinal (GI) superior pueden alterar la solubilidad de erlotinib y por lo tanto su biodisponibilidad. La coadministración de erlotinib con omeprazol, un inhibidor de la bomba de protones (IBP), disminuyó la exposición [AUC] y la concentración máxima (Cmáx) de erlotinib un 46% y 61%, respectivamente. No hubo cambio alguno del Tmáx o de la vida media. La administración concomitante de Tarceva con 300 mg de ranitidina, un antagonista de los receptores H2, disminuye la exposición de erlotinib [AUC] y las concentraciones máximas [Cmax] un 33% y 54% respectivamente. No es probable que un aumento de la dosis de Tarceva cuando se coadministre con tales agentes compense esta pérdida de exposición. Sin embargo, cuando Tarceva se administró de forma escalonada, 2 horas antes ó 10 horas después de la administración de 150 mg de ranitidina dos veces al día, la exposición de erlotinib [AUC] y las concentraciones máximas [Cmax] disminuyeron sólo un 15% y 17%, respectivamente. No se ha investigado el efecto de antiácidos sobre la absorción de erlotinib pero la absorción puede verse afectada produciendo una disminución de los niveles plasmáticos. En resumen, deberá evitarse la combinación de erlotinib con inhibidores de la bomba de protones. Si se considera necesario el uso de antiácidos durante el tratamiento con Tarceva, deberían tomarse al menos 4 horas antes ó 2 horas después de la dosis diaria de Tarceva. Si se considera necesario el uso de ranitidina, ésta debe administrarse de forma escalonada, es decir, se debe tomar Tarceva al menos 2 horas antes ó 10 horas después de la dosis de ranitidina.
Erlotinib y Gemcitabina
En un estudio Fase Ib, no se dieron efectos significativos de gemcitabina sobre la farmacocinética de erlotinib ni tampoco efectos significativos de erlonitib en la farmacocinética de gemcitabina.
Erlotinib y Carboplatino/Paclitaxel
Erlotinib incrementa las concentraciones de platino. En un ensayo clínico el uso concomitante de erlotinib con carboplatino y paclitaxel dio lugar a un incremento en el AUC0-48 total de platino del 10,6%. Aunque es estadísticamente significativa, la magnitud de esta diferencia no se considera que sea clínicamente relevante. En la práctica clínica puede haber otros factores que produzcan un aumento en la exposición al carboplatino como el trastorno renal. No hubo efectos significativos de carboplatino o placlitaxel en la farmacocinética de erlotinib.
Erlotinib y Capecitabina
Capecitabina puede incrementar la concentración de erlotinib. Al administrar erlotinib en combinación con capecitabina, se produjo un aumento estadísticamente significativo en la AUC de erlotinib y un aumento incierto en la Cmax en comparación con los valores observados en otro estudio en el cual se administro erlotinib como único agente. No hubo efectos significativos de erlotinib en la farmacocinética de capecitabina.
Erlotinib e inhibidores del proteasoma
Por su mecanismo de acción, los inhibidores del proteasoma, incluyendo el bortezomib pueden influir en el efecto de los inhibidores del EGFR, incluyendo el erlotinib. Esta influencia se apoya en datos clínicos limitados y en estudios preclínicos que muestran la degradación del EGFR mediante el proteasoma.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de erlotinib en mujeres embarazadas. Los estudios en animales no han mostrado evidencia de teratogenicidad o parto anormal. Sin embargo, no se puede excluir un efecto adverso en el embarazo, ya que los estudios llevados a cabo en ratas y conejos han mostrado un incremento de la letalidad embrio/fetal (ver sección 5.3). El riesgo potencial en humanos se desconoce.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil que eviten quedarse embarazadas mientras estén en tratamiento con Tarceva. Deberán emplearse métodos anticonceptivos adecuados durante el tratamiento y durante al menos las 2 semanas siguientes a su terminación. Sólo se continuará el tratamiento en mujeres embarazadas si el beneficio potencial para la madre supera al riesgo para el feto.
Lactancia
Se desconoce si erlotinib se excreta en la leche humana. Se debe desaconsejar a las madres la lactancia materna mientras sean tratadas con Tarceva por el daño potencial que se pueda causar al niño.
Fertilidad
Los estudios en animales no han mostrado evidencia de alteración de la fertilidad. Sin embargo, no se puede excluir un efecto adverso en la fertilidad, ya que los estudios con animales han mostrado efectos sobre los parámetros reproductivos (ver sección 5.3). No se conoce el riesgo potencial en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas. Sin embargo, no hay asociación entre erlotinib y la alteración de la habilidad mental.
4.8 Reacciones adversas
Cáncer de pulmón no microcítico (Tarceva administrado en monoterapia):
En el ensayo aleatorizado doble-ciego (BR.21; Tarceva administrado como segunda línea de tratamiento), las reacciones adversas al medicamento observadas más frecuentemente fueron rash (75%) y diarrea (54%). La mayoría fueron de gravedad grado 1/2 y no necesitaron intervención. Se observaron rash y diarrea de grado 3/4 en un 9% y 6%, respectivamente, de los pacientes tratados con Tarceva y, en ambos casos, supuso el abandono del ensayo en el 1% de los pacientes. Fue necesaria la reducción de la dosis debido a rash y diarrea en un 6% y un 1% de los pacientes, respectivamente. En el ensayo BR.21, la mediana de tiempo que tardó en aparecer el rash fue 8 días y la de la diarrea, 12 días.
Generalmente, la aparición de rash se manifiesta en forma de una erupción eritematosa y papulopustular leve o moderada, que puede producirse o empeorar en las zonas expuestas al sol. Sería aconsejable que los pacientes expuestos al sol usen ropa para protegerse y/o protección solar (por ejemplo que contenga minerales).
En el ensayo pivotal BR.21, las reacciones adversas que se observaron con más frecuencia (>3%) en los pacientes tratados con Tarceva que en el grupo placebo, y que ocurren en al menos el 10% de los pacientes del grupo tratado con Tarceva, están resumidos en la Tabla 1 en función de los grados según los criterios comunes de toxicidad del Instituto Nacional del Cáncer de Estados Unidos (NCI-CTC).
Se han utilizado los siguientes términos para clasificar los efectos indeseables por frecuencia: muy frecuente (>1/10); frecuente (>1/100 a < 1/10); poco frecuente (>1/1.000 a < 1/100); raros (>1/10.000 a < 1/1.000); muy raros (< 1/10.000) incluyendo casos aislados.
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
|
Erlotinib N = 485 |
Placebo N = 242 | |||||
|
Grado del NCI-CTC |
Cualquier grado |
3 |
4 |
Cualquier grado |
3 |
4 |
|
Término MedDRA |
% |
% |
% |
% |
% |
% |
|
Total de pacientes con cualquier RA |
99 |
40 |
22 |
96 |
36 |
22 |
|
Infecciones e infestaciones | ||||||
|
Infección* |
24 |
4 |
0 |
15 |
2 |
0 |
|
Trastornos del metabolismo y de la nutrición | ||||||
|
Anorexia |
52 |
8 |
1 |
38 |
5 |
< 1 |
|
Trastornos oculares | ||||||
|
Queratoconjuntivitis seca |
12 |
0 |
0 |
3 |
0 |
0 |
|
Conjuntivitis |
12 |
<1 |
0 |
2 |
<1 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos | ||||||
|
Disnea |
41 |
17 |
11 |
35 |
15 |
11 |
|
Tos |
33 |
4 |
0 |
29 |
2 |
0 |
|
Trastornos gastrointestinales | ||||||
|
Diarrea** |
54 |
6 |
< 1 |
18 |
< 1 |
0 |
|
Náuseas |
33 |
3 |
0 |
24 |
2 |
0 |
|
Vómitos |
23 |
2 |
< 1 |
19 |
2 |
0 |
|
Estomatitis |
17 |
< 1 |
0 |
3 |
0 |
0 |
|
Dolor abdominal |
11 |
2 |
< 1 |
7 |
1 |
< 1 |
|
Trastornos de la piel y del tejido subcutáneo | ||||||
|
Rash*** |
75 |
8 |
< 1 |
17 |
0 |
0 |
|
Prurito |
13 |
< 1 |
0 |
5 |
0 |
0 |
|
Sequedad de la piel |
12 |
0 |
0 |
4 |
0 |
0 |
|
Trastornos generales y alteraciones en el lugar de administración | ||||||
|
Fatiga |
52 |
14 |
4 |
45 |
16 |
4 |
* Infecciones graves con o sin neutropenia, incluyeron neumonía sepsis y celulitis. ** Puede producir deshidratación, hipopotasemia y fallo renal.
*** Rash incluida dermatitis acneiforme.
En dos ensayos, doble-ciego, aleatorizados controlados con placebo, Fase III BO18192 (SATURN) y BO25460 (IUNO), Tarceva se administró como tratamiento de mantenimiento tras quimioterapia de primera línea. Estos ensayos se llevaron a cabo en 1.532 pacientes con CPNM avanzado, recurrente o metastásico, tras quimioterapia estándar en primera línea basada en compuestos de platino y no se identificaron nuevas señales de seguridad.
Las reacciones adversas observadas más frecuentemente en pacientes tratados con Tarceva, en los ensayos BO18192 y BO25460 fueron rash y diarrea (ver tabla2). No se observaron rash o diarrea grado 4 en ninguno de los estudios. El rash y la diarrea supusieron el abandono del tratamiento con Tarceva en el 1% y en <1% de los pacientes respectivamente, en el estudio BO18192, mientras que ningún paciente abandonó el tratamiento por rash o diarrea en el estudio BO25460. Se requirieron modificaciones de dosis (interrupciones o reducciones) por el rash y la diarrea en el 8,3% y 3% de los
pacientes, respectivamente, en el estudio BO18192, y 5,6% y 2,8% de los pacientes, respectivamente, en el estudio BO25460.
Tabla 2 : Reacciones adversas más frecuentes en los Estudios BO18192 (SATURN) y BO25460
(IUNO)
|
BO18192 (SAT1 |
JRN)* |
BO25460 (IUNO)* | ||
|
Tarceva n=433 |
Placebo n=445 |
Tarceva n=322 |
Placebo n=319 | |
|
% |
% |
% |
% | |
|
Rash, todos los grados |
49,2 |
5,8 |
39,4 |
10,0 |
|
Grado 3 |
6,0 |
0 |
5,0 |
1,6 |
|
Diarrea, todos los grados |
20,3 |
4,5 |
24,2 |
4,4 |
|
Grado 3 |
1,8 |
0 |
2,5 |
0,3 |
*Análisis de seguridad de la población
En un estudio fase III, ML20650 abierto, aleatorizado, llevado a cabo en 154 pacientes, la seguridad de Tarceva en primera línea de tratamiento en CPNM con mutaciones activadoras de EGFR fue evaluada en 75 pacientes; no se han observado nuevas señales de seguridad en estos pacientes.
En el estudio ML20650, las RAs más frecuentes observadas en pacientes tratados con Tarceva fueron rash y diarrea (80% y 57% respectivamente, de cualquier grado), la mayoría fueron Grado 1/2 y se manejaron sin necesidad de intervención. Se observaron rash y diarrea de Grado 3 en un 9% y 4% de los pacientes, respectivamente. No se observó rash y diarrea Grado 4. Tanto el rash como la diarrea supusieron el abandono del tratamiento con Tarceva en el 1% de los pacientes. Se necesitaron modificaciones de la dosis (interrupciones o reducciones) por el rash y la diarrea en el 11% y 7% de los pacientes, respectivamente.
Cáncer de páncreas (Tarceva administrado en combinación con gemcitabina):
Las reacciones adversas más frecuentes que se observaron en el ensayo pivotal PA.3 en pacientes con cáncer de páncreas tratados con Tarceva 100 mg y gemcitabina, fueron fatiga, rash y diarrea. En el brazo tratado con Tarceva y gemcitabina, se observó rash Grado 3-4 y diarrea en un 5% de los pacientes, respectivamente. La mediana del tiempo de aparición de rash y diarrea fue de 10 y 15 días, respectivamente. Tanto el rash como la diarrea provocaron la reducción de las dosis en un 2% de los pacientes, y ocasionaron la interrupción del ensayo de hasta el 1% de los pacientes tratados con Tarceva y gemcitabina.
En el ensayo pivotal PA.3, las reacciones adversas que se presentaron con mayor frecuencia (>3%) en el grupo de pacientes tratados con Tarceva 100 mg y gemcitabina versus el grupo tratado con placebo y gemcitabina y, en al menos el 10% de los pacientes tratados con Tarceva 100 mg y gemcitabina, se resumen en la Tabla 3 siguiendo los criterios de clasificación por grados de toxicidad del Instituto Nacional del Cáncer (NCI-CTC).
Se han utilizado los siguientes términos para clasificar los efectos indeseables por frecuencia: muy frecuente (>1/10); frecuente (>1/100 a < 1/10); poco frecuente (>1/1.000 a < 1/100); raros (>1/10.000 a < 1/1.000); muy raros (< 1/10.000) incluyendo casos aislados.
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
Tabla 3 : Reacciones adversas (RA) muy frecuentes observadas en el ensayo PA.3 (grupo cohorte
tratado con 100 mg)
|
Erlotinib N = 259 |
Placebo N = 256 | |||||
|
Cualquier |
Cualquier | |||||
|
Grado según NCI-CTC |
grado |
3 |
4 |
grado |
3 |
4 |
|
Término MedDRA |
% |
% |
% |
% |
% |
% |
|
Total de pacientes con cualquier RA |
99 |
48 |
22 |
97 |
48 |
16 |
|
Infecciones e infestaciones | ||||||
|
Infección* |
31 |
3 |
< 1 |
24 |
6 |
< 1 |
|
Trastornos del metabolismo y de la | ||||||
|
nutrición |
39 |
2 |
0 |
29 |
< 1 |
0 |
|
Pérdida de peso | ||||||
|
Trastornos psiquiátricos | ||||||
|
Depresión |
19 |
2 |
0 |
14 |
< 1 |
0 |
|
Trastornos del sistema nervioso | ||||||
|
< 1 | ||||||
|
Neuropatía |
13 |
1 |
0 |
10 |
< 1 |
0 |
|
Cefalea |
15 |
<1 |
10 |
0 |
0 | |
|
Trastornos respiratorios, torácicos y | ||||||
|
mediastínicos | ||||||
|
Tos |
16 |
0 |
0 |
11 |
0 |
0 |
|
Trastornos gastrointestinales | ||||||
|
Diarrea** |
48 |
5 |
< 1 |
36 |
2 |
0 |
|
Estomatitis |
22 |
< 1 |
0 |
12 |
0 |
0 |
|
Dispepsia |
17 |
< 1 |
0 |
13 |
< 1 |
0 |
|
Flatulencia |
13 |
0 |
0 |
9 |
< 1 |
0 |
|
Trastornos de la piel y tejidos | ||||||
|
subcutáneos | ||||||
|
Rash*** |
69 |
5 |
0 |
30 |
1 |
0 |
|
Alopecia |
14 |
0 |
0 |
11 |
0 |
0 |
|
Trastornos generales y alteraciones | ||||||
|
en el lugar de administración | ||||||
|
73 |
14 |
2 |
70 |
13 |
2 | |
|
Fatiga |
36 |
3 |
0 |
30 |
4 |
0 |
|
Fiebre |
12 |
0 |
0 |
9 |
0 |
0 |
|
Escalofríos | ||||||
* Las infecciones graves, con o sin neutropenia, incluyeron neumonía, sepsis y celulitis. ** Puede producir deshidratación, hipopotasemia y fallo renal.
*** Rash incluida dermatitis acneiforme.
Otras observaciones:
La evaluación de seguridad de Tarceva está basada en los datos obtenidos en más de 1.500 pacientes tratados con, al menos, una dosis de 150 mg de Tarceva en monoterapia y en más de 300 pacientes que recibieron Tarceva 100 o 150 mg en combinación con gemcitabina.
Se han observado las siguientes reacciones adversas en pacientes tratados con Tarceva en monoterapia y en pacientes tratados con Tarceva en combinación con quimioterapia.
Las reacciones adversas observadas muy frecuentemente, en los estudios BR21 y PA 3, se describen en las Tablas 1 y 3 mientras que otras reacciones adversas, incluyendo las observadas en otros estudios, se resumen en la Tabla 4.
Dentro de cada grupo de frecuencia, las reacciones adversas son presentadas en orden decreciente de gravedad.
|
Sistema Corporal |
Muy F recuente (>1/10) |
Frecuente (>1/100 a < 1/10) |
Poco frecuente (>1/1.000 a < 1/100) |
Raros (>1/10.000 a < 1/1.000) |
Muy raros (< 1/10.000) |
|
Transtornos oculares |
-Queratitis -Conjuntivitis1 |
-Cambios en las pestañas2 |
-Perforación de la córnea -Ulceración de la córnea -Uveitis | ||
|
Transtornos respiratorios, torácicos y mediastínicos |
-Epistaxis -Enfermedad pulmonar intersticial grave (EPI)3 | ||||
|
Transtornos gastro intestinales |
-Diarrea7 |
-Hemorragias gastrointestinales4, 7 |
-Perforación gastro-intestinal7 | ||
|
Transtornos hepatobiliares |
Anormalida des en el test de función hepática5 |
-Fallo hepático6 | |||
|
Transtornos de la piel y el tejido subcutáneo |
-Alopecia -Piel seca1 -Paroniquia -Foliculitis -Acné/ Dermatitis acneiforme -Grietas en la piel |
-Hirsutismo -Cambios en las cejas -Uñas quebradizas y sueltas -Reacciones cutáneas leves como hiperpigmentació n |
-Síndrome eritro- disestesia palmo- plantar |
-Síndrome Stevens- Johnson/necrólis is epidérmica 7 tóxica | |
|
Trastornos renales y urinarios |
-Insuficiencia renal1 |
-Nefritis1 -Proteinuria1 |
En el ensayo clínico PA.3
2 Incluyendo crecimiento hacia el interior de las pestañas, crecimiento, y engrosamiento excesivo de las pestañas.
3 Incluye fallecimientos, en pacientes que recibieron T arceva para el tratamiento de CPNM u otros tumores sólidos avanzados (ver sección 4.4). Se ha observado una incidencia alta en pacientes de origen Japonés (ver sección 4.4).
4 En ensayos clínicos algunos casos se asociaros a la administración concomitante de warfarina y algunos a la administración concomitante de AINEs (ver sección 4.5)
5 Incluyendo niveles incrementados de alanina aminotransferasa [ALT], aspartamo aminotransferasa [AST] y bilirrubina. Estos fueron muy frecuentes en el ensayo clínico P A 3 y frecuentes en el ensayo clínico BR. 21. Los casos fueron principalmente de gravedad media o moderadaza, de naturaleza transitoria o asociadas a metástasis hepáticas.
6 Incluye fallecimientos. Entre los factores de confusión se ha incluido la existencia previa de enfermedad hepática o la medicación concomitante hepatotóxica (ver sección 4.4)
7 Incluye fallecimientos (ver sección 4.4)
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Anexo V.
4.9 Sobredosis
Síntomas
Se han administrado dosis orales únicas de Tarceva de hasta 1.000 mg de erlotinib en sujetos sanos y hasta 1.600 mg en pacientes con cáncer y éstas se toleraron bien. Las dosis repetidas de 200 mg dos veces al día administradas a sujetos sanos fueron mal toleradas tras sólo unos pocos días de tratamiento. En base a los datos derivados de estos ensayos, por encima de la dosis recomendada podrían darse reacciones adversas graves tales como diarrea, rash y un posible aumento de la actividad de las aminotransferasas hepáticas.
Tratamiento
En caso de que exista sospecha de sobredosis, se debe interrumpir el tratamiento con Tarceva e iniciar un tratamiento sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agente antineoplásico inhibidor de la proteína quinasa, código ATC: L01XE03
Mecanismo de acción
Erlotinib es un inhibidor del receptor del factor de crecimiento epidérmico / de la tirosina quinasa del receptor del factor de crecimiento epidérmico humano tipo 1 (EGFR, también conocido como HER1). Erlotinib inhibe potentemente la fosforilación intracelular del EGFR. El EGFR se expresa en la superficie de células normales y cancerosas. En modelos no clínicos, la inhibición de la fosfotirosina del EGFR da lugar a que la célula quede en fase de equilibrio y/o conduce a la muerte celular.
Las mutaciones del EGFR pueden conducir a la activación constitutiva de rutas de señalización antiapoptóticas y de proliferación. La potente efectividad de erlotinib para bloquear la señal mediada por el EGFR en estos tumores con mutación positiva del EGFR, se atribuye a la estrecha unión de erlotinib al lugar de unión del ATP en el dominio quinasa mutado del EGFR. Debido al bloqueo de la cascada de señales por debajo del receptor, se detiene la proliferación celular y se induce la muerte celular a través de la ruta intrínseca de apoptosis. Se ha observado regresión tumoral en modelos de ratones con marcada expresión de mutaciones activadoras del EGFR.
Eficacia clínica
- Tratamiento en primera línea para pacientes con Cáncer de Pulmón No Microcítico (CPNM) con mutaciones activadoras del EGFR (Tarceva administrado en monoterapia):
La eficacia de Tarceva en el tratamiento en primera línea para los pacientes que presentan mutaciones activadoras del EGFR en CPNM, se demostró en un ensayo fase III, aleatorizado, abierto (ML20650, EURTAC). Este estudio se llevó acabo en pacientes caucásicos con CPNM metastásico o localmente avanzado (estadío IIIB y IV) que no habían recibido quimioterapia previa o cualquier terapia antitumoral sistémica para su enfermedad avanzada y que presentaban mutaciones en el dominio de la tirosina kinasa del EGFR (eliminación del exón 19 o mutación del exón 21). Los pacientes fueron aleatorizados 1:1 para ser tratados con Tarceva 150 mg o quimioterapia doble basada en platinos.
La SLP, variable principal del investigador. Los resultados de eficacia se resumen en la Tabla 5.

Qy | M IGT E RÁPIj t RIOTINIB
TrílJiü
| mdOfn ludo
QUIMIOTERAPIA
IRLOIINIR
|
Tarceva |
Ouimioteraui a |
Hazard Ratio (95% CI) |
Valor- d | ||
|
Análisis intermedio pre planificado (n=153) Fecha de corte: Aaosto 2010 |
n=77 |
n=76 | |||
|
Variable principal: Supervivencia Libre de Progresión ( mediana de SLP en meses)* Evaluación del investigador** Revisión independiente ** |
9.4 10.4 |
52 54 |
0,42 10.27- 0,641 0,47 10.27- 0,781 |
p<0,0001 p=0,003 | |
|
Tasa respuesta objetiva (CR/PR) |
54,5% |
10,5% |
p<0,0001 | ||
|
Supervivencia global (SG) (meses) (35% de eventos) |
22,9 |
18,8 |
0,80 10,47-1,371 |
p=0,4170 | |
|
Análisis exploratorio |
n=86 |
n=87 | |||
|
(n=173) |
SLP (mediana en meses). Evaluación del investigador |
97 |
52 |
0,37 10,27-0,541 |
p<0,0001 |
|
Fecha de |
Tasa respuesta objetiva (CR/PR) |
58,1% |
14,9% |
p<0,0001 | |
|
corte: Enero 2011 |
SG (meses) (40% de eventos) |
19,3 |
19,5 |
1,04 10,65-1,681 |
p=0,8702 |
|
Actualización del análisis |
n=86 |
n=87 | |||
|
(n=173) |
SLP (mediana en meses) |
10,4 |
51 |
0,34 10,23-0,491 |
p<0,0001 |
|
Fecha de corte: Abril 2012 |
SG*** (meses) (62% de eventos) |
22,9 |
20,8 |
0,93 10,64-1,361 |
p=0,7149 |
CR = respuesta completa, PR = respuesta parcial
* Se observó una reducción del 58% en el riesgo de progresión de la enfermedad o muerte ** La tasa global de concordancia entre el investigador y la evaluación del Comité Investigador Independiente fue del 70%
*** Se observó un elevado número de cruces en el tratamiento. El 82% de los pacientes en el brazo de quimioterapia recibieron en segunda línea un inhibidor de la tirosina quinasa del EGFR (todos menos 2 pacientes recibieron Tarceva).
-Tratamiento de mantenimiento de CPNM tras quimioterapia de primera línea (Tarceva administrado en monoterapia):
Se ha investigado la eficacia y la seguridad de Tarceva como mantenimiento tras una primera línea de quimioterapia, para pacientes con CPNM, en un ensayo (BO18192, SATURN) aleatorizado, doble-ciego, controlado con placebo. Este ensayo fue realizado en 889 pacientes con CPNM localmente avanzado o metastásico que no habían progresado tras 4 ciclos de un doblete de quimioterapia, basada en compuestos de platino. Los pacientes fueron aleatorizados 1:1 para ser tratados con Tarceva 150 mg o placebo por vía oral una vez al día, hasta progresión de la enfermedad. El objetivo primario del ensayo incluía Supervivencia Libre de Progresión (PFS) en todos los pacientes . Las características demográficas basales y de la enfermedad, estuvieron bien equilibradas en los dos brazos de tratamiento. No se incluyeron en el estudio pacientes con ECOG PS>1, con comorbilidad hepática o renal significativa.
En este estudio, la población total mostró un beneficio para la variable principal SLP (HR=0,71 p< 0,0001) y la variable secundaria SG (HR=0,81 p=0,0088). Sin embargo, el mayor beneficio se observó en un análisis exploratorio predefinido en pacientes con mutaciones activadoras de EGFR (n=49) demostrando un beneficio considerable de SLP (HR=0,10, 95% CI 0,04 a 0,25, p<0,0001) y un HR de la supervivencia global de 0,83 (95% CI 0,34 a 2,02). El 67% de los pacientes del subgrupo placebo con mutación EGFR positiva recibieron tratamiento de segunda o sucesivas líneas con EGFR-TKIs.
El estudio BO25460 (IUNO) se realizó en 643 pacientes con CPNM avanzado sin mutaciones activadoras de EGFR (deleción del exón 19 o mutación L858R del exón 21) y que no experimentaron progres ión de la enfermedad después de cuatro ciclo de quimioterapia basada en compuestos de platino.
El objetivo del estudio era comparar la supervivencia global del tratamiento de mantenimiento de primera línea con erlotinib versus erlotinib administrado en el momento de progresión de la enfermedad. Este estudio no alcanzó con su variable principal. La SG de Tarceva en el tratamiento de mantenimiento de primera línea no fue superior al tratamiento con Tarceva en segunda línea en pacientes cuyo tumor no albergó una mutación activadora de EGFR (HR=1,02, 95% CI 0,85 a 1,22, p=0,82). La variable secundaria de SLP no mostró ninguna diferencia entre Tarceva y placebo en el tratamiento de mantenimiento (HR=0,94, 95% CI 0,80 a 1,11, p=0,48).
Según los datos del estudio BO25460 (IUNO), el uso de Tarceva no está recomendado en el tratamiento de mantenimiento de primera línea en pacientes sin mutaciones activadoras de EGFR.
-Tratamiento de CPNM tras fallo de al menos un régimen quimioterápico anterior (Tarceva administrado en monoterapia):
La eficacia y seguridad de Tarceva en segunda/tercera línea han sido demostradas en un ensayo aleatorizado, doble ciego, controlado con placebo (BR.21) realizado en 731 pacientes con CPNM localmente avanzado o metastático tras el fallo de, al menos, un tratamiento quimioterápico. Los pacientes fueron aleatorizados 2:1 para ser tratados con Tarceva 150 mg o placebo por vía oral una vez al día. Los objetivos del ensayo incluyeron supervivencia global, supervivencia libre de progresión (PFS), índice de respuesta, duración de la respuesta, tiempo hasta el deterioro de los síntomas relacionados con el cáncer de pulmón (tos, disnea y dolor) y seguridad. El objetivo principal fue la supervivencia.
Las características demográficas estuvieron bien equilibradas en los dos grupos de tratamiento. Alrededor de dos tercios de los pacientes fueron hombres y aproximadamente un tercio presentaban un ECOG basal de 2 y un 9% tenían un ECOG basal de 3. El 93% y el 92% de todos los pacientes del grupo Tarceva y del grupo placebo respectivamente, habían sido tratados con una terapia anterior que contenía platino y un 36% y un 37% de todos los pacientes, respectivamente, habían sido tratados anteriormente con taxanos.
El índice de riesgo ajustado por muerte en el grupo tratado con Tarceva en relación con el grupo placebo fue 0,73 (95% CI, de 0,6 a 0,87) (p = 0,001). El porcentaje de pacientes vivos a los 12 meses fue del 31,2% y 21,5% para los grupos tratados con Tarceva y con placebo, respectivamente. La mediana de supervivencia global fue de 6,7 meses (95% CI, de 5,5 a 7,8 meses) en el grupo tratado con Tarceva en comparación con los 4,7 meses observados en el grupo placebo (95% CI, de 4,1 a 6,3 meses).
Se ha investigado el efecto sobre la supervivencia global en distintos subgrupos de pacientes. El efecto de Tarceva sobre la supervivencia global fue similar en pacientes con una ECOG basal de 2 - 3 (HR = 0,77, 95% CI 0,6 - 1,0) o de 0 - 1 (HR = 0,73, 95% CI 0,6 - 0,9), hombres (HR = 0,76, 95% CI 0,6 - 0,9) o mujeres (HR = 0,80, 95% CI 0,6 - 1,1), pacientes menores de 65 años (HR = 0,75, 95% CI 0,6 - 0,9) o mayores (HR = 0,79, 95% CI 0,6 - 1,0), pacientes con un tratamiento anterior (HR = 0,76, 95% CI 0,6 - 1,0) o con más de uno (HR = 0,75, 95% CI 0,6 - 1,0), caucasianos (HR = 0,79, 95% CI 0,6 - 1,0) o asiáticos (HR = 0,61, 95% CI 0,4 - 1,0), pacientes con adenocarcinoma (HR = 0,71, 95% CI 0,6 - 0,9) o carcinoma escamoso (HR = 0,67, 95% CI 0,5 - 0,9), pero no con otras histologías (HR = 1,04, 95% CI 0,7 - 1,5), pacientes con enfermedad en estadio IV diagnosticada (HR = 0,92,
95% CI 0,7 - 1,2) o en estadio < IV (HR = 0,65, 95% CI 0,5 - 0,8). Los pacientes que nunca habían fumado obtuvieron un beneficio mucho mayor con erlotinib (supervivencia HR = 0,42, 95% CI 0,28 -0,64) en comparación con los fumadores o los ex - fumadores (HR = 0,87, 95% CI 0,71 - 1,05).
La expresión del EGFR se determinó en el 45% de los pacientes, estableciéndose un índice de riesgo de 0,68 (95% CI 0,49 - 0,94) en los pacientes con tumores EGFR - positivos y de 0,93 (95% CI 0,63 -1,36) en aquellos con tumores EGFR - negativos (definidos mediante ICH empleando el kit EGFR
pharmDx y definiendo EGFR - negativo como tinción de menos del 10% de las células tumorales). En el 55% restante, en el que se desconocía la expresión del EGFR, el índice de riesgo fue de 0,77 (95% CI 0,61 -0,98).
La mediana de PFS fue de 9,7 semanas en el grupo tratado con Tarceva (95% CI, 8,4 a 12,4 semanas) siendo de 8,0 semanas en el grupo placebo (95% CI, 7,9 a 8,1 semanas).
El índice de respuesta objetiva medido por RECIST fue del 8,9% en el grupo con Tarceva (95% CI,
6,4 a 12,0). Los primeros 330 pacientes que fueron evaluados centralmente (índice de respuesta: 6,2%) y 401 pacientes fueron evaluados por el investigador (índice de respuesta: 11,2%).
La mediana de duración de la respuesta fue de 34,3 semanas, con un rango entre 9,7 y 57,6+ semanas. La proporción de pacientes que presentaron respuesta completa, respuesta parcial o enfermedad estable en el grupo tratado con Tarceva y placebo fue del 44,0% y 27,5% (p = 0,004), respectivamente.
También se observó un beneficio en la supervivencia en pacientes tratados con Tarceva que no alcanzaron una respuesta objetiva tumoral (por RECIST). La evidencia de esta afirmación radica en que el índice de riesgo por muerte fue de 0,82 (95% CI, 0,68 a 0,99) en pacientes cuya mejor respuesta fue enfermedad estable o progresiva.
En el tratamiento con Tarceva se obtuvieron beneficios en los síntomas ya que se prolongó de forma significativa el tiempo hasta el deterioro de los síntomas en forma de tos, disnea y dolor versus placebo.
-Cáncer de páncreas (Tarceva administrado en combinación con gemcitabina en el ensayo PA.3):
La eficacia y seguridad de Tarceva en combinación con gemcitabina como tratamiento de primera línea fueron evaluadas en un ensayo aleatorizado, doble-ciego, controlado con placebo en pacientes con cáncer de páncreas localmente avanzado, no resecable o metastásico. Los pacientes fueron aleatorizados para ser tratados con Tarceva o placebo una vez al día de forma continua y gemcitabina IV (1000 mg/ m2, Ciclo 1 - Días 1, 8, 15, 22, 29, 36 y 43 de un ciclo de 8 semanas; Ciclo 2 y siguientes ciclos - Días 1, 8 y 15 de un ciclo de 4 semanas (ver la Ficha Técnica de gemcitabina para la dosis y posología autorizadas para el cáncer de páncreas). Tanto Tarceva como el placebo fueron administrados por vía oral una vez al día hasta progresión de la enfermedad o toxicidad inaceptable. El objetivo principal del ensayo fue supervivencia global.
Las características demográficas y de enfermedad de los pacientes fueron similares entre los 2 grupos de tratamiento, Tarceva 100 mg y gemcitabina o placebo y gemcitabina, excepto por una ligera mayor proporción de mujeres en el brazo de erlotinib/gemcitabina en comparación con el brazo tratado con placebo/gemcitabina:
|
Situación a nivel basal |
Tarceva |
Placebo |
|
Mujeres |
51% |
44% |
|
ECOG performance status (PS) = 0 a nivel basal |
31% |
32% |
|
ECOG performance status (PS) = 1 a nivel basal |
51% |
51% |
|
ECOG performance status (PS) = 2 a nivel basal |
17% |
17% |
|
Enfermedad metastásica a nivel basal |
77% |
76% |
La supervivencia se evaluó en la población con intención de ser tratada (“Intend-to-treat population”) en base al seguimiento de los datos de supervivencia. Los resultados se muestran en la tabla siguiente (los datos de los grupos de pacientes con enfermedad metastásica o localmente avanzada se derivan del análisis exploratorio de los subgrupos).
|
Resultado |
Tarceva (meses) |
Placebo (meses) |
A (meses) |
CI del A |
HR |
CI del HR |
Valor de P |
|
Población Global | |||||||
|
Mediana de supervivencia global |
6,4 |
6,0 |
0,41 |
-0,54-1,64 |
0,82 |
0,69-0,98 |
0,028 |
|
Media de supervivencia global |
8,8 |
7,6 |
1,16 |
-0,05-2,34 | |||
|
Población con enfermedad metastásica | |||||||
|
Mediana de supervivencia global |
5,9 |
5,1 |
0,87 |
-0,26-1,56 |
0,80 |
0,66-0,98 |
0,029 |
|
Media de supervivencia global |
8,1 |
6,7 |
1,43 |
0,17-2,66 | |||
|
Población con enfermedad localmente avanzada | |||||||
|
Mediana de supervivencia global |
8,5 |
8,2 |
0,36 |
-2,43-2,96 |
0,93 |
0,65-1,35 |
0,713 |
|
Media de supervivencia global |
10,7 |
10,5 |
0,19 |
-2,43-2,69 | |||
Supervivencia Global-Todos los pacientes

Supervivencia Global - Pacientes con metástasis a distancia

Supervivencia (meses)
En un análisis de los datos del estudio realizado a posteriori se observó que los pacientes con situación clínica favorable a nivel basal (baja intensidad de dolor, buena calidad de vida y buen PS) pueden obtener más beneficio del tratamiento con Tarceva. El beneficio se relaciona principalmente con la existencia de una puntuación baja de intensidad de dolor.
En un análisis de los datos del estudio realizado a posteriori se observó que los pacientes en tratamiento con Tarceva que desarrollaron rash, tuvieron una supervivencia global más larga comparada con los pacientes que no tuvieron rash (mediana de supervivencia global de 7,2 meses versus 5 meses, HR: 0,61). El 90% de los pacientes desarrollaron rash en los primeros 44 días de tratamiento. La mediana del tiempo de aparición de rash fue de 10 días.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Tarceva en los diferentes grupos de la población pediátrica para las indicaciones de Cáncer de Pulmón No Microcítico y Cáncer Pancreático (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica)
5.2 Propiedades farmacocinéticas
Absorción: Tras la administración oral, los niveles plasmáticos máximos de erlotinib se obtienen a las 4 horas, aproximadamente, tras dicha administración. En un ensayo con voluntarios sanos se pudo estimar que la biodisponibilidad absoluta es del 59%. La exposición tras una dosis oral puede verse incrementada por los alimentos.
Distribución: Erlotinib tiene un volumen de distribución aparente medio de 232 l y se distribuye dentro del tejido tumoral en humanos. En un ensayo con 4 pacientes (3 con cáncer de pulmón no microcítico [CPNM] y 1 con cáncer de laringe) que fueron tratados con dosis orales diarias de 150 mg de Tarceva, se determinó los niveles de erlotinib en muestras de tumores obtenidas por extracciones quirúrgicas realizadas el Día 9 del tratamiento, obteniéndose concentraciones medias de erlotinib de 1.185 ng/g de tejido tumoral. Esto correspondía a una media global del 63% (rango 5-161%) de las concentraciones plasmáticas máximas en equilibrio que han sido determinadas. Los metabolitos activos principales estaban presentes en el tumor en concentraciones medias de 160 ng/g de tejido, lo que correspondía a un promedio global del 113% (rango 88-130%) de las concentraciones plasmáticas máximas en equilibrio que han sido determinadas. La unión a las proteínas plasmáticas es aproximadamente de un 95%. Erlotinib se une a la albúmina sérica y a la glicoproteína ácida alfal (AAG).
Biotran sformación: En humanos, erlotinib se metaboliza en el hígado por los citocromos hepáticos, principalmente por el CYP3A4 y en menor medida por el CYP1A2. También contribuye potencialmente al aclaramiento metabólico de erlotinib el metabolismo extrahepático por el CYP3A4 en el intestino, por el CYP1A1 en pulmones y por el CYP1B1 en tejido tumoral.
Se han identificado tres rutas metabólicas principales: 1) O-demetilación de cualquiera de las cadenas laterales o de ambas, seguida de la oxidación de los ácidos carboxílicos; 2) oxidación del grupo acetileno, seguida de la hidrólisis del ácido aril carboxílico y 3) hidroxilación aromática del grupo fenil-acetileno. Los metabolitos principales de erlotinib, OSI-420 y OSI-413, producidos por la O-demetilación de cualquiera de las cadenas laterales, tuvieron una potencia comparable a erlotinib en ensayos no-clínicos in vitro y en modelos tumorales in vivo. Estos metabolitos están presentes en el plasma a niveles < 10% de erlotinib y muestran una farmacocinética similar a la de erlotinib.
Eliminación: Erlotinib se excreta predominantemente por las heces en forma de metabolitos (>90%) y una pequeña cantidad de una dosis oral se elimina por vía renal (aproximadamente el 9%). Menos del 2% de la dosis administrada oralmente se excreta como sustancia sin alterar. En un análisis farmacocinético poblacional realizado en 591 pacientes que recibieron Tarceva como medicamento único, se determinó un aclaramiento aparente medio de 4,47 l/hora con una mediana de semivida de
36,2 horas. Por lo tanto, el tiempo en alcanzar la concentración plasmática en equilibrio se espera que sea de 7-8 días aproximadamente.
Farmacocinética en poblaciones especiales:
En base a los análisis farmacocinéticos poblacionales, no se ha observado relación clínicamente significativa entre el aclaramiento aparente predicho y la edad, peso, sexo y raza del paciente. Los factores de los pacientes que se correlacionaban con la farmacocinética de erlotinib fueron la bilirrubina total sérica, AAG y fumar en la actualidad. Las concentraciones séricas elevadas de bilirrubina total y las concentraciones de AAG se asociaron con una reducción del aclaramiento de erlotinib. No está clara la relevancia clínica de estas diferencias.
Sin embargo, los fumadores tuvieron un índice incrementado de aclaramiento de erlotinib. Esto fue confirmado en un estudio farmacocinético realizado en sujetos sanos que fumaban en el momento de realizar el estudio y en no fumadores, recibiendo ambos grupos una dosis oral única de 150 mg de erlotinib. La media geométrica de la Cmax fue 1056 ng/mL en no fumadores y 689 ng/mL en fumadores con una proporción media de fumadores versus no fumadores del 65,2% (95% CI: 44,3 a 95,9, p = 0,031). La media geométrica del AUC0_inf fue 18726 ng^h/mL en los no fumadores y 6718 ng^h/mL en los fumadores con una proporción media del 35,9% (95% CI: 23,7 a 54,3, p < 0,0001). La media geométrica de la C24h fue 288 ng/mL en no fumadores y 34,8 ng/mL en fumadores con una proporción media del 12,1% (95% CI: 4,82 a 30,2, p = 0,0001).
En un estudio pivotal fase III en fumadores activos con CPNM, se alcanzó una concentración plasmática en estado estacionario de 0,65 pg/mL (n=16), que fue aproximadamente 2 veces menor en aquellos que habían dejado de fumar o en pacientes que nunca habían fumado (1,28 pg/mL n=108). Este efecto se produjo junto a un aumento del 24% en el aclaramiento plasmático aparente de erlotinib. En un estudio fase I de escalada de dosis en pacientes que fueron fumadores activos con CPNM, el análisis de la farmacocinética indicó un aumento proporcional de la exposición a erlotinib en el estado de equilibrio, cuando la dosis de Tarceva se aumento de 150 mg a la dosis máxima tolerada de 300 mg. En este estudio, la concentración plasmática en estado estacionario para una dosis de 300 mg en fumadores activos fue de 1,22 pg/mL (n=17).
En base a los resultados de estudios farmacocinéticos, se debe aconsejar a los fumadores que dejen de fumar mientras estén en tratamiento con Tarceva, ya que, de lo contrario, las concentraciones plasmáticas podrían verse reducidas.
En base a los análisis farmacocinéticos poblacionales, la presencia de un opioide incrementó la exposic ión alrededor de un 11%.
Se llevó a cabo un segundo análisis farmacocinético poblacional incorporando los datos de erlotinib obtenidos de 204 pacientes con cáncer pancreático que fueron tratados con erlotinib y gemcitabina. Este análisis demostró que las covariantes que afectan al aclaramiento de erlotinib en los pacientes del estudio pancreático eran muy similares a los observados en el análisis farmacocinético previo en monoterapia. No se han identificado nuevos efectos covariantes. La co-administración de gemcitabina no tuvo efecto en el aclaramiento plasmático de erlotinib.
Población pediátrica: no se han realizado estudios específicos en pacientes pediátricos.
Población anciana: no se han realizado estudios específicos en pacientes ancianos.
Insuficiencia hepática: Erlotinib se aclara principalmente en el hígado. En pacientes con tumores sólidos y con insuficiencia hepática moderada (valor Child-Pugh 7- 9) la media geométrica del AUC0-t y la Cmax de erlotinib fue 27000 ng^h/mL y 805 ng/mL, respectivamente, en comparación con 29300 ng^h/mL y 1090 ng/mL en pacientes con buena función hepática incluyendo pacientes con cáncer de hígado primario o metástasis hepáticas. Aunque la Cmax fue más baja de forma estadísticamente significativa en pacientes con insuficiencia hepática moderada, se consideró que esta diferencia no era clínicamente relevante. No hay datos disponibles respecto a la influencia de la disfunción hepática grave en la farmacocinética de erlotinib. En análisis farmacocinéticos poblacionales, el aumento de las concentraciones séricas de la bilirrubina total se asoció con un índice de aclaramiento de erlotinib más lento.
Insuficiencia renal: Erlotinib y sus metabolitos no se excretan significativamente vía renal ya que menos del 9% de una dosis única es excretada en la orina. En análisis farmacocinéticos poblacionales, no se observó una relación significativa entre el aclaramiento de erlotinib y el aclaramiento de creatinina, pero no hay datos disponibles en pacientes con aclaramiento de creatinina < 15 ml/min.
5.3 Datos preclínicos sobre seguridad
Los efectos debidos a dosis crónicas observados en al menos una especie animal o estudio incluyeron efectos en la córnea (atrofia, ulceración), piel (degeneración folicular e inflamación, enrojecimiento y alopecia), ovarios (atrofia), hígado (necrosis hepática), riñón (necrosis papilar renal y dilatación tubular), y tracto gastrointestinal (vaciado gástrico retardado y diarrea). Los parámetros de las células rojas sanguíneas disminuyeron y las células blancas sanguíneas, principalmente neutrófilos, aumentaron. Hubo aumentos en ALT, AST y bilirrubina relacionados con el tratamiento. Estos hallazgos se observaron para exposiciones muy por debajo de exposiciones clínicamente relevantes.
En base al mecanismo de acción, erlotinib puede ser potencialmente teratógeno. Los datos obtenidos en pruebas de toxicidad reproductiva realizadas a ratas y conejos a dosis cercanas a la dosis máxima tolerada y/o maternalmente tóxicas mostraron toxicidad reproductiva (embriotoxicidad en ratas, reabsorción del embrión y toxicidad fetal en conejos) y de desarrollo (disminución en el crecimiento de las crías y en la supervivencia en ratas) pero no resultó teratogénico y no dañó la fertilidad. Estos hallazgos fueron observados a exposiciones clínicamente relevantes.
El resultado de estudios de genotoxicidad convencionales con erlotinib fue negativo. Los resultados de carcinogenicidad realizados con erlotinib durante dos años en ratas y ratones expuestos hasta dosis superiores a la exposición terapéutica en humanos (hasta 2 veces y 10 veces más altas, respectivamente, basado en la Cmax y/o AUC) fueron negativos.
En ratas se ha observado una reacción fototóxica media en la piel tras irradiación UV.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Núcleo del comprimido'.
Lactosa monohidrato Celulosa microcristalina (E460)
Almidón glicolato sódico Tipo A Laurilsulfato sódico Estearato magnésico (E470b)
Cubierta del comprimido:
Hidroxipropil celulosa (E463)
Dióxido de titanio (E171)
Macrogol
Hipromellosa (E464)
6.2 Incompatibilidades
No procede.
6.3 Período de validez
4 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Blister de PVC sellado con una lámina de aluminio que contiene 30 comprimidos.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Roche Registration Limited 6 Falcon Way Shire Park
Welwyn Garden City AL7 1TW Reino Unido.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/311/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 19 de Septiembre 2005 Fecha de la última renovación: 2 de Julio 2010
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de
Medicamentos
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Roche Pharma AG Emil-Barell-Strasse 1 D-79639 Grenzach-Wyhlen Germany
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107quarter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Una actualización del PGR debe presentarse en Marzo 2016
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Tarceva 25 mg comprimidos recubiertos con película Erlotinib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 25 mg de erlotinib (como erlotinib clorhidrato).
3. LISTA DE EXCIPIENTES
Contiene lactosa monohidrato. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral
Leer el prospecto antes de utilizar este medicamento
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Roche Registration Limited 6 Falcon Way Shire Park
Welwyn Garden City AL7 1TW Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/311/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
tarceva 25 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
|
1. |
NOMBRE DEL MEDICAMENTO |
Tarceva 25 mg comprimidos recubiertos con película Erlotinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Roche Registration Ltd.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Tarceva 100 mg comprimidos recubiertos con película Erlotinib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 100 mg de erlotinib (como erlotinib clorhidrato).
3. LISTA DE EXCIPIENTES
Contiene lactosa monohidrato. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral
Leer el prospecto antes de utilizar este medicamento
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Roche Registration Limited 6 Falcon Way Shire Park
Welwyn Garden City AL7 1TW Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/311/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
tarceva 100 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
|
1. |
NOMBRE DEL MEDICAMENTO |
Tarceva 100 mg comprimidos recubiertos con película Erlotinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Roche Registration Ltd.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Tarceva 150 mg comprimidos recubiertos con película Erlotinib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 150 mg de erlotinib (como erlotinib clorhidrato).
3. LISTA DE EXCIPIENTES
Contiene lactosa monohidrato. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral
Leer el prospecto antes de utilizar este medicamento
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Roche Registration Limited 6 Falcon Way Shire Park
Welwyn Garden City AL7 1TW Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/311/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
tarceva 150 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
|
1. |
NOMBRE DEL MEDICAMENTO |
Tarceva 150 mg comprimidos recubiertos con película Erlotinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Roche Registration Ltd.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Tarceva 25 mg comprimidos recubiertos con película Tarceva 100 mg comprimidos recubiertos con película Tarceva 150 mg comprimidos recubiertos con película
Erlotinib
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto:
1. Qué es Tarceva y para qué se utiliza
2. Qué necesita saber antes de tomar Tarceva
3. Cómo tomar Tarceva
4. Posibles efectos adversos
5. Conservación de Tarceva
6. Contenido del envase e información adicional
1. Qué es Tarceva y para qué se utiliza
Tarceva contiene el principio activo erlotinib. Tarceva es un medicamento utilizado para tratar el cáncer y actúa impidiendo la actividad de una proteína llamada receptor del factor de crecimiento epidérmico (EGFR). Se sabe que esta proteína está implicada en el crecimiento y propagación de las células tumorales.
Tarceva está indicado para adultos. Le pueden recetar este medicamento si padece cáncer de pulmón no microcítico en un estado avanzado. Se lo pueden recetar como tratamiento inicial o como tratamiento si su enfermedad permanece prácticamente sin cambios tras la quimioterapia inicial, ya que sus células cancerígenas presentan mutaciones específicas en el EGFR. Se lo pueden recetar también si la quimioterapia anterior no ha ayudado a frenar su enfermedad.
Le pueden recetar también este medicamento en combinación con otro tratamiento denominado gemcitabina si padece cáncer de páncreas en un estado metastásico.
2. Qué necesita saber antes de tomar Tarceva No tome Tarceva:
• si es alérgico a erlotinib o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones:
• si está tomando otros medicamentos que pueden aumentar o disminuir la cantidad de erlotinib en su sangre o influir en su efecto (por ejemplo, antifungicos como ketoconazol, inhibidores de la proteasa, eritromicina, claritromicina, fenitoína, carbamazepina, barbitúricos, rifampicina, ciprofloxacino, omeprazol, ranitidina, Hipérico (Hierba de San Juan) o inhibidores del proteasoma), consulte a su médico. En algunos casos, estos medicamentos pueden disminuir la eficacia o aumentar los efectos adversos de Tarceva y, por tanto, su médico necesitaría ajustar su tratamiento. Su médico debe evitar tratarle con estos medicamentos mientras esté tomando Tarceva.
• si toma anticoagulantes (medicamentos que ayudan a prevenir la aparición de trombosis o coágulos, por ej. warfarina) ya que Tarceva puede hacerle más propenso a sufrir hemorragias. Consulte a su médico, él necesitará hacerle algunos análisis de sangre de forma regular.
• si está tomando estatinas (medicamentos que disminuyen el nivel de colesterol en sangre), puesto que Tarceva puede aumentar el riesgo de problemas musculares relacionados con la estatina que, en raras ocasiones, pueden llevar a degradación muscular (rabdomiolisis) provocando daño en el riñón, consulte a su médico.
• si usa lentes de contacto y/o tiene antecedentes de problemas en el ojo como ojos muy secos, inflamación de la parte frontal del ojo (cornea) o úlceras que comprenden la parte frontal del ojo, informe a su médico.
Ver también a continuación “Uso de Tarceva con otros medicamentos”
Debe comentar a su médico:
• si tiene de pronto dificultad para respirar asociada con tos o fiebre ya que, si es así, su médico puede que tenga que darle otros medicamentos e interrumpir su tratamiento con Tarceva.
• si tiene diarrea ya que su médico puede que tenga que darle un antidiarreico (por ejemplo loperamida).
• de forma inmediata en caso de que tenga diarrea persistente o grave, náuseas, pérdida de apetito o vómitos ya que su médico puede que tenga que interrumpir la administración de Tarceva y tener que tratarle a usted en el hospital.
• si tiene dolor agudo en el abdomen, ampollas o descamación grave de la piel. Su médico puede tener que interrumpir o poner fin a su tratamiento.
• si presenta empeoramiento o enrojecimiento agudo y dolor en el ojo, mayor lagrimeo, visión borrosa y/o sensibilidad a la luz, por favor informe a su médico o enfermera inmediatamente ya que puede necesitar tratamiento urgente (ver más abajo Posibles Efectos Adversos).
• si también está tomando una estatina y sufre dolor muscular inexplicable, dolor con la palpación, debilidad o calambres. Su médico puede tener que interrumpir o suspender su tratamiento.
Ver también sección 4 “Posibles efectos adversos”.
Enfermedad del hígado o riñón:
No se sabe si Tarceva tiene un efecto diferente en caso de que su hígado o sus riñones no funcionen normalmente. No se recomienda el tratamiento con este medicamento si tiene una enfermedad hepática grave o una enfermedad renal grave.
Trastorno de la glucuronidación, como el síndrome de Gilbert
Si tiene un trastorno de la glucuronidación, como el síndrome de Gilbert, su médico le deberá administrar el tratamiento con Tarceva con precaución.
Fumadores
Es recomendable que deje de fumar si está siendo tratado con Tarceva ya que fumar puede disminuir la cantidad de este medicamento en la sangre.
Niños y adolescentes
Tarceva no ha sido estudiado en pacientes menores de 18 años. No se recomienda el tratamiento con este me dicamento en niños y adolescentes.
Uso de Tarceva con otros medicamentos
Informe a su médico o farmacéutico si está tomando o ha tomado recientemente otros medicamentos o podría tener que tomar cualquier otro medicamento.
Toma de Tarceva con los alimentos y bebidas
No tome Tarceva con alimentos. Ver también sección 3 “Cómo tomar Tarceva”
Embarazo y lactancia
Evite quedarse embarazada mientras tome Tarceva. Si puede quedarse embarazada, utilice métodos anticonceptivos adecuados durante el tratamiento y durante, al menos, las 2 semanas siguientes a la toma del último comprimido de Tarceva.
Si se queda embarazada mientras toma Tarceva, informe a su médico inmediatamente ya que él decidirá la conveniencia o no de que continúe con el tratamiento.
No debe dar el pecho a su bebé si está tomando Tarceva.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
No se han estudiado los posibles efectos de Tarceva sobre la capacidad de conducir y usar máquinas pero es muy improbable que su tratamiento afecte a esta capacidad.
Hipersensibilidad
Tarceva contiene un azúcar llamado lactosa monohidrato.
Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar Tarceva.
3. Cómo tomar Tarceva
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas.
El comprimido debe tomarse al menos una hora antes o dos horas después de haber ingerido alimentos.
La dosis recomendada es un comprimido de Tarceva 150 mg cada día si padece cáncer de pulmón no microcítico.
La dosis recomendada es un comprimido de Tarceva 100 mg cada día si padece cáncer de páncreas metastásico. Tarceva se utiliza en combinación con gemcitabina.
Su médico puede ajustar su dosis en intervalos de 50 mg. Por esta razón, Tarceva está disponible en dosis de 25 mg, 100 mg y 150 mg para ajustar los diferentes regímenes de dosis
Si toma más Tarceva del que debe
Contacte inmediatamente con su médico o farmacéutico.
Puede que tenga un aumento de los efectos adversos y su médico tenga que interrumpir su tratamiento. Si olvidó tomar Tarceva
Si olvida tomar una o más dosis de Tarceva, contacte tan pronto como pueda con su médico o farmacéutico.
No tome una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Tarceva
Es importante tomar Tarceva todos los días y durante todo el tiempo que su médico se lo recete.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede tener efectos adversos, aunque no todas las personas los sufran.
Si tiene alguno de los efectos adversos mencionados, contacte con su médico tan pronto como sea posible. En algunos casos, su médico puede que tenga que reducirle la dosis o interrumpir el tratamiento con Tarceva.
• Diarreas y vómitos (muy frecuentes: puede afectar a más de 1 de cada diez personas). La diarrea grave y persistente puede hacer que se disminuya el potasio en sangre y que se disminuya la función de su riñón, especialmente si usted está siendo tratado con otros tratamientos quimioterápicos al mismo tiempo. En caso de que se le agrave la diarrea o que ésta sea persistente, contacte con su médico inmediatamente ya que su médico puede necesitar que se le administre un tratamiento en el hospital.
• Irritación de los ojos debido a conjuntivitis/queratoconjuntivitis (muy frecuente: puede afectar a más de 1 de cada diez personas) y queratitis (frecuente: puede afectar hasta 1 de cada 10 personas).
• Forma de irritación de los pulmones llamada enfermedad pulmonar intersticial (poco frecuente en pacientes europeos; frecuente en pacientes de origen japonés: puede afectar hasta 1 de cada 100 personas en Europa y hasta a 1 de cada 10 personas en Japón). Esta enfermedad puede también estar relacionada con el avance natural de su enfermedad y, en algunos casos, puede ser mortal. Si de pronto tiene síntomas como dificultad para respirar asociada con tos o fiebre, contacte inmediatamente con su médico ya que podría sufrir esta enfermedad. Su médico podría decidir interrumpir permanentemente su tratamiento con Tarceva.
• Se han observado perforaciones gastrointestinales (poco frecuente: puede afectar hasta 1 de cada 100 personas). Si tiene dolor abdominal intenso informe a su médico. Informe también a su médico si previamente ha tenido una úlcera péptica o enfermedad diverticular, ya que esto puede aumentar el riesgo de sufrir perforaciones gastrointestinales.
• En raros casos se observó fallo hepático (raro: puede afectar hasta 1 de cada 1.000 personas). Si sus análisis de sangre indican cambios graves en su función hepática, su médico puede necesitar interrumpir su tratamiento.
Efectos adversos muy frecuentes (puede afectar a más de 1 de cada 10 personas):
• Erupciones que pueden aparecer o empeorar en zonas expuestas al sol. Si se expone al sol, sería aconsejable que utilizara ropa para protegerse y/o usar protección solar (por ejemplo que contenga minerales).
• Infección
• Pérdida de apetito, pérdida de peso
• Depresión
• Dolor de cabeza, sensación de alteración en la piel o entumecimiento en las extremidades
• Dificultad al respirar, tos
• Nauseas
• Irritación de la boca
• Dolor de estómago, indisgestión y flatulencia
• Resultados anormales en los análisis de sangre realizados para comprobar la función del hígado.
• Picores, sequedad en la piel y pérdida de pelo
• Cansancio, fiebre, rigidez
Efectos adversos frecuentes (puede afectar hasta 1 de cada 10 personas):
• Hemorragias en la nariz
• Hemorragias en el estómago o en el intestino
• Reacciones inflamatorias alrededor de la uña
• Infección de los folículos del pelo
• Acné
• Grietas en la piel (fisuras en la piel)
• Función renal reducida (cuando se da fuera de las indicaciones aprobadas en combinación con la quimioterapia)
Efectos adversos poco frecuentes (puede afectar hasta 1 de cada 100 personas):
• Cambio en las pestañas
• Excesiva presencia de pelo corporal y facial con un patrón de distribución masculino
• Cambios en las cejas
• Uñas quebradizas y sueltas
Efectos adversos raros (pueden afectar hasta 1 de cada 1.000 personas):
• Dolor y enrojecimiento u hormigueo de las manos y/o los pies (Síndrome eritrodisestesia palmo-plantar)
Efectos adversos muy raros (puede afectar hasta 1 de cada 10.000 personas):
• Casos de ulceración o perforación de la córnea
• Ampollas o descamación grave de la piel (indicativo de síndrome de Stevens-Johnson)
• Inflamación de la zona coloreada del ojo (iris)
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Tarceva
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja después de EXP o CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Compo sición de Tarceva
• El principio activo de Tarceva es erlotinib. Cada comprimido recubierto con película contiene 25, 100 ó 150 mg de erlotinib (como erlotinib clorhidrato) dependiendo de la dosis.
• Los demás componentes son:
Núcleo del comprimido: lactosa monohidrato, celulosa microcristalina, almidón glicolato sódico, laurilsulfato sódico, estearato magnésico (ver también sección 2 para la lactosa monohidrato). Cubierta del comprimido: hipromellosa, hidroxipropil celulosa, dióxido de titanio, macrogol.
Aspecto del producto y contenido del envase
Tarceva 25 mg se presenta en forma de comprimido recubierto con película, redondo, de color blanco a amarillento con el grabado “T 25” en una cara y está disponible en envases de 30 comprimidos. Tarceva 100 mg se presenta en forma de comprimido recubierto con película, redondo, de color blanco a amarillento con el grabado “T 100” en una cara y está disponible en envases de 30 comprimidos. Tarceva 150 mg se presenta en forma de comprimido recubierto con película, redondo, de color blanco a amarillento con el grabado “T 150” en una cara y está disponible en envases de 30 comprimidos.
Titular de la autorización de comercialización
Roche Registration Limited 6 Falcon Way Shire Park
Welwyn Garden City AL7 1TW Reino Unido
Responsable de la fabricación
Roche Pharma AG Emil-Barrell-Str. 1 D-79639 Grenzach-Wyhlen Alemania
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
N.V. Roche S.A.
Tél/Tel: +32 (0) 2 525 82 11
Etarapna
Pom Etarapua EOOfl Tea: +359 2 818 44 44
Ceská republika
Roche s. r. o.
Tel: +420 - 2 20382111
Danmark
Roche a/s
Tlf: +45 - 36 39 99 99
Deutschland
Roche Pharma AG Tel: +49 (0) 7624 140
medicamento dirigiéndose al representante local del
|
Eesti Roche Eesti OÜ Tel: + 3 72 - 6 177 380 |
Norge Roche Norge AS Tlf: +47 - 22 78 90 00 |
|
ELXáóa Roche (Hellas) A.E. Tnk: +30 210 61 66 100 |
Osterreich Roche Austria GmbH Tel: +43 (0) 1 27739 |
|
España Roche Farma S.A. Tel: +34 - 91 324 81 00 |
Polska Roche Polska Sp.z o.o. Tel: +48 - 22 345 18 88 |
|
France Roche Tél: +33 (0)1 47 61 40 00 |
Portugal Roche Farmacéutica Química, Lda Tel: +351 - 21 425 70 00 |
|
Hrvatska Roche d.o.o. Tel: + 385 1 47 22 333 |
Romania Roche Romania S.R.L. Tel: +40 21 206 47 01 |
|
Ireland Roche Products (Ireland) Ltd. Tel: +353 (0) 1 469 0700 |
Slovenija Roche farmacevtska druzba d.o.o. Tel: +386 - 1 360 26 00 |
|
Ísland Roche a/s c/o Icepharma hf Sími: +354 540 8000 |
Slovenská republika Roche Slovensko, s.r.o. Tel: +421 - 2 52638201 |
|
Italia Roche S.p.A. Tel: +39 - 039 2471 |
Suomi/Finland Roche Oy Puh/Tel: +358 (0) 10 554 500 |
|
Kúnpoq r.A.Exapáxn? & Era AxS. Tnk: +357 - 22 76 62 76 |
Sverige Roche AB Tel: +46 (0) 8 726 1200 |
|
Latvija Roche Latvija SIA Tel: +371 - 6 7039831 |
United Kingdom Roche Products Ltd. Tel: +44 (0) 1707 366000 |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos : http://www.ema.europa.eu/.
94