Tantum Verde 0,255 Mg/Pulsacion Solucion Para Pulverizacion Bucal
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
TANTUM VERDE 0,255 mg/pulsación Solución para pulverización bucal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada pulverización contiene:
Bencidamina hidrocloruro............................... 0, 255 mg
Excipientes:
Sorbitol líquido cristalizable (E-420)..................6,8 mg
Parahidroxibenzoato de propilo (E-216)............ 0,024 mg
Parahidroxibenzoato de metilo (E-218).......... 0,210 mg
Para la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución para pulverización bucal.
La solución es transparente incolora.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Alivio local sintomático de las irritaciones de la garganta y de la boca que cursen con dolor y sin fiebre.
4.2. Posología y forma de administración
Via bucal
Adultos y niños mayores de 12 años: Aplicar de 3 a 6 pulverizaciones al día durante 4-6 días. No se debe comer ni beber hasta después de 1 hora de utilizar el medicamento.
En un número limitado de pacientes, las ulceraciones bucofaríngeas suelen ser signo de patología graves. Por lo tanto los pacientes en los que los síntomas no desaparecen en 3 días, empeoran o aparece fiebre deben consultar al médico o dentista.
El tratamiento no debe exceder de los 6 días
No se aconseja usarlo en niños menores de 12 años, salvo mejor criterio médico.
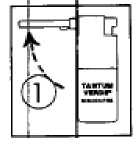
(Dibujo 1) Levantar la cánula pulverizadora.
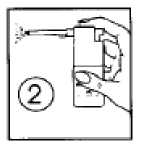
(Dibujo 2) Introducir la cánula en la boca y dirigir la pulverización hacia la zona dolorida. Apretar con el dedo sobre la zona rallada del pulsador.
En el primer uso del producto, apretar el pulsador varias veces al vacío hasta obtener una pulverización regular.
Dibujo 1
Dibujo 2
4.3. Contraindiuadiuiiei
Hipersensibilidad a la bencidamina o a alguno de los excipientes de este medicamento.
4.4. Advertencias y precauciones especiales de empleo
El uso de bencidamina no está recomendado en pacientes con hipersensibilidad al ácido salicílico y/o AINE.
En pacientes que hayan sufrido o que sufran asma bronquial, puede provocar broncoespasmo, por lo que debe tenerse precaución con estos pacientes.
Advertencias sobre excipientes
Este medicamento contiene sorbitol. Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento. Puede tener un ligero efecto laxante.
Por contener parahidroxibenzoato de metilo y parahidroxibenzoato de propilo puede provocar reacciones alérgicas (posiblemente retardadas).
4.5. Interacciones con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción en humanos.
4.6. Embarazo y lactancia
No existen datos suficientes sobre la utilización de bencidamina en mujeres embarazadas ni durante la lactancia. No se ha estudiado su excreción en la leche materna. Los estudios en animales son insuficientes para determinar las reacciones durante el embarazo y lactancia (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos.
TANTUM VERDE no debe ser utilizado durante el embarazo ni durante la lactancia.
4.7. Efectos sobre la capacidad para conducir vehículos y utilizar máquinas
La influencia de TANTUM VERDE, a las dosis indicadas, sobre la capacidad para conducir y utilizar máquinas es nula.
4.8. Reacciones adversas Trastornos gastrointestinales:
Raros (> 1/ 10.000, < 1/ 1.000): escozor y sequedad de boca.
Trastornos del sistema inmunológico:
Raros ( > 1 / 10.000, < 1/ 1.000): reacciones de hipersensibilidad.
Trastornos respiratorios, torácicos y mediastínicos:
Muy raros ( < 1/ 10.000): laringospasmo.
Trastornos de la piel y del tejido subcutáneo:
Poco frecuentes ( > 1/ 1.000, < 1/ 100): fotosensibilidad.
Muy raros ( < 1/ 10.000): angioedema.
4.9. Sobredosificación
Debido a su uso tópico, no es probable que se produzcan cuadros de intoxicación.
No obstante, en caso de sobredosis puede producirse agitación psicomotora, ansiedad, alucinaciones y convulsiones. No tiene tratamiento específico, debiéndose proceder, en caso necesario a lavado de estómago y a una terapia sintomática. Debe mantenerse una hidratación adecuada del paciente.
5. PROPIEDADES FARMACOLOGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Preparados estomatológicos. Otros fármacos para el tratamiento oral local: Bencidamina. Código ATC: A01AD02.
Los estudios clínicos demuestran que la bencidamina es eficaz en el alivio del dolor debido a los procesos irritativos locales de la boca y faringe. Además, la bencidamina posee un moderado efecto anestésico local.
5.2. Propiedades farmacocinéticas
Cuando la bencidamina se administra localmente, se observa una acumulación en los tejidos inflamados donde se alcanzan concentraciones eficaces por su capacidad para penetrar en el tejido epitelial.
Dicha absorción a través de la mucosa orofaríngea está demostrada por los niveles de bencidamina en suero humano. Los niveles plasmáticos máximos se alcanzan al cabo de 2 horas.
La excreción de la bencidamina se produce principalmente por vía urinaria, mayoritariamente en forma de metabolitos inactivos y productos de conjugación.
5.3. Datos preclínicos sobre seguridad
Se estudió la toxicidad peri y posnatal en estudios de toxicidad reproductiva en ratas y conejos, con concentraciones plasmáticas muy superiores a las observadas después de una única dosis terapéutica oral (más de 40 veces). En estos estudios no se observaron efectos teratógenos. Los datos farmacocinéticos disponibles, no permiten establecer la relevancia clínica de los estudios de toxicidad reproductiva. Puesto que los estudios preclínicos son deficientes y por lo tanto son de valor limitado, no proporcionan más información adicional al prescriptor que la ya incluida en otros apartados de la ficha técnica.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Sorbitol líquido cristalizable (E-420),
Glicerol (E-422),
Polisorbato 20,
Sacarina sódica,
Acesulfamo potásico,
Parahidroxibenzoato de metilo (E-218), Parahidroxibenzoato de propilo (E-216), Aroma de menta,
Agua purificada.
6.2. Incompatibilidades
No procede.
6.3. Período de validez 3 años.
6.4. Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5. Naturaleza y contenido del envase
Frasco de HDPE blanco con bomba dosificadora mecánica y pulsador de polietileno/polipropileno, conteniendo 15 ml de una solución al 0,15%.
6.6. Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con las normativas locales o se procederá a su devolución a la farmacia.
7. Titular de la autorización de comercialización
ANGELINI FARMACEUTICA, S.A.
C. Osi, 7 08034 Barcelona