Sutent 12,5 Mg Capsulas Duras
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
SUTENT 12,5 mg cápsulas duras SUTENT 25 mg cápsulas duras SUTENT 37,5 mg cápsulas duras SUTENT 50 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cápsulas duras de 12,5 mg
Cada cápsula contiene malato de sunitinib, equivalente a 12,5 mg de sunitinib. Cápsulas duras de 25 mg
Cada cápsula contiene malato de sunitinib, equivalente a 25,0 mg de sunitinib. Cápsulas duras de 37,5 mg
Cada cápsula contiene malato de sunitinib, equivalente a 37,5 mg de sunitinib. Cápsulas duras de 50 mg
Cada cápsula contiene malato de sunitinib, equivalente a 50 mg de sunitinib. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura.
SUTENT 12,5 mg cápsulas duras
Cápsulas de gelatina con tapa naranja y cuerpo naranja, con “Pfizer” impreso en tinta blanca en la tapa y “STN 12.5 mg” en el cuerpo, y que contienen gránulos de color amarillo a naranja.
SUTENT 25 mg cápsulas duras
Cápsulas de gelatina con tapa color caramelo y cuerpo naranja, con “Pfizer” impreso en tinta blanca en la tapa y “STN 25 mg” en el cuerpo, y que contienen gránulos de color amarillo a naranja.
SUTENT 37,5 mg cápsulas duras
Cápsulas de gelatina con tapa amarilla y cuerpo amarillo, con “Pfizer” impreso en tinta negra en la tapa y “STN 37.5 mg” en el cuerpo, y que contienen gránulos de color amarillo a naranja.
SUTENT 50 mg cápsulas duras
Cápsulas de gelatina con tapa color caramelo y cuerpo color caramelo, con “Pfizer” impreso en tinta blanca en la tapa y “STN 50 mg” en el cuerpo, y que contienen gránulos de color amarillo a naranja.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tumor del estroma gastrointestinal (GIST)
SUTENT está indicado para el tratamiento de tumores malignos no resecables y/o metastásicos del estroma gastrointestinal (GIST) en adultos después del fracaso al tratamiento con imatinib debido a resistencia o intolerancia.
Carcinoma de células renales metastásico (CCRM)
SUTENT está indicado para el tratamiento del carcinoma de células renales avanzado/metastásico (CCRM) en adultos.
Tumores neuroendocrinos pancreáticos (pNET)
SUTENT está indicado para el tratamiento de tumores neuroendocrinos pancreáticos (pNET) bien diferenciados, no resecables o metastáticos, con progresión de la enfermedad en adultos.
La experiencia con SUTENT como tratamiento en primera línea es limitada (ver sección 5.1).
4.2 Posología y forma de administración
El tratamiento con sunitinib debe ser iniciado por un médico con experiencia en la administración de agentes anticancerosos.
Posología
En el caso de GIST y CCRM, la dosis recomendada de SUTENT es de 50 mg por vía oral una vez al día, durante un periodo de 4 semanas consecutivas, seguido por un periodo de 2 semanas de descanso (régimen 4/2) para completar un ciclo de 6 semanas.
En el caso de pNET, la dosis recomendada de SUTENT es de 37,5 mg por vía oral una vez al día, sin periodo de descanso programado.
Ajustes de dosis
Seguridad y tolerabilidad
En el caso de GIST y CCRM, se pueden aplicar modificaciones de la dosis con variaciones de 12,5 mg en base a la seguridad y la tolerabilidad individual. La dosis diaria no debe exceder de 75 mg ni estar por debajo de 25 mg.
En el caso de pNET, se pueden aplicar modificaciones de la dosis con variaciones de 12,5 mg en base a la seguridad y la tolerabilidad individual. La dosis máxima administrada en el estudio Fase 3 de pNET fue de 50 mg al día.
Puede ser necesario interrumpir la administración según la seguridad y la tolerabilidad individual.
Inhibidores/inductores del CYP3A4
La administración concomitante de sunitinib con inductores potentes del CYP3A4 como rifampicina, debe evitarse (ver secciones 4.4 y 4.5). Si esto no es posible, puede que sea necesario aumentar las dosis de sunitinib en tramos de 12,5 mg (hasta 87,5 mg al día en el caso de GIST y CCRM o de 62,5 mg al día para pNET) basándose en una cuidadosa monitorización de la tolerabilidad.
La administración concomitante de sunitinib con inhibidores potentes del CYP3A4, como el ketoconazol, debe evitarse (ver secciones 4.4 y 4.5). Si esto no es posible, puede que sea necesario reducir las dosis de sunitinib hasta un mínimo de 37,5 mg al día en el caso de GIST y CCRM o de 25 mg al día para pNET, basándose en una cuidadosa monitorización de la tolerabilidad.
Se debe considerar la elección de un medicamento alternativo para administración concomitante que no tenga o con un potencial mínimo para inducir o inhibir el CYP3A4.
Poblaciones especiales
Población pediátrica
No se ha establecido la seguridad ni la eficacia de sunitinib en pacientes por debajo de 18 años de edad.
Los datos actualmente disponibles son limitados y están descritos en las secciones 4.8, 5.1 y 5.2, sin embargo no se puede hacer una recomendación posológica.
Pacientes de edad avanzada (65 años de edad o mayores)
Aproximadamente un tercio de los pacientes en los estudios clínicos que recibieron sunitinib tenían 65 o más años de edad. No se observaron diferencias significativas ni en seguridad ni en eficacia entre los pacientes más jóvenes y los más mayores.
Insuficiencia hepática
No es necesario realizar un ajuste de dosis inicial cuando se administra sunitinib a pacientes con insuficiencia hepática leve o moderada (Child-Pugh Clases A y B). Sunitinib no ha sido estudiado en sujetos con alteración hepática severa (Child-Pugh Clase C) y por lo tanto, no se puede recomendar su uso en pacientes con alteración hepática severa (ver sección 5.2).
Insuficiencia renal
No es necesario realizar ajuste de la dosis inicial cuando se administra sunitinib a pacientes con insuficiencia renal (leve-grave) o con enfermedad renal terminal en hemodiálisis. Los ajustes de dosis posteriores se deben realizar en función de la seguridad y tolerabilidad individual (ver sección 5.2).
Forma de administración
SUTENT se administra por vía oral. Puede tomarse con o sin alimentos.
Si el paciente olvida tomar una dosis no se le debe administrar una dosis adicional. El paciente debe tomar la dosis prescrita habitual al día siguiente.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
La administración concomitante de inductores potentes del CYP3A4 debe evitarse ya que puede reducir la concentración plasmática de sunitinib (ver secciones 4.2 y 4.5).
La administración concomitante con inhibidores potentes del CYP3A4 debe evitarse ya que puede aumentar la concentración plasmática de sunitinib (ver secciones 4.2 y 4.5).
La decoloración de la piel, posiblemente debido al color del principio activo (amarillo) es una reacción adversa muy frecuente que ocurre en aproximadamente el 30% de los pacientes. Se debe advertir a los pacientes que la despigmentación del pelo o la piel también puede ocurrir durante el tratamiento con sunitinib. Otros efectos dermatológicos posibles pueden incluir sequedad, engrasamiento o agrietamiento de la piel, ampollas o erupción ocasional en las palmas de las manos y las plantas de los pies.
Las reacciones mencionadas anteriormente no fueron acumulativas, fueron normalmente reversibles y en general, no motivaron la suspensión del tratamiento. Se han notificado casos de pioderma gangrenoso, generalmente reversible tras la interrupción del tratamiento. Se han notificado casos de reacciones cutáneas graves, incluidos casos de eritema multiforme (EM) y casos que podían ser de síndrome de Stevens-Johnson (SSJ) y de necrólisis epidérmica tóxica (NET), algunos con desenlace mortal. Si se confirma la presencia de signos o síntomas de SSJ, NET o EM (por ejemplo, erupción cutánea progresiva, a menudo acompañada de ampollas o de lesiones en las mucosas), debe discontinuarse el tratamiento con sunitinib. Si se confirma el diagnóstico de SSJ o de NET, no debe reiniciarse el tratamiento. En algunos casos de sospecha de EM, los pacientes toleraron la reintroducción del tratamiento con sunitinib a una dosis inferior una vez resuelta la reacción; algunos de esos pacientes recibieron, además, tratamiento concomitante con corticoesteroides o antihistamínicos.
Hemorragia y hemorragia tumoral
Durante el período post-comercialización se han notificado acontecimientos hemorrágicos, algunos de ellos mortales, como hemorragia gastrointestinal, respiratoria, del tracto urinario y cerebral.
En un estudio de GIST en fase 3 se notificaron acontecimientos hemorrágicos en el 18% de los pacientes tratados con sunitinib, en comparación con el 17% de los pacientes que recibieron placebo. De los pacientes con CCRM que no habían recibido tratamiento previo para la enfermedad avanzada y que recibían sunitinib, el 39% tuvo acontecimientos hemorrágicos en comparación con el 11% de los pacientes que recibieron interferón alfa. Diecisiete pacientes (4,5%) en tratamiento con sunitinib versus 5 pacientes (1,7%) que recibieron interferón alfa presentaron acontecimientos hemorrágicos de grado 3 o superiores. De los pacientes que recibieron tratamiento con sunitinib para el CCRM resistente a citoquinas, 26% presentaron hemorragias. Se observaron acontecimientos hemorrágicos, excluyendo epistaxis, en el 21,7% de los pacientes que recibieron sunitinib en el estudio fase 3 de pNET en comparación con el 9,85% de los pacientes que recibieron placebo. La valoración rutinaria de este acontecimiento debe incluir recuentos sanguíneos completos y examen físico.
La epistaxis fue la reacción adversa hemorrágica más frecuente, habiendo sido notificada en aproximadamente la mitad de los pacientes con tumores sólidos que experimentaron acontecimientos hemorrágicos. Algunos de estos acontecimientos de epistaxis fueron graves, si bien muy raramente mortales.
Se han notificado acontecimientos de hemorragia tumoral, en ocasiones asociados con necrosis tumoral; algunos de estos acontecimientos hemorrágicos fueron mortales.
En ensayos clínicos, la hemorragia tumoral ocurrió en aproximadamente el 2% de los pacientes con GIST. Estos acontecimientos pueden ocurrir de forma repentina, y en el caso de los tumores pulmonares, pueden presentarse como hemoptisis grave y amenazante para la vida o como hemorragia pulmonar. Se han observado casos de hemorragia pulmonar, algunos con desenlace mortal, en ensayos clínicos y se han notificado en la experiencia postcomercialización en pacientes tratados con sunitinib para CCRM, GIST y cáncer de pulmón. SUTENT no está aprobado para el uso en pacientes con cáncer de pulmón.
Los pacientes que reciben tratamiento concomitante con anticoagulantes (por ejemplo warfarina,
acenocumarol) pueden ser monitorizados periódicamente mediante recuento sanguíneo completo (plaquetas), factores de coagulación (PT/INR) y examen físico.
Trastornos gastrointestinales
Las reacciones adversas gastrointestinales que se notificaron más frecuentemente fueron diarrea, náuseas/vómitos, dolor abdominal, dispepsia y estomatitis/dolor bucal; también se han notificado casos de esofagitis (ver sección 4.8).
El tratamiento de soporte de las reacciones adversas gastrointestinales que requieren tratamiento puede incluir medicación con propiedades antieméticas, antidiarreicas o antiácidas.
Se han producido complicaciones gastrointestinales graves, algunas veces mortales, incluyendo perforación intestinal, en paciente con tumores intra-abdominales tratados con sunitinib. En el ensayo en fase 3 de GIST, el 0,98% de los pacientes que recibieron placebo presentaron hemorragia gastrointestinal mortal.
Hipertensión
La hipertensión fue una reacción adversa muy frecuente notificada en ensayos clínicos. La dosis de sunitinib fue reducida o su administración se suspendió temporalmente en aproximadamente el 2,7% de los pacientes que experimentaron hipertensión. No se interrumpió el tratamiento con sunitinib de forma permanente en ninguno de estos pacientes. En el 4,7% de los pacientes con tumores sólidos se produjo hipertensión severa (>200 mmHg sistólico ó 110 mmHg diastólico). En el estudio de CCRM en pacientes que no habían recibido tratamiento previo para la enfermedad avanzada, el 33,9% de los pacientes que recibieron sunitinib y el 3,6% de los pacientes que recibieron IFN-a experimentaron hipertensión. Ésta fue grave en el 12% de los pacientes sin tratamiento previo que recibieron sunitinib y en <1% de los pacientes con IFN-a. Se notificó hipertensión en el 26,5% de los pacientes que recibieron sunitinib en un ensayo fase 3 en pNET, en comparación con el 4,9% de los pacientes que recibieron placebo. Se observó hipertensión severa en el 10% de los pacientes con pNET en el brazo sunitinib y en el 3% de los pacientes en placebo. Se debe someter a los pacientes a un seguimiento y control adecuado de la tensión arterial. Se recomienda la suspensión temporal del tratamiento en pacientes que presenten hipertensión grave no controlada mediante intervención médica. Se puede reanudar el tratamiento una vez que la hipertensión esté adecuadamente controlada.
Trastornos hematológicos
Se notificaron recuentos absolutos disminuidos de neutrófilos, de intensidad de grado 3 y 4 respectivamente, en el 10% y en el 1,7% de los pacientes del estudio fase 3 en GIST, en el 16% y en el 1,6% de los pacientes del estudio fase 3 en CCRM, y en el 13% y 2,4% de pacientes en el ensayo fase 3 de pNET. Se comunicaron recuentos disminuidos de plaquetas de intensidad de grado 3 y 4 respectivamente, en el 3,7% y en el 0,4% de los pacientes del estudio fase 3 en GIST, en el 8,2% y en el 1,1% de los pacientes del estudio fase 3 en CCRM, y en el 3,7% y 1,2% de los pacientes en el ensayo fase 3 de pNET. Los acontecimientos mencionados no fueron acumulativos, fueron normalmente reversibles y en general, no motivaron la suspensión del tratamiento. Ninguno de estos acontecimientos de los estudios fase 3 fue mortal, aunque a lo largo de la experiencia postcomercialización se han notificado raramente acontecimientos hematológicos mortales, incluyendo hemorragia asociada a trombocitopenia e infecciones neutropénicas.
Se ha observado la aparición de anemia tanto de forma temprana como tardía durante el tratamiento con sunitinib; se ha notificado grado 3 en 4 casos.
Se deben realizar recuentos sanguíneos completos al principio de cada ciclo de tratamiento en los pacientes que reciben tratamiento con sunitinib.
Se han notificado acontecimientos cardiovasculares, incluyendo fallo cardiaco, cardiomiopatía, isquemia e infarto de miocardio, algunos de ellos mortales, en pacientes tratados con sunitinib. Estos datos sugieren que sunitinib incrementa el riesgo de cardiomiopatía. En los pacientes tratados no se han identificado factores de riesgo adicionales específicos para cardiomiopatías inducidas por sunitinib aparte del efecto específico del medicamento. Se debe usar sunitinib con precaución en los pacientes con riesgo o antecedentes de estos eventos.
En los ensayos clínicos, se produjeron disminuciones en la fracción de eyección del ventrículo izquierdo (FEVI) de > 20% y por debajo del límite inferior normal en aproximadamente el 2% de los pacientes con GIST tratados con sunitinib, en el 4% de los pacientes con CCRM resistente a citoquinas y en el 2% de los pacientes con GIST tratados con placebo. No parece que estas disminuciones en la FEVI hayan sido progresivas y en muchas ocasiones mejoraron durante la continuación del tratamiento. En el ensayo en pacientes con CCRM que no habían recibido tratamiento previo para la enfermedad avanzada, el 27% de los pacientes tratados con sunitinib y el 15% de los tratados con IFN-a tuvieron unos valores de FEVI por debajo del límite inferior del valor normal. A dos pacientes (<1%) que recibieron sunitinib se les diagnosticó insuficiencia cardiaca congestiva (ICC).
En pacientes con GIST, en el 1,2% de los pacientes tratados con sunitinib y en el 1% de los pacientes tratados con placebo se notificaron ‘insuficiencia cardiaca’, ‘insuficiencia cardiaca congestiva’ o ‘insuficiencia ventricular izquierda’. En el ensayo pivotal fase 3 de GIST (n = 312), hubo un 1% de reacciones cardiacas mortales relacionadas con el tratamiento en cada uno de los brazos del ensayo (es decir, tanto en el brazo de sunitinib como en el brazo placebo). En un ensayo en fase 2 en pacientes con CCRM resistente a citoquinas, el 0,9% de pacientes experimentaron infarto de miocardio mortal relacionado con el tratamiento, y en el ensayo en fase 3 en pacientes con CCRM que no habían recibido tratamiento previo para la enfermedad avanzada presentaron acontecimientos cardiacos mortales el 0,6% de los pacientes en el brazo de IFN-a y 0% de pacientes en el brazo de sunitinib. En el ensayo fase 3 de pNET, un paciente (1%) que recibió sunitinib experimentó una insuficiencia cardiaca mortal relacionada con el tratamiento. La relación, si la hay, entre la inhibición del receptor de tirosina kinasa (RTK) y la función cardiaca no está clara.
Fueron excluidos de los ensayos clínicos con sunitinib los pacientes que presentaron acontecimientos cardiacos dentro de los 12 meses previos a la administración de sunitinib, tales como infarto de miocardio (incluyendo angina grave/inestable), bypass arterial coronario/periférico, insuficiencia cardiaca congestiva sintomática (ICC), accidente cerebrovascular o ataque isquémico transitorio, o embolismo pulmonar. Se desconoce si los pacientes con estas patologías concomitantes pueden encontrarse en un riesgo más alto de desarrollar disfunción del ventrículo izquierdo relacionada con el medicamento.
Se ha de realizar una estrecha monitorización en busca de signos y síntomas de ICC, especialmente en pacientes con factores de riesgo cardiacos y/o antecedentes de enfermedad coronaria Se aconseja a los médicos que valoren este riesgo frente a los beneficios potenciales del medicamento. Estos pacientes deben ser cuidadosamente monitorizados en relación con los signos clínicos y síntomas de ICC mientras reciben sunitinib. Deben considerarse evaluaciones basales y periódicas de la FEVI mientras el paciente esté recibiendo sunitinib. En pacientes sin factores de riesgo cardiacos, debe considerarse una evaluación basal de la fracción de eyección.
En presencia de manifestaciones clínicas de ICC, se recomienda la suspensión de sunitinib. La administración de sunitinib debe interrumpirse y/o reducirse la dosis en pacientes sin evidencia clínica de ICC pero con una fracción de eyección <50% y >20% por debajo del nivel basal.
Los datos de ensayos pre-clínicos (in vivo e in vitro), a una dosis equivalente más alta que la recomendada en humanos, indican que sunitinib puede inhibir el proceso de repolarización cardiaca (induciendo prolongación del intervalo QT).
Se han observado incrementos en el intervalo QTc por encima de 500 mseg en un 0,5% y cambios desde los niveles basales por encima de 60 mseg en un 1,1% de los 450 pacientes con tumores sólidos; ambos parámetros se consideran cambios potencialmente significativos. Se ha observado que aproximadamente dos veces las concentraciones terapéuticas, sunitinib prolonga el intervalo QTcF (Corrección de Frederica).
Se estudió la prolongación del intervalo QTc en un ensayo en 24 pacientes, de edad comprendida entre 20 - 87 años, con tumores avanzados. Los resultados de este estudio demostraron que sunitinib tenía un efecto en el intervalo QTc (definido como el cambio medio ajustado a placebo de >10 mseg con un límite superior >15 mseg y un IC del 90%) a una concentración terapéutica (día 3) utilizando el método de la corrección del primer día, y a una concentración superior a la terapéutica (día 9) utilizando ambos métodos de corrección del nivel basal. Ningún paciente tuvo un valor de QTc > 500 mseg. Aunque en el día 3 se observó un efecto en el intervalo QTcF 24 horas después de la administración de la dosis (es decir, a la concentración plasmática esperada tras la administración de la dosis de inicio recomendada de 50 mg) aplicando el método de corrección del primer día, la importancia clínica de este hallazgo no está clara.
Utilizando una serie completa de evaluaciones del ECG a tiempos mayores o iguales de exposición terapéutica, se observó que ninguno de los pacientes en el grupo ITT desarrolló prolongaciones del intervalo QTc considerados como “graves” (es decir, de grado 3 o superior según el CTCAE versión 3.0).
A concentraciones plasmáticas terapéuticas, el cambio máximo del intervalo QTcF (Corrección de Frederica) respecto al nivel basal fue de 9,6 mseg (IC 90%: 15,1 mseg). A aproximadamente el doble de la concentración terapéutica, el cambio máximo sobre el nivel basal del intervalo QTcF fue de 15,4 mseg (IC 90%: 22,4 mseg). Utilizando como control positivo moxifloxacino (400 mg), se observó una media máxima del cambio en el intervalo QTc de 5,6 mseg con respecto al nivel basal. Ningún individuo experimentó un incremento en el intervalo QTc mayor de grado 2 (CTCAE versión 3.0).
La prolongación del intervalo QT puede provocar un aumento del riesgo de arritmias ventriculares, incluyendo Torsade de pointes. Se han observado Torsade de pointes en <0,1% de los pacientes expuestos a sunitinib. Sunitinib debe utilizarse con precaución en pacientes con historial conocido de prolongación del intervalo QT, en pacientes que están en tratamiento con antiarrítmicos, o con medicamentos que pueden prolongar el intervalo QT, o en pacientes con enfermedad cardiaca relevante preexistente, bradicardia o alteraciones electrolíticas. La administración concomitante de sunitinib con inhibidores potentes del CYP3A4 debe estar limitada por el posible incremento de las concentraciones plasmáticas de sunitinib (ver secciones 4.2 y 4.5).
Acontecimientos tromboembólicos venosos
Se notificaron acontecimientos tromboembólicos venosos relacionados con el tratamiento en aproximadamente el 1,0% de los pacientes con tumores sólidos que recibieron sunitinib dentro de los ensayos clínicos, incluyendo GIST y CCRM.
Siete pacientes (3%) en el brazo de sunitinib y ninguno en el brazo placebo en el ensayo en fase 3 de GIST experimentaron acontecimientos tromboembólicos venosos; cinco de los siete sufrieron trombosis venosa profunda (TVP) de grado 3, y dos de grado 1 ó 2. Cuatro de estos siete pacientes de GIST interrumpieron el tratamiento tras la primera observación de TVP.
Trece pacientes (3%) en tratamiento con sunitinib en el estudio en fase 3 para CCRM no tratado previamente y cuatro pacientes (2%) en los dos ensayos de CCRM resistente a citoquinas notificaron acontecimientos tromboembólicos venosos. Nueve de estos pacientes sufrieron embolismos pulmonares, uno de grado 2 y ocho de grado 4. Ocho de estos pacientes tuvieron TVP, uno de grado 1, dos de grado 2, cuatro de grado 3 y uno de grado 4. Uno de los pacientes con embolismo pulmonar en el ensayo de CCRM resistente a citoquinas interrumpió la dosis.
En los pacientes con CCRM que no habían recibido tratamiento previo para la enfermedad avanzada y en tratamiento con IFN-a, hubo seis (2%) acontecimientos tromboembólicos venosos; un paciente (<1%) experimentó un TVP de grado 3 y cinco pacientes (1%) sufrieron embolismos pulmonares, todos de grado 4.
En el ensayo en fase 3 de pNET se notificaron acontecimientos tromboembólicos venosos en 1 (1,2%) paciente del brazo de sunitinib y en 5 (6,1%) pacientes del brazo de placebo. Dos de los pacientes que recibieron placebo presentaron TVP, uno de grado 2 y el otro de grado 3.
No se notificó ningún caso con un desenlace mortal en los estudios para registro en GIST, CCRM y pNET. Se han observado casos con desenlace mortal en la fase de post comercialización (ver acontecimientos respiratorios y sección 4.8).
Acontecimientos tromboembólicos arteriales
Se han notificado casos de acontecimientos tromboembólicos arteriales (ATA), en ocasiones mortales, en pacientes tratados con sunitinib. Los acontecimientos más frecuentes fueron accidente cerebrovascular, accidente isquémico transitorio e infarto cerebral. Los factores de riesgo asociados con los ATA, aparte de la enfermedad maligna subyacente y la edad > 65 años, incluían hipertensión, diabetes mellitus y enfermedad tromboembólica previa.
Microangiopatía trombótica (MAT)
Se han notificado casos de MAT, incluida púrpura trombocitopénica trombótica (PTT) y síndrome urémico hemolítico (SUH), que en ocasiones causaron insuficiencia renal o desenlace mortal, en los ensayos clínicos y en la experiencia poscomercialización de sunitinib como monoterapia y en combinación con bevacizumab. El diagnóstico de MAT se debe considerar en el caso de anemia hemolítica, trombocitopenia, fatiga, manifestaciones neurológicas variables, alteración renal y fiebre. El tratamiento con sunitinib se debe interrumpir en los pacientes que desarrollen MAT y se debe iniciar inmediatamente el tratamiento adecuado. Se ha observado que los efectos de MAT son reversibles tras la interrupción del tratamiento (ver sección 4.8).
Acontecimientos respiratorios
Los pacientes que presentaron embolismo pulmonar en los 12 meses previos, fueron excluidos de los ensayos clínicos de sunitinib.
En los pacientes que recibieron sunitinib en los estudios de registro Fase 3, se notificaron acontecimientos pulmonares (es decir, disnea, derrame pleural, embolismo pulmonar o edema pulmonar) en aproximadamente el 17,8% de los pacientes con GIST, en aproximadamente el 26,7% de los pacientes con CCRM y en el 12% de los pacientes con pNET.
Aproximadamente el 22,2% de pacientes con tumores sólidos, incluyendo GIST y CCRM, que recibieron sunitinib en los ensayos clínicos, experimentaron acontecimientos pulmonares.
Se observaron casos de embolismo pulmonar en aproximadamente el 3,1% de los pacientes con GIST y en aproximadamente el 1,2% de los pacientes con CCRM, que recibieron sunitinib en los estudios en fase 3 (ver sección 4.4 - Acontecimientos tromboembólicos venosos). No se notificó ningún embolismo pulmonar en pacientes con pNET que recibieron sunitinib en el ensayo fase 3. Se han observado casos raros con desenlace fatal en la fase de post-comercialización (ver sección 4.8).
Alteraciones tiroideas
Se recomienda realizar la analítica basal de la función tiroidea en todos los pacientes. Aquellos pacientes con hipotiroidismo o hipertiroidismo pre-existente se deben tratar conforme a la práctica médica habitual antes de iniciar el tratamiento con sunitinib. Durante el tratamiento con sunitinib, se debe realizar una monitorización rutinaria de la función tiroidea cada 3 meses. Además, durante el tratamiento, los pacientes deben ser monitorizados estrechamente para detectar signos y síntomas de alteraciones tiroideas, y los pacientes que desarrollen cualquier signo y/o síntoma que sugiera alteración tiroidea se deben someter a análisis de la función tiroidea, tal y como esté clínicamente indicado. Los pacientes que desarrollen una alteración tiroidea deben ser tratados conforme a la práctica médica habitual.
Se ha observado que el hipotiroidismo se produce tanto de forma temprana como tardía durante el tratamiento con sunitinib.
Se notificó hipotiroidismo como una reacción adversa en 7 pacientes (4%) que recibieron sunitinib a lo largo de los dos ensayos de CCRM resistente a citoquinas; y en 61 pacientes (16%) en el brazo de sunitinib y en tres pacientes (<1%) en el brazo de IFN-a en el estudio de pacientes con CCRM que no habían recibido tratamiento previo para la enfermedad avanzada.
Adicionalmente, se notificaron elevaciones de la TSH en 4 pacientes (2%) de CCRM resistente a citoquinas. En total, en el 7% de la población con CCRM hubo evidencia clínica o analítica de aparición de hipotiroidismo a consecuencia del tratamiento. El hipotiroidismo adquirido se observó en el 6,2% de los pacientes de GIST en el brazo de sunitinib versus el 1% en el brazo placebo. En el ensayo fase 3 de pNET, se notificó hipotiroidismo en 6 pacientes (7,2%) que recibieron sunitinib y en un paciente (1,2%) con placebo.
En dos estudios en pacientes con cáncer de mama se monitorizó la función tiroidea de manera prospectiva; SUTENT no está aprobado para su uso en cáncer de mama. En uno de los estudios se notificó hipotiroidismo en 15 (13,6%) sujetos en tratamiento con sunitinib y en 3 (2,9%) sujetos tratados conforme a la práctica médica habitual. Se notificó un aumento de la TSH en sangre en 1 (0,9%) sujeto en tratamiento con sunitinib y en ninguno de los tratados conforme a la práctica médica habitual. No se notificó hipertiroidismo en ninguno de los sujetos tratados con sunitinib pero sí hubo en 1 (1,0%) sujeto tratado conforme a la práctica médica habitual. En el otro estudio se notificó hipotiroidismo en un total de 31 (13%) sujetos tratados con sunitinib y en 2 (0,8%) tratados con capecitabina. Se notificó un aumento de la TSH en sangre en 12 (5,0%) sujetos tratados con sunitinib pero en ninguno de los tratados con capecitabina. Se notificó hipertiroidismo en 4 (1,7%) sujetos tratados con sunitinib pero en ninguno de los tratados con capecitabina. Se notificó disminución de la TSH en sangre en 3 (1,3%) sujetos tratados con sunitinib y en ninguno de los tratados con capecitabina. Se observó un aumento de T4 en 2 (0,8%) sujetos tratados con sunitinib y en 1 (0,4%) de los sujetos tratados con capecitabina. Se notificó un aumento de T3 en 1 (0,8%) sujeto tratado con sunitinib y en ninguno de los sujetos tratados con capecitabina. Todos los acontecimientos tiroideos notificados fueron de grado 1-2.
En ensayos clínicos y durante la experiencia post comercialización, se han notificado de forma poco frecuente casos de hipertiroidismo, algunos de los cuales fueron seguidos de hipotiroidismo, y casos de tiroiditis.
Pancreatitis
Se observaron aumentos en la actividad de la lipasa y la amilasa séricas en los pacientes con varios tumores sólidos que recibieron sunitinib. Los aumentos en la actividad de la lipasa fueron transitorios y en general, no se acompañaron de signos ni síntomas de pancreatitis en los sujetos con varios tumores sólidos.
De forma poco frecuente (<1%) se han observado casos de pancreatitis en pacientes que recibían sunitinib para GIST o CCRM.
Se han notificado casos de acontecimientos pancreáticos graves, algunos de ellos con desenlace mortal.
Si se presentan síntomas de pancreatitis, los pacientes deben suspender el tratamiento con sunitinib y se les debe proporcionar soporte médico adecuado.
No se han notificado pancreatitis relacionadas con el tratamiento en el estudio fase 3 de pNET. Hepatotoxicidad
Se ha observado hepatotoxicidad en pacientes tratados con sunitinib. Se observaron casos de insuficiencia hepática, algunos de ellos con resultado mortal, en <1% de los pacientes con tumores sólidos tratados con sunitinib. Se deben monitorizar las pruebas de función hepática (niveles de alanina transaminasa [ALT], aspartato transaminasa [AST], bilirrubina) antes del inicio del tratamiento, durante cada ciclo de tratamiento y cuando esté clínicamente indicado. Si aparecen signos o síntomas de insuficiencia hepática, se interrumpirá el tratamiento con sunitinib y se instaurarán las medidas de soporte adecuadas.
Trastornos hepatobiliares
El tratamiento con sunitinib puede asociarse con colecistitis, incluida colecistitis acalculosa y colecistitis enfisematosa. En los estudios clínicos para registro, la incidencia de colecistitis fue del 0,5%. Se han notificado casos de colecistitis en el periodo postcomercialización.
Función renal
Se han notificado casos de alteración renal, insuficiencia renal y/o insuficiencia renal aguda, en algunos casos con desenlace mortal.
Los factores de riesgo asociados a la alteración/insuficiencia renal en pacientes que reciben sunitinib incluyeron, además del carcinoma de células renales subyacente, edad avanzada, diabetes mellitus, insuficiencia renal subyacente, fallo cardiaco, hipertensión, sepsis, deshidratación/hipovolemia y rabdomiolisis.
En pacientes con proteinuria de moderada a severa, no se ha evaluado de manera sistemática la seguridad del tratamiento continuado con sunitinib.
Se han notificado casos de proteinuria y casos raros de síndrome nefrótico. Se recomienda realizar análisis de orina al inicio del tratamiento, realizando un seguimiento a los pacientes con el fin de detectar el desarrollo o empeoramiento de proteinuria.
En pacientes con síndrome nefrótico, se debe discontinuar el tratamiento con sunitinib.
Fístula
En caso de que se forme una fístula, se deberá interrumpir el tratamiento con sunitinib. Se dispone de información limitada del uso continuado de sunitinib en pacientes con fístula.
Durante el tratamiento con sunitinib se han notificado casos de alteración en la cicatrización de heridas.
No se han realizado ensayos clínicos formales del efecto de sunitinib sobre la cicatrización de heridas. Se recomienda la interrupción temporal del tratamiento con sunitinib como medida de precaución en pacientes sometidos a procedimientos quirúrgicos mayores. La experiencia clínica relativa al tiempo para el reinicio del tratamiento tras un procedimiento quirúrgico mayor es limitada. Por lo tanto, la decisión para reanudar el tratamiento con sunitinib después de un procedimiento quirúrgico mayor debe basarse en una evaluación clínica de la recuperación tras la cirugía.
Osteonecrosis del maxilar (ONM)
Se han notificado casos de ONM en pacientes tratados con SUTENT. La mayoría de los casos ocurrieron en pacientes que habían recibido un tratamiento anterior o concomitante con bifosfonatos por vía intravenosa, para los cuales la ONM es un riesgo identificado. Por tanto, se debe tener precaución cuando se utilicen SUTENT y bifosfonatos por vía intravenosa tanto de forma simultánea como secuencial.
Los procedimientos dentales invasivos también se han identificado como un factor de riesgo. Antes del tratamiento con SUTENT, se debe considerar realizar un examen dental y los adecuados cuidados dentales preventivos. En pacientes que hayan recibido previamente o estén recibiendo bifosfonatos por vía intravenosa, se deben evitar, si es posible, los procedimientos dentales invasivos (ver sección 4.8).
Hipersensibilidad/angioedema
Si aparece angioedema debido a hipersensibilidad, se deberá interrumpir el tratamiento con sunitinib y se instaurarán las medidas de soporte estándar.
Trastornos del sistema nervioso
Alteración del sentido del gusto
Se notificó disgeusia en aproximadamente el 28% de los pacientes que recibieron sunitinib en los ensayos clínicos.
Convulsiones
En los estudios clínicos con sunitinib y en la experiencia post comercialización, se han observado convulsiones en pacientes con o sin evidencia radiológica de metástasis en el cerebro. Además, ha habido pocas notificaciones (<1%), algunas de ellas con desenlace mortal, de sujetos que presentaban convulsiones y evidencia radiológica de síndrome de leucoencefalopatía posterior reversible (SLPR). Los pacientes con convulsiones y signos/síntomas relacionados con SLPR, tales como hipertensión, dolor de cabeza, disminución de la alerta, función mental alterada, y pérdida visual, incluyendo ceguera cortical, deben ser controlados mediante atención médica, que incluya el control de la hipertensión. Se recomienda la suspensión temporal de sunitinib; tras la resolución, el tratamiento puede ser reiniciado a criterio del facultativo.
Síndrome de lisis tumoral (SLT)
Se han observado casos de SLT, en ocasiones mortales, a una frecuencia rara en ensayos clínicos y se han notificado durante la experiencia post-comercialización en pacientes tratados con sunitinib. Los factores de riesgo del SLT incluyen una mayor masa tumoral, insuficiencia renal crónica preexistente, oliguria, deshidratación, hipotensión y orina acidificada. Estos pacientes deben ser monitorizados
cuidadosamente y tratados como esté clínicamente indicado, y se ha de considerar hidratación profiláctica.
Infecciones
Se han notificado infecciones graves, con o sin neutropenia, incluyendo algunas con desenlace mortal. Las infecciones observadas con mayor frecuencia en el tratamiento con sunitinib son infecciones típicamente observadas en pacientes con cáncer, como por ejemplo, infecciones respiratorias, del tracto urinario, de la piel y sepsis.
Se han notificado casos raros de fascitis necrotizante, incluyendo del perineo, en ocasiones mortal. Debe interrumpirse el tratamiento con sunitinib a los pacientes que presenten fascitis necrotizante, y comenzarse de inmediato la administración de un tratamiento adecuado.
Hipoglucemia
Se han notificado disminuciones de la glucosa en sangre, en ocasiones clínicamente sintomáticas y que requirieron hospitalización por la pérdida de consciencia, durante el tratamiento con sunitinib. En caso de hipoglucemia sintomática, sunitinib se debe interrumpir temporalmente. Se deben comprobar con regularidad los niveles de glucosa en sangre de los pacientes diabéticos, con el fin de valorar si es necesario ajustar la dosis del antidiabético para reducir al mínimo el riesgo de hipoglucemia.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los estudios de interacciones se han realizado sólo en adultos.
Medicamentos que pueden aumentar las concentraciones plasmáticas de sunitinib
En voluntarios sanos, la administración concomitante de una única dosis de sunitinib con el potente inhibidor de CYP3A4, ketoconazol, ocasionó un aumento del 49% y del 51% en los valores de Cmax y AUC0-<X) del combinado [sunitinib+metabolito principal], respectivamente.
La administración de sunitinib con inhibidores potentes del CYP3A4 (por ejemplo, ritonavir, itraconazol, eritromicina, claritromicina, zumo de pomelo) puede aumentar las concentraciones de sunitinib.
Por tanto, se debe evitar la combinación con inhibidores del CYP3A4 o considerar la elección de una medicación concomitante alternativa que tenga nulo o mínimo potencial para inhibir el CYP3A4.
Si esto no es posible, puede que sea necesario reducir la dosis de SUTENT hasta un mínimo de 37,5 mg al día en el caso de GIST y CCRM o de 25 mg al día para pNET, basándose en la cuidadosa monitorización de la tolerabilidad (ver sección 4.2).
Medicamentos que _pueden reducir las concentraciones _plasmáticas de sunitinib
En voluntarios sanos, la administración concomitante de una única dosis de sunitinib con el inductor del CYP3A4, rifampicina, ocasionó una disminución del 23% y del 46% en los valores de Cmax y AUC0-a, del combinado [sunitinib + metabolito principal], respectivamente.
La administración de sunitinib con inductores potentes del CYP3A4 (por ejemplo, dexametasona, fenitoína, carbamazepina, rifampicina, fenobarbital o plantas medicinales conteniendo Hierba de San Juan/Hypericum perforatum) puede reducir las concentraciones de sunitinib. Por tanto, se debe evitar la combinación con inductores del CYP3A4 o considerar la elección de una medicación concomitante alternativa que tenga nulo o mínimo potencial inductor del CYP3A4. Si esto no es posible, puede que sea necesario aumentar la dosis de SUTENT con incrementos de 12,5 mg (hasta 87,5 mg al día en el
caso de GIST y CCRM o de 62,5 mg al día para pNET), basándose en una cuidadosa monitorización de la tolerabilidad (ver sección 4.2).
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay estudios en mujeres embarazadas tratadas con sunitinib. Los estudios en animales han mostrado toxicidad reproductiva, incluyendo malformaciones fetales (ver sección 5.3). SUTENT no debe utilizarse durante el embarazo ni en ninguna mujer que no esté utilizando métodos anticonceptivos eficaces, a menos que el beneficio potencial justifique el riesgo potencial para el feto. Si se utiliza SUTENT durante el embarazo, o si la paciente se queda embarazada mientras está en tratamiento con SUTENT, debe ser informada del daño potencial para el feto.
Se debe advertir a las mujeres en edad fértil que utilicen un método anticonceptivo eficaz y que eviten quedarse embarazadas mientras estén en tratamiento con SUTENT.
Lactancia
Sunitinib y/o sus metabolitos se excretan en la leche en ratas. Se desconoce si sunitinib o su principal metabolito activo se excreta en la leche materna. Puesto que las sustancias activas se excretan con frecuencia en la leche materna y debido al potencial para producir reacciones adversas graves en los niños lactantes, las mujeres no deben dar el pecho mientras tomen SUTENT.
Fertilidad
Conforme a los hallazgos no clínicos, la fertilidad de varones y mujeres podría estar comprometida por el tratamiento con sunitinib (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Se debe informar a los pacientes de que pueden experimentar mareos durante el tratamiento con sunitinib.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más graves asociadas a sunitinib, algunas de ellas con desenlace mortal, son insuficiencia renal, insuficiencia cardiaca, embolismo pulmonar, perforación gastrointestinal y hemorragias (por ejemplo, hemorragia del tracto respiratorio, gastrointestinal, tumoral, del tracto urinario y cerebral). Las reacciones adversas más frecuentes de cualquier grado (experimentadas por los pacientes en los ensayos para registro de CCR, GIST y pNET) incluyeron: disminución del apetito, alteración del gusto, hipertensión, fatiga, alteraciones gastrointestinales (por ejemplo, diarrea, náuseas, estomatitis, dispepsia y vómitos), decoloración de la piel y síndrome de eritrodisestesia palmo-plantar. Estos síntomas pueden disminuir a medida que el tratamiento continúa.
Durante el tratamiento se puede desarrollar hipotiroidismo. Entre las reacciones adversas más frecuentes se encuentran las alteraciones hematológicas (por ejemplo, neutropenia, trombocitopenia y anemia).
Otros acontecimientos mortales distintos de los relacionados en la sección 4.4 o en la sección 4.8 que se consideraron como posiblemente relacionados con sunitinib incluyeron fallo multiorgánico, coagulación intravascular diseminada, hemorragia peritoneal, insuficiencia adrenal, neumotórax, shock y muerte súbita.
Tabla de reacciones adversas
Las reacciones adversas que se notificaron en pacientes con GIST, CCRM y pNET en una base de datos agrupada de 7.115 pacientes, se listan a continuación, según la clasificación por órganos y sistemas, frecuencia y gravedad (NCI-CTCAE). También se incluyen las reacciones adversas postcomercialización identificadas en los estudios clínicos. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Las frecuencias se definen como: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1 - Reacciones adversas notificadas en los ensayos clínicos
|
Clasificación de órganos |
Muy frecuentes >1/10 |
Frecuentes >1/100 a <1/10 |
Poco frecuentes >1/1.000 a <1/100 |
Raras >1/10.000 a <1/1.000 |
|
Infecciones e infestaciones |
Infecciones víricas3 Infecciones respiratoriasb* Abscesos3* Infecciones por hongosd Infección del tracto urinario Infecciones cutánease Sepsisf* |
Fascitis necrotizante* Infecciones bacterianasg | ||
|
Trastornos de la sangre y del sistema linfático |
Neutropenia Trombocitopenia Anemia Leucopenia |
Linfopenia |
Pancitopenia |
Microangiopatía trombótica11* |
|
Trastornos del sistema inmunológico |
Hipersensibilidad |
Angioedema | ||
|
Trastornos endocrinos |
Hipotiroidismo |
Hipertiroidismo |
Tiroiditis | |
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetitoi |
Deshidratación Hipoglucemia |
Síndrome de lisis tumoral* | |
|
Trastornos psiquiátricos |
Insomnio |
Depresión | ||
|
Trastornos del sistema nervioso |
Mareo Cefalea Alteración del gustoJ |
Neuropatía periférica Parestesia Hipoestesia Hiperestesia |
Hemorragia cerebral Accidente cerebrovascular Accidente isquémico transitorio |
Síndrome de leucoencefalopatía posterior reversible |
|
Trastornos oculares |
Edema periorbital Edema del párpado Aumento del lagrimeo |
|
Clasificación de órganos |
Muy frecuentes >1/10 |
Frecuentes >1/100 a <1/10 |
Poco frecuentes >1/1.000 a <1/100 |
Raras >1/10.000 a <1/1.000 |
|
Trastornos cardiacos |
Isquemia de miocardio10’* Disminución de la fracción de eyección1 |
Insuficiencia cardiaca congestiva Infarto de miocardio™’ Insuficiencia cardiaca Cardiomiopatía Derrame pericárdico Intervalo QT del electrocardiogram a prolongado |
Insuficiencia ventricular izquierda* Torsade de pointes | |
|
Trastornos vasculares |
Hipertensión |
Trombosis venosa profunda Sofocos Rubefacción |
Hemorragia tumoral | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea Epistaxis Tos |
Embolismo pulmonar Derrame pleural Hemoptisis Disnea de esfuerzo Dolor orofaríngeon Congestión nasal Sequedad nasal |
Hemorragia pulmonar Insuficiencia * respiratoria | |
|
Trastornos gastrointestina les |
Estomatitis0 Dolor abdominalp Vómitos Diarrea Dispepsia Náuseas Estreñimiento |
Enfermedad de reflujo gastroesofágico Disfagia Hemorragia gastrointestinal Esofagitis Distensión abdominal Molestia abdominal Hemorragia rectal Sangrado gingival Ulceración de la boca Proctalgia Queilitis Hemorroides Glosodinia Dolor bucal Sequedad de boca Flatulencia Molestias orales Eructos |
Perforación gastrointestinal^ Pancreatitis Fístula anal | |
|
Trastornos hepatobiliares |
Insuficiencia hepática Colecistitis1’ Función hepática anormal |
Hepatitis |
|
Clasificación de órganos |
Muy frecuentes >1/10 |
Frecuentes >1/100 a <1/10 |
Poco frecuentes >1/1.000 a <1/100 |
Raras >1/10.000 a <1/1.000 |
|
Trastornos de la piel y del tejido subcutáneo |
Cambio de color de la piels Síndrome de eritrodisestesia palmoplantar Erupción1 Cambio de coloración del pelo Sequedad de piel |
Exfoliación de la piel Reacción cutáneau Eczema Ampollas Eritema Alopecia Acné Prurito Hiperpigmentación de la piel Lesión de la piel Hiperqueratosis Dermatitis Trastornos en las uñasv |
Eritema multiforme Síndrome de Stevens-Johnson Pioderma gangrenoso Necrolisis epidérmica tóxica | |
|
Trastornos musculoesquel éticos y del tejido conjuntivo |
Dolor en las extremidades Artralgia Dolor de espalda |
Dolor musculoesquelético Espasmos musculares Mialgia Debilidad muscular |
Osteonecrosis mandibular Fístula |
Rabdomiolisis* Miopatía |
|
Trastornos renales y urinarios |
Fallo renal Insuficiencia renal aguda Cromaturia Proteinuria |
Hemorragia del tracto urinario |
Síndrome nefrótico | |
|
Trastornos generales y alteraciones en el lugar de administración |
Inflamación de las mucosas Fatiga" Edemax Pirexia |
Dolor torácico Dolor Enfermedad similar a la influenza Escalofríos |
Alteración en la cicatrización | |
|
Exploraciones complementari as |
Disminución del peso Disminución del recuento de glóbulos blancos Lipasa elevada Recuento disminuido de plaquetas Disminución de la hemoglobina Amilasa elevaday Aumento de la aspartato aminotransferasa Aumento de la alanina aminotransferasa Aumento de la creatinina en sangre Aumento de la presión sanguínea Aumento del ácido úrico en sangre |
Creatinina fosfoquinasa sanguínea elevada Aumento de la hormona estimulante de la tiroides en sangre |
Se han combinado los siguientes términos: a Nasofaringitis y herpes oral
b
c
d
e
f
g
h
i
J
k
l
m
n
o
P
q
r
s
t
u
v
w
x
y
*
Bronquitis, infección del tracto respiratorio inferior, neumonía e infección del tracto respiratorio
Absceso, absceso en extremidad, absceso anal, absceso gingival, absceso hepático, absceso pancreático, absceso perineal, absceso perirrectal, absceso rectal, absceso subcutáneo y absceso dental
Candidiasis esofágica y candidiasis oral Celulitis e infección cutánea Sepsis y choque septicémico
Absceso abdominal, sepsis abdominal, diverticulitis y osteomielitis Microangiopatía trombótica, púrpura trombocitopénica trombótica, síndrome urémico hemolítico
Apetito disminuido y anorexia Disgeusia, ageusia y alteración del gusto
Síndrome coronario agudo, angina de pecho, angina inestable, oclusión de la arteria coronaria,
e isquemia miocárdica
Fracción de eyección disminuida/anormal
Infarto agudo de miocardio, infarto de miocardio, infarto miocárdico silente Dolor orofaríngeo y laringofaríngeo Estomatitis y estomatitis aftosa
Dolor abdominal, dolor en la zona inferior del abdomen y dolor en la zona superior del abdomen
Perforación gastrointestinal y perforación intestinal Colecistitis y colecistitis acalculosa
Piel amarilla, cambio de color de la piel y trastorno de la pigmentación Dermatitis psoriasiforme, erupción exfoliativa, erupción, erupción eritematosa, erupción folicular, erupción generalizada, erupción macular, erupción maculopapular, erupción papular y erupción prurítica
Reacción cutánea y trastorno de la piel Trastorno de las uñas y cambio de color de las uñas Fatiga y astenia
Edema facial, edema y edema periférico Amilasa y aumento de amilasa Incluyendo acontecimientos mortales.
Descripción de las reacciones adversas seleccionadas
Infecciones e infestaciones: Se han notificado casos de infección grave (con o sin neutropenia), incluyendo casos mortales. Se han notificado casos de fascitis necrotizante, incluyendo del perineo, en ocasiones mortal (ver también sección 4.4).
Trastornos de la sangre y del sistema linfático: Se han notificado casos de microangiopatía trombótica, en algunos casos con desenlace mortal (ver también sección 4.4).
Trastornos del sistema inmunológico: Se han notificado reacciones de hipersensibilidad incluyendo angioedema.
Trastornos del sistema nervioso: Se han notificado pocos casos, algunos mortales, de sujetos con convulsiones y evidencia radiológica del síndrome de leucoencefalopatía posterior reversible (SLPR) (ver también sección 4.4).
Trastornos del metabolismo y de la nutrición: En pacientes con pNET se notificó una incidencia más alta de acontecimientos de hipoglucemia en comparación con CCRM y GIST. Sin embargo, la mayoría de estas reacciones adversas observadas en ensayos clínicos no se consideraron relacionadas con el tratamiento en estudio.
Trastornos hepatobiliares: Se ha notificado disfunción hepática que puede incluir anomalías en las pruebas de función hepática, hepatitis o insuficiencia hepática.
Trastornos de la piel y del tejido subcutáneo: Se han notificado casos de pioderma gangrenoso, generalmente reversible tras el cese del tratamiento con el medicamento (ver también sección 4.4).
Trastornos musculoesqueléticos y del tejido conjuntivo: Se han notificado casos de miopatía y/o rabdomiolisis, algunos con insuficiencia renal aguda. El tratamiento de pacientes con signos o síntomas de toxicidad muscular debe hacerse de acuerdo a la práctica médica habitual.
Se han notificado casos de formación de fístulas algunas veces asociados con necrosis y regresión del tumor, en algunos casos con desenlace mortal.
Se han notificado casos de osteonecrosis del maxilar (ONM) en pacientes tratados con SUTENT, la mayor parte de los cuales ocurrieron en pacientes que tenían factores de riesgo identificados para la ONM, en particular la exposición a bifosfonatos por vía intravenosa y/o antecedentes de enfermedad dental con necesidad de procedimientos dentales invasivos (ver también sección 4.4).
Población pediátrica
Se realizó un estudio fase I de escalado de dosis con sunitinib oral en 35 pacientes pediátricos y adultos jóvenes (de 2 a 21 años de edad) con tumores sólidos refractarios, la mayoría de los cuales tenían un diagnóstico primario de tumor cerebral. Todos los participantes del estudio experimentaron reacciones adversas, y en aquellos pacientes previamente tratados con antraciclinas o radiación cardiaca, la mayor parte de éstas fueron graves (grado de toxicidad >3) e incluyeron cardiotoxicidad. El riesgo de reacciones adversas cardiacas parece mayor en los pacientes pediátricos tratados previamente con radiación cardiaca y antraciclinas, en comparación con aquellos pacientes pediátricos sin exposición previa. No se ha identificado una dosis máxima tolerada de sunitinib para esta población de pacientes debido a las toxicidades limitantes de la dosis (ver sección 5.1). En los pacientes pediátricos sin tratamiento previo con antraciclinas o radiación cardiaca, las reacciones adversas más frecuentes fueron la toxicidad gastrointestinal, neutropenia, fatiga y aumento de la ALT.
Según un análisis farmacocinético/farmacodinámico (PK/PD) y farmacocinético (PK) poblacional, sunitinib en dosis de 25 mg/m2 al día en el régimen 4/2 en pacientes pediátricos (de 6 a 11 años de edad y de 12 a 17 años de edad) con GIST podría proporcionar exposiciones plasmáticas del medicamento y, en consecuencia, perfiles de seguridad y eficacia, comparables a los de los pacientes adultos con GIST tratados con 50 mg al día en el régimen 4/2.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No existe un antídoto específico para la sobredosis con sunitinib y el tratamiento de la misma debe consistir en las medidas generales de soporte. En caso necesario, la eliminación de la sustancia activa no absorbida se puede conseguir mediante emesis o lavado gástrico. Se han notificado casos de sobredosis; algunos casos fueron asociados con reacciones adversas concordantes con el perfil de seguridad conocido de sunitinib.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos, inhibidores directos de la protein-quinasa, código ATC: LO1XE04
Mecanismo de acción
Sunitinib inhibe múltiples receptores tirosina kinasa (RTKs) que están implicados en el crecimiento tumoral, la neoangiogénesis y la progresión a metástasis del cáncer. Sunitinib se identificó como un inhibidor de los receptores del factor de crecimiento derivado de plaquetas (PDGFRa y PDGFRP), de los receptores de los factores de crecimiento del endotelio vascular (VEGFR1, VEGFR2 y VEGFR3), del receptor de factor de células madre (KIT), de la tirosin-kinasa 3 tipo Fms (FLT3), del factor estimulador de colonias (CSF-1R), y del receptor del factor neurotrófico derivado de la línea celular glial (RET). En los ensayos celulares y bioquímicos el metabolito principal muestra una potencia similar comparado con sunitinib.
Eficacia clínica y seguridad
Se ha estudiado la seguridad y la eficacia clínicas de sunitinib en el tratamiento de pacientes con GIST que fueron resistentes a imatinib (es decir, pacientes que experimentaron progresión de la enfermedad durante o después del tratamiento con imatinib) o fueron intolerantes a imatinib (es decir, pacientes que experimentaron una toxicidad significativa durante el tratamiento con imatinib que imposibilitó la continuación del tratamiento), en el tratamiento de pacientes con CCRM y en el tratamiento de pacientes con pNET no resecable.
La eficacia se basa en el tiempo hasta la progresión tumoral y el aumento de la supervivencia en GIST, en la supervivencia libre de progresión y en las tasas de respuesta objetiva para CCRM no tratado previamente y resistente a citoquinas respectivamente, y en la supervivencia libre de progresión en el caso de pNET.
Tumor del estroma gastrointestinal (GIST)
Se realizó un ensayo inicial abierto, de dosis progresivas escalonadas en pacientes con GIST después del fracaso a imatinib (dosis diaria máxima media de 800 mg) debido a resistencia o a intolerancia. Noventa y siete pacientes fueron incluidos con varias dosis y programas; 55 pacientes recibieron 50 mg en el programa de tratamiento recomendado, 4 semanas de tratamiento y 2 semanas de descanso (“régimen 4/2”).
En este ensayo, el tiempo medio hasta la progresión del tumor (TTP) fue de 34,0 semanas (95% IC = 22,0 - 46,0 semanas).
Se realizó un ensayo controlado con placebo, doble ciego, aleatorizado fase 3 de sunitinib en pacientes con GIST intolerantes o que habían experimentado progresión de la enfermedad durante o después del tratamiento con imatinib (dosis diaria máxima media de 800 mg). En este estudio, 312 pacientes fueron aleatorizados (2:1) para recibir 50 mg de sunitinib o placebo, por vía oral una vez al día en el régimen 4/2 hasta progresión de la enfermedad o retirada del estudio por alguna otra razón (207 pacientes recibieron sunitinib y 105 pacientes recibieron placebo). La variable principal de eficacia del estudio fue TTP, definido como el tiempo desde la aleatorización a la primera documentación de progresión objetiva del tumor. En el momento del análisis intermedio preespecificado, la mediana del TTP en el brazo de sunitinib fue de 28,9 semanas (95% IC = 21,3 - 34,1 semanas) según la evaluación del investigador, y de 27,3 semanas (95% IC = 16,0 - 32,1 semanas) según la evaluación del Comité de Revisión Independiente y fue estadística y significativamente más largo que el TTP del placebo de 5,1 semanas (95% IC = 4,4-10,1 semanas, p<0,001) según la evaluación del investigador y de 6,4 semanas (95% IC = 4,4 - 10,0 semanas) según la evaluación del
Comité de Revisión Independiente. La diferencia en la supervivencia global fue estadísticamente favorable a sunitinib [riesgo relativo (HR, HazardRisk): 0,491 (95% IC: 0,290 - 0,831)]; el riesgo de fallecimiento fue 2 veces más alto en los pacientes del brazo placebo comparado con el brazo de sunitinib.
Tras el análisis intermedio de eficacia y seguridad, a recomendación del DSMB Independiente, se abrió el ciego del estudio y se ofreció a los pacientes en el brazo de placebo el tratamiento abierto con sunitinib.
Un total de 255 pacientes recibieron sunitinib en la fase de tratamiento abierta del estudio, incluyendo 99 pacientes que inicialmente fueron tratados con placebo.
Los análisis de las variables de eficacia primaria y secundaria en la fase abierta del estudio confirmaron los resultados obtenidos en el momento del análisis intermedio, tal y como se refleja en la tabla inferior:
Tabla 2 - Resumen de las variables de eficacia (población por intención de tratar, ITT)
_Tratamiento Doble-Ciegoa_
Mediana (95% IC) Riesgo relativo Tratamiento
Grupo
Placebo
|
Variable |
SUTENT |
Placebo |
(95% IC) |
P |
Cruzadob |
|
Primaria: TTP (semanas) | |||||
|
Intermedio |
27,3 (de 16,0 a |
6,4 (de 4,4 a |
0,329 (de 0,233 a |
<0,001 |
- |
|
32,1) |
10,0) |
0,466) | |||
|
Final |
26,6 (de 16,0 a |
6,4 (de 4,4 a |
0,339 (de 0,244 a |
<0,001 |
10,4 (de 4,3 a |
|
32,1) |
10,0) |
0,472) |
22,0) | ||
|
Secundaria PFS (semanas)c | |||||
|
Intermedio |
24,1 (de 11,1 a |
6,0 (de 4,4 a 9,9) |
0,333 (de 0,238 a |
<0,001 |
- |
|
28,3) |
0,467) | ||||
|
Final |
22,9 (de 10,9 a |
6,0 (de 4,4 a 9,7) |
0,347 (de 0,253 a |
<0,001 |
- |
|
ORR (%)d |
28,0) |
0,475) | |||
|
Intermedio |
6,8 (de 3,7 a |
0 (-) |
NA |
0,006 |
- |
|
11,1) | |||||
|
Final |
6,6 (de 3,8 a |
0 (-) |
NA |
0,004 |
10,1 (de 5,0 a |
|
10,5) |
17,8) | ||||
|
OS (semanas)e | |||||
|
Intermedio |
- |
- |
0,491 (de 0,290 a |
0,007 |
- |
|
0,831) | |||||
|
Final |
72,7 (de 61,3 a |
64,9 (de 45,7 a |
0,876 (de 0,679 a |
0,306 |
- |
|
83,0) |
96,0) |
1,129) |
a Resultados del tratamiento doble-ciego proceden de la población por intención de tratar (ITT) y utilizando medidas radiológicas centrales, tal y como procedía.
b Resultados de eficacia para 99 sujetos que se cruzaron desde placebo a SUTENT tras apertura del ciego. Los datos iniciales fueron reajustados en el cruzamiento y los análisis de eficacia se basaron en la evaluación de los investigadores.
c Los datos intermedios de PFS han sido actualizados de acuerdo a los nuevos cálculos de los datos originales.
d Los resultados de ORR se proporcionan como el porcentaje de sujetos con respuesta confirmada con el 95% IC.
e Mediana no alcanzada debido a que los datos no estaban aún maduros.
La mediana de la supervivencia global (OS) en la población por intención de tratar fue de 72,7 semanas y de 64,9 semanas (riesgo relativo 0,876, 95% IC: 0,679 - 1,129, p = 0,306), en el brazo de sunitinib y en el de placebo respectivamente. En este análisis, el brazo de placebo incluyó aquellos pacientes aleatorizados a placebo que posteriormente recibieron sunitinib en el tratamiento abierto.
Carcinoma de células renales metastásico (CCRM) no tratado previamente
Se realizó un ensayo fase 3, aleatorizado, multicéntrico, internacional para evaluar la eficacia y seguridad de sunitinib en comparación con IFN-a en pacientes con CCRM no tratado previamente. Setecientos cincuenta pacientes fueron aleatorizados en proporción 1:1 a los brazos de tratamiento; recibieron tratamiento o bien con sunitinib en ciclos repetidos de 6 semanas, consistentes en una administración oral diaria de 50 mg durante 4 semanas seguidas de 2 semanas de descanso (régimen 4/2), o bien IFN-a, administrado como una inyección subcutánea de 3 millones de unidades (MU) la primera semana, 6 MU la segunda semana, y 9 MU la tercera semana, y de ahí en adelante en 3 días no consecutivos cada semana.
La duración media del tratamiento fue de 11,1 meses (rango: 0,4 - 46,1) para el tratamiento con sunitinib y de 4,1 meses (rango: 0,1 - 45,6) para el tratamiento con IFN- a. Las reacciones adversas graves relacionadas con el tratamiento (TRSAEs: Treatment related serious adverse events) se notificaron en el 23,7% de los pacientes que recibieron sunitinib y en el 6,9% de los pacientes que recibieron IFN-a. Sin embargo, los porcentajes de discontinuación debidos a reacciones adversas fueron del 20% para sunitinib y del 23% para IFN-a. Hubo interrupciones de dosis en 202 pacientes (54%) con sunitinib y en 141 pacientes (39%) con IFN-a. Hubo reducción de dosis en 194 pacientes (52%) con sunitinib y en 98 pacientes (27%) con IFN-a. Los pacientes fueron tratados hasta la progresión de la enfermedad o hasta retirada del estudio. La variable principal de eficacia fue la supervivencia libre de progresión (PFS: Progression free survival). El análisis intermedio planificado mostró una ventaja estadísticamente significativa para sunitinib con respecto a IFN-a, en este estudio, la PFS media para el grupo tratado con sunitinib fue de 47,3 semanas en comparación con 22,0 semanas para el grupo tratado con IFN-a; el riesgo relativo fue de 0,415 (95% IC: 0,320 - 0,539, valor p <0,001). El resto de variables de eficacia fueron la tasa de respuesta objetiva (ORR: Objective response rate), supervivencia global (OS: Overall survival) y seguridad. La evaluación radiológica se discontinuó una vez alcanzada la variable de eficacia primaria. En el análisis final, la ORR tal y como determinó la evaluación del investigador fue del 46% (95% IC: 41 - 51) para el grupo de sunitinib y del 12,0% (95% IC: 9 - 16) para el brazo de IFN-a (p<0,001).
El tratamiento con sunitinib se asoció a una supervivencia más larga comparado con IFN-a. La mediana de OS fue de 114,6 semanas para el grupo de sunitinib (95% IC: 100,1 - 142,9 semanas) y de
94,9 semanas para el grupo de IFN-a (95% IC: 77,7 - 117,0 semanas) con un riesgo relativo de 0,821 (95% IC: 0,673 - 1,001; p = 0,0510 por un rango logarítmico no estratificado).
Los datos de PFS y OS, observados en la población con intención de tratar, tal y como se han determinado por el laboratorio central de evaluación radiológica, se resumen en la siguiente tabla:
Tabla 3 - Resumen de las variables de eficacia (población por intención de tratar, ITT)
|
Resumen de supervivencia libre de progresión |
Sunitinib (N = 375) |
IFN-a (N = 375) |
|
Sujetos observados que no progresaron o |
161 (42,9) |
176 (46,9) |
|
murieron [n (%)] | ||
|
Sujetos observados con progresión o muerte [n |
214 (57,1) |
199 (53,1) |
|
(%)] | ||
|
PFS (semanas) | ||
|
Cuartil (95% IC) | ||
|
25% |
22,7 (18,0 a 34,0) |
10,0 (7,3 a 10,3) |
|
50% |
48,3 (46,4 a 58,3) |
22,1 (17,1 a 24,0) |
|
75% |
84,3 (72,9 a 95,1) |
58,1 (45,6 a 82,1) |
|
Análisis no estratificado | ||
|
Riesgo relativo (sunitinib vs IFN-a) |
0,5268 | |
|
95% IC para el riesgo relativo |
(0,4316 a 0,6430) | |
|
p-valora |
<0,0001 | |
|
a Desde un análisis rango-logarítmico a 2-lados | ||
|
Resumen de supervivencia global |
Sunitinib |
IFN-a |
|
(N = 375) |
(N = 375) | |
|
Sujetos que no han muerto [n (%)] |
185 (49,3) |
175 (46,7) |
|
Sujetos que han muerto [n (%)] |
190 (50,7) |
200 (53,3) |
|
OS (semanas) | ||
|
Cuartil (95% IC) | ||
|
25% |
56,6 (48,7 a 68,4) |
41,7 (32,6 a 51,6) |
|
50% |
114,6 (100,1 a 142,9) |
94,9 (77,7 a 117,0) |
|
75% |
NA (NA a NA) |
NA (NA a NA) |
|
Análisis no estratificado | ||
|
Riesgo relativo (sunitinib vs IFN-a) |
0,8209 | |
|
95% IC para el riesgo relativo |
(0,6730 a 1,0013) | |
|
p-valora |
0,0510 | |
a Desde un análisis rango-logarítmico a 2-lados NA: No disponible (no alcanzado)
Carcinoma de células renales metastásico (CCRM) resistente a citoquinas
Se realizó un ensayo fase 2 de sunitinib en pacientes refractarios al tratamiento previo basado en citoquinas con interleukina-2 o IFN-a. Sesenta y tres pacientes recibieron una dosis inicial de 50 mg de sunitinib por vía oral, una vez al día durante un periodo de cuatro semanas consecutivas seguido por un periodo de 2 semanas de descanso, para cumplimentar un ciclo completo de 6 semanas (régimen 4/2). La variable principal de eficacia fue la tasa de respuesta objetiva (ORR) en base a los Criterios de Evaluación de Respuesta en Tumores Sólidos (RECIST).
En este estudio la tasa de respuesta objetiva fue del 36,5% (95% IC: 24,7% - 49,6%) y el tiempo medio hasta la progresión (TTP) fue de 37,7 semanas (95% IC: 24,0 - 46,4 semanas).
Se realizó un ensayo confirmatorio, abierto, de un solo brazo, multicéntrico para evaluar la eficacia y seguridad de sunitinib en pacientes con CCRM resistente a la terapia previa basada en citoquinas. Ciento seis pacientes recibieron al menos una dosis de 50 mg de sunitinib en el régimen 4/2.
La variable principal de eficacia de este estudio fue la tasa de respuesta objetiva (ORR). Las variables secundarias incluyeron TTP, duración de respuesta (DR) y supervivencia global (OS).
En este estudio la ORR fue del 35,8% (95% IC: 26,8% - 47,5%). La DR y OS medias no se habían alcanzado todavía.
Tumores neuroendocrinos pancreáticos (pNET)
Un ensayo de apoyo fase 2, multicéntrico y abierto evaluó la eficacia y seguridad de sunitinib 50 mg al día como agente único en un régimen 4/2 [4 semanas de tratamiento, 2 semanas de descanso] en pacientes con pNET no resecable. En un subgrupo de 66 pacientes con tumor de células de los islotes pancreáticos, el objetivo primario de eficacia consistente en la tasa de respuesta fue del 17%.
Se realizó un ensayo pivotal fase 3, multicéntrico, internacional, aleatorizado, doble ciego y controlado con placebo de sunitinib como agente único en pacientes con pNET no resecable.
Se requirió que los pacientes tuvieran documentada progresión, según RECIST, durante los 12 meses previos y se les distribuyó en forma aleatoria (1:1) para recibir sunitinib 37,5 mg una vez al día sin periodo de descanso (n = 86) o placebo (n = 85).
El objetivo primario fue comparar la supervivencia libre de progresión (PFS) en pacientes que recibieron sunitinib versus pacientes que recibieron placebo. Otros objetivos del ensayo fueron la supervivencia global (OS), la tasa de respuesta objetiva (ORR), los resultados notificados por los pacientes (PRO) y la seguridad.
Los datos demográficos fueron comparables entre los grupos de sunitinib y placebo. Adicionalmente, el 49% de los pacientes con sunitinib tuvieron tumores no funcionales versus el 52% de los pacientes con placebo y el 92% de los pacientes en ambos grupos tuvieron metástasis hepáticas.
En este estudio se permitió el uso de análogos de somatostatina.
Un total del 66% de los pacientes con sunitinib habían recibido tratamiento sistémico previo en comparación con el 72% de los pacientes con placebo. Además, el 24% de los pacientes con sunitinib habían recibido análogos de somatostatina en comparación con el 22% de los pacientes con placebo.
Se observó una ventaja clínicamente significativa en la PFS evaluada por el investigador para sunitinib sobre placebo. La mediana de la PFS fue de 11,4 meses para el grupo de sunitinib en comparación con los 5,5 meses del grupo placebo [riesgo relativo: 0,418 (95% IC: 0,263; 0,662), p-valor = 0,0001]; se observaron resultados similares cuando se utilizaron las evaluaciones derivadas de la respuesta del tumor, en base a la aplicación de RECIST de las mediciones tumorales desarrolladas por el investigador para determinar la progresión de la enfermedad, tal y como se muestra en la Tabla 4. Se observó un riesgo relativo a favor de sunitinib en todos los subgrupos de las características basales evaluadas, incluyendo un análisis del número de tratamientos sistémicos previos. Un total de 29 pacientes en el grupo de sunitinib y de 24 en el grupo placebo no habían recibido ningún tratamiento sistémico previo; entre estos pacientes, el riesgo relativo de la PFS fue del 0,365 (95% IC: 0,156; 0,857), p = 0,0156. Análogamente, entre los 57 pacientes del grupo sunitinib (incluyendo 28 con 1 tratamiento sistémico previo y 29 con 2 o más tratamientos sistémicos previos) y 61 pacientes en el grupo placebo (incluyendo 25 con 1 tratamiento sistémico previo y 36 con 2 o más tratamientos sistémicos previos), el riesgo relativo para la PFS fue de 0,456 (95% IC: 0,264; 0,787), p = 0,0036.
Se realizó un análisis de sensibilidad de la PFS, en el que la progresión se determinó según las medidas del tumor notificadas por parte del investigador, y donde los sujetos descartados por razones distintas a la de la finalización del estudio fueron considerados como eventos de PFS. Este análisis proporcionó una estimación conservadora del efecto del tratamiento de sunitinib y apoyó el análisis primario, demostrando un riesgo relativo del 0,507 (95% IC: 0,350; 0,733), p = 0,000193. El ensayo pivotal en pNET finalizó de forma prematura según la recomendación del Comité de Monitorización independiente de Medicamento (Drug Monitoring Committee, DMC), y la variable de eficacia primaria estuvo basada en una evaluación del investigador, hechos ambos que pueden haber afectado a las estimaciones del efecto del tratamiento.
Con objeto de descartar sesgos en las evaluaciones de la PFS por parte de los investigadores, se llevó a cabo una revisión central, independiente y ciega de los escáneres; dicha revisión apoyó la evaluación de los investigadores, tal y como se muestra en la Tabla 4.
Tabla 4 - Resultados de eficacia en pNET del estudio en fase 3
|
Parámetro de Eficacia |
SUTENT (n = 86) |
Placebo (n = 85) |
RR (95% IC) |
P-valor |
|
Supervivencia Libre de Progresión [mediana, meses (95% IC)] según la Evaluación del Investigador |
11,4 (7,4; 19,8) |
5,5 (3,6; 7,4) |
0,418 (0,263; 0,662) |
0,0001a |
|
Supervivencia Libre de Progresión [mediana, meses (95% IC)] según la evaluación de la respuesta tumoral mediante la aplicación de RECIST por parte del investigador |
12,6 (7,4; 16,9) |
5,4 (3,5; 6,0) |
0,401 (0,252; 0,640) |
0,000066a |
|
Supervivencia Libre de Progresión [mediana, meses (95% IC)] según la revisión central, independiente y ciega de las evaluaciones tumorales |
12,6 (11.1; 20,6) |
5,8 (3,8; 7,2) |
0,315 (0,181; 0,546) |
0,000015a |
|
Supervivencia Global [seguimiento de 5 años] [mediana, meses (95% IC)] |
38,6 (25,6; 56,4) |
29,1 (16,4; 36,8) |
0,730 (0,504; 1,057) |
0,0940a |
|
Grado de Respuesta Objetiva [%, (95% IC)] |
9,3 (3,2; 15,4) |
0 |
NA |
0,0066b |
IC=Intervalo de Confianza, RR=Riesgo relativo, NA=No aplicable a Análisis rango-logarítmico de dos lados no estratificado b Análisis Exacto de Fisher
Figura 1 - Curva Kaplan-Meier de la PFS en el Estudio Fase 3 de pNET
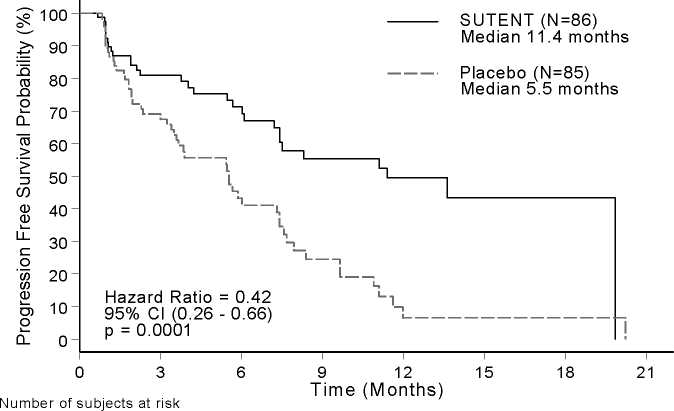
SUTENT 86 52 34 20 15 4 2
Placebo 85 42 20 9 2 2 2
Eje x = Tiempo (Meses); Eje y = Supervivencia Libre de Progresión (%);
-Sutent (N=86) Mediana 11,4 meses
------Placebo (N=85) Mediana 5,5 meses; Riesgo Relativo = 0,42 95% IC (0,26 - 0,66) p = 0,0001
Número de sujetos en riesgo
Los datos de OS no eran definitivos en el momento del cierre del ensayo [20,6 meses (95% IC: 20,6; No Alcanzado) para el grupo de sunitinib en comparación con No Alcanzado (95% IC: 15,5; No Alcanzado) para el grupo placebo, riesgo relativo: 0,409 (95% IC: 0,187; 0,894), p-valor = 0,0204]. Hubo 9 muertes en el grupo de sunitinib y 21 muertes en el grupo placebo.
En el momento de progresión de la enfermedad, se abrió el ciego y a los pacientes en el grupo de placebo se les ofreció el acceso a un ensayo de extensión separado y abierto con sunitinib. A consecuencia del cierre prematuro del ensayo, se abrió el ciego de los pacientes que continuaban y se les ofreció el acceso a un estudio de extensión abierto con sunitinib. Un total de 59 de los 85 (69,4%) pacientes del grupo placebo cambiaron al tratamiento abierto con sunitinib tras progresión de la enfermedad o tras la apertura del ciego en el momento del cierre del estudio. La supervivencia global observada tras un seguimiento de 5 años en el estudio de extensión reveló un riesgo relativo de 0,730 (95% IC: 0,504; 1,057).
Los resultados del Cuestionario de Calidad de Vida de la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC QLQ-C30) mostraron que la calidad de vida global relacionada con la salud y con las cinco escalas funcionales (físico, rol, cognitivo, emocional y social) se mantuvo en los pacientes en tratamiento con sunitinib en comparación con el grupo placebo con efectos adversos sintomáticos limitados.
Población pediátrica
La experiencia en el uso de sunitinib en pacientes pediátricos es limitada (ver sección 4.2 Población pediátrica).
Se realizó un estudio fase I de escalado de dosis con sunitinib oral en pacientes pediátricos y adultos jóvenes (de 2 a 21 años de edad) con tumores sólidos refractarios, la mayoría de los cuales tenían un diagnóstico primario de tumor cerebral en el momento de la inclusión. Se comprobó cardiotoxicidad limitante de la dosis en la primera parte del estudio, por lo que se modificó para excluir a los pacientes que habían sido tratados previamente con terapias potencialmente cardiotóxicas (como las antraciclinas) o radiación cardiaca. En la segunda parte del estudio, que incluía pacientes con tratamiento oncológico previo, pero sin factores de riesgo para la cardiotoxicidad, sunitinib fue generalmente tolerado y clínicamente manejable con dosis de 15 mg/m2 al día en el régimen 4/2. Ninguno de los pacientes consiguió una respuesta completa o parcial. Se comprobó enfermedad estable en 6 pacientes (17%). Se incluyó un paciente con GIST con un nivel de dosis de 15 mg/m2 que no mostró indicios de mejora. Las reacciones adversas observadas fueron en general similares a las observadas en adultos (ver sección 4.8).
Se realizó un análisis PK/PD y PK poblacional con el objetivo de extrapolar los valores PK y los criterios de valoración principales de la seguridad y eficacia de sunitinib a pacientes pediátricos con GIST (grupo de edad de 6 a 17 años). Este análisis se basó en los datos recopilados de adultos con GIST o tumores sólidos, y de pacientes pediátricos con tumores sólidos. Según el análisis por modelización, una edad más temprana y un menor tamaño corporal no parecen afectar negativamente a las respuestas de seguridad y eficacia a la exposición plasmática del medicamento. Una edad más temprana o un menor tamaño corporal no parecen afectar negativamente a la relación beneficio/riesgo de sunitinib, que se debió principalmente a la exposición plasmática del medicamento.
Según los resultados de PK, seguridad y eficacia del ensayo simulado, una dosis inicial de aproximadamente 25 mg/m2 al día en el régimen 4/2 en pacientes pediátricos con GIST (de 6 a 11 años de edad y de 12 a 17 años de edad) podría proporcionar exposiciones plasmáticas del medicamento y, en consecuencia, perfiles de seguridad y eficacia, comparables a los de los pacientes adultos con GIST tratados con 50 mg al día en régimen 4/2.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con SUTENT en uno o más subgrupos de la población pediátrica en GIST (ver sección 4.2 Población pediátrica).
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con SUTENT en los diferentes grupos de la población pediátrica en el tratamiento del carcinoma de riñón y pelvis renal (excluyendo nefroblastoma, nefroblastomatosis, sarcoma de células claras, nefroma mesoblástico, carcinoma medular renal y tumor rabdoide del riñón) (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con SUTENT en los diferentes grupos de la población pediátrica en el tratamiento de tumores neuroendocrinos gastroenteropancreáticos (excluyendo neuroblastoma, neuroganglioblastoma, feocromocitoma) (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Se evaluó la farmacocinética de sunitinib en 135 voluntarios sanos y 266 pacientes con tumores sólidos. La farmacocinética fue similar en todas las poblaciones de tumores sólidos analizadas así como en los voluntarios sanos.
En el rango de dosis de 25 a 100 mg, el área bajo la curva de concentración plasmática-tiempo (AUC) y la Cmax aumentan proporcionalmente con la dosis. Con la administración diaria repetida, sunitinib se acumula de 3 a 4 veces y su metabolito principal activo se acumula de 7 a 10 veces. Las concentraciones de sunitinib y su metabolito activo principal en el estado estacionario se alcanzan entre los 10 y 14 días. En el día 14, las concentraciones plasmáticas combinadas de sunitinib y su metabolito activo son de 62,9 - 101 ng/ml, que son las concentraciones diana calculadas en base a los datos no clínicos para inhibir la fosforilación del receptor in vitro y que tiene como resultado la reducción de estasis/crecimiento tumoral in vivo. El metabolito activo principal supone del 23 al 37% de la exposición total. El metabolito activo principal supone del 23 al 37% de la exposición total. No se observa ningún cambio significativo en la farmacocinética de sunitinib o en su metabolito activo principal con la administración diaria repetida o con los ciclos repetidos en los regímenes de dosis probados.
Absorción
Tras la administración oral de sunitinib, generalmente se observan las concentraciones máximas (Cmax) de 6 a 12 horas (Tmax) detrás la administración.
Los alimentos no tienen efecto sobre la biodisponibilidad de sunitinib.
Distribución
In vitro, la unión de sunitinib y su metabolito activo principal a proteínas plasmáticas humanas en los ensayos in vitro fue del 95% y del 90%, respectivamente, sin ninguna dependencia aparente de la concentración. El volumen aparente de distribución (Vd) para sunitinib fue elevado (2230 l), lo que indica que se distribuye a los tejidos.
Interacciones metabólicas
Los valores de Ki calculados in vitro para todas las isoformas del citocromo (CYP) que han sido ensayadas (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 y CYP4A9/11) indicaron que es improbable que sunitinib y su metabolito activo principal induzcan el metabolismo, de manera clínicamente relevante, de otros principios activos que se puedan metabolizar mediante estas enzimas.
Biotransformación
Sunitinib se metaboliza principalmente por CYP3A4, isoforma del citocromo P450, que origina su metabolito activo principal, desetil sunitinib, el cual es metabolizado aún más por el mismo isoenzima.
La co-administración de sunitinib con inductores o inhibidores potentes del CYP3A4, debe evitarse ya que se pueden alterar los niveles plasmáticos de sunitinib (ver secciones 4.4 y 4.5).
Eliminación
Se excreta principalmente a través de las heces (61%), siendo la eliminación renal del principio activo sin metabolizar y de sus metabolitos del 16% de la dosis administrada. Sunitinib y su metabolito activo principal fueron los compuestos principales que se identificaron en plasma, orina y heces, representando el 91,5%, 86,4% y 73,8% de la radioactividad en muestras combinadas, respectivamente. Se identificaron los metabolitos menores en la orina y las heces, pero en general, no fueron encontrados en el plasma. El aclaramiento oral total (CL/F) fue de 34 - 62 l/h. Después de la administración oral en voluntarios sanos, las semividas de eliminación de sunitinib y de su principal desetil metabolito activo son de aproximadamente 40 - 60 horas, y 80 - 110 horas, respectivamente.
Poblaciones especiales
Insuficiencia hepática: Sunitinib y su principal metabolito son metabolizados mayoritariamente en el hígado. La exposición sistémica tras una dosis única de sunitinib fue similar en sujetos con insuficiencia hepática leve o moderada (Child-Pugh Clases A y B) en comparación con sujetos con función hepática normal. SUTENT no ha sido estudiado en sujetos con insuficiencia hepática grave (Child-Pugh Clase C).
En los ensayos en pacientes oncológicos se excluyeron los pacientes con ALT o AST >2,5 x ULN (Por Encima del Límite Normal) o, si era debido a metástasis hepática, >5,0 x ULN.
Insuficiencia renal: Los análisis farmacocinéticos poblacionales indicaron que el aclaramiento aparente de sunitinib (CL/F) no fue afectado por el aclaramiento de creatinina dentro del rango evaluado (42 - 347 ml/ min.). La exposición sistémica tras la administración de una única dosis de sunitinib fue similar entre sujetos con insuficiencia renal grave (CLcr <30 ml/min) y sujetos con función renal normal (CLcr >80 ml/min). Aunque sunitinib y su metabolito principal no se eliminaron mediante hemodiálisis en sujetos con enfermedad renal terminal, las exposiciones sistémicas totales fueron un 47% inferiores para sunitinib y un 31% para su metabolito principal en comparación con sujetos con una función renal normal.
Peso, estado de salud: Los análisis farmacocinéticos poblacionales de los datos demográficos indican que no es necesario ningún ajuste de dosis en base al peso o a la escala del estado de salud ECOG
(Eastern Cooperative Oncology Group).
Sexo: Los datos disponibles indican que las mujeres podrían tener un aclaramiento aparente de sunitinib (CL/F) alrededor del 30% más bajo que los varones: sin embargo, esta diferencia no requiere ajustes de dosis.
Población pediátrica: La experiencia en el uso de sunitinib en pacientes pediátricos es limitada (ver sección 4.2 Población pediátrica). Se realizaron análisis de PK poblacional de una serie de datos combinados de pacientes adultos con GIST y tumores sólidos, así como de pacientes pediátricos con tumores sólidos. Se realizaron análisis por modelización escalonados de covariables para estudiar el efecto de la edad y el tamaño corporal (peso corporal total o superficie corporal), así como de otras covariables sobre parámetros PK clave para sunitinib y su metabolito activo. De las covariables asociadas a la edad y el tamaño corporal estudiadas, la edad fue una covariable significativa en el aclaramiento aparente de sunitinib (cuanto menor es la edad del paciente pediátrico, menor es el aclaramiento aparente). De manera similar, la superficie corporal fue una covariable significativa en el aclaramiento aparente del metabolito activo (cuanto menor es la superficie corporal, menor es el aclaramiento aparente). Según los resultados finales del modelo de ensayo simulado de PK, y teniendo en cuenta todos los efectos de las covariables, una dosis de sunitinib de 25 mg/m2 al día en pacientes pediátricos (de 6 a 11 años de edad y de 12 a 17 años de edad) con GIST podría proporcionar exposiciones plasmáticas del medicamento comparables a las de los pacientes adultos con GIST tratados con 50 mg al día en el régimen 4/2.
5.3 Datos preclínicos sobre seguridad
En los estudios toxicológicos de dosis repetidas en ratas y monos de hasta 9 meses de duración, se identificaron los efectos principales sobre el órgano diana en el tracto gastrointestinal (emesis y diarrea en monos); la glándula adrenal (congestión cortical y/o hemorragia en ratas y monos, con necrosis seguido de fibrosis en ratas); el sistema hemolinfopoyético (hipocelularidad de la médula ósea y depleción linfoide del timo, del bazo y del nódulo linfático); el páncreas exocrino (degranulación de la célula acinar con necrosis de célula única); las glándulas salivares (hipertrofia acinar); la articulación ósea (engrasamiento de la placa de crecimiento); el útero (atrofia); y los ovarios (desarrollo folicular disminuido). Todos estos hallazgos se produjeron a niveles de exposición plasmática de sunitinib clínicamente relevantes. Se observaron efectos adicionales en otros estudios, incluido: prolongación del intervalo QTc, reducción de la fracción de eyección del ventrículo izquierdo y atrofia tubular testicular, incremento de las células mesangiales del riñón, hemorragia en el tracto gastrointestinal y en la mucosa oral, e hipertrofia de las células de la hipófisis anterior. Se piensa que los cambios en el útero (atrofia endometrial) y en la placa de crecimiento óseo (engrasamiento fiseal o displasia de cartílago) están relacionados con la acción farmacológica de sunitinib. La mayoría de estos hallazgos fueron reversibles después de 2 a 6 semanas sin tratamiento.
Genotoxicidad
Se valoró el potencial genotóxico de sunitinib in vitro e in vivo. Sunitinib no fue mutagénico en bacterias a las que se produjo una activación metabólica mediante hígado de rata. Sunitinib no indujo aberraciones cromosómicas estructurales en las células linfocíticas de sangre periférica humana in vitro. Se observó poliploidia (aberraciones cromosómicas numéricas) en los linfocitos de sangre periférica humana in vitro, tanto en presencia como en ausencia de activación metabólica. Sunitinib no fue clastogénico en médula ósea de ratas in vivo. No se evaluó el potencial genotóxico del metabolito activo principal.
Carcinogenicidad
En un estudio de búsqueda de rango de dosis con alimentación forzada oral de 1 mes de duración (0, 10, 25, 75, o 200 mg/kg/día) y una administración diaria continuada en ratones transgénicos rasH2, a la dosis más alta estudiada (200 mg/kg/día) se observaron carcinoma e hiperplasia de las glándulas de Brunner del duodeno.
Se llevó a cabo un estudio de carcinogenicidad con alimentación forzada oral de 6 meses de duración (0, 8, 25, 75 [reducido a 50] mg/kg/día), con administración diaria en ratones transgénicos rasH2. Fueron observados carcinomas gastroduodenales, un aumento en la incidencia de hemangiosarcomas de fondo y/o hiperplasia de la mucosa gástrica a dosis de >25 mg/kg/día tras 1- ó 6-meses de duración (>7,3 veces el área bajo la curva (AUC) en pacientes a los que se les administró la dosis diaria recomendada [DDR]).
En un estudio de carcinogenicidad en ratas de 2 años de duración (0, 0.33, 1 ó 3 mg/kg/día), la administración de sunitinib en ciclos de 28 días seguido de un periodo de 7 días sin dosificación, dio lugar a incrementos en la incidencia de feocromocitomas e hiperplasia en la médula adrenal de ratas macho a las que se les administró 3 mg/kg/día tras más de 1 año de dosificación (>7,8 veces el AUC en pacientes a los que se les administra la DDR). Se observó carcinoma de glándulas de Brunner en el duodeno a >1 mg/kg/día en las hembras y a 3 mg/kg/día en los machos, mientras que la hiperplasia de las células de la mucosa resultó evidente en el estómago glandular a 3 mg/kg/día en los machos, lo cual sucedió a >0.9, 7.8 y 7.8 veces el AUC de pacientes a los que se les administró la DDR, respectivamente. No está clara la relevancia para los humanos de los hallazgos neoplásicos observados en los estudios de carcinogenicidad de ratones (transgénicos rasH2) y ratas en tratamiento con sunitinib.
Toxicidad reproductiva y del desarrollo
No se observaron efectos sobre la fertilidad masculina ni femenina en estudios de toxicidad reproductiva. Sin embargo, en los estudios toxicológicos de dosis repetidas realizados en ratas y en monos, se observaron efectos en la fertilidad de las hembras en forma de atresia folicular, degeneración del cuerpo lúteo, cambios endometriales en el útero y disminución del peso del útero y de los ovarios, a niveles de exposición sistémica clínicamente relevantes. Se observaron efectos en la fertilidad de ratas macho en forma de atrofia tubular en los testículos, reducción de espermatozoides en el epidídimo y depleción coloidal en la próstata y en las vesículas seminales, a exposiciones plasmáticas 25 veces la exposición sistémica en humanos.
En ratas, se evidenció mortalidad embrio-fetal como reducciones significativas en el número de fetos vivos, incremento del número de reabsorciones embrionarias, incremento de pérdidas postimplantación, y pérdida total de la camada en 8 de 28 hembras preñadas, a niveles de exposición sistémica 5,5 veces la exposición sistémica en humanos. En conejos, el descenso en el peso de úteros grávidos y en el número de fetos vivos se debió a un aumento en el número de reabsorciones embrionarias, incrementos en las pérdidas postimplantación, y pérdida completa de la camada en 4 de 6 hembras preñadas a niveles de exposición sistémica 3 veces la exposición sistémica en humanos. El tratamiento con sunitinib en ratas durante la organogénesis produjo efectos en el desarrollo a >5 mg/kg/día consistentes en una mayor incidencia de malformaciones esqueléticas del feto, predominantemente clasificadas como osificación retardada de las vértebras torácicas/lumbares y que se observaron a una exposición de niveles plasmáticos 5,5 veces la exposición sistémica en humanos. En conejos, los efectos sobre el desarrollo consistieron en una incidencia incrementada de labio leporino, a niveles de exposición plasmática de 2,7 veces la exposición sistémica en humanos.
Sunitinib (0,3; 1,0; 3,0 mg/kg/día) se evaluó en un estudio de desarrollo pre- y postnatal en ratas preñadas. La ganancia de peso maternal se redujo durante la gestación y la lactancia a >1 mg/kg/día, pero no se observó toxicidad reproductiva maternal a dosis hasta 3 mg/kg/día (exposición estimada >2,3 veces el AUC en pacientes a los que se les ha administrado la DDR). Se observaron disminuciones en el peso corporal de las crías durante los periodos pre-destete y post-destete a 3 mg/kg/día. No se observó toxicidad en el desarrollo a 1 mg/kg/día (exposición aproximada >0,9 veces el AUC en pacientes a los que se ha administrado la DDR).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cápsulas duras de 12,5 mg Contenido de la cápsula Manitol (E421)
Croscarmelosa de sodio Povidona (K-25)
Estearato de magnesio
Cubierta de la cápsula Gelatina
Óxido de hierro rojo (E172)
Dióxido de titanio (E171)
Tinta de impresión Shellac Propilenglicol Hidróxido de sodio Povidona
Dióxido de titanio (E171)
Cápsulas duras de 25 mg Contenido de la cápsula Manitol (E421)
Croscarmelosa de sodio Povidona (K-25)
Estearato de magnesio
Cubierta de la cápsula naranja Gelatina
Óxido de hierro rojo (E172)
Dióxido de titanio (E171)
Cubierta de la cápsula color caramelo Gelatina
Dióxido de titanio (E171)
Óxido de hierro amarillo (E172)
Óxido de hierro rojo (E172)
Óxido de hierro negro (E172)
Tinta de impresión Shellac Propilenglicol Hidróxido de sodio Povidona
Dióxido de titanio (E171)
Cápsulas duras de 37,5 mg Contenido de la cápsula Manitol (E421)
Croscarmelosa de sodio Povidona (K-25)
Estearato de magnesio
Cubierta de la cápsula Gelatina
Dióxido de titanio (E171)
Óxido de hierro amarillo (E172)
Tinta de impresión
Shellac
Propilenglicol
Hidróxido de potasio
Óxido de hierro negro (E172)
Cápsulas duras de 50 mg Contenido de la cápsula Manitol (E421)
Croscarmelosa de sodio Povidona (K-25)
Estearato de magnesio
Cubierta de la cápsula Gelatina
Dióxido de titanio (E171)
Óxido de hierro amarillo (E172)
Óxido de hierro rojo (E172)
Óxido de hierro negro (E172)
Tinta de impresión Shellac Propilenglicol Hidróxido de sodio Povidona
Dióxido de titanio (E171)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere ninguna precaución especial de conservación.
6.5 Naturaleza y contenido del envase
Frascos de polietileno de alta densidad (HDPE) con cierre de polipropileno, que contienen 30 cápsulas duras.
Blíster unidosis troquelado de poli(clorotrifluoroetileno)/PVC transparente y lámina de aluminio, recubierto con laca termosellada que contiene 28 x 1 cápsulas duras.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Ltd Ramsgate Road Sandwich, Kent CT13 9NJ Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
SUTENT 12,5 mg cápsulas duras
EU/1/06/347/001
EU/1/06/347/004
SUTENT 25 mg cápsulas duras
EU/1/06/347/002
EU/1/06/347/005
SUTENT 37,5 mg cápsulas duras
EU/1/06/347/007
EU/1/06/347/008
SUTENT 50 mg cápsulas duras
EU/1/06/347/003
EU/1/06/347/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 19/julio/2006 Fecha de la última renovación: 9/enero/2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
PFIZER Italia S.r.l Via del Commercio Zona Industriale
IT-63100 Marino del Tronto (Ascoli Piceno)
Italia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Sutent 12,5 mg cápsulas duras Sunitinib
2. PRINCIPIO(S) ACTIVO(S)_
Cada cápsula contiene malato de sunitinib, equivalente a 12,5 mg de sunitinib
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 cápsulas duras
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Este medicamento no requiere condiciones especiales de conservación.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/347/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sutent 12,5 mg
FRASCOS DE HDPE - CÁPSULAS DE 12,5 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Sutent 12,5 mg cápsulas duras
Sunitinib
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 cápsulas
6. OTROS
1. NOMBRE DEL MEDICAMENTO
Sutent 25 mg cápsulas duras Sunitinib
2. PRINCIPIO(S) ACTIVO(S)_
Cada cápsula contiene malato de sunitinib, equivalente a 25,0 mg de sunitinib
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 cápsulas duras
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Este medicamento no requiere condiciones especiales de conservación.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/347/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sutent 25 mg
FRASCOS DE HDPE - CÁPSULAS DE 25 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Sutent 25 mg cápsulas duras
Sunitinib
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 cápsulas
6. OTROS
1. NOMBRE DEL MEDICAMENTO
Sutent 37,5 mg cápsulas duras Sunitinib
2. PRINCIPIO(S) ACTIVO(S)
Cada cápsula contiene malato de sunitinib, equivalente a 37,5 mg de sunitinib
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 cápsulas duras
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Este medicamento no requiere condiciones especiales de conservación.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/347/007
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sutent 37,5 mg
FRASCOS DE HDPE - CÁPSULAS DE 37,5 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Sutent 37,5 mg cápsulas duras
Sunitinib
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 cápsulas
6. OTROS
1. NOMBRE DEL MEDICAMENTO
Sutent 50 mg cápsulas duras Sunitinib
2. PRINCIPIO(S) ACTIVO(S)_
Cada cápsula contiene malato de sunitinib, equivalente a 50,0 mg de sunitinib
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 cápsulas duras
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Este medicamento no requiere condiciones especiales de conservación.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/347/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sutent 50 mg
FRASCOS DE HDPE - CÁPSULAS DE 50 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Sutent 50 mg cápsulas duras
Sunitinib
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
30 cápsulas
6. OTROS
1. NOMBRE DEL MEDICAMENTO
Sutent 12,5 mg cápsulas duras Sunitinib
|
2. |
PRINCIPIO(S) ACTIVO(S) |
|
Cada cápsula contiene malato de sunitinib, equivalente a 12,5 mg de sunitinib | |
|
3. |
LISTA DE EXCIPIENTES |
|
4. |
FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE |
|
28 x |
1 cápsulas duras |
|
5. |
FORMA Y VÍA(S) DE ADMINISTRACIÓN |
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Este medicamento no requiere condiciones especiales de conservación.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/347/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sutent 12,5 mg
1. NOMBRE DEL MEDICAMENTO
Sutent 12,5 mg cápsulas duras Sunitinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Ltd
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
LUN
MAR
MIÉ
JUE
VIE
SÁB
DOM
1. NOMBRE DEL MEDICAMENTO
Sutent 25 mg cápsulas duras Sunitinib
|
2. |
PRINCIPIO(S) ACTIVO(S) |
|
Cada cápsula contiene malato de sunitinib, equivalente a 25 mg de sunitinib | |
|
3. |
LISTA DE EXCIPIENTES |
|
4. |
FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE |
|
28 x |
1 cápsulas duras |
|
5. |
FORMA Y VÍA(S) DE ADMINISTRACIÓN |
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Este medicamento no requiere condiciones especiales de conservación.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/347/005
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sutent 25 mg
1. NOMBRE DEL MEDICAMENTO
Sutent 25 mg cápsulas duras Sunitinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Ltd
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
LUN
MAR
MIÉ
JUE
VIE
SÁB
DOM
1. NOMBRE DEL MEDICAMENTO
Sutent 37,5 mg cápsulas duras Sunitinib
|
2. |
PRINCIPIO(S) ACTIVO(S) |
|
Cada cápsula contiene malato de sunitinib, equivalente a 37,5 mg de sunitinib | |
|
3. |
LISTA DE EXCIPIENTES |
|
4. |
FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE |
|
28 x |
1 cápsulas duras |
|
5. |
FORMA Y VÍA(S) DE ADMINISTRACIÓN |
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Este medicamento no requiere condiciones especiales de conservación.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/347/008
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sutent 37,5 mg
1. NOMBRE DEL MEDICAMENTO
Sutent 37,5 mg cápsulas duras Sunitinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Ltd
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
LUN
MAR
MIÉ
JUE
VIE
SÁB
DOM
1. NOMBRE DEL MEDICAMENTO
Sutent 50 mg cápsulas duras Sunitinib
|
2. |
PRINCIPIO(S) ACTIVO(S) |
|
Cada cápsula contiene malato de sunitinib, equivalente a 50,0 mg de sunitinib | |
|
3. |
LISTA DE EXCIPIENTES |
|
4. |
FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE |
|
28 x |
1 cápsulas duras |
|
5. |
FORMA Y VÍA(S) DE ADMINISTRACIÓN |
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Este medicamento no requiere condiciones especiales de conservación.
Pfizer Ltd Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/347/006
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sutent 50 mg
1. NOMBRE DEL MEDICAMENTO
Sutent 50 mg cápsulas duras Sunitinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Ltd
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
LUN
MAR
MIÉ
JUE
VIE
SÁB
DOM
B. PROSPECTO
Prospecto: información para el usuario
SUTENT 12,5 mg cápsulas duras SUTENT 25 mg cápsulas duras SUTENT 37,5 mg cápsulas duras SUTENT 50 mg cápsulas duras
Sunitinib
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Sutent y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Sutent
3. Cómo tomar Sutent
4. Posibles efectos adversos
5. Conservación de Sutent
6. Contenido del envase e información adicional
1. Qué es Sutent y para qué se utiliza
Sutent contiene el principio activo sunitinib, el cual es un inhibidor de la protein-quinasa. Se utiliza para el tratamiento del cáncer y actúa mediante la prevención de la actividad de un grupo especial de proteínas que están involucradas en el crecimiento y proliferación de las células cancerosas.
Sutent únicamente le será recetado por un médico con experiencia en el uso de medicamentos anticancerosos.
Sutent se utiliza para tratar a adultos con los siguientes tipos de cáncer:
- Tumor del estroma gastrointestinal (GIST), un tipo de cáncer del estómago y del intestino, cuando imatinib (otro medicamento antitumoral) ya ha fracasado o cuando no se puede tomar imatinib.
- Carcinoma de células renales metastásico (CCRM), un tipo de cáncer de los riñones que tiene implicaciones en otras partes del cuerpo.
- Tumores neuroendocrinos pancreáticos (pNET) (tumores de las células secretoras de hormonas en el páncreas) que han progresado o que no se pueden extirpar con cirugía.
Si tiene alguna duda sobre cómo funciona Sutent o por qué este medicamento le ha sido recetado, consulte a su médico.
2. Qué necesita saber antes de empezar a tomar Sutent
No tome Sutent
- si es alérgico a sunitinib o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte con su médico antes de empezar a tomar Sutent
- Si tiene la tensión arterial alta. Sutent puede aumentar la tensión arterial. Su médico puede controlar su tensión arterial durante el tratamiento con Sutent, y de ser necesario, se le puede tratar con medicamentos que reducen la tensión arterial.
- Si tiene o ha tenido alteraciones sanguíneas, problemas de sangrados o moratones. El
tratamiento con Sutent puede dar lugar a un riesgo alto de sangrados o producir cambios en el número de ciertas células de la sangre lo que puede ocasionar anemia o afectar a la capacidad de coagulación de la sangre. Si está tomando warfarina o acenocumarol, medicamentos que diluyen la sangre para evitar trombos, puede haber un mayor riesgo de sangrado. Si durante el tratamiento con Sutent tiene algún sangrado, consulte con su médico.
- Si tiene problemas de corazón. Sutent puede causar problemas de corazón. Consulte con su médico si se encuentra muy cansado, se queda sin aliento o si tiene los pies y los tobillos hinchados.
- Si tiene cambios anormales en el ritmo del corazón. Sutent puede causar anomalías en el ritmo del corazón. Su médico puede obtener electrocardiogramas para evaluar estos problemas durante el tratamiento con Sutent. Consulte con su médico si durante el tratamiento con Sutent se siente mareado, débil o tiene latidos anormales en el corazón.
- Si ha tenido algún problema reciente de trombos sanguíneos en venas y/o arterias (tipos de vasos sanguíneos), incluyendo ictus, infarto de miocardio, embolia o trombosis.
Contacte con su médico inmediatamente si tiene síntomas tales como dolor o presión en el pecho, dolor en los brazos, espalda, cuello o mandíbula, falta de aliento, adormecimiento o debilidad en un lado del cuerpo, problemas al hablar, dolor de cabeza o mareo mientras se encuentra en tratamiento con Sutent.
- Si sufre o ha sufrido daño en los vasos sanguíneos más pequeños conocido como microangiopatía trombótica (MAT). Contacte con su médico si experimenta fiebre, fatiga, cansancio, moratones, sangrado, hinchazón, confusión, pérdida de visión y convulsiones.
- Si tiene problemas en las glándulas tiroides. Sutent puede causar problemas en las glándulas tiroides. Contacte con su médico si se encuentra cansado con mayor facilidad, tiene habitualmente más frío que otras personas o su voz se vuelve más grave mientras está tomando Sutent. Antes del tratamiento con Sutent se debe controlar la función tiroidea y de manera periódica mientras lo está tomando. Si su glándula tiroidea no segrega suficiente hormona tiroidea, se le puede tratar con hormona tiroidea sustitutiva.
- Si tiene o ha tenido alteraciones pancreáticas o trastornos de la vesícula biliar. Contacte con su médico si desarrolla cualquiera de los siguientes signos y síntomas: dolor en la zona del estómago (parte alta del abdomen), náuseas, vómitos y fiebre. Estos pueden estar causados por inflamación del páncreas o de la vesícula biliar.
- Si tiene o ha tenido problemas de hígado. Contacte con su médico si desarrolla cualquiera de los siguientes signos y síntomas de problemas en el hígado durante el tratamiento con Sutent:
prurito, ojos o piel amarillos, orina oscura y dolor o molestias en la zona superior derecha del estómago. Su médico debe hacerle análisis de sangre para monitorizar la función hepática antes y durante el tratamiento con Sutent, así como cuando esté clínicamente indicado.
- Si tiene o ha tenido problemas de riñón. Su médico monitorizará su función renal.
- Si se va a someter a una cirugía o si ha tenido una operación recientemente. Sutent puede afectar la manera de cicatrización de las heridas. Si se va a someter a una operación, por lo general dejará de tomar Sutent. Su médico decidirá cuándo empezar con Sutent de nuevo.
- Antes de iniciar el tratamiento con Sutent es posible que se le aconseje una revisión dental.
- si tiene o ha tenido dolor en la boca, los dientes y/o el maxilar, hinchazón o llagas dentro de la boca, entumecimiento o una sensación de pesadez en el maxilar, o de que se le mueve algún diente, dígaselo de inmediato a su médico y a su dentista.
- si necesita hacerse un tratamiento dental invasivo o una cirugía dental, dígale a su dentista que está en tratamiento con Sutent, particularmente si además está en tratamiento o ha sido tratado con bifosfonatos por vía intravenosa. Los bifosfonatos son medicamentos utilizados para evitar complicaciones en los huesos que pueden ocurrir por alguna otra situación médica.
- Si tiene o ha tenido trastornos de la piel y del tejido subcutáneo. Durante el tratamiento con este medicamento se puede producir “pioderma gangrenoso” (ulceración dolorosa de la piel) o “fascitis necrotizante” (infección de la piel/los tejidos blandos que se propaga con rapidez y puede resultar mortal). Esta reacción es generalmente reversible tras la interrupción del tratamiento. Se han notificado, asociados al uso de sunitinib, casos de erupción cutánea grave (síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, eritema multiforme) que tenían inicialmente el aspecto de manchas rojizas parecidas a dianas o de manchas circulares, a menudo acompañadas de ampollas centrales en el tronco. Dicha erupción puede progresar hasta formar ampollas diseminadas o hasta provocar la descamación de la piel, y pueden ser amenazantes para la vida. Consulte inmediatamente a su médico si usted desarrolla una erupción cutánea o los síntomas cutáneos indicados.
- Si tiene o ha tenido convulsiones. Si tiene la presión arterial alta, dolor de cabeza o pérdida de visión, notifíqueselo a su médico tan pronto como sea posible.
- Si tiene diabetes. Se deben comprobar con regularidad los niveles de glucosa en sangre de los pacientes diabéticos, con el fin de valorar si es necesario ajustar la dosis del antidiabético para reducir al mínimo el riesgo de azúcar bajo en sangre.
Niños y adolescentes
No se recomienda el uso de Sutent en población de edad inferior a 18 años.
Toma de Sutent con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que
tomar cualquier otro medicamento, incluso los adquiridos sin receta.
Algunos medicamentos pueden afectar los niveles de Sutent en su organismo. Debe informar a su
médico si está tomando medicamentos que contengan alguno de los siguientes principios activos:
• ketoconazol, itraconazol - utilizados para tratar infecciones fungicas
• eritromicina, claritromicina, rifampicina - utilizados para tratar infecciones
• ritonavir - utilizado para tratar el SIDA
• dexametasona - un corticoesteroide utilizado para diversas enfermedades
• fenitoína, carbamazepina, fenobarbital - utilizados para tratar la epilepsia y otras enfermedades neurológicas
• hierbas medicinales que contengan Hierba de San Juan o hipérico (Hypericum perforatum) -utilizada para el tratamiento de la depresión y la ansiedad
Toma de Sutent con alimentos y bebidas
Debe evitar tomar zumo de pomelo mientras se encuentre en tratamiento con Sutent.
Embarazo y lactancia
Si está embarazada o piensa que pudiera estarlo, informe a su médico.
No debe utilizar Sutent durante el embarazo a menos que sea estrictamente necesario. Su médico le informará de los riesgos potenciales de tomar Sutent durante el embarazo.
Si puede quedarse embarazada, debe utilizar medidas anticonceptivas fiables durante el tratamiento con Sutent.
Si está dando el pecho a su hijo, informe a su médico. No debe dar el pecho a su hijo durante el tratamiento con Sutent.
Conducción y uso de máquinas
Si experimenta mareos o un cansancio inusual, tenga especial cuidado cuando conduzca o utilice maquinaria.
3. Cómo tomar Sutent
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
Su médico establecerá la dosis correcta para usted dependiendo del tipo de cáncer que se vaya a tratar. Si va a recibir tratamiento para GIST o CCRM, la dosis habitual es de 50 mg una vez al día durante 28 días (4 semanas), seguido por 14 días (2 semanas) de descanso (sin medicación) en ciclos de 6 semanas. Si va a recibir tratamiento para pNET, la dosis habitual es de 37,5 mg una vez al día sin periodo de descanso.
Su médico le indicará la dosis adecuada que necesita tomar, así como también si necesita suspender el tratamiento con Sutent y en qué momento.
Sutent puede tomarse con o sin alimentos.
Si toma más Sutent del que debe
Si usted ha tomado accidentalmente demasiadas cápsulas, consulte a su médico inmediatamente. Puede que requiera atención médica.
Si olvidó tomar Sutent
No tome una dosis doble para compensar las dosis olvidadas.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Debe contactar inmediatamente con su médico si experimenta alguno de estos efectos adversos graves (ver también Qué necesita saber antes de empezar a tomar Sutent):
Problemas de corazón. Consulte con su médico si se encuentra muy cansado, se queda sin aliento o si tiene los pies y los tobillos hinchados. Pueden ser síntomas de problemas de corazón que pueden incluir insuficiencia cardiaca y problemas del músculo cardiaco (cardiomiopatía).
Problemas pulmonares o respiratorios. Consulte con su médico si desarrolla tos, dolor en el pecho, aparición repentina de problemas para respirar o expectora sangre. Pueden ser síntomas de una situación denominada embolismo pulmonar que ocurre cuando los coágulos de sangre viajan a los pulmones.
Alteraciones en el riñón. Consulte con su médico si experimenta una alteración en la frecuencia o una ausencia de orina, ya que pueden ser síntomas de insuficiencia renal.
Sangrados. Consulte con su médico de inmediato si tiene alguno de estos síntomas o un problema de sangrado grave durante el tratamiento con Sutent: estómago (abdomen) dolorido o hinchado, vomita sangre, tiene heces negras y viscosas, orina con sangre, tiene dolor de cabeza o algún cambio en su estado mental, tos con sangre o esputos sanguinolentos de los pulmones o las vías respiratorias.
Destrucción del tumor produciendo una perforación en el intestino. Consulte con su médico si tiene dolor abdominal grave, fiebre, náuseas, vómitos, sangre en heces o cambios en los hábitos de deposición.
Otros efectos adversos con Sutent pueden incluir:
Efectos adversos muy frecuentes (pueden afectar a más de 1 paciente de cada 10)
• Reducción del número de plaquetas, glóbulos rojos y/o glóbulos blancos (por ejemplo, neutrófilos).
• Dificultad para respirar.
• Tensión arterial alta.
• Cansancio extremo, pérdida de fuerza.
• Hinchazón rápida de tejidos causada por líquidos debajo de la piel y alrededor del ojo, erupción alérgica grave.
• Dolor/irritación bucal, llagas en la boca/inflamación/sequedad en la boca, trastornos del sentido del gusto, molestias en el estómago, náuseas, vómitos, diarrea, estreñimiento, dolor/hinchazón abdominal, pérdida/disminución del apetito.
• Disminución de la actividad de la glándula tiroides (hipotiroidismo).
• Mareo.
• Dolor de cabeza.
• Sangrado de la nariz.
• Dolor de espalda, dolor de las articulaciones.
• Dolor en brazos y piernas.
• Piel amarilla/decoloración de la piel, exceso de pigmentación de la piel, cambio en el color de pelo, erupción cutánea en las palmas de las manos y las plantas de los pies, erupción, sequedad de la piel.
• Tos.
• Fiebre.
• Dificultad para conciliar el sueño.
Efectos adversos frecuentes (pueden afectar de 1 a 10 pacientes de cada 100)
• Coágulos de sangre en los vasos sanguíneos.
• Falta de riego sanguíneo al músculo cardiaco debido a la obstrucción o constricción de las arterias coronarias.
• Dolor en el pecho.
• Disminución en la cantidad de sangre que bombea el corazón.
• Retención de líquidos incluido alrededor de los pulmones.
• Infecciones.
■ Nivel de azúcar disminuido en sangre. Si experimenta cualquiera de los signos y síntomas de
bajo nivel de azúcar en sangre: Consulte a su médico tan pronto como sea posible si experimenta fatiga, palpitaciones, sudor, hambre y pérdida de consciencia.
• Pérdida de proteínas en la orina que puede provocar hinchazón.
• Síndrome pseudogripal.
• Alteración de los análisis de sangre incluyendo las enzimas del páncreas y del hígado.
• Nivel elevado de ácido úrico en sangre.
• Hemorroides, dolor en el recto, sangrado gingival, dificultad para tragar o incapacidad para tragar.
• Sensación de quemazón o dolor en la lengua, inflamación del revestimiento del tracto digestivo, exceso de gases en el estómago o en el intestino.
• Pérdida de peso.
• Dolor musculoesquelético (dolor en músculos y huesos), debilidad, fatiga muscular, dolor muscular, espasmos musculares.
• Sequedad nasal, congestión nasal.
• Excesiva producción de lágrimas.
• Sensación anormal en la piel, sequedad de la piel, picor, piel escamosa e inflamada, ampollas, acné, cambio de color de las uñas, caída del cabello.
• Sensación anormal en las extremidades.
• Sensibilidad anormalmente disminuida/aumentada, especialmente al tacto.
• Ardor de estómago.
• Deshidratación.
• Sofocos.
• Coloración anormal de la orina.
• Depresión.
• Escalofríos.
Efectos adversos poco frecuentes (pueden afectar de 1 a 10 pacientes de cada 1.000)
• Infección potencialmente mortal de tejidos blandos, incluyendo la región ano-genital. Consulte con su médico inmediatamente si los síntomas de la infección aparecen alrededor de una herida en la piel, incluyendo fiebre, dolor, enrojecimiento, hinchazón o drenaje de pus o sangre.
• Accidente cerebrovascular.
• Infarto de miocardio causado por la interrupción o la disminución del riego sanguíneo al corazón.
• Cambios en la actividad eléctrica o ritmo anormal del corazón.
• Líquido alrededor del corazón (derrame pericárdico).
• Insuficiencia hepática.
• Dolor de estómago (abdomen) causado por la inflamación del páncreas.
• Destrucción del tumor produciendo un agujero en el intestino (perforación).
• Inflamación (hinchazón y enrojecimiento) de la vesícula biliar, asociada o no a cálculos biliares.
• Tubo anormal como si fuera un conducto desde una cavidad corporal normal a otra cavidad corporal o a la piel.
• Dolor en la boca, los dientes y/o el maxilar, hinchazón o llagas dentro de la boca, entumecimiento o una sensación de pesadez en el maxilar, o de que se le mueve algún diente. Todos ellos pueden ser signos y síntomas de daño óseo en la mandíbula (osteonecrosis). Consulte con su médico y dentista inmediatamente si experimenta alguno de ellos.
• Sobreproducción de hormonas tiroideas que incrementan la cantidad de energía que el organismo consume en reposo.
• Problemas con la cicatrización de las heridas tras cirugía.
• Nivel elevado en sangre de una enzima (creatinfosfoquinasa) del músculo.
• Reacción inadecuada y excesiva a un alérgeno.
Efectos adversos raros (pueden afectar de 1 a 10 pacientes de cada 10.000)
• Reacción cutánea y/o de las membranas mucosas grave (síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, eritema multiforme).
• Síndrome de lisis tumoral (SLT) - el SLT engloba una serie de complicaciones metabólicas que pueden ocurrir durante el tratamiento del cáncer. Estas complicaciones están causadas por los productos liberados por las células cancerígenas que mueren, y pueden ser las siguientes: náuseas, falta de aliento, latido cardiaco irregular, calambres musculares, convulsiones, oscurecimiento de la orina y cansancio, asociados a unos resultados analíticos del laboratorio anormales (niveles altos de potasio, ácido úrico y fósforo, y niveles bajos de calcio en sangre) que pueden dar lugar a cambios en la función renal y a insuficiencia renal aguda.
• Rotura anormal de los músculos que puede conducir a problemas en el riñón (rabdomiolisis).
• Cambios anormales en el cerebro que pueden provocar una serie de síntomas que incluyen dolor de cabeza, confusión, convulsiones y pérdida de la visión (síndrome de leucoencefalopatía posterior reversible).
• Ulceración dolorosa de la piel (pioderma gangrenoso).
• Inflamación del hígado (hepatitis).
• Inflamación de la glándula tiroides.
• Daño en los vasos sanguíneos más pequeños conocido como microangiopatía trombótica (MAT).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Sutent
• Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en el envase exterior
y la etiqueta después de CAD. La fecha de caducidad es el último día del mes que se indica.
• Este medicamento no requiere condiciones especiales de conservación.
• No utilice este medicamento si observa que el envase está dañado o muestra signos de haber
sido abierto.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Composición de Sutent
Sutent 12,5 mg cápsulas duras
El principio activo es sunitinib. Cada cápsula contiene malato de sunitinib equivalente a 12,5 mg de
sunitinib.
Los demás componentes son:
- Contenido de la cápsula: manitol (E421), croscarmelosa sódica, povidona (K-25) y estearato de magnesio.
- Cubierta de la cápsula: gelatina, óxido de hierro rojo (E172) y dióxido de titanio (E171).
- Tinta de impresión: shellac, propilenglicol, hidróxido de sodio, povidona y dióxido de titanio (E171).
Sutent 25 mg cápsulas duras
El principio activo es sunitinib. Cada cápsula contiene malato de sunitinib equivalente a 25 mg.
Los demás componentes son:
- Contenido de la cápsula: manitol (E421), croscarmelosa sódica, povidona (K-25) y estearato de magnesio.
- Cubierta de la cápsula: gelatina, dióxido de titanio (E171), óxido de hierro amarillo (E172), óxido de hierro rojo (E172) y óxido de hierro negro (E172).
- Tinta de impresión: shellac, propilenglicol, hidróxido de sodio, povidona y dióxido de titanio (E171).
Sutent 37,5 mg cápsulas duras
El principio activo es sunitinib. Cada cápsula contiene malato de sunitinib equivalente a 37,5 mg.
Los demás componentes son:
- Contenido de la cápsula: manitol (E421), croscarmelosa sódica, povidona (K-25) y estearato de magnesio.
- Cubierta de la cápsula: gelatina, dióxido de titanio (E171), óxido de hierro amarillo (E172).
- Tinta de impresión: shellac, propilenglicol, hidróxido de potasio, óxido de hierro negro (E172).
Sutent 50 mg cápsulas duras
El principio activo es sunitinib. Cada cápsula contiene malato de sunitinib equivalente a 50 mg.
Los demás componentes son:
- Contenido de la cápsula: manitol (E421), croscarmelosa sódica, povidona (K-25) y estearato de magnesio.
- Cubierta de la cápsula: gelatina, dióxido de titanio (E171), óxido de hierro amarillo (E172), óxido de hierro rojo (E172) y óxido de hierro negro (E172).
- Tinta de impresión: shellac, propilenglicol, hidróxido de sodio, povidona y dióxido de titanio (E171).
Sutent 12,5 mg se presenta en cápsulas duras de gelatina con una tapa de color naranja y un cuerpo de color naranja, con la palabra “Pfizer” impresa con tinta blanca en la tapa y “STN 12.5 mg” en el cuerpo, conteniendo gránulos de color amarillo a naranja.
Sutent 25 mg se presenta en cápsulas duras de gelatina con una tapa de color caramelo y un cuerpo de color naranja, con la palabra “Pfizer” impresa con tinta blanca en la tapa y “STN 25 mg” en el cuerpo, conteniendo gránulos de color amarillo a naranja.
Sutent 37,5 mg se presenta en cápsulas duras de gelatina con una tapa de color amarillo y un cuerpo de color amarillo, con la palabra “Pfizer” impresa con tinta negra en la tapa y “STN 37.5 mg” en el cuerpo, conteniendo gránulos de color amarillo a naranja.
Sutent 50 mg se presenta en cápsulas duras de gelatina con una tapa de color caramelo y un cuerpo de color caramelo, con la palabra “Pfizer” impresa con tinta blanca en la tapa y “STN 50 mg” en el cuerpo, conteniendo gránulos de color amarillo a naranja.
Está disponible en frascos de plástico de 30 cápsulas y en blísteres unidosis troquelados conteniendo 28 x 1 cápsulas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Pfizer Limited Ramsgate Road Sandwich, Kent CT13 9NJ Reino Unido
Responsable de la fabricación
Pfizer Italia S.r.l.
Via del Commercio - Zona Industriale 63100 Marino del Tronto (Ascoli Piceno) Italia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Belgique / Belgie /Belgien
Pfizer S.A. / N.V.
Tél/Tel: +32 (0)2 554 62 11
Etarapna
n^aroep HmKceMÓypr CAPH, KaoH Etarapna Tea.: +359 2 970 4333
Ceská republika
Pfizer PFE, spol. s r.o.
Tel.: +420 283 004 111
Lietuva
Pfizer Luxembourg SARL filialas Lietuvoje Tel. + 370 52 51 4000
Luxembourg/Luxemburg
Pfizer S.A.
Tél/Tel: +32 (0)2 554 62 11
Magyarország
Pfizer Kft.
Tel.: +36-1-488-37-00
Danmark
Pfizer ApS
Tlf: +45 44 20 11 00
Malta
V.J. Salomone Pharma Ltd. Tel. +356 21220174
Deutschland
Nederland
Pfizer BV
Tel: +31 (0)10 406 43 01
Pfizer Pharma GmbH Tel: +49 (0)30 550055 51000
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel.: +372 666 7500 |
Norge Pfizer Norge AS Tlf: +47 67 52 61 00 |
|
EXXáSa Pfizer EA,Mg A.E. T^: +30 210 6785 800 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
España Pfizer, S.L. Tél: +34 91 490 99 00 |
Polska Pfizer Polska Sp.z.o.o Tel.:+48 22 335 61 00 |
|
France Pfizer Tél: +33 (0)1 58 07 34 40 |
Portugal Pfizer Biofarmaceutica, Sociedade Unipessoal Lda Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 |
Romania Pfizer Romania S.R.L. Tel: +40 (0) 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) + 44 (0) 1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podruznica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel.: + 386 (0)1 52 11 400 |
|
Ísland Icepharma hf. Sími: +354 540 8000 |
Slovenská republika Pfizer Luxembourg SARL, organizacná zlozka Tel.:+ 421 2 3355 5500 |
|
Italia Pfizer S.r.l. Tel: +39 06 33 18 21 |
Suomi/Finland Pfizer Oy Puh./Tel: +358 (0)9 43 00 40 |
|
Kúnpoq Pfizer EA,Mg A.E. (Cyprus Branch) Tn^.:+ 357 22 817690 |
Sverige Pfizer Innovations AB Tel: +46 (0)8 550 520 00 |
|
Latvija Pfizer Luxembourg SARL filiale Latvija Tel.: + 371 670 35 775 |
United Kingdom Pfizer Limited Tel: +44 (0) 1304 616161 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
72