Sprimeo 300 Mg Comprimidos Recubiertos Con Pelicula
Información obsoleta, busque otro
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO


1. NOMBRE DEL MEDICAMENTO
Sprimeo 150 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 150 mg de aliskiren (como hemifumarato). Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
9>
a otra.
Comprimido recubierto con película
Comprimido redondo, rosa claro, biconvexo, marcado con ‘IL’ en una cara y ‘NV
R’ en
4. DATOS CLÍNICOS
JF
■a3>
4.1 Indicaciones terapéuticas
Tratamiento de la hipertensión esencial.
4.2 Posología y forma de administración
La dosis recomendada de Sprimeo es de 150 mg una vez al día. En pacientes en los que la presión arterial no esté adecuadamente controlada, la dosis puede aumentarse hasta 300 mg una vez al día.
El 85-90% del efecto antihipertensivo se a’caaza dentro de las dos primeras semanas de tratamiento con 150 mg una vez al día.
*0
Sprimeo puede usarse solo o en combinación con otros agentes antihipertensivos excepto en combinación con inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de la angiotensina (ARA II) en pacientes con diabetes mellitus o insuficiencia renal (tasa de filtración glomerular (TFG) < 60 ml/min/1,73 m2) (ver secciones 4.3, 4.4 y 5.1).
vvCr
Sprimeo debe tomarse con una comida ligera una vez al día, preferiblemente a la misma hora cada día. Junto con Sprimeo no se debe tomar zumo de pomelo.
Insuficiencia renal
No se requiere un ajuste de la dosis inicial en pacientes con insuficiencia renal leve a moderada (ver secciones 4.4 y 5.2). Sprimeo no está recomendado en pacientes con insuficiencia renal grave (TFG < 30 ml/min/1,73 m2). El uso concomitante de Sprimeo con ARA II o IECAs está contraindicado en pacientes con insuficiencia renal (TFG < 60 ml/min/1,73 m2) (ver sección 4.3).
Insuficiencia hepática
No se requiere un ajuste de la dosis inicial en pacientes con insuficiencia hepática leve a grave (ver sección 5.2).
Pacientes de edad avanzada (mayores de 65 años)
La dosis de inicio recomendada de aliskiren en pacientes de edad avanzada es 150 mg. Al aumentar la dosis hasta 300 mg no se observa una reducción adicional de la presión arterial clínicamente significativa en la mayoría de pacientes de edad avanzada.
Pacientes pediátricos (menores de 18 años)
Sprimeo no está recomendado para uso en niños y adolescentes menores de 18 años debido a la ausencia de datos sobre seguridad y eficacia (ver sección 5.2).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes. Antecedentes de angioedema con aliskiren.
Angioedema hereditario o idiopático.
Segundo y tercer trimestre del embarazo (ver sección 4.6).
El uso concomitante de aliskiren con ciclosporina e itraconazol, dos inhibidores muy potentes de la gpP, y otros inhibidores potentes de la gpP (p.ej. quinidina) está contraindicado (ver sección 4.5).
, 4 4,
El uso concomitante de aliskiren con ARA II o IECAs está contraindicado en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) (ver secciones 4.2, 4 4, *.5 y 5.1).
4.4 Advertencias y precauciones especiales de empleo
Aliskiren debe utilizarse con precaución en pacientes con insuficiencia cardiaca congestiva grave (clase funcional III-IV de la New York Heart Association [NYHa]).
pirs
En el caso de diarrea grave y persistente, debe interrumpir se el tratamiento con Sprimeo.
Doble bloqueo del sistema renina-angiotensina-aldosteiona (SRAA)
Hipotensión, síncope, ictus, hiperpotasemia y cambios en la función renal (incluyendo insuficiencia renal aguda) se han notificado en individuos susceptibles, especialmente si se combinan medicamentos que afectan a este sistema (ver sección 5.1). Por ello no se recomienda el doble bloqueo del sistema renina-angiotensina-aldosterona mediante la combinación de aliskiren con un inhibidor de la enzima convertidora de angiotensina (IECA) o un antagonista de los receptores de la angiotensina (ARA II).
ació
¿Y
El uso de aliskiren en comb inaci ón con ARA II o IECAs está contraindicado en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) (ver sección 4.3).
Angioedema
Como con otros agentes que actúan sobre el sistema renina-angiotensina, se han notificado casos de angioedema o síntomas sugestivos de angioedema (hinchazón de la cara, labios, garganta y/o lengua) en pacientes tratados con aliskiren.
Algunos de estos pacientes tenían antecedentes de angioedema o síntomas sugestivos de angioedema, que en algunos casos siguieron al uso de otros medicamentos que pueden causar angioedema, incluyendo antagonistas del SRAA (inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de la angiotensina) (ver sección 4.8).
Los pacientes con antecedentes de angioedema puede presentar un aumento del riesgo de sufrir un angioedema durante el tratamiento con aliskiren (ver secciones 4.3 y 4.8). Por ello se recomienda precaución cuando se prescriba aliskiren a pacientes con antecedentes de angioedema y dichos pacientes se monitorizarán estrechamente durante el tratamiento (ver sección 4.8), especialmente al inicio del tratamiento.
Si aparece angioedema, debe interrumpirse de inmediato el tratamiento con Sprimeo e instaurar una monitorización y tratamiento adecuados hasta obtener la resolución completa y sostenida de los signos y síntomas. Cuando haya una afectación de la lengua, glotis o laringe debe administrarse adrenalina. Además, deben proporcionarse las medidas oportunas para mantener la permeabilidad de las vías aéreas.
Pacientes con depleción de sodio y/o de volumen
Los pacientes con depleción marcada de volumen y/o de sodio (p. ej. los que reciben dosis elevadas de diuréticos) pueden sufrir hipotensión sintomática después de iniciar el tratamiento con Sprimeo. Esta situación debe corregirse antes de administrar Sprimeo, o se debe iniciar el tratamiento bajo estrecha supervisión médica.
Insuficiencia renal
i ren rena
En los ensayos clínicos, Sprimeo no se ha estudiado en pacientes hipertensos con insuficiencia renal grave (creatinina sérica > 150 micromol/l o 1,70 mg/dl en mujeres y > 177 micromol/l o 2,00 mg/dl en hombres y/o una TFG estimada < 30 ml/min/1,73 m2), antecedentes de diálisis, síndrome nefrótico o hipertensión renovascular. Sprimeo no está recomendado en pacientes con insuficiencia renal grave
(TFG < 30 ml/min/1,73 m2). Jh?
Como con otros agentes que actúan sobre el sistema renina-angiotensina, debe tenerse precaución cuando se administra aliskiren en presencia de condiciones que predisponen a una disfunción renal tales como hipovolemia (p. ej. debida a una pérdida de sangre, diarrea severa o prolongada, vómitos prolongados, etc.), enfermedad cardiaca, hepática, diabetes mellitus o enfermedad renal. El uso concomitante de aliskiren con ARA II o IECAs está contraindicado en pacientes con insuficiencia renal (TFG < 60 ml/min/1,73 m2). Se ha notificado insuficiencia renal aguda, reversible tras interrumpir el tratamiento, en pacientes de riesgo que recibieron aliskiren durante la experiencia postcomercialización. En el caso que aparezca algún signo de insuficiencia renal debe interrumpirse inmediatamente la administración de aliskiren.
Durante la experiencia post-comercialización con aliskiren se han observado aumentos de los niveles séricos de potasio que pueden exacerbarse con el uso concomitante de otros agentes que actúan sobre el SRAA o con antiinflamatorios no esteroideos (AINEs). De acuerdo con la práctica médica habitual, se aconseja la determinación periódica de la función renal incluyendo los electrolitos séricos si se considera necesaria la administración simultánea.
Estenosis de la arteria renal No hay datos disponibles de ensayos clínicos controlados sobre el uso de Sprimeo en pacientes con estenosis unilateral o bilateral de la arteria renal o estenosis en pacientes con riñón único. Sin embargo, como con otros agentes que actúan sobre el sistema renina-angiotensina, hay un aumento del riesgo de insuficiencia renal, incluyendo fallo renal agudo, cuando estos pacientes con estenosis de la arteria renal son tratados con aliskiren. Por tanto, se tendrá precaución con estos pacientes. Si se produce insuficiencia renal, debe interrumpirse el tratamiento.
Inhibidores moderados de la gpP
La administración concomitante de 300 mg de aliskiren con 200 mg de ketoconazol o 240 mg de verapamilo dio lugar a un aumento del 76% o 97%, respectivamente, de la AUC de aliskiren. Por lo tanto, debe tenerse precaución cuando aliskiren se administre con inhibidores moderados de la gpP tales como ketoconazol o verapamilo (ver sección 4.5).
4.5 Interacción con otros medicamentos y otras formas de interacción
La combinación de aliskiren con ARA II o IECAs está contraindicada en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) y no se recomienda en otros pacientes (ver secciones 4.3, 4.4 y 5.1).
En ensayos clínicos de farmacocinética se han estudiado los siguientes compuestos: acenocumarol, atenolol, celecoxib, pioglitazona, alopurinol, isosorbida-5-mononitrato e hidroclorotiazida. No se han identificado interacciones.
La administración concomitante de aliskiren con metformina ([28%), amlodipino ('¡29%) o cimetidina (¡19%) provocó un cambio entre el 20% y el 30% en la Cmax o el AUC de Sprimeo. Cuando se administró con atorvastatina, el AUC y la Cmax en estado estacionario de Sprimeo aumentaron en un 50%. La administración concomitante de Sprimeo no tuvo un impacto significativo sobre la farmacocinética de atorvastatina, metformina o amlodipino. Por tanto, no es necesario un ajuste de dosis ni de Sprimeo ni de estos medicamentos cuando se administran conjuntamente.
La biodisponibilidad de digoxina y verapamilo puede reducirse ligeramente con Sprimeo.
En experimentos con animales, se ha demostrado que la glicoproteína P (gpP) es un factor determinante de la biodisponibilidad de Sprimeo. Los inductores de la gpP (hierba de San Juan, rifampicina) pueden, por tanto, disminuir la biodisponibilidad de Sprimeo.
Interacciones con CYP450
Aliskiren no inhibe los isoenzimas CYP450 (CYP1A2, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A). Aliskiren no induce el CYP3A4. Por tanto no cabe esperar que aliskiren afecte la exposición sistémica de sustancias que inhiban, induzcan o se metabolicen por estos enzimas. Aliskiren se metaboliza marginalmente por los enzimas del citocromo P450. Por ello, no son de esperar interacciones debidas a la inhibición o inducción de los isoenzimas CYP450. Sin embargo, los inhibidores del CYP3A4 a menudo también afectan a la gpP. Por tanto, puede esperarse que el aumento de la exposición a aliskiren durante la administración concomitante con inhibidores de. C YP3A4 también inhiba la gpP (ver a continuación interacciones con la glicoproteína P).
Interacciones con la glicoproteína P
En estudios preclínicos se ha observado que el MDR1/Mdria/1b (gpP) es el mayor sistema de eflujo relacionado con la absorción intestinal y la excreción bliar de aliskiren. Rifampicina, un inductor de la gpP, en un ensayo clínico redujo la biodisponibilidad de aliskiren en aproximadamente un 50%. Otros inductores de la gpP (hierba de San Juan o Hipérico) podrían disminuir la biodisponibilidad de Sprimeo. Si bien esto no ha sido investigado con respecto a aliskiren, es conocido que la gpP también controla la recaptación tisular de una varierad de sustratos y que los inhibidores de la gpP pueden aumentar los cocientes entre las concentraciones tisulares y plasmáticas. Por ello, los inhibidores de la gpP pueden aumentar más los niveles tisulares que los niveles plasmáticos. El potencial de interacciones farmacológicas en el lugar de unión a la gpP probablemente dependerá del grado de inhibición de este transportador.
Inhibidores potentes de la gpP
Un ensayo de interacción de fármacos a dosis única en voluntarios sanos, mostró que ciclosporina (200 y 600 mg) aumenta la Cmax de 75 mg de aliskiren 2,5 veces, aproximadamente, y la AUC 5 veces, aproximadamente. El aumento puede ser mayor con dosis más altas de aliskiren. En sujetos sanos, itraconazol (100 mg) aumentó el AUC y Cmax de aliskiren (150 mg) 6,5 veces y 5,8 veces, respectivamente. Por ello, está contraindicado el uso concomitante de aliskiren e inhibidores potentes de la gpP (ver sección 4.3).
Inhibidores moderados de la gpP
La administración concomitante de ketoconazol (200 mg) o verapamilo (240 mg) con aliskiren (300 mg) provocó un aumento del 76% o 97%, respectivamente, de la AUC de aliskiren. Es de esperar que el cambio en los niveles plasmáticos de aliskiren en presencia de ketoconazol o verapamilo esté dentro del rango que se alcanzaría si se doblara la dosis de aliskiren. En ensayos clínicos controlados se demostró que dosis de aliskiren de hasta 600 mg, lo que corresponde al doble de la dosis máxima recomendada en terapéutica, son bien toleradas. Estudios preclínicos indican que la administración concomitante de aliskiren y ketoconazol potencia la absorción gastrointestinal de aliskiren y disminuye su excreción biliar. Por lo tanto, debe tenerse precaución cuando aliskiren se administre con ketoconazol, verapamilo u otros inhibidores moderados de la gpP (claritromicina, telitromicina, eritromicina, amiodarona).
Sustratos de la gpP o inhibidores débiles
No se han observado interacciones importantes con atenolol, digoxina, amlodipino o cimetidina. Cuando se administró con atorvastatina (80 mg), el AUC de aliskiren (300 mg) en estado estacionario y la Cmax aumentaron en un 50%.
Inhibidores de los polipéptidos transportadores de aniones orgánicos (OATP)
Estudios preclínicos indican que aliskiren podría ser un sustrato de los polipéptidos transportadores de aniones orgánicos. Por ello, existe un potencial de interacciones entre los inhibidores de los OATP y aliskiren cuando se administran concomitantemente (ver interacción con el zumo de pomelo).
Furosemida
Cuando aliskiren se administró concomitantemente con furosemida, se redujo el AUC y la Cmax de furosemida en un 28% y un 49%, respectivamente. Por ello se recomienda que se monitoricen los efectos de furosemida cuando se inicia o se modifica el tratamiento para evitar la posible utilización subóptima en casos de hipervolemia.
Antiinflamatorios no esteroideos (AINEs)
Como otros agentes que actúan sobre el sistema renina-angiotensina los AINEs pueden reducir el efecto antihipertensivo de aliskiren. En algunos pacientes con la función renal comprometida (pacientes deshidratados o pacientes de edad avanzada) aliskiren administrado concomitantemente con AINEs puede aumentar el deterioro de la función renal, incluyendo una posible insuficiencia renal aguda, que normalmente es reversible. Por ello, se requiere precaución al combinar aliskiren con AINEs, especialmente en pacientes de edad avanzada.
Medicamentos que afectan a los niveles séricos de potasio
El uso concomitante de otros agentes que afectan al SRAA, de AINEs o de agentes que aumentas los niveles séricos de potasio (p. ej. diuréticos ahorradores de potasio, suplementos de potasio, sustitutos de la sal que contengan potasio, heparina) pueden provocar un aumento de los niveles séricos de potasio. Se debe tener precaución si se considera necesaria la medicación concomitante con un agente que afecte a los niveles séricos de potasio. La combinación de aliskiren con ARA II o IECAs está contraindicada en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) y no se recomienda en otros pacientes (vei secciones 4.3, 4.4 y 5.1).
Zumo de pomelo
La administración de zumo de pomelo con aliskiren dio lugar a una disminución en la AUC y la Cmax de aliskiren. La administración concomitante con 150 mg de aliskiren dio lugar a una disminución del 61% en la AUC de aliskiren y la administración concomitante con 300 mg de aliskiren dio lugar a una disminución del 38% en la AUC de aliskiren. Esta disminución probablemente se deba a una inhibición de la recaptación de alikiren mediada por el polipéptido transportador de aniones orgánicos en el tracto intestinal por parte del zumo de pomelo. Por ello, debido al riesgo de un fallo terapéutico, el zumo de pomelo no debe tomarse junto con Sprimeo.
Warfarina
No se han evaluado los efectos de Sprimeo sobre la farmacocinética de warfarina.
Ingesta de alimentos
Se ha demostrado que las comidas con un alto contenido en grasa reducen la absorción de Sprimeo de forma significativa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de aliskiren en mujeres embarazadas. Sprimeo no fue teratogénico en ratas o conejos (ver sección 5.3). Sin embargo, otras sustancias que actúan directamente sobre el SRAA se han asociado con graves malformaciones fetales y letalidad neonatal. Como cualquier medicamento que actúe directamente sobre el SRAA, Sprimeo no debe utilizarse durante el primer trimestre del embarazo o en mujeres que planeen quedarse embarazadas y está contraindicado durante el segundo y tercer trimestre del embarazo (ver sección 4.3). Los médicos que prescriban medicamentos que actúen sobre el SRAA deben advertir a las mujeres que puedan quedarse embarazadas de los potenciales riesgos de estos medicamentos durante el embarazo. Por consiguiente, si se detecta un embarazo durante el tratamiento, debe interrumpirse el tratamiento con Sprimeo.
Lactancia
Se desconoce si aliskiren se excreta en la leche materna. Sprimeo se excretó en la leche de ratas en periodo de lactancia. Por tanto, no se recomienda su uso en mujeres que estén dando el pecho.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, debe tenerse en cuenta cuando se conduzca o se maneje maquinaria que ocasionalmente pueden producirse mareos o fatiga asociados a la medicación antihipertensiva. La influencia de Sprimeo sobre la capacidad para conducir y utilizar máquinas es insignificante.
4.8 Reacciones adversas
Se ha evaluado la seguridad de Sprimeo en más de 7.800 pacientes, entre los que se incluyen más de 2.300 tratados durante más de 6 meses, y más de 1.200 tratados durante más de 1 año. La incidencia de reacciones adversas no se asoció con el sexo, edad, índice de masa corporal, raza u origen étnico.
El tratamiento con Sprimeo a dosis de hasta 300 mg tuvo una incidencia global de reacciones adversas similar a placebo. Las reacciones adversas fueron en general eves y transitorias y sólo en raras ocasiones requirieron la interrupción del tratamiento. La reacción adversa más frecuente es la diarrea.
Las reacciones adversas (Tabla 1) se enumeran bajo cada epígrafe de frecuencia en orden decreciente de frecuencia, utilizando la siguiente convención: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000), y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 1
kO
<v-
&
e>
&
También se han notificado casos de angioedema o síntomas sugestivos de angioedema (hinchazón de la cara, labios, garganta y/o lengua) durante la experiencia post-comercialización. Algunos de estos pacientes tenían antecedentes de angioedema o síntomas sugestivos de angioedema, que en algunos casos estuvieron asociados con la administración de otros medicamentos conocidos por causar angiodema, incluyendo los antagonistas del SRAA (inhibidores de la ECA y ARA II).
También se han notificado reacciones de hipersensibilidad durante la experiencia post-
comercialización.
Trastornos del sistema nervioso
Frecuentes: Mareos
Trastornos vasculares
Poco frecuentes: Hipotensión
Trastornos gastrointestinales
Frecuentes: Diarrea
Trastornos del sistema inmunológico
Raras: Reacciones de hipersensibilidad
Trastornos de la piel y del tejido subcutáneo
Poco frecuentes: Erupción, reacciones adversas cutáneas graves (SCARs) que incluyen
necrolisis epidérmica tóxica (NET) y reacciones en la mucosa bucal Raras: Angioedema
Trastornos musculoesqueléticos y del tejido conjuntivo
Frecuentes: Artralgia
Trastornos renales y urinarios
Poco frecuentes: Insuficiencia renal aguda, deterioro de la función renal
Trastornos generales y alteraciones en el lugar de administración
Poco frecuentes: Edema periférico
Exploraciones complementarias
Frecuentes: Hiperpotasemia
Disminución de la hemoglobina, disminución del hematocrito
Raras:
Raras:
Aumento de la creatinina en sangre ___
ón del
Se han notificado casos de angioedema y reacciones de hipersensibilidad durante el tratamiento con aliskiren. En ensayos clínicos controlados, raramente se notificaron casos de angioedema y reacciones de hipersensibilidad durante el tratamiento con aliskiren, con una incidencia comparable a la registrada con el tratamiento con placebo o comparadores.
Si aparecen signos que sugieran una reacción de hipersensibilidad/angioedema (en particular dificultades en la respiración o al tragar, erupción, picor, urticaria o hinchazón de la cara, extremidades, ojos, labios y/o lengua, mareos), los pacientes deben interrumpir el tratamiento y contactar con el médico (ver sección 4.4).
Se ha notificado artralgia durante la experiencia post-comercialización. En algunos casos esto ha ocurrido como parte de una reacción de hipersensibilidad.
Datos de laboratorio
En ensayos clínicos controlados, la administración de Sprimeo raramente se asoció con cambios clínicamente relevantes en los parámetros estándar de laboratorio. En ensayos clínicos en pacientes hipertensos, Sprimeo no provocó efectos clínicamente importantes sobre el colesterol total, el colesterol asociado a lipoproteínas de alta densidad (HDL-C), los triglicéridos en ayunas, la glucosa en ayunas o el ácido úrico.
Hemoglobina y hematocrito: Se han observado pequeños descensos en los valores de hemoglobina y hematocrito (descensos medios de aproximadamente 0,05 mmol/l y 0,16 en el porcentaje de volumen, respectivamente). Ningún paciente interrumpió el tratamiento debido a una anemia. Este efecto también se observa con otros agentes que actúan sobre el sistema renina angiotensina, como IECA y
ARA II.
Niveles séricos de potasio'. Con aliskiren se ha observado aumentos de los niveles séricos de potasio que pueden ser exacerbados por el uso concomitante de otros agentes que actúen sobre el SRAA o por los AINEs. De acuerdo con la práctica médica habitual, se aconseja la determinación periódica de la función renal incluyendo los electrolitos séricos si se considera necesaria la administración simultánea. La combinación de aliskiren con ARA II o IECAs está contraindicada en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) y no se recomienda en otros pacientes (ver secciones 4.3, 4.4 y 5.1).
En la experiencia post-comercialización, se ha notificado disfunción renal y casos de insuficiencia renal aguda en pacientes de riesgo (ver sección 4.4). También ha habido notificaciones de edema periférico, aumento de la creatinina en sangre y reacciones adversas cutáneas graves (SCARs) que incluyen necrolisis epidérmica tóxica (NET) y reacciones en la mucosa bucal.
4.9 Sobredosis
Se dispone de datos limitados acerca de la sobredosis en humanos. La manifestación más probable de una sobredosis sería hipotensión, relacionada con el efecto antihipertensivo de aliskiren. Si se produce hipotensión sintomática, se debe iniciar un tratamiento de soporte.

inal (ESRD) que recibían aclaramiento oral). Por ello
En un ensayo realizado en pacientes con enfermedad renal en estadi hemodiálisis, el aclaramiento de aliskiren por diálisis fue bajo (< 2% la diálisis no es adecuada para tratar una sobreexposición a aliskiren.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Inhibidor de la renina, código ATC: C09XA02
Aliskiren es un inhibidor directo, selectivo y potente de la renina humana, de naturaleza no peptídica y activo por vía oral.
Mediante la inhibición del enzima renina, aliskiren inhibe el SRAA en el punto de activación, bloqueando la conversión de angiotensinógeno a angiotensina I, y disminuyendo, por consiguiente, los niveles de angiotensina I y angiotensina II. A diferencia de otros inhibidores del SRAA (IECA y antagonistas de los receptores de la angiotensina II (ARA II)) que causan un aumento compensatorio en la actividad de la renina plasmática (ARP), el tratamiento con aliskiren disminuye la ARP en pacientes hípenensos en aproximadamente un 50-80%. Se observaron reducciones similares con aliskiren en combinación con otros agentes antihipertensivos. Actualmente se desconocen las implicaciones clínicas de las diferencias en el efecto sobre ARP.
Hipertensión
En pacientes hipertensos, la administración una vez al día de Sprimeo a dosis de 150 mg y 300 mg produjo una reducción dosis-dependiente en la presión arterial sistólica y diastólica, que se mantenía durante todo el intervalo de administración de 24 horas (manteniendo el beneficio hasta la mañana siguiente) con un índice T/P medio (peak to trough ratio) para la respuesta diastólica de hasta el 98% para la dosis de 300 mg. Tras 2 semanas de tratamiento se alcanzó el 85-90% del máximo efecto hipotensor. El efecto hipotensor se mantuvo durante el tratamiento de larga duración y fue independiente de la edad, sexo, índice de masa corporal y origen étnico. Sprimeo se ha estudiado en 1.864 pacientes de 65 años o mayores y en 426 pacientes de 75 años o mayores.
Los ensayos clínicos de Sprimeo en monoterapia han mostrado un efecto hipotensor comparable al de otras clases de agentes antihipertensivos, incluyendo los IECA y los ARA II. Comparado con un
diurético (hidroclorotiazida - HCTZ), Sprimeo 300 mg disminuyó la presión sistólica/diastólica en 17,0/12,3 mmHg, en comparación con una disminución de 14,4/10,5 mmHg con HCTZ 25 mg tras 12 semanas de tratamiento.
Se han realizado ensayos clínicos de las combinaciones terapéuticas de Sprimeo con el diurético hidroclorotiazida, el bloqueante de canales de calcio amlodipino y el betabloqueante atenolol. Estas combinaciones fueron bien toleradas. Sprimeo indujo un efecto hipotensor aditivo cuando se combinó con hidroclorotiazida. En pacientes que no respondieron adecuadamente a 5 mg del bloqueante de canales de calcio amlodipino, la coadministración de Sprimeo 150 mg tuvo un efecto hipotensor similar al obtenido al aumentar la dosis de amlodipino a 10 mg, pero con una menor incidencia de edema (2,1% con aliskiren 150 mg/amlodipino 5 mg frente a 11,2% con amlodipino 10 mg).
La eficacia y seguridad del tratamiento basado en aliskiren se compararon con el tratamiento basado en ramipril en un ensayo clínico de no inferioridad de 9 meses en 901 pacientes de edad avanzada (> 65 años) con hipertensión esencial sistólica. Aliskiren a dosis de 150 mg o 300 mg al día o ramipril a dosis de 5 mg o 10 mg al día fueron administrados durante 36 semanas con la adición orcional de hidroclorotiazida (12,5 mg o 25 mg) en la semana 12, y amlodipino (5 mg o 10 mg) en la semana 22. Durante el periodo de 12 semanas, la monoterapia con aliskiren disminuyó la presten arterial sistólica/diastólica en 14,0/5,1 mmHg, en comparación con 11,6/3,6 mmHg con ramipril, coherente con la no inferioridad de aliskiren respecto a ramipril en las dosis seleccionadas, y las diferencias en la presión arterial sistólica y diastólica fueron estadísticamente significativas. La tolerabilidad fue comparable en los dos brazos de tratamiento, sin embargo en el régimen con ramipril se notificó tos más a menudo que en el régimen con aliskiren (14,2% vs. 4,4%), mientras que la diarrea fue más frecuente en el régimen con aliskiren que en el régimen con ramipril (6,6% vs. 5,0%).
En un ensayo clínico de 8 semanas en 754 pacientes hipecensos de edad avanzada (> 65 años) y de edad muy avanzada (30% > 75 años) aliskiren a dosis de 75 mg, 150 mg y 300 mg produjo una reducción superior estadísticamente significativa en la presión arterial (sistólica y diastólica) cuando se comparó con placebo. No se detectó un efecto reductor adicional sobre la presión arterial con 300 mg de aliskiren en comparación con 150 mg de aliskiren. Las tres dosis fueron bien toleradas en pacientes de edad avanzada y en pacientes de edad muy avanzada.
(j
En pacientes hipertensos obesos que no respondieron adecuadamente a HCTZ 25 mg, la adición de Sprimeo 300 mg indujo una reducción adicional de la presión arterial comparable a la obtenida con la adición de irbesartán 300 mg o amlodipino 10 mg.
No se han registrado casos de hipotensión tras la primera dosis ni tampoco efectos sobre la frecuencia cardiaca en los pacientes tratados en ensayos clínicos controlados. Se ha observado poco frecuentemente un efecto hipotensor excesivo (0,1%) en pacientes con hipertensión no complicada tratados con Sprimeo en monoterapia. La hipotensión también fue poco frecuente (< 1%) durante el tratamiento de combinación con otros agentes antihipertensivos. Tras la interrupción del tratamiento, las cifras de presión arterial revirtieron gradualmente al valor inicial al cabo de varias semanas, sin evidencia de efecto rebote en la presión arterial ni en la ARP.
En un ensayo clínico de 36 semanas que involucró a 820 pacientes con disfunción ventricular izquierda isquémica, no se detectaron cambios en el remodelado ventricular evaluado mediante el volumen telesistólico del ventrículo izquierdo con aliskiren en comparación con placebo añadido al tratamiento de base.
Las tasas combinadas de muerte cardiovascular, hospitalización por insuficiencia cardiaca, ataque cardiaco recurrente, ictus y muerte súbita resucitada fueron similares en el grupo con aliskiren y en el grupo con placebo. Sin embargo, en los pacientes que recibían aliskiren hubo una tasa significativamente mayor de hiperpotasemia, hipotensión y disfunción renal en comparación con el grupo con placebo.
Aliskiren ha sido evaluado respecto al beneficio cardiovascular y/o renal en un ensayo clínico randomizado, controlado con placebo, doble ciego en 8.606 pacientes con diabetes tipo 2 y enfermedad renal crónica (evidenciada por una proteinuria y/o TFG < 60 ml/min/1,73 m2) con o sin enfermedad cardiovascular. En la mayoría de pacientes la presión arterial estaba bien controlada a nivel basal. La variable principal fue una combinación de complicaciones cardiovasculares y renales.
.orbilid
En este ensayo, 300 mg de aliskiren se compararon con placebo cuando se añadieron al tratamiento estándar que incluía un inhibidor de la enzima convertidora de angiotensina o un antagonista de los receptores de la angiotensina. El ensayo clínico fue interrumpido prematuramente porqué era poco probable que los participantes se beneficiaran de la administración de aliskiren. Los resultados preliminares del ensayo indicaron una tasa de riesgo para la variable principal de 1,09 a favor del grupo con placebo (Intervalo de confianza al 95%: 0,97; 1,22; valor de p de 2-colas p=0,17). Además, se observó un aumento de la incidencia de resultados adversos graves con aliskiren en comparación con placebo para complicaciones renales (4,7% frente al 3,3%), hiperpotasemia (36,9% frente al 27,1%), hipotensión (18,4% frente al 14,6%) e ictus (2,7% frente al 2,0%). El aumento de la incidencia de ictus no fatal fue mayor en pacientes con insuficiencia renal.
ilidad
ad, mo do,
No se conoce aún si Sprimeo tiene efectos beneficiosos en términos de mortalidad cardiovascular y daño a órganos diana.
Electrofisiología cardiaca No se han registrado efectos sobre el intervalo QT en un ensayo aleatorizado, doble ciego, controlado con placebo y comparador activo, utilizando electrocardiografía estándar y Holter.
./fa
P'
5.2 Propiedades farmacocinéticas
Absorción
Tras la absorción oral, las concentraciones plasmáticas máximas de aliskiren se alcanzan después de 1-3 horas. La biodisponibilidad absoluta de aliskiren es aproximadamente del 2-3%. Las comidas con un alto contenido en grasa reducen la Cmax en un 85% y el AUC en un 70%. Tras la administración de una dosis única diaria, las concentraciones plasmáticas en el estado estacionario se alcanzan en un plazo de 5-7 días; dichas concentraciones son aproximadamente el doble de la concentración obtenida con la dosis inicial.
Distribución
Tras la administración intravenosa, el volumen de distribución medio en el estado estacionario es de aproximadamente 135 litros, lo que indica que aliskiren se distribuye ampliamente en el espacio extravascular. La unión de aliskiren a las proteínas plasmáticas es moderada (47-51%) e independiente de la concentración.
Metabolismo
ación
La semivid" de eliminación es de aproximadamente 40 horas (rango 34-41 horas). Aliskiren se elimina principalmente inalterado con las heces (78%). Se metaboliza aproximadamente el 1,4% de la dosis oral total. El enzima responsable de este metabolismo es el CYP3A4. Aproximadamente el 0,6% de la dosis se recupera en orina tras la administración oral. Tras la administración intravenosa, el aclaramiento plasmático medio es de aproximadamente 9 l/h.
Linealidad/no-linealidad
La exposición a aliskiren aumentó más que proporcionalmente respecto al incremento en la dosis.
Tras la administración de una dosis única en el intervalo de dosis de 75 a 600 mg, la administración subsiguiente de una dosis doble dio como resultado un incremento de ~2,3 y 2,6 veces en el AUC y la Cmax, respectivamente. La no-linealidad puede ser más pronunciada en el estado estacionario. No se han identificado los mecanismos responsables de la desviación de la linealidad. Un posible mecanismo es la saturación de los transportadores en el lugar de la absorción o en la vía del aclaramiento hepatobiliar.
Características en pacientes
Aliskiren es un tratamiento antihipertensivo eficaz que se administra una vez al día en pacientes adultos, independientemente del sexo, edad, índice de masa corporal y origen étnico.
El AUC es un 50% más elevado en pacientes de edad avanzada (> 65 años) que en pacientes jóvenes. El sexo, peso y origen étnico no tienen influencia clínicamente relevante sobre la farmacocinética de aliskiren.
Se evaluó la farmacocinética de aliskiren en pacientes con diferentes grados de insuficiencia renal. La Cmax y el AUC relativos de aliskiren en individuos con insuficiencia renal oscilaron entre 0,8 y 2 veces los valores en el estado estacionario en individuos sanos tras la administración de dosis únicas. Sin embargo, la variabilidad observada no se correlaciona con la gravedad de la insuficiencia renal. No se requiere un ajuste de la dosis inicial de Sprimeo en pacientes con insuficiencia renal leve a moderada (ver secciones 4.2 y 4.4). Sprimeo no está recomendado en pacientes con insuficiencia renal grave (tasa de filtración glomerular (TFG) < 30 ml/min/1,73 m2). El uso concomitante de Sprimeo con ARA II o IECAs está contraindicado en pacientes con insuficiencia renal (TFG < 60 ml/min/1,73 m2) (ver sección 4.3).
La farmacocinética de aliskiren se evaluó en pacientes con enfermedad renal en estadio terminal que recibían hemodiálisis. La administración de una dosis única de 300 mg de aliskiren se asoció a cambios muy pequeños en la farmacocinética de aliskiren (cambio en la CnPx de menos de 1,2 veces; aumento de la AUC de hasta 1,6 veces) en comparación con individuos sanos como control. El periodo de hemodiálisis no alteró de forma significativa la farmacocinética de aliskiren en pacientes con ESRD. Por ello, si se considera necesaria la administración de aliskiren en pacientes con ESRD que reciben hemodiálisis, en estos pacientes no está justificado ningún ajuste de la dosis. Sin embargo, el uso de aliskiren no está recomendado en pacientes con insuficiencia renal grave (ver sección 4.4).
La farmacocinética de aliskiren no se vio afectada significativamente en pacientes con enfermedad hepática leve a grave. Por lo tanto, no se requiere un ajuste de la dosis inicial de aliskiren en pacientes con insuficiencia hepática leve a grave.
r&
5.3 Datos preclínicos sobre seguridad
El potencial carcinógeno se evaluó en un estudio de 2 años en ratas y en un estudio de 6 meses en ratones transgénicos. No se observó potencial carcinógeno. Se registraron un caso de adenoma de colon y otro de adenocarcinoma de ciego en ratas a dosis de 1.500 mg/kg/día, pero no fueron estadísticamente significativos. Aunque aliskiren tiene potencial irritativo conocido, los márgenes de seguridad en humanos se consideraron apropiados, obtenidos durante un ensayo en voluntarios sanos con la dosis de 300 mg, estableciéndose un margen de 9 a 11 veces en base a concentraciones fecales, o de 6 veces en base a las concentraciones en mucosa, en comparación con 250 mg/kg/día en el estudio de carcinogénesis en ratas.
Aliskiren no mostró potencial mutagénico en los estudios de mutagenicidad in vitro e in vivo. Entre los estudios realizados se incluyeron estudios in vitro en células bacterianas y de mamíferos y estudios in vivo en ratas.
Los estudios de toxicidad reproductiva con aliskiren no revelaron evidencias de toxicidad embriofetal o teratogenicidad con dosis de hasta 600 mg/kg/día en ratas o 100 mg/kg/día en conejos. En ratas no se observó afectación de la fertilidad, ni del desarrollo prenatal y postnatal con dosis de hasta 250 mg/kg/día. Las dosis administradas a ratas y conejos dieron lugar a exposiciones sistémicas de 1 a 4 y 5 veces superiores, respectivamente, a la dosis máxima recomendada en humanos (300 mg).
Los estudios farmacológicos de seguridad no revelaron ningún efecto adverso sobre la función nerviosa central, respiratoria o cardiovascular. Los hallazgos durante los estudios de toxicidad de dosis repetidas en animales fueron consistentes con el potencial irritativo local conocido o los efectos farmacológicos esperados de aliskiren.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Crospovidona Estearato de magnesio Celulosa microcristalina Povidona
Sílice coloidal anhidra
Hipromelosa
Macrogol
Talco
&
JF
■a3>
Óxido de hierro, negro (E 172)
Óxido de hierro, rojo (E 172)
Dióxido de titanio (E 171)
6.2 Incompatibilidades
No procede
6.3 Período de validez
2 años
á-0
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C. Conservar en el embalaje original para protegerlo de la humedad.
rCT
6.5 Naturaleza y contenido del envase Blisters de PA/Alu/PVC - Alu:
Envases con 7, 14, 28, 30, 50, 56, 84, 90, 98 o 280 comprimidos.
Los envases con 84 (3x28), 98 (2x49) o 280 (20x14) comprimidos son envases múltiples.
Blisters de PVC/polic’orotrifluoroetileno (PCTFE) - Alu:
Envases con 14, 28, 30, 50, 56, 90, 98 o 280 comprimidos.
Los envases con 98 (2x49) o 280 (20x14) comprimidos son envases múltiples.
Los envase^ con 56 y 98 (2x49) comprimidos contienen blisters unidosis perforados.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/407/001-010
EU/1/07/407/021-030
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
22.08.2007

10. FECHA DE LA REVISIÓN DEL TEXTO

La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu

1. NOMBRE DEL MEDICAMENTO
Sprimeo 300 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 300 mg de aliskiren (como hemifumarato). Para consultar la lista completa de excipientes ver sección 6.1.
3
FORMA FARMACÉUTICA
Comprimido recubierto con película
Comprimido ovalado, rojo claro, biconvexo, marcado con ‘IU’ en una cara y ‘NV
R’ en -
a otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de la hipertensión esencial.
4.2 Posología y forma de administración
La dosis recomendada de Sprimeo es de 150 mg una vez al día. En pacientes en los que la presión arterial no esté adecuadamente controlada, la dosis puede aumentarse hasta 300 mg una vez al día.
El 85-90% del efecto antihipertensivo se alcanza dentro de las dos primeras semanas de tratamiento con 150 mg una vez al día.
Sprimeo puede usarse solo o en co combinación con inhibidores receptores de la angiotensin
de filtración glomerular
nación con otros agentes antihipertensivos excepto en nzima convertidora de angiotensina (IECA) o antagonistas de los II) en pacientes con diabetes mellitus o insuficiencia renal (tasa
< 60 ml/min/1,73 m2) (ver secciones 4.3, 4.4 y 5.1).
Sprimeo debe tomarse con una comida ligera una vez al día, preferiblemente a la misma hora cada día. Junto con Sprimeo no se debe tomar zumo de pomelo.
Insuficiencia renal
No se requiere un ajuste de la dosis inicial en pacientes con insuficiencia renal leve a moderada (ver secciones 4.4 y 5.2). Sprimeo no está recomendado en pacientes con insuficiencia renal grave (TFG < 30 ml/min/1,73 m2). El uso concomitante de Sprimeo con ARA II o IECAs está contraindicado en pacientes con insuficiencia renal (TFG < 60 ml/min/1,73 m2) (ver sección 4.3).
Insuficiencia hepática
No se requiere un ajuste de la dosis inicial en pacientes con insuficiencia hepática leve a grave (ver sección 5.2).
Pacientes de edad avanzada (mayores de 65 años)
La dosis de inicio recomendada de aliskiren en pacientes de edad avanzada es 150 mg. Al aumentar la dosis hasta 300 mg no se observa una reducción adicional de la presión arterial clínicamente significativa en la mayoría de pacientes de edad avanzada.
Pacientes pediátricos (menores de 18 años)
Sprimeo no está recomendado para uso en niños y adolescentes menores de 18 años debido a la ausencia de datos sobre seguridad y eficacia (ver sección 5.2).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes. Antecedentes de angioedema con aliskiren.
Angioedema hereditario o idiopático.
Segundo y tercer trimestre del embarazo (ver sección 4.6).
El uso concomitante de aliskiren con ciclosporina e itraconazol, dos inhibidores muy potentes de la gpP, y otros inhibidores potentes de la gpP (p.ej. quinidina) está contraindicado (ver sección 4.5).
El uso concomitante de aliskiren con ARA II o IECAs está contraindicado en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) (ver secciones 4 2, 4.4, 4.5 y 5.1).
Aliskiren debe utilizarse con precaución en pacientes con insuficiencia cardiaca congestiva grave
4.4 Advertencias y precauciones especiales de empleo
(clase funcional III-IV de la New York Heart Association [N HIa]).
id
En el caso de diarrea grave y persistente, debe interrumpirse el tratamiento con Sprimeo.
Doble bloqueo del sistema renina-angiotensina-aldosterona (SRAA)
&
Hipotensión, síncope, ictus, hiperpotasemia y cambios en la función renal (incluyendo insuficiencia renal aguda) se han notificado en individuos susceptibles, especialmente si se combinan medicamentos que afectan a este sistema (ver sección 5.1). Por ello no se recomienda el doble bloqueo del sistema renina-angiotensina-aldosterona mediante la combinación de aliskiren con un inhibidor de la enzima convertidora de angiotensina (IECA) o un antagonista de los receptores de la angiotensina (ARA II).
El uso de aliskiren en combinación con ARA II o IECAs está contraindicado en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) (ver sección 4.3).
0
Angioedema
Como con otros agentes que actúan sobre el sistema renina-angiotensina, se han notificado casos de angioedema o síntomas sugestivos de angioedema (hinchazón de la cara, labios, garganta y/o lengua) en pacientes tratados con aliskiren.
Algunos de estos pacientes tenían antecedentes de angioedema o síntomas sugestivos de angioedema, que en algunos casos siguieron al uso de otros medicamentos que pueden causar angioedema, incluyendo antagonistas del SRAA (inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de la angiotensina) (ver sección 4.8).
Los pacientes con antecedentes de angioedema puede presentar un aumento del riesgo de sufrir un angioedema durante el tratamiento con aliskiren (ver secciones 4.3 y 4.8). Por ello se recomienda precaución cuando se prescriba aliskiren a pacientes con antecedentes de angioedema y dichos pacientes se monitorizarán estrechamente durante el tratamiento (ver sección 4.8), especialmente al inicio del tratamiento.
Si aparece angioedema, debe interrumpirse de inmediato el tratamiento con Sprimeo e instaurar una
monitorización y tratamiento adecuados hasta obtener la resolución completa y sostenida de los signos y síntomas. Cuando haya una afectación de la lengua, glotis o laringe debe administrarse adrenalina. Además, deben proporcionarse las medidas oportunas para mantener la permeabilidad de las vías aéreas.
Pacientes con depleción de sodio y/o de volumen
Los pacientes con depleción marcada de volumen y/o de sodio (p. ej. los que reciben dosis elevadas de diuréticos) pueden sufrir hipotensión sintomática después de iniciar el tratamiento con Sprimeo. Esta situación debe corregirse antes de administrar Sprimeo, o se debe iniciar el tratamiento bajo estrecha supervisión médica.
Insuficiencia renal
En los ensayos clínicos, Sprimeo no se ha estudiado en pacientes hipertensos con insuficiencia renal grave (creatinina sérica > 150 micromol/l o 1,70 mg/dl en mujeres y > 177 micromol/l o 2,00 mg/dl en hombres y/o una TFG estimada < 30 ml/min/1,73 m2), antecedentes de diálisis, síndrome nefrótico o hipertensión renovascular. Sprimeo no está recomendado en pacientes con insuficiencia enal grave (TFG < 30 ml/min/1,73 m2).
liskiren durante la experiencia post-iciencia renal debe interrumpirse
Como con otros agentes que actúan sobre el sistema renina-angiotensina, debe tenerse precaución cuando se administra aliskiren en presencia de condiciones que predisponen a una disfunción renal tales como hipovolemia (p. ej. debida a una pérdida de sangre, diarrea seveia o prolongada, vómitos prolongados, etc.), enfermedad cardiaca, hepática, diabetes mellitus o enfermedad renal. El uso concomitante de aliskiren con ARA II o IECAs está contraindicado en pacientes con insuficiencia renal (TFG < 60 ml/min/1,73 m2). Se ha notificado insuficiencia renal aguda, reversible tras interrumpir el tratamiento, en pacientes de riesgo que recibi comercialización. En el caso que aparezca algún signo de m, inmediatamente la administración de aliskiren. SP
Durante la experiencia post-comercialización con aliskiren se han observado aumentos de los niveles séricos de potasio que pueden exacerbarse con el uso concomitante de otros agentes que actúan sobre el SRAA o con antiinflamatorios no estero'deos (AINEs). De acuerdo con la práctica médica habitual, se aconseja la determinación periódica de la función renal incluyendo los electrolitos séricos si se considera necesaria la administración simultánea.
Estenosis de la arteria renal
No hay datos disponibles de ensayos clínicos controlados sobre el uso de Sprimeo en pacientes con estenosis unilateral o bilateral de la arteria renal o estenosis en pacientes con riñón único. Sin embargo, como con otros agentes que actúan sobre el sistema renina-angiotensina, hay un aumento del riesgo de insuficiencia renal, incluyendo fallo renal agudo, cuando estos pacientes con estenosis de la arteria renal son tratados con aliskiren. Por tanto, se tendrá precaución con estos pacientes. Si se produce insuficiencia renal, debe interrumpirse el tratamiento.
Inhibidores moderados de la gpP
La administración concomitante de 300 mg de aliskiren con 200 mg de ketoconazol o 240 mg de verapamilo dio lugar a un aumento del 76% o 97%, respectivamente, de la AUC de aliskiren. Por lo tanto, debe tenerse precaución cuando aliskiren se administre con inhibidores moderados de la gpP tales como ketoconazol o verapamilo (ver sección 4.5).
4.5 Interacción con otros medicamentos y otras formas de interacción
La combinación de aliskiren con ARA II o IECAs está contraindicada en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) y no se recomienda en otros pacientes (ver secciones 4.3, 4.4 y 5.1)
En ensayos clínicos de farmacocinética se han estudiado los siguientes compuestos: acenocumarol, atenolol, celecoxib, pioglitazona, alopurinol, isosorbida-5-mononitrato e hidroclorotiazida. No se han identificado interacciones.
La administración concomitante de aliskiren con metformina ([28%), amlodipino (|29%) o cimetidina (|19%) provocó un cambio entre el 20% y el 30% en la Cmax o el AUC de Sprimeo. Cuando se administró con atorvastatina, el AUC y la Cmax en estado estacionario de Sprimeo aumentaron en un 50%. La administración concomitante de Sprimeo no tuvo un impacto significativo sobre la farmacocinética de atorvastatina, metformina o amlodipino. Por tanto, no es necesario un ajuste de dosis ni de Sprimeo ni de estos medicamentos cuando se administran conjuntamente.
La biodisponibilidad de digoxina y verapamilo puede reducirse ligeramente con Sprimeo.
En experimentos con animales, se ha demostrado que la glicoproteína P (gpP) es un factor determinante de la biodisponibilidad de Sprimeo. Los inductores de la gpP (hierba de San Juan, rifampicina) pueden, por tanto, disminuir la biodisponibilidad de Sprimeo.
Interacciones con CYP450
Aliskiren no inhibe los isoenzimas CYP450 (CYP1A2, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A). Aliskiren no induce el CYP3A4. Por tanto no cabe esperar que aliskiren afecte la exposición sistémica de sustancias que inhiban, induzcan o se metabolicen por estos enzimas. Aliskiren se metaboliza marginalmente por los enzimas del citocromo P450. Por ello, no son de esperar interacciones debidas a la inhibición o inducción de los isoenzimas CYP450. Sin embargo, loe inhibidores del CYP3A4 a menudo también afectan a la gpP. Por tanto, puede esperarse que el aumento de la exposición a aliskiren durante la administración concomitante con inhibidores de1 CYP3A4 también inhiba la gpP (ver a continuación interacciones con la glicoproteína P).
Interacciones con la glicoproteína P En estudios preclínicos se ha observado que el MDR1/Mcr1a/1b (gpP) es el mayor sistema de eflujo relacionado con la absorción intestinal y la excreción biliar de aliskiren. Rifampicina, un inductor de la gpP, en un ensayo clínico redujo la biodisponibilidad de aliskiren en aproximadamente un 50%. Otros inductores de la gpP (hierba de San Juan o Hipérico) podrían disminuir la biodisponibilidad de Sprimeo. Si bien esto no ha sido investigado con respecto a aliskiren, es conocido que la gpP también controla la recaptación tisular de una variedad de sustratos y que los inhibidores de la gpP pueden aumentar los cocientes entre las concentraciones tisulares y plasmáticas. Por ello, los inhibidores de la gpP pueden aumentar más los niveles tisulares que los niveles plasmáticos. El potencial de interacciones farmacológicas en el lugar de unión a la gpP probablemente dependerá del grado de inhibición de este transportador.
Inhibidores potentes de la gpP
Un ensayo de interacción de fármacos a dosis única en voluntarios sanos, mostró que ciclosporina (200 y 600 mg) aumenta la Cmax de 75 mg de aliskiren 2,5 veces, aproximadamente, y la AUC 5 veces, aproximadamente. El aumento puede ser mayor con dosis más altas de aliskiren. En sujetos sanos, itraconazol (100 mg) aumentó el AUC y Cmax de aliskiren (150 mg) 6,5 veces y 5,8 veces, respectivamente. Por ello, está contraindicado el uso concomitante de aliskiren e inhibidores potentes de la gpP (ver sección 4.3).
Inhibidores moderados de la gpP
La administración concomitante de ketoconazol (200 mg) o verapamilo (240 mg) con aliskiren (300 mg) provocó un aumento del 76% o 97%, respectivamente, de la AUC de aliskiren. Es de esperar que el cambio en los niveles plasmáticos de aliskiren en presencia de ketoconazol o verapamilo esté dentro del rango que se alcanzaría si se doblara la dosis de aliskiren. En ensayos clínicos controlados se demostró que dosis de aliskiren de hasta 600 mg, lo que corresponde al doble de la dosis máxima recomendada en terapéutica, son bien toleradas. Estudios preclínicos indican que la administración concomitante de aliskiren y ketoconazol potencia la absorción gastrointestinal de aliskiren y disminuye su excreción biliar. Por lo tanto, debe tenerse precaución cuando aliskiren se administre con ketoconazol, verapamilo u otros inhibidores moderados de la gpP (claritromicina, telitromicina, eritromicina, amiodarona).
Sustratos de la gpP o inhibidores débiles
No se han observado interacciones importantes con atenolol, digoxina, amlodipino o cimetidina. Cuando se administró con atorvastatina (80 mg), el AUC de aliskiren (300 mg) en estado estacionario y la Cmax aumentaron en un 50%.
Inhibidores de los polipéptidos transportadores de aniones orgánicos (OATP)
Estudios preclínicos indican que aliskiren podría ser un sustrato de los polipéptidos transportadores de aniones orgánicos. Por ello, existe un potencial de interacciones entre los inhibidores de los OATP y aliskiren cuando se administran concomitantemente (ver interacción con el zumo de pomelo).
Furosemida
sible uti
Cuando aliskiren se administró concomitantemente con furosemida, se redujo el AUC y la Cmax de furosemida en un 28% y un 49%, respectivamente. Por ello se recomienda que se monitoricen los efectos de furosemida cuando se inicia o se modifica el tratamiento para evitar la posible utilización subóptima en casos de hipervolemia.
Antiinflamatorios no esteroideos (AINEs)
&
Como otros agentes que actúan sobre el sistema renina-angiotensina los AINEs pueden reducir el efecto antihipertensivo de aliskiren. En algunos pacientes con la función renal comprometida (pacientes deshidratados o pacientes de edad avanzada) aliskiren administrado concomitantemente con AINEs puede aumentar el deterioro de la función renal, incluyendo una posible insuficiencia renal aguda, que normalmente es reversible. Por ello, se requiere piecaución al combinar aliskiren con AINEs, especialmente en pacientes de edad avanzada.
Medicamentos que afectan a los niveles séricos de potasio El uso concomitante de otros agentes que afectan al SRAa, de AINEs o de agentes que aumentas los niveles séricos de potasio (p. ej. diuréticos ahorradores de potasio, suplementos de potasio, sustitutos de la sal que contengan potasio, heparina) pueden provocar un aumento de los niveles séricos de potasio. Se debe tener precaución si se considera necesaria la medicación concomitante con un agente que afecte a los niveles séricos de potasio. La combinación de aliskiren con ARA II o IECAs está contraindicada en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) y no se recomienda en otros pacientes (ver secciones 4.3, 4.4 y 5.1).
Zumo de pomelo
La administración de zumo de pomelo con aliskiren dio lugar a una disminución en la AUC y la Cm de aliskiren. La administración concomitante con 150 mg de aliskiren dio lugar a una disminución del 61% en la AUC de ali skiren y la administración concomitante con 300 mg de aliskiren dio lugar a una disminución del 38% en la AUC de aliskiren. Esta disminución probablemente se deba a una inhibición de la recaptación de alikiren mediada por el polipéptido transportador de aniones orgánicos en el tracto 'intestinal por parte del zumo de pomelo. Por ello, debido al riesgo de un fallo terapéutico, el zumo de pomelo no debe tomarse junto con Sprimeo.
Warfarina
No se han evaluado los efectos de Sprimeo sobre la farmacocinética de warfarina.
Ingesta de alimentos
Se ha demostrado que las comidas con un alto contenido en grasa reducen la absorción de Sprimeo de forma significativa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de aliskiren en mujeres embarazadas. Sprimeo no fue teratogénico en ratas o conejos (ver sección 5.3). Sin embargo, otras sustancias que actúan directamente sobre el SRAA se han asociado con graves malformaciones fetales y letalidad neonatal.
Como cualquier medicamento que actúe directamente sobre el SRAA, Sprimeo no debe utilizarse durante el primer trimestre del embarazo o en mujeres que planeen quedarse embarazadas y está contraindicado durante el segundo y tercer trimestre del embarazo (ver sección 4.3). Los médicos que prescriban medicamentos que actúen sobre el SRAA deben advertir a las mujeres que puedan quedarse embarazadas de los potenciales riesgos de estos medicamentos durante el embarazo. Por consiguiente, si se detecta un embarazo durante el tratamiento, debe interrumpirse el tratamiento con Sprimeo.
Lactancia
Se desconoce si aliskiren se excreta en la leche materna. Sprimeo se excretó en la leche de ratas en periodo de lactancia. Por tanto, no se recomienda su uso en mujeres que estén dando el pecho.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. Sin embargo, debe tenerse en cuenta cuando se conduzca o se maneje maquinaria que ocasionalmente pueden producirse mareos o fatiga asociados a la medicación antihipertensiva. La influencia de Sprimeo sobre la capacidad para conducir y utilizar máquinas es insignificante.
4.8 Reacciones adversas
Se ha evaluado la seguridad de Sprimeo en más de 7.800 pacientes, entre los que se incluyen más de 2.300 tratados durante más de 6 meses, y más de 1.200 tratados dmante más de 1 año. La incidencia de reacciones adversas no se asoció con el sexo, edad, índice de masa corporal, raza u origen étnico.
El tratamiento con Sprimeo a dosis de hasta 300 mg tuvo una incidencia global de reacciones adversas similar a placebo. Las reacciones adversas fueron en gene ral leves y transitorias y sólo en raras ocasiones requirieron la interrupción del tratamiento. La reacción adversa más frecuente es la diarrea.
Las reacciones adversas (Tabla 1) se enumeran bajo cada epígrafe de frecuencia en orden decreciente de frecuencia, utilizando la siguiente convención: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000), y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 1
e>
&
También se han notificado casos de angioedema o síntomas sugestivos de angioedema (hinchazón de la cara, labios, garganta y/o lengua) durante la experiencia post-comercialización. Algunos de estos pacientes tenían antecedentes de angioedema o síntomas sugestivos de angioedema, que en algunos casos estuvieron asociados con la administración de otros medicamentos conocidos por causar angiodema, incluyendo los antagonistas del SRAA (inhibidores de la ECA y ARA II).
También se han notificado reacciones de hipersensibilidad durante la experiencia post-
Trastornos del sistema nervioso
Frecuentes: Mareos
Trastornos vasculares
Poco frecuentes: Hipotensión
Trastornos gastrointestinales
Frecuentes: Diarrea
Trastornos del sistema inmunológico
Raras: Reacciones de hipersensibilidad
Trastornos de la piel y del tejido subcutáneo
Poco frecuentes: Erupción, reacciones adversas cutáneas graves (SCARs) que incluyen
necrolisis epidérmica tóxica (NET) y reacciones en la mucosa bucal Raras: Angioedema
Trastornos musculoesqueléticos y del tejido conjuntivo
Frecuentes: Artralgia
Trastornos renales y urinarios
Poco frecuentes: Insuficiencia renal aguda, deterioro de la función renal
Trastornos generales y alteraciones en el lugar de administración
Poco frecuentes: Edema periférico
Exploraciones complementarias
Frecuentes: Hiperpotasemia
Disminución de la hemoglobina, disminución del hematocrito
Raras:
Raras:
Aumento de la creatinina en sangre ___
ón del
Se han notificado casos de angioedema y reacciones de hipersensibilidad durante el tratamiento con aliskiren. En ensayos clínicos controlados, raramente se notificaron casos de angioedema y reacciones de hipersensibilidad durante el tratamiento con aliskiren, con una incidencia comparable a la registrada con el tratamiento con placebo o comparadores.
comercialización.
Si aparecen signos que sugieran una reacción de hipersensibilidad/angioedema (en particular dificultades en la respiración o al tragar, erupción, picor, urticaria o hinchazón de la cara, extremidades, ojos, labios y/o lengua, mareos), los pacientes deben interrumpir el tratamiento y contactar con el médico (ver sección 4.4).
Se ha notificado artralgia durante la experiencia post-comercialización. En algunos casos esto ha ocurrido como parte de una reacción de hipersensibilidad.
Datos de laboratorio
En ensayos clínicos controlados, la administración de Sprimeo raramente se asoció con cambios clínicamente relevantes en los parámetros estándar de laboratorio. En ensayos clínicos en pacientes hipertensos, Sprimeo no provocó efectos clínicamente importantes sobre el colesterol total, el colesterol asociado a lipoproteínas de alta densidad (HDL-C), los triglicéridos en ayunas, la glucosa en ayunas o el ácido úrico.
Hemoglobina y hematocrito: Se han observado pequeños descensos en los valores de hemoglobina y hematocrito (descensos medios de aproximadamente 0,05 mmol/l y 0,16 en el porcentaje de volumen, respectivamente). Ningún paciente interrumpió el tratamiento debido a una anemia. Este efecto también se observa con otros agentes que actúan sobre el sistema renina angiotensina, como IECA y
ARA II.
Niveles séricos de potasio '. Con aliskiren se ha observado aumentos de los niveles séricos de potasio que pueden ser exacerbados por el uso concomitante de otros agentes que actúen sobre el SRAA o por los AINEs. De acuerdo con la práctica médica habitual, se aconseja la determinación periódica de la función renal incluyendo los electrolitos séricos si se considera necesaria la administración simultánea. La combinación de aliskiren con ARA II o IECAs está contraindicada en pacientes con diabetes mellitus o insuficiencia renal (TFG < 60 ml/min/1,73 m2) y no se recomienda en otros pacientes (ver secciones 4.3, 4.4 y 5.1)
En la experiencia post-comercialización, se ha notificado disfunción renal y casos de insuficiencia renal aguda en pacientes de riesgo (ver sección 4.4). También ha habido notificaciones de edema periférico, aumento de la creatinina en sangre y reacciones adversas cutáneas graves (SCARs) que incluyen necrolisis epidérmica tóxica (NET) y reacciones en la mucosa bucal.
4.9 Sobredosis
Se dispone de datos limitados acerca de la sobredosis en humanos. La manifestación más probable de una sobredosis sería hipotensión, relacionada con el efecto antihipertensivo de aliskiren. Si se produce hipotensión sintomática, se debe iniciar un tratamiento de soporte.

inal (ESRD) que recibían aclaramiento oral). Por ello
En un ensayo realizado en pacientes con enfermedad renal en estadi hemodiálisis, el aclaramiento de aliskiren por diálisis fue bajo (< 2% la diálisis no es adecuada para tratar una sobreexposición a aliskiren.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Inhibidor de la renina, código ATC: C09XA02
Aliskiren es un inhibidor directo, selectivo y potente de la renina humana, de naturaleza no peptídica y activo por vía oral.
Mediante la inhibición del enzima renina, aliskiren inhibe el SRAA en el punto de activación, bloqueando la conversión de angiotensinógeno a angiotensina I, y disminuyendo, por consiguiente, los niveles de angiotensina I y angiotensina II. A diferencia de otros inhibidores del SRAA (IECA y antagonistas de los receptores de la angiotensina II (ARA II)) que causan un aumento compensatorio en la actividad de la renina plasmática (ARP), el tratamiento con aliskiren disminuye la ARP en pacientes hipertensos en aproximadamente un 50-80%. Se observaron reducciones similares con aliskiren en combinación con otros agentes antihipertensivos. Actualmente se desconocen las implicaciones clínicas de las diferencias en el efecto sobre ARP.
Hipertensión
En pacientes hipertensos, la administración una vez al día de Sprimeo a dosis de 150 mg y 300 mg produjo una reducción dosis-dependiente en la presión arterial sistólica y diastólica, que se mantenía durante todo el intervalo de administración de 24 horas (manteniendo el beneficio hasta la mañana siguiente) con un índice T/P medio (peak to trough ratio) para la respuesta diastólica de hasta el 98% para la dosis de 300 mg. Tras 2 semanas de tratamiento se alcanzó el 85-90% del máximo efecto hipotensor. El efecto hipotensor se mantuvo durante el tratamiento de larga duración y fue independiente de la edad, sexo, índice de masa corporal y origen étnico. Sprimeo se ha estudiado en 1.864 pacientes de 65 años o mayores y en 426 pacientes de 75 años o mayores.
Los ensayos clínicos de Sprimeo en monoterapia han mostrado un efecto hipotensor comparable al de otras clases de agentes antihipertensivos, incluyendo los IECA y los ARA II. Comparado con un diurético (hidroclorotiazida - HCTZ), Sprimeo 300 mg disminuyó la presión sistólica/diastólica en 17,0/12,3 mmHg, en comparación con una disminución de 14,4/10,5 mmHg con HCTZ 25 mg tras 12 semanas de tratamiento.
Se han realizado ensayos clínicos de las combinaciones terapéuticas de Sprimeo con el diurético hidroclorotiazida, el bloqueante de canales de calcio amlodipino y el betabloqueante atenolol. Estas combinaciones fueron bien toleradas. Sprimeo indujo un efecto hipotensor aditivo cuando se combinó con hidroclorotiazida. En pacientes que no respondieron adecuadamente a 5 mg del bloqueante de canales de calcio amlodipino, la coadministración de Sprimeo 150 mg tuvo un efecto hipotensor similar al obtenido al aumentar la dosis de amlodipino a 10 mg, pero con una menor incidencia de edema (2,1% con aliskiren 150 mg/amlodipino 5 mg frente a 11,2% con amlodipino 10 mg).
La eficacia y seguridad del tratamiento basado en aliskiren se compararon con el tratamiento basado en ramipril en un ensayo clínico de no inferioridad de 9 meses en 901 pacientes de edad avanzada (> 65 años) con hipertensión esencial sistólica. Aliskiren a dosis de 150 mg o 300 mg al día o ramipril a dosis de 5 mg o 10 mg al día fueron administrados durante 36 semanas con la adición orcional de hidroclorotiazida (12,5 mg o 25 mg) en la semana 12, y amlodipino (5 mg o 10 mg) en la semana 22. Durante el periodo de 12 semanas, la monoterapia con aliskiren disminuyó la presten arterial sistólica/diastólica en 14,0/5,1 mmHg, en comparación con 11,6/3,6 mmHg con ramipril, coherente con la no inferioridad de aliskiren respecto a ramipril en las dosis seleccionadas, y las diferencias en la presión arterial sistólica y diastólica fueron estadísticamente significativas. La tolerabilidad fue comparable en los dos brazos de tratamiento, sin embargo en el régimen con ramipril se notificó tos más a menudo que en el régimen con aliskiren (14,2% vs. 4,4%), mientras que la diarrea fue más frecuente en el régimen con aliskiren que en el régimen con ramipril (6,6% vs. 5,0%).
En un ensayo clínico de 8 semanas en 754 pacientes hiperrensos de edad avanzada (> 65 años) y de edad muy avanzada (30% > 75 años) aliskiren a dosis de 75 mg, 150 mg y 300 mg produjo una reducción superior estadísticamente significativa en la presión arterial (sistólica y diastólica) cuando se comparó con placebo. No se detectó un efecto reductor adicional sobre la presión arterial con 300 mg de aliskiren en comparación con 150 mg de aliskiren. Las tres dosis fueron bien toleradas en pacientes de edad avanzada y en pacientes de edad muy avanzada.
(j
En pacientes hipertensos obesos que no respondieron adecuadamente a HCTZ 25 mg, la adición de Sprimeo 300 mg indujo una reducción adicional de la presión arterial comparable a la obtenida con la adición de irbesartán 300 mg o amlodipino 10 mg.
No se han registrado casos de hipotensión tras la primera dosis ni tampoco efectos sobre la frecuencia cardiaca en los pacientes tratados en ensayos clínicos controlados. Se ha observado poco frecuentemente un efecto hipotensor excesivo (0,1%) en pacientes con hipertensión no complicada tratados con Sprimeo en monoterapia. La hipotensión también fue poco frecuente (< 1%) durante el tratamiento de combinación con otros agentes antihipertensivos. Tras la interrupción del tratamiento, las cifras de presión arterial revirtieron gradualmente al valor inicial al cabo de varias semanas, sin evidencia de efecto rebote en la presión arterial ni en la ARP.
En un ensayo clínico de 36 semanas que involucró a 820 pacientes con disfunción ventricular izquierda isquémica, no se detectaron cambios en el remodelado ventricular evaluado mediante el volumen telesistólico del ventrículo izquierdo con aliskiren en comparación con placebo añadido al tratamiento de base.
Las tasas combinadas de muerte cardiovascular, hospitalización por insuficiencia cardiaca, ataque cardiaco recurrente, ictus y muerte súbita resucitada fueron similares en el grupo con aliskiren y en el grupo con placebo. Sin embargo, en los pacientes que recibían aliskiren hubo una tasa significativamente mayor de hiperpotasemia, hipotensión y disfunción renal en comparación con el grupo con placebo.
Aliskiren ha sido evaluado respecto al beneficio cardiovascular y/o renal en un ensayo clínico randomizado, controlado con placebo, doble ciego en 8.606 pacientes con diabetes tipo 2 y enfermedad renal crónica (evidenciada por una proteinuria y/o TFG < 60 ml/min/1,73 m2) con o sin enfermedad cardiovascular. En la mayoría de pacientes la presión arterial estaba bien controlada a nivel basal. La variable principal fue una combinación de complicaciones cardiovasculares y renales.
En este ensayo, 300 mg de aliskiren se compararon con placebo cuando se añadieron al tratamiento estándar que incluía un inhibidor de la enzima convertidora de angiotensina o un antagonista de los receptores de la angiotensina. El ensayo clínico fue interrumpido prematuramente porqué era poco probable que los participantes se beneficiaran de la administración de aliskiren. Los resultados preliminares del ensayo indicaron una tasa de riesgo para la variable principal de 1,09 a favor del grupo con placebo (Intervalo de confianza al 95%: 0,97; 1,22; valor de p de 2-colas p=0,17). Además, se observó un aumento de la incidencia de resultados adversos graves con aliskiren en comparación con placebo para complicaciones renales (4,7% frente al 3,3%), hiperpotasemia (36,9% frente al 27,1%), hipotensión (18,4% frente al 14,6%) e ictus (2,7% frente al 2,0%). El aumento de la incidencia de ictus no fatal fue mayor en pacientes con insuficiencia renal.
ad, mo do,
orbilidad
No se conoce aún si Sprimeo tiene efectos beneficiosos en términos de mortalidad cardiovascular y daño a órganos diana.
Electrofisiología cardiaca No se han registrado efectos sobre el intervalo QT en un ensayo aleatorizado, doble ciego, controlado con placebo y comparador activo, utilizando electrocardiografía estándar y Holter.
./fa
P'
5.2 Propiedades farmacocinéticas
Absorción
Tras la absorción oral, las concentraciones plasmáticas máximas de aliskiren se alcanzan después de 1-3 horas. La biodisponibilidad absoluta de aliskiren es aproximadamente del 2-3%. Las comidas con un alto contenido en grasa reducen la Cmax en un 85% y el AUC en un 70%. Tras la administración de una dosis única diaria, las concentraciones plasmáticas en el estado estacionario se alcanzan en un plazo de 5-7 días; dichas concentraciones son aproximadamente el doble de la concentración obtenida con la dosis inicial.
kP
sa, el
Distribución
Tras la administración intravenosa, el volumen de distribución medio en el estado estacionario es de aproximadamente 135 litros, lo que indica que aliskiren se distribuye ampliamente en el espacio extravascular. La unión de Jiskiren a las proteínas plasmáticas es moderada (47-51%) e independiente de la concentración.
Metabolismo
ación
La semivid" de eliminación es de aproximadamente 40 horas (rango 34-41 horas). Aliskiren se elimina principalmente inalterado con las heces (78%). Se metaboliza aproximadamente el 1,4% de la dosis oral total. El enzima responsable de este metabolismo es el CYP3A4. Aproximadamente el 0,6% de la dosis se recupera en orina tras la administración oral. Tras la administración intravenosa, el aclaramiento plasmático medio es de aproximadamente 9 l/h.
Linealidad/no-linealidad
La exposición a aliskiren aumentó más que proporcionalmente respecto al incremento en la dosis.
Tras la administración de una dosis única en el intervalo de dosis de 75 a 600 mg, la administración subsiguiente de una dosis doble dio como resultado un incremento de ~2,3 y 2,6 veces en el AUC y la Cmax, respectivamente. La no-linealidad puede ser más pronunciada en el estado estacionario. No se han identificado los mecanismos responsables de la desviación de la linealidad. Un posible mecanismo es la saturación de los transportadores en el lugar de la absorción o en la vía del aclaramiento hepatobiliar.
Características en pacientes
Aliskiren es un tratamiento antihipertensivo eficaz que se administra una vez al día en pacientes adultos, independientemente del sexo, edad, índice de masa corporal y origen étnico.
El AUC es un 50% más elevado en pacientes de edad avanzada (> 65 años) que en pacientes jóvenes. El sexo, peso y origen étnico no tienen influencia clínicamente relevante sobre la farmacocinética de aliskiren.
Se evaluó la farmacocinética de aliskiren en pacientes con diferentes grados de insuficiencia renal. La Cmax y el AUC relativos de aliskiren en individuos con insuficiencia renal oscilaron entre 0,8 y 2 veces los valores en el estado estacionario en individuos sanos tras la administración de dosis únicas. Sin embargo, la variabilidad observada no se correlaciona con la gravedad de la insuficiencia renal. No se requiere un ajuste de la dosis inicial de Sprimeo en pacientes con insuficiencia renal leve a moderada (ver secciones 4.2 y 4.4). Sprimeo no está recomendado en pacientes con insuficiencia renal grave (tasa de filtración glomerular (TFG) < 30 ml/min/1,73 m2). El uso concomitante de Sprimeo con ARA II o IECAs está contraindicado en pacientes con insuficiencia renal (TFG < 60 ml/min/1,73 m2) (ver sección 4.3).
La farmacocinética de aliskiren se evaluó en pacientes con enfermedad renal en estadio terminal que recibían hemodiálisis. La administración de una dosis única de 300 mg de aliskiren se asoció a cambios muy pequeños en la farmacocinética de aliskiren (cambio en la CnPx de menos de 1,2 veces; aumento de la AUC de hasta 1,6 veces) en comparación con individuos sanos como control. El periodo de hemodiálisis no alteró de forma significativa la farmacocinética de aliskiren en pacientes con ESRD. Por ello, si se considera necesaria la administración de aliskiren en pacientes con ESRD que reciben hemodiálisis, en estos pacientes no está justificado ningún ajuste de la dosis. Sin embargo, el uso de aliskiren no está recomendado en pacientes con insuficiencia renal grave (ver sección 4.4).
La farmacocinética de aliskiren no se vio afectada significativamente en pacientes con enfermedad hepática leve a grave. Por lo tanto, no se requiere un ajuste de la dosis inicial de aliskiren en pacientes con insuficiencia hepática leve a grave.
r&
5.3 Datos preclínicos sobre seguridad
El potencial carcinógeno se evaluó en un estudio de 2 años en ratas y en un estudio de 6 meses en ratones transgénicos. No se observó potencial carcinógeno. Se registraron un caso de adenoma de colon y otro de adenocarcinoma de ciego en ratas a dosis de 1.500 mg/kg/día, pero no fueron estadísticamente significativos. Aunque aliskiren tiene potencial irritativo conocido, los márgenes de seguridad en humanos se consideraron apropiados, obtenidos durante un ensayo en voluntarios sanos con la dosis de 300 mg, estableciéndose un margen de 9 a 11 veces en base a concentraciones fecales, o de 6 veces en base a las concentraciones en mucosa, en comparación con 250 mg/kg/día en el estudio de carcinogénesis en ratas.
Aliskiren no mostró potencial mutagénico en los estudios de mutagenicidad in vitro e in vivo. Entre los estudios realizados se incluyeron estudios in vitro en células bacterianas y de mamíferos y estudios in vivo en ratas.
Los estudios de toxicidad reproductiva con aliskiren no revelaron evidencias de toxicidad embriofetal o teratogenicidad con dosis de hasta 600 mg/kg/día en ratas o 100 mg/kg/día en conejos. En ratas no se observó afectación de la fertilidad, ni del desarrollo prenatal y postnatal con dosis de hasta 250 mg/kg/día. Las dosis administradas a ratas y conejos dieron lugar a exposiciones sistémicas de 1 a 4 y 5 veces superiores, respectivamente, a la dosis máxima recomendada en humanos (300 mg).
Los estudios farmacológicos de seguridad no revelaron ningún efecto adverso sobre la función nerviosa central, respiratoria o cardiovascular. Los hallazgos durante los estudios de toxicidad de dosis repetidas en animales fueron consistentes con el potencial irritativo local conocido o los efectos farmacológicos esperados de aliskiren.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Crospovidona Estearato de magnesio Celulosa microcristalina Povidona
Sílice coloidal anhidra
Hipromelosa
Macrogol
Talco
&
JF
■a3>
Óxido de hierro, negro (E 172)
Óxido de hierro, rojo (E 172)
Dióxido de titanio (E 171)
6.2 Incompatibilidades
No procede
6.3 Período de validez
2 años
á-0
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C. Conservar en el embalaje original para protegerlo de la humedad.
rCT
6.5 Naturaleza y contenido del envase Blisters de PA/Alu/PVC - Alu:
Envases con 7, 14, 28, 30, 50, 56, 84, 90, 98 o 280 comprimidos.
Los envases con 84 (3x28), 90 (3x30), 98 (2x49) o 280 (20x14) comprimidos son envases múltiples.
Blisters de PVC/polic’orotrifluoroetileno (PCTFE) - Alu:
Envases con 14, 28, 30, 50, 56, 90, 98 o 280 comprimidos.
Los envases con 98 (2x49) o 280 (20x14) comprimidos son envases múltiples.
Los envase^ con 56 y 98 (2x49) comprimidos contienen blisters unidosis perforados.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/407/011-020
EU/1/07/407/031-040
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
22.08.2007

10. FECHA DE LA REVISIÓN DEL TEXTO

La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu

V
A.
B.
C.
RE
ANEXO II
FABRICANTE RESPONSABLE DE la LIBERACION DE LOS LOTES
CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACION DE COMERCIALIZACIÓN

A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Novartis Farma S.p.A.
Via Provinciale Schito 131 I-80058 Torre Annunziata/NA Italia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sistema de Farmacovigilancia
El Titular de la Autorización de Comercialización (TAC) debe asegurar que el Sistema de Farmacovigilancia, presentado en el Módulo 1.8.1. de la Autorización de Comercialización, esté instaurado y en funcionamiento antes de que el medicamento se comercialice y durante el tiempo que permanezca en el mercado.
Plan de Gestión de Riesgos (PGR)
El TAC se compromete a realizar las actividades de farmacovigilancia detalladas en el Plan de Farmacovigilancia, de acuerdo con la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y cualquier actualización posterior del PGR acordada por el Comité de Medicamentos de Uso Humano (CHMP).
De acuerdo con la Directriz del CHMP sobre Sistemas de Gestión de Riesgos para medicamentos de uso humano, el PGR actualizado se debe presentar junto con el siguiente Informe Periódico de Seguridad (IPS).
Además, se debe presentar un PGR actualizado:
• Cuando se reciba nueva información que pueda afectar a las especificaciones de seguridad vigentes, al Plan de Farmacovigilancia o las actividades de minimización de riesgos
• Dentro de los 60 días posteriores a la consecución de un hito importante (farmacovigilancia o minimización de riesgos)
• A petición de la Agencia Europea de Medicamentos.
• CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
No procede.
• OBLIGACIÓN DE REALIZAR MEDIDAS POST-AUTORIZACIÓN
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha |
|
El TAC debe presentar los resultados finales y el informe del ensayo de las actividades de la fase de tratamiento del ensayo ALTITUDE cuando estén disponibles. |
31 Julio 2012 |
|
El TAC debe presentar un plan de gestión de riesgos actualizado (PGR) que describa adecuadamente todos los problemas de seguridad, las actividades de |
En un mes tras la Decisión de la |
|
farmacovigilancia y las intervenciones diseñadas para identificar, caracterizar, |
Comisión |
|
prevenir o minimizar los riesgos. |


ANEXO III


A. ETIQUETADO
<y

1. NOMBRE DEL MEDICAMENTO
Sprimeo 150 mg comprimidos recubiertos con película Aliskiren
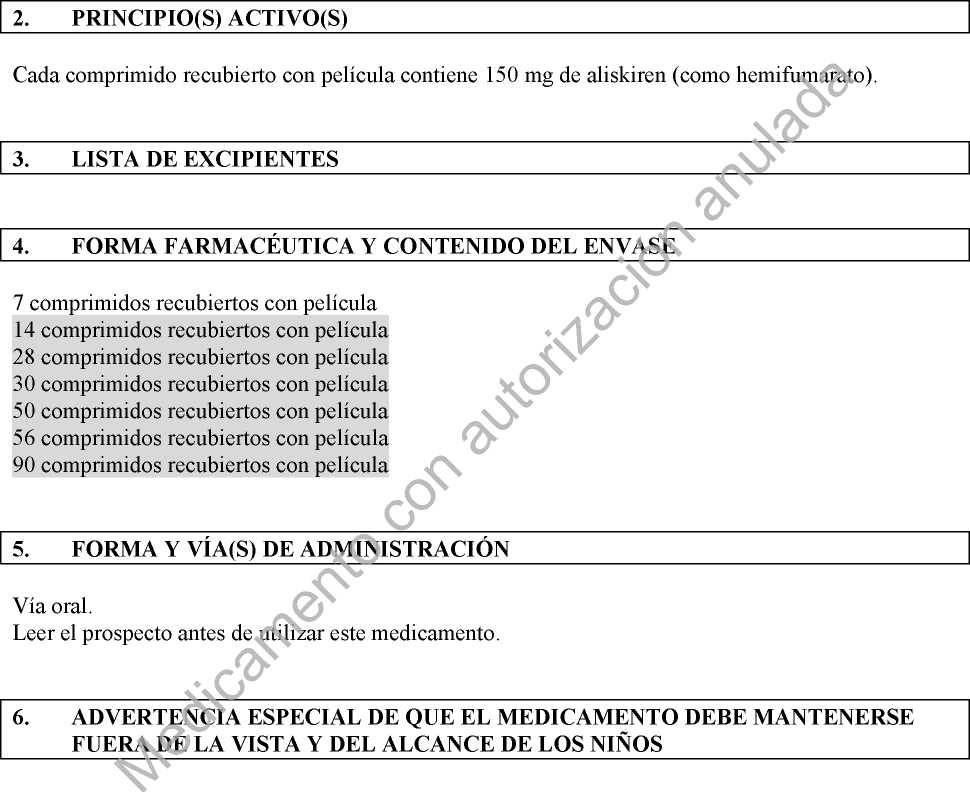
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(es), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN

Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
12. NUMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/407/001
EU/1/07/407/002
EU/1/07/407/003
EU/1/07/407/004
EU/1/07/407/005
EU/1/07/407/006
EU/1/07/407/008
7 comprimidos recubiertos con película 14 comprimidos recubiertos con película 28 comprimidos recubiertos con película 30 comprimidos recubiertos con película 50 comprimidos recubiertos con película 56 comprimidos recubiertos con película 90 comprimidos recubieCos con película
13. NÚMERO DE LOTE

Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Sprimeo 150 mg
1. NOMBRE DEL MEDICAMENTO
Sprimeo 150 mg comprimidos recubiertos con película Aliskiren
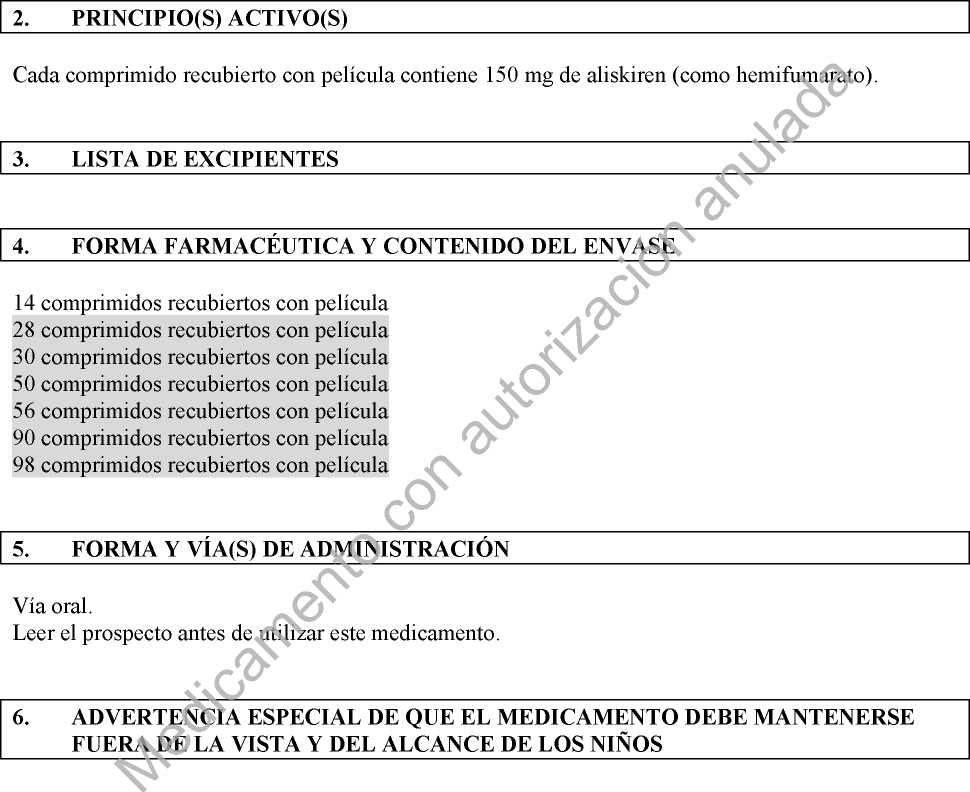
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(es), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
&
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
12. NUMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
£
EU/1/07/407/021
EU/1/07/407/022
EU/1/07/407/023
EU/1/07/407/024
EU/1/07/407/025
EU/1/07/407/026
EU/1/07/407/027
EU/1/07/407/028
14 comprimidos recubiertos con película.
28 comprimidos recubiertos con película 30 comprimidos recubiertos con película 50 comprimidos recubiertos con película 56 comprimidos recubiertos con película 56 comprimidos recubiertos con película (blíster unidosis perforado)
90 comprimidos recubiertos con película 98 comprimidos recubiertos con película
13. NÚMERO DE LOTE
=
<$
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
|
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS | ||
|
BLÍSTER | ||
|
BLÍSTER (CALENDARIO) | ||
|
1. NOMBRE DEL MEDICAMENTO | ||
|
Sprimeo 150 mg comprimidos recubiertos con Aliskiren |
película | |
|
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN | ||
|
Novartis Europharm Limited |
& | |
|
3. FECHA DE CADUCIDAD |
_ | |
|
EXP |
& | |
|
4. NÚMERO DE LOTE | ||
|
Lot | ||
|
5. OTROS | ||
Lunes
Martes
Miércoles
Jueves
Viernes
Sábado
Domingo
CAJA INTERMEDIA PARA ENVASES MÚLTIPLES (SIN BLUE BOX) CON BLISTERS DE PA/ALU/PVC
1. NOMBRE DEL MEDICAMENTO
Sprimeo 150 mg comprimidos recubiertos con película Aliskiren
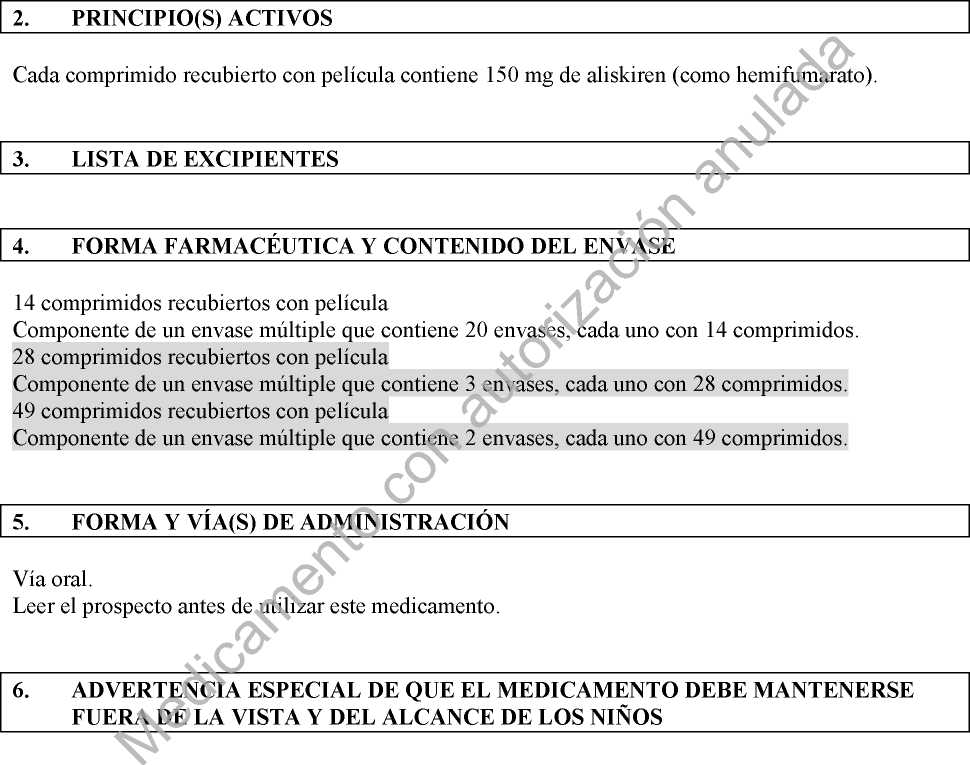
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
-<N
EU/1/07/407/007 84 comprimidos recubiertos con película (3x28)
EU/1/07/407/009 98 comprimidos recubiertos con película (2x49)

EU/1/07/407/010 280 comprimidos recubiertos con película (20x14)

Medicamento sujeto a prescripción médica.
EMBALAJE EXTERIOR DE ENVASES MÚLTIPLES (INCLUYE BLUE BOX) CON BLISTERS DE PA/ALU/PVC
1. NOMBRE DEL MEDICAMENTO
Sprimeo 150 mg comprimidos recubiertos con película Aliskiren

Envase múltiple que contiene 3 envases, cada uno con 28 comprimidos. 98 comprimidos recubiertos con película
Envase múltiple que contiene 2 envases, cada uno con 49 comprimidos. 280 comprimidos recubiertos con película
Envase múltiple que contiene 20 envases, cada uno con 14 comprimidos.

Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SUS USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
-<N
EU/1/07/407/007 84 comprimidos recubiertos con película (3x28)
EU/1/07/407/009 98 comprimidos recubiertos con película (2x49)

EU/1/07/407/010 280 comprimidos recubiertos con película (20x14)

Medicamento sujeto a prescripción médica.
CAJA INTERMEDIA PARA ENVASES MÚLTIPLES (SIN BLUE BOX) CON BLISTERS DE PCTFE/PVC
1. NOMBRE DEL MEDICAMENTO
Sprimeo 150 mg comprimidos recubiertos con película Aliskiren

Vía oral.
Leer el prospecto antes de utilizar este medicamento.
jzr
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(es), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
&
West Sussex, RH12 5AB Reino Unido
12. NUMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/407/029 98 comprimidos recubiertos con película (2x49) (blíster unidosis
perforado)
EU/1/07/407/030 280 comprimidos recubiertos con película (20x14)
_
13. NÚMERO DE LOTE
Lote
E DISP
14. CONDICIONES GENERALES DE DISPENSACIÓN
-:
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONE
S DE
USO
¿Si
16. INFORMACIÓN EN BRAILLE
Sprimeo 150 mg
1. NOMBRE DEL MEDICAMENTO
Sprimeo 150 mg comprimidos recubiertos con película Aliskiren
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 150 mg de aliskiren (como hemifumarato).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENV
ASE
Cr
280 comprimidos recubiertos con película
Envase múltiple que contiene 20 envases, cada uno con 14 comprimidos. 98 comprimidos recubiertos con película
_
Envase múltiple que contiene 2 envases, cada uno con 49 comprimidos.
5. FORMA Y VÍA(S) DE ADMINISTP ACIÓN
—
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
__
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS_
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(es), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
12. NUMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
___
EU/1/07/407/029 98 comprimidos recubiertos con película (2x49) (blíster unidosis
perforado)
EU/1/07/407/030 280 comprimidos recubiertos con película (20x14)
13. NÚMERO DE LOTE
Lote
DIS
¡FET
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
nP
15. INSTRUCCIONES D
E USO
16.
Sprimeo 150
INFORMACIÓN EN BRAILLE
0 mg
1. NOMBRE DEL MEDICAMENTO
Sprimeo 300 mg comprimidos recubiertos con película Aliskiren
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 300 mg de aliskiren (como hemifumarato).
3
LISTA DE EXCIPIENTES
=
4.
FORMA FARMACÉUTICA Y CONTENIDO DEL ENV
7 comprimidos recubiertos con película 14 comprimidos recubiertos con película 28 comprimidos recubiertos con película 30 comprimidos recubiertos con película 50 comprimidos recubiertos con película 56 comprimidos recubiertos con película
_
ASE
5.
FORMA Y VÍA(S) DE ADMINISTRACIÓN
a" esti
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTEN CIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(es), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
12. NUMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓ
EU/1/07/407/011
EU/1/07/407/012
EU/1/07/407/013
EU/1/07/407/014
EU/1/07/407/015
EU/1/07/407/016
13. NÚMERO DE LOTE
7 comprimidos recubiertos con película 14 comprimidos recubiertos con película 28 comprimidos recubiertos con película 30 comprimidos recubiertos con película 50 comprimidos recubiertos con película 56 comprimidos recubiertos con película
¿y
—
N
Lote
o°
14. CONDICIONES GEN
ES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
-tM*-
15. INSTRU1 \ IONES DE USO
TRUC
16. INFORMACIÓN EN BRAILLE
Sprimeo 300 mg
1. NOMBRE DEL MEDICAMENTO
Sprimeo 300 mg comprimidos recubiertos con película Aliskiren
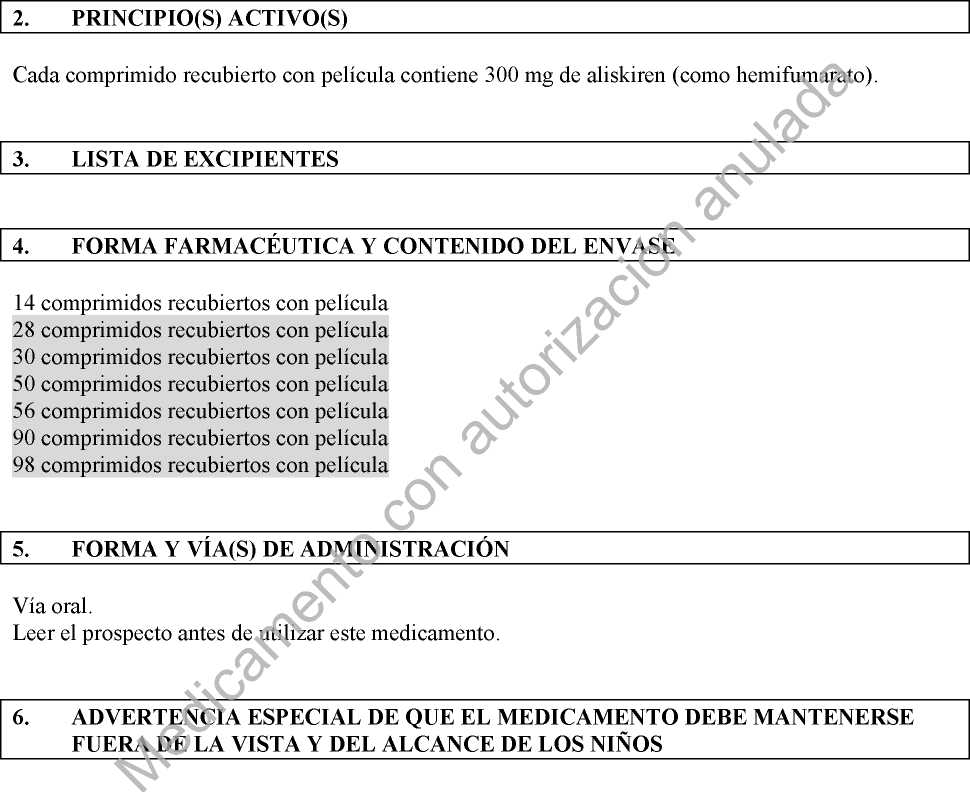
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(es), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
&
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
12. NUMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
£
EU/1/07/407/031
EU/1/07/407/032
EU/1/07/407/033
EU/1/07/407/034
EU/1/07/407/035
EU/1/07/407/036
EU/1/07/407/037
EU/1/07/407/038
14 comprimidos recubiertos con película.
28 comprimidos recubiertos con película 30 comprimidos recubiertos con película 50 comprimidos recubiertos con película 56 comprimidos recubiertos con película 56 comprimidos recubiertos con película (blíster unidosis perforado)
90 comprimidos recubiertos con película 98 comprimidos recubiertos con película
13. NÚMERO DE LOTE
=
<$
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
|
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS | ||
|
BLÍSTER | ||
|
BLÍSTER (CALENDARIO) | ||
|
1. NOMBRE DEL MEDICAMENTO | ||
|
Sprimeo 300 mg comprimidos recubiertos con Aliskiren |
película | |
|
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN | ||
|
Novartis Europharm Limited |
& | |
|
3. FECHA DE CADUCIDAD |
_ | |
|
EXP |
& | |
|
4. NÚMERO DE LOTE | ||
|
Lot | ||
|
5. OTROS | ||
Lunes
Martes
Miércoles
Jueves
Viernes
Sábado
Domingo
CAJA INTERMEDIA PARA ENVASES MÚLTIPLES (SIN BLUE BOX) CON BLISTERS DE PA/ALU/PVC
1. NOMBRE DEL MEDICAMENTO
Sprimeo 300 mg comprimidos recubiertos con película Aliskiren

Componente de un envase múltiple que contiene 3 envases, cada uno con 30 comprimidos. 49 comprimidos recubiertos con película
Componente de un envase múltiple que contiene 2 envases, cada uno con 49 comprimidos.
SP
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto
__

<&■
de utilizar este medicamento.
6
) VERTE
ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
&
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
_s_,_wP
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZA CIÓN
EU/1/07/407/017
EU/1/07/407/018
EU/1/07/407/019
EU/1/07/407/020
84 comprimidos recubiertos con película (3x28)
90 comprimidos recubiertos cor película (3x30)
98 comprimidos recubiertos con película (2x49) 280 comprimidos recubiertos con película (20x14)

EMBALAJE EXTERIOR DE ENVASES MÚLTIPLES (INCLUYE BLUE BOX) CON BLISTERS DE PA/ALU/PVC
1. NOMBRE DEL MEDICAMENTO
Sprimeo 300 mg comprimidos recubiertos con película Aliskiren
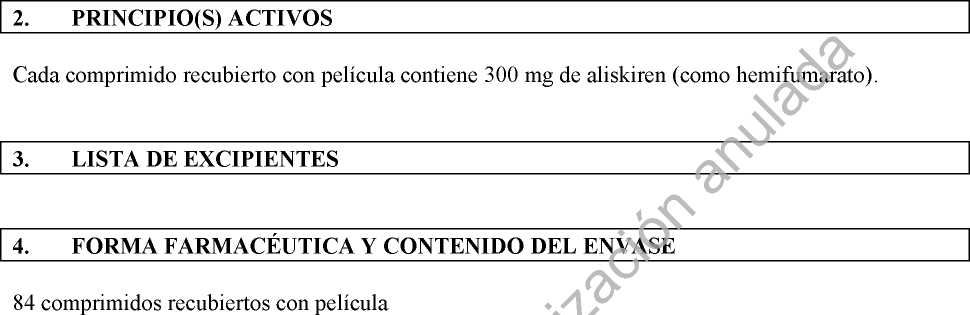
Envase múltiple que contiene 3 envases, cada uno con 28 comprimidos. 90 comprimidos recubiertos con película
Envase múltiple que contiene 3 envases, cada uno con 30 comprimidos. 98 comprimidos recubiertos con película
Envase múltiple que contiene 2 envases, cada uno con 49 comprimidos. 280 comprimidos recubiertos con película (V
Envase múltiple que contiene 20 envases, cada uno con 14 comprimidos.
SP
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto
<&■
de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SUS USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
&
Novartis Europharm Limited Wimblehurst Road Horsham
West Sussex, RH12 5AB Reino Unido
_s_,_wP
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZA CIÓN
EU/1/07/407/017
EU/1/07/407/018
EU/1/07/407/019
EU/1/07/407/020
84 comprimidos recubiertos con película (3x28)
90 comprimidos recubiertos cor película (3x30)
98 comprimidos recubiertos con película (2x49) 280 comprimidos recubiertos con película (20x14)

CAJA INTERMEDIA PARA ENVASES MÚLTIPLES (SIN BLUE BOX) CON BLISTERS DE PCTFE/PVC
1. NOMBRE DEL MEDICAMENTO
Sprimeo 300 mg comprimidos recubiertos con película Aliskiren

Vía oral.
Leer el prospecto antes de utilizar este medicamento.
jzr
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(es), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
&
West Sussex, RH12 5AB Reino Unido
12. NUMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/407/039 98 comprimidos recubiertos con película (2x49) (blíster unidosis
perforado)
EU/1/07/407/040 280 comprimidos recubiertos con película (20x14)
_
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES D
Medicamento sujeto a prescripción médica.
E DIS
&
SPENSACIÓN
15. INSTRUCCIONE
S DE
USO
.-.o
16. INFORMACIÓN EN BRAILLE
Sprimeo 300 mg
EMBALAJE EXTERIOR DE ENVASES MÚLTIPLES (INCLUYE BLUE BOX) CON BLISTERS DE PCTFE/PVC
1. NOMBRE DEL MEDICAMENTO
Sprimeo 300 mg comprimidos recubiertos con película Aliskiren

Envase múltiple que contiene 20 envases, cada uno con 14 comprimidos. 98 comprimidos recubiertos con película
Envase múltiple que contiene 2 envases, cada uno con 49 comprimidos.
_<N_
5. FORMA Y VÍA(S) DE ADMINISTR ACIÓN_
Vía oral.
Leer el prospecto antes de utiliza - este medicamento.
jzr
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(es), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Wimblehurst Road Horsham
&
West Sussex, RH12 5AB Reino Unido
12. NUMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/407/039 98 comprimidos recubiertos con película (2x49) (blíster unidosis
perforado)
EU/1/07/407/040 280 comprimidos recubiertos con película (20x14)
_
13. NÚMERO DE LOTE
Lote
E DISP
14. CONDICIONES GENERALES DE DISPENSACIÓN
-:
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONE
S DE
USO
¿Si
16. INFORMACIÓN EN BRAILLE
Sprimeo 300 mg

Sprimeo 150 mg comprimidos recubiertos con película
Aliskiren
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
&
Contenido del prospecto:
1. Qué es Sprimeo y para qué se utiliza
2. Antes de tomar Sprimeo
3. Cómo tomar Sprimeo
4. Posibles efectos adversos
5. Conservación de Sprimeo
6. Información adicional
1. QUÉ ES SPRIMEO Y PARA QUÉ SE UTILIZA
Sprimeo pertenece a una nueva clase de medicamentos llamados inhibidores de la renina. Sprimeo ayuda a disminuir la hipertensión (presión arterial alta). Los inhibidores de la renina reducen la cantidad de angiotensina II que el organismo puede producir. La angiotensina II causa un estrechamiento de los vasos sanguíneos, lo que aumenta la presión arterial. La reducción de los niveles de angiotensina II permite que los vasos sanguíneos se relajen, lo que disminuye la presión arterial.
La hipertensión aumenta la carga de trabajo del corazón y de las arterias. Si esto continúa durante mucho tiempo, se pueden dañar los vasos sanguíneos del cerebro, corazón y riñones, lo que puede provocar ictus, insuficiencia cardiaca, infarto de miocardio o insuficiencia renal. La disminución de la presión arterial al nivel normal reduce el riesgo de desarrollar estas enfermedades.
AN
TOMAR SPRIMEO
nivel
2
No tome Sprimeo
- si es alérgico (hipersensible) a aliskiren o a cualquiera de los demás componentes de Sprimeo. Si cree que puede ser alérgico, consulte a su médico.
- si alguna vez ha experimentado los siguientes tipos de angioedema (dificultad al respirar o tragar, o hinchazón de la cara, manos y pies, ojos, labios y/o lengua):
- angioedema al tomar aliskiren.
- angioedema hereditario.
- angioedema de causa desconocida.
- durante los últimos 6 meses del embarazo o si está dando el pecho, ver sección Embarazo y lactancia.
- si está tomando ciclosporina (un medicamento utilizado en trasplantes para prevenir el rechazo de un órgano o para otras enfermedades, p. ej. artritis reumatoide o dermatitis atópica), itraconazol (un medicamento para tratar las infecciones por hongos) o quinidina (un medicamento utilizado para corregir el ritmo cardiaco).
si tiene diabetes mellitus o insuficiencia renal y está siendo tratado con alguna de las siguientes clases de medicamentos utilizados para tratar la hipertensión:
- un “inhibidor de la enzima convertidora de angiotensina” como enalapril, lisinopril, ramipril etc.
o
- un “antagonista de los receptores de la angiotensina” como valsarán, telmisartán, irbesartán etc.
Tenga especial cuidado con Sprimeo
- si está tomando un diurético (un tipo de medicamento para aumentar la cantidad de orina).
- si está tomando alguna de las siguientes clases de medicamentos utilizados para tratar la hipertensión:
- un “inhibidor de la enzima convertidora de angiotensina” como enalapril, lisinopril, ramipril etc.
- un “antagonista de los receptores de la angiotensina” como valsartán, telmisarián, irbesartán etc.
- si tiene insuficiencia renal, su médico considerará cuidadosamente si Sprimeo es apropiado para usted y puede querer controlarlo cuidadosamente.
- si experimenta angioedema (dificultad al respirar, o tragar, o hinchazón de la cara, manos y pies, ojos, labios y/o lengua). Si esto ocurre, deje de tomar Sprimeo y contacte con su médico.
♦ fcy
Si se encuentra en alguna de estas situaciones, informe a su médico antes de tomar Sprimeo.
No está recomendado el uso de Sprimeo en niños y adolescentes.
La dosis habitual de Sprimeo en pacientes de 65 años de edad o mayores es de 150 mg.
Uso de otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta
Su médico puede tener que cambiar su dosis y/o tomar otras precauciones si está usando alguno de los siguientes medicamentos:
- medicamentos que incrementan la cantidad de potasio en su sangre, incluyendo diuréticos ahorradores de potasio y suplementos de potasio.
- furosemida, un medicamento que pertenece al grupo de medicamentos conocidos como diuréticos que se utiliza para aumentar la cantidad de orina.
- una de las siguientes clases de medicamentos utilizados para tratar la hipertensión:
- un “inhibidor de la enzima convertidora de angiotensina” como enalapril, lisinopril, ramipnl etc.
o
- un “antagonista de los receptores de la angiotensina” como valsartán, telmisartán, irbesartán etc.
ketoconazol, un medicamento utilizado para tratar infecciones de hongos. verapamilo, un medicamento utilizado para disminuir la tensión arterial, corregir el ritmo cardíaco o tratar una angina de pecho.
cierto tipo de medicamentos para tratar el dolor llamados medicamentos antiinflamatorios no esteroideos (AINEs).
Toma de Sprimeo con los alimentos y bebidas
Debe tomar Sprimeo con una comida ligera una vez al día, preferiblemente a la misma hora cada día. No debe tomar Sprimeo junto con zumo de pomelo.
Embarazo y lactancia
No tome Sprimeo si está embarazada. Es importante que informe a su médico inmediatamente si piensa que pueda estar embarazada o planea quedarse embarazada. No dé el pecho si está tomando
Sprimeo.
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
Puede notar mareos y esto puede afectar a su capacidad de concentración. Antes de conducir un vehículo, manejar maquinaria o realizar otras actividades que requieran un cierto grado de concentración, debe asegurarse de que conoce su reacción a los efectos de Sprimeo.
3. CÓMO TOMAR SPRIMEO
Siga exactamente las instrucciones de administración de Sprimeo indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas.
Las personas hipertensas a menudo no notan ningún síntoma de su problema. Muchos pueden sentirse normales. Es muy importante que tome este medicamento exactamente como le ha indicado su médico para obtener los mejores resultados y reducir el riesgo de efectos adversos. Mantenga las visitas con su médico aunque se encuentre bien.
La dosis normal al inicio del tratamiento es de un comprimido de 150 mg una vez al día.
♦ Vv
Dependiendo de cómo responda al tratamiento, su médico puede subirle la dosis a 300 mg una vez al día. Su médico puede recetar Sprimeo junto con otros medicamentos para tratar la hipertensión.
♦/1/
Forma de administración , c„.. „
Se recomienda tomar los comprimidos con un poco de agua. Debe tomar Sprimeo una vez al día con una comida ligera, preferiblemente a la misma hora cada día. No debe tomar Sprimeo junto con zumo de pomelo. &
Si toma más Sprimeo del que debiera
Si accidentalmente ha tomado demasiados comprimidos de Sprimeo, consulte a su médico inmediatamente. Es posible que necesite asistencia médica.
Si olvidó tomar Sprimeo
Si olvidó tomar una dosis la hora habitual. Sin eml comprimido a la hora habi
meo, tómela en cuanto lo recuerde y luego tome la siguiente dosis a si ya casi es hora de tomar la siguiente dosis, tome sólo el siguiente al. No tome una dosis doble para compensar las dosis olvidadas.
4.
PO
sib
.les :
EFECTOS ADVERSOS
Al igual que todos los medicamentos, Sprimeo puede producir efectos adversos, aunque no todas las personas los sufran.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico. Puede que tenga que dejar de tomar Sprimeo.
Frecuentes (afectan a menos de 1 de cada 10 pacientes): Diarrea, dolor en las articulaciones (artralgia), niveles elevados de potasio en sangre, mareos.
Poco frecuentes (afectan a menos de 1 de cada 100 pacientes): Erupción cutánea (esto también puede ser un signo de una reacción alérgica o angioedema - ver a continuación efectos adversos “Raros”), problemas de riñón que incluyen insuficiencia renal aguda (producción de orina seriamente disminuida), hinchazón de manos, tobillos o pies (edema periférico), reacciones cutáneas graves (necrolisis epidérmica tóxica y/o reacciones en la mucosa bucal - enrojecimiento de la piel, ampollas en los labios, ojos o boca, descamación de la piel, fiebre), hipotensión.
Raros (afectan a menos de 1 de cada 1.000 pacientes): Reacciones alérgicas (hipersensibilidad) y angioedema (cuyos síntomas pueden incluir dificultad al respirar o tragar, erupción, picor, urticaria o hinchazón de la cara, manos y pies, ojos, labios y/o lengua, mareos), aumento de los niveles de creatinina en sangre.
5. CONSERVACIÓN DE SPRIMEO
Mantener fuera del alcance y de la vista de los niños.
No utilice Sprimeo después de la fecha de caducidad que aparece en el envase y el blister. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
6.
INFORMACIÓN ADICIONAL
de m
Composición de Sprimeo
- El principio activo es aliskiren (como hemifumarato) 150 mg.
- Los demás componentes son crospovidona, hipromelosa, estearato de magnesio, macrogol, celulosa microcristalina, povidona, sílice coloidal anhidra, talco, dióxido de titanio (E 171), óxido de hierro negro (E 172), óxido de hierro rojo (E 172)
&
).
Aspecto del producto y contenido del envase
Sprimeo 150 mg comprimidos recubiertos con película son comprimidos de color rosa claro, biconvexos, redondos, marcados con “IL” en una cara y “ N VR” en la otra.
Spnmeo está disponible en envases que condenen , ,4
Los envases que contienen 84 (3x28), 98 (2x49) o 280 (20x14) comprimidos son envases múltiples. Puede que no estén comercializados todos los tam años de envase.
/■
West Sussex, RH12 5AP
Reino Unido
Responsable de la fabricación Novartis F?rma S.p.A.
Via Provinciale Schito 131 I-80058 Torre Annunziata/NA Italia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Etarapun
Novartis Pharma Services Inc. Tea.: +359 2 489 98 28
Luxembourg/Luxemburg
Novartis Pharma GmbH Tél/Tel: +49 911 273 0
Magyarország
Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00
Malta
Ceská republika
Novartis s.r.o.
Tel: +420 225 775 111
Novartis Pharma Services Inc. Tel: +356 2298 3217
Eesti
Novartis Pharma Services Inc. Tel: +372 66 30 810
ELXába
Novartis (Hellas) A.E.B.E. Tr(k: +30 210 281 17 12
España
Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00
Tel: +43 1 86 6570
Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888
Novartis Farma Produtos Farmacéuticos, S.A. Tel: +351 21 000 8600
France
Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00
Ireland
Novartis Ireland Limited Tel: +353 1 260 12 55
•o*
<£sl(
Tel: +41
0 21 31299 01
Slovenská republika
Novartis Slovakia s.r.o.
Tel: +421 2 5542 5439
Suomi/Finland
Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200
Sverige
Novartis Sverige AB Tel: +46 8 732 32 00
Ísland
Vistor hf.
Sími: +354 535 7000 Italia
Novartis Farma S.p.A.
Tel: +39 02 96 54 1
Kúnpoq
Novartis Pharma Services Inc. Tni: +357 22 690 690
Lietuva
Novartis Pharma Services Inc. Tel: +370 5 269 16 50
Este prospecto ha sido aprobado en
La información detallada de este medicamento está disponible en la página web de la Agencia
Europea de Medicamentos http://www.ema.europa.eu

Sprimeo 300 mg comprimidos recubiertos con película
Aliskiren
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico.
&
Contenido del prospecto:
1. Qué es Sprimeo y para qué se utiliza
2. Antes de tomar Sprimeo
3. Cómo tomar Sprimeo
4. Posibles efectos adversos
5. Conservación de Sprimeo
6. Información adicional
1. QUÉ ES SPRIMEO Y PARA QUÉ SE UTILIZA
Sprimeo pertenece a una nueva clase de medicamentos llamados inhibidores de la renina. Sprimeo ayuda a disminuir la hipertensión (presión arterial alta). Los inhibidores de la renina reducen la cantidad de angiotensina II que el organismo puede producir. La angiotensina II causa un estrechamiento de los vasos sanguíneos, lo que aumenta la presión arterial. La reducción de los niveles de angiotensina II permite que los vasos sanguíneos se relajen, lo que disminuye la presión arterial.
La hipertensión aumenta la carga de trabajo del corazón y de las arterias. Si esto continúa durante mucho tiempo, se pueden dañar los vasos sanguíneos del cerebro, corazón y riñones, lo que puede provocar ictus, insuficiencia cardiaca, infarto de miocardio o insuficiencia renal. La disminución de la presión arterial al nivel normal reduce el riesgo de desarrollar estas enfermedades.
AN
TOMAR SPRIMEO
nivel
2
No tome Sprimeo
- si es alérgico (hipersensible) a aliskiren o a cualquiera de los demás componentes de Sprimeo. Si cree que puede ser alérgico, consulte a su médico.
- si alguna vez ha experimentado los siguientes tipos de angioedema (dificultad al respirar o tragar, o hinchazón de la cara, manos y pies, ojos, labios y/o lengua):
- angioedema al tomar aliskiren.
- angioedema hereditario.
- angioedema de causa desconocida.
- durante los últimos 6 meses del embarazo o si está dando el pecho, ver sección Embarazo y lactancia.
- si está tomando ciclosporina (un medicamento utilizado en trasplantes para prevenir el rechazo de un órgano o para otras enfermedades, p. ej. artritis reumatoide o dermatitis atópica), itraconazol (un medicamento para tratar las infecciones por hongos) o quinidina (un medicamento utilizado para corregir el ritmo cardiaco).
si tiene diabetes mellitus o insuficiencia renal y está siendo tratado con alguna de las siguientes clases de medicamentos utilizados para tratar la hipertensión:
- un “inhibidor de la enzima convertidora de angiotensina” como enalapril, lisinopril, ramipril etc.
o
- un “antagonista de los receptores de la angiotensina” como valsarán, telmisartán, irbesartán etc.
Tenga especial cuidado con Sprimeo
- si está tomando un diurético (un tipo de medicamento para aumentar la cantidad de orina).
- si está tomando alguna de las siguientes clases de medicamentos utilizados para tratar la hipertensión:
- un “inhibidor de la enzima convertidora de angiotensina” como enalapril, lisinopril, ramipril etc.
- un “antagonista de los receptores de la angiotensina” como valsartán, telmisarián, irbesartán etc.
azón de
si tiene insuficiencia renal, su médico considerará cuidadosamente si Sprimeo es apropiado para usted y puede querer controlarlo cuidadosamente.
e la cara, manos y
si experimenta angioedema (dificultad al respirar, o tragar, o hinch
pies, ojos, labios y/o lengua). Si esto ocurre, deje de tomar Sprimeo y contacte con su médico.
♦ fcy
Si se encuentra en alguna de estas situaciones, informe a su médico antes de tomar Sprimeo.
No está recomendado el uso de Sprimeo en niños y adolescentes.
La dosis habitual de Sprimeo en pacientes de 65 años de edad o mayores es de 150 mg.
xO
Uso de otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
Su médico puede tener que cambiar su dosis y/o tomar otras precauciones si está usando alguno de los siguientes medicamentos:
- medicamentos que incrementan la cantidad de potasio en su sangre, incluyendo diuréticos ahorradores de potasio y suplementos de potasio.
- furosemida, un medicamento que pertenece al grupo de medicamentos conocidos como diuréticos que se utiliza para aumentar la cantidad de orina.
- una de las siguientes clases de medicamentos utilizados para tratar la hipertensión:
- un “inhibidor de la enzima convertidora de angiotensina” como enalapril, lisinopril, ramipnl etc.
o
- un “antagonista de los receptores de la angiotensina” como valsartán, telmisartán, irbesartán etc.
ketoconazol, un medicamento utilizado para tratar infecciones de hongos. verapamilo, un medicamento utilizado para disminuir la tensión arterial, corregir el ritmo cardíaco o tratar una angina de pecho.
cierto tipo de medicamentos para tratar el dolor llamados medicamentos antiinflamatorios no esteroideos (AINEs).
Toma de Sprimeo con los alimentos y bebidas
Debe tomar Sprimeo con una comida ligera una vez al día, preferiblemente a la misma hora cada día. No debe tomar Sprimeo junto con zumo de pomelo.
Embarazo y lactancia
No tome Sprimeo si está embarazada. Es importante que informe a su médico inmediatamente si piensa que pueda estar embarazada o planea quedarse embarazada. No dé el pecho si está tomando
Sprimeo.
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
Puede notar mareos y esto puede afectar a su capacidad de concentración. Antes de conducir un vehículo, manejar maquinaria o realizar otras actividades que requieran un cierto grado de concentración, debe asegurarse de que conoce su reacción a los efectos de Sprimeo.
3. CÓMO TOMAR SPRIMEO
Siga exactamente las instrucciones de administración de Sprimeo indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas.
Las personas hipertensas a menudo no notan ningún síntoma de su problema. Muchos pueden sentirse normales. Es muy importante que tome este medicamento exactamente como le ha indicado su médico para obtener los mejores resultados y reducir el riesgo de efectos adversos. Mantenga las visitas con su médico aunque se encuentre bien.
La dosis normal al inicio del tratamiento es de un comprimido de 150 mg una vez al día.
♦ Vv
Dependiendo de cómo responda al tratamiento, su médico puede subirle la dosis a 300 mg una vez al día. Su médico puede recetar Sprimeo junto con otros medicamentos para tratar la hipertensión.
♦/1/
Forma de administración , c„,. „
Se recomienda tomar los comprimidos con un poco de agua. Debe tomar Sprimeo una vez al día con una comida ligera, preferiblemente a la misma hora cada día. No debe tomar Sprimeo junto con zumo de pomelo. &
Si toma más Sprimeo del que debiera
Si accidentalmente ha tomado demasiados comprimidos de Sprimeo, consulte a su médico inmediatamente. Es posible que necesite asistencia médica.
Si olvidó tomar Sprimeo
Si olvidó tomar una dosis la hora habitual. Sin eml comprimido a la hora habi
meo, tómela en cuanto lo recuerde y luego tome la siguiente dosis a si ya casi es hora de tomar la siguiente dosis, tome sólo el siguiente al. No tome una dosis doble para compensar las dosis olvidadas.
4.
PO
SIBL
.les :
EFECTOS ADVERSOS
Al igual que todos los medicamentos, Sprimeo puede producir efectos adversos, aunque no todas las personas los sufran.
Si considera que alguno de los efectos adversos que sufre es grave o si aprecia cualquier efecto adverso no mencionado en este prospecto, informe a su médico o farmacéutico. Puede que tenga que dejar de tomar Sprimeo.
Frecuentes (afectan a menos de 1 de cada 10 pacientes): Diarrea, dolor en las articulaciones (artralgia), niveles elevados de potasio en sangre, mareos.
Poco frecuentes (afectan a menos de 1 de cada 100 pacientes): Erupción cutánea (esto también puede ser un signo de una reacción alérgica o angioedema - ver a continuación efectos adversos “Raros”), problemas de riñón que incluyen insuficiencia renal aguda (producción de orina seriamente disminuida), hinchazón de manos, tobillos o pies (edema periférico), reacciones cutáneas graves (necrolisis epidérmica tóxica y/o reacciones en la mucosa bucal - enrojecimiento de la piel, ampollas en los labios, ojos o boca, descamación de la piel, fiebre), hipotensión.
Raros (afectan a menos de 1 de cada 1.000 pacientes): Reacciones alérgicas (hipersensibilidad) y angioedema (cuyos síntomas pueden incluir dificultad al respirar o tragar, erupción, picor, urticaria o hinchazón de la cara, manos y pies, ojos, labios y/o lengua, mareos), aumento de los niveles de creatinina en sangre.
5. CONSERVACIÓN DE SPRIMEO
Mantener fuera del alcance y de la vista de los niños.
No utilice Sprimeo después de la fecha de caducidad que aparece en el envase y el blister. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Conservar en el embalaje original para protegerlo de la humedad.
6.
INFORMACIÓN ADICIONAL
de m
Composición de Sprimeo
- El principio activo es aliskiren (como hemifumarato) 300 mg.
- Los demás componentes son crospovidona, hipromelosa, estearato de magnesio, macrogol, celulosa microcristalina, povidona, sílice coloidal anhidra, talco, dióxido de titanio (E 171), óxido de hierro negro (E 172), óxido de hierro rojo (E 172)
&
).
Aspecto del producto y contenido del envase
Sprimeo 300 mg comprimidos recubiertos con película son comprimidos de color rojo claro, biconvexos, ovalados, marcados con “IU” en una cara y “NVR” en la otra.
Sprimeo está disponible en envases que contienen 7, 14, 28, 30, 50, 56, 84, 90, 98 o 280 comprimidos. Los envases que contienen 84 (3x28), 90 (3x30), 98 (2x49) o 280 (20x14) comprimidos son envases múltiples. Puede que no estén comercializados todos los tamaños de envase.
/■
West Sussex, RH12 5AB
Reino Unido
Responsable de la fabricación
Novartis Farma S.p.A.
Via Provinciale Schito 131 I-80058 Torre Annunziata/NA Italia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Novartis Pharma N.V.
Tél/Tel: +32 2 246 16 11
Etarapun
Novartis Pharma Services Inc. Tea.: +359 2 489 98 28
Luxembourg/Luxemburg
Novartis Pharma GmbH Tél/Tel: +49 911 273 0
Magyarország
Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00
Malta
Ceská republika
Novartis s.r.o.
Tel: +420 225 775 111
Novartis Pharma Services Inc. Tel: +356 2298 3217
Eesti
Novartis Pharma Services Inc. Tel: +372 66 30 810
ELXába
Novartis (Hellas) A.E.B.E. Tr(k: +30 210 281 17 12
España
Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00
Tel: +43 1 86 6570
Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888
Novartis Farma Produtos Farmacéuticos, S.A. Tel: +351 21 000 8600
France
Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00
Ireland
Novartis Ireland Limited Tel: +353 1 260 12 55
•o*
<£sl(
Tel: +41
0 21 31299 01
Slovenská republika
Novartis Slovakia s.r.o.
Tel: +421 2 5542 5439
Suomi/Finland
Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200
Sverige
Novartis Sverige AB Tel: +46 8 732 32 00
Ísland
Vistor hf.
Sími: +354 535 7000 Italia
Novartis Farma S.p.A.
Tel: +39 02 96 54 1
Kúnpoq
Novartis Pharma Services Inc. Tni: +357 22 690 690
Lietuva
Novartis Pharma Services Inc. Tel: +370 5 269 16 50
Este prospecto ha sido aprobado en
La información detallada de este medicamento está disponible en la página web de la Agencia
Europea de Medicamentos http://www.ema.europa.eu

71