Sildenafilo Sandoz 50 Mg Laminas Bucodispersables Efg
Información obsoleta, busque otroFICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Sildenafilo Sandoz 25 mg láminas bucodispersables EFG Sildenafilo Sandoz 50 mg láminas bucodispersables EFG Sildenafilo Sandoz 75 mg láminas bucodispersables
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Sildenafilo Sandoz 25 mg láminas bucodispersables:
Una lámina bucodispersable contine 31,5 mg de citrato de sildenafilo, equivalente a 25 mg de sildenafilo. Sildenafilo Sandoz 50 mg láminas bucodispersables:
Una lámina bucodispersable contiene 70,2 mg de citrato de sildenafilo, equivalente a 50 mg de sildenafilo. Sildenafilo Sandoz 75 mg láminas bucodispersables:
Una lámina bucodispersable contiene 105,4 mg de citrato de sildenafilo, equivalente a 75 mg de sildenafilo. Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Lámina bucodispersable.
lámina, rectangulares, y flexibles lámina, rectangulares, y flexibles lámina, rectangulares, y flexibles
Sildenafilo Sandoz 25 mg láminas bucodispersables son tiras en forma de de color azul claro (14 mm x 25 mm).
Sildenafilo Sandoz 50 mg láminas bucodispersables son tiras en forma de de color azul claro (28 mm x 25 mm).
Sildenafilo Sandoz 75 mg láminas bucodispersables son tiras en forma de de color azul claro (42 mm x 25 mm).
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de la disfunción eréctil en hombres, que es la incapacidad para obtener o mantener una erección suficiente para una actividad sexual satisfactoria. Para que sildenafilo sea efectivo es necesaria la estimulación sexual.
4.2 Posología y forma de administración
Posología Uso en adultos
La dosis recomendada es de 50 mg tomados a demanda, aproximadamente una hora antes de la actividad sexual. En base a la eficacia y tolerancia, la dosis se puede aumentar hasta 100 mg (dos láminas bucodispersables de 50 mg se pueden tomar de una vez) o disminuir a 25 mg. La dosis máxima recomendada es de 100 mg. La pauta máxima de dosificación recomendada es de una vez al día. Si se toma sildenafilo con alimentos, el inicio de su acción farmacológica podría retrasarse en comparación a cuando se toma en ayunas (ver sección 5.2).
Uso en pacientes de edad avanzada
No se requiere ajuste de dosis en pacientes de edad avanzada.
Uso en _pacientes con insuficiencia renal
Las dosis recomendadas descritas en “Uso en adultos” son aplicables a pacientes con insuficiencia renal leve a moderada (aclaramiento de creatinina = 30-80 ml/min).
Como el aclaramiento de sildenafilo se reduce en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min) debe considerarse una dosis de 25 mg para estos pacientes. En base a la eficacia y tolerancia, se puede incrementar la dosis a 50 mg, 75 mg y 100 mg (dos láminas bucodispersables de 50 mg se pueden tomar de una vez).
Uso en _pacientes con insuficiencia hepática
Como el aclaramiento de sildenafilo se reduce en pacientes con insuficiencia hepática (por ejemplo, cirrosis) debe considerarse una dosis de 25 mg para estos pacientes. En base a la eficacia y tolerancia, se puede incrementar la dosis a 50 mg, 75 mg y 100 mg (dos láminas bucodispersables de 50 mg se pueden tomar de una vez).
Población pediátrica
Sildenafilo no está indicado para su uso en menores de 18 años de edad.
Uso en pacientes en tratamiento con otros medicamentos
A excepción de ritonavir, para el que no se aconseja su administración concomitante con sildenafilo (ver sección 4.4), se debe considerar una dosis inicial de 25 mg en aquellos pacientes que reciben tratamiento concomitante con inhibidores del CYP3A4 (ver sección 4.5).
Con el fin de minimizar la potencial aparición de hipotensión postural, los pacientes que reciban tratamiento con alfabloqueantes deben encontrarse estables bajo este tratamiento antes de iniciar la administración de sildenafilo. Asimismo, se debe valorar el inicio del tratamiento con sildenafilo a una dosis de 25 mg (ver secciones 4.4 y 4.5).
Forma de administración
Sildenafilo Sandoz láminas bucodispersables es para uso por vía oral y se toman sin agua.
Si se desea Sildenafilo Sandoz láminas bucodispersables también se puede tomar con agua.
Instrucciones de uso
Importante: ¡No coja la lámina bucodispersable con las manos húmedas!
a) Coja el sobre, coloque la marca de la flecha que aparece por uno de los lados más cortos y sujete el sobre por ese lado mirando hacia arriba. El sobre no está sellado por ahí.
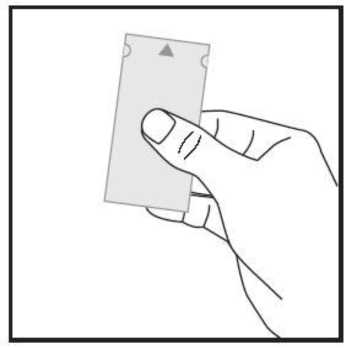
b) Con suavidad despegue ambas partes del sobre por la parte de la marca de la flecha. De esta forma, puede sujetar cada lado del sobre con sus pulgares y dedos índice utilizando una mano para cada parte del sobre.
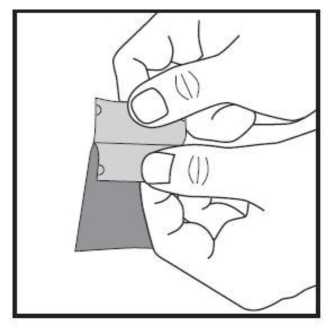
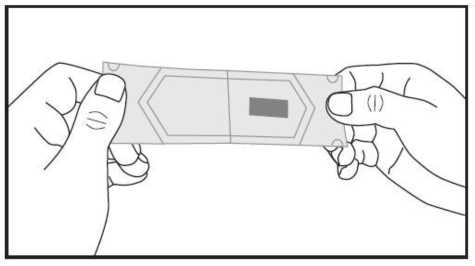
c) Con cuidado tire de ambas partes del sobre en direcciones opuestas hasta que se hayan separado. La lámina bucodispersable es ahora visible y se encuentra en una de las partes separadas del sobre
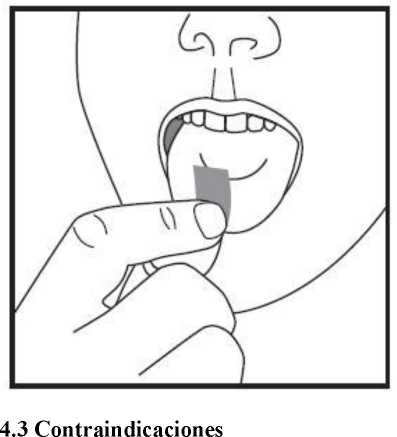
d) Coja la lamina bucodispersable con los dedos secos del sobre y póngala directamente en su boca sobre la lengua. Esta se disolverá rápidamente y se podrá tragar con facilidad.
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
De acuerdo con sus conocidos efectos sobre la vía óxido nítrico/guanosina monofosfato cíclica (GMPc) (ver sección 5.1), sildenafilo ha demostrado potenciar los efectos hipotensores de los nitratos, estando contraindicada la administración concomitante de sildenafilo con los dadores de óxido nítrico (tales como nitrito de amilo) o nitratos en cualquiera de sus formas.
No se deben utilizar medicamentos para el tratamiento de la disfunción eréctil, incluyendo sildenafilo, en hombres en los que la actividad sexual esté desaconsejada (por ejemplo: pacientes con trastornos cardiovasculares graves tales como: angina inestable o insuficiencia cardíaca grave).
Sildenafilo está contraindicado en pacientes que han perdido la visión en un ojo debido a neuropatía óptica isquémica anterior no arterítica (NOIA-NA), independientemente de si este episodio se asoció o no con la exposición previa a un inhibidor de la PDE5 (ver sección 4.4).
La seguridad de sildenafilo no ha sido estudiada en los siguientes subgrupos de pacientes y, por lo tanto, su uso está contraindicado en estos pacientes: insuficiencia hepática grave, hipotensión (tensión arterial <90/50 mmHg), historia reciente de accidente isquémico cerebral o infarto de miocardio y conocidos trastornos hereditarios degenerativos de la retina tales como retinitis pigmentosa (una minoría de estos pacientes tienen trastornos genéticos de las fosfodiesterasas de la retina).
4.4 Advertencias y precauciones especiales de empleo
Es recomendable realizar una historia clínica y exploración física del paciente, para diagnosticar la disfunción eréctil y determinar las causas potenciales subyacentes, antes de considerar el tratamiento farmacológico.
Factores de riesgo cardiovasculares
Antes de iniciar cualquier tratamiento de la disfunción eréctil, el médico debe considerar el estado cardiovascular de sus pacientes, ya que existe algún riesgo cardíaco asociado con la actividad sexual. Sildenafilo tiene propiedades vasodilatadoras, resultando en una disminución leve y transitoria de la tensión arterial (ver sección 5.1). Antes de prescribir sildenafilo, el médico debe considerar cuidadosamente si sus pacientes con ciertas patologías subyacentes podrían verse afectados de forma adversa por tales efectos vasodilatadores, especialmente combinados con la actividad sexual. Los pacientes con una mayor susceptibilidad a los vasodilatadores incluyen aquellos con obstrucción del flujo ventricular izquierdo (por ejemplo: estenosis aórtica, miocardiopatía hipertrófica obstructiva) o aquellos con el infrecuente síndrome de atrofia sistémica múltiple que se caracteriza por una insuficiencia grave del control autónomo de la presión sanguínea.
Sildenafilo potencia el efecto hipotensor de los nitratos (ver sección 4.3).
P r i a p r i s m o
Se ha notificado, en la asociación temporal con el uso de sildenafilo, durante el seguimiento postcomercialización de acontecimientos cardiovasculares graves, incluyendo infarto de miocardio, angina inestable, muerte cardíaca súbita, arritmia ventricular, hemorragia cerebrovascular, ataque isquémico transitorio, hipertensión e hipotensión. La mayoría de estos pacientes, aunque no todos, padecian factores de riesgo cardiovasculares anteriores. Se ha notificado que muchos acontecimientos tuvieron lugar durante o poco tiempo después de la relación sexual y unos pocos sucedieron poco después del uso de sildenafilo sin actividad sexual. No es posible determinar si estos acontecimientos están directamente relacionados con estos factores o con otros factores.
U s o concomitante con otros tratamientos para la disfunción eréctil
Los medicamentos para el tratamiento de la disfunción eréctil, incluyendo sildenafilo, se deben utilizar con precaución en pacientes con deformaciones anatómicas del pene (tales como: angulación, fibrosis carvernosa o enfermedad de Peyronie), o en pacientes con antecedentes que puedan predisponer a priapismo (tales como: anemia falciforme, mieloma múltiple o leucemia).
No se ha estudiado la seguridad y eficacia de la asociación de sildenafilo con otros tratamientos para la disfunción eréctil. Por lo tanto, no se recomienda el uso de tales asociaciones.
E f e c t o s en la visión
Se han notificado defectos visuales y casos de neuropatía óptica isquémica anterior no arterítica en asociación con la administración de sildenafilo y de otros inhibidores de la PDE5. Debe advertirse a los pacientes que en el caso de un defecto visual repentino, dejen de tomar sildenafilo y consulten inmediatamente con un médico (ver sección 4.3).
U s o concomitante con ritonavir
No se recomienda la administración conjunta de sildenafilo con ritonavir (ver sección 4.5).
U s o concomitante con alfa bloqueantes
Se recomienda tener precaución cuando se administre sildenafilo a pacientes en tratamiento con un alfabloqueante, ya que la administración concomitante de ambos medicamentos puede producir hipotensión sintomática en un pequeño número de pacientes más susceptibles de padecerla (ver sección 4.5). Ésta es más probable que ocurra en las 4 horas posteriores a la toma de sildenafilo. Con el fin de minimizar la potencial aparición de hipotensión postural, los pacientes que reciban tratamiento con alfabloqueantes deben encontrarse hemodinámicamente estables bajo el tratamiento con alfabloqueantes antes de iniciar la administración de sildenafilo. Por otro lado, se debe valorar iniciar el tratamiento con sildenafilo a una dosis de 25 mg (ver sección 4.2). Además, los médicos deben informar a sus pacientes de qué medidas adoptar en caso de experimentar síntomas de hipotensión postural.
Estudios con plaquetas humanas indican que sildenafilo potencia el efecto antiagregante del nitroprusiato sódico in vitro. No existen datos de seguridad sobre la administración de sildenafilo a pacientes con trastornos hemorrágicos o con úlcera péptica activa. Por lo tanto, sildenafilo se debe administrar a estos pacientes sólo tras la evaluación del beneficio-riesgo.
El uso de sildenafilo no está indicado en mujeres.
4.5 Interacción con otros medicamentos y otras formas de interacción
Efectos de otros medicamentos sobre sildenafilo Estudios in vitro
El metabolismo de sildenafilo está mediado predominantemente por el citocromo P450 (CYP) isoformas 3A4 (principalmente) y 2C9 (en menor medida). Por lo tanto, los inhibidores de estas isoenzimas pueden reducir el aclaramiento de sildenafilo.
Estudios in vivo
El análisis de los datos farmacocinéticos de los ensayos clínicos, mostró que se produjo una reducción del aclaramiento de sildenafilo cuando se administró concomitantemente con inhibidores del CYP3A4 (tales como ketoconazol, eritromicina, cimetidina). Aunque no se observó un aumento de la incidencia de acontecimientos adversos en estos pacientes, se debe considerar una dosis inicial de 25 mg cuando éste se administra concomitantemente con los inhibidores del CYP3A4,.
La administración concomitante de ritonavir, inhibidor de la proteasa del VIH, que presenta una potente acción inhibitoria sobre el citocromo P450, en el estado de equilibrio (500 mg dos veces al día) junto con sildenafilo (dosis única de 100 mg) produjo un aumento del 300% (4 veces superior) en la Cmax de sildenafilo y del 1000% (11 veces superior) en la AUC plasmática de sildenafilo. A las 24 horas, los niveles plasmáticos de sildenafilo eran todavía de aproximadamente de 200 ng/ml, en comparación con los aproximadamente 5 ng/ml cuando se administra sólo sildenafilo. Este hecho está en concordancia con los efectos evidentes de ritonavir sobre un gran número de sustratos del citocromo P450. Sildenafilo no presentó ningún efecto sobre la farmacocinética de ritonavir. En base a estos resultados farmacocinéticos,
no se aconseja la administración concomitante del sildenafilo con ritonavir (ver sección 4.4) y en ninguna circunstancia la dosis máxima de sildenafilo debe exceder de 25 mg en 48 horas.
La administración concomitante de saquinavir, inhibidor de la proteasa del VIH, inhibor del citocromo CYP3A4, en el estado de equilibrio (1.200 mg tres veces al día), con sildenafilo (dosis única de 100 mg) produjo un aumento del 140% en la Cmax de sildenafilo y del 210% en la AUC de sildenafilo. Sildenafilo no presentó ningún efecto sobre la farmacocinética de saquinavir (ver sección 4.2). Cabría esperar efectos más intensos con inhibidores más potentes del citocromo CYP 3A4, tales como ketoconazol e itraconazol.
Cuando se administró una dosis única de 100 mg de sildenafilo con eritromicina, un inhibidor específico del CYP3A4, en el estado de equilibrio (500 gm dos veces al día durante 5 días), hubo un incremento del 182% en la exposición sistémica de sildenafilo (AUC).. En voluntarios varones sanos, no se observó ninguna evidencia de un efecto con azitromicina (500 mg diarios durante 3 días) sobre el AUC, la Cmax, el tmax, la constante de velocidad de eliminación o la consiguiente semivida de sildenafilo o de su metabolito principal en sangre. Cimetidina (800 mg), un inhibidor del citocromo P450 e inhibidor no específico del CYP3A4, produjo un aumento del 56% de la concentración plasmática de sildenafilo cuando se administró concomitante con sildenafilo (50 mg) a voluntarios sanos.
El zumo de pomelo es un inhibidor débil del metabolismo del citocromo CYP3A4 localizado en la pared intestinal que puede provocar pequeños incrementos de los niveles plasmáticos de sildenafilo.
Dosis únicas de antiácido (hidróxido magnésico/hidróxido de aluminio) no afectaron la biodisponibilidad de sildenafilo.
Aunque no se han realizado estudios de interacción específica con todos los medicamentos posibles, el análisis de los datos farmacocinéticos no mostró efecto alguno sobre la farmacocinética de sildenafilo cuando se administró concomitantemente con inhibidores del CYP2C9 (tales como tolbutamida, warfarina, fenitoína), inhibidores del CYP2D6 (tales como inhibidores selectivos de la recaptación de serotonina, antidepresivos tricíclicos), tiazidas y diuréticos relacionados (diuréticos de asa y ahorradores de potasio), inhibidores de la enzima conversora de angiotensina, bloqueantes de los canales del calcio, antagonistas beta-adrenérgicos o inductores del metabolismo del CYP450 (tales como rifampicina, barbitúricos).
Nicorandil es un híbrido entre un activador de los canales de potasio y un nitrato. Debido a su componente nitrato, tiene el potencial de presentar una interacción grave con sildenafilo.
Efectos de sildenafilo sobre otros medicamentos
Estudios in vitro
Sildenafilo es un inhibidor débil del citocromo P450 isoformas 1A2, 2C9, 2C19, 2D6, 2E1 y 3A4 (IC50 > 150 pM). Dado que las concentraciones plasmáticas máximas de sildenafilo, tras las dosis recomendadas, son de aproximadamente 1 pM, no es probable que sildenafilo altere el aclaramiento de los sustratos de estas isoenzimas.
No se dispone de datos de interacción de sildenafilo e inhibidores no específicos de la fosfodiesterasa, tales como teofilina o dipiridamol.
Estudios in vivo
De acuerdo con sus efectos conocidos sobre la vía óxido nítrico/GMPc (ver sección 5.1), sildenafilo potenció los efectos hipotensores de los nitratos. Por lo tanto, su administración concomitante con los dadores del óxido nítrico o nitratos está contraindicada (ver sección 4.3).
La administración concomitante de sildenafilo a pacientes en tratamiento con alfabloqueantes puede producir hipotensión sintomática en un pequeño número de pacientes susceptible de padecerla. Ésto es más probable que ocurra en las 4 horas posteriores a la toma de sildenafilo (ver secciones 4.2 y 4.4). En tres estudios específicos de interacción farmacológica, se administraron simultáneamente el alfabloqueante doxazosina (4 mg y 8 mg) y sildenafilo (25 mg, 50 mg o 100 mg) a pacientes con hiperplasia benigna de
]£
próstata (HBP) y que se encontraban ya estables en el tratamiento con doxazosina. En estas poblaciones objeto de estudio, se observaron unas reducciones medias adicionales de la presión arterial en decúbito supino de 7/7 mmHg, de 9/5 mmHg y de 8/4 mmHg, y unas reducciones medias adicionales de la presión arterial en bipedestación de 6/6 mmHg, de 11/4 mmHg y de 4/5 mmHg, respectivamente. Cuando sildenafilo y doxazosina fueron administrados concomitantemente a pacientes estables en el tratamiento con doxazosina, los casos notificados de pacientes que experimentaron hipotensión postural sintomática fueron poco frecuentes. Estos casos incluyeron mareos o sensación de vahído, pero no síncope.
No se han observado interacciones significativas cuando se administró sildenafilo (50 mg) concomitantemente con tolbutamida (250 mg) o warfarina (40 mg), metabolizándose ambos por el CYP2C9.
Sildenafilo (50 mg) no potenció el aumento del tiempo de hemorragia causado por ácido acetilsalicílico (150 mg).
Sildenafilo (50 mg) no potenció los efectos hipotensores del alcohol en voluntarios sanos con niveles máximos medios de alcohol en sangre de 80 mg/dl.
El análisis conjunto de todos los datos obtenidos de los siguientes tipos de medicamentos antihipertensivos: diuréticos, beta bloqueantes, inhibidores de la ECA, antagonistas de la angiotensina II, medicamentos antihipertensivos (vasodilatadores y de acción central), bloqueantes de las neuronas adrenérgicas, bloqueantes de los canales del calcio y bloqueantes alfa-adrenérgicos, mostró que no existen diferencias en el perfil de reacciones adversas en pacientes a los que se administró sildenafilo, en comparación con placebo. En un estudio de interacción específico, cuando sildenafilo (100 mg) se administró concomitantemente con amlodipino a pacientes hipertensos, la reducción media adicional en la tensión arterial sistólica en posición supina fue de 8 mmHg. La reducción adicional correspondiente de la tensión arterial diastólica en posición supina fue de 7 mmHg. Estas reducciones adicionales en la tensión arterial fueron de una magnitud similar a aquellas observadas cuando se administró sildenafilo como único medicamento a voluntarios sanos (ver sección 5.1).
Sildenafilo (100 mg) no afectó a la farmacocinética del estado estacionario de los inhibidores de la proteasa del VIH, saquinavir y ritonavir, que son sustratos del citocromo CYP3A4.
4.6 Fertilidad, embarazo y lactancia
El uso de sildenafilo no está indicado en mujeres.
No existen estudios adecuados y bien controlados en el embarazo y la lactancia en mujeres.
Tras la administración oral de sildenafilo no se observaron efectos adversos relevantes en los estudios para la reproducción realizados en ratas y conejos. N
o hubo efectos en la movilidad del esperma o en la morfología a tomas de 100 mg por vía oral de sildenafil
o en voluntarios
sanos (ver sección 5.1.).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas.
En los estudios clínicos con sildenafilo se notificaron mareos, y trastornos visuales, por lo tanto, los pacientes deben saber cómo reaccionan a sildenafilo, antes de conducir vehículos o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
El perfil de seguridad de sildenafilo se basa en 8.691 pacientes que recibieron el régimen posológico recomendado en 67 ensayos clínicos controlados con placebo. Las reacciones adversas más frecuentemente notificadas en los ensayos clínicos entre los pacientes tratados con sildenafilo fueron dolor de cabeza, rubefacción, dispepsia, alteraciones visuales, congestión nasal, mareos y distorsión visual de los colores.
Las reacciones adversas notificadas durante la experiencia post-comercialización se han recogido cubriendo un período estimado superior a 9 años. Dado que no todas las reacciones adversas se han notificado al titular de la autorización de comercialización e incluido en la base de datos de seguridad, las frecuencias de estas reacciones adversas no pueden determinarse de modo fiable.
Listado tabulado de reacciones adversas
En la tabla a continuación aparecen todas las reacciones adversas clíncamente importantes, que ocurrieron en los ensayos clínicos con una incidencia superior al placebo, listadas según la clasificación por órganos y sistemas (muy frecuentes = 1/10), frecuentes (= 1/100 y < 1/10), poco frecuentes (= 1/1.000 y <1/100), raras (= 1/10.000 y < 1/1.000).
Además, la frecuencia de las reacciones adversas clínicamente importantes notificadas a partir de la experiencia post-comercialización, se incluye como frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 1: Reacciones adversas clínicamente importantes notificadas con una incidencia superior a placebo en ensayos clínicos controlados y reacciones adversas clínicamente importantes notificadas a partir de la experiencia post-comercialización.
Clasificación por órganos y sistemas Reacciones adversas
Trastornos del sistema inmunológico
Raras: Reacciones de hipersensibilidad
Trastornos del sistema nervioso
Muy frecuentes:
Frecuentes:
Poco frecuentes:
Raras:
No conocidas:
Trastornos oculares
Frecuentes:
Poco frecuentes:
No conocidas:
Cefalea
Mareo
Somnolencia, hipoestesia
Accidente cerebrovascular, síncope
Ataque isquémico transitorio, convulsiones, convulsiones
recurrentes
Alteraciones visuales, distorsión visual de los colores Trastornos conjuntivales, trastornos del ojo, trastornos de la lagrimación y otros trastornos Neuropatía óptica isquémica anterior no arterítica (NOIANA), oclusión vascular retiniana y defectos del campo visual
Trastornos del oido y del laberinto
Poro frecuentes:
Raras:
Trastornos vasculares
Frecuentes:
Raras:
Trastornos cardiacos
Poco frecuentes:
Raras:
No conocidas:
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes:
Raros:
Trastornos gastrointestinales
Frecuentes:
Poco frecuentes:
Trastornos de la piel y del tejido subcutáneo
Poco frecuentes:
No conocidas:
Vértigo, Acúfenos Sordera*
Rubefacción
Hipertensión, hipotensión
Palpitaciones, taquicardia
Infarto de miocardio, fibrilación auricular
Arritmia ventricular, angina inestable, muerte cardiaca súbita
Congestión nasal Epistaxis
Dispepsia
Vómitos, náuseas, boca seca
Erupciones cutáneas
Síndrome de Steven Johnson (SJS), necrólisis tóxica epidérmica (NTE)
Trastornos musculoesqueléticos y del tejido conectivo
Poco frecuentes:
Trastornos renales y urinarios Poco frecuentes:
Mialgia
Trastornos del aparato reproductor y de la mama Poco frecuentes:
No conocidas:
Trastornos generales y alteraciones en el lugar de administración
Poco frecuentes:
Dolor torácico, fatiga
Frecuencia cardiaca aumentada
SAN IDAD, POLITICA LITIGA
SOCIAL E IGUALDAD IALDAD Agencaespañoiaoe <3áoé
medicamentos y ¡y
oroouctos san-tanos -aws
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación : Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano website: www.notificaram.es .
4.9 Sobredosis
En estudios realizados en voluntarios sanos con dosis únicas de hasta 800 mg, las reacciones adversas fueron similares a las observadas con dosis más bajas, pero la incidencia y la gravedad aumentaron Dosis de 200 mg no incrementaron la eficacia pero sí la incidencia de reacciones adversas (cefalea, enrojecimiento, mareos, dispepsia, congestión nasal y trastornos visuales).
En caso de sobredosis, se deben tomar medidas normales de apoyo. Dado que sildenafilo se une intensamente a las proteínas plasmáticas y no se elimina por orina, no se espera que la diálisis renal acelere el aclaramiento del medicamento.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Medicamentos urológicos, utilizados en la disfunción eréctil. Código ATC G04B E03.
Mecanismo de acción
Sildenafilo es una terapia de administración oral para el tratamiento de la disfunción eréctil. En condiciones normales, es decir, con estimulación sexual, restaura la función eréctil deteriorada mediante el aumento del flujo sanguíneo al pene.
El mecanismo fisiológico responsable de la erección del pene implica la liberación de óxido nítrico (ON) en los cuerpos cavernosos durante la estimulación sexual. El óxido nítrico activa la enzima guanilatociclasa, lo que da lugar a un aumento de los niveles de guanosina monofosfato cíclica (GMPc), que produce una relajación del músculo liso en los cuerpos cavernosos del pene, permitiendo la afluencia de sangre.
Efectos farmacodinámicos
Sildenafilo es un inhibidor potente y selectivo de la fosfodiesterasa tipo 5 (PDE5) específica del GMPc en los cuerpos cavernosos, donde la PDE5 es la responsable de la degradación del GMPc. Sildenafilo actúa a nivel periférico sobre la erección. Sildenafilo no tiene un efecto relajante directo sobre los cuerpos cavernosos humanos aislados, pero aumenta potentemente el efecto relajante del ON en este tejido. Cuando se encuentra activada la vía ON/GMPc, como ocurre durante la estimulación sexual, la inhibición de la PDE5 por sildenafilo ocasiona un aumento de los niveles de GMPc en los cuerpos cavernosos. Por lo tanto es necesaria la estimulación sexual para que sildenafilo produzca sus efectos farmacológicos beneficiosos previstos.
Los estudios in vitro han demostrado que sildenafilo es selectivo de la PDE5, implicada en el proceso de erección. Su efecto es más potente sobre la PDE5 que sobre otras fosfodiesterasas conocidas. Tiene una selectividad 10 veces mayor que por la PDE6, que participa en el mecanismo de fototransducción en la retina. A las dosis máximas recomendadas, tiene una selectividad 80 veces superior por la PDE1 y 700 veces superior por la PDE2, 3, 4, 7, 8, 9, 10 y 11. Particularmente, sildenafilo es 4.000 veces más selectivo por la PDE5 que por la PDE3, la isoforma fosfodiesterasa específica AMPc relacionada con el control de la contractilidad cardíaca.
Eficacia y seguridad clínica
Dos estudios clínicos fueron específicamente diseñados para evaluar el tiempo durante el cual sildenafilo podría producir una erección en respuesta a la estimulación sexual. En un estudio utilizando plestimografía peneana (RigiScan) con pacientes en ayunas, el tiempo mediano de inicio de una erección con rigidez superior al 60% (suficiente para el acto sexual) fue de 25 minutos (rango de 12-37 minutos) tras la administración de sildenafilo. En otro estudio utilizando también RigiScan, sildenafilo, a las 4-5 horas de ser administrado, aún fue capaz de producir una erección en respuesta a la estimulación.
Sildenafilo causa una disminución leve y transitoria en la tensión arterial que, en la mayoría de los casos, no se traduce en efectos clínicos. La disminución máxima media de la tensión arterial sistólica, en posición supina, tras una dosis oral de 100 mg de sildenafilo, fue de 8,4 mmHg y de 5,5 mmHg en la tensión arterial diastólica. Estas disminuciones en la tensión arterial son congruentes con los efectos vasodilatadores de sildenafilo, probablemente debido al aumento en los niveles de GMPc en la musculatura lisa vascular. Dosis únicas orales de sildenafilo de hasta 100 mg en voluntarios sanos no produjeron efectos clínicamente relevantes sobre el ECG.
En un estudio sobre los efectos hemodinámicos de una dosis única de 100 mg de sildenafilo administrada por vía oral a 14 pacientes con enfermedad arterial coronaria grave (EAC) (estenosis >70% de al menos una arteria coronaria), la presión arterial sistólica y diastólica media en reposo disminuyeron alrededor del 7% y 6%, respectivamente, en comparación con los datos basales. La presión arterial sistólica pulmonar media disminuyó un 9%. Sildenafilo no presentó efectos sobre el rendimiento cardíaco, y no afectó al flujo sanguíneo en arterias coronarias estenosadas.
Se demostró que no hubo diferencias clínicamente relevantes en el tiempo necesario para desencadenar la aparición de una angina con el uso de sildenafilo en comparación con placebo en un estudio de prueba de esfuerzo, doble ciego, controlado con placebo, con 144 pacientes con disfunción eréctil y angina estable crónica que estaban tomando su medicación antianginosa habitual (excepto nitratos).
En algunos pacientes, se han detectado diferencias leves y transitorias en la discriminación del color (azul/verde), cuando se utilizó la prueba de tinción Farnsworth-Munsell 100, una hora después de administrar una dosis de 100 mg, sin que se produjeran efectos evidentes a las dos horas de la administración. El mecanismo postulado para este cambio en la discriminación de color se relaciona con la inhibición de la PDE6, que participa en la cascada de la fototransducción de la retina. Sildenafilo no tiene efectos sobre la agudeza visual o sobre la sensibilidad al contraste. En un estudio de pequeño tamaño controlado con placebo en pacientes con degeneración macular temprana documentada (n=9), se demostró que sildenafilo (dosis única, 100 mg) no produjo cambios significativos en las pruebas visuales realizadas (agudeza visual, test de Amsler, discriminación de los colores estimulados por las luces de tráfico, perímetro de Humphrey y fotoestrés).
No hubo ningún efecto sobre la motilidad o la morfología del esperma tras la administración oral de dosis únicas de 100 mg de sildenafilo en voluntarios sanos.
Información adicional sobre ensayos clínicos
En los ensayos clínicos sildenafilo se administró a más de 8.000 pacientes de edades comprendidas entre los 19 y 87 años. Los siguientes grupos de pacientes estuvieron representados: pacientes de edad avanzada (19,9%), pacientes con hipertensión (30,9%), diabetes mellitus (20,3%), enfermedades cardíacas isquémicas (5,8%), hiperlipidemia (19,8%), lesión medular (0,6%), depresión (5,2%), resección transuretral de la próstata (3,7%), prostatectomía radical (3,3%). Los siguientes grupos, no estuvieron bien representados o se excluyeron de los ensayos clínicos: pacientes con cirugía de pelvis, pacientes que han sido sometidos a radioterapia, pacientes con disfunción renal o hepática grave y pacientes con ciertos trastornos cardiovasculares (ver sección 4.3).
En los estudios de dosis fijas, la proporción de pacientes que reconoció que el tratamiento mejoró sus erecciones fue del 62% (25 mg), 74% (50 mg) y 82% (100 mg) en comparación con un 25% con placebo. En ensayos clínicos controlados, la proporción de abandonos atribuibles a sildenafilo fue baja y similar a placebo.
Considerando todos los estudios clínicos, la proporción de pacientes que notificaron mejoría con sildenafilo fue la siguiente: disfunción eréctil psicógena (84%), disfunción eréctil mixta (77%), disfunción eréctil orgánica (68%), pacientes de edad avanzada (67%), diabetes mellitus (59%), enfermedad cardíaca isquémica (69%), hipertensión (68%), resección transuretral de la próstata (RTUP) (61%), prostatectomía radical (43%), lesión medular (83%), depresión (75%). La seguridad y eficacia de sildenafilo se mantuvo en los estudios a largo plazo.
5.2 Propiedades farmacocinéticas
Absorción
Sildenafilo se absorbe rápidamente. Tras la administración oral, en ayunas, se observan concentraciones plasmáticas máximas entre 30 y 120 minutos (mediana de 60 minutos) después de la dosis. La biodisponibilidad oral absoluta media es del 41% (rango del 25 al 63%). Tras la administración oral de sildenafilo el AUC y Cmax aumentaron en proporción a la dosis en el intervalo de dosis recomendado (25100 mg).
Cuando sildenafilo se administra con alimentos, la velocidad de absorción disminuye con un retraso medio en la tmax de 60 minutos y una reducción media en la Cmax del 29%.
Distribución
El valor medio del volumen de distribución medio (Vd) en el estado de equilibrio para sildenafilo es de 105 l, lo que indica una distribución tisular del medicamento. Tras la administración de una dosis única de 100 mg, la media de la concentración plasmática máxima total media de sildenafilo es aproximadamente 440 ng/ml (CV 40%). Dado que sildenafilo (y su metabolito principal circulante N-desmetilo) se encuentra unido a proteínas plasmáticas en un 96%, esto da como resultado una concentración plasmática libre media de sildenafilo de 18 ng/ml (38 nM). La unión a proteínas es independiente de las concentraciones totales de ambos compuestos.
En el eyaculado de voluntarios sanos que recibían sildenafilo (100 mg como dosis única), se detectó menos del 0,0002% (promedio 188 ng) de la dosis administrada, 90 minutos después de la dosificación.
Biotransformación
Sildenafilo se metaboliza predominantemente por las isoenzimas microsomales hepáticas CYP3A4 (principalmente) y CYP2C9 (en menor medida). El metabolito principal circulante resulta de la N-desmetilación de sildenafilo. Este metabolito tiene un perfil de selectividad por las fosfodiesterasas similar a sildenafilo y la potencia in vitro por PDE5 es de aproximadamente el 50% del profármaco. Las concentraciones plasmáticas de este metabolito son aproximadamente el 40% de las observadas para sildenafilo. El metabolito N-desmetilo continúa metabolizándose, con una semivida terminal de aproximadamente 4 horas.
Eliminación
El aclaramiento total de sildenafilo es de 41 l/hora, con una fase terminal resultante en una semivida de 3-5 horas. Tras la administración oral o intravenosa, sildenafilo se excreta en forma de metabolitos principalmente en heces (aproximadamente el 80% de la dosis oral administrada) y en menor medida en orina (aproximadamente el 13% de la dosis oral administrada).
Farmacocinética en grupos especiales de _pacientes Pacientes de edad avanzada
Sildenafilo mostró un aclaramiento reducido en voluntarios sanos de edad avanzada (más de 65 años), siendo las concentraciones plasmáticas de sildenafilo y de su metabolito activo N-desmetilo un 90% más altas que las observadas en voluntarios sanos jóvenes (18-45 años). La concentración de sildenafilo libre en plasma fue aproximadamente 40% mayor, debido al efecto que la diferencia de edad ejerce sobre la unión a las proteínas plasmáticas.
Insuficiencia renal
En voluntarios con insuficiencia renal leve a moderada (aclaramiento de creatinina = 30-80 ml/min), no se alteró la farmacocinética de sildenafilo después de recibir una única dosis oral de 50 mg. El AUC y Cmax medios del metabolito N-desmetilo aumentaron el 126% y el 73% respectivamente, en comparación con voluntarios de la misma edad sin insuficiencia renal. Sin embargo, debido a la elevada variabilidad interindividual, estas diferencias no fueron estadísticamente significativas. En voluntarios con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min), se redujo el aclaramiento de sildenafilo, con un aumento del AUC y Cmax del 100% y del 88% respectivamente, en comparación a los voluntarios de la misma edad sin insuficiencia renal. Además, los valores de AUC y Cmax para el metabolito N-desmetilo aumentaron significativamente, 79% y 200%, respectivamente.
Insuficiencia hepática
En voluntarios con cirrosis hepática de leve a moderada (Child-Pugh A y B), el aclaramiento de sildenafilo se redujo, dando lugar a un aumento del AUC (84%) y de la Cmax (47%) en comparación con voluntarios de la misma edad sin insuficiencia hepática. La farmacocinética de sildenafilo en pacientes con insuficiencia hepática grave no ha sido estudiada.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no revelaron un riesgo especial para los humanos, según los estudios convencionales de farmacología de seguridad, por toxicidad a dosis repetidas, de genotoxicidad, de potencial carcinogénico y de toxicidad sobre la reproducción.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Hidroxipropilcelulosa Glicerol al 85 %
Sucralosa
Sabor a menta (SYM 353592)
Levomentol Cloruro de sodio
Contramarum forte (SYM 225023)
Carmín índigo E 132
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 2 años.
6.4 Precauciones especiales de conservación
Conservar en el embalaje original.
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Cada lámina bucodispersable esta envasada en sobres de PET/ALU/PE.
Se presentan en envases de 1, 2, 4, 8, 10, 12, 16, 20, 24 ó 28 láminas bucodispersables.
Puede que solamente estén comercializados algunos tamaños de envase.
]£
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan esado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz Farmacéutica, S.A.
Centro Empresarial Osa Mayor Avda. Osa Mayor, n° 4 28023 (Aravaca) Madrid España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Agosto 2013
10. FECHA DE LA REVISIÓN DEL TEXTO Abril de 2013.
¡y
taños
14 de 14