Saxenda 6Mg/Ml Solucion Inyectable En Pluma Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Saxenda 6 mg/ml solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un ml de solución contiene 6 mg de liraglutida*. Una pluma precargada contiene 18 mg de liraglutida en 3 ml.
* análogo humano del péptido-1 similar al glucagón (GLP-1) producido por tecnología de ADN recombinante en Saccharomyces cerevisiae.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución transparente, incolora o casi incolora e isotónica; pH=8,15.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Saxenda está indicado, en combinación con una dieta baja en calorías y un aumento de la actividad física, para controlar el peso en pacientes adultos con un índice de masa corporal (IMC) inicial de
• > 30 kg/m2 (obesidad) o
• > 27 kg/m2 a < 30 kg/m2 (sobrepeso) que presentan al menos una comorbilidad relacionada con el peso, como alteraciones de la glucemia (prediabetes o diabetes mellitus tipo 2), hipertensión, dislipidemia o apnea obstructiva del sueño.
El tratamiento con una dosis diaria de 3,0 mg de Saxenda se debe interrumpir si después de 12 semanas los pacientes no han perdido al menos el 5% de su peso corporal inicial.
4.2 Posología y forma de administración
Posología
La dosis inicial es de 0,6 mg al día. La dosis se debe aumentar hasta 3 mg al día en incrementos de 0,6 mg en intervalos de al menos una semana para que mejore la tolerancia gastrointestinal (ver tabla 1). Si el paciente no tolera un aumento de la dosis durante dos semanas consecutivas, se debe considerar interrumpir el tratamiento. No se recomiendan dosis diarias superiores a 3,0 mg.
Tabla 1 Programa de aumento de la dosis
|
Dosis |
Semanas | |
|
Aumento de la dosis 4 semanas |
0,6 mg |
1 |
|
1,2 mg |
1 | |
|
1,8 mg |
1 | |
|
2,4 mg |
1 | |
|
Dosis de mantenimiento |
3,0 mg | |
El efecto del tratamiento se ha documentado solo para 1 año. Cada año se debe volver a evaluar si es necesario continuar con el tratamiento.
Pacientes con diabetes mellitus tipo 2
Saxenda no se debe utilizar en combinación con otro agonista del receptor de GLP-1.
Cuando se inicia el tratamiento con Saxenda, se debe considerar reducir la dosis de insulina o de secretagogos de la insulina (como sulfonilureas) que se administran de forma concomitante para reducir el riesgo de hipoglucemia.
Poblaciones especiales
Pacientes de edad avanzada (>65 años)
No es necesario un ajuste de dosis en función de la edad. La experiencia terapéutica en pacientes de 75 años en adelante es limitada, por lo que no se recomienda su uso en estos pacientes (ver secciones 4.4 y 5.2).
Pacientes con insuficiencia renal
No es necesario un ajuste de dosis en pacientes con insuficiencia renal leve o moderada (aclaramiento de creatinina >30 ml/min). No se recomienda utilizar Saxenda en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min), incluidos los pacientes con enfermedad renal en etapa terminal (ver secciones 4.4, 4.8 y 5.2).
Pacientes con insuficiencia hepática
No se recomienda ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. No se recomienda utilizar Saxenda en pacientes con insuficiencia hepática grave y se debe utilizar con precaución en pacientes con insuficiencia hepática leve o moderada (ver secciones 4.4 y 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de Saxenda en niños y adolescentes menores de 18 años (ver sección 5.1). No se dispone de datos. No se recomienda utilizar este medicamento en pacientes pediátricos.
Forma de administración
Saxenda solo se debe administrar por vía subcutánea. No se debe administrar por vía intravenosa o intramuscular.
Saxenda se administra una vez al día en cualquier momento del día, con independencia de las comidas. Se debe inyectar en el abdomen, en el muslo o en la parte superior del brazo. Tanto el lugar de inyección como el momento de la administración se pueden modificar sin necesidad de ajustar la dosis. Sin embargo, es preferible que Saxenda se inyecte sobre la misma hora del día, una vez se haya elegido el momento más conveniente del día para ello.
Saxenda no se debe mezclar con otros inyectables (como insulinas).
Si el paciente olvida inyectarse una dosis a su hora habitual y han transcurrido menos de 12 horas desde entonces, se debe inyectar la dosis lo antes posible. Si quedan menos de 12 horas para la siguiente dosis, el paciente no se debe inyectar la dosis olvidada y continuará con la dosis diaria habitual, es decir con la siguiente dosis programada. No se debe inyectar una dosis adicional ni aumentar la dosis para compensar la dosis olvidada. Para consultar más instrucciones sobre la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad a liraglutida o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
En pacientes con diabetes mellitus no se debe utilizar liraglutida como sustituto de la insulina.
La experiencia en pacientes con insuficiencia cardiaca congestiva de clase I y II según la New York Heart Association (NYHA) es limitada y, por lo tanto, liraglutida se debe utilizar con precaución. No existe experiencia en pacientes con insuficiencia cardiaca congestiva de clase III y IV según la NYHA y, por lo tanto, liraglutida no se recomienda en estos pacientes.
No se ha establecido la seguridad y eficacia de liraglutida para controlar el peso en pacientes:
- de 75 años de edad en adelante,
- tratados con otros productos para controlar el peso,
- con obesidad debida a trastornos endocrinos o alimenticios o al tratamiento con medicamentos que pueden provocar aumento de peso,
- con insuficiencia renal grave,
- con insuficiencia hepática grave.
No se recomienda el uso en estos pacientes (ver sección 4.2).
Como liraglutida no se ha estudiado para controlar el peso en sujetos con insuficiencia hepática leve o moderada, se debe utilizar con precaución en estos pacientes (ver secciones 4.2 y 5.2)
La experiencia en pacientes con enfermedad inflamatoria intestinal y gastroparesia diabética es limitada. No se recomienda el uso de liraglutida en estos pacientes ya que se asocia a reacciones adversas gastrointestinales transitorias, como náuseas, vómitos y diarrea.
Pancreatitis
El uso de agonistas del receptor de GLP-1 se ha asociado con el riesgo de desarrollar pancreatitis aguda. Se han notificado pocos casos de pancreatitis aguda con liraglutida. Se debe informar a los pacientes de los síntomas característicos de la pancreatitis aguda. Ante la sospecha de pancreatitis, se debe interrumpir el tratamiento con liraglutida, y este no se debe reanudar si se confirma la pancreatitis aguda. Se debe extremar la precaución en pacientes con antecedentes de pancreatitis. Colelitiasis y colecistitis
En ensayos clínicos sobre control del peso, se ha observado una mayor tasa de colelitiasis y colecistitis en los pacientes tratados con liraglutida que en los pacientes tratados con placebo. El hecho de que la pérdida importante de peso puede aumentar el riesgo de colelitiasis y, por consiguiente de colecistitis, solo explicó parcialmente la mayor tasa con liraglutida. La colelitiasis y la colecistitis pueden requerir hospitalización y colecistectomía. Se debe informar a los pacientes de los síntomas característicos de la colelitiasis y la colecistitis.
Enfermedad tiroidea
En ensayos clínicos llevados a cabo en pacientes con diabetes tipo 2, se han notificado acontecimientos adversos tiroideos, que incluyen aumento de calcitonina en sangre, bocio y neoplasia tiroidea, especialmente en pacientes con enfermedad tiroidea preexistente. En los ensayos clínicos de control del peso también se han observado casos de aumento de calcitonina en sangre. Por tanto, liraglutida se debe utilizar con precaución en pacientes con enfermedad tiroidea.
Frecuencia cardiaca
En ensayos clínicos se ha observado que liraglutida produce un aumento de la frecuencia cardiaca (ver sección 5.1). No está clara la importancia clínica del aumento de la frecuencia cardiaca con el tratamiento de liraglutida, especialmente en pacientes con cardiopatía o enfermedad cerebrovascular, como resultado de la exposición limitada de estos pacientes en los ensayos clínicos. La frecuencia cardiaca se debe controlar de forma periódica de acuerdo con la práctica clínica habitual. Se debe informar a los pacientes de los síntomas del aumento de la frecuencia cardiaca (palpitaciones o sensación de aceleración del pulso en reposo). El tratamiento con liraglutida se debe interrumpir en pacientes que experimenten un incremento sostenido clínicamente significativo de la frecuencia cardiaca en reposo.
Deshidratación
Se han notificado signos y síntomas de deshidratación que incluyen insuficiencia renal y fallo renal agudo en pacientes en tratamiento con agonistas del receptor de GLP-1. Se debe advertir a los pacientes en tratamiento con liraglutida de que existe un riesgo potencial de deshidratación relacionado con los efectos adversos gastrointestinales y de que tomen precauciones para evitar la pérdida de líquidos.
Hipoglucemia en pacientes con diabetes mellitus tipo 2
Los pacientes con diabetes mellitus tipo 2 a los que se les administra liraglutida en combinación con una sulfonilurea podrían presentar un riesgo mayor de hipoglucemia. Es posible disminuir el riesgo de hipoglucemia reduciendo la dosis de sulfonilurea. No se ha estudiado la adición de Saxenda en pacientes tratados con insulina.
Excipientes
Saxenda contiene menos de 1 mmol de sodio (23 mg) por dosis, por lo que se considera esencialmente exento de sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
In vitro, liraglutida ha demostrado un potencial muy bajo de estar implicada en interacciones farmacocinéticas con otras sustancias activas relacionadas con el citocromo P450 (CYP) y la unión a proteínas plasmáticas.
El leve retraso en el vaciamiento gástrico asociado a liraglutida puede influir en la absorción de medicamentos orales administrados de forma concomitante. Los estudios de interacción no han demostrado ningún retraso clínicamente significativo en la absorción y, por lo tanto, no se requiere ajuste de dosis.
Se han realizado estudios de interacciones con 1,8 mg de liraglutida. El efecto sobre la tasa de vaciamiento gástrico fue equivalente para 1,8 mg y 3 mg de liraglutida, (AUC0-300 min de paracetamol). Pocos pacientes tratados con liraglutida notificaron al menos un episodio de diarrea grave. La diarrea puede influir en la absorción de medicamentos de administración oral concomitante.
Warfarina y otros derivados de la cumarina
No se han realizado estudios de interacciones. No se puede excluir una interacción clínicamente significativa con principios activos con escasa solubilidad o índice terapéutico estrecho, tales como la warfarina. Al inicio del tratamiento con liraglutida en pacientes tratados con warfarina u otros derivados de la cumarina, se recomienda un control de la Razón Internacional Normalizada (INR) más frecuente.
Paracetamol (Acetaminofeno)
Liraglutida no modificó la exposición total del paracetamol tras la administración de una dosis única de 1.000 mg. Se produjo una disminución del 31% en la Cmax de paracetamol y un retraso en el Cax medio de hasta 15 min. No es necesario un ajuste de dosis en el uso concomitante de paracetamol.
Atorvastatina
Liraglutida no modificó la exposición total de atorvastatina tras la administración de una dosis única de 40 mg de atorvastatina. Por lo tanto, no es necesario un ajuste de dosis de atorvastatina cuando se administra con liraglutida. Se produjo una disminución del 38% en la Cmax de atorvastatina y el tmax medio se retrasó de 1 a 3 horas con liraglutida.
Griseofulvina
Liraglutida no modificó la exposición total de griseofulvina tras la administración de una dosis única de 500 mg de griseofulvina. Se produjo un aumento del 37% en la Cmax de griseofulvina y el tmax medio permaneció inalterado. No es necesario un ajuste de dosis de griseofulvina y otros componentes de baja solubilidad y alta permeabilidad.
Digoxina
La administración de una única dosis de 1 mg de digoxina con liraglutida produjo una reducción en la AUC de digoxina de un 16%; la Cmax disminuyó un 31%. Se produjo un retraso en el tmax medio de la digoxina de 1 a 1,5 horas. No es necesario un ajuste de dosis de digoxina en base a estos resultados.
Lisinopril
La administración de una única dosis de 20 mg de lisinopril con liraglutida mostró una reducción en la AUC de lisinopril de un 15%; la Cmax disminuyó un 27%. Se produjo un retraso en el tmax medio del lisinopril que pasó de 6 a 8 horas con liraglutida. No es necesario un ajuste de dosis de lisinopril en base a estos resultados.
Anticonceptivos orales
Tras la administración de una única dosis de un medicamento anticonceptivo oral, liraglutida disminuyó la Cmax de etinilestradiol y levonorgestrel un 12% y un 13% respectivamente. Se produjo un retraso en el Cax de alrededor de 1,5 horas con liraglutida para ambos compuestos. No se observó ningún efecto clínicamente significativo sobre la exposición total ni al etinilestradiol ni al levonorgestrel. Se prevé, por lo tanto, que el efecto anticonceptivo permanezca inalterado cuando se administran de forma conjunta con liraglutida.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Los datos que existen sobre la utilización de liraglutida en mujeres embarazadas son limitados. Los estudios en animales han mostrado toxicidad para la reproducción (ver sección 5.3). Se desconoce el riesgo en seres humanos.
No se debe administrar liraglutida durante el embarazo. Se debe interrumpir el tratamiento con liraglutida en caso de que una paciente desee quedarse embarazada o si se produce un embarazo.
Lactancia
Se desconoce si liraglutida se excreta en la leche materna. Estudios realizados en animales han mostrado que la transferencia a la leche de liraglutida y metabolitos de estrecha relación estructural es baja. Estudios no clínicos han mostrado una reducción en el crecimiento neonatal relacionada con el tratamiento en crías de rata en periodo de lactancia (ver sección 5.3). Dada la falta de experiencia, no se debe usar Saxenda durante el periodo de lactancia.
Fertilidad
Los estudios en animales no han revelado efectos nocivos relacionados con la fertilidad, aparte de una ligera disminución en el número de implantes vivos (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Saxenda sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas Resumen del perfil de seguridad:
El programa de desarrollo clínico de Saxenda consta de 6 ensayos clínicos completos en los que han participado 5.813 pacientes obesos o pacientes con sobrepeso con al menos una comorbilidad relacionada con el peso. En general, las reacciones gastrointestinales fueron las reacciones adversas notificadas más frecuentemente durante el tratamiento con Saxenda (ver sección “Descripción de las reacciones adversas seleccionadas”).
Tabla de reacciones adversas
En la Tabla 2 se presentan las reacciones adversas notificadas en ensayos de fase 3 controlados a largo plazo. Las reacciones adversas figuran en la lista según el sistema de clasificación de órganos y la frecuencia. Las categorías de frecuencia se definen del siguiente modo: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000). Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 2 Reacciones adversas notificadas en estudios controlados de fase 3
|
Sistema de clasificación de órganos MedDRA |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
|
Trastornos del sistema inmunológico |
Reacción anafiláctica | |||
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia* |
Deshidratación | ||
|
Trastornos psiquiátricos |
Insomnio** | |||
|
Trastornos del sistema nervioso |
Mareo Disgeusia | |||
|
Trastornos cardiacos |
Taquicardia | |||
|
Trastornos gastrointestinales |
Náuseas Vómitos Diarrea Estreñimiento |
Sequedad de boca Dispepsia Gastritis Enfermedad de reflujo gastroesofágico Dolor abdominal superior Flatulencia Eructos Distensión abdominal |
Pancreatitis*** | |
|
Trastornos hepatobiliares |
Colelitiasis*** |
Colecistitis*** | ||
|
Trastornos de la piel y del tejido subcutáneo |
Urticaria | |||
|
Trastornos renales y urinarios |
Fallo renal agudo Insuficiencia renal | |||
|
Trastornos generales y alteraciones en el lugar de administración |
Reacciones en el lugar de inyección Astenia Fatiga |
Malestar | ||
|
Exploraciones complementarias |
Aumento de lipasa Aumento de amilasa |
*Se notificaron casos de hipoglucemia (según los síntomas indicados por los pacientes y no confirmados mediante mediciones de glucosa en sangre) en pacientes sin diabetes mellitus tipo 2 en tratamiento con Saxenda en combinación con dieta y ejercicio. Para obtener más información, ver sección “Descripción de las reacciones adversas seleccionadas”.
**El insomnio se produjo principalmente durante los 3 primeros meses de tratamiento.
***Ver sección 4.4.
Descripción de las reacciones adversas seleccionadas:
Hipoglucemia en _pacientes sin diabetes mellitus tipo 2
En ensayos clínicos realizados en pacientes obesos o con sobrepeso sin diabetes mellitus tipo 2 en tratamiento con Saxenda en combinación con dieta y ejercicio, no se notificaron episodios hipoglucémicos graves (que requiriesen la asistencia de terceras personas). El 1,6% de los pacientes tratados con Saxenda y el 1,1% de los pacientes tratados con placebo notificaron que presentaron síntomas de episodios hipoglucémicos; sin embargo, estos episodios no se confirmaron mediante mediciones de glucosa en sangre. La mayoría de los episodios fueron leves.
Hipoglucemia en _pacientes con diabetes mellitus tipo 2
En un ensayo clínico realizado en pacientes obesos o con sobrepeso con diabetes mellitus tipo 2 en tratamiento con Saxenda en combinación con dieta y ejercicio, se notificó hipoglucemia grave (que requirió la asistencia de terceras personas) en el 0,7% de los pacientes tratados con Saxenda y solo en pacientes tratados de forma concomitante con sulfonilurea. Además, se documentaron casos de hipoglucemia sintomática en el 43,6% de los pacientes tratados con Saxenda y en el 27,3% de los pacientes tratados con placebo. Entre los pacientes que no se trataron con sulfonilurea de forma concomitante, se documentaron episodios de hipoglucemia sintomática (definidos como glucosa en plasma <3,9 mmol/l acompañados de síntomas) en el 15,7% de los pacientes tratados con Saxenda y el 7,6% de los pacientes tratados con placebo.
Reacciones adversas gastrointestinales
La mayoría de los episodios gastrointestinales fueron de leves a moderados, transitorios y no conllevaron la interrupción del tratamiento. Las reacciones generalmente sucedieron durante las primeras semanas y disminuyeron una vez transcurridos algunos días o semanas de tratamiento continuado.
Los pacientes de 65 años de edad en adelante pueden experimentar más efectos gastrointestinales al ser tratados con Saxenda.
Los pacientes con insuficiencia renal leve o moderada (aclaramiento de creatinina >30 ml/min) pueden experimentar más efectos gastrointestinales al ser tratados con Saxenda.
Fallo renal agudo
En pacientes tratados con agonistas del receptor de GLP-1 se han notificado casos de fallo renal agudo. La mayoría de los casos notificados se produjeron en pacientes que habían experimentado náuseas, vómitos o diarrea con la consiguiente disminución del volumen (ver sección 4.4).
Reacciones alérgicas
Durante la comercialización de liraglutida, se han notificado pocos casos de reacciones anafilácticas con síntomas tales como hipotensión, palpitaciones, disnea y edema. Las reacciones anafilácticas pueden ser potencialmente mortales. Ante la sospecha de una reacción anafiláctica, se debe interrumpir el tratamiento con liraglutida y este no se debe reanudar (ver sección 4.3).
Reacciones en el lugar de inyección
En pacientes tratados con Saxenda se han notificado reacciones en el lugar de inyección. Estas reacciones fueron por lo general leves y transitorias y la mayoría desaparecieron durante el tratamiento continuado.
Taquicardia
En ensayos clínicos se notificó taquicardia en el 0,6% de los pacientes tratados con Saxenda y en el 0,1% de los pacientes tratados con placebo. La mayoría de los episodios fueron leves o moderados. Se trató de episodios aislados que en su mayoría se resolvieron durante el tratamiento continuado con Saxenda.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Durante los ensayos clínicos y el uso de liraglutida tras su comercialización, se han notificado casos de sobredosis de hasta 72 mg (24 veces la dosis recomendada para controlar el peso). Los casos notificados incluyeron náuseas y vómitos intensos, que son también los síntomas esperados de una sobredosis con liraglutida. Ninguna de las notificaciones incluyó hipoglucemia grave. Todos los pacientes se recuperaron sin complicaciones.
En caso de sobredosis, se debe iniciar el tratamiento de soporte adecuado en función de los síntomas y signos clínicos del paciente. Se debe observar al paciente para detectar signos clínicos de deshidratación y se deben controlar sus niveles de glucosa en sangre.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos utilizados en la diabetes, otros fármacos hipoglucemiantes, excluyendo las insulinas. Código ATC: A10BX07
Mecanismo de acción
Liraglutida es un análogo acilado humano del péptido-1 similar al glucagón (GLP-1) con un 97% de homología de secuencia de aminoácidos con el GLP-1 humano endógeno. Liraglutida se une al receptor de GLP-1 (GLP-1R) y lo activa.
El GLP-1 es un regulador fisiológico del apetito y de la ingesta de alimentos, pero el mecanismo exacto de acción no está completamente claro. En estudios llevados a cabo con animales, la administración periférica de liraglutida supuso la absorción en regiones específicas del cerebro implicadas en la regulación del apetito, donde liraglutida, a través de la activación específica de GLP-1R, aumentó las señales de saciedad básicas y redujo las señales de hambre básicas que permitieron perder peso.
Efectos farmacodinámicos
Liraglutida contribuye a reducir el peso corporal en humanos principalmente a través de la pérdida de materia grasa con reducciones relativas de grasa visceral que son mayores que la pérdida de grasa subcutánea. Liraglutida regula el apetito porque aumenta la sensación de plenitud y saciedad, a la vez que reduce la sensación de hambre y el posible consumo de alimentos, lo que conduce a una reducción en la ingesta de alimentos. En comparación con el placebo, liraglutida no incrementa el gasto de energía.
Liraglutida estimula la secreción de insulina y disminuye la secreción de glucagón de un modo dependiente de la glucosa, lo que reduce la glucosa en ayunas y posprandial. El efecto hipoglucemiante es mayor en pacientes con prediabetes y diabetes que en los pacientes con normoglucemia. Los ensayos clínicos sugieren que liraglutida mejora y mantiene la función de las células beta según HOMA-B y la relación proinsulina/insulina.
Eficacia clínica y seguridad
La eficacia y seguridad de liraglutida para controlar el peso en combinación con una menor ingesta de calorías y un aumento de la actividad física se evaluó en 4 ensayos aleatorizados de fase 3, doble ciegos y controlados por placebo en los que participaron un total de 5.358 pacientes.
• Ensayo 1 (SCALE Obesity & Pre-Diabetes - 1839): Ensayo de 56 semanas de duración en el que se evaluó la pérdida de peso corporal en 3.731 pacientes aleatorizados (de los cuales 2.590
completaron el ensayo) con obesidad y con sobrepeso con una de las siguientes patologías: prediabetes, hipertensión o dislipidemia. El 61% de los pacientes tenía prediabetes al inicio.
• Ensayo 2 (SCALE Diabetes - 1922): Ensayo de 56 semanas de duración en el que se evaluó la pérdida de peso corporal en 846 pacientes aleatorizados (de los cuales 628 completaron el ensayo) con obesidad y sobrepeso, además de diabetes mellitus tipo 2 insuficientemente controlada (rango de HbA1c 7-10%). El tratamiento al comienzo del ensayo consistía en dieta y ejercicio solamente o en metformina, una sulfonilurea o una glitazona en monoterapia, o una combinación de estos.
• Ensayo 3 (SCALE Sleep Apnoea - 3970): Ensayo de 32 semanas de duración en el que se evaluó la gravedad de la apnea del sueño y la pérdida de peso corporal en 359 pacientes aleatorizados (de los cuales 276 completaron el ensayo) con obesidad y apnea del sueño obstructiva moderada o grave.
• Ensayo 4 (SCALE Maintenance - 1923): Ensayo de 56 semanas de duración en el que se evaluó el mantenimiento y la pérdida de peso corporal en 422 pacientes aleatorizados (de los cuales 305 completaron el ensayo) con obesidad y sobrepeso, además de hipertensión o dislipidemia tras experimentar una pérdida de peso anterior del >5% a causa de una dieta baja en calorías.
Peso corporal
Se alcanzó una mayor pérdida de peso con liraglutida que con placebo en pacientes obesos o con sobrepeso en todos los grupos estudiados. En todas las poblaciones del ensayo, fue mayor el porcentaje de pacientes que experimentaron una pérdida de peso >5% y >10% con liraglutida en comparación con placebo (tablas 3-5). En el ensayo 4, fue mayor el número de pacientes que mantuvieron la pérdida de peso alcanzada con anterioridad al inicio del tratamiento con liraglutida que con placebo (81,4% y 48,9%, respectivamente). Los datos específicos sobre la pérdida de peso, los pacientes que respondieron al tratamiento, la evolución temporal y la distribución acumulada del cambio de peso (en %) correspondientes a los ensayos 1-4 aparecen en las tablas 3-6 y en las figuras 1, 2, y 3.
Pérdida de _peso después de 12 semanas de tratamiento con liraglutida (3,0 mg)
Los pacientes con respuesta inicial rápida se definieron como los pacientes en los que se produjo una pérdida de peso >5% tras 12 semanas con la dosis de tratamiento de liraglutida (4 semanas de aumento de dosis y 12 semanas con la dosis de tratamiento). En el ensayo 1, el 67,5% de los pacientes lograron una pérdida de peso >5% después de 12 semanas. En el ensayo 2, el 50,4% de los pacientes lograron una pérdida de peso >5% después de 12 semanas. Si se continúa el tratamiento con liraglutida, se prevé que el 86,2% de los pacientes con respuesta inicial rápida alcancen una pérdida de peso >5% y que el 51% alcance una pérdida de peso >10% después de 1 año de tratamiento. Se prevé que los pacientes con respuesta inicial rápida que completen 1 año de tratamiento pierdan una media del 11,2% de su peso corporal inicial (9,7% en hombres y 11,6% en mujeres). Para los pacientes que presentan una pérdida de peso <5% tras 12 semanas con la dosis de tratamiento de liraglutida, la proporción de pacientes que no consiguen experimentar una pérdida de peso >10% tras 1 año es del 93,4%.
Control glucémico
El tratamiento con liraglutida mejora de forma significativa los parámetros glucémicos en subpoblaciones con normoglucemia, prediabetes y diabetes mellitus tipo 2. En el ensayo 1, desarrollaron menos diabetes mellitus tipo 2 los pacientes tratados con liraglutida que los tratados con placebo (0,2% frente a 1,1%). En comparación con los pacientes tratados con placebo, la prediabetes inicial desapareció en más pacientes (69,2% frente a 32,7%).
Factores de riesgo cardiometabólicos
El tratamiento con liraglutida mejoró de forma significativa la presión arterial sistólica y la circunferencia de la cintura en comparación con placebo (tablas 3 y 4).
Índice de Apnea-Hipopnea (IAH)
El tratamiento con liraglutida reduce de manera significativa la gravedad de la apnea obstructiva del sueño como indica el cambio con respecto al nivel basal del IAH frente a placebo (tabla 5).
Tabla 3 Ensayo 1: Cambios en peso corporal, glucemia y parámetros cardiometabólicos en la semana 56 respecto a los valores iniciales_
|
Saxenda (N=2437) |
Placebo (N=1225) |
Saxenda frente a placebo | |
|
Peso corporal | |||
|
Valor inicial, kg (DS) |
106,3 (21,2) |
106,3 (21,7) |
- |
|
Cambio medio en la semana 56, % (IC 95%) |
-8,0 |
-2,6 |
-5,4** (-5,8; -5,0) |
|
Cambio medio en la semana 56, kg (IC 95%) |
-8,4 |
-2,8 |
-5,6** (-6,0; -5,1) |
|
Proporción de pacientes que pierden >5% de peso corporal en la semana 56, % (IC 95%) |
63,5 |
26,6 |
4,8** (4,1; 5,6) |
|
Proporción de pacientes que pierden >10% de peso corporal en la semana 56, % (IC 95%) |
32,8 |
10,1 |
4,3** (3,5; 5,3) |
|
Glucemia y factores cardiometabólicos |
Valor Cambio inicial |
Valor Cambio inicial | |
|
HbAlc, % |
5,6 -0,3 |
5,6 -0,1 |
-0,23** (-0,25; -0,21) |
|
GPA, mmol/l |
5,3 -0,4 |
5,3 -0,01 |
-0,38** (-0,42; -0,35) |
|
Presión arterial sistólica, mmHg |
123,0 -4,3 |
123,3 -1,5 |
-2,8** (-3,6; -2,1) |
|
Presión arterial diastólica, mmHg |
78,7 -2,7 |
78,9 -1,8 |
-0,9* (-1,4; -0,4) |
|
Circunferencia de la cintura, cm |
115,0 -8,2 |
114,5 -4,0 |
-4,2** (-4,7; -3,7) |
Grupo completo de análisis. En lo que se refiere al peso corporal, HbAic, GPA, presión arterial y circunferencia de la cintura, los valores iniciales son medias, los cambios con respecto a estos valores iniciales en la semana 56 son medias estimadas (mínimos cuadrados) y los contrastes de tratamiento en la semana 56 son diferencias estimadas de tratamiento. Se presentan índices de probabilidad estimados para la proporción de pacientes que pierden >5/>10% de peso corporal. Los valores postratamiento que faltan se introdujeron utilizando la última observación considerada.
* p<0,05. ** p<0,0001. IC=intervalos de confianza. GPA=glucosa plasmática en ayunas. DS=desviación estándar.
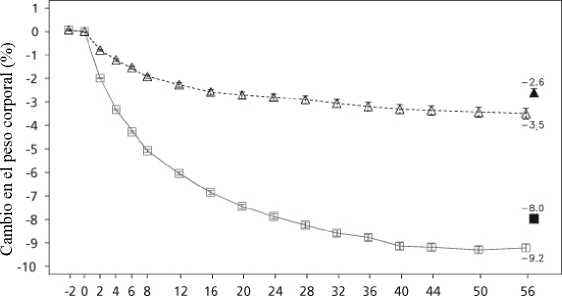
Tiempo en semanas
¡ ¡ Saxenda ¿ Placebo ■ a Última observación considerada (LOCF)
Valores observados para pacientes que completan cada visita programada
Figura 1 Cambio en el peso corporal inicial (%) con el tiempo en el ensayo 1
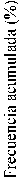
|
J'r y' / | ||||||||||||
|
f |
/ t ! | |||||||||||
|
> | ||||||||||||
|
f | ||||||||||||
|
i | ||||||||||||
|
i |
j | |||||||||||
|
/ | ||||||||||||
|
/ |
f f | |||||||||||
|
: l il i |
-45 -40 -35 -30 -25 -20 -15 -10 ™5 0 5
Cambio en el peso corporal (%) Saxenda — Placebo Última observación considerada
10 15 20
Figura 2 Distribución acumulada del cambio de peso (%) tras 56 semanas de tratamiento en el ensayo 1
Tabla 4 Ensayo 2: Cambios en peso corporal, glucemia y parámetros cardiometabólicos en la semana 56 respecto a los valores iniciales_
Saxenda (N=412) Placebo (N=211) Saxenda frente a
placebo
Peso corporal
|
Valor inicial, kg (DS) |
105,6 (21,9) |
106,7 (21,2) |
- | ||
|
Cambio medio en la semana 56, % (IC 95%) |
-5,9 |
-2,0 |
-4,0** (-4,8; -3,1) | ||
|
Cambio medio en la semana 56, kg (IC 95%) |
-6,2 |
-2,2 |
-4,1** (-5,0; -3,1) | ||
|
Proporción de pacientes que pierden >5% de peso corporal en la semana 56, % (IC 95%) |
49,8 |
13,5 |
6,4** (4,1; 10,0) | ||
|
Proporción de pacientes que pierden >10% de peso corporal en la semana 56, % (IC 95%) |
22,9 |
4,2 |
6,8** (3,4; 13,8) | ||
|
Glucemia y factores cardiometabólicos |
Valor inicial |
Cambio |
Valor inicial |
Cambio | |
|
HbA1c, % |
7,9 |
-1,3 |
7,9 |
-0,4 |
-0,9** (-1,1; -0,8) |
|
GPA, mmol/l |
8,8 |
-1,9 |
8,6 |
-0,1 |
-1,8** (-2,1; -1,4) |
|
Presión arterial sistólica, mmHg |
128,9 |
-3,0 |
129,2 |
-0,4 |
-2,6* (-4,6; -0,6) |
|
Presión arterial diastólica, mmHg |
79,0 |
-1,0 |
79,3 |
-0,6 |
-0,4 (-1,7; 1,0) |
|
Circunferencia de la cintura, cm |
118,1 |
-6,0 |
117,3 |
-2,8 |
-3,2** (-4,2; -2,2) |
|
Grupo completo de análisis. En lo que se refiere al peso corporal, HbAic, GPA, presión arterial y circunferencia de la cintura, los valores iniciales son medias, los cambios con respecto a estos valores iniciales en la semana 56 | |||||
son medias estimadas (mínimos cuadrados) y los contrastes de tratamiento en la semana 56 son diferencias estimadas de tratamiento. Se presentan índices de probabilidad estimados para la proporción de pacientes que pierden >5/>10% de peso corporal. Los valores postratamiento que faltan se introdujeron utilizando la última observación considerada.
* p<0,05. ** p<0,0001. IC=intervalos de confianza. GPA=glucosa plasmática en ayunas. DS=desviación estándar.
Tabla 5 Ensayo 3: Cambios en peso corporal y en el Índice de Apnea-Hipopnea (IAH) en la semana 32 respecto a los valores iniciales
Saxenda (N=180) Placebo (N=179) Saxenda frente a
placebo
Peso corporal
|
Valor inicial, kg (DS) |
116,5 (23,0) |
118,7 (25,4) |
- |
|
Cambio medio en la semana 32, % (IC 95%) |
-5,7 |
-1,6 |
-4,2** (-5,2; -3,1) |
|
Cambio medio en la semana 32, kg (IC 95%) |
-6,8 |
-1,8 |
-4,9** (-6,2; -3,7) |
|
Proporción de pacientes que pierden >5% de peso corporal en la semana 32, % (IC 95%) |
46,4 |
18,1 |
3,9** (2,4; 6,4) |
|
Proporción de pacientes que pierden >10% de peso corporal en la semana 32, % (IC 95%) |
22,4 |
1,5 |
19,0** (5,7; 63,1) |
|
Valor Cambio inicial |
Valor Cambio inicial | ||
|
Índice de Apnea-Hipopnea (IAH), episodios/hora |
49,0 -12,2 |
49,3 -6,1 |
-6,1* (-11,0; -1,2) |
Grupo completo de análisis. Los valores iniciales son medias, los cambios con respecto a estos valores iniciales en la semana 32 son medias estimadas (mínimos cuadrados) y los contrastes de tratamiento en la semana 32 son diferencias estimadas de tratamiento (IC 95%). Se presentan índices de probabilidad estimados para la
proporción de pacientes que pierden >5/>10% de peso corporal. Los valores postratamiento que faltan se introdujeron utilizando la última observación considerada. * p<0,05. ** p<0,0001. IC=intervalos de confianza. DS=desviación estándar.
Tabla 6 Ensayo 4: Cambios en peso corporal en la semana 56 respecto al valor inicial_
|
Saxenda |
Placebo |
Saxenda frente a | |
|
(N=207) |
(N=206) |
placebo | |
|
Valor inicial, kg (DS) |
100,7 (20,8) |
98,9 (21,2) |
- |
|
Cambio medio en la semana 56, % (IC 95%) |
-6,3 |
-0,2 |
-6,1** (-7,5; -4,6) |
|
Cambio medio en la semana 56, kg (IC 95%) |
-6,0 |
-0,2 |
-5,9** (-7,3; -4,4) |
|
Proporción de pacientes que pierden >5% de peso corporal en la semana 56, % (IC 95%) |
50,7 |
21,3 |
3,8** (2,4; 6,0) |
|
Proporción de pacientes que pierden >10% de peso corporal en la semana 56, % (IC 95%) |
27,4 |
6,8 |
5,1** (2,7; 9,7) |
Grupo completo de análisis. Los valores iniciales son medias, los cambios con respecto a estos valores iniciales en la semana 56 son medias estimadas (mínimos cuadrados) y los contrastes de tratamiento en la semana 56 son diferencias estimadas de tratamiento. Se presentan índices de probabilidad estimados para la proporción de pacientes que pierden >5/>10% de peso corporal. Los valores postratamiento que faltan se introdujeron utilizando la última observación considerada. ** p<0,0001. IC=intervalos de confianza. DS=desviación estándar.
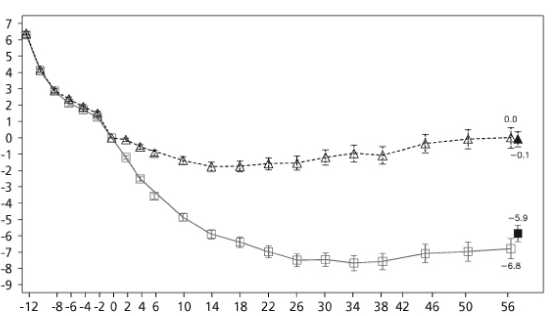
Tiempo en semanas
B Saxenda A Placebo ■ a Última observación considerada (LOCF) Valores observados para pacientes que completan cada visita programada
Figura 3 Cambio en el peso corporal (%) con el tiempo desde la aleatorización (semana 0) para el ensayo 4
Antes de la semana 0, el tratamiento de los pacientes consistía exclusivamente en una dieta baja en calorías y ejercicio. En la semana 0 los pacientes fueron aleatorizados para recibir Saxenda o placebo.
Inmunogenicidad
De acuerdo con las propiedades potencialmente inmunogénicas de los fármacos que contienen proteínas o péptidos, los pacientes pueden desarrollar anticuerpos antiliraglutida tras el tratamiento con liraglutida. En los ensayos clínicos, el 2,5% de los pacientes tratados con liraglutida desarrolló anticuerpos antiliraglutida. La formación de anticuerpos no se ha asociado con una reducción en la eficacia de liraglutida.
Evaluación cardiovascular
Un grupo de expertos independiente y externo se encargó de valorar los acontecimientos adversos cardiovasculares graves (MACE) y los definió como infarto de miocardio no mortal, accidente cerebrovascular no mortal y muerte cardiovascular. En todos los ensayos clínicos a largo plazo realizados con Saxenda, se produjeron 6 MACE en pacientes tratados con liraglutida y 10 MACE en pacientes que recibieron placebo. La razón de riesgo y el IC 95% es 0,33 [0,12; 0,90] para liraglutida en comparación con placebo. En los ensayos clínicos de fase 3 se ha observado que liraglutida produce un aumento medio de la frecuencia cardiaca desde el valor inicial de 2,5 latidos por minuto (el valor varía entre los ensayos de 1,6 a 3,6 latidos por minuto). La frecuencia cardiaca alcanzó su valor máximo después de 6 semanas aproximadamente. No se ha determinado el impacto clínico a largo plazo de este aumento medio de la frecuencia cardiaca. Este cambio en la frecuencia cardiaca fue reversible tras la interrupción del tratamiento con liraglutida (ver sección 4.4).
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Saxenda en uno o más grupos de la población pediátrica para el tratamiento de la obesidad y del síndrome de Prader-Willi (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
La absorción de liraglutida tras la administración por vía subcutánea fue lenta, alcanzando su concentración máxima aproximadamente a las 11 horas tras su administración. La media de la concentración en estado estacionario de liraglutida (AUCt/24) alcanzó aproximadamente los 31 nmol/l en pacientes obesos (IMC 30-40 kg/m2) tras la administración de 3 mg de liraglutida. La exposición a liraglutida aumentó proporcionalmente con la dosis. La biodisponibilidad absoluta de liraglutida tras su administración por vía subcutánea es de aproximadamente un 55%.
Distribución
El volumen de distribución aparente medio tras la administración subcutánea es de 20-25 l (para una persona que pesa unos 100 kg). Liraglutida se encuentra ampliamente ligada a proteínas plasmáticas (>98%).
Biotransformación
Durante 24 horas tras la administración de una única dosis de [3H]-liraglutida a sujetos sanos, el componente mayoritario en plasma fue liraglutida intacta. Se detectaron dos metabolitos minoritarios en el plasma (<9% y <5% de la exposición a radioactividad plasmática total).
Eliminación
Liraglutida se metaboliza endógenamente de un modo similar al de las grandes proteínas sin un órgano específico como ruta principal de eliminación. Tras una dosis de [3H]-liraglutida, no se detectó liraglutida intacta en orina o heces. Únicamente una proporción menor de la radioactividad administrada se excretó en forma de metabolitos relacionados con liraglutida a través de orina o heces (6% y 5% respectivamente). La radiactividad en orina y heces se excretó principalmente durante los primeros 6-8 días y correspondió a tres metabolitos minoritarios respectivamente.
El aclaramiento medio tras la administración por vía subcutánea de liraglutida es de aproximadamente 0,9-1,4 l/h con una vida media de eliminación de aproximadamente 13 horas.
Poblaciones especiales
Pacientes de edad avanzada
La edad no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de liraglutida según los resultados de un análisis de datos farmacocinético de la población de pacientes obesos y con sobrepeso (entre 18 y 82 años). No es necesario un ajuste de dosis en función de la edad.
Sexo
Según los resultados de los análisis farmacocinéticos de la población, las mujeres tienen un aclaramiento de liraglutida ajustado al peso que es inferior en un 24% al de los hombres. Según los datos de respuesta a la exposición, no es necesario un ajuste de dosis en función del sexo del paciente.
Origen étnico
El origen étnico no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de liraglutida según los resultados del análisis farmacocinético de la población en el que se incluyeron pacientes obesos y con sobrepeso de grupos de población blanca, negra, asiática, hispanoamericana y no hispanoamericana.
Peso corporal
La exposición a liraglutida disminuye con un aumento del peso corporal inicial. La dosis diaria de 3 mg de liraglutida proporcionó exposiciones sistémicas adecuadas sobre el rango de pesos de 60 a 234 kg cuya respuesta a la exposición se evaluó en los ensayos clínicos. No se estudió la exposición a liraglutida en pacientes con un peso corporal superior a los 234 kg.
Insuficiencia hepática
Se evaluó la farmacocinética de liraglutida en pacientes con diversos grados de insuficiencia hepática en un ensayo de dosis única (0,75 mg). La exposición a liraglutida disminuyó un 13-23% en pacientes con insuficiencia hepática de leve a moderada en comparación con los sujetos sanos. La exposición fue significativamente menor (44%) en pacientes con insuficiencia hepática grave (puntuación Child Pugh >9).
Insuficiencia renal
La exposición a liraglutida disminuyó en pacientes con insuficiencia renal en comparación con los individuos con una función renal normal en un ensayo de dosis única (0,75 mg). La exposición a liraglutida disminuyó un 33%, un 14%, un 27% y un 26%, respectivamente, en pacientes con insuficiencia renal leve (aclaramiento de creatinina, CrCl 50-80 ml/min), moderada (CrCl 3050 ml/min) y grave (CrCl <30 ml/min) y con enfermedad renal en etapa terminal con necesidad de diálisis.
Población _ pediátrica
No se ha estudiado el tratamiento con Saxenda en pacientes pediátricos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas o genotoxicidad.
Se observaron tumores no letales en células C de tiroides en estudios de carcinogenicidad de dos años de duración en ratas y ratones. En ratas no se ha observado el nivel sin efecto adverso observado (NOAEL). Estos tumores no se observaron en monos tratados durante 20 meses. Estos hallazgos en roedores están provocados por un mecanismo específico no genotóxico mediado por el receptor GLP-1 al que los roedores son especialmente sensibles. La relevancia en humanos es probablemente baja pero no se puede excluir completamente. No se ha detectado ningún otro tumor relacionado con el tratamiento.
Los estudios en animales no sugieren efectos perjudiciales directos en términos de fertilidad, pero sí un leve aumento de las muertes embrionarias tempranas a la dosis más alta. La administración de liraglutida durante el periodo intermedio de gestación provocó una reducción en el peso de la madre y en el crecimiento del feto con efectos no claros sobre las costillas en ratas y en la variación esquelética en el conejo. El crecimiento neonatal se redujo en el caso de las ratas durante su exposición a liraglutida y continuó durante el periodo de destete en el grupo de dosis elevada. Se desconoce si la disminución en el crecimiento de las crías se debe a una reducción en la ingesta de leche debido a un efecto directo del GLP-1 o a una reducción de la producción de leche materna a causa de una disminución de la ingesta calórica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Fosfato disódico dihidrato
Propilenglicol
Fenol
Ácido clorhídrico (para ajuste del pH)
Hidróxido de sodio (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Las sustancias añadidas a Saxenda pueden provocar la degradación de liraglutida. En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
30 meses
Después de la primera utilización: 1 mes
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar lejos del congelador.
Después del primer uso: conservar por debajo de 30°C o en nevera (entre 2°C y 8°C).
Conservar la pluma con el capuchón puesto para protegerla de la luz.
6.5 Naturaleza y contenido del envase
Cartucho (vidrio tipo 1) con un émbolo (bromobutilo) y un tapón (bromobutilo/poliisopreno) dentro de una pluma precargada desechable multidosis hecha de polipropileno, poliacetal, policarbonato y acrilonitrilo butadieno estireno.
Cada pluma contiene 3 ml de solución pudiendo suministrar dosis de 0,6 mg, 1,2 mg, 1,8 mg, 2,4 mg y 3,0 mg.
Envases con 1, 3 o 5 plumas precargadas.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La solución no se debe utilizar si no tiene un aspecto transparente e incoloro o casi incoloro.
Saxenda no se debe utilizar si se ha congelado.
La pluma está diseñada para su utilización con agujas desechables NovoFine o NovoTwist de hasta 8 mm de longitud y un grosor de 32 G o mayor.
Las agujas no están incluidas.
Se debe indicar al paciente que deseche la aguja después de cada inyección y que conserve la pluma sin la aguja puesta. De esta forma se evita la contaminación, las infecciones y la pérdida de producto. Así también se garantiza que la dosificación es precisa.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/992/001 -003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 23/Marzo/2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes del principio activo biológico
Novo Nordisk A/S
Hallas Allé
4400 Kalundborg
Dinamarca
Novo Nordisk A/S Novo Allé 2880 Bagsv^rd Dinamarca
Nombre y dirección del fabricante responsable de la liberación de los lotes
Novo Nordisk A/S
Novo Allé
2880 Bagsv^rd
Dinamarca
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización.
Posteriormente, el titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN
SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CARTONAJE
1. NOMBRE DEL MEDICAMENTO
Saxenda 6 mg/ml solución inyectable en pluma precargada Liraglutida
2. PRINCIPIO ACTIVO
Un ml contiene 6 mg de liraglutida. Una pluma precargada contiene 18 mg de liraglutida.
3. LISTA DE EXCIPIENTES
Excipientes: fosfato disódico dihidrato, propilenglicol, fenol, ácido clorhídrico/hidróxido de sodio (para ajuste del pH), agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable
1 pluma 3 plumas 5 plumas
Cada pluma contiene 3 ml de solución y puede suministrar dosis de 0,6 mg, 1,2 mg, 1,8 mg, 2,4 mg y 3,0 mg.
5. FORMA Y VÍA DE ADMINISTRACIÓN
La pluma está diseñada para su utilización con agujas desechables NovoFine o NovoTwist. Las agujas no están incluidas.
Leer el prospecto antes de utilizar este medicamento.
Vía subcutánea
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
No conservar la pluma con la aguja puesta. Para ser utilizado por una sola persona.
8. FECHA DE CADUCIDAD
CAD
Deseche la pluma 1 mes después del primer uso.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera.
No congelar.
Después del primer uso, conservar la pluma por debajo de 30°C o en nevera. Conservar la pluma con el capuchón puesto para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
12. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/992/001 1 x 3 ml EU/1/15/992/002 3 x 3 ml EU/1/15/992/003 5 x 3 ml
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Saxenda
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DE PLUMA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Saxenda 6 mg/ml inyectable
Liraglutida
Vía SC
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
3 ml
6. OTROS
Novo Nordisk A/S
B. PROSPECTO
Prospecto: información para el paciente
Saxenda 6 mg/ml solución inyectable en pluma precargada
liraglutida
"VEste medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Saxenda y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Saxenda
3. Cómo usar Saxenda
4. Posibles efectos adversos
5. Conservación de Saxenda
6. Contenido del envase e información adicional
1. Qué es Saxenda y para qué se utiliza Qué es Saxenda
Saxenda es un medicamento para perder peso que contiene el principio activo liraglutida. Es parecido a una hormona de origen natural llamada GLP-1 que se libera en el intestino después de comer. Saxenda actúa sobre los receptores del cerebro que controlan el apetito y le hacen sentirse más lleno y menos hambriento. De esta forma, puede ayudarle a comer menos y reducir su peso corporal.
Para qué se utiliza Saxenda
Saxenda se utiliza para perder peso junto a una dieta adecuada y la realización de ejercicio en adultos de más de 18 años con
• un IMC de 30 o superior (obesidad) o
• un IMC desde 27 hasta menor de 30 (sobrepeso) y problemas de salud relacionados con el peso (como diabetes, presión arterial alta, niveles anormales de grasas en sangre o problemas respiratorios durante el sueño denominados “apnea obstructiva del sueño”).
El IMC (índice de masa corporal) es una medida del peso en relación con la altura.
Solo debe seguir utilizando Saxenda si ha perdido al menos el 5% de su peso corporal inicial después de 12 semanas en tratamiento con una dosis diaria de 3 mg (ver sección 3). Consulte a su médico antes de continuar.
Dieta y ejercicio
Su médico le pondrá una dieta y le indicará un programa de ejercicio, que deberá realizar mientras esté en tratamiento con Saxenda.
2. Qué necesita saber antes de empezar a usar Saxenda No use Saxenda:
- si es alérgico a liraglutida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Saxenda.
Hay poca o ninguna experiencia con este medicamento en pacientes con insuficiencia cardiaca. No está recomendado si padece insuficiencia cardiaca grave.
Hay poca experiencia con este medicamento en pacientes de 75 años en adelante. No está recomendado si tiene 75 años o más.
Hay poca experiencia con este medicamento en pacientes con problemas de riñón. Si padece una enfermedad de riñón o está en diálisis, consulte a su médico.
Hay poca experiencia con este medicamento en pacientes con problemas de hígado. Si tiene problemas de hígado, consulte a su médico.
No se recomienda este medicamento si tiene un problema grave de estómago o de intestino que produce un retraso del vaciado del estómago (llamado gastroparesia), o si tiene una enfermedad inflamatoria intestinal.
Personas con diabetes
Si es diabético, no utilice Saxenda como sustituto de la insulina.
Inflamación del páncreas
Consulte a su médico si tiene o ha tenido una enfermedad del páncreas.
Inflamación de la vesícula y cálculos biliares
Si pierde mucho peso, corre el riesgo de desarrollar cálculos biliares y como consecuencia, inflamación de la vesícula. Deje de utilizar Saxenda y contacte con su médico inmediatamente si experimenta dolor intenso en la parte superior del abdomen, generalmente peor en el lado derecho debajo de las costillas. El dolor se puede sentir hasta la espalda o el hombro derecho. Ver sección 4.
Enfermedad tiroidea
Consulte a su médico si tiene enfermedad tiroidea, incluyendo nódulos tiroideos y agrandamiento de la glándula tiroidea.
Frecuencia cardiaca
Consulte a su médico si tiene palpitaciones (es consciente del latido de su corazón) o si tiene una sensación de aceleración del pulso en reposo durante el tratamiento con Saxenda.
Pérdida de líquidos y deshidratación
Al iniciar el tratamiento con Saxenda, es posible que pierda líquidos o se deshidrate. Esto puede deberse a la aparición de náuseas, vómitos y diarrea. Es importante evitar la deshidratación bebiendo mucho líquido. Si tiene alguna duda o pregunta, consulte a su médico, farmacéutico o enfermero. Ver sección 4.
Niños y adolescentes
Saxenda no se debe utilizar en niños y adolescentes menores de 18 años porque no se han estudiado los efectos de este medicamento en este grupo de edad.
Uso de Saxenda con otros medicamentos
Informe a su médico, farmacéutico o enfermero si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
En concreto, informe a su médico, farmacéutico o enfermero si:
• toma medicamentos para la diabetes llamados “sulfonilureas” (como glimepirida o glibenclamida) - su nivel de azúcar en sangre puede bajar (hipoglucemia) si utiliza estos medicamentos con Saxenda. Su médico puede ajustar la dosis de su medicación para la diabetes para que no sufra episodios de hipoglucemia. Ver sección 4 para consultar los síntomas de aviso de una bajada de azúcar en sangre.
• toma warfarina u otros medicamentos por vía oral que reducen la coagulación de la sangre (anticoagulantes). Pueden ser necesarios análisis de sangre más frecuentes para determinar la capacidad de coagulación de su sangre.
Embarazo y lactancia
No use Saxenda si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, porque se desconoce si Saxenda puede afectar al feto.
Si está usando Saxenda, debe evitar la lactancia, ya que se desconoce si Saxenda se excreta en la leche materna.
Conducción y uso de máquinas
Es poco probable que Saxenda afecte a su capacidad para conducir y utilizar máquinas. Si necesita más información, consulte a su médico, farmacéutico o enfermero.
Información importante sobre alguno de los componentes de Saxenda
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis. Esto significa que está
esencialmente exento de sodio.
3. Cómo usar Saxenda
Siga exactamente las instrucciones de administración de Saxenda indicadas por su médico. En caso de duda, consulte de nuevo a su médico, farmacéutico o enfermero.
Su médico le pondrá una dieta y le indicará un programa de ejercicio, que deberá realizar mientras esté en tratamiento con Saxenda.
Cuánto inyectarse
El tratamiento se iniciará con una dosis baja que aumentará gradualmente durante las cinco primeras semanas de tratamiento.
• Cuando comienza a utilizar Saxenda, la dosis inicial es de 0,6 mg una vez al día, durante al menos una semana.
• Debe aumentar la dosis 0,6 mg por semana hasta llegar a la dosis recomendada de 3,0 mg una vez al día.
Su médico le indicará la cantidad de Saxenda que debe utilizar cada semana. Normalmente, se le indicará que siga la siguiente tabla.
|
Semana |
Dosis inyectada |
|
Semana 1 |
0,6 mg una vez al día |
|
Semana 2 |
1,2 mg una vez al día |
|
Semana 3 |
1,8 mg una vez al día |
|
Semana 4 |
2,4 mg una vez al día |
|
Semana 5 en adelante |
3,0 mg una vez al día |
Una vez alcanzada la dosis recomendada de 3,0 mg en la semana 5 de tratamiento, siga utilizando esta dosis hasta que finalice el periodo de tratamiento. No aumente más la dosis.
Su médico evaluará el tratamiento de forma periódica.
Cómo y cuándo utilizar Saxenda
• Antes de utilizar la pluma por primera vez, su médico o enfermero le mostrarán cómo utilizarla.
• Puede utilizar Saxenda a cualquier hora del día, con o sin alimentos y bebidas.
• Utilice Saxenda aproximadamente a la misma hora todos los días: elija la hora que más le convenga.
Dónde inyectarse
Saxenda se administra como una inyección bajo la piel (inyección subcutánea).
• Las mejores zonas para la inyección son la zona del abdomen, la parte frontal del muslo o la parte superior del brazo.
• No se inyecte en una vena o músculo.
En la otra cara de este prospecto encontrará instrucciones detalladas sobre su uso.
Personas con diabetes
Informe a su médico si tiene diabetes. Su médico puede ajustar la dosis de su medicación para la diabetes para que no sufra episodios de hipoglucemia.
• No mezcle Saxenda con otros medicamentos inyectables (por ejemplo, insulinas).
• No utilice Saxenda en combinación con otros medicamentos que contengan agonistas del
receptor de GLP-1 (como exenatida, lixisenatida).
Si usa más Saxenda del que debe
Si usa más Saxenda del que debe, hable con un médico o vaya inmediatamente a un hospital. Lleve con usted el envase del medicamento. Puede que necesite tratamiento médico. Podrían producirse los siguientes efectos:
• náuseas
• vómitos.
Si olvidó usar Saxenda
• Si olvida una dosis y se acuerda de ello durante las 12 horas siguientes desde que generalmente se inyecta la dosis, inyéctesela tan pronto como se acuerde.
• Sin embargo, si han pasado más de 12 horas desde que debería haber usado Saxenda, sáltese la dosis olvidada e inyéctese la siguiente dosis al día siguiente a la hora habitual.
• No use una dosis doble ni aumente la dosis del día siguiente para compensar la dosis olvidada.
Si interrumpe el tratamiento con Saxenda
No interrumpa el tratamiento con Saxenda sin consultar a su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Pocas veces se han notificado reacciones alérgicas graves (anafilaxia) en pacientes que utilizan Saxenda. Acuda a su médico inmediatamente si tiene síntomas tales como problemas respiratorios, hinchazón de la cara y la garganta, y palpitaciones.
Con muy poca frecuencia se han notificado casos de inflamación del páncreas (pancreatitis) en pacientes que utilizan Saxenda. La pancreatitis es una enfermedad grave y potencialmente mortal.
Deje de usar Saxenda y contacte con su médico inmediatamente si nota alguno de los siguientes efectos adversos graves:
• dolor intenso y persistente en el abdomen (zona del estómago) que puede llegar hasta la espalda, así como náuseas y vómitos, ya que podría ser un signo de una inflamación del páncreas (pancreatitis).
Otros efectos adversos
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas
• náuseas, vómitos, diarrea, estreñimiento; suelen desaparecer tras pocos días o semanas. Frecuentes: pueden afectar hasta 1 de cada 10 personas
• problemas que afectan al estómago y a los intestinos como: indigestión (dispepsia), inflamación del revestimiento del estómago (gastritis), malestar estomacal, dolor en la parte superior del estómago, ardor de estómago, sensación de hinchazón, gases (flatulencia), eructos, sequedad de boca
• sensación de debilidad o cansancio
• alteraciones en el sentido del gusto
• mareos
• dificultad para dormir (insomnio). Normalmente se producen en los 3 primeros meses de tratamiento
• cálculos biliares
• reacciones en el lugar de inyección (como hematomas (moratones), dolor, irritación, picor y
sarpullido)
• nivel de azúcar en sangre bajo (hipoglucemia). Los síntomas de aviso de una bajada de azúcar en sangre pueden aparecer repentinamente e incluir: sudor frío, piel fría y pálida, dolor de cabeza, palpitaciones, náuseas, apetito excesivo, trastornos visuales, somnolencia, sensación de debilidad, nerviosismo, ansiedad, confusión, dificultad de concentración y temblores. Su médico le indicará cómo tratar el bajo nivel de azúcar en sangre y qué tiene que hacer en el caso de que observe estos síntomas de aviso.
• aumento de las enzimas pancreáticas, como lipasa y amilasa.
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas
• pérdida de líquidos (deshidratación). Esto es más probable que ocurra al principio del tratamiento y puede ser debido a los vómitos, náuseas y diarrea
• vesícula biliar inflamada
• reacciones alérgicas incluidas las erupciones cutáneas
• sensación de malestar general
• pulso más rápido.
Raros: pueden afectar hasta 1 de cada 1.000 personas
• función renal reducida
• fallo renal agudo. Entre los síntomas se pueden incluir la reducción en el volumen urinario, sabor metálico en la boca y facilidad para desarrollar hematomas (moratones).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Saxenda
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice Saxenda después de la fecha de caducidad que aparece en la etiqueta de la pluma y en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
Antes del primer uso:
Conservar en nevera (entre 2°C y 8°C). No congelar. Mantener alejado del congelador.
Cuando empiece a utilizar la pluma:
Puede conservar la pluma durante un mes si la mantiene por debajo de 30°C o en nevera (entre 2°C y 8°C). No congelar. Mantener alejado del congelador.
Cuando no se utilice, conserve la pluma con el capuchón puesto para protegerla de la luz.
No utilice este medicamento si observa que la solución no es transparente e incolora, o casi incolora.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Saxenda
- El principio activo es liraglutida. 1 ml de solución inyectable contiene 6 mg de liraglutida. Una pluma precargada contiene 18 mg de liraglutida.
- Los demás componentes son fosfato disódico dihidrato, propilenglicol, fenol, ácido clorhídrico e hidróxido de sodio (para ajuste del pH) y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Saxenda se suministra como una solución inyectable transparente, incolora o casi incolora en una pluma precargada. Cada pluma contiene 3 ml de solución y puede administrar dosis de 0,6 mg, 1,2 mg,
1,8 mg, 2,4 mg y 3,0 mg.
Saxenda está disponible en envases de 1, 3 o 5 plumas. Puede que solamente estén comercializados algunos tamaños de envases.
Las agujas no están incluidas.
Titular de la autorización de comercialización y responsable de la fabricación
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
Fecha de la última revisión de este prospecto Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones de uso de Saxenda 6 mg/ml solución inyectable en pluma precargada
Lea atentamente estas instrucciones antes de utilizar su pluma precargada Saxenda.
No utilice la pluma sin haber recibido la formación adecuada de su médico o enfermero.
Empiece comprobando la pluma para asegurarse de que contiene Saxenda
6 mg/ml y después observe las ilustraciones para familiarizarse con las distintas partes de la pluma y la aguja.
Si es invidente o tiene visión reducida y no puede leer el contador de dosis de la pluma, no utilice esta pluma sin ayuda. Busque la ayuda de una persona que vea bien y esté formada en el uso de la pluma precargada Saxenda.
Su pluma es una pluma precargada dosificadora. Contiene 18 mg de liraglutida, y administra dosis de 0,6 mg, 1,2 mg, 1,8 mg, 2,4 mg y 3,0 mg. La pluma está diseñada para utilizarse con agujas desechables NovoFine o NovoTwist de hasta 8 mm de longitud y un grosor de 32 G o mayor.
Las agujas no están incluidas en el envase.
A Información importante
Preste especial atención a estas notas porque son importantes para el uso seguro de la pluma._
Saxenda pluma precargada y aguja (ejemplo)
r

Escala de la pluma
Ventana de la pluma
Etiqueta de la pluma
Botón de dosis
Contador de
dosis
Marcador de dosis
Selector de dosis
— Capuchón de la pluma
Capuchón exterior de la aguja
Capuchón interior de la aguja

Lengüeta de papel
Aguja

Símbolo
de
comprobación de flujo
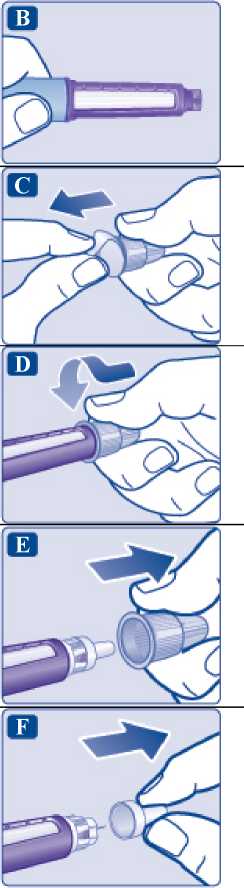
1 Preparación de la pluma con una aguja nueva
Compruebe el nombre y el color de la etiqueta de su pluma para asegurarse de que contiene Saxenda. Esto es especialmente importante si utiliza más de un tipo de medicamento inyectable. El uso de un medicamento equivocado puede ser perjudicial para su salud.
Retire el capuchón de la pluma.
Compruebe que la solución de la pluma tiene un aspecto transparente e
incoloro. Mire a través de la ventana de la pluma. Si la solución tiene un aspecto turbio, no utilice la pluma.
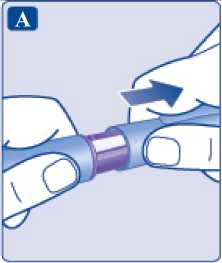
Coja una aguja nueva y retire la lengüeta de papel.
Retire el capuchón exterior de la aguja y guárdelo para más tarde. Lo
necesitará después de la inyección para retirar la aguja de la pluma de forma segura.
Retire el capuchón interior de la aguja y tírelo. Si intenta volver a colocarlo, puede pincharse accidentalmente con la aguja.
Puede aparecer una gota de solución en la punta de la aguja. Esto es normal, pero a pesar de ello debe comprobar el flujo si utiliza una pluma nueva por primera vez.
No coloque una aguja nueva en la pluma hasta que esté listo para ponerse la inyección.
A Utilice siempre una aguja nueva para cada inyección.
De esta forma puede evitar que las agujas se atasquen, las contaminaciones, las infecciones y las dosificaciones inexactas.
A Nunca utilice agujas dobladas o dañadas._
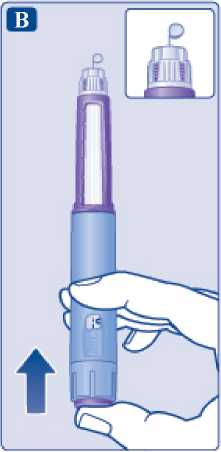
2 Comprobación del flujo
Antes de la primera inyección con cada pluma nueva, compruebe el flujo. Si su pluma está ya en uso, vaya al paso 3 “Selección de la dosis”. Gire el selector de dosis hasta que aparezca el símbolo de comprobación
de flujo en el contador de dosis


Símbolo de comprobación de flujo seleccionado

• Sujete la pluma con la aguja apuntando hacia arriba.
Presione y mantenga presionado el botón de dosis hasta que el contador de dosis vuelva a 0. El 0 debe quedar alineado con el marcador de dosis. Debe aparecer una gota de solución en la punta de la aguja.
Puede que una pequeña gota se quede en la punta de la aguja, pero no se inyectará.
Si no aparece ninguna gota, repita el paso 2 “Comprobación del flujo” hasta 6 veces. Si sigue sin aparecer una gota, cambie la aguja y repita el paso 2 “Comprobación del flujo” una vez más.
Si, a pesar de todo, no aparece una gota, deseche la pluma y utilice una nueva.
A Asegúrese siempre de que aparezca una gota en la punta de la aguja
antes de utilizar una pluma nueva por primera vez. Así se asegura de que la solución fluye.
Si no aparece una gota, no se inyectará medicamento, aunque el contador de dosis se mueva. Esto puede indicar que la aguja está bloqueada o dañada.
Si no comprueba el flujo antes de la primera inyección con cada pluma nueva, es posible que no se administre la dosis prescrita y que Saxenda no
_produzca el efecto previsto._
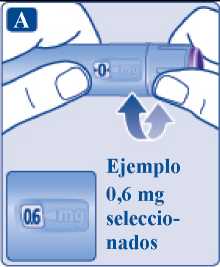
3 Selección de la dosis
• Gire el selector de dosis hasta que aparezca la dosis en el contador de dosis (0,6 mg, 1,2 mg, 1,8 mg, 2,4 mg o 3,0 mg).
Si ha seleccionado una dosis incorrecta, puede girar el selector de dosis hacia delante o hacia atrás para seleccionar la dosis correcta.
La pluma puede seleccionar hasta un máximo de 3,0 mg.
El selector de dosis cambia la dosis. Solamente el contador de dosis y el marcador de dosis muestran cuántos mg ha seleccionado en cada administración.
Puede seleccionar hasta 3,0 mg por dosis. Cuando la pluma contiene menos de 3,0 mg, el contador de dosis se detiene antes de que aparezca 3,0 mg.
El selector de dosis hace clic de forma diferente cuando se gira hacia delante, hacia atrás o se pasa del número de mg que quedan. No cuente los clics de la pluma.
A Antes de inyectarse el medicamento, utilice siempre el contador de dosis y el marcador de dosis para ver cuántos mg ha seleccionado.
No cuente los clics de la pluma.
No utilice la escala de la pluma, ya que solo muestra la cantidad aproximada de solución que queda en esta.
Con el selector de dosis solo deben seleccionarse dosis de 0,6 mg,
1,2 mg, 1,8 mg, 2,4 mg o 3,0 mg. La dosis seleccionada tiene que estar alineada de manera exacta con el marcador de dosis para asegurar que la
_dosis inyectada es la correcta._
¿Cuánta solución queda?
La escala de la pluma muestra la cantidad aproximada de solución que queda en la pluma.
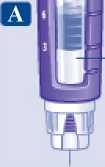
Cantidad aproximada de solución restante
|
• Para saber cuánta solución queda exactamente, utilice el contador de dosis: Gire el selector de dosis hasta que el contador de dosis se detenga. Si muestra 3.0, significa que quedan al menos 3,0 mg en la pluma. Si el contador de dosis se detiene antes de 3,0 mg, significa que no queda suficiente solución para una dosis completa de 3,0 mg. Si necesita más medicamento del que queda en la pluma Si el médico o enfermero lo aconsejan y le han enseñado a hacerlo, puede dividir la dosis entre la pluma en uso y una nueva. Utilice una calculadora para planificar la dosis según le haya indicado su médico o enfermero. A Tenga mucho cuidado de hacer el cálculo correctamente. Si no está seguro de cómo dividir la dosis utilizando dos plumas, seleccione e inyéctese la dosis que necesita con una pluma nueva. |
Ejemplo & |
xk Contador de dosis detenido: quedan 2,4 mg | |
|
4 Inyección de la dosis • Inserte la aguja bajo la piel tal como le ha enseñado su médico o enfermero. • Compruebe que puede ver el contador de dosis. No lo tape con los dedos. Esto podría interrumpir la inyección. |
0 JV y-J p 1 A...... | ||
|
• Presione y mantenga presionado el botón de dosis hasta que el contador de dosis indique 0. El 0 debe quedar alineado con el marcador de dosis. En ese momento puede que oiga o sienta un clic. |
Q 1 ® 1 |
M- LQl + ■ f i LJ | |
|
• Mantenga la aguja bajo la piel después de que el contador de dosis haya vuelto a 0 y cuente lentamente hasta 6. • Si retira antes la aguja, puede que vea salir solución de la punta de la aguja. Esto significa que no se ha administrado la dosis completa. |
Cuente lentamente: | ||
|
• Retire la aguja de la piel. Si aparece sangre en el lugar de inyección, presione ligeramente. No frote la zona. Puede aparecer una gota de solución en la punta de la aguja después de la inyección. Esto es normal y no afecta a la dosis. A Observe siempre el contador de dosis para saber cuántos mg inyecta. Presione y mantenga presionado el botón de dosis hasta que el contador de dosis indique 0. ¿Cómo detectar si la aguja está bloqueada o dañada? • Si no aparece el 0 en el contador de dosis después de presionar continuamente el botón de dosis, puede que haya usado una aguja bloqueada o dañada. • En este caso, no habrá recibido nada de medicamento, incluso aunque el contador de dosis se haya movido de la dosis original que seleccionó. |
s n tu | ||
|
¿Qué hacer si la aguja está bloqueada? Cambie la aguja tal como se describe en el paso 5, “Después de la inyección”, y repita todos los pasos desde el paso 1 “Preparación de la pluma con una aguja nueva”. Asegúrese de seleccionar la dosis completa que necesita. No toque nunca el contador de dosis mientras se está inyectando. Esto puede interrumpir la inyección. | ||
|
5 Después de la inyección • Introduzca la punta de la aguja en su capuchón exterior, colocado sobre una superficie plana, sin tocar la aguja ni el capuchón exterior de la aguja. |
° «■ crjf) AüC- | |
|
• Cuando la aguja esté cubierta, presione completamente y con cuidado el capuchón exterior. • Desenrosque la aguja y deséchela con cuidado. | ||
|
• Ponga el capuchón en la pluma después de cada uso para proteger la solución de la luz. Deseche siempre la aguja después de cada inyección para asegurar que las inyecciones se administren correctamente y evitar que se atasquen las agujas. Si la aguja está atascada, no se inyectará medicamento. Cuando la pluma esté vacía, tírela sin la aguja puesta, siguiendo las instrucciones de su médico, enfermero, farmacéutico o de las autoridades locales. A Nunca intente volver a colocar el capuchón interior de la aguja. Podría pincharse con ella. A Retire siempre la aguja de la pluma después de cada inyección. De esta forma puede evitar que las agujas se atasquen, las contaminaciones, las infecciones, las pérdidas de solución y las dosificaciones inexactas. |
“ ^ | |
|
Más información importante • Mantenga siempre la pluma y las agujas fuera de la vista y del alcance de otras personas, especialmente de los niños. • Nunca comparta la pluma o las agujas con otras personas. • Las personas que atienden a los pacientes deben tener mucho cuidado cuando manejen agujas usadas para evitar pinchazos accidentales e infecciones. | ||
|
Cuidados de la pluma • No deje la pluma en el coche ni en otro lugar donde pueda calentarse o enfriarse en exceso. • No se inyecte Saxenda si se ha congelado. Si lo hace, no conseguirá el efecto previsto de este medicamento. • No exponga la pluma al polvo, la suciedad o líquidos. • No lave, ponga a remojo ni lubrique la pluma. Si es necesario, límpiela con un paño humedecido con un detergente suave. • Procure que la pluma no se caiga ni golpee contra superficies duras. Si se le cae la pluma o sospecha que pueda tener un problema, coloque una aguja | ||
nueva y compruebe el flujo antes de inyectarse.
No intente rellenar la pluma. Una vez vacía, se debe desechar. No intente reparar la pluma ni desmontarla._
ANEXO IV
CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DE LAS CONDICIONES DE LAS AUTORIZACIONES DE COMERCIALIZACIÓN
Conclusiones científicas
Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre los informes periódicos de seguridad (IPS) para liraglutida las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
De acuerdo a la señal de aumento de lipasa y los acontecimientos de aumento en los valores medios de lipasa observados en los ensayos clínicos y de las fuentes poscomercialización, el PRAC consideró que se debe actualizar la información del producto para añadir las reacciones adversas “aumento de lipasa” y “aumento de amilasa” con una frecuencia clasificada como de frecuente en la sección 4.8 del Resumen de las Características del Producto. El prospecto se debe actualizar en consecuencia.
Por lo tanto, en vista de los datos presentados en el IPS revisado, el PRAC considera que los cambios de la información del producto de los medicamentos que contienen liraglutida estaban justificados.
El CHMP está de acuerdo con las conclusiones científicas del PRAC.
Motivos para la modificación de las condiciones de las autorizaciones de comercialización
De acuerdo con las conclusiones científicas para liraglutida, el CHMP considera que el balance beneficio-riesgo de los medicamentos que contienen liraglutida no se modifica sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de las autorizaciones de comercialización.
40