Sandostatin Lar 30 Mg Polvo Para Suspension Inyectable
Información obsoleta, busque otro.<5^.
"I
¡m
Prospecto: información para el paciente
SANDOSTATIN LAR 30 mg polvo y disolvente para suspensión inyectable
Octreotida
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Sandostatin LAR y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Sandostatin LAR
3. Cómo usar Sandostatin LAR
4. Posibles efectos adversos
5. Conservación de Sandostatin LAR
6. Contenido del envase e información adicional
1. Qué es Sandostatin LAR y para qué se utiliza
Sandostatin LAR es un compuesto sintético derivado de la somatostatina. La somatostatina se encuentra normalmente en el cuerpo humano, donde inhibe la liberación de algunas hormonas como la hormona del crecimiento. Las ventajas de Sandostatin LAR respecto a somatostatina son que es más potente y sus efectos son más duraderos.
Sandostatin LAR se utiliza
• para tratar la acromegalia,
La acromegalia es una enfermedad en la que el cuerpo produce demasiada hormona del crecimiento. Normalmente la hormona del crecimiento controla el crecimiento de los tejidos, los órganos y los huesos. Un exceso de hormona del crecimiento supone un aumento en el tamaño de los huesos y los tejidos, especialmente en las manos y los pies. Sandostatin LAR reduce notablemente los síntomas de la acromegalia, que incluyen dolor de cabeza, exceso de sudoración, adormecimiento de las manos y los pies, cansancio y dolor en las articulaciones. En la mayoría de los casos, la sobreproducción de hormona del crecimiento está causada por aumento del tamaño de la glándula pituitaria (adenoma pituitario); el tratamiento con Sandostatin LAR puede reducir el tamaño del adenoma.
Sandostatin LAR se utiliza para tratar personas que sufren acromegalia:
- cuando otros tipos de tratamiento para la acromegalia (cirugía o radioterapia) no son adecuados o no han funcionado correctamente;
ÍTTI
- después de la radioterapia, para cubrir el periodo de tiempo intermedio hasta que la radioterapia es completamente eficaz.
• para aliviar los síntomas asociados con la sobreproducción de algunas hormonas específicas y otras sustancias relacionadas en el estómago, intestino o páncreas.
La sobre producción de unas hormonas específicas y de otras sustancias naturales relacionadas puede estar causada por algunas alteraciones raras del estómago, intestino o páncreas. Esto altera el equilibrio hormonal natural y provoca una serie de síntomas como sofocos, diarrea, baja tensión arterial, erupción cutánea y pérdida de peso. El tratamiento con Sandostatin LAR ayuda a controlar estos síntomas.
• para tratar tumores neuroendocrinos localizados en el intestino (p.ej. apéndice, intestino delgado o colon)
Los tumores neuroendocrinos son tumores raros que se pueden encontrar en diferentes partes del cuerpo. Sandostatin LAR también se utiliza para controlar el crecimiento de estos tumores, cuando están localizados en el intestino (p.ej. apéndice, intestino delgado o colon)
• para tratar tumores pituitarios que producen demasiada hormona estimulante del tiroides (TSH).
Un exceso de hormona estimulante del tiroides (TSH) provoca hipertiroidismo. Sandostatin LAR se utiliza para tratar personas con tumores pituitarios que producen demasiada hormona estimulante del tiroides (TSH):
- cuando otros tipos de tratamiento (cirugía o radioterapia) no son adecuados o no han funcionado;
después de la radioterapia, para cubrir el periodo hasta que la radioterapia es completamente efectiva.
2. Qué necesita saber antes de empezar a usar Sandostatin LAR
Siga todas las instrucciones que le dé su médico cuidadosamente. Pueden ser diferentes de la información contenida en este prospecto.
Lea las siguientes indicaciones antes de utilizar Sandostatin LAR.
No use Sandostatin LAR:
- si es alérgico a octreotida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Sandostatin LAR:
- si sabe que tiene actualmente cálculos en la vesícula biliar, o los ha tenido en el pasado; informe a su médico, pues el uso prolongado de Sandostatin LAR puede provocar la formación de cálculos biliares. Su médico prodría querer controlar su vesícula biliar periódicamente.
- si sabe que tiene diabetes, ya que Sandostatin LAR puede afectar los niveles de azúcar en la sangre. Si es diabético, debe controlar regularmente sus niveles de azúcar.
- si tiene antecedentes de deficiencia de vitamina B12 su médico puede controlar el nivel de B12 periodicamente.
Análisis y controles
Si recibe tratamiento con Sandostatin LAR durante un periodo prolongado de tiempo, su médico puede controlar su función tiroidea periódicamente.
Su médico controlará la función de su hígado.
Niños
Existe poca experiencia con el uso de Sandostatin LAR en niños.
Uso de Sandostatin LAR con otros medicamentos
ÍTTI
Comunique a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Normalmente puede continuar tomando otros medicamentos mientes esté en tratamiento con Sandostatin LAR. Sin embargo, se han notificado que algunos medicamentos como cimetidina, ciclosporina, bromocriptina, quinidina y terfenadina se ven afectados por Sandostatin LAR.
Si está tomando un medicamento para controlar la presión arterial (p.ej. un beta bloqueante o un antagonista de los canales del calcio) o un agente para controlar el equilibrio de líquidos y electrolitos, su médico puede necesitar ajustar la dosis.
Si es diabético, su médico puede necesitar ajustar su dosis de insulina.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Sólo se debe utilizar Sandostatin LAR durante el embarazo si es estrictamente necesario.
Las mujeres en edad fértil deben utilizar un método anticonceptivo eficaz durante el tratamiento.
No debe dar lactancia durante el tratamiento con Sandostatin LAR. Se desconoce si Sandostatin LAR pasa a la leche materna.
Conducción y uso de máquinas
Sandostatin LAR no tiene efectos o éstos son insignificantes sobre la capacidad de conducir o utilizar máquinas. Sin embargo algunos de estos efectos adversos que puede sufrir durante el tratamiento con Sandostatin LAR, como dolor de cabeza y cansancio, pueden reducir su capacidad para conducir y utilizar máquinas de forma segura.
3. Cómo usar Sandostatin LAR
Sandostatin LAR se debe administrar siempre como una inyección en el músculo de los glúteos. Con la administración repetida, se debe utilizar el glúteo derecho e izquierdo alternativamente.
Si usa más Sandostatin LAR del que debe
No se han notificado reacciones adversas que suponen una amenaza vital después de una sobredosis con Sandostatin LAR.
Los síntomas de sobredosis son: sofocos, micciones frecuentes, cansancio, depresión, ansiedad y falta de concentración.
Si piensa que ha sufrido una sobredosis y presenta alguno de estos síntomas, informe a su médico inmediatamente. También puede llamar al Servicio de Información Toxicológica, Tel. 91 562 0420.
Si olvidó usar Sandostatin LAR
Si ha olvidado su inyección, se recomienda que se la administren tan pronto como se acuerde, y después continuar con la pauta habitual. No va a provocarle ningún daño el hecho de recibir una dosis unos días más tarde, pero pueden reaparecer temporalmente los síntomas hasta que vuelva a la pauta habitual de tratamiento.
Si interrumpe el tratamiento con Sandostatin LAR
Si interrumpe su tratamiento con Sandostatin LAR pueden reaparecer sus síntomas. Por tanto, no interrumpa el tratamiento con Sandostatin LAR a menos que se lo indique su médico.
ÍTTI
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, enfermero o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Algunas reacciones adversas podrían ser graves. Informe a su médico inmediatamente si sufre alguno de los siguientes:
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
• Cálculos biliares, que conllevan dolor de espalda repentino.
• Demasiado azúcar en la sangre.
Frecuentes (pueden afectar hasta 1 de cada 10 personas:
• Disminución de la actividad de la glándula tiroidea (hipotiroidismo) que causa cambios en el ritmo del corazón, el apetito o el peso; cansancio, sensación de frío, o hinchazón en la parte de delante del cuello.
• Cambios en los análisis de la función tiroidea.
• Inflamación de la vesícula biliar (colecistitis); los síntomas pueden incluir dolor en la parte superior derecha del abdomen, fiebre, náuseas, coloración amarilla de la piel y los ojos (ictericia).
• Muy poco azúcar en la sangre.
• Alteración de la tolerancia a la glucosa.
• Latido del corazón lento.
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas^
• Sed, baja eliminación de orina, color oscuro en la orina, piel seca enrojecida.
• Latido del corazón rápido.
Otras reacciones adversas graves
• Reacciones de hipersensibilidad (alérgicas) incluyendo urticaria en la piel.
• Un tipo de reacción alérgica (anafilaxis) que causa dificultad en la respiración o mareo.
• Una inflamación de la glándula del páncreas (pancreatitis); los síntomas pueden incluir dolor repentino en la parte superior del abdomen, náuseas, vómitos, diarrea.
• Inflamación del hígado (hepatitis); síntomas que pueden incluir color amarillento de la piel y los ojos (ictericia), náuseas, vómitos, pérdida de apetito, sensación general de malestar, picor, orina ligeramente coloreada.
• Latido del corazón irregular.
Informe a su médico inmediatamente si nota alguno de las reacciones adversas anteriores.
Otros efectos adversos:
Informe a su médico, farmacéutico o enfermero si nota alguno de los efectos adversos enumerados a continuación. Normalmente son leves y tienden a desaparecer al avanzar el tratamiento.
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas^
• Diarrea.
• Dolor abdominal.
• Náuseas.
• Estreñimiento.
• Flatulencia (gases).
• Dolor de cabeza.
• Dolor local en el lugar de inyección.
ÍTTI
Frecuentes (puede afectar hasta 1 de cada 10 personas!:
• Molestia en el estómago después de comer (dispepsia).
• Vómitos.
• Sensación de tener el estómago lleno.
• Heces grasas.
• Heces líquidas.
• Cambio de color de las heces.
• Mareo.
• Pérdida de apetito.
• Cambios en los análisis sobre la función del hígado.
• Pérdida de pelo.
• Dificultad para respirar.
• Debilidad.
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, enfermero o farmacéutico. Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: http://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Sandostatin LAR
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD.
La fecha de caducidad es el último día del mes que se indica.
Conservar entre 2°C y 8°C (en nevera). Conservar en el embalaje original para protegerlo de la luz. Sandostatin LAR puede permanecer a temperatura ambiente (menos de 25°C) durante el día de la inyección, manteniéndolo dentro del envase exterior. Sin embargo, una vez preparada la suspensión ésta debe ser administrada inmediatamente.
Los medicamentos no se deben tirar por los desagües ni a la basura. Deposite los envases y los medicamentos que no necesita en el punto SIGRE ® de la farmacia. En caso de duda pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Sandostatin LAR
- El principio activo es octreótida.
Cada vial contiene 30 mg de octreótida.
- Los demás componentes del vial son: poli(DL-lactida-co-glicolida) y manitol
- Los componentes de la jeringa precargada son: carboximetilcelulosa sódica, manitol, poloxamer 188 y agua para preparaciones inyectables
Aspecto de Sandostatin LAR y contenido del envase
Cada envase de Sandostatin LAR contiene:
- 1 vial con polvo blanco o blanco con un tono amarillento de octreotida.
- 1 jeringa precargada con 2 ml de disolvente transparente, incoloro a ligeramente amarillo o marrón,
- 1 aguja,
- 1 adaptador al vial.
ÍTTI
Titular de la autorización de comercialización
Novartis Farmacéutica, S.A.
Gran Vía de les Corts Catalanes, 764 08013 Barcelona
Responsable de la fabricación
Novartis Farmacéutica, S.A.
Ronda de Santa María, 158.
08210 Barberá del Vallés (Barcelona)
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo con los siguientes nombres:
|
Austria, Bulgaria, Chipre, República Checa, Dinamarca, Estonia, Finlandia, Alemania, Grecia, Hungría, Islandia, Irlanda, Letonia, Lituania, Malta, Noruega, Polonia, Rumanía, Eslovaquia, Eslovenia, España, Suecia, Reino Unido |
Sandostatin |
|
Bélgica, Francia |
Sandostatine |
|
Luxemburgo |
Sandostatin / Sandostatine |
|
Holanda |
Sandostatine |
|
Italia, Portugal |
Sandostatina |
Fecha de la última revisión de este prospecto: Octubre 2014
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
Esta información está destinada únicamente a profesionales del sector sanitario:
Cuánto Sandostatin LAR se debe utilizar
Acromegalia
Se recomienda iniciar el tratamiento con la administración de 20 mg de Sandostatin LAR a intervalos de 4 semanas durante 3 meses. Los pacientes en tratamiento con Sandostatin s.c. pueden iniciar el tratamiento con Sandostatin LAR el día después de la última dosis de Sandostatin s.c.. El ajuste de dosis subsiguiente se debe basar en las concentraciones séricas de la hormona del crecimiento (GH) y el factor de crecimiento 1 de tipo insulina/somatomedina C (IGF-1) y los síntomas clínicos.
Para los pacientes en los que no están controlados completamente los síntomas clínicos y los parámetros bioquímicos (GH; IGF-1) en un periodo de 3 meses (concentraciones de GH todavía por encima de 2,5 microgramos/L), se puede aumentar la dosis a 30 mg cada 4 semanas. Si después de 3 meses, no están controlados adecuadamente GH, IGF-1, y/o los síntomas a la dosis de 30 mg, la dosis se puede aumentar a 40 mg cada 4 semanas.
Para pacientes con concentraciones de GH que se encuentran de forma constante por debajo de 1 microgramo/L, y con concentraciones séricas de IGF-1 normalizadas, y en los cuales la mayoría de los signos/síntomas reversibles de acromegalia han desaparecido después de 3 meses de tratamiento con 20 mg, se pueden administrar 10 mg de Sandostatin LAR cada 4 semanas. Sin embargo, especialmente en
ÍTTI
este grupo de pacientes, se recomienda controlar estrechamente las concentraciones séricas de GH e IGF-1, y los signos/síntomas a esta dosis baja de Sandostatin LAR.
Para pacientes que están tratados con una dosis estable de Sandostatin LAR, la valoración de GH e IGF-1 se debe realizar cada 6 meses.
Tumores endocrinos gastroenteropancreaticos
• Tratamiento de pacientes con síntomas asociados con tumores neuroendocrinos gastroenteropancreaticos funcionales
Se recomienda iniciar el tratamiento con la administración de 20 mg de Sandostatin LAR a intervalos de 4 semanas. Los pacientes en tratamiento con Sandostatin s.c. deben continuar a la dosis previamente efectiva durante 2 semanas después de la primera inyección de Sandostatin LAR.
Para pacientes en los que los síntomas y los marcadores biológicos están bien controlados después de 3 meses de tratamiento, se puede reducir la dosis a 10 mg de Sandostatin LAR cada 4 semanas.
Para pacientes en los que los síntomas están sólo parcialmente controlados después de 3 meses de tratamiento, se puede aumentar la dosis a 30 mg de Sandostatin LAR cada 4 semanas.
Para los días en que pueden aumentar los síntomas asociados con tumores gastroenteropancreáticos durante el tratamiento con Sandostatin LAR, se recomienda la administración adicional de Sandostatin s.c. a la dosis utilizada antes del tratamiento con Sandostatin LAR. Esto puede aparecer principalmente en los
2 primeros meses de tratamiento hasta que se alcancen las concentraciones terapéuticas de octreotida.
• Tratamiento de pacientes con Tumores Neuroendocrinos avanzados del intestino o de origen desconocido donde se ha excluido los lugares de origen que no sean del intestino
La dosis recomendada de Sandostatin LAR es de 30 mg administrado cada 4 semanas. El tratamiento con Sandostatin LAR para controlar el tumor se debe continuar en ausencia de progresión del tumor.
Tratamiento de adenomas secretores de TSH
El tratamiento con Sandostatin LAR se debe iniciar a la dosis de 20 mg a intervalos de 4 semanas durante
3 meses antes de considerar un ajuste de dosis. Después la dosis se ajusta en base de la TSH y de la respuesta de la hormona tiroidea.
Instrucciones para administrar Sandostatin LAR
Instrucciones para la preparación y la inyección i.m. de Sandostatin LAR. Sólo para inyección profunda en la zona glútea.
Contenido del envase:
Contenido:
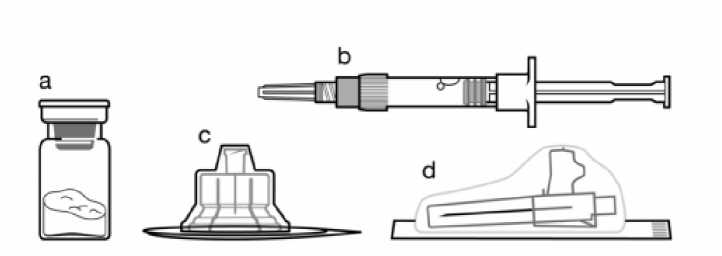
O" »
Un vial que contiene el polvo de Sandostatin LAR Una jeringa precargada que contiene el disolvente para la reconstitución c Un adaptador al vial para la reconstitución del medicamento d Una aguja de inyección de seguridad (0,91 mm x 38,1 mm [20G x 1,5”])
Siga cuidadosamente las instrucciones que se indican a continuación para asegurar la reconstitución de Sandostatin LAR antes de la inyección intraglútea profunda
La suspensión de Sandostatin LAR deberá prepararse sólo inmediatamente antes de la administración. Sandostatin LAR deberá ser administrado sólo por un profesional sanitario experto.
PASO 1
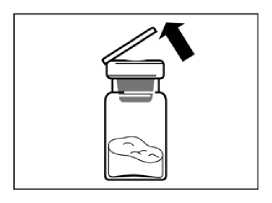
Sacar de la nevera el kit de inyección de Sandostatin LAR para asegurar que alcance la temperatura ambiente.
Calcular aproximadamente 30 a 60 minutos para la aclimatación pero no exceder las 24 h.
Lavar las manos con jabón y agua caliente. Colocar el envase en una superficie limpia y plana. Quitar la lámina protectora de la bandeja que contiene el kit de inyección.
Coger el vial que contiene el polvo de Sandostatin LAR y estirar la lengüeta del vial que contiene Sandostatin LAR.
PASO 2
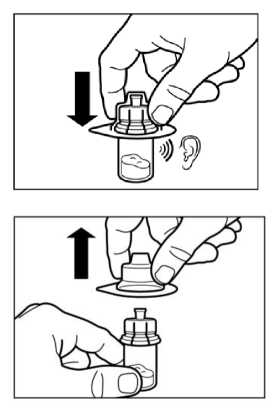
Desinfectar el tapón de caucho del vial con una torunda de algodón con alcohol. No tocar el tapón de caucho después de desinfectarlo. Quitar la lámina protectora del envoltorio que contiene el adaptador del vial. NO sacar el adaptador del vial de su envoltorio.
Sujetando el adaptador del vial por su envoltorio, colocarlo en la parte superior del vial y apretarlo completamente hacia abajo para que encaje encima del vial. Esto lo confirmará cuando escuche un “click”. Coger el envoltorio por la parte de arriba y con un movimiento vertical sacarlo del adaptador del vial
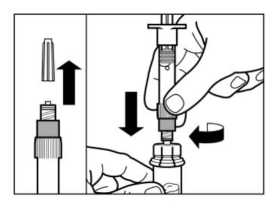
PASO 3
Sacar el tapón de la jeringa precargada que contiene el disolvente y enroscar la jeringa en el adaptador de vial.
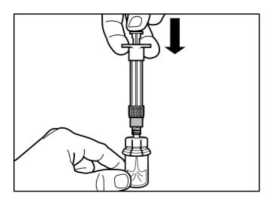
Inyectar toda la solución en el vial apretando lentamente el émbolo hasta el fondo.
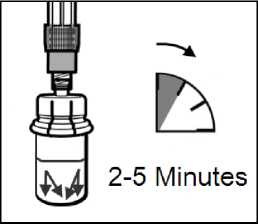
PASO 4
Dejar reposar el vial hasta que el disolvente haya humedecido totalmente el polvo de Sandostatin LAR (como mínimo 2-5 minutos). En este punto preparar al paciente para la inyección.
Nota: es normal que el émbolo se mueva hacia arriba ya que puede haber una sobrepresión en el vial.
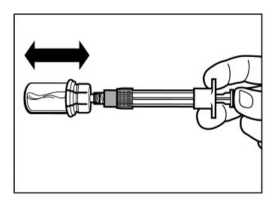
PASO 5
Después del periodo en que se ha humedecido el polvo, presionar el émbolo hacia el fondo de la jeringa.
Mantener el émbolo presionado y agitar el vial moderadamente en sentido horizontal durante unos 30 segundos.
Comprobar visualmente que el polvo está completamente suspendido en el disolvente, formando una suspensión lechosa uniforme. Repetir la agitación durante 30 segundos más si el polvo no está completamente suspendido.
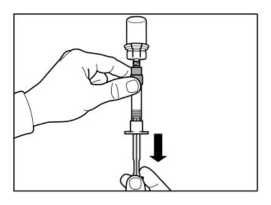
PASO 6
Girar la jeringa y el vial boca abajo, y lentamente estirar el émbolo y transferir el contenido completo del vial a la jeringa.
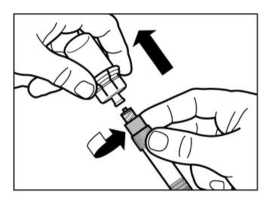
Desenroscar la jeringa del adaptador del vial.
Después de la reconstitución deberá administrarse inmediatamente.
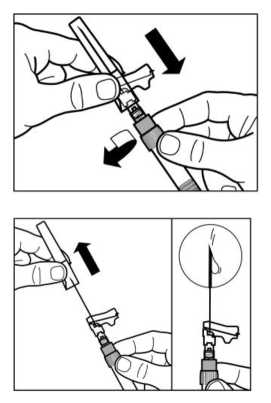
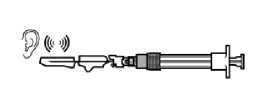
PASO 7
Enroscar la aguja de inyección de seguridad en la jeringa.
Sacar la cubierta protectora de la aguja.
Invertir suavemente la jeringa para mantener una suspensión uniforme.
Golpear ligeramente la jeringa para sacar cualquier burbuja visible y expulsarla fuera de la jeringa.
La solución reconstituida de Sandostatin LAR está ahora preparada para la administración inmediata.
PASO 8
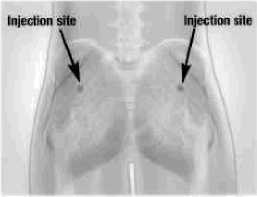
Sandostatin LAR debe administrarse sólo mediante inyección profunda en la zona glútea, nunca por vía intravenosa.
Limpiar el lugar de inyección con una torunda de algodón con alcohol.
Insertar la aguja completamente en el glúteo derecho o izquierdo. Lentamente aspirar el émbolo para comprobar que no se ha penetrado un vaso sanguíneo, y si fuera así, cambiar la posición de la aguja. Utilizando una presión constante, presionar lentamente el émbolo para inyectar la dosis completa. Después de completar la inyección, retirar la aguja del lugar de inyección y activar el mecanismo de seguridad tal como se muestra en el Paso 9 posterior.
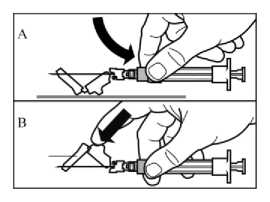
Paso 9
Activar el mecanismo de seguridad sobre la aguja, utilizando una sola mano:
A. o bien presionando la sección articulada del dispositivo de seguridad hacia abajo sobre una superficie rígida, p.ej. una mesa
B. o bien apretando la parte articulada con el dedo índice asegurando siempre que se mantienen todos los dedos por detrás del extremo de la aguja
El sonido de un “click” confirma la activación adecuada del mecanismo de seguridad.
Desechar el vial y la jeringa con la aguja inmediatamente en un contenedor de elementos cortantes.
10 de 10