Salbutamol Sandoz 100 Microgramos/Dosis Suspension Para Inhalacion En Envase A Presion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Salbutamol Sandoz 100 microgramos/dosis, suspensión para inhalación en envase a presión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Una dosis fija contiene 100 microgramos de sulfato de salbutamol (como sulfato).
La dosis administrada a través de la boquilla es de 90 microgramos de salbutamol (como sulfato).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Suspensión para inhalación en envase a presión.
El medicamento es una suspensión blanca,.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento sintomático de la broncoconstricción reversible debida a asma bronquial y enfermedad pulmonar obstructiva crónica (EPOC), incluyendo bronquitis crónica y enfisema. Profilaxis del asma inducido por el ejercicio físico y estímulos alergénicos.
Salbutamol es particularmente útil para el alivio de los síntomas de asma, siempre que no retrase la implantación y uso regular de la terapia corticosteroide por inhalación.
4.2 Posología y forma de administración
Salbutamol Sandoz se usa sólo por vía inhalatoria.
El objetivo debe ser determinar la dosis individual.
Adultos y niños a partir de 12 años
Alivio de ataques: 1-2 inhalaciones, según se precise.
Dosis máxima: 8 inhalaciones diarias.
Para prevenir los síntomas inducidos por el ejercicio físico o estímulos alergénicos debe efectuarse una inhalación, o dos si es necesario, 10-15 minutos antes de la provocación.
Niños de menos de 12 años
Alivio de ataques: 1 inhalación, según proceda.
Dosis máxima: aproximadamente 8 dosis por día.
Profilaxis de los síntomas causados por ejercicio físico o estímulos alergénicos: 1 inhalación, o 2 si es necesario, 10-15 minutos antes.
Manejo
Es muy común observar una técnica deficiente de inhalación con inhaladores presurizados. Por ello es importante instruir al usuario en la técnica correcta de inhalación, la cual debe ser verificada en cada visita.
Salbutamol Sandoz puede usarse con un dispositivo espaciador Vortex® o AeroChamber® en el caso de niños y pacientes a los que es difícil sincronizar la operación del inhalador con la inspiración.
Léanse las correspondientes instrucciones de uso del dispositivo espaciador Vortex® o AeroChamber® en los respectivos folletos de información para el usuario.
Preparación del dispositivo
Comprobar el buen funcionamiento del inhalador si se usa por primera vez o no se ha usado durante 7 días o más. Quitar la cubierta protectora, agitar el inhalador y emitir dos pulverizaciones en el aire.
Instrucciones de uso
Inhalar en posición sentada o de pie, como sea posible.
1 Quitar la cubierta protectora. Verificar la limpieza interior y exterior de la boquilla.
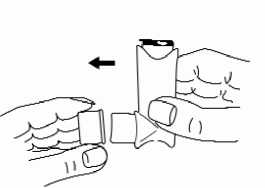
2 Agitar bien el inhalador durante unos segundos antes de su uso.
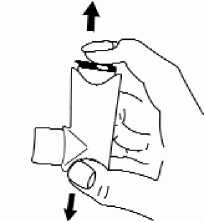
3 Mantener el inhalador vertical, con el fondo del contenedor hacia arriba, y aplicar el pulgar a la base, debajo de la boquilla. Exhalar de forma cómoda, pero no en el interior de la boquilla.
4 El paciente debe poner la boquilla en su boca entre los dientes, y cerrar sus labios sobre ella, pero sin morderla.
5 Justo después de iniciar la aspiración por la boca se debe pulsar la parte superior del inhalador para recibir una ráfaga al tiempo que se efectúa una aspiración firme y profunda.
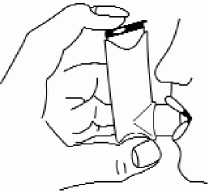
6 Aguantar la respiración, manteniendo el inhalador retirando el inhalador de la boca y el dedo de la parte superior. Debe mantenerse la respiración el máximo de tiempo que sea cómodamente posible.
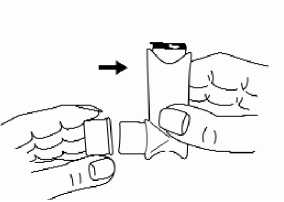
7 Si es necesaria otra descarga, conservar el inhalador vertical y esperar medio minuto
aproximadamente antes de repetir los pasos 2 a 6.
8 Después del uso, se debe reponer siempre la cubierta de la boquilla para mantenerla libre de polvo y pelusa. Colocar dicha cubierta con firmeza.
Limpieza
Para instrucciones sobre la limpieza del inhalador ver Sección 6.6 Contenido del inhalador:
Se debe agitar el pulverizador para comprobar el medicamento que queda en su inhalador. No usar Salbutamol Sandoz si al agitar no se detecta la presencia de líquido en el inhalador.
Uso a baja temperatura:
Si el inhalador ha sido conservado a menos de 0°C, debe calentarse entre las manos durante 2 minutos, agitarlo y descargar dos ráfagas en el aire antes de su uso..
4.3 Contraindicaciones
Hipersensibilidad a la sustancia activa o a alguno de los excipientes.
4.4 Advertencias y precauciones especiales de empleo
El tratamiento del asma normalmente se lleva a cabo conforme a un programa gradualmente ajustado, y la respuesta del paciente debe ser controlada clínicamente y por medio de pruebas de la función pulmonar. Un mayor uso de agonista beta-2 indica un deterioro del asma y la necesidad consecuente de reevaluación del tratamiento.
Los pacientes con asma persistente no deben ser tratados única o principalmente con broncodilatadores.
Salbutamol Sandoz solamente debe usarse con cuidado y si ha sido estrictamente indicado, en los casos siguientes:
- graves trastornos cardiacos, en particular infarto reciente de miocardio
- enfermedad coronaria, cardiomiopatía hipertrófica obstructiva y taquiarritmia
- hipertensión grave y no tratada
- aneurisma
- diabetes difícil de controlar
- feocromocitoma
- hipertiroidismo no controlado
- hipopotasemia no tratada
Se pueden observar efectos cardiovasculares con los fármacos simpaticomiméticos,
incluyendo salbutamol. Datos de postcomercialización, y de la literatura publicada, arrojan cierta evidencia de casos raros de isquemia miocárdica asociada con beta agonistas.
Los pacientes con grave cardiopatía subyacente (p.ej. cardiopatía isquémica, taquiarritmia o grave insuficiencia cardiaca) que reciben salbutamol deben ser instados a recabar consejo médico si experimentan dolor pectoral u otros síntomas de empeoramiento de la patología cardiaca. Se debe prestar atención a la valoración de los síntomas tales como disnea y dolor de pecho, ya que pueden tener origen cardiaco o respiratorio.
La hipopotasemia puede potenciarse en caso de tratamiento concomitante con derivados de xantina, esteroides o diuréticos, así como con hipoxia. Por consiguiente, debe controlarse la concentración de potasio en pacientes con riesgo, en especial durante el tratamiento de asma grave aguda con altas dosis de Salbutamol Sandoz.
¡m
Se recomienda efectuar controles adicionales del nivel de glucosa en sangre al iniciar el tratamiento con Salbutamol Sandoz en diabéticos, dado que los beta2-agonistas aumentan el riesgo de hiperglucemia.
Se pueden observar efectos cardiovasculares con los fármacos simpaticomiméticos, incluyendo salbutamol. Datos de postcomercialización, y de la literatura publicada, arrojan cierta evidencia de casos raros de isquemia miocárdica asociada con beta agonistas.
Los pacientes con grave cardiopatía subyacente (p.ej. cardiopatía isquémica, taquiarritmia o grave insuficiencia cardiaca) que reciben salbutamol deben ser instados a recabar consejo médico si experimentan dolor pectoral u otros síntomas de empeoramiento de la patología cardiaca. Se debe prestar atención a la valoración de los síntomas tales como disnea y dolor de pecho, ya que pueden tener origen cardiaco o respiratorio.
La hipopotasemia puede potenciarse en caso de tratamiento concomitante con derivados de xantina, esteroides o diuréticos, así como con hipoxia. Por consiguiente, debe controlarse la concentración de potasio en pacientes con riesgo, en especial durante el tratamiento de asma grave aguda con altas dosis de Salbutamol Sandoz.
Los bloqueantes no selectivos de los receptores beta adrenérgicos pueden inhibir totalmente el efecto del salbutamol. En pacientes con asma, la administración de medicamentos bloqueantes se asocia con riesgo de grave broncoconstricción. Por consiguiente, normalmente no debieran prescribirse conjuntamente salbutamol y medicamentos bloqueantes beta-adrenérgicos no selectivos (ver sección 4.5).
El deterioro súbito y progresivo del control del asma puede tener consecuencias letales. Si el efecto de Salbutamol Sandoz se vuelve menos eficaz, se debe advertir al paciente que busque asistencia médica, dado que las inhalaciones repetidas no deben retrasar la instauración de otra terapia importante. Procede considerar el tratamiento con corticosteroides a dosis más altas.
Como con otras terapias inhalatorias puede sobrevenir broncospasmo paradójico, con dificultades respiratorias inmediatamente después de la administración. De ser así, el tratamiento debe ser inmediatamente retirado y reemplazado por otro alternativo.
4.5 Interacción con otros medicamentos y otras formas de interacción
La hipopotasemia puede agudizarse en caso de tratamiento concomitante con derivados de xantina, esteroides o diuréticos (ver sección 4.4.).
Normalmente no deben prescribirse conjuntamente el salbutamol y los medicamentos bloqueadores no selectivos de los receptores beta adrenérgicos. En los pacientes con asma, la administración de dichos bloqueadores se asocia con riesgo de grave broncoconstricción.
Con la administración de anestésicos halogenados, p.ej. halotano, metoxiflurano o enflurano, a pacientes tratados con salbutamol, cabe esperar un mayor riesgo de grave disritmia e hipotensión. Si se prevé un tratamiento con anestésicos halogenados, debe ponerse especial cuidado en asegurar de que no se usa salbutamol durante al menos 6 horas antes de iniciar la anestesia.
Los inhibidores de la monoaminoxidasa y los antidepresivos tricíclicos pueden aumentar el riesgo de efectos adversos cardiovasculares.
La hipopotasemia inducida por salbutamol puede incrementar la susceptibilidad de arritmias inducidas por digoxina.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Los estudios en animales han revelado toxicidad para la reproducción. La seguridad en mujeres embarazadas no ha sido establecida. Salbutamol no debe usarse durante el embarazo salvo si es claramente necesario.
Lactancia
Dado que salbutamol probablemente se excreta en la leche materna, su uso en madres lactantes requiere cuidadosa consideración. No se puede excluir el riesgo en el bebe lactante. La decisión de si continuar/discontinuar la lactancia o continuar/discontinuar la terapia con salbutamol debe tomarse teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio de la terapia de salbutamol para la madre.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas se clasifican por sistema orgánico afectado y frecuencia. Los casos de afectación se definen como muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1000 a <1/100), raros (>1/10.000 a <1/1000), muy raros (<1/10.000), y desconocidos (no puede estimarse según datos disponibles).
Dentro de cada grupo de frecuencias, las reacciones adversas se presentan en orden decreciente de gravedad.
Los ensayos clínicos han revelado reacciones adversas muy frecuentes, frecuentes y poco frecuentes. Se han obtenido informes espontáneos postcomercalizacion de reacciones adversas muy raras
|
Sistema orgánico |
Reacciones adversas |
Frecuencia |
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidad, incl. angioedema, colapso, broncospasmo, hipotensión, urticaria |
Muy rara |
|
Trastornos del metabolismo y nutrición |
hipopotasemia |
Rara |
|
Trastornos del sistema |
Temblores, cefalea |
Frecuente |
|
nervioso |
Hiperactividad, trastornos del sueño, hiperexcitabilidad, alucinaciones |
Muy rara |
|
Trastornos cardiacos |
Taquicardia |
Frecuente |
|
Palpitaciones |
Poco frecuente | |
|
Arritmia (p.ej. fibrilación auricular, taquicardia supraventricular y extrasístoles) |
Muy rara | |
|
Isquemia miocárdica* (Ver seccion 4.4) |
Desconocidos |
|
Trastornos vasculares |
Vasodilatación periférica |
Rara |
|
Trastornos respiratorios, torácicos y mediastínicos |
Broncospasmo paradójico |
Muy rara |
|
Trastornos gastrointestinales |
Irritación en boca y garganta |
Poco frecuente |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Calambres musculares |
Frecuente |
* Registrada espontáneamente en los datos de postcomercializacion, por tanto la frecuencia referida es desconocida.
Al inicio del tratamiento pueden aparecer reacciones adversas típicas de los beta2-agonistas, tales como temblores musculoesqueléticos y palpitaciones, y son a menudo dependientes de la dosis.
Como con cualquier otra terapia por inhalación puede sobrevenir tras el tratamiento broncospasmo paradójico con incremento inmediato de las dificultades respiratorias. El caso debe ser tratado inmediatamente con una presentación alternativa o una inhalación broncodilatadora diferente de acción rápida. Hay que cesar inmediatamente el tratamiento con Salbutamol Sandoz, evaluar la situación del paciente y, si es necesario, instaurar una terapia alternativa.
4.9 Sobredosis
Síntomas de sobredosis
En caso de sobredosificación pueden sobrevenir con gran rapidez y, posiblemente en mayor medida, las reacciones adversas citadas.
Los síntomas típicos son:
Taquicardia, palpitaciones, arritmias, agitación, trastornos del sueño, dolor torácico y marcados temblores afectando en particular a las manos, aunque también a todo el cuerpo.
Pueden sobrevenir molestias gastrointestinales incluyendo náuseas, en particular tras intoxicación oral.
Tras dosis de salbutamol excesivas se han observado con poca frecuencia reacciones psicóticas.
En asociación con una sobredosis de salbutamol pueden darse desplazamientos de potasio en el espacio intracelular, con consecuente hipopotasemia y también hiperglucemia.
Medidas terapéuticas en caso de sobredosis
El tratamiento de la sobredosis con beta-simpaticomiméticos es principalmente sintomático.
Cabe recomendar las medidas siguientes:
- Debe considerarse el lavado gástrico si involuntariamente se han ingerido grandes cantidades del medicamento. El carbón activado y los laxantes pueden influir positivamente en la absorción no deseada.
- Los síntomas cardiacos pueden ser tratados con un beta-bloqueador cardioselectivo, pero debe tenerse presente el elevado riesgo de broncospasmia en pacientes con asma bronquial.
- Está indicado el control ECG para supervisión cardiaca.
En caso de hipotensión más pronunciada se recomienda sustitución de volumen (p.ej. sustitutos plasmáticos).
Debe esperarse el desarrollo de hipopotasemia, de donde que se recomiende el control apropiado del equilibrio electrolítico, y si procede, efectuar las sustituciones pertinentes en el caso de un tratamiento precedente con otros medicamentos que puedan inducir hipopotasemia,
hiperlipemia, cetonemia.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico:,agonistas selectivos de los receptores beta-2-adrenérgicos.
Código ATC: R03AC02
Salbutamol es un estimulante de los receptores beta adrenérgicos con un efecto selectivo en los -receptores beta2 de los bronquios y la consiguiente broncodilatación. El efecto broncodilatador aparece a los pocos minutos de la inhalación y alcanza su máximo al cabo de 30-60 minutos. Dura en general al menos 4 horas. Con la inhalación, el efecto broncodilatador no guarda relación con la concentración sérica.
Se ha demostrado que los estimulantes de los receptores beta2- adrenérgicos aumentan el aclaramiento mucociliar reducido presente en la enfermedad pulmonar obstructiva y, así, facilita la expectoración de la secreción viscosa.
El principio activo de Salbutamol Sandoz es el sulfato de salbutamol micronizado, suspendido en un propulsor líquido no freónico (norflurano) .
5.2 Propiedades farmacocinéticas
El principio activo de Salbutamol Sandoz es el sulfato de salbutamol micronizado, suspendido en un propulsor líquido no freónico (norflurano) .
La porción deglutida de la dosis inhalada se absorbe desde el tracto gastrointestinal y experimenta un considerable metabolismo de primer paso a sulfato fenólico. Tanto la sustancia inalterada como el conjugado se excretan principalmente en la orina. La mayor parte de la dosis de salbutamol administrada intravenosamente, oralmente o por inhalación, se excreta en 72 horas. Salbutamol se une a las proteínas plasmáticas en un 10%.
Administrado intravenosamente, salbutamol tiene una semivida de 4 a 6 horas y se elimina en parte por vía renal, en parte metabólicamente a 4’-O-sulfato (sulfato fenólico) inactivo, que se excreta también principalmente en la orina. Las heces constituyen una vía de excreción menor. Tras la administración por vía inhalatoria, el 10% al 20% de la dosis alcanza las vías respiratorias inferiores. El resto es retenido en el sistema de liberación o se deposita en la orofaringe, de la que sigue la deglución. La fracción depositada en las vías respiratorias es absorbida en los tejidos pulmonares y circulación, pero no es metabolizada en el pulmón. Al alcanzar la circulación sistémica se hace accesible al metabolismo hepático y se excreta, principalmente en la orina, como sustancia inalterada y como sulfato fenólico.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción. Los efectos observados en los estudios preclínicos se relacionaron con la actividad beta-adrenérgica de salbutamol.
Como otros potentes agonistas selectivos de los receptores P2 adrenérgicos, salbutamol se ha demostrado teratogénico en ratones cuando se administra subcutáneamente. En un estudio de reproducción, el 9,3% de los fetos se calificaron con paladar hendido a 2,5mg/kg, 4 veces la dosis oral humana máxima. En ratas, el tratamiento durante el embarazo a razón de 0,5, 2,32, 10,75 y 50 mg/kg/día por vía oral, no determinó anomalías fetales significativas. El único efecto tóxico observado fue un aumento de la mortalidad neonatal con la dosis máxima, debido a la falta de cuidado materno. Los estudios de reproducción en conejos con dosis orales de 50 mg/kg/día (es decir, 78 veces la dosis oral humana máxima) han revelado fetos con cambios relacionados con el tratamiento, incluyendo ausencia total o parcial de los párpados (ablefaria), hendidura palatal secundaria (palatosquisis), cambios de osificación en los huesos frontales del cráneo (craneosquisis) y flexión de las extremidades.
¡m
El propulsor no-clorofluorocarbono, HFA 134a, ha demostrado no tener efectos tóxicos a elevadas concentraciones de vapor, mucho más altas que las posiblemente experimentadas por los pacientes, en una amplia gama de especies animales expuesta diariamente por periodos de dos años
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Norflurano (HFA 134a)
Etanol anhidro Ácido oleico
6.2 Incompatibilidades
No aplicable.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No conservar a más de 30°C.
Salbutamol Sandoz debe conservarse en posición tumbada o invertida, con la boquilla hacia abajo.
La lata contiene líquido presurizado. No hay que exponerla a temperaturas superiores a 50°C, ni durante un period corto de tiempo.
Protéjase del calor, luz solar directa y la congelación.
No perforar el envase, ni aun vacío.
6.5 Naturaleza y contenido del envase
Envases de aluminio con válvula dosificadora y aplicador de polipropileno.
Los envases contienen:
200 dosis (equivalentes a 8,5 g de suspensión presurizada para inhalación).
2 x 200 dosis (equivalentes a 2 x 8,5 g de suspensión presurizada para inhalación).
3 x 200 dosis (equivalentes a 3 x 8,5 g de suspensión presurizada para inhalación).
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Para limpiar el inhalador:
1 1 Extraiga el tubo metálico de la caja de plástico del inhalador y quite la cubierta de la boquilla.
2 Lave la caja de plástico y la cubierta de la boquilla en agua tibia. No trate de quitar con un objeto agudo, como una aguja, un posible resto de medicamento alrededor de la boquilla. Puede añadir un detergente suave al agua, y aclarar luego con agua corriente limpia antes de proceder al secado. No sumerja el tubo metálico en el agua.
3 Deje que la caja de plástico y la cubierta de la boquilla sequen en un lugar seco y cálido.
¡m
Evite un calor excesivo.
4 Reponga el tubo y la cubierta de la boquilla.
Para evitar el bloqueamiento del inhalador, es importante limpiarlo al menos una vez a la semana siguiendo las instrucciones dadas a continuación. Si el inhalador se bloquea, se deben seguir las mismas instrucciones de limpieza.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz Farmacéutica S.A Centro Empresarial Osa Mayor Avenida Osa Mayo, n°4 28023 (Aravaca) Madrid España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN Noviembre 2009
10. FECHA DE LA REVISIÓN DEL TEXTO
Agosto 2010
9 de 9