Rhinospray Eucaliptus 1,18 Mg/ Ml Solucion Para Pulverizacion Nasal
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Rhinospray Eucaliptus 1,18 mg/ ml solución para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada 1 ml contiene:
Tramazolina hidrocloruro..............................................................1,18 mg
(equivalente a 83 pg por pulverización)
Excipientes con efecto conocido:
Cloruro de benzalconio........................................... 0,202 mg
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución en envase de 10 ml de solución para pulverización nasal.
Solución límpida, ligeramente amarillenta con olor a eucalipto.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Alivio local y temporal de la congestión nasal en adultos y niños a partir de 6 años.
4.2 Posología y forma de administración La dosis normal es:
Adultos y niños a partir de 6 años: Después de limpiar la nariz, administrar 1- 2 pulverizaciones en cada orificio nasal hasta 3 veces al día, si es necesario.
Población pediátrica
Los niños son más sensibles a los efectos adversos de los simpaticomiméticos. No administrar a niños menores de 6 años.
Forma de administración
El medicamento se administra por vía nasal.
Antes de cada pulverización deben tenerse en cuenta las siguientes instrucciones:
1. Retirar el capuchón protector.
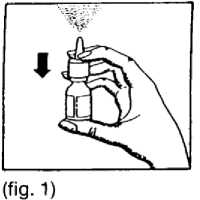
2. Antes de proceder a la primera pulverización deberá accionarse varias veces el microdosificador hasta lograr una pulverización uniforme (ver figura 1). A partir de aquí el microdosificador se encuentra siempre a punto de aplicación inmediata. Limpiar la nariz antes de introducir el cabezal pulverizador en el orificio nasal.
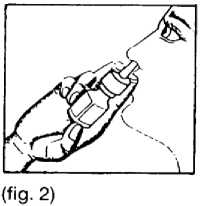
3. La pulverización se realiza accionando el microdosificador una sola vez (ver figura 2). Este proceso se repite en el otro orificio nasal. Durante la pulverización debe realizarse una ligera inspiración por la nariz.
Se recomienda limpiar el cabezal pulverizador después de su uso.
4. Colocar el capuchón protector una vez finalizada la administración.
utilizar por más de 1
Para minimizar el riesgo de transmisión de infecciones, el medicamento no se debe persona.
se deberá suprimir el
Si el paciente empeora o si los síntomas persisten después de 3 días de tratamiento, tratamiento y evaluar la situación clínica.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, otros descongestivos adrenérgicos o a alguno de los excipientes incluidos en la sección 6.1.
Pacientes con glaucoma de ángulo cerrado, rinitis seca y después de cirugía craneal a través de la cavidad nasal.
Pacientes a los que se les ha practicado una hiperfisectomía transesfenoidal o algún tipo de cirugía con exposición a la duramadre.
Rhinospray Eucaliptus no es adecuado en niños menores de 6 años.
4.4 Advertencias y precauciones especiales de empleo
Aunque la acción de Rhinospray Eucaliptus es local, debido al posible riesgo de absorción sistémica se debe evaluar la administración, en pacientes con hipertensión arterial, enfermedades cardiacas, hipertiroidismo, hipertrofia de próstata, feocromocitoma y porfiria.
En pacientes en tratamiento con inhibidores de la monoaminoxidasa (iMAO), antidepresivos tricíclicos, medicamentos vasopresores y antihipertensivos se debe evaluar detenidamente la administración de este medicamento (ver sección 4.5).
El uso prolongado de vasoconstrictores de administración nasal puede provocar inflamación crónica (y por lo tanto bloqueo nasal) y atrofia de la membrana mucosa nasal.
Tras la disminución del efecto terapéutico, podría aparecer una significativa congestión nasal (edema nasal) como señal de congestión de rebote.
Se debe evitar el contacto de Rhinospray Eucaliptus con los ojos con el fin de evitar irritaciones.
Raramente puede aparecer insomnio, en estos casos se deberá evitar la administración del medicamento a última hora de la tarde o por la noche.
Población pediátrica: No administrar este medicamento a niños menores de 6 años.
Uso en mayores de 65 años
Las personas mayores de esta edad son más sensibles a los efectos adversos de este medicamento. Advertencia sobre excipientes:
Este medicamento contiene cloruro de benzalconio. Puede producir inflamación de la mucosa nasal, especialmente con tratamientos de larga duración. Si se sospecha tal reacción (congestión nasal persistente), siempre que sea posible, se debería utilizar un medicamento de uso nasal que no contenga este excipiente.
4.5 Interacción con otros medicamentos y otras formas de interacción
Con el uso simultáneo de fármacos antidepresivos (inhibidores de la monoaminoxidasa o antidepresivos tricíclicos) o fármacos vasopresores, los efectos sobre el sistema cardiovascular pueden producir un incremento de la presión arterial. El uso simultáneo con antidepresivos tricíclicos también puede producir la aparición de arritmias. La interacción con los antihipertensivos, especialmente con aquellos cuya acción involucra al sistema nervioso simpático puede ser compleja y producir varios efectos cardiovasculares.
4.6 Fertilidad, embarazo y lactancia
Embarazo
Se debe evitar el uso durante el embarazo.
Lactancia
Se debe evitar el uso durante la lactancia.
Fertilidad
No se dispone de datos en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas. Sin embargo, debe advertirse a los pacientes que durante el tratamiento pueden experimentar alucinaciones, somnolencia, sedación, mareo y fatiga. Por lo tanto, se recomienda precaución al conducir y utilizar máquinas. Si los pacientes experimentan los efectos mencionados deben evitar la conducción y el manejo de maquinaria.
4.8 Reacciones adversas
Las reacciones adversas han sido ordenadas según frecuencias utilizando la siguiente clasificación:
Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Trastornos del sistema inmunológico
Frecuencia no conocida: Hipersensibilidad, edema cutáneo*
Trastornos psiquiátricos
Poco frecuente: Frecuencia no conocida:
Trastornos del sistema nervioso Poco frecuentes:
Raras:
Frecuencia no conocida:
Trastornos cardíacos
Poco frecuentes: Frecuencia no conocida:
Inquietud
Alucinaciones, insomnio
Cefalea
Mareo, disgeusia Somnolencia, sedación
Palpitaciones Arritmia, taquicardia
Trastornos respiratorios, torácicos y mediastínicos
Frecuentes: Malestar nasal
Poco frecuentes: Edema nasal, sequedad nasal, rinorrea, estornudos
Raras: Epistaxis
Trastornos gastrointestinales Poco frecuentes:
Náuseas
Trastornos de la piel y del tejido subcutáneo Frecuencia no conocida:
Exantema, prurito
Trastornos generales y alteraciones en el lugar de administración
Frecuencia no conocida: Edema de la mucosa*, fatiga
Exploraciones complementarias Frecuencia no conocida:
* como síntoma de hipersensibilidad
Aumento de la presión arterial
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
En caso de sobredosis, especialmente en niños, un incremento de la presión sanguínea y taquicardia, pueden preceder a una bajada de la temperatura, un descenso de la presión arterial, shock y bradicardia refleja.
Al igual que con otros alfa simpaticomiméticos el cuadro clínico de una intoxicación puede ser confuso debido a que se pueden alternar fases de estimulación y de depresión del sistema nervioso central y del sistema cardiovascular.
Especialmente en niños, una intoxicación puede tener como resultado efectos sobre el SNC con convulsiones y coma, bradicardia y depresión respiratoria. Los síntomas de la estimulación del sistema nervioso central (SNC) son ansiedad, agitación, alucinaciones y convulsiones. Los síntomas de la depresión del SNC son descenso de la temperatura corporal, letargo, somnolencia y coma.
Además pueden producirse los siguientes síntomas: midriasis, miosis, sudoración, fiebre, palidez, cianosis de los labios, disfunción cardiovascular incluyendo paro cardiaco, disfunción respiratoria incluyendo fallo respiratorio y paro respiratorio, alteraciones psicológicas.
Tratamiento:
En caso de sobredosificación por vía nasal, se efectúa una limpieza cuidadosa de la nariz.
Además puede ser necesario tratamiento sintomático: en casos leves se aplica respiración artificial con oxígeno. En caso de shock se utilizan expansores del plasma. Si se presentan síntomas anticolinérgicos manifiestos, se utiliza fisostigmina como antídoto (adultos 2 mg, niños 0,5 mg i.m. o i.v. lentamente).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Preparados de uso nasal, Descongestivos y otros preparados nasales para uso tópico. Simpaticomiméticos monofármacos.
Código ATC: R01AA 09.
El principio activo, hidrodoruro de tramazolina, es un a-simpaticomimético que tiene efecto vasoconstrictor y reduce la inflamación de la mucosa nasal. Esto conduce a una descongestión de los conductos nasales.
En pacientes con sinusitis o catarro tubárico se podrá tratar la congestión con este medicamento después de descartar cualquier otra complicación como pueda ser una sinusitis bacteriana.
5.2 Propiedades farmacocinéticas
No se han llevado a cabo estudios de farmacocinética en humanos.
Tras la administración intranasal de este medicamento, la vasoconstricción local habitualmente se produce al cabo de 5 minutos y dura entre 8-10 horas.
La farmacocinética de la tramazolina se ha investigado en rata, conejo y primates.
Absorción
Se ha demostrado una absorción del 50-80% de la dosis tras administración oral o intranasal.
Distribución
La tramazolina y sus metabolitos se distribuyen a todos los órganos internos, aunque la concentración máxima se encuentra siempre en el hígado.
Eliminación
La vida media es de 5-7 horas, y la eliminación de las sustancias relacionadas y metabolitos es principalmente por vía renal.
5.3 Datos preclínicos sobre seguridad
En estudios de toxicidad aguda, realizados en ratas y ratones, se observaron algunos síntomas clínicos tras la administración de este medicamento por vía intraperitoneal, subcutánea y oral, como palidez de la piel, depresión del sistema nervioso central y postración.
No se pudo demostrar toxicidad aguda cuando la sustancia se administró por vía inhalatoria.
Los estudios de toxicidad crónica tras administración por vía intranasal en distintas especies animales no revelaron ninguna evidencia de efectos tóxicos atribuibles a la sustancia.
No se han realizado estudios de mutagénesis. Estudios a largo plazo en ratas no mostraron evidencias de efecto tumorígeno.
En investigaciones toxicológicas sobre la reproducción en distintas especies animales, no se observaron evidencias de teratogenicidad, u otros efectos embriotóxicos. La fertilidad de la rata no se vio afectada, ni
se observaron efectos sobre el desarrollo embrional, fetal ni postnatal, aunque sí se observó una reducción de la producción de leche a dosis de 3 mg/kg peso corporal/día.
No se dispone de estudios clínicos sobre el paso de la tramazolina a leche materna en animales, aunque la concentración máxima de tramazolina que podría esperarse en la leche, excluye cualquier posible efecto sobre el recién nacido.
Datos preclínicos sugieren que el cloruro de benzalconio puede producir un efecto ciliar tóxico, incluyendo inmovilidad irreversible, dependiente de la concentración y del tiempo de exposición y puede producir cambios histopatológicos en la mucosa nasal.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Eucaliptol, mentol, alcanfor, cloruro de benzalconio, glicerol, ácido cítrico monohidratado, hidróxido de sodio, hipromelosa, povidona, sulfato de magnesio, cloruro de magnesio, cloruro de calcio, bicarbonato de sodio, cloruro de sodio y agua purificada.
6.2 Incompatibilidades
No se han descrito.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Frasco de vidrio color topacio de 10 ml con bomba dosificadora (pulverizaciones de 0,07 ml) y aplicador nasal.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim España, S.A.
Prat de la Riba, 50
¡m
08174 Sant Cugat del Vallés (Barcelona)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
56.731
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 23/Octubre/1986 Fecha de renovación de la autorización: 31/Marzo/2008
10. FECHA DE LA REVISIÓN DEL TEXTO 13/11/2015
7 de 7