Revestive 5 Mg Polvo Y Disolvente Para Solucion Inyectable
Información obsoleta, busque otroANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Revestive 5 mg de polvo y disolvente para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un vial de polvo contiene 5 mg de teduglutida*
Tras la reconstitución, cada vial contiene 5 mg de teduglutida en 0,5 ml de disolución, que corresponde a una concentración de 10 mg/ml.
*Un análogo del péptido-2 similar al glucagón (GLP-2) que se produce en las células de Escherichia coli por técnicas de ADN recombinante.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
El polvo es blanco y el disolvente es transparente e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Revestive está indicado para el tratamiento del Síndrome de Intestino Corto en adultos. Los pacientes deben estar estables tras el periodo de adaptación intestinal posterior a la cirugía.
4.2 Posología y forma de administración
El tratamiento debe iniciarse bajo la supervisión de un profesional médico con experiencia en el tratamiento del Síndrome de Intestino Corto (SIC).
El tratamiento no se debe iniciar hasta que se asuma razonablemente que un paciente está estable después de un periodo de adaptación intestinal. Antes del comienzo del tratamiento se deben optimizar y estabilizar el fluido intravenoso y el aporte nutricional.
El efecto del tratamiento se debe evaluar después de 6 meses. La evaluación clínica del médico debe considerar los objetivos de tratamiento individuales y las preferencias del paciente. El tratamiento debe interrumpirse si no se consigue una mejora general en la enfermedad del paciente. En todos los pacientes se deben monitorizar la eficacia y seguridad de forma estrecha y permanente, de acuerdo con las guías clínicas de tratamiento. Se recomienda el tratamiento continuado para los pacientes que han dejado la nutrición parenteral.
Posología
Adultos
La dosis recomendada de Revestive es de 0,05 mg/kg de peso corporal una vez al día. En la sección 6.6 se proporciona una tabla indicando el volumen de inyección por peso corporal.
Debido a la heterogeneidad de la población que padece SIC, debe considerarse cuidadosamente la disminución monitorizada de la dosis diaria en algunos pacientes, con el fin de optimizar la tolerabilidad del tratamiento. Si se olvida una dosis, ésta debe tomarse lo antes posible en el mismo día.
Poblaciones especiales Pacientes de edad avanzada
No es necesario ajustar la dosis en pacientes mayores de 65 años de edad.
Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve. En pacientes con insuficiencia renal moderada y grave (aclaramiento de creatinina inferior a 50 ml/min) y nefropatía terminal, la dosis diaria se debe reducir un 50% (ver sección 5.2).
Insuficiencia hepática
No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve o moderada, según un estudio realizado en sujetos de grado B en la clasificación Child-Pugh. Revestive no se ha estudiado en pacientes con insuficiencia hepática grave (ver secciones 4.4 y 5.2).
Población pediátrica
No se ha establecido la seguridad y la eficacia de Revestive en niños menores de 18 años de edad (ver sección 5.1).
Forma de administración
La solución reconstituida debe administrarse por inyección subcutánea una vez al día, alternando los sitios entre uno de los cuatro cuadrantes del abdomen. En caso de dificultad para la inyección en el abdomen por dolor, cicatrices o endurecimiento del tejido, se puede administrar también en el muslo. Revestive no debe administrarse por vía intravenosa o intramuscular.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1, o a trazas de residuos de tetraciclinas.
Posible neoplasia maligna o neoplasia maligna activa.
Pacientes con antecedentes de neoplasia maligna en el tracto gastrointestinal, incluido el sistema hepatobiliar, durante los últimos 5 años.
4.4 Advertencias y precauciones especiales de empleo
Pólipos colorrectales
En el momento de comenzar el tratamiento con Revestive, se debe realizar una colonoscopia con eliminación de pólipos. Se recomienda realizar colonoscopias de seguimiento una vez al año (o imágenes alternativas) durante los dos primeros años del tratamiento con Revestive. Se recomienda realizar colonoscopias posteriores a intervalos mínimos de cinco años. Se debe realizar una evaluación individual sobre al aumento de la frecuencia de las revisiones en base a las características del paciente (ej. edad, enfermedad subyacente). Ver también sección 5.1. Si se observa un pólipo, se recomienda el cumplimiento de las directrices vigentes para el seguimiento de pólipos. En caso de neoplasia maligna, debe suspenderse el tratamiento con Revestive (ver sección 4.3).
Neoplasia gastrointestinal, incluido el sistema hepatobiliar
En el estudio de carcinogenicidad en ratas, se encontraron tumores benignos en el intestino delgado y los conductos biliares extrahepáticos. Estas observaciones no han sido confirmadas en estudios clínicos de más de un año de duración. Si se detecta alguna neoplasia maligna, se debe extirpar. En caso de neoplasia maligna, debe suspenderse el tratamiento con Revestive (ver secciones 4.3 y 5.3).
Vesícula biliar y conductos biliares
Se han notificado casos de colecistitis. colangitis y colelitiasis en estudios clínicos. En caso de síntomas relacionados con la vesícula o los conductos biliares, se debe evaluar de nuevo la necesidad de continuar el tratamiento con Revestive.
Pancreopatías
En estudios clínicos se han notificado acontecimientos adversos pancreáticos, tales como pancreatitis aguda o crónica, estenosis del conducto pancreático, infección de páncreas y aumento de amilasa y lipasa en sangre. En caso de acontecimientos adversos pancreáticos, se debe evaluar de nuevo la necesidad de continuar el tratamiento con Revestive.
Monitorización del intestino delgado, vesícula biliar y conductos biliares, y páncreas.
Se debe mantener a los pacientes con SIC bajo una estrecha vigilancia de acuerdo a las guías clínicas de tratamiento. Normalmente esto incluye la monitorización de la función del intestino delgado, vesícula biliar y conductos biliares, y páncreas, para detectar signos y síntomas. Si fuese necesario también se podrán realizar pruebas analíticas adicionales, y utilizar técnicas apropiadas de imagen.
Obstrucción intestinal
Se han notificado casos de obstrucción intestinal en estudios clínicos. En caso de obstrucción intestinal, se debe evaluar de nuevo la necesidad de continuar el tratamiento con Revestive.
Cardiovascular
Debido al aumento de absorción hídrica, se debe monitorizar a los pacientes con cardiopatía, como insuficiencia cardíaca e hipertensión, para detectar hipervolemia, especialmente durante el inicio del tratamiento. Se advertirá a los pacientes que deben ponerse en contacto con su médico en caso de aumento repentino de peso, edema maleolar y/o disnea. En general, la hipervolemia puede prevenirse mediante la evaluación apropiada y a tiempo de las necesidades de nutrición parenteral. Esta evaluación debe realizarse con mayor frecuencia durante los primeros meses de tratamiento. En caso de un empeoramiento significativo de la cardiopatía, se debe evaluar de nuevo la necesidad de continuar el tratamiento con Revestive.
Medicamentos concomitantes
Se debe monitorizar estrechamente a los pacientes que reciban, de forma concomitante, medicamentos por vía oral que requieran un ajuste de la dosis o que presenten un margen terapéutico estrecho, debido al posible aumento de su absorción (ver sección 4.5).
Patologías clínicas especiales
Revestive no se ha estudiado en pacientes con enfermedades concomitantes graves y clínicamente inestables (ej. cardiovasculares, respiratorias, renales, infecciosas, endocrinas, hepáticas, o SNC), ni en pacientes que presentaron neoplasias malignas en los últimos cinco años (ver sección 4.3). Deben tomarse precauciones a la hora de prescribir Revestive.
Insuficiencia hepática
No se ha estudiado Revestive en pacientes con insuficiencia hepática grave. Los datos disponibles de utilización en pacientes con insuficiencia hepática moderada no sugieren la necesidad de limitar su uso.
Suspensión del tratamiento
Debido al riesgo de deshidratación, la suspensión del tratamiento con Revestive se debe realizar con precaución.
Excipientes
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
Se debe tener precaución cuando se administre Revestive a personas con hipersensibilidad conocida a las tetraciclinas.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones fármaco-fármaco. Un estudio in vitro apunta a que teduglutida no inhibe las enzimas del citocromo P450 metabolizadoras del fármaco. En base al efecto farmacodinámico de teduglutida, existe un riesgo de aumento de la absorción de los medicamentos que se usan de forma concomitante (ver sección 4.4).
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos relativos al uso de Revestive en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción (ver sección 5.3). Como medida de precaución, es preferible evitar el uso de Revestive durante el embarazo.
Lactancia
Se desconoce si teduglutida se excreta en la leche materna. En ratas, la concentración media de teduglutida en la leche fue inferior al 3% de la concentración plasmática materna tras una única inyección subcutánea de 25 mg/kg. No se puede excluir el riesgo en recién nacidos/lactantes. Como medida de precaución, es preferible evitar el uso de Revestive durante la lactancia.
Fertilidad
No se dispone de datos relativos al efecto de teduglutida sobre la fertilidad en seres humanos. Los estudios realizados en animales no han mostrado alteración en la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Revestive sobre la capacidad para conducir y utilizar máquinas es pequeña. Sin embargo, se han notificado casos de síncope en estudios clínicos (ver sección 4.8). En estos casos, la capacidad para conducir y utilizar máquinas puede verse afectada.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas se obtuvieron a partir de 2 estudios clínicos con Revestive, controlados con placebo en 109 pacientes con SIC tratados con dosis de 0,05 mg/kg/día y 0,10 mg/kg/día durante un máximo de 24 semanas. Aproximadamente el 52% de los pacientes tratados con Revestive presentaron reacciones adversas (frente al 36% del grupo con placebo). Las reacciones adversas notificadas con mayor frecuencia fueron dolor y distensión abdominal (49%), infecciones en las vías respiratorias (28%), náuseas (27%), reacciones en el lugar de la inyección (21%), cefalea (17%), vómitos (14%) y edema periférico (10%). Aproximadamente el 38% de los pacientes con estoma presentaron complicaciones en el estoma gastrointestinal. La mayoría de estas reacciones fueron de intensidad leve a moderada.
No se han identificado nuevas señales de seguridad en pacientes expuestos a 0,05 mg/kg/día de Revestive durante un máximo de 30 meses en un estudio de extensión abierto a largo plazo.
Tabla de reacciones adversas
A continuación se presentan las reacciones adversas según la clasificación de órganos del sistema MedDRA y su frecuencia. Las frecuencias se definen como muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1000); muy raras (< 1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Frecuencia Sistema de clasificación de órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
|
Infecciones e infestaciones |
Infección respiratoria |
Gripe | |
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito | ||
|
Trastornos psiquiátricos |
Ansiedad Trastornos del sueño | ||
|
Trastornos del sistema nervioso |
Cefalea |
Parestesia | |
|
Trastornos cardíacos |
Insuficiencia cardíaca congestiva | ||
|
Trastornos vasculares |
Eritema |
Síncope | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea Tos | ||
|
Trastornos gastrointestinales |
Dolor y distensión abdominales Vómitos Náuseas Complicación en el estoma gastrointestinal* |
Pancreatitis Obstrucción intestinal | |
|
Trastornos hepatobiliares |
Colestasis y colecistitis | ||
|
Trastornos de la piel y del tejido subcutáneo |
Dermatitis alérgica | ||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Artralgia | ||
|
Trastornos renales y urinarios |
Cólico nefrítico Sensibilidad a palpación en la zona del costado | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Edema periférico Reacción en el lugar de la inyección |
Dolor torácico Sudores nocturnos | |
|
Exploraciones complementarias |
Aumento de la proteína C reactiva |
* Complicación en el estoma gastrointestinal (inflamación del estoma y complicaciones asociadas) se considera más un signo de eficacia que una reacción adversa.
Descripción de reacciones adversas seleccionadas
Inmunogenicidad
Tal y como ocurre con los medicamentos que contienen péptidos, debido a sus potenciales propiedades inmunogénicas, es posible que la administración de Revestive desencadene la síntesis de anticuerpos. En estudios de fase III en pacientes con SIC que recibieron Revestive durante > 2 años, el 39% de los pacientes desarrolló anticuerpos frente a teduglutida y el 21% anticuerpos frente a proteínas de E. coli (proteínas celulares residuales del huésped procedentes del proceso de fabricación). La formación de anticuerpos no se ha asociado a hallazgos de seguridad clínicamente relevantes, a una menor eficacia ni a cambios en la farmacocinética de Revestive.
Reacciones en el lugar de la inyección
Las reacciones en el lugar de la inyección aparecieron en el 21% de los pacientes de SIC tratados con Revestive. Parece ser que las reacciones fueron dependientes de la dosis y ocurrieron con una frecuencia similar en los pacientes que recibieron la dosis recomendada de 0,05 mg/kg/día de Revestive y en los pacientes que recibieron placebo (las reacciones en el lugar de la inyección se dieron en el 12% de los pacientes tratados con placebo, en el 13% de los que recibieron 0,05 mg/kg/día de Revestive y en el 41% de los que recibieron 0,10 mg/kg/día de Revestive). Las reacciones fueron eritema, hematoma y dolor en el lugar de la inyección (ver también sección 5.3).
Proteína C reactiva
Se han observado pequeños aumentos de la proteína C reactiva de aproximadamente 25mg/l durante los primeros 7 días de tratamiento con Revestive, que disminuyeron durante las inyecciones diarias continuadas. Tras 24 semanas de tratamiento con Revestive, los pacientes mostraron un ligero aumento global de la proteína C reactiva de 1,5 mg/l de promedio. Estos cambios no se asociaron con cambios en otros parámetros de laboratorio ni con síntomas clínicos notificados. No hubo aumentos medios clínicamente relevantes de la proteína C reactiva desde el inicio después del tratamiento a largo plazo con Revestive durante un máximo de 30 meses.
Notificación de sospechas de reacciones adversas
¡istema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Anexo V.
4.9 Sobredosis
La dosis máxima de teduglutida estudiada durante el desarrollo clínico fue de 86 mg/día durante 8 días. No se observaron reacciones adversas sistémicas inesperadas (ver sección 4.8).
En caso de sobredosis, el profesional médico debe monitorizar estrechamente al paciente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: otros productos para el aparato digestivo y metabolismo, código ATC: A16AX08.
Mecanismo de acción
Se sabe que el análogo del péptido-2 similar al glucagón (GLP 2) humano, es un péptido que secretan las células L intestinales y aumenta el flujo sanguíneo portal e intestinal, inhibe la secreción ácida del estómago y reduce la motilidad intestinal. Teduglutida es un análogo del GLP 2. En varios estudios preclínicos, se ha observado que teduglutida preserva la integridad de la mucosa promoviendo la reparación y el crecimiento normal del intestino mediante un aumento de la longitud de las vellosidades intestinales y la profundidad de las criptas.
Efectos farmacodinámicos
Al igual que el GLP 2, teduglutida tiene una longitud de 33 aminoácidos con una sustitución de un residuo de alanina por uno de glicina en la segunda posición del extremo N-terminal. La variación de un solo aminoácido con respecto al GLP 2 natural tiene como resultado una resistencia a la degradación in vivo por la enzima dipeptidil peptidasa IV (DPP IV), lo cual prolonga la semivida. Teduglutida aumenta la longitud de las vellosidades y la profundidad de las criptas del epitelio intestinal.
En base a los hallazgos derivados de los estudios preclínicos (ver sección 5.3) y al mecanismo de acción propuesto de efectos tróficos sobre la mucosa intestinal, parece haber un riesgo de aumento de neoplasias del intestino delgado y/o del colon. Los estudios clínicos realizados no pudieron excluir ni confirmar el aumento de riesgo. Durante el trascurso de los ensayos, aparecieron varios casos de pólipos benignos en el colon, aunque la frecuencia no aumentó en comparación con los pacientes tratados con placebo. Además de la necesidad de realizar una colonoscopia con eliminación de pólipos al inicio del tratamiento (ver sección 4.4.), debe evaluarse la necesidad de aumentar los periodos de revisión en base a las características de cada paciente (ej. edad y enfermedades subyacentes, incidencia previa de pólipos etc.).
Eficacia clínica
Revestive se ha estudiado en 17 pacientes con SIC asignados a cinco grupos de tratamiento con dosis de teduglutida de 0,03, 0,10 o 0,15 mg/kg una vez al día o 0,05 o 0,075 mg/kg dos veces al día, en un ensayo abierto y multicéntrico de determinación de dosis. El tratamiento favoreció la absorción hídrica gastrointestinal, en aproximadamente 750-1000 ml/día, mejoró la absorción de macronutrientes y electrolitos, redujo la excreción estomal o fecal de líquidos y macronutrientes y favoreció las principales adaptaciones estructurales y funcionales en la mucosa intestinal. Las adaptaciones estructurales fueron de naturaleza transitoria y recuperaron los niveles basales en tres semanas desde la suspensión del tratamiento.
En el estudio pivotal en fase III controlado con placebo y doble ciego en pacientes con SIC que necesitaban nutrición parenteral, 43 pacientes fueron aleatorizados para recibir una dosis de Revestive de 0,05 mg/kg/día y 43 pacientes para recibir placebo durante un máximo de 24 semanas.
La proporción de sujetos tratados con Revestive que alcanzaron una reducción de entre el 20% y el 100% de la nutrición parenteral en las semanas 20 y 24 mostró una diferencia estadísticamente significativa de la de pacientes con placebo (27 de 43 sujetos, 62,8%, frente a 13 de 43 pacientes, 30,2%, p = 0,002). El tratamiento con Revestive dio lugar a una reducción de 4,4 l/semana en las necesidades de nutrición parenteral (desde un valor basal pretratamiento de 12,9 litros) frente a la de 2,3 l/semana (desde un valor basal pretratamiento de 13,2 litros) del placebo a las 24 semanas. Veintiún pacientes tratados con Revestive (48,8%) frente a 9 con placebo (20,9%) alcanzaron al menos una reducción de un día en la administración de nutrición parenteral (p = 0,008).
El noventa y siete por ciento de los pacientes (37 de 39 pacientes tratados con teduglutida) que completaron el estudio controlado con placebo decidieron continuar en un estudio de extensión a largo plazo, en el que todos los pacientes recibieron 0,05 mg/kg de Revestive al día durante un máximo de 2 años más. En total 88 pacientes participaron en este estudio de extensión, de los cuales 39 habían sido tratados con placebo y 12 incluidos, pero no aleatorizados, en el estudio anterior; 65 de los 88 pacientes completaron el estudio de extensión. En todos los grupos expuestos a Revestive, continuó existiendo evidencia del aumento de la respuesta al tratamiento hasta los 2,5 años, en cuanto a la reducción del volumen de nutrición parenteral, obteniéndose días adicionales por semana sin nutrición parenteral y alcanzando un abandono del apoyo parenteral.
Treinta (30) de los 43 pacientes tratados con Revestive del estudio pivotal que participaron en el estudio de extensión completaron un total de 30 meses de tratamiento. De ellos, 28 pacientes (93%) lograron una reducción del 20% o más del apoyo parenteral. De los pacientes con respuesta en el estudio pivotal que completaron el estudio de extensión, 21 de los 22 (96%) mantuvieron su respuesta a Revestive después de 2 años más de tratamiento continuado.
La reducción media en la nutrición parenteral (n=30) fue de 7,55 l/semana (una reducción del 65,6% desde el inicio). Diez sujetos abandonaron el apoyo parenteral mientras estaban recibiendo el tratamiento con Revestive durante 30 meses. A los sujetos se les mantuvo el tratamiento con Revestive incluso cuando ya no necesitaban más nutrición parenteral. Estos 10 sujetos habían necesitado apoyo nutricional parenteral entre 1,2 y 15,5 años, y con anterioridad al tratamiento con Revestive habían necesitado entre 3,5 l/semana y 13,4 l/semana de apoyo nutricional parenteral. Al final del estudio, 21 (70%), 18 (60%) y 18 (60%) de los 30 sujetos que habían completado el estudio lograron una reducción de 1, 2, o 3 días por semana en el apoyo parenteral, respectivamente.
De los 39 sujetos a quienes se les administró placebo, 29 completaron 24 meses de tratamiento con Revestive. La reducción media en la nutrición parenteral fue de 3,11 l/semana (una reducción adicional del 28,3%). Dieciséis (55,2%) de los 29 sujetos que completaron el estudio lograron una reducción del 20% o más de nutrición parenteral. Al final del estudio, 14 (48,3%), 7 (24,1%) y 5 (17,2%) pacientes lograron una reducción de 1, 2, o 3 días por semana de nutrición parenteral, respectivamente. Dos de los sujetos abandonaron la nutrición parenteral mientras se les estaba administrando Revestive.
De los 12 sujetos no aleatorizados en el estudio pivotal, 6 completaron 24 meses de tratamiento con Revestive. La reducción media en la nutrición parenteral fue de 4,0 l/semana (una reducción del 39,4% desde el inicio, el principio del estudio de extensión) y 4 de los 6 que completaron el estudio (66,7%) lograron una reducción del 20% o más de nutrición parenteral. Al final del estudio, 3 (50%), 2 (33%) y 2 (33%) pacientes lograron una reducción de 1, 2, o 3 días por semana de nutrición parenteral, respectivamente. Uno de los sujetos abandonó la nutrición parenteral mientras se le estaba administrando Revestive.
En otro estudio en fase III controlado con placebo y doble ciego en pacientes con SIC que necesitaban nutrición parenteral, los pacientes recibieron una dosis de teduglutida de 0,05 mg/kg/día (n = 35), una dosis de 0,10 mg/kg/día (n = 32) o placebo (n = 16) durante un máximo de 24 semanas.
Los primeros resultados de análisis de eficacia del estudio no mostraron diferencias estadísticamente significativas entre el grupo que recibió 0,10 mg/kg/día de teduglutida y el que recibió placebo, mientras que la proporción de sujetos que estaban recibiendo la dosis recomendada de teduglutida de 0,05 mg/kg/día y que alcanzó, como mínimo, una reducción del 20% de la nutrición parenteral en las semanas 20 y 24 fue estadísticamente diferente, frente a los que recibieron placebo (46% frente al 6.3%, p < 0,01). El tratamiento con Revestive dio lugar a una reducción de 2,5 l/semana en las necesidades de nutrición parenteral (desde un valor basal pretratamiento de 9,6 litros) frente a 0,9 l/semana (desde un valor basal pretratamiento de 10,7 litros) para placebo a las 24 semanas.
El tratamiento con Revestive indujo la prolongación del epitelio de absorción aumentando de forma significativa la longitud de las vellosidades del intestino delgado.
Sesenta y cinco pacientes participaron en un estudio de seguimiento del SIC durante un periodo adicional de tratamiento de hasta 28 semanas. Los pacientes tratados con Revestive mantuvieron la asignación previa de la dosis a lo largo de la fase de extensión, mientras que los pacientes tratados con placebo fueron aleatorizados para recibir tratamiento activo de 0,05 mg/kg/día o 0,10 mg/kg/día .
De los pacientes que alcanzaron una reducción de al menos el 20% de la nutrición parenteral en las semanas 20 y 24 en el estudio inicial, el 75% mantuvo esta respuesta con Revestive después de hasta 1 año de tratamiento continuado.
La reducción media del volumen de nutrición parenteral semanal fue de 4,9 l/semana (reducción del 52% con respecto al valor basal) tras un año de tratamiento continuado con teduglutida.
Dos pacientes que recibieron la dosis recomendada de teduglutida abandonaron la nutrición parenteral a las 24 semanas. Otro paciente más abandonó gradualmente la nutrición parenteral en el estudio de extensión.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Revestive en uno o más grupos de la población pediátrica en el tratamiento del SIC (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Teduglutida se absorbió rápidamente en los lugares de inyección subcutánea con concentraciones plasmáticas máximas aproximadamente a las 3-5 horas después de la administración de la dosis, a todas las dosis. La biodisponibilidad absoluta de teduglutida administrada por vía subcutánea es elevada (88%). No se observó acumulación de teduglutida tras la administración subcutánea repetida.
Distribución
Después de la administración por vía subcutánea, teduglutida presenta un volumen de distribución aparente de 26 litros en pacientes con SIC.
Biotransformación
Se desconoce el metabolismo de teduglutida. Al tratarse de un péptido, es probable que siga el mecanismo principal del metabolismo peptídico.
Eliminación
La semivida de eliminación terminal de teduglutida es de aproximadamente 2 horas. Tras la administración intravenosa, el aclaramiento plasmático de teduglutida fue aproximadamente de 127 ml/h/kg, lo cual es equivalente a la velocidad de filtración glomerular (VFG). La eliminación renal se confirmó en un estudio farmacocinético en sujetos con insuficiencia renal. No se observó acumulación de teduglutida tras administraciones repetidas por vía subcutánea.
Linealidad de la dosis
La velocidad y el grado de absorción de teduglutida son proporcionales a la dosis, tanto a dosis únicas como a dosis repetidas de hasta 20 mg, por vía subcutánea.
Farmacocinética en subpoblaciones
Sexo
No se han observado diferencias clínicamente relevantes entre ambos sexos.
Población de edad avanzada
En un estudio en fase I no pudieron detectarse diferencias en la farmacocinética de teduglutida en sujetos sanos menores de 65 años comparada con la de mayores de 65 años. La experiencia en sujetos mayores de 75 años es limitada.
Insuficiencia hepática
En un estudio en fase I se analizó el efecto de la insuficiencia hepática sobre la farmacocinética de teduglutida tras la administración subcutánea de 20 mg. La exposición máxima y el grado de exposición total de teduglutida tras una única dosis subcutánea de 20 mg fueron menores (entre un 10% y un 15%) en sujetos con insuficiencia hepática moderada que en sujetos sanos utilizados como control.
Insuficiencia renal
En un estudio en fase I se analizó el efecto de la insuficiencia renal sobre la farmacocinética de teduglutida tras la administración subcutánea de 10 mg. En casos de insuficiencia renal progresiva hasta incluyendo nefropatía terminal, los principales parámetros farmacocinéticos de teduglutida aumentaron hasta un factor de 2,6 (AUCmf) y de 2,1 (Cmáx), en comparación con sujetos sanos.
5.3 Datos preclínicos sobre seguridad
Se han observado hiperplasia de la vesícula biliar, los conductos biliares hepáticos y los conductos pancreáticos, en estudios de toxicidad subcrónica y crónica. Estas observaciones estuvieron posiblemente asociadas a la farmacología esperada de teduglutida y fueron reversibles, en mayor o menor medida, en un periodo de recuperación de 8 a 13 semanas, tras administración crónica.
Reacciones en el lugar de la inyección
En estudios preclínicos se encontraron inflamaciones granulomatosas graves asociadas al lugar de la inyección.
Carcinogenicidad / mutagenicidad
La batería de pruebas estándar de genotoxicidad para teduglutida fue negativa.
En un estudio de carcinogenicidad en ratas, las neoplasias benignas asociadas al tratamiento incluyeron tumores del epitelio de los conductos biliares en machos expuestos a niveles de teduglutida en plasma de aproximadamente 32 y 155 veces más elevado que el obtenido en pacientes a los que se les administró la dosis diaria recomendada (incidencia de 1 de 44 y 4 de 48, respectivamente). Se observaron adenomas de la mucosa del yeyuno en 1 de 50 ratas macho, y en 5 de 50 ratas macho expuestas a niveles de teduglutida en plasma de aproximadamente 10 y 155 veces por encima del obtenido en pacientes a los que se les administró la dosis diaria recomendada. Además, se observó un adenocarcinoma de yeyuno en una rata macho a la que se le administró la dosis más baja probada (margen de exposición plasmática animal:humano aproximadamente 10 veces superior).
Toxicidad para la función reproductora y el desarrollo
Se han llevado a cabo estudios de toxicidad para la función reproductora y el desarrollo con teduglutida en ratas y conejos a dosis de 0,2 , 10 mg/kg/día y 50 mg/kg/día por vía subcutánea. En estudios para analizar la fertilidad, el desarrollo embriofetal y el desarrollo pre y posnatal, teduglutida no se asoció a efectos sobre la actividad reproductora ni parámetros prenatales o del desarrollo. Los datos farmacocinéticos mostraron que la exposición a teduglutida de fetos de conejo y ratas lactantes fue muy baja.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo
L-histidina
Manitol
Fosfato de sodio monohidrato Fosfato disódico, heptahidrato
Hidróxido de sodio (ajuste de pH) Ácido clorhídrico (ajuste de pH)
Disolvente
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Período de validez
4 años.
Tras la reconstitución, desde un punto de vista microbiológico, la solución debe utilizarse inmediatamente. Aún así, se ha observado que el producto es física y químicamente estable durante 3 horas a 25°C.
6.4 Precauciones especiales de conservación
Conservar a menos de 25 °C.
No congelar.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
5 mg de teduglutida en forma de polvo en vial (vidrio) con un tapón de goma (bromobutilo).
0,5 ml de disolvente en jeringa precargada (vidrio) y émbolo (plástico) para acoplar la jeringa precargada.
Tamaños de envase de 28 viales de polvo, 28 jeringas precargadas y 6 émbolos.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La determinación del número de viales necesarios para la administración de una dosis debe basarse en el peso del paciente y la dosis recomendada de 0,05 mg/kg/día (ver volúmenes de inyección en la tabla a continuación). En cada consulta, el médico debe pesar al paciente, determinar la dosis diaria para administrarle hasta la siguiente consulta e informar al paciente según corresponda.
A continuación se presenta una tabla con el volumen de inyección por peso corporal:
|
Peso corporal |
Volumen a inyectar |
|
38-41 kg |
0,20 ml |
|
42-45 kg |
0,22 ml |
|
46-49 kg |
0,24 ml |
|
50-53 kg |
0,26 ml |
|
54-57 kg |
0,28 ml |
|
58-61 kg |
0,30 ml |
|
62-65 kg |
0,32 ml |
|
66-69 kg |
0,34 ml |
|
70-73 kg |
0,36 ml |
|
74-77 kg |
0,38 ml |
|
78-81 kg |
0,40 ml |
|
82-85 kg |
0,42 ml |
|
86-89 kg |
0,44 ml |
|
90-93 kg |
0,46 ml |
La jeringa precargada debe ensamblarse con el émbolo y la aguja para la reconstitución.
El polvo del vial debe disolverse añadiendo todo el disolvente de la jeringa precargada.
No se debe agitar el vial, pero se puede rodar entre las palmas de las manos y suavemente de arriba abajo una vez. Cuando en el vial se haya formado una solución transparente e incolora, se debe succionar la solución con una jeringa para inyección de 1 ml con escala a intervalos de 0,02 ml o menos (no incluida en el envase).
Si se necesitan dos viales, el procedimiento se debe repetir para el segundo vial y preparar la solución adicional para succionar en la jeringa utilizada para el primer vial. Cualquier volumen que exceda la dosis prescrita en ml debe expulsarse y desecharse.
La solución debe inyectarse por vía subcutánea en una zona despejada del abdomen, o si no es posible, en el muslo (ver sección 4.2. Forma de administración) utilizando una aguja para inyección subcutánea.
Las instrucciones detalladas sobre la preparación y la inyección de Revestive se adjuntan en el prospecto para el paciente.
La solución no debe utilizarse si presenta un aspecto turbio o contiene partículas.
De un solo uso.
El medicamento que no haya sido utilizado y todos los materiales de desecho deben ser eliminados de acuerdo a la normativa local.
Todas las agujas y jeringas deben desecharse en contenedores para eliminación de objetos punzantes.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
NPS Pharma Holdings Limited Grand Canal House 1 Grand Canal Street Upper
Dublin 4 Irlanda
Tel.: +800 6774 4357
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/787/001
LA
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE AUTORIZACIÓN
Fecha de la primera autorización: 30 de agosto de 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico.
Boehringer Ingelheim RCV GmbH & Co KG Dr. Boehringer-Gasse 5-11 A-1121 Vienna Austria
Nombre y dirección del fabricante responsable de la liberación de los lotes
Almac Pharma Services Seagoe Industrial Estate Craigavon County Armagh BT63 5UA Reino Unido
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o
como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
• Obligación de llevar a cabo medidas post-autorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Registro Internacional de Síndrome de Intestino Corto. |
Se proporcionarán |
|
Estudio post-autorización (EPA) para reunir datos adicionales de seguridad, con el fin de aclarar aún más el riesgo identificado y potencial en el PGR, en base a protocolos aprobados por el CHMP. |
cuatro informes provisionales durante seis meses tras la fecha de cierre de |
|
Se deben proporcionar datos provisionales al EPA cada dos años. |
datos (ej., Q3 2015, Q3 2017, Q3, 2019, |
|
and Q3 2021). | |
|
Informe final del estudio |
Q3 2022 |
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CARTÓN
1. NOMBRE DEL MEDICAMENTO
Revestive 5 mg polvo y disolvente para solución inyectable Teduglutida
2. PRINCIPIO(S) ACTIVO(S)
Un vial de polvo contiene 5 mg de teduglutida. Tras la reconstitución, cada vial contiene 5 mg de teduglutida en 0,5 ml de disolución, que corresponde a una concentración de 10 mg/ml.
3. LISTA DE EXCIPIENTES
Polvo: L-histidina, manitol, fosfato de sodio monohidrato, fosfato disódico heptahidrato, hidróxido de sodio (ajuste de pH), ácido clorhídrico (ajuste de pH).
Disolvente: Agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable 5 mg de polvo en vial / 0,5 mg de disolvente en jeringa precargada.
Tamaño de envase de 28 unidades (con 6 émbolos).
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Conservar a menos de 25 °C.
No congelar.
Tras la reconstitución, desde un punto de vista microbiológico, la solución debe utilizarse inmediatamente. Aún así, se ha demostrado la estabilidad física y química durante 3 horas a 25°C.
|
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN UTILIZADO Y DE LOS MATERIALES DERIVADOS CORRESPONDA) |
DEL DE |
MEDICAMENTO NO SU USO (CUANDO | ||
|
11. NOMBRE Y DIRECCIÓN DEL COMERCIALIZACIÓN |
TITULAR DE |
LA |
AUTORIZACIÓN |
DE |
NPS Pharma Holdings Limited Grand Canal House 1 Grand Canal Street Upper Dublin 4 Irlanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/787/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Revestive
|
INFORMACIÓN MÍNIMA QUE DEBE ACONDICIONAMIENTOS PRIMARIOS |
INCLUIRSE |
EN |
PEQUEÑOS |
|
ETIQUETA DEL VIAL |
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Revestive 5 mg polvo para solución inyectable
Teduglutida
Vía subcutánea.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 mg de Teduglutida
6. OTROS
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DE LA JERINGA PRECARGADA CON DISOLVENTE
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Disolvente para Revestive Vía subcutánea.
|
2. |
FORMA DE ADMINISTRACIÓN |
|
3. |
FECHA DE CADUCIDAD |
|
CAD |
4. NÚMERO DE LOTE
|
Lote | |
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES |
|
0,5 ml | |
|
6. |
OTROS |
Para reconstitución
B. PROSPECTO
Revestive 5 mg polvo y disolvente para solución inyectable
Teduglutida
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Revestive y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Revestive
3. Cómo usar Revestive
4. Posibles efectos adversos
5. Conservación de Revestive
6. Contenido del envase e información adicional
1. Qué es Revestive y para qué se utiliza
Revestive contiene el principio activo teduglutida. Mejora la absorción intestinal de nutrientes y líquidos de su tracto gastrointestinal (intestino).
Revestive se utiliza para el tratamiento del Síndrome de Intestino Corto en adultos. El Síndrome de Intestino Corto es un trastorno que se produce por una incapacidad de absorber los nutrientes de los alimentos y el agua en su recorrido por el intestino. Generalmente está causado por la extirpación quirúrgica, parcial o total, del intestino delgado.
2. Qué necesita saber antes de empezar a usar Revestive
No use Revestive
- si es alérgico a la teduglutida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6) o a trazas de residuos de tetraciclinas.
- si padece o cree que puede padecer cáncer.
- si ha padecido cáncer en alguna parte del tracto gastrointestinal, como el hígado, la vesícula biliar o los conductos biliares, en los últimos cinco años.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Revestive:
- si padece insuficiencia hepática grave. Su médico lo tendrá en cuenta a la hora de recetarle este medicamento.
- si padece alguna enfermedad cardiovascular (que afecta al corazón y/o de los vasos sanguíneos) tales como presión sanguínea alta (hipertensión) o corazón débil (insuficiencia cardíaca). Los síntomas incluyen aumento brusco de peso, hinchazón en los tobillos y/o dificultad para respirar.
- si presenta otras enfermedades graves que no están bien controladas. Su médico lo tendrá en cuenta a la hora de recetarle este medicamento.
- si padece insuficiencia renal. Es posible que su médico tenga que darle una dosis más baja de este medicamento.
Revisiones médicas antes y durante el tratamiento con Revestive
Antes de comenzar el tratamiento con este medicamento, su médico necesitará hacerle una colonoscopia (un procedimiento para observar el interior del colon y el recto) para detectar la presencia de pólipos (pequeños crecimientos anómalos) y eliminarlos. Se recomienda que su médico realice estas exploraciones una vez al año durante los 2 primeros años tras el inicio del tratamiento y después, como mínimo, una vez cada cinco años. Si se hallan pólipos antes o durante el tratamiento con Revestive, su médico decidirá si debe continuar usando este medicamento. Si durante la colonoscopia se le diagnostica cáncer, no deberá usar Revestive.
Su médico tendrá especial cuidado y hará un seguimiento de la función de su intestino delgado y de los signos y síntomas que indiquen problemas en su vesícula biliar, conductos biliares y páncreas.
Niños y adolescentes
Se desconocen los beneficios y riesgos de usar Revestive en niños o adolescentes menores de 18 años. Uso de Revestive con otros medicamentos
Informe a su médico, farmacéutico o enfermero si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Puede que Revestive afecte a la forma en que otros medicamentos se absorben en el intestino y, por tanto, al buen funcionamiento de éstos. Es posible que su médico tenga que cambiarle la dosis de otros medicamentos.
Embarazo y lactancia
No se recomienda el uso de Revestive si está embarazada o en periodo de lactancia.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, farmacéutico o enfermero antes de utilizar este medicamento.
Conducción y uso de máquinas
Este medicamento puede provocar mareo. Si esto sucediera, no conduzca ni utilice máquinas hasta que se encuentre mejor.
Información importante sobre algunos componentes de Revestive
Este medicamento contiene menos de 23 mg (1 mmol) de sodio por dosis, lo que se considera esencialmente “exento de sodio”.
Hay que tener precaución si usted es hipersensible a las tetraciclinas.
3. Cómo usar Revestive
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico, farmacéutico o enfermero.
Dosis
La dosis diaria recomendada es 0,05 mg por kg de peso corporal. La dosis se dará en ml de solución.
Su médico decidirá la dosis más adecuada para usted dependiendo de su peso corporal. Su médico le indicará la dosis a inyectar. Si no es así, o tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
Cómo usar Revestive
Revestive se inyecta bajo la piel (vía subcutánea) una vez al día. La inyección puede administrársela el propio paciente u otra persona, por ejemplo su médico, cuidador o enfermero. Si se está inyectando el medicamento usted mismo, debe recibir la formación adecuada por parte de su médico o enfermero. Encontrará las instrucciones detalladas para la inyección al final de este prospecto.
Si usa más Revestive del que debe
Si, de forma accidental, se inyecta más Revestive del indicado por su médico, debe ponerse en contacto con su médico, farmacéutico o enfermero.
Si olvidó usar Revestive
Si olvida usar este medicamento (o no puede usarlo a su hora habitual), utilícelo lo antes posible ese mismo día. Nunca utilice más de una inyección en el mismo día. No utilice una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Revestive
Continúe usando este medicamento durante el tiempo que su médico le indique. No deje de usar este medicamento sin consultarlo con su médico, ya que una interrupción repentina puede provocarle cambios en el equilibrio de líquidos.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Solicite atención médica inmediatamente si se produce alguno de los siguientes efectos adversos:
Frecuentes, (pueden afectar hasta 1 de cada 10 pacientes):
- Insuficiencia cardíaca congestiva. Contacte con su médico si presenta cansancio, dificultad para respirar o inflamación de los tobillos o de las piernas.
- Inflamación del páncreas (pancreatitis). Contacte con su médico o con un servicio de urgencias si sufre intenso dolor de estómago y fiebre.
- Obstrucción intestinal (obstrucción del intestino). Contacte con su médico o con un servicio de urgencias si sufre intenso dolor de estómago, vómitos y estreñimiento.
- Reducción del flujo de bilis desde la vesícula biliar y/o inflamación de la vesícula biliar. Contacte con su médico o con un servicio de urgencias si presenta color amarillento de la piel y la zona blanca de los ojos, picor, orina oscura y heces de color claro o si sufre dolor en el lado superior derecho o en la mitad de la zona del estómago.
Poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes):
- Desmayo. Si la frecuencia cardíaca y la respiración son normales y se despierta rápido, informe a su médico. En otros casos, solicite asistencia lo antes posible.
Otros efectos adversos incluidos:
Muy frecuentes (pueden afectar a más de 1 de cada 10 pacientes):
- Infección del tracto respiratorio (cualquier infección en los senos nasales, garganta, vías respiratorias o pulmones)
- Dolor de cabeza
- Dolor de estómago, hinchazón del estómago, sensación de mareo (náuseas), inflamación del estoma (abertura artificial para la eliminación de desechos), vómitos
- Enrojecimiento, dolor o inflamación en el lugar de la inyección.
- Hinchazón de manos y/o pies.
Frecuentes (pueden afectar hasta 1 de cada 10 pacientes):
- Gripe
- Disminución del apetito
- Problemas para dormir, ansiedad
- Entumecimiento y hormigueo en la piel
- Sofoco
- Tos, dificultad para respirar
- Sarpullidos
- Dolor de las articulaciones
- Dolor al palparle en la zona de los riñones, cólico nefrítico (dolor en la espalda, en el costado o en la ingle, presencia de sangre en la orina, fiebre, sensación de mareo)
- Dolor en el pecho, sudores nocturnos
- Aumento de la concentración de proteína C reactiva, que se observa en los resultados de los análisis de sangre.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Revestive
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja, el vial y la jeringa precargada después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar a menos de 25 °C.
No congelar.
Tras la reconstitución, desde un punto de vista microbiológico, la solución debe usarse inmediatamente. Aún así, se ha demostrado estabilidad química y física durante 3 horas a 25° C.
No utilice este medicamento si observa turbidez o partículas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente. Todas las agujas y jeringas deben desecharse en contenedores para eliminación de objetos punzantes.
6. Contenido del envase e información adicional
Composición de Revestive
El principio activo es teduglutida. Un vial de polvo contiene 5 mg de teduglutida. Tras la reconstitución, cada vial contiene 5 mg de teduglutida en 0,5 ml de disolución, que corresponde a una concentración de 10 mg/ml.
- Los demás componentes son L-histidina, manitol, fosfato de sodio monohidrato y fosfato disódico heptahidrato, hidróxido de sodio (ajuste de pH), ácido clorhídrico (ajuste de pH)..
- El disolvente contiene agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Revestive es un polvo y un disolvente para solución inyectable (5 mg de polvo en vial, 0,5 ml de disolvente en jeringa precargada. Tamaño de envase de 28 unidades y con 6 émbolos).
El polvo es blanco y el disolvente es transparente e incoloro.
Titular de la autorización de comercialización
NPS Pharma Holdings Limited Grand Canal House 1 Grand Canal Street Upper Dublin 4 Irlanda
Tel.: +800 6774 4357
Responsable de la fabricación
Almac Pharma Services Seagoe Industrial Estate Craigavon County Armagh BT63 5UA Reino Unido
Fecha de la última revisión de este prospecto: {MM/AAAA}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
Instrucciones para la Preparación e Inyección de Revestive
Información importante:
• Lea el prospecto antes de usar Revestive.
• Revestive se inyecta por debajo de la piel (vía subcutánea).
• No inyectar Revestive en una vena (vía intravenosa) ni en un músculo (vía intramuscular).
• Mantenga Revestive fuera de la vista y el alcance de los niños.
• No use Revestive después de la fecha de caducidad que aparece en la caja, el vial y la jeringa
precargada. La fecha de caducidad es el último día del mes que se indica. Conservar por debajo de 25 °C.
• No congelar.
• Tras la reconstitución, desde un punto de vista microbiológico, la solución se debe usar inmediatamente. Sin embargo, se ha demostrado la estabilidad química y física durante 3 horas a 25 °C.
• No use Revestive si nota que la solución está turbia o contiene partículas.
• Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no usa. De esta forma, ayudará a proteger el medio ambiente.
• Tire todas las agujas y jeringas en un recipiente para objetos punzantes.
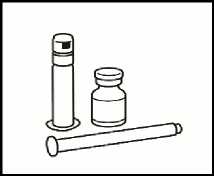
Materiales del envase de Revestive:
• 28 viales con 5 mg de teduglutida en forma de polvo.
• 28 jeringas precargadas con disolvente.
• 6 émbolos
Material necesario pero no incluido en el envase:
• Agujas para reconstitución (grosor 22G, largo 1/" (0,7 x 40 mm))
• Jeringuillas para inyección de 1 ml (con escala de intervalos de 0,02 ml o menores). Agujas finas para inyección subcutánea (p.ej., grosor 26G, largo 5/8" (0,45 x 16 mm)).
• Gasas y alcohol
• Algodón con alcohol
• Recipiente a prueba de pinchazos donde desechar las jeringas y agujas usadas de forma segura.
NOTA: Antes de comenzar, lávese las manos y asegúrese de que dispone de una superficie limpia donde manipular los materiales antes de proceder.
1. Monte la jeringa precargada
Una vez preparado todo el material, debe montar la jeringa precargada. A continuación se muestra el procedimiento a seguir:
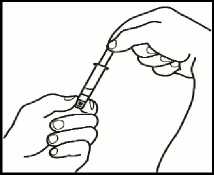
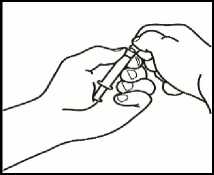
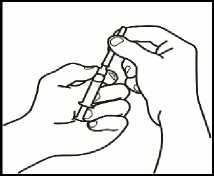
1.1 Coja la jeringa precargada con el disolvente y ensamble (enroscando) el émbolo a la parte inferior de la misma.
1.2 Desprenda la parte superior del tapón de plástico blanco de la jeringa precargada de manera que pueda colocar la aguja para la reconstitución.
1.3 Acople la aguja para reconstitución (22G 1/" (0,7 x 40 mm)) en la jeringa precargada ya montada enroscando en el sentido de las agujas del reloj.
2. Disuelva el polvo
Ahora ya puede disolver el polvo con el disolvente.
2.1 Retire el precinto verde del vial de polvo, limpie la parte superior con una gasa empapada en alcohol y déjela secar. No toque la parte superior del vial.
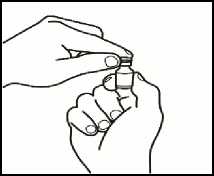
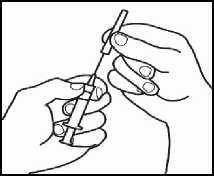
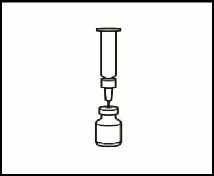
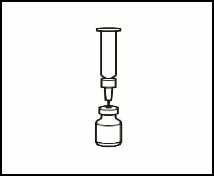
2.2 Retire el capuchón de la aguja de reconstitución de la jeringa precargada con el disolvente, sin tocar la punta de la aguja.
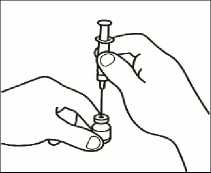
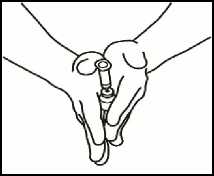
2.3 Coja el vial de polvo e introduzca la aguja de reconstitución acoplada a la jeringa precargada ya montada a través del centro del tapón de goma; a continuación, presione cuidadosamente el émbolo, hasta el fondo, para inyectar todo el contenido del disolvente dentro del vial.
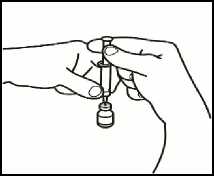
2.4 Retire el émbolo de la jeringa vacía desenroscándolo y guárdelo para utilizarlo más tarde en su siguiente dosis.
2.5 Deje la aguja de reconstitución y la jeringa vacía en el vial. Deje reposar el contenido durante aproximadamente 30 segundos.
2.6 Haga rodar suavemente el vial entre las palmas de sus manos durante unos 15 segundos. A continuación, invierta el vial con cuidado y vuelva a colocarlo en su posición original, una sola vez, con la aguja de reconstitución y la jeringa vacía aún en el vial.
NOTA: No agite el vial. La agitación del vial puede producir espuma, que hace que sea difícil extraer la solución del vial.
Deje reposar el contenido del vial unos dos minutos.
2.8 Observe si el vial contiene polvo sin disolver. Si aún queda polvo no disuelto, repita
los pasos 6 y 7. No agite el vial. Si aún queda polvo sin disolver, deseche el vial y repita el procedimiento desde el principio con un nuevo vial.
NOTA: La disolución final debe ser transparente. Si la disolución está turbia o contiene partículas, no debe inyectarse.
NOTA: Una vez preparada, la solución debe usarse inmediatamente. Debe conservarse por debajo de 25° C durante un máximo de tres horas.
3. Prepare la jeringuilla para la inyección
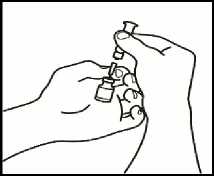
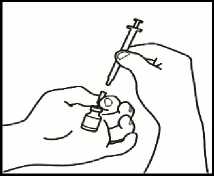
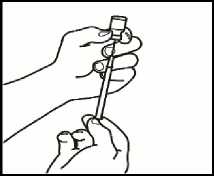
3.1 Extraiga la jeringuilla de reconstitución de la aguja de reconstitución
que aún está en el vial y deseche la jeringuilla de reconstitución.
3.2 Coja la jeringuilla de inyección y acóplela a la aguja de reconstitución que aún está en el vial.
3.3 Invierta el vial, de forma que quede boca abajo, deslice la punta de la aguja de reconstitución cerca del tapón y tire suavemente del émbolo para llenar la jeringuilla con el medicamento.
NOTA: Si su médico le ha indicado que necesita dos viales, prepare una segunda jeringa precargada con disolvente y un segundo vial de polvo, tal y como se muestra en los pasos 1 y 2. Con la misma jeringuilla que acaba de utilizar, extraiga la disolución del segundo vial repitiendo el paso 3.
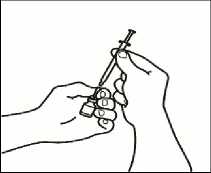
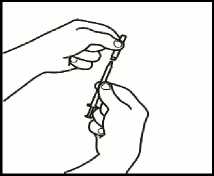
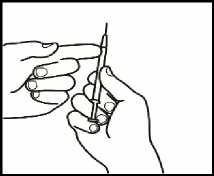
3.4 Retire la jeringuilla de inyección de la aguja de reconstitución dejando la aguja en el vial. Tire el vial y la aguja de reconstitución al recipiente para objetos punzantes.
3.5 Coja la aguja de inyección (26G, 5/8" (0,45 x 16 mm), pero no retire el capuchón de plástico de la aguja. Acople la aguja a la jeringuilla de inyección que contiene el medicamento.
3.6 Compruebe que no haya burbujas de aire. Si las hay, golpee suavemente con el dedo la pared de la jeringuilla hasta que las burbujas
suban a la superficie. Seguidamente, presione el émbolo para expulsar las burbujas de aire.
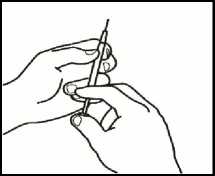
3.7 Su médico ha calculado su dosis en ml. Expulse el exceso de volumen de la jeringuilla con el capuchón de la aguja puesto hasta alcanzar el volumen de su dosis.
4. Inyecte la solución de Revestive.
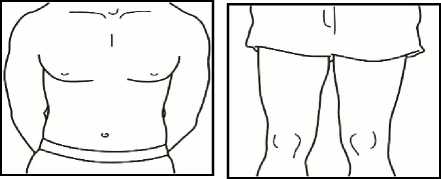
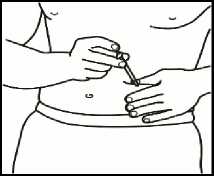
4.1 Localice una zona de su vientre, en la que le resulte fácil administrarse una inyección, o de su muslo si tiene dolor o endurecimiento del vientre (ver el diagrama).
NOTA: No se aplique las inyecciones siempre en la misma zona - cambie de zona (utilice la parte superior, inferior, izquierda o derecha de su vientre) para evitar molestias. Evite las zonas inflamadas, hinchadas, con cicatrices o cubiertas por un lunar, una marca de nacimiento o cualquier tipo de lesión.
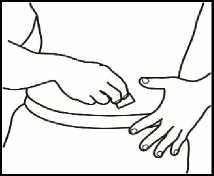
4.2 Una vez elegido el punto de inyección, limpie toda la zona con un algodón empapado en alcohol mediante movimientos circulares desde dentro hacia fuera. Deje secar la zona.
4.3 Retire el capuchón de plástico de la aguja que ha preparado para la inyección. Agarre suavemente la piel limpia del punto de inyección con una mano. Con la otra, sujete la jeringuilla como si fuera un lápiz. Flexione la muñeca hacia atrás e inserte rápidamente la aguja en un ángulo de 45°.
4.4 Tire ligeramente del émbolo. Si observa sangre en la jeringuilla, retire la aguja y sustituyala en la jeringuilla de inyección por otra nueva y limpia del mismo tamaño. Aún puede utilizar el medicamento que se encuentra dentro de la jeringuilla. Trate de escoger otro punto de inyección en la misma zona de piel limpia.
4.5 Inyecte el medicamento despacio, presionando el émbolo de forma continuada, hasta que haya inyectado todo el medicamento y la jeringuilla esté vacía.
4.6 Extraiga rápidamente la aguja de la piel y tire la aguja y la jeringuilla al recipiente para objetos punzantes. Es posible que sangre un poco. Si fuera necesario, presione con suavidad la zona de inyección con un hisopo o una gasa empapados en alcohol hasta que cese la hemorragia.
4.7 Deseche todas las agujas y jeringuillas en un recipiente para eliminar objetos punzantes o de paredes gruesas (por ejemplo, un bote de detergente con tapón). Debe utilizar un recipiente resistente a los pinchazos (incluida la tapa y las paredes laterales). Si necesita un recipiente para desechar objetos punzantes, por favor consulte a su médico.
34