Revatio 10 Mg/Ml Polvo Para Suspension Oral
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Revatio 20 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 20 mg de sildenafilo (como citrato).
Excipiente(s) con efecto conocido
Cada comprimido también contiene 0,7 mg de lactosa.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Comprimidos redondos, blancos, biconvexos, recubiertos con película, marcados “PFIZER” en una cara y “RVT 20” en la otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Adultos
Tratamiento de pacientes adultos con hipertensión arterial pulmonar tipificada como grado funcional II y III de la OMS, para mejorar la capacidad de ejercicio. Se ha demostrado eficacia en hipertensión pulmonar primaria e hipertensión pulmonar asociada con enfermedades del tejido conjuntivo.
Población pediátrica
Tratamiento de pacientes pediátricos de 1 a 17 años con hipertensión arterial pulmonar. Se ha demostrado eficacia en términos de mejora de la capacidad de ejercicio o de hemodinámica pulmonar en hipertensión pulmonar primaria e hipertensión pulmonar asociada a enfermedad cardiaca congénita (ver sección 5.1).
4.2 Posología y forma de administración
El tratamiento sólo debe iniciarse y controlarse por un médico con experiencia en el tratamiento de la hipertensión arterial pulmonar. En caso de deterioro clínico, pese al tratamiento con Revatio, deberán considerarse terapias alternativas.
Posología
Adultos
La dosis recomendada es de 20 mg tres veces al día (TID). Los médicos deben advertir a los pacientes que olviden tomar Revatio, que tomen una dosis tan pronto como sea posible y que después continúen con la dosis normal. Los pacientes no deben tomar una dosis doble para compensar la dosis olvidada.
Población pediátrica (de 1 a 17 años)
En pacientes pediátricos entre 1 a 17 años, la dosis recomendada para pacientes < 20 kg es de 10 mg tres veces al día y para pacientes > 20 kg es de 20 mg tres veces al día. En pacientes pediátricos con hipertensión arterial pulmonar (HAP) no deben utilizarse dosis superiores a las recomendadas (ver también secciones 4.4 y 5.1). No se deben utilizar los comprimidos de 20 mg en aquellos casos en que se deba administrar una dosis de 10 mg TID a pacientes más jóvenes. Existen otras formas farmaceúticas para la administración en pacientes de < 20 kg y en otros pacientes más jóvenes que no pueden tragar los comprimidos.
Pacientes en tratamiento con otros medicamentos
En general, cualquier ajuste de dosis sólo debe administrarse tras una cuidadosa evaluación del balance beneficio-riesgo. En el caso de administración conjunta con inhibidores del CYP3A4, como eritromicina o saquinavir, debe considerarse una reducción de la dosis a 20 mg dos veces al día. Se recomienda una reducción de la dosis a 20 mg una vez al día en el caso de la administración concomitante con inhibidores del CYP3A4 más potentes como claritromicina, telitromicina y nefazodona. Para el uso de sildenafilo con inhibidores mucho más potentes del CYAP3A4, ver información en la sección 4.3. Puede requerirse un ajuste de la dosis para sildenafilo cuando se administra conjuntamente con inductores del CYP3A4 (ver sección 4.5).
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
No se requiere ajuste de la dosis en pacientes de edad avanzada. La eficacia clínica, medida por la prueba de distancia recorrida en 6 minutos, puede ser menor en pacientes de edad avanzada.
Insuficiencia renal
No se requiere ajuste inicial de la dosis en pacientes con insuficiencia renal, incluyendo insuficiencia renal grave (aclaramiento de creatinina <30 ml/min). Unicamente si la terapia no es bien tolerada, debe considerarse un ajuste de dosis a 20 mg dos veces al día, tras una cuidadosa evaluación riesgo-beneficio.
Insuficiencia hepática
No se requiere ajuste inicial de la dosis en pacientes con insuficiencia hepática (Child-Pugh clase A y B). Únicamente si la terapia no es bien tolerada, debe considerarse un ajuste de dosis a 20 mg dos veces al día, tras una cuidadosa evaluación riesgo-beneficio.
Revatio está contraindicado en pacientes con insuficiencia hepática grave (Child-Pugh clase C) (ver sección 4.3).
Población pediátrica
No se ha establecido la seguridad y eficacia de Revatio en niños menores de 1 año. No hay datos disponibles.
Interrupción del tratamiento
Datos limitados sugieren que una interrupción abrupta del tratamiento con Revatio no se asocia con un empeoramiento de rebote de la hipertensión arterial pulmonar. No obstante para evitar la posible aparición de un deterioro repentino durante la interrupción, debe considerarse una reducción gradual de la dosis. Se recomienda un estrecho seguimiento durante el periodo de retirada.
Forma de administración
Revatio se administra solo por vía oral. Los comprimidos deben tomarse cada 6 a 8 horas con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Administración concomitante con dadores de óxido nítrico (como el nitrilo de amilo) o nitratos en cualquier forma debido a los efectos hipotensores de los nitratos (ver sección 5.1).
La administración conjunta de inhibidores de la PDE5, incluyendo sildenafilo, con estimuladores de la guanilato-ciclasa, como riociguat, está contraindicado ya que puede producir hipotensión sintomática de forma potencial (ver sección 4.5).
Combinación con los inhibidores más potentes del CYP3A4 (por ejemplo, ketoconazol, itraconazol, ritonavir) (ver sección 4.5).
Pacientes que han perdido la visión en un ojo debido neuropatía óptica isquémica anterior no arterítica (NOIA-NA), independientemente de si este episodio se asoció o no con la exposición previa a un inhibidor de la PDE5 (ver sección 4.4).
No se ha estudiado la seguridad de sildenafilo en los siguientes subgrupos de pacientes y por tanto su uso está contraindicado:
Insuficiencia hepática grave,
Antecedentes de ictus o infarto de miocardio reciente,
Hipotensión grave (presión sanguínea < 90/50 mmHg) al inicio.
4.4 Advertencias y precauciones especiales de empleo
No se ha establecido la eficacia de Revatio en pacientes con hipertensión arterial pulmonar grave (clase funcional IV). Si la situación clínica se deteriora, deben reconsiderarse las terapias que se recomiendan inicialmente en las etapas más graves de la enfermedad (por ejemplo, epoprostenol) (ver sección 4.2). No se ha establecido el balance beneficio-riesgo de sildenafilo en pacientes con hipertensión arterial pulmonar tipificada como clase funcional I de la OMS.
Se han realizado estudios con sildenafilo en hipertensión arterial pulmonar primaria (idiopática), asociada a enfermedades del tejido conectivo o asociada a cardiopatías congénitas como formas de HAP (ver sección 5.1). No se recomienda el uso de sildenafilo en otras formas de HAP.
En el estudio pediátrico de extensión a largo plazo se observó un aumento de mortalidad en los pacientes que recibieron dosis superiores a las recomendadas. Por tanto, no deben utilizarse dosis superiores a las recomendadas en pacientes pediátricos con HAP (ver también secciones 4.2 y 5.1).
Retinitis pigmentaria
La seguridad de sildenafilo no ha sido estudiada en pacientes con conocidos trastornos hereditarios degenerativos de la retina tales como retinitis pigmentaria (una minoría de estos pacientes tienen trastornos genéticos de las fosfodiesterasas de la retina) y por tanto no se recomienda su uso.
Acción vasodilatadora
Al prescribir sildenafilo, el médico debe considerar cuidadosamente si los pacientes con ciertas patologías subyacentes pueden verse afectados de forma adversa por los efectos vasodilatadores de carácter leve a moderado producidos por sildenafilo, por ejemplo pacientes con hipotensión, con depleción de volumen, obstrucción grave del flujo ventricular izquierdo o alteración del control autónomo (ver sección 4.4).
Factores de riesgo cardiovascular
En el seguimiento post-comercialización de sildenafilo para el tratamiento de la disfunción eréctil masculina, se ha notificado la asociación temporal del uso del sildenafilo con acontecimientos cardiovasculares graves, incluyendo infarto de miocardio, angina inestable, muerte cardíaca súbita, arritmia ventricular, hemorragia cerebrovascular, ataque isquémico transitorio, hipertensión e hipotensión. La mayoría de estos pacientes, aunque no todos, padecían factores de riesgo cardiovascular anteriores. Se ha informado que muchos acontecimientos tuvieron lugar durante o poco tiempo después de la relación sexual y unos pocos sucedieron poco después del uso de sildenafilo sin actividad sexual. No es posible determinar si estos acontecimientos están directamente relacionados con estos factores o con otros factores.
Priapismo
Sildenafilo debe utilizarse con precaución en pacientes con deformaciones anatómicas del pene (tales como angulación, fibrosis cavernosa o enfermedad de Peyronie), o en pacientes con enfermedades que les pueden predisponer a sufrir priapismo (tales como anemia falciforme, mieloma múltiple o leucemia).
Se han notificado casos de erección prolongada y priapismo con sildenafilo durante la experiencia post-comercialización. En caso de que la erección persista más de 4 horas, el paciente debe solicitar inmediatamente atención médica. Si el priapismo no se trata inmediatamente, se puede producir daño en el tejido peneano y una pérdida permanente de potencia (ver sección 4.8).
Crisis vaso-oclusivas en pacientes con anemia de células falciformes
Sildenafilo no se debe utilizar en pacientes con hipertensión arterial pulmonar secundaria a anemia de células falciformes. En un estudio clínico se notificaron más frecuentemente acontecimientos de crisis vaso-oclusivas que requirieron hospitalización en los pacientes que recibieron Revatio que en los del grupo placebo lo que condujo a una finalización precoz de este estudio.
Acontecimientos visuales
De forma espontánea, se han comunicado casos de defectos visuales en asociación con la toma de sildenafilo y de otros inhibidores de la PDE5. De forma espontánea y en un estudio observacional, se han comunicado casos de neuropatía óptica isquémica anterior no arterítica, una enfermedad rara, en asociación con la toma de sildenafilo y de otros inhibidores de la PDE5 (ver sección 4.8). En el caso de algún defecto visual repentino, el tratamiento debe interrumpirse inmediatamente y se debe considerar un tratamiento alternativo (ver sección 4.3).
Alfa-bloqueantes
Se recomienda precaución cuando se administra sildenafilo a pacientes que reciben un alfa-bloqueante dado que la administración concomitante puede producir hipotensión sintomática en pacientes sensibles (ver sección 4.5). Antes de iniciar el tratamiento con sildenafilo, los pacientes deben encontrarse hemodinámicamente estables con la terapia con alfa-bloqueantes, a fin de minimizar el potencial para desarrollar hipotensión postural. Los médicos deben indicar a los pacientes qué hacer en caso de que experimenten síntomas de hipotensión postural.
Trastornos hemorrágicos
Estudios con plaquetas humanas indican que sildenafilo potencia el efecto antiagregante del nitroprusiato sódico in vitro. No existen datos de seguridad sobre la administración de sildenafilo a pacientes con trastornos hemorrágicos o con úlcera péptica activa. Por lo tanto, sildenafilo se debe administrar a estos pacientes sólo tras una evaluación cuidadosa del beneficio-riesgo.
Antagonistas de la vitamina K
En pacientes con hipertensión arterial pulmonar, puede existir un mayor riesgo de hemorragia cuando se inicia el tratamiento con sildenafilo en pacientes que ya están tomando un antagonista de la vitamina K, especialmente en pacientes con hipertensión arterial pulmonar secundaria a enfermedad del tejido conjuntivo.
Enfermedad veno-oclusiva
No se dispone de información con sildenafilo en pacientes con hipertensión arterial pulmonar asociada con enfermedad pulmonar veno-oclusiva. No obstante, se han comunicado casos de edema pulmonar con amenaza de muerte cuando se han utilizado vasodilatadores (principalmente prostaciclina) en estos pacientes. En consecuencia, si se produjeran signos de edema pulmonar cuando se administra sildenafilo a pacientes con hipertensión pulmonar, debe considerarse la posibilidad de una enfermedad veno-oclusiva asociada.
Intolerancia a la galactosa
En el recubrimiento del comprimido se incluye lactosa monohidratada. Los pacientes con un raro problema hereditario de intolerancia a la galactosa, deficiencia de lactasa de Lapp o mala absorción de glucosa-galactosa no deben tomar este medicamento.
Uso de sildenafilo con bosentan
No se ha demostrado de forma concluyente la eficacia de sildenafilo en pacientes que ya están en tratamiento con bosentán (ver seciones 4.5 y 5.1).
Uso concomitante con otros inhibidores de la PDE5
No se ha estudiado la seguridad y eficacia de sildenafilo en pacientes con HAP cuando se administra conjuntamente con otros medicamentos inhibidores de la PDE5, incluyendo Viagra, y por tanto no se recomienda su uso concomitante (ver sección 4.5).
4.5 Interacción con otros medicamentos y otras formas de interacción
Efectos de otros medicamentos sobre sildenafilo
Estudios in vitro
El metabolismo de sildenafilo está mediado predominantemente por las isoformas 3A4 (principalmente) y 2C9 (en menor medida) del citocromo P450 (CYP). Por lo tanto, los inhibidores de estas isoenzimas pueden reducir el aclaramiento de sildenafilo y los inductores de estas isoenzimas pueden aumentar el aclaramiento de sildenafilo. Para recomendaciones posológicas, ver secciones 4.2 y 4.3.
Estudios in vivo
Se ha evaluado la administración concomitante de sildenafilo oral y epoprostenol intravenoso (ver secciones 4.8 y 5.1).
No se ha estudiado en ensayos clínicos controlados la eficacia y seguridad de sildenafilo administrado con otros tratamientos para la hipertensión arterial pulmonar (por ejemplo, ambrisentán, iloprost). Por tanto, se aconseja precaución en caso de administración conjunta.
No se ha estudiado la seguridad y eficacia de sildenafilo cuando se administra junto con otros inhibidores de la PDE5 en pacientes con hipertensión arterial pulmonar (ver sección 4.4).
El análisis de los datos farmacocinéticos de la población de los ensayos clínicos en hipertensión arterial pulmonar, indicó una reducción del aclaramiento de sildenafilo y/o un aumento de la biodisponibilidad oral cuando se administró concomitantemente con sustratos del CYP3A4 y con la combinación de sustratos del CYP3A4 y beta-bloqueantes. Estos fueron los únicos factores con un impacto estadísticamente significativo sobre la farmacocinética de sildenafilo en pacientes con hipertensión arterial pulmonar. La exposición a sildenafilo en pacientes que recibían sustratos del CYP3A4 y sustratos del CYP3A4 junto con beta-bloqueantes fue un 43% y un 66% mayor, respectivamente, comparada con la de pacientes que no recibían este tipo de medicamentos. La exposición a sildenafilo fue 5 veces mayor con una dosis de 80 mg tres veces al día, en comparación a la exposición obtenida con la dosis de 20 mg tres veces al día. Este intervalo de concentración cubre el aumento en la exposición a sildenafilo observada en los estudios de interacción diseñados específicamente con inhibidores del CYP3A4 (excepto con los inhibidores más potentes del CYP3A4, por ejemplo ketoconazol, itraconazol, ritonavir).
Los inductores del CYP3A4 parecen tener un impacto substancial sobre la farmacocinética de sildenafilo en pacientes con hipertensión arterial pulmonar, que ha sido confirmado en un estudio de interacción in vivo con el inductor del CYP3A4, bosentan.
La administración concomitante de 125 mg de bosentan (un inductor moderado del CYP3A4,
CYP2C9 y posiblemente del CYP2C19) dos veces al día con 80 mg de sildenafilo tres veces al día (en estado de equilibrio) administrados de forma concomitante durante 6 días en voluntarios sanos produjo una reducción del 63% del AUC de sildenafilo. Un análisis farmacocinético poblacional de datos de sildenafilo en pacientes adultos con HAP que participaban en ensayos clínicos, entre los que se incluye un estudio de doce semanas destinado a evaluar la eficacia y la seguridad de 20 mg de sildenafilo oral tres veces al día añadidos a una dosis estable de bosentan (62,5 mg - 125 mg dos veces al día), indicó una reducción de la exposición a sildenafilo cuando se administraba conjuntamente con bosentan, similar a la observada en voluntarios sanos (ver secciones 4.4 y 5.1).
En aquellos pacientes que utilizan inductores potentes del CYP3A4, como carbamazepina, fenitoína, fenobarbital, hierba de San Juan y rifampicina, debe vigilarse estrechamente la eficacia de sildenafilo.
La administración conjunta de ritonavir, inhibidor de la proteasa del VIH, que es un potente inhibidor del citocromo P450, en el estado de equilibrio (500 mg dos veces al día) junto con sildenafilo (dosis única de 100 mg) produjo un aumento del 300% (4 veces) en la Cmax de sildenafilo y del 1000% (11 veces) en el AUC plasmática de sildenafilo. A las 24 horas, los niveles plasmáticos de sildenafilo eran todavía de aproximadamente de 200 ng/ml, en comparación con los aproximadamente 5 ng/ml cuando se administra sólo sildenafilo. Este hecho concuerda con los notables efectos de ritonavir sobre un gran número de sustratos del P450. En base a estos resultados farmacocinéticos está contraindicada la administración concomitante de sildenafilo y ritonavir en pacientes con hipertensión arterial pulmonar (ver sección 4.3).
La administración conjunta de saquinavir, inhibidor de la proteasa del VIH, un inhibidor del CYP3A4, en el estado de equilibrio (1200 mg tres veces al día), con sildenafilo (dosis única de 100 mg) produjo un aumento del 140% en la Cmax de sildenafilo y del 210% en el AUC de sildenafilo. Sildenafilo no tuvo efecto sobre la farmacocinética de saquinavir. Para recomendaciones posológicas, ver sección 4.2.
Cuando se administró una dosis única de 100 mg de sildenafilo con eritromicina, un inhibidor moderado del CYP3A4, en el estado de equilibrio (500 mg dos veces al día durante 5 días) hubo un incremento del 182% en la exposición sistémica de sildenafilo (AUC). Para recomendaciones posológicas, ver sección 4.2. En voluntarios varones sanos, no se observó evidencia de un efecto de azitromicina (500 mg diarios durante 3 días) sobre el AUC, Cmax, Tmax, constante de velocidad de eliminación o la consiguiente semivida de sildenafilo o de su metabolito principal en sangre. No se requiere un ajuste de la dosis. Cimetidina (800 mg), un inhibidor del citocromo P450 e inhibidor no específico del CYP3A4, produjo un aumento del 56% de la concentración plasmática de sildenafilo cuando se administró concomitantemente con sildenafilo (50 mg) a voluntarios sanos. No se requiere un ajuste de la dosis.
Se espera que los inhibidores más potentes del CYP3A4 como ketoconazol e itraconazol tengan efectos similares a los de ritonavir (ver sección 4.3). De los inhibidores del CYP3A4 como claritromicina, telitromicina y nefazodona se espera que tengan un efecto entre el de ritonavir y el de los inhibidores del CYP3A4 como saquinavir o eritromicina y se asume un aumento de 7 veces en la exposición. Por tanto, se recomiendan ajustes de dosis cuando se utilizan inhibidores del CYP3A4 (ver sección 4.2).
El análisis farmacocinético de la población en los pacientes con hipertensión arterial pulmonar sugiere que la administración conjunta de beta-bloqueantes en combinación con sustratos del CYP3A4 puede producir un aumento adicional en la exposición a sildenafilo comparado con la administración de sustratos del CYP3A4 solo.
El zumo de pomelo es un inhibidor débil del metabolismo del citocromo CYP3A4 localizado en la pared intestinal que puede provocar pequeños incrementos de los niveles plasmáticos de sildenafilo. No se requiere un ajuste de la dosis, pero no se recomienda el uso concomitante de sildenafilo y zumo de pomelo.
Dosis únicas de antiácido (hidróxido magnésico/hidróxido de aluminio) no afectaron la biodisponibilidad de sildenafilo.
La administración concomitante de anticonceptivos orales (30 ^g de etinilestradiol y 150 ^.g de levonorgestrel) no afectaron la farmacocinética de sildenafilo.
Nicorandil es un híbrido de activador de los canales de potasio y nitrato. Debido al componente nitrato, tiene potencial para presentar una interacción grave con sildenafilo (ver sección 4.3).
Efectos de sildenafilo sobre otros medicamentos
Estudios in vitro
Sildenafilo es un inhibidor débil de las isoformas 1A2, 2C9, 2C19, 2D6, 2E1 y 3A4 (IC50 > 150 ^M) del citocromo P450.
No se dispone de datos sobre la interacción de sildenafilo e inhibidores no específicos de la fosfodiesterasa como teofilina o dipiridamol.
Estudios in vivo
No se han observado interacciones significativas cuando se administró sildenafilo (50 mg) concomitantemente con tolbutamida (250 mg) o warfarina (40 mg), metabolizándose ambos por el CYP2C9.
Sildenafilo no tuvo efectos significativos sobre la exposición a atorvastatina (el AUC aumentó un 11%), lo que sugiere que sildenafilo no tiene un efecto clínicamente relevante sobre el CYP3A4.
No se observaron interacciones entre sildenafilo (dosis única de 100 mg) y acenocumarol.
Sildenafilo (50 mg) no potenció el aumento del tiempo de hemorragia causado por ácido acetil salicílico (150 mg).
Sildenafilo (50 mg) no potenció los efectos hipotensores del alcohol en voluntarios sanos con niveles máximos medios de alcohol en sangre de 80 mg/dl.
En un estudio en voluntarios sanos, sildenafilo en el estado de equilibrio (80 mg tres veces al día), produjo un aumento del 50% en el AUC de bosentan (125 mg dos veces al día). Un análisis farmacocinético poblacional de datos procedentes de un estudio con pacientes adultos con HAP que recibían tratamiento de base con bosentan (65,5 mg - 125 mg dos veces al día), indicó un aumento (20% (95% IC: -9,8 - 30,8) del AUC de bosentan con la administración concomitante de sildenafilo en estado estacionario (20 mg tres veces al día) de magnitud inferior a la observada en voluntarios sanos cuando se administró conjuntamente con 80 mg de sildenafilo tres veces al día (ver secciones 4.4 y 5.1).
En un estudio de interacción específico, cuando se administró concomitantemente sildenafilo (100 mg) junto con amlodipino en pacientes hipertensos, hubo una reducción adicional de la presión sanguínea sistólica en posición supina de 8 mmHg. La correspondiente reducción adicional de la presión sanguínea diastólica en posición supina fue de 7 mmHg. Estas reducciones adicionales de la presión sanguínea eran de magnitud similar a las observadas con sildenafilo cuando se administró solo a voluntarios sanos.
En tres estudios específicos de interacción, se administraron simultáneamente el alfa-bloqueante doxazosina (4 mg y 8 mg) y sildenafilo (25 mg, 50 mg o 100 mg) a pacientes con hiperplasia prostética benigna (HPB) que estaban estabilizados con el tratamiento con doxazosina. En estas poblaciones del estudio, se observaron reducciones adicionales medias de las tensiones sanguínea sistólica y diastólica en posición supina de 7/7 mmHg, 9/5 mmHg y 8/4 mmHg, respectivamente, y reducciones adicionales medias de la presión sanguínea en bipedestación de 6/6 mmHg, 11/4 mmHg y 4/5 mmHg, respectivamente. Infrecuentemente se comunicaron casos de pacientes que sufrieran hipotensión postural sintomática, cuando se administran simultáneamente sildenafilo y doxazosina a pacientes estabilizados con tratamiento con doxazosina. Estos informes incluyeron mareos y vértigo, pero no síncope. La administración simultánea de sildenafilo a pacientes que recibían tratamiento con alfa-bloqueantes puede conducir a hipotensión sintomática en pacientes sensibles (ver sección 4.4).
Sildenafilo (dosis única de 100 mg) no afectó a la farmacocinética en estado de equilibrio del inhibidor de la proteasa del VIH, saquinavir, que es un substrato/inhibidor del CYP3A4.
Concordantemente con sus conocidos efectos sobre la vía óxido nítrico/GMPc (ver sección 5.1), sildenafilo ha mostrado potenciar los efectos hipotensores de los nitratos y por tanto está contraindicada su administración concomitante con dadores de óxido nítrico o nitratos en cualquier forma (ver sección 4.3).
Riociguat
Estudios preclínicos mostraron un efecto aditivo de la disminución de la presión arterial sistémica cuando se combinaron inhibidores de la PDE5 con riociguat. Riociguat ha mostrado en ensayos clínicos que aumenta los efectos hipotensores de los inhibidores de la PDE5. En la población estudiada no hubo indicios de un efecto clínico favorable de dicha combinación. El uso concomitante de riociguat con inhibidores de la PDE5, incluyendo sildenafilo, está contraindicado (ver sección 4.3).
Sildenafilo no tiene impacto clínicamente significativo sobre los niveles plasmáticos de los anticonceptivos orales (30 pg de etinilestradiol y 150 pg de levonorgestrel).
Población pediátrica
Sólo se han realizado estudios de interacción en adultos.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil y anticoncepción en hombres y mujeres.
A causa de la falta de datos sobre los efectos de Revatio en mujeres embarazadas, Revatio no está recomendado en mujeres en edad fértil amenos que se utilicen medidas anticonceptivas adecuadas.
Embarazo
No hay datos sobre el uso de sildenafilo en mujeres embarazadas. Los estudios en animales no indican efectos perjudiciales directos o indirectos respecto al embarazo y desarrollo embrionario/fetal. Los estudios en animales han revelado toxicidad respecto al desarrollo postnatal (ver sección 5.3).
A causa de la falta de datos, Revatio no debe utilizarse en mujeres embarazadas a menos que sea estrictamente necesario.
Lactancia
No se sabe si sildenafilo penetra en la leche materna. Revatio no debe administrarse a mujeres lactantes.
Fertilidad
Los estudios preclínicos no han revelado un riesgo especial para los humanos en base a los estudios convencionales de fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Revatio sobre la capacidad para conducir y utilizar máquinas es moderada.
Como en los ensayos clínicos con sildenafilo se notificaron mareos y trastornos visuales, los pacientes deben saber cómo les puede afectar Revatio antes de conducir vehículos o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En el ensayo pivotal de Revatio en hipertensión arterial pulmonar, controlado con placebo, un total de 207 pacientes fueron aleatorizados para ser tratados con dosis de 20 mg, 40 mg u 80 mg de Revatio TID y 70 pacientes fueron aleatorizados para recibir placebo. La duración del tratamiento fue de 12 semanas. La frecuencia global de abandonos en el grupo de pacientes tratados con dosis de 20 mg,
40 mg y 80 mg de sildenafilo TID fue de 2,9%, 3,0% y 8,5% respectivamente, en comparación con el 2,9% con placebo. De los 277 sujetos tratados en el ensayo pivotal, 259 entraron en un ensayo de extensión a largo plazo. Se administraron dosis de hasta 80 mg tres veces al día (4 veces superiores a la dosis recomendada de 20 mg tres veces al día) y tras 3 años, un 87% de los 183 pacientes en tratamiento del estudio estaban recibiendo 80 mg TID de Revatio.
En un ensayo controlado con placebo de Revatio como terapia adyuvante a epoprostenol intravenoso en hipertensión arterial pulmonar, un total de 134 pacientes fueron tratados con Revatio (en una titulación fija que se iniciaba con 20 mg pasando a 40 mg y posteriormente a 80 mg, tres veces al día, si se toleraba) y epoprostenol y 131 pacientes fueron tratados con placebo y epoprostenol. La duración del tratamiento fue de 16 semanas. La tasa global de retirada de los pacientes tratados con sildenafilo/epoprostenol debido a acontecimientos adversos fue del 5,2% en comparación con la del 10,7% en los pacientes tratados con placebo/epoprostenol. Las nuevas reacciones adversas que se notificaron con mayor frecuencia en el grupo de silfenafilo/epoprostenol, fueron hiperemia ocular, visión borrosa, congestión nasal, sudores nocturnos, dolor de espalda y sequedad de boca. Las reacciones adversas conocidas: cefalea, rubefacción, dolor en las extremidades y edema se observaron con mayor frecuencia en los pacientes tratados con sildenafilo/epoprostenol en comparación con los pacientes que recibían placebo/epoprostenol. De los sujetos que completaron el estudio inicial,
242 entraron en un estudio de extensión a largo plazo. Se administraron dosis de hasta 80 mg TID, y tras 3 años el 68% de los 133 pacientes en tratamiento del estudio estaban recibiendo 80 mg TID de Revatio.
En los dos ensayos controlados con placebo, los efectos adversos fueron generalmente de leves a moderados. Los efectos adversos más comúnmente comunicados que se produjeron con mayor frecuencia (mayor o igual a 10%) con Revatio en comparación con placebo eran cefalea, rubefacción, dispepsia, diarrea y dolor en una extremidad.
Tabla de reacciones adversas
Las reacciones adversas, que se produjeron en > 1% de los pacientes tratados con Revatio y que eran más frecuentes (> 1% de diferencia) con Revatio en el ensayo pivotal o en el conjunto de los datos combinados de los dos ensayos de Revatio controlados con placebo en hipertensión arterial pulmonar, con dosis de 20, 40 ó 80 mg TID, se muestran en la siguiente tabla agrupadas por grupos y frecuencias (muy frecuente (> 1/10), frecuente (> 1/100 a < 1/10), poco frecuente ((> 1/1000 a < 1/100) y frecuencia no conocida (no puede estimarse con los datos disponibles)). Dentro de cada grupo de frecuencias, se presentan las reacciones adversas en orden descendente de gravedad.
Las reacciones adversas notificadas durante la experiencia post-comercialización se incluyen en cursiva.
|
Clasificación de Órganos del Sistema MedDRA (V.14.0) |
Reacción adversa |
|
Infecciones e infestaciones Frecuentes |
celulitis, gripe, bronquitis, sinusitis, rinitis, gastroenteritis |
|
Trastornos de la sangre y del sistema linfático | |
|
Frecuentes |
anemia |
|
Trastornos del metabolismo y de la nutrición Frecuentes |
retención de líquidos |
|
Trastornos psiquiátricos Frecuentes |
insomnio, ansiedad |
|
Trastornos del sistema nervioso Muy frecuentes |
cefalea |
|
Frecuentes |
migraña, temblor, parestesia, sensación de ardor, hipoestesia |
Trastornos oculares
Frecuentes
Poco frecuentes Frecuencia no conocida
Trastornos del oído y del laberinto
Frecuentes
Frecuencia no conocida
Trastornos vasculares
Muy frecuentes
Frecuencia no conocida
Trastornos respiratorios, torácicos y
mediastínicos
Frecuentes
Trastornos gastrointestinales
Muy frecuentes Frecuentes
Trastornos de la piel y del tejido subcutáneo
Frecuentes
Frecuencia no conocida
Trastornos musculoesqueléticos y del tejido
conjuntivo
Muy frecuentes Frecuentes
Trastornos renales y urinarios
Poco frecuentes
Trastornos del aparato reproductor y de la mama
Poco frecuentes Frecuencia no conocida
Trastornos generales y alteraciones en el lugar de administración
Frecuentes
hemorragia retiniana, alteración visual, visión borrosa, fotofobia, cromatopsia, cianopsia, irritación ocular, hiperemia ocular
reducción de la agudeza visual, diplopía, sensación anormal en el ojo
Neuropatía óptica isquémica anterior no arterítica (NOIA-NA)*, Oclusión vascular retiniana*, Defectos del campo visual*
vértigo
pérdida súbita de la audición
rubefacción
hipotensión
epistaxis, tos, congestión nasal
diarrea, dispepsia
gastritis, enfermedad por reflujo gastroesofágico, hemorroides, distensión abdominal, sequedad de boca
alopecia, eritema, sudores nocturnos
erupción
dolor en una extremidad mialgia, dolor de espalda
hematuria
hemorragia del pene, hematospermia, ginecomastia
priapismo, erección aumentada
pirexia
*Estos efectos/reacciones adversos/as se han notificado en los pacientes que recibían sildenafilo para el tratamiento de la disfunción eréctil en varones (DE).
Población pediátrica
En el estudio controlado con placebo de Revatio en pacientes de 1 a 17 años con hipertensión arterial pulmonar, se trataron, un total de 174 pacientes, tres veces al día con regímenes de dosis baja (10 mg en pacientes > 20 kg; ningún paciente < 20 kg recibió la dosis baja), media (10 mg en pacientes > 820 kg; 20 mg en pacientes > 20-45 kg; 40 mg en pacientes > 45 kg) o dosis alta (20 mg en pacientes
> 8-20 kg; 40 mg en pacientes > 20-45 kg; 80 mg en pacientes > 45 kg) de Revatio y 60 fueron tratados con placebo.
El perfil de reacciones adversas en este estudio pediátrico fue en general concordante con el de los adultos (ver tabla más arriba). Las reacciones adversas más frecuentes que se produjeron (con una frecuencia > 1%) en los pacientes que recibieron Revatio (dosis combinadas) y con una frecuencia
> 1% con respecto a los pacientes que recibieron placebo fueron pirexia, infección del tracto
respiratorio superior (11,5% cada una), vómitos (10,9%), erección aumentada (incluidas erecciones espontáneas del pene en los sujetos varones) (9,0%), náuseas, bronquitis (4,6% cada una), faringitis (4,0%), rinorrea (3,4%) y neumonía, rinitis (2,9% cada una).
De los 234 sujetos pediátricos tratados en el estudio a corto plazo, controlado mediante placebo, 220 participaron en el estudio de extensión a largo plazo. Los sujetos en tratamiento activo con sildenafilo continuaron con el mismo régimen de tratamiento, mientras que los sujetos del grupo placebo en el estudio a corto plazo, fueron reasignados aleatoriamente a tratamiento con sildenafilo.
En general, las reacciones adversas más frecuentes notificadas a lo largo del tiempo que duraron los estudios de corto y largo plazo, fueron similares a las observadas en el estudio a corto plazo. Las reacciones adversas notificadas en > 10% de los 229 sujetos tratados con sildenafilo (grupo de dosis combinadas, incluyendo 9 pacientes que no continuaron en el estudio a largo plazo) fueron infección de las vías respiratorias superiores (31%), cefalea (26%), vómitos (22%), bronquitis (20%), faringitis (18%), pirexia (17%), diarrea (15%), gripe (12%) y epistaxis (12%). La mayoría de estas reacciones adversas se consideraron de intensidad leve a moderada.
Se notificaron efectos adversos graves en 94 (41%) de los 229 sujetos que recibían sildenafilo. De los 94 sujetos que notificaron un efecto adverso grave, 14/55 (25,5%) sujetos estaban en el grupo de dosis baja, 35/74 (47,3%) en el grupo de dosis media y 45/100 (45%) en el grupo de dosis alta. Los efectos adversos graves más frecuentes que se produjeron con una frecuencia > 1% en los pacientes tratados con sildenafilo (dosis combinadas) fueron: neumonía (7,4%), insuficiencia cardiaca, hipertensión pulmonar (cada uno 5,2%), infección del tracto respiratorio superior (3,1%), insuficiencia ventricular derecha, gastroenteritis (cada uno 2,2%), dolor torácico, caries dental (cada uno 1,7%) y shock cardiogénico, gastroenteritis vírica e infección del tracto urinario (cada uno 1,3%).
Los siguientes efectos adversos graves se consideraron relacionados con el tratamiento: enterocolitis, convulsión, hipersensibilidad, estridor, hipoxia, sordera neurosensorial y arritmia ventricular.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
En ensayos realizados en voluntarios sanos con dosis únicas de hasta 800 mg, las reacciones adversas fueron similares a las observadas con dosis más bajas, pero la incidencia y gravedad aumentó. Con dosis únicas de 200 mg aumentó la incidencia de reacciones adversas (cefalea, rubefacción, mareos, dispepsia, congestión nasal y trastornos visuales).
En caso de sobredosis, se deben tomar medidas normales de apoyo. Dado que sildenafilo se une intensamente a proteínas plasmáticas y no se elimina por orina, no se espera que la diálisis renal acelere el aclaramiento del fármaco.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Urológicos, Fármacos utilizados en disfunción eréctil, código ATC: G04B E03
Mecanismo de acción
Sildenafilo es un inhibidor potente y selectivo de la fosfodiesterasa tipo 5 (PDE5) específica de la guanosina monofosfatasa cíclica (GMPc) que es la enzima responsable de la degradación del GMPc.
Además de la presencia de esta enzima en el cuerpo cavernoso del pene, la PDE5 está presente en la vasculatura pulmonar. Sildenafilo, por tanto, eleva el GMPc en las células de la vasculatura muscular lisa pulmonar produciendo relajación. En pacientes con hipertensión pulmonar esto puede llevar a vasodilatación del lecho vascular pulmonar y, en menor grado, vasodilatación en la circulación sistémica.
Efectos farmacodinámicos
Los estudios in vitro han mostrado que sildenafilo es selectivo de la PDE5. Su efecto es más potente sobre la PDE5 que sobre otras fosfodiesterasas conocidas. Tiene una selectividad 10 veces mayor que por la PDE6, que participa en el mecanismo de fototransducción en la retina. Tiene una selectividad 80 veces superior por la PDE1 y 700 veces superior por la PDE2, 3, 4, 7, 8, 9, 10 y 11.
Particularmente, sildenafilo es 4.000 veces más selectivo por la PDE5 que por la PDE3, la isoforma fosfodiesterasa específica del AMPc relacionada con el control de la contractilidad cardíaca.
Sildenafilo causa una disminución leve y transitoria en la presión arterial sistémica que, en la mayoría de los casos, no se traduce en efectos clínicos. Tras la administración crónica de 80 mg tres veces al día en pacientes con hipertensión sistémica, el cambio medio desde la basal en las tensiones sanguíneas sistólica y diastólica fue una reducción de 9,4 mmHg y 9,1 mmHg, respectivamente. Tras la administración crónica de 80 mg tres veces al día en pacientes con hipertensión arterial pulmonar, se observaron menos efectos sobre la presión sanguínea (una reducción de 2 mmHg tanto en la presión sistólica como diastólica). Con la dosis recomendada de 20 mg tres veces al día, no se han observado reducciones de la presión sistólica o diastólica.
Dosis únicas orales de sildenafilo de hasta 100 mg en voluntarios sanos no produjeron efectos clínicamente relevantes sobre el ECG. Tras la administración crónica de 80 mg tres veces al día en pacientes con hipertensión arterial pulmonar no se comunicaron efectos clínicamente relevantes sobre el ECG.
En un ensayo sobre los efectos hemodinámicos de una dosis oral única de 100 mg de sildenafilo en 14 pacientes con cardiopatía coronaria grave (CC) (> 70% de estenosis de al menos una arteria coronaria), las presiones sanguíneas sistólica y diastólica en reposo se redujeron en un 7% y 6%, respectivamente comparadas con la basal. La presión sanguínea sistólica pulmonar media se redujo en un 9%. Sildenafilo no evidenció efectos sobre el gasto cardíaco, ni alteró al flujo sanguíneo en las arterias coronarias estenosadas.
En algunos pacientes, se han detectado diferencias leves y transitorias en la discriminación del color (azul/verde), cuando se utilizó la prueba de tinción Farnsworth-Munsell 100, una hora después de administrar una dosis de 100 mg, sin que se produjeran efectos evidentes a las dos horas de la administración. El mecanismo postulado para este cambio en la discriminación de color se relaciona con la inhibición de la PDE6, que participa en la cascada de fototransducción de la retina.
Sildenafilo no tiene efectos sobre la agudeza visual o sensibilidad al contraste. En un ensayo de pequeño tamaño controlado con placebo en pacientes con degeneración macular temprana documentada (n=9), se demostró que sildenafilo (dosis única, 100 mg) no produjo cambios significativos en las pruebas visuales realizadas (agudeza visual, test de Amsler, discriminación de los colores estimulados por las luces de tráfico, perímetro de Humphrey y fotoestrés).
Eficacia y seguridad clínicas
Eficacia en pacientes adultos con hipertensión arterial pulmonar (HAP)
Se realizó un ensayo aleatorizado, doble-ciego, controlado con placebo en 278 pacientes con hipertensión pulmonar primaria (idiopática), HAP asociada con enfermedad del tejido conectivo y HAP tras reparación quirúrgica de cardiopatías congénitas. Se asignaron aleatoriamente a uno de los cuatro grupos de tratamiento: placebo, sildenafilo 20 mg, sildenafilo 40 mg o sildenafilo 80 mg, tres veces al día. De los 278 pacientes aleatorizados, 277 pacientes recibieron al menos una dosis del medicamento en investigación. La población del ensayo consistía en 68 (25%) hombres y 209 (75%) mujeres con una edad media de 49 años (rango: 18-81 años) y distancia basal en la prueba de la distancia recorrida en 6 minutos entre 100 y 450 metros inclusive (media: 344 metros). 175 pacientes (63%) incluidos fueron diagnosticados de hipertensión pulmonar primaria, 84 (30%) fueron diagnosticados de HAP asociada a enfermedad del tejido conectivo y 18 (7%) de los pacientes fueron diagnosticados de HAP tras reparación quirúrgica de cardiopatías congénitas. La mayoría de los pacientes pertenecía a la Clase Funcional II de la OMS (107/277; 39%) o III (160/277; 58%) con una distancia basal media en la prueba de la distancia recorrida en 6 minutos, de 378 metros y de 326 metros respectivamente; un menor número eran de la Clase funcional I (1/277; 0,4%) o IV (9/277;
3%) en el inicio. No se estudiaron pacientes con una fracción de eyección ventricular izquierda <45% o un acortamiento de la fracción ventricular izquierda <0,2.
Se añadió sildenafilo (o placebo) al tratamiento de base de los pacientes que incluía una combinación de anticoagulantes, digoxina, bloqueantes de los canales del calcio, diuréticos u oxígeno. No se permitió, como terapia añadida, el uso de prostaciclina, análogos de la prostaciclina y antagonistas de los receptores de la endotelina así como tampoco de los suplementos de arginina. Se excluyó del ensayo a los pacientes en los que previamente había fracasado bosentan.
La variable primaria de eficacia fue el cambio entre la distancia recorrida en 6 minutos (DR6M) basal y a las 12 semanas. Se observó un aumento estadísticamente significativo en la DR6M en todos (3) los grupos que recibían dosis de sildenafilo en comparación con placebo. Los aumentos, corregidos con placebo, en la DR6M eran 45 metros (p <0,0001), 46 (p<0,0001) y 50 metros (p<0,0001) con 20 mg, 40 mg y 80 mg de sildenafilo TID, respectivamente. No hubo diferencias significativas en los efectos entre las dosis de sildenafilo. En los pacientes con una DR6M basal <325 metros se observó una mejora en la eficacia con las dosis más altas (mejoras corregidas con placebo de 58 metros, 65 metros y 87 metros con 20 mg, 40 mg y 80 mg TID, respectivamente).
Cuando se analizaron, de acuerdo con la clase funcional de la OMS, se observó un aumento estadísticamente significativo en la DR6M del grupo tratado con dosis de 20 mg. Se observaron unos aumentos de la DR6M frente a placebo, para las clases funcionales II y III, de 49 metros (p=0,0007) y 45 metros (p=0,0031) respectivamente.
La mejoría en la DR6M era visible tras 4 semanas de tratamiento y este efecto se mantuvo durante las semanas 8 y 12. Los resultados fueron generalmente concordantes en los subgrupos de acuerdo con la etiología (HAP primaria y asociada a enfermedad del tejido conectivo ), clase funcional de la OMS, sexo, raza, situación, PAP media y IRVP.
Los pacientes que recibían cualquier dosis de sildenafilo alcanzaron una reducción estadísticamente significativa en la presión arterial pulmonar media (PAPm) y la resistencia vascular pulmonar (RVP) en comparación con los tratados con placebo. Los efectos del tratamiento, corregidos con placebo, para la PAPm fueron de -2,7 mmHg (p =0,04), -3,0 mmHg (p =0,01) y -5,1 mmHg (p =0,0001), con 20 mg, 40 mg y 80 mg de sildenafilo TID, respectivamente. . Los efectos del tratamiento corregidos con placebo en la RVP fueron de -178 dina.s/cm5 (p=0,0051), -195 dina.s/cm5 (p=0,0017) y -320 dina.s/cm5 (p<0,0001) con 20 mg, 40 mg y 80 mg TID de sildenafilo, respectivamente. El porcentaje de reducción a las 12 semanas con 20 mg, 40 mg y 80 mg TID de sildenafilo en la RVP (11,2%,
12,9%, 23,3%) era proporcionalmente mayor que la reducción en la resistencia vascular sistémica (RVS) (7,2%, 5,9 %, 14,4 %). Se desconoce el efecto de sildenafilo sobre la mortalidad.
Un mayor porcentaje de pacientes en cada dosis de sildenafilo (es decir, 28 %, 36 % y 42 % de los sujetos que recibieron dosis de 20 mg, 40 mg y 80 mg TID de sildenafilo, respectivamente) evidenció una mejoría de al menos una clase funcional de la OMS en la semana 12 comparado con placebo (7 %). Los respectivos odds ratios fueron 2,92 (p=0,0087), 4,32 (p=0,0004) y 5,75 (p<0,0001).
Datos de supervivencia a largo _plazo en _población naive
Los pacientes que se incluyeron en el estudio pivotal eran candidatos para entrar en un estudio de extensión, abierto, a largo plazo. A los 3 años, el 87% de los pacientes estaban recibiendo una dosis de 80 mg TID. En el estudio pivotal, un total de 207 pacientes fueron tratados con Revatio, y se evaluó su supervivencia a largo plazo durante un mínimo de 3 años. En esta población, las estimaciones de Kaplan-Meier de supervivencia a los 1, 2 y 3 años fueron de 96%, 91% y 82%, respectivamente. La supervivencia de los pacientes tipificados como clase funcional II de la OMS desde el inicio hasta 1,2 y 3 años fue de 99%, 91% y 84%, respectivamente y de los pacientes tipificados como la clase funcional III de la OMS desde el inicio hasta 1,2 y 3 años fue de 94%, 90% y 81%, respectivamente.
Eficacia en _pacientes adultos con HAP (cuando se utiliza en combinación con epoprostenol)
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 267 pacientes con HAP que estaban estabilizados con epoprostenol intravenoso. Los pacientes con HAP incluidos padecían Hipertensión Arterial Pulmonar Primaria (212/267, 79%) y HAP asociada con enfermedad del tejido conectivo (55/267, 21%). Al inicio la mayoría de los pacientes estaban tipificados como clase funcional II (68/267, 26%) o III (175/267, 66%) de la OMS; pocos pacientes estaban tipificados como clase funcional I (3/267, 1%) o IV (16/267, 6%) de la OMS; en unos pocos pacientes (5/267, 2%) se desconocía la clase funcional de la OMS. Los pacientes fueron aleatorizados para recibir placebo o sildenafilo (en una titulación fija que se iniciaba con 20 mg, pasando a 40 mg y posteriormente a 80 mg, tres veces al día, si se toleraba) cuando se utilizaba en combinación con epoprostenol intravenoso.
La variable principal de eficacia era el cambio desde el inicio hasta la semana 16 en la prueba de la distancia recorrida en 6 minutos. Hubo un beneficio estadísticamente significativo en la DR6M para sildenafilo comparado con placebo. Se observó un aumento en la DR6M, corregida con placebo, de 26 metros a favor de sildenafilo (95% IC: 10,8; 41,2) (p=0,0009). En los pacientes que inicialmente alcanzaban una DR6M > 325 metros, el efecto del tratamiento era de 38,4 metros a favor de sildenafilo mientras que en los pacientes que inicialmente recorrían una DR6M <325 metros, el efecto del tratamiento fue de 2,3 metros a favor de placebo. En los pacientes con HAP primaria, el efecto del tratamiento fue de 31,1 metros comparado con 7,7 metros en los pacientes con HAP asociada a enfermedad del tejido conectivo. La diferencia en los resultados entre los subgrupos aleatorizados puede deberse a la casualidad a la vista del limitado tamaño de la muestra.
Los pacientes tratados con sildenafilo alcanzaron una reducción estadísticamente significativa de la Presión Arterial Pulmonar media (PAPm) en comparación con los tratados con placebo. Se observó un efecto medio del tratamiento, corregido con placebo, de -3,9 mmHg a favor de sildenafilo (95% IC: -5,7; -2,1) (p=0,00003). El tiempo hasta empeoramiento clínico era una variable secundaria que se definió como el tiempo desde la aleatorización hasta la aparición del primer acontecimiento de empeoramiento clínico (muerte, trasplante pulmonar, inicio del tratamiento con bosentan o un deterioro clínico que requiriese un cambio en el tratamiento con epoprostenol). El tratamiento con sildenafilo retrasó significativamente el tiempo hasta empeoramiento clínico de la HAP en comparación con placebo (p=0,0074). Veintitrés sujetos sufrieron acontecimientos de empeoramiento clínico en el grupo placebo (17,6%) en comparación con 8 sujetos en el grupo de sildenafilo (6,0%).
Datos de supervivencia a largo plazo en un estudio con epoprostenol de tratamiento base Los pacientes que entraron en el estudio de tratamiento añadido a epoprostenol eran elegibles para entrar en un estudio de extensión abierto a largo plazo. A los 3 años el 68% de los pacientes estaba recibiendo una dosis de 80 mg TID. En el estudio inicial se trataron un total de 134 pacientes con Revatio y se evaluó su estado de supervivencia a largo plazo durante un mínimo de 3 años. En esta población, las estimaciones de supervivencia de Kaplan-Meier a 1, 2 y 3 años fueron de 92 %, 81 % y 74 %, respectivamente.
Eficacia y seguridad en pacientes adultos con HAP (cuando se utiliza en combinación con bosentan)
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 103 sujetos con HAP (grado funcional II y III de la OMS) clínicamente estables, que llevaban en tratamiento con bosentan un mínimo de tres meses. Los pacientes con HAP incluían aquellos pacientes con HAP primaria, y HAP asociada a enfermedad del tejido conectivo. Se aleatorizó a los pacientes para recibir placebo o sildenafilo (20 mg tres veces al día) en combinación con bosentan (62,5 - 125 mg dos veces al día). La variable principal de eficacia fue el cambio en la DR6M desde el inicio a la semana 12. Los resultados indican que no se observa una diferencia significativa en la media del cambio en la DR6M desde el inicio, entre 20 mg de sildenafilo y placebo (13,62 m (95% IC: -3,89 a 31,12) y 14,08 m (95% IC: -3,89 a 31,12), respectivamente).
Se observaron diferencias en la DR6M entre los pacientes con HAP primaria y los pacientes con HAP asociada a enfermedad del tejido conectivo. En el caso de los sujetos con HAP primaria (67 sujetos), la media de cambio desde el inicio fue de 26,39 m (95% IC: 10,70 a 42,08) y 11,84 m (95% IC: -8,83 a 32,52) para los grupos con sildenafilo y placebo, respectivamente. Sin embargo, en el caso de los sujetos con HAP asociada a enfermedad del tejido conectivo (36 sujetos), la media del cambio desde el inicio fue de -18,32 m (95% IC: -65,66 a 29,02) y 17,50 m (95% IC: -9,41 a 44,41) para los grupos con sildenafilo y placebo, respectivamente.
En conjunto, los acontecimientos adversos fueron, por lo general, similares entre ambos grupos de tratamiento (sildenafilo más bosentan frente a bosentan en monoterapia), y coherentes con el perfil de seguridad conocido de sildenafilo cuando se emplea en monoterapia (ver secciones 4.4 y 4.5).
Población pediátrica
Un total de 234 sujetos de edades entre 1 y 17 años fueron tratados en un estudio aleatorizado, doble ciego, multicéntrico, controlado con placebo de grupos paralelos de rango de dosis. Los sujetos (38% varones y 62% mujeres) tenían un peso corporal > 8 kg, y tenían hipertensión arterial pulmonar primaria (HPP) [33%], o HAP secundaria a cardiopatía congénita [shunt sistémico pulmonar_37%, reparación quirúrgica 30%]. En este estudio, 63 de los 234 (27 %) pacientes eran < 7 años (dosis baja de sildenafilo = 2; dosis media = 17; dosis alta = 28; placebo = 16) y 171 de los 234 (73%) pacientes tenían 7 años o más (dosis baja de sildenafilo = 40; dosis media = 38; y dosis alta = 49; placebo = 44). En el momento basal, la mayoría de los sujetos estaban en clase funcional I (75/234, 32%) o II de la OMS (120/234, 51%); menos pacientes estaban en clase funcional III (35/234, 15%) o IV (1/234, 0.4%); en unos pocos pacientes (3/234, 1.3%), se desconocía la clase funcional de la OMS.
Los pacientes eran naíve a tratamientos específicos para la HAP y no se permitió en el estudio el uso de prostaciclina, análogos de la prostaciclina y antagonistas de los receptores de endotelina, ni de suplementos de arginina, nitratos, alfa-bloqueantes e inhibidores potentes del CYP450 3A4.
El objetivo primario del estudio era evaluar la eficacia a 16 semanas del tratamiento crónico con sildenafilo oral en sujetos pediátricos para mejorar la capacidad de ejercicio medida por el Test de Ejercicio Cardiopulmonar (TECP) en sujetos que estaban lo bastante desarrollados para realizar el test (n=115). Las variables secundarias incluían monitorización hemodinámica, evaluación de síntomas, clase funcional de la OMS, cambios en el tratamiento basal y determinaciones de calidad de vida.
Los sujetos fueron aleatorizados a uno de los tres grupos de tratamiento de sildenafilo con regímenes de dosis baja (10 mg), media (10-40 mg) o alta (20-80 mg) de Revatio administrado tres veces al día, o placebo. Las dosis realmente administradas en cada grupo dependieron del peso corporal (ver sección 4.8). La proporción de sujetos que recibieron medicación de soporte al inicio (anticoagulantes, digoxina, bloqueantes de los canales del calcio, diuréticos y/o oxígeno) fue similar en los grupos de sildenafilo combinados (47,7%) y grupo tratados con placebo (41,7%).
La variable principal fue el porcentaje de cambio corregido con placebo en el VO2 pico desde la basal hasta la semana 16 evaluado por el TECP en los grupos combinados de dosis (Tabla 2). Un total de 106 de 234 (45%) sujetos fueron evaluables por el TECP, que incluía aquellos niños > 7 años y con un desarrollo capaz de realizar el test. Los niños < 7 años (dosis combinadas de sildenafilo = 47; placebo = 16) solo fueron evaluados para las variables secundarias. Los volúmenes medios basales del consumo pico de oxígeno (VO2) fueron comparables en todos los grupos de tratamiento de sildenafilo (17,37 a 18,03 ml/kg/min) y ligeramente superior en el grupo tratado con placebo (20,02 ml/kg/min). Los resultados del análisis principal (grupos de dosis combinados versus placebo) no fueron estadísticamente significativos (p = 0,056) (ver Tabla 2). La diferencia estimada entre la dosis media de sildenafilo y placebo fue de 11,33% (IC 95%: 1,72 a 20,94) (ver Tabla 2).
Tabla 2: Porcentaje de cambio corregido con placebo en el VO2 pico por grupo de tratamiento activo
Grupo de tratamiento
Diferencia estimada Intervalo de confianza del
95%
Dosis baja 3,81 -6,11; 13,73
(n=24)
Dosis media 11,33 1,72; 20,94
(n=26)
Dosis alta 7.98 -1,64; 17,60
(n=27)
Grupos de dosis 7,71 -0,19; 15,60
combinados (n=77) (p = 0,056)
n=29 para el grupo de placebo
Estimados basados en el ANCOVA con ajustes para las covarianzas del VO2 máximo en la basal, etiología y grupo de peso.
Se observaron mejorías relacionadas con la dosis en el índice de resistencia vascular pulmonar (IPVR) y presión arterial pulmonar media (PAPm). Los grupos de dosis media y alta de sildenafilo mostraron reducciones del IPVR comparados con placebo, del 18% (IC 95%: 2% a 32%) y 27% (IC 95%: 14% a 39%), respectivamente; mientras que el grupo de dosis baja no mostró diferencia significativa con placebo (diferencia del 2%). Los grupos de dosis media y alta de sildenafilo mostraron cambios en la PAPm respecto a la basal en comparación con placebo, de -3,5 mmHg (IC 95%: -8,9; 1,9) y -7,3 mmHg (IC 95%: -12,4; -2,1), respectivamente; mientras que el grupo de dosis baja mostró poca diferencia con placebo (diferencia de 1,6 mmHg). Se observaron mejorías en el índice cardiaco en los tres grupos de sildenafilo sobre placebo, 10%, 4% y 15% para los grupos de dosis baja, media y alta, respectivamente.
Sólo se demostraron mejorías significativas en la clase funcional en los sujetos con dosis alta de sildenafilo comparados con los de placebo. Los cocientes de Odds para los grupos de dosis baja, media y alta de sildenafilo comparados con placebo fueron de 0,6 (IC 95%: 0,18; 2,01), 2,25 (IC 95%: 0,75; 6,69) y 4,52 (IC 95%: 1,56; 13,10), respectivamente.
Datos de la extensión a largo plazo
De los 234 sujetos pediátricos tratados en el estudio a corto plazo, controlado mediante placebo, 220 participaron en el estudio de extensión a largo plazo. Los sujetos en el grupo del placebo en el estudio a corto plazo se les reasignó aleatoriamente a tratamiento con sildenafilo; a los sujetos con peso corporal < 20 kg se les englobó en los grupos de dosis intermedia o alta (1:1), mientras que a los sujetos con peso corporal > 20 kg se les englobó en los grupos de dosis baja, intermedia o alta (1:1:1). Del total de 229 sujetos a quienes se administró sildenafilo, hubo 55, 74 y 100 sujetos en los grupos de dosis baja, intermedia o alta, respectivamente. A lo largo del estudio de corto plazo y de largo plazo, la duración total del tratamiento desde el inicio del doble ciego para cada sujeto individual osciló entre 3 y 3129 días. Por grupo de tratamiento con sildenafilo, la duración mediana del tratamiento con sildenafilo fue de 1696 días (excluidos los 5 sujetos que recibieron placebo en el doble ciego y que no fueron tratados en la extensión de largo plazo del estudio).
La estimación de la supervivencia de Kaplan-Meier a los 3 años en pacientes con un peso corporal > 20 kg al inicio, fue del 94%, 93% y 85% en los grupos de dosis baja, media y alta, respectivamente; en pacientes con un peso corporal < 20 kg al inicio, la estimación de la supervivencia fue del 94% y 93% para los pacientes incluidos en los grupos de dosis media y alta, respectivamente (ver secciones 4.4 y 4.8).
Durante la realización del estudio, se notificaron un total de 42 muertes tanto durante el tratamiento como las notificadas durante el seguimiento de la supervivencia. 37 muertes se produjeron antes de la decisión del Comité de Control de los Datos de reducir la dosis hasta la dosis baja, como resultado del balance de muertes observado con el incremento de dosis de sildenafilo. Entre estas 37 muertes, el número (%) de muertes era de 5/55 (9,1%), 10/74 (13,5%) y 22/100 (22%) en los grupos de dosis baja, media y alta de sildenafilo, respectivamente. Posteriormente se notificaron 5 muertes adicionales. Las causas de estas muertes estaban relacionadas con la HAP. No deben utilizarse dosis superiores a las recomendadas en pacientes pediátricos con HAP (ver secciones 4.2 y 4.4).
Se evaluó el VO2 pico un año después del inicio del estudio controlado con placebo. De los sujetos tratados con sildenafilo cuyo desarrollo permitía realizar el TECP, en 59/114 sujetos (52%) no se evidenció ningún deterioro del VO2 máximo desde el inicio del tratamiento con sildenafilo. De forma similar, 191 de 229 sujetos (83%) que habían recibido sildenafilo durante el estudio controlado con placebo habían mantenido o mejorado su clase funcional de la OMS en el momento de la evaluación realizada tras un año.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Revatio en recién nacidos con hipertensión arterial pulmonar (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Sildenafilo se absorbe rápidamente. Tras la administración oral, en ayunas, se observan concentraciones plasmáticas máximas entre 30 y 120 minutos (mediana de 60 minutos) post-dosis. La biodisponibilidad oral absoluta media es del 41% (rango del 25 al 63%). Tras la administración oral tres veces al día de sildenafilo, el AUC y Cmax aumentaron en proporción a la dosis en el rango de dosis de 20-40 mg. Tras la administración de dosis orales de 80 mg tres veces al día, se observaron niveles plasmáticos de sildenafilo superiores a los proporcionales a la dosis. En pacientes con hipertensión arterial pulmonar, la biodisponibilidad oral de sildenafilo tras 80 mg tres veces al día fue de media un 43% (90% IC: 27% - 60%) mayor comparada con las dosis inferiores.
Cuando sildenafilo se administra con alimentos, la velocidad de absorción disminuye con un retraso medio en la Tmax de 60 minutos y una reducción media en la Cmax del 29%. No obstante, el grado de absorción no se vio significativamente afectado (el AUC se redujo en un 11%).
Distribución
El volumen medio de distribución (Vdss) en estado de equilibrio para sildenafilo es de 105 l, indicando una distribución tisular del fármaco. Tras la administración de dosis orales de 20 mg tres veces al día, la concentración plasmática máxima total media de sildenafilo en el estado de equilibrio es aproximadamente 113 ng/ml. Sildenafilo y su metabolito principal circulante N-desmetil se encuentran unidos a proteínas plasmáticas en un 96%. La unión a proteínas es independiente de las concentraciones totales de ambos compuestos.
Biotransformación
Sildenafilo se metaboliza predominantemente por las isoenzimas microsomales hepáticas CYP3A4 (principalmente) y CYP2C9 (en menor medida). El metabolito principal circulante resulta de la N-desmetilación de sildenafilo. Este metabolito tiene un perfil de selectividad por las fosfodiesterasas similar a sildenafilo y la potencia in vitro por PDE5 es de aproximadamente el 50% de la del principio activo original. El metabolito N-desmetil continúa metabolizándose, con una vida media terminal de aproximadamente 4 horas. En pacientes con hipertensión pulmonar, las concentraciones plasmáticas del metabolito desmetilo son aproximadamente el 72% de las de sildenafilo tras una administración diaria de 20 mg tres veces al día (traduciéndose su contribución en un 36% de los efectos farmacológicos de sildenafilo). Se desconocen los efectos posteriores sobre la eficacia.
Eliminación
El aclaramiento total de sildenafilo es de 41 l/hora, con una fase terminal resultante en una vida media de 3-5 horas. Tras la administración oral o intravenosa, sildenafilo se excreta en forma de metabolitos predominantemente en heces (aproximadamente el 80% de la dosis oral administrada) y en menor medida en orina (aproximadamente el 13% de la dosis oral administrada).
Farmacocinética en grupos especiales de pacientes
Pacientes de edad avanzada
Sildenafilo mostró un aclaramiento reducido en voluntarios sanos de edad avanzada (más de 65 años), siendo las concentraciones plasmáticas de sildenafilo y de su metabolito activo N-desmetil un 90% más altas que las observadas en voluntarios sanos jóvenes (18-45 años). La concentración de sildenafilo libre en el plasma fue aproximadamente un 40% mayor, debido al efecto que el envejecimiento ejerce sobre la unión a las proteínas plasmáticas.
Insuficiencia renal
En voluntarios con insuficiencia renal leve a moderada (aclaramiento de creatinina = 30-80 ml/min), no se alteró la farmacocinética de sildenafilo después de recibir una única dosis oral de 50 mg. En voluntarios con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min), se redujo el aclaramiento de sildenafilo, con un aumento del AUC y Cmax del 100% y del 88% respectivamente, en comparación a los voluntarios de la misma edad sin insuficiencia renal. Además, los valores de AUC y Cmax para el metabolito N-desmetil aumentaron significativamente en 200% y 79%, respectivamente en sujetos con insuficiencia renal grave en comparación con sujetos con función renal normal.
Insuficiencia hepática
En voluntarios con cirrosis hepática de leve a moderada (Child-Pugh clase A y B), el aclaramiento de sildenafilo se redujo, resultando en aumentos en el AUC (85%) y Cmax (47%) en comparación con voluntarios de la misma edad sin insuficiencia hepática. Además, los valores del AUC y Cmax para el metabolito N-desmetil estaban significativamente aumentados en un 154% y 87%, respectivamente en sujetos con cirrosis en comparación con sujetos con la función hepática normal. La farmacocinética de sildenafilo en pacientes con insuficiencia hepática grave no ha sido estudiada.
Farmacocinética en la población
En pacientes con hipertensión arterial pulmonar, las concentraciones medias en el estado de equilibrio eran de 20-50% superiores en el rango de dosis estudiado de 20-80 mg tres veces al día en comparación con los voluntarios sanos. La Cmin era el doble en comparación con los voluntarios sanos. Ambos hallazgos sugieren un menor aclaramiento y/o una mayor biodisponibilidad de sildenafilo en pacientes con hipertensión arterial pulmonar en comparación con voluntarios sanos.
Población pediátrica
A partir de los análisis del perfil farmacocinético de sildenafilo en pacientes incluidos en los estudios clínicos pediátricos, se demostró que el peso corporal era un buen valor predictivo de la exposición al fármaco en niños. Se estimó que los valores de la semivida de las concentraciones plasmáticas de sildenafilo oscilaban entre 4,2 y 4,4 horas para un intervalo de 10 a 70 kg de peso corporal y no mostraron ninguna diferencia que pudiera parecer como clínicamente importante. Se estimó que la Cmax tras una dosis única de 20 mg de sildenafilo administrada oralmente era de 49, 104 y 165 ng/ml en pacientes de 70, 20 y 10 kg, respectivamente. Se estimó que la Cmax tras una dosis única de 10 mg de sildenafilo administrada oralmente era de 24, 53 y 85 ng/ml en pacientes de 70, 20 y 10 kg, respectivamente. Se estimó la Tmax aproximadamente en 1 hora y era casi independiente del peso corporal.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción y el desarrollo.
En las crías de ratas que fueron tratadas pre- y postnatalmente con 60 mg/kg de sildenafilo, se observó una reducción del tamaño de la camada, un peso inferior en el día 1 y una reducción de la supervivencia en el día 4 con exposiciones que eran aproximadamente cincuenta veces la exposición esperada en humanos con 20 mg tres veces al día. En los estudios preclínicos se han observado efectos con exposiciones que se consideraron suficientemente en exceso de la dosis máxima en humanos lo que indica poca relevancia para el uso clínico.
No hubo reacciones adveras, con posible relevancia para el uso clínico, observadas en animales con niveles de exposición clínicamente relevantes que no hubieran sido observadas en los ensayos clínicos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido:
Celulosa microcristalina Fosfato cálcico dibásico (anhidro)
Croscarmelosa sódica Estearato magnésico
Recubrimiento:
Hipromelosa
Dióxido de titanio (E 171)
Lactosa monohidrato Triacetato de glicerol
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
5 años
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C. Conservar en el envase original para protegerlo de la humedad.
6.5 Naturaleza y contenido del envase
Blíster de PVC/Aluminio de 90 comprimidos.
Envase de 90 comprimidos en caja.
Blister de PVC/Aluminio de 300 comprimidos.
Envase de 300 comprimidos en caja.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial para su eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited, Sandwich, Kent CT13 9NJ, Reino Unido.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/318/001
EU/1/05/318/004
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 28/octubre/2005 Fecha de la última renovación: 23/septiembre/2010
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Revatio 0,8 mg/ml solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución contiene 0,8 mg de sildenafilo (como citrato). Cada vial de 20 ml contiene 12,5 ml de solución (10 mg de sildenafilo, como citrato)
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable.
Solución transparente, incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Revatio solución inyectable está indicado en el tratamiento de pacientes adultos (> 18 años)con hipertensión arterial pulmonar a los que se ha prescrito Revatio oral y que temporalmente no pueden recibir la terapia oral, pero que se encuentran clínica y hemodinámicamente estables.
Revatio (oral) está indicado para el tratamiento de pacientes adultos con hipertensión arterial pulmonar tipificada como grado funcional II y III de la OMS, para mejorar la capacidad de ejercicio. Se ha demostrado eficacia en hipertensión pulmonar primaria e hipertensión pulmonar asociada con enfermedades del tejido conjuntivo.
4.2 Posología y forma de administración
El tratamiento sólo debe iniciarse y controlarse por un médico con experiencia en el tratamiento de la hipertensión arterial pulmonar. En caso de deterioro clínico, pese al tratamiento con Revatio, deberán considerarse terapias alternativas.
Revatio solución inyectable debe administrarse a pacientes, a los que ya se ha prescrito Revatio oral, como sustitución a la administración oral, en aquellas condiciones en las que temporalmente no sea posible recibir tratamiento con Revatio oral.
No se ha establecido la seguridad y eficacia de dosis superiores a 12,5 ml (10 mg) TID.
Posología
Adultos
La dosis recomendada es de 10 mg (correspondientes a 12,5 ml) tres veces al día administrado como una inyección intravenosa en bolo (ver sección 6.6).
Se estima que una dosis de 10 mg de Revatio solución inyectable proporciona una exposición a sildenafilo y a su metabolito N-desmetil con unos efectos farmacológicos comparables a los de una dosis oral de 20 mg.
Pacientes en tratamiento con otros medicamentos:
En general, cualquier ajuste de dosis sólo debe administrarse tras una cuidadosa evaluación del balance beneficio-riesgo. En el caso de administración conjunta con inhibidores del CYP3A4, como eritromicina o saquinavir, debe considerarse una reducción de la dosis a 10 mg dos veces al día. Se recomienda una reducción de la dosis a 10 mg una vez al día en el caso de la administración concomitante con inhibidores más potentes del CYP3A4 como claritromicina, telitromicina y nefazodona. Para el uso de sildenafilo con inhibidores mucho más potentes del CYAP3A4, ver información en la sección 4.3. Puede requerirse un ajuste de la dosis para sildenafilo cuando se administra conjuntamente con inductores del CYP3A4 (ser sección 4.5).
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
No se requiere ajuste de la dosis en pacientes de edad avanzada. La eficacia clínica, medida por la prueba de marcha de 6 minutos, puede ser menor en pacientes de edad avanzada.
Insuficiencia renal:
No se requiere ajuste inicial de la dosis en pacientes con insuficiencia renal, incluyendo insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min). Unicamente si la terapia no es bien tolerada, debe considerarse un ajuste de dosis a 10 mg dos veces al día, tras una cuidadosa evaluación riesgo-beneficio.
Insuficiencia hepática:
No se requiere ajuste inicial de la dosis en pacientes con insuficiencia hepática (Child-Pugh clase A y B). Únicamente si la terapia no es bien tolerada, debe considerarse un ajuste de dosis a 10 mg dos veces al día, tras una cuidadosa evaluación del balance beneficio-riesgo.
Revatio está contraindicado en pacientes con insuficiencia hepática grave (Child-Pugh clase C), (ver sección 4.3).
Población pediátrica
Revatio solución inyectable no está indicado en niños menores de 18 años ya que no se dispone de suficientes datos de seguridad y eficacia.
Interrupción del tratamiento
Datos limitados sugieren que una interrupción abrupta del tratamiento con Revatio oral no se asocia con un empeoramiento de rebote de la hipertensión arterial pulmonar. No obstante para evitar la posible aparición de un deterioro repentino durante la interrupción, debe considerarse una reducción gradual de la dosis. Se recomienda un estrecho seguimiento durante el periodo de retirada.
Forma de administración
Revatio solución inyectable es para su administración por vía intravenosa como inyección en bolo.
Ver instrucciones de uso en la sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Administración concomitante con dadores de óxido nítrico (como el nitrilo de amilo) o nitratos en cualquier forma debido a los efectos hipotensores de los nitratos (ver sección 5.1).
La administración conjunta de inhibidores de la PDE5, incluyendo sildenafilo, con estimuladores de la guanilato-ciclasa, como riociguat, está contraindicado ya que puede producir hipotensión sintomática de forma potencial (ver sección 4.5).
Combinación con los inhibidores más potentes del CYP3A4 (por ejemplo, ketoconazol, itraconazol, ritonavir) (ver sección 4.5).
Pacientes que han perdido la visión en un ojo debido neuropatía óptica isquémica anterior no arterítica (NOIA-NA), independientemente de si este episodio se asoció o no con la exposición previa a un inhibidor de la PDE5 (ver sección 4.4).
No se ha estudiado la seguridad de sildenafilo en los siguientes subgrupos de pacientes y por tanto su uso está contraindicado:
Insuficiencia hepática grave,
Antecedentes de ictus o infarto de miocardio reciente,
Hipotensión grave (presión sanguínea < 90/50 mmHg) al inicio.
4.4 Advertencias y precauciones especiales de empleo
No se dispone de datos clínicos de la administración de sildenafilo IV en pacientes que están clínica o hemodinámicamente inestables. Por tanto no se recomienda su uso en estos pacientes.
No se ha establecido la eficacia de Revatio en pacientes con hipertensión arterial pulmonar grave (clase funcional IV). Si la situación clínica se deteriora, deben reconsiderarse las terapias que se recomiendan inicialmente en las etapas más graves de la enfermedad (por ejemplo, epoprostenol) (ver sección 4.2).
No se ha establecido el balance riesgo/beneficio de sildenafilo en pacientes con hipertensión arterial pulmonar tipificada como clase funcional I de la OMS.
Se han realizado estudios con sildenafilo en hipertensión arterial pulmonar primaria (idiopática), asociada a enfermedades del tejido conectivo o asociada a cardiopatías congénitas como formas de HAP (ver sección 5.1). No se recomienda el uso de sildenafilo en otras formas de HAP.
Retinitis pigmentaria
La seguridad de sildenafilo no ha sido estudiada en pacientes con conocidos trastornos hereditarios degenerativos de la retina tales como retinitis pigmentaria (una minoría de estos pacientes tienen trastornos genéticos de las fosfodiesterasas de la retina) y por tanto no se recomienda su uso.
Acción vasodilatadora
Al prescribir sildenafilo, el médico debe considerar cuidadosamente si los pacientes con ciertas patologías subyacentes pueden verse afectados de forma adversa por los efectos vasodilatadores de carácter leve a moderado producidos por sildenafilo, por ejemplo pacientes con hipotensión, con depleción de volumen, obstrucción grave del flujo ventricular izquierdo o alteración del control autónomo (ver sección 4.4).
Factores de riesgo cardiovascular
En el seguimiento post-comercialización de sildenafilo para el tratamiento de la disfunción eréctil masculina, se ha notificado la asociación temporal del uso del sildenafilo con acontecimientos cardiovasculares graves, incluyendo infarto de miocardio, angina inestable, muerte cardíaca súbita, arritmia ventricular, hemorragia cerebrovascular, ataque isquémico transitorio, hipertensión e hipotensión. La mayoría de estos pacientes, aunque no todos, padecían factores de riesgo cardiovascular anteriores. Se ha informado que muchos acontecimientos tuvieron lugar durante o poco tiempo después de la relación sexual y unos pocos sucedieron poco después del uso de sildenafilo sin actividad sexual. No es posible determinar si estos acontecimientos están directamente relacionados con estos factores o con otros factores.
Priapismo
Sildenafilo debe utilizarse con precaución en pacientes con deformaciones anatómicas del pene (tales como angulación, fibrosis cavernosa o enfermedad de Peyronie), o en pacientes con enfermedades que les pueden predisponer a sufrir priapismo (tales como anemia falciforme, mieloma múltiple o leucemia).
Se han notificado casos de erección prolongada y priapismo con sildenafilo durante la experiencia post-comercialización. En caso de que la erección persista más de 4 horas, el paciente debe solicitar inmediatamente atención médica. Si el priapismo no se trata inmediatamente, se puede producir daño en el tejido peneano y una pérdida permanente de potencia (ver sección 4.8).
Crisis vaso-oclusivas en pacientes con anemia de células falciformes
Sildenafilo no se debe utilizar en pacientes con hipertensión arterial pulmonar secundaria a anemia de células falciformes. En un estudio clínico se notificaron más frecuentemente acontecimientos de crisis vaso-oclusivas que requirieron hospitalización en los pacientes que recibieron Revatio que en los del grupo placebo lo que condujo a una finalización precoz de este estudio.
Acontecimientos visuales
De forma espontánea, se han comunicado casos de defectos visuales en asociación con la toma de sildenafilo y de otros inhibidores de la PDE5. De forma espontánea y en un estudio observacional, se han comunicado casos de neuropatía óptica isquémica anterior no arterítica, una enfermedad rara, en asociación con la toma de sildenafilo y de otros inhibidores de la PDE5 (ver sección 4.8). En el caso de algún defecto visual repentino, el tratamiento debe interrumpirse inmediatamente y se debe considerar un tratamiento alternativo (ver sección 4.3).
Alfa-bloqueantes
Se recomienda precaución cuando se administra sildenafilo a pacientes que reciben un alfa-bloqueante dado que la administración concomitante puede producir hipotensión sintomática en pacientes sensibles (ver sección 4.5). Antes de iniciar el tratamiento con sildenafilo, los pacientes deben encontrarse hemodinámicamente estables con la terapia con alfa-bloqueantes, a fin de minimizar el potencial para desarrollar hipotensión postural. Los médicos deben indicar a los pacientes qué hacer en caso de que experimenten síntomas de hipotensión postural.
Trastornos hemorrágicos
Estudios con plaquetas humanas indican que sildenafilo potencia el efecto antiagregante del nitroprusiato sódico in vitro. No existen datos de seguridad sobre la administración de sildenafilo a pacientes con trastornos hemorrágicos o con úlcera péptica activa. Por lo tanto, sildenafilo se debe administrar a estos pacientes sólo tras una evaluación cuidadosa del beneficio-riesgo.
Antagonistas de la vitamina K
En pacientes con hipertensión arterial pulmonar, puede existir un mayor riesgo de hemorragia cuando se inicia el tratamiento con sildenafilo en pacientes que ya están tomando un antagonista de la vitamina K, especialmente en pacientes con hipertensión arterial pulmonar secundaria a enfermedad del tejido conjuntivo.
Enfermedad veno-oclusiva
No se dispone de información con sildenafilo en pacientes con hipertensión arterial pulmonar asociada con enfermedad pulmonar veno-oclusiva. No obstante, se han comunicado casos de edema pulmonar con amenaza de muerte cuando se han utilizado vasodilatadores (principalmente prostaciclina) en estos pacientes. En consecuencia, si se produjeran signos de edema pulmonar cuando se administra sildenafilo a pacientes con hipertensión pulmonar, debe considerarse la posibilidad de una enfermedad veno-oclusiva asociada.
Uso de sildenafilo con bosentan
No se ha demostrado de forma concluyente la eficacia de sildenafilo en pacientes que ya están en tratamiento con bosentán (ver seciones 4.5 y 5.1).
Uso concomitante con otros inhibidores de la PDE5
No se ha estudiado la seguridad y eficacia de sildenafilo en pacientes con HAP cuando se administra conjuntamente con otros medicamentos inhibidores de la PDE5, incluyendo Viagra, y por tanto no se recomienda su uso concomitante (ver sección 4.5).
4.5 Interacción con otros medicamentos y otras formas de interacción
A menos que se indique lo contrario, los estudios de interacción se han realizado en varones adultos sanos utilizando sildenafilo oral. Estos resultados son relevantes para otras poblaciones y vías de administración.
Efectos de otros medicamentos sobre sildenafilo intravenoso
Las predicciones basadas en un modelo farmacocinético sugieren que las interacciones farmacológicas con los inhibidores del CYP3A4 deberían ser menores que las observadas con la administración de sildenafilo oral. Se espera que se reduzca la magnitud de la interacción para sildenafilo intravenoso, ya que las interacciones del sildenafilo oral se deben, al menos en parte, a los efectos del metabolismo de primer paso.
Efectos de otros medicamentos sobre sildenafilo oral
Estudios in vitro
El metabolismo de sildenafilo está mediado predominantemente por las isoformas 3A4 (principalmente) y 2C9 (en menor medida) del citocromo P450. Por lo tanto, los inhibidores de estas isoenzimas pueden reducir el aclaramiento de sildenafilo y los inductores de estas isoenzimas pueden aumentar el aclaramiento de sildenafilo. Para recomendaciones posológicas, ver secciones 4.2 y 4.3.
Estudios in vivo
Se ha evaluado la administración concomitante de sildenafilo oral y epoprostenol intravenoso (ver secciones 4.8 y 5.1).
No se ha estudiado, en ensayos clínicos controlados, la eficacia y seguridad de sildenafilo administrado con otros tratamientos para la hipertensión arterial pulmonar (por ejemplo, ambrisentán, iloprost). Por tanto se aconseja precaución en caso de administración conjunta.
No se ha estudiado la seguridad y eficacia de sildenafilo cuando se administra junto con otros inhibidores de la PDE5 en pacientes con hipertensión arterial pulmonar (ver sección 4.4)..
El análisis de los datos farmacocinéticos de la población de los ensayos clínicos en hipertensión arterial pulmonar, indicó una reducción del aclaramiento de sildenafilo y/o un aumento de la biodisponibilidad oral cuando se administró concomitantemente con sustratos del CYP3A4 y con la combinación de sustratos del CYP3A4 y beta-bloqueantes. Estos fueron los únicos factores con un impacto estadísticamente significativo sobre la farmacocinética de sildenafilo oral en pacientes con hipertensión arterial pulmonar. La exposición a sildenafilo en pacientes que recibían sustratos del CYP3A4 y sustratos del CYP3A4 junto con beta-bloqueantes fue un 43% y un 66% mayor, respectivamente, comparada con la de pacientes que no recibían este tipo de medicamentos. La exposición a sildenafilo fue 5 veces mayor con una dosis oral de 80 mg tres veces al día, en comparación a la exposición obtenida con la dosis oral de 20 mg tres veces al día. Este intervalo de concentración cubre el aumento en la exposición a sildenafilo observada en los estudios de interacción diseñados específicamente con inhibidores del CYP3A4 (excepto con los inhibidores más potentes del CYP3A4, por ejemplo ketoconazol, itraconazol, ritonavir).
Los inductores del CYP3A4 parecen tener un impacto substancial sobre la farmacocinética de sildenafilo oral en pacientes con hipertensión arterial pulmonar, que ha sido confirmado en un estudio de interacción in vivo con el inductor del CYP3A4, bosentan. La administración concomitante de 125 mg de bosentan (un inductor moderado del CYP3A4, CYP2C9 y posiblemente del CYP2C19) dos veces al día con 80 mg de sildenafilo oral tres veces al día (en estado de equilibrio) administrados de forma concomitante durante 6 días en voluntarios sanos produjo una reducción del 63% del AUC de sildenafilo. Un análisis farmacocinético poblacional de datos de sildenafilo en pacientes adultos con HAP que participaban en ensayos clínicos, entre los que se incluye un estudio de doce semanas destinado a evaluar la eficacia y la seguridad de 20 mg de sildenafilo oral tres veces al día añadidos a una dosis estable de bosentan (62,5 mg - 125 mg dos veces al día), indicó una reducción de la exposición a sildenafilo cuando se administraba conjuntamente con bosentan, similar a la observada en voluntarios sanos (ver secciones 4.4 y 5.1).
En aquellos pacientes que utilizan inductores potentes del CYP3A4, como carbamazepina, fenitoína, fenobarbital, hierba de San Juan y rifampicina, debe vigilarse estrechamente la eficacia de sildenafilo.
La administración conjunta de ritonavir, inhibidor de la proteasa del VIH, que es un potente inhibidor del citocromo P450, en el estado de equilibrio (500 mg dos veces al día) junto con sildenafilo oral (dosis única de 100 mg) produjo un aumento del 300% (4 veces) en la Cmax de sildenafilo y del 1000% (11 veces) en el AUC plasmática de sildenafilo. A las 24 horas, los niveles plasmáticos de sildenafilo eran todavía de aproximadamente de 200 ng/ml, en comparación con los aproximadamente 5 ng/ml cuando se administra sólo sildenafilo. Este hecho concuerda con los notables efectos de ritonavir sobre un gran número de sustratos del P450. En base a estos resultados farmacocinéticos está contraindicada la administración concomitante de sildenafilo y ritonavir en pacientes con hipertensión arterial pulmonar (ver sección 4.3).
La administración conjunta de saquinavir, inhibidor de la proteasa del VIH, un inhibidor del CYP3A4, en el estado de equilibrio (1200 mg tres veces al día), con sildenafilo oral (dosis única de 100 mg) produjo un aumento del 140% en la Cmax de sildenafilo y del 210% en el AUC de sildenafilo. Sildenafilo no tuvo efecto sobre la farmacocinética de saquinavir. Para recomendaciones posológicas, ver sección 4.2.
Cuando se administró una dosis única de 100 mg de sildenafilo oral con eritromicina, un inhibidor moderado del CYP3A4, en el estado de equilibrio (500 mg dos veces al día durante 5 días) hubo un incremento del 182% en la exposición sistémica de sildenafilo (AUC). Ver recomendaciones posológicas en la sección 4.2. En voluntarios varones sanos, no se observó evidencia de un efecto de azitromicina (500 mg diarios durante 3 días) sobre el AUC, Cmax, Tmax, constante de velocidad de eliminación o la consiguiente semivida de sildenafilo oral o de su metabolito principal en sangre. No se requiere un ajuste de la dosis. Cimetidina (800 mg), un inhibidor del citocromo P450 e inhibidor no específico del CYP3A4, produjo un aumento del 56% de la concentración plasmática de sildenafilo cuando se administró concomitantemente con sildenafilo oral (50 mg) a voluntarios sanos. No se requiere un ajuste de la dosis.
Se espera que los inhibidores más potentes del CYP3A4 como ketoconazol e itraconazol tengan efectos similares a los de ritonavir (ser sección 4.3). De los inhibidores del CYP3A4 como claritromicina, telitromicina y nefazodona se espera que tengan un efecto entre el de ritonavir y el de los inhibidores del CYP3A4 como saquinavir o eritromicina y se asume un aumento de 7 veces en la exposición. Por tanto, se recomiendan ajustes de dosis cuando se utilizan inhibidores del CYP3A4 (ver sección 4.2).
El análisis farmacocinético de la población en los pacientes con hipertensión arterial pulmonar que recibían sildenafilo oral sugiere que la administración conjunta de beta-bloqueantes en combinación con sustratos del CYP3A4 puede producir un aumento adicional en la exposición a sildenafilo comparado con la administración de sustratos del CYP3A4 solo.
El zumo de pomelo es un inhibidor débil del metabolismo del citocromo CYP3A4 localizado en la pared intestinal que puede provocar pequeños incrementos de los niveles plasmáticos de sildenafilo oral. No se requiere un ajuste de la dosis, pero no se recomienda el uso concomitante de sildenafilo y zumo de pomelo.
Dosis únicas de antiácido (hidróxido magnésico/hidróxido de aluminio) no afectaron la biodisponibilidad de sildenafilo oral.
La administración concomitante de anticonceptivos orales (30 ^g de etinilestradiol y 150 ^.g de levonorgestrel) no afectaron la farmacocinética de sildenafilo oral
Nicorandil es un híbrido de activador de los canales de potasio y nitrato. Debido al componente nitrato, tiene potencial para presentar una interacción grave con sildenafilo (ver sección 4.3).
Efectos de sildenafilo oral sobre otros medicamentos
Estudios in vitro
Sildenafilo es un inhibidor débil de las isoformas 1A2, 2C9, 2C19, 2D6, 2E1 y 3A4 (IC50 > 150 pM) del citocromo P450.
No se dispone de datos sobre la interacción de sildenafilo e inhibidores no específicos de la fosfodiesterasa como teofilina o dipiridamol.
Estudios in vivo
No se han observado interacciones significativas cuando se administró sildenafilo oral (50 mg) concomitantemente con tolbutamida (250 mg) o warfarina (40 mg), metabolizándose ambos por el CYP2C9.
Sildenafilo oral no tuvo efectos significativos sobre la exposición a atorvastatina (el AUC aumentó un 11%), lo que sugiere que sildenafilo no tiene un efecto clínicamente relevante sobre el CYP3A4.
No se observaron interacciones entre sildenafilo oral (dosis única de 100 mg) y acenocumarol.
Sildenafilo oral (50 mg) no potenció el aumento del tiempo de hemorragia causado por ácido acetilsalicílico (150 mg).
Sildenafilo oral (50 mg) no potenció los efectos hipotensores del alcohol en voluntarios sanos con niveles máximos medios de alcohol en sangre de 80 mg/dl.
En un estudio en voluntarios sanos, sildenafilo oral en el estado de equilibrio (80 mg tres veces al día), produjo un aumento del 50% en el AUC de bosentan (125 mg dos veces al día). Un análisis farmacocinético poblacional de datos procedentes de un estudio con pacientes adultos con HAP que recibían tratamiento de base con bosentan (65,5 mg - 125 mg dos veces al día) indicó un aumento (20% (95% IC:9,8 - 30,8) del AUC de bosentan con la administración concomitante de sildenafilo en estado de estacionario (20 mg tres veces al día) de magnitud inferior a la observada en voluntarios sanos cuando se administró conjuntamente con 80 mg de sildenafilo tres veces al día (ver secciones 4.4 y 5.1).
En un estudio de interacción específico, cuando se administró concomitantemente sildenafilo oral (100 mg) junto con amlodipino en pacientes hipertensos, hubo una reducción adicional de la presión sanguínea sistólica en posición supina de 8 mmHg. La correspondiente reducción adicional de la presión sanguínea diastólica en posición supina fue de 7 mmHg. Estas reducciones adicionales de la presión sanguínea eran de magnitud similar a las observadas con sildenafilo cuando se administró solo a voluntarios sanos.
En tres estudios específicos de interacción, se administraron simultáneamente el alfa-bloqueante doxazosina (4 mg y 8 mg) y sildenafilo oral (25 mg, 50 mg o 100 mg) a pacientes con hiperplasia prostática benigna (HPB) que estaban estabilizados con el tratamiento con doxazosina. En estas poblaciones del estudio, se observaron reducciones adicionales medias de las tensiones sanguínea sistólica y diastólica en posición supina de 7/7 mmHg, 9/5 mmHg y 8/4 mmHg, respectivamente, y reducciones adicionales medias de la presión sanguínea en bipedestación de 6/6 mmHg, 11/4 mmHg y 4/5 mmHg, respectivamente. Infrecuentemente se comunicaron casos de pacientes que sufrieran hipotensión postural sintomática, cuando se administran simultáneamente sildenafilo y doxazosina a pacientes estabilizados con tratamiento con doxazosina. Estos informes incluyeron mareos y vértigo, pero no síncope. La administración simultánea de sildenafilo a pacientes que recibían tratamiento con alfa-bloqueantes puede conducir a hipotensión sintomática en pacientes sensibles (ver sección 4.4).
Sildenafilo oral (dosis única de 100 mg) no afectó a la farmacocinética en estado de equilibrio del inhibidor de la proteasa del VIH, saquinavir, que es un substrato/inhibidor del CYP3A4.
Concordantemente con sus conocidos efectos sobre la vía óxido nítrico/GMPc (ver sección 5.1), sildenafilo ha mostrado potenciar los efectos hipotensores de los nitratos y por tanto está contraindicada su administración concomitante con dadores de óxido nítrico o nitratos en cualquier forma (ver sección 4.3).
Riociguat
Estudios preclínicos mostraron un efecto aditivo de la disminución de la presión arterial sistémica cuando se combinaron inhibidores de la PDE5 con riociguat. Riociguat ha mostrado en ensayos clínicos que aumenta los efectos hipotensores de los inhibidores de la PDE5. En la población estudiada no hubo indicios de un efecto clínico favorable de dicha combinación. El uso concomitante de riociguat con inhibidores de la PDE5, incluyendo sildenafilo, está contraindicado (ver sección 4.3).
Sildenafilo oral no tiene impacto clínicamente significativo sobre los niveles plasmáticos de los anticonceptivos orales (30 pg de etinilestradiol y 150 pg de levonorgestrel).
Población pediátrica
Solo se han realizado estudios de interacción en adultos.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil y anticoncepción en hombres y mujeres.
A causa de la falta de datos sobre los efectos de Revatio en mujeres embarazadas, Revatio no está recomendado en mujeres en edad fértil amenos que se utilicen medidas anticonceptivas adecuadas.
Embarazo
No hay datos sobre el uso de sildenafilo en mujeres embarazadas. Los estudios en animales no indican efectos perjudiciales directos o indirectos respecto al embarazo y desarrollo embrionario/fetal. Los estudios en animales han revelado toxicidad respecto al desarrollo postnatal (ver sección 5.3).
Lactancia
A causa de la falta de datos, Revatio no debe utilizarse en mujeres embarazadas a menos que sea estrictamente necesario. No se sabe si sildenafilo penetra en la leche materna. Revatio no debe administrarse a mujeres lactantes.
Fertilidad
Los estudios preclínicos no han revelado un riesgo especial para los humanos en base a los estudios convencionales de fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Revatio sobre la capacidad para conducir y utilizar máquinas es moderada.
Como en los ensayos clínicos con sildenafilo se notificaron mareos y trastornos visuales, los pacientes deben saber cómo les puede afectar Revatio antes de conducir vehículos o utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas resultantes del uso de Revatio intravenoso son similares a los asociados al uso de Revatio oral. Dado que los datos con Revatio intravenoso son limitados y que el modelo farmacocinético predice que 20 mg de la formulación oral y 10 mg de la formulación intravenosa proporcionarán una exposición plasmática similar, la información de seguridad para Revatio intravenoso está apoyada por la de Revatio oral.
Administración intravenosa
Se estima que una dosis de 10 mg de Revatio solución inyectable proporciona una exposición total a sildenafilo libre y a su metabolito N-desmetil con unos efectos farmacológicos combinados comparables a los de una dosis oral de 20 mg.
El estudio A1481262 fue un ensayo monocéntrico, con dosis única, abierto para evaluar la seguridad, tolerancia y farmacocinética de una dosis única de sildenafilo intravenoso (10 mg) administrado como una inyección en bolo en pacientes con Hipertensión Arterial Pulmonar (HAP) que estaban recibiendo Revatio 20 mg tres veces al día y estaban estables.
Un total de 10 pacientes con HAP se incluyeron y completaron el estudio. La media de los cambios posturales en la presión sanguínea sistólica y diastólica fue pequeña (< 10 mmHg) y volvieron a las valores iniciales después de 2 horas. Con estos cambios no se asociaron síntomas de hipotensión. La media del cambio en el ritmo cardiaco fue clínicamente no significativa. Dos sujetos sufrieron un total de 3 reacciones adversas (rubefacción, flatulencia y sofocos). Se produjo una reacción adversa grave en un sujeto con cardiomiopatía isquémica grave que sufrió una fibrilación ventricular y murió tras 6 días de exposición al fármaco del estudio. Se consideró un efecto no relacionado con el medicamento en estudio.
Administración oral
En el ensayo pivotal de Revatio en hipertensión arterial pulmonar, controlado con placebo, un total de 207 pacientes fueron aleatorizados para ser tratados con dosis de 20 mg, 40 mg u 80 mg de Revatio oral TID y 70 pacientes fueron aleatorizados para recibir placebo. La duración del tratamiento fue de 12 semanas. La frecuencia global de abandonos en el grupo de pacientes tratados con dosis de 20 mg, 40 mg y 80 mg de sildenafilo TID fue de 2,9%, 3,0% y 8,5% respectivamente, en comparación con el 2,9% con placebo. De los 277 sujetos tratados en el ensayo pivotal, 259 entraron en un ensayo de extensión a largo plazo. Se administraron dosis de hasta 80 mg tres veces al día (4 veces superiores a la dosis recomendada de 20 mg tres veces al día) y tras 3 años, un 87% de los 183 pacientes en tratamiento del estudio estaban recibiendo 80 mg TID de Revatio.
En un ensayo controlado con placebo de Revatio como terapia adyuvante a epoprostenol intravenoso en hipertensión arterial pulmonar, un total de 134 pacientes fueron tratados con Revatio oral (en una titulación fija que se iniciaba con 20 mg pasando a 40 mg y posteriormente a 80 mg, tres veces al día, si se toleraba) y epoprostenol; y 131 pacientes fueron tratados con placebo y epoprostenol. La duración del tratamiento fue de 16 semanas. La tasa global de retirada de los pacientes tratados con sildenafilo/epoprostenol debido a acontecimientos adversos fue del 5,2% en comparación con la del 10,7% en los pacientes tratados con placebo/epoprostenol. Las nuevas reacciones adversas que se notificaron con mayor frecuencia en el grupo de silfenafilo/epoprostenol, fueron: hiperemia ocular, visión borrosa, congestión nasal, sudores nocturnos, dolor de espalda y sequedad de boca. Los acontecimientos adversos conocidos: cefalea, rubefacción, dolor en las extremidades y edema se observaron con mayor frecuencia en los pacientes tratados con sildenafilo/epoprostenol en comparación con los pacientes que recibían placebo/epoprostenol. De los sujetos que completaron el estudio inicial, 242 entraron en un estudio de extensión a largo plazo. Se administraron dosis de hasta 80 mg TID, y tras 3 años el 68% de los 133 pacientes en tratamiento del estudio estaban recibiendo 80 mg TID de Revatio.
En los dos ensayos de Revatio oral controlados con placebo, los efectos adversos fueron generalmente de leves a moderados. Los efectos adversos más comúnmente comunicados que se produjeron con mayor frecuencia (mayor o igual a 10%) con Revatio en comparación con placebo eran cefalea, rubefacción, dispepsia, diarrea y dolor en una extremidad.
Tabla de reacciones adversas
Las reacciones adversas, que se produjeron en > 1% de los pacientes tratados con Revatio y que eran más frecuentes (> 1% de diferencia) con Revatio en el ensayo pivotal o en el conjunto de los datos combinados de los dos ensayos de Revatio controlados con placebo en hipertensión arterial pulmonar, con dosis orales de 20, 40 ó 80 mg TID, se muestran en la siguiente tabla agrupadas por grupos y frecuencias (muy frecuente (> 1/10), frecuente (> 1/100 a < 1/10), poco frecuente ((> 1/1000 a
< 1/100) y frecuencia no conocida (no puede estimarse con los datos disponibles)). Dentro de cada grupo de frecuencias, se presentan los efectos adversos en orden descendente de gravedad.
Las reacciones adversas notificadas durante la experiencia post-comercialización se incluyen en cursiva.
|
Clasificación de Órganos del Sistema MedDRA (V.14.0) |
Reacción adversa |
|
Infecciones e infestaciones Frecuentes |
celulitis, gripe, bronquitis, sinusitis, rinitis, gastroenteritis |
|
Trastornos de la sangre y del sistema linfático | |
|
Frecuentes |
anemia |
|
Trastornos del metabolismo y de la nutrición Frecuentes |
retención de líquidos |
|
Trastornos psiquiátricos Frecuentes |
insomnio, ansiedad |
|
Trastornos del sistema nervioso Muy frecuentes |
cefalea |
|
Frecuentes |
migraña, temblor, parestesia, sensación de ardor, hipoestesia |
|
Trastornos oculares Frecuentes |
hemorragia retiniana, alteración visual, visión borrosa, fotofobia, cromatopsia, cianopsia, irritación ocular, hiperemia ocular |
|
Poco frecuentes |
reducción de la agudeza visual, diplopía, sensación anormal en el ojo |
|
Frecuencia no conocida |
Neuropatía óptica isquémica anterior no arterítica (NOIA-NA)*, Oclusión vascular retiniana*, Defectos del campo visual* |
|
Trastornos del oído y del laberinto Frecuentes |
vértigo |
|
Frecuencia no conocida |
pérdida súbita de la audición |
|
Trastornos vasculares Muy frecuentes |
rubefacción |
|
Frecuencia no conocida |
hipotensión |
|
Trastornos respiratorios, torácicos y mediastínicos Frecuentes |
epistaxis, tos, congestión nasal |
|
Trastornos gastrointestinales Muy frecuentes |
diarrea, dispepsia |
|
Frecuentes |
gastritis , enfermedad por reflujo gastroesofágico, hemorroides, distensión abdominal, sequedad de boca |
|
Trastornos de la piel y del tejido subcutáneo Frecuentes |
alopecia, eritema, sudores nocturnos |
|
Frecuencia no conocida |
erupción |
|
Trastornos musculoesqueléticos y del tejido conjuntivo Muy frecuentes |
dolor en una extremidad |
|
Frecuentes |
mialgia, dolor de espalda |
|
Trastornos renales y urinarios Poco frecuentes |
hematuria |
|
Trastornos del aparato reproductor y de la | |
|
mama | |
|
Poco frecuentes |
hemorragia del pene, hematospermia, ginecomastia priapismo, erección aumentada |
|
Frecuencia no conocida Trastornos generales y alteraciones en el lugar de administración Frecuentes |
pirexia |
*Estos efectos/reacciones adversos/as se han notificado en los pacientes que recibían sildenafilo en el tratamiento de la disfunción eréctil en varones (DE).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
En ensayos realizados en voluntarios sanos con dosis orales únicas de hasta 800 mg, las reacciones adversas fueron similares a las observadas con dosis más bajas, pero la incidencia y gravedad aumentó. Con dosis orales únicas de 200 mg aumentó la incidencia de reacciones adversas (cefalea, rubefacción, mareos, dispepsia, congestión nasal y trastornos visuales).
En caso de sobredosis, se deben tomar medidas normales de apoyo. Dado que sildenafilo se une intensamente a proteínas plasmáticas y no se elimina por orina, no se espera que la diálisis renal acelere el aclaramiento del fármaco.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Urológicos. Fármacos utilizados en disfunción eréctil, código ATC: G04B E03
Mecanismo de acción
Sildenafilo es un inhibidor potente y selectivo de la fosfodiesterasa tipo 5 (PDE5) específica de la guanosina monofosfatasa cíclica (GMPc) que es la enzima responsable de la degradación del GMPc. Además de la presencia de esta enzima en el cuerpo cavernoso del pene, la PDE5 está presente en la vasculatura pulmonar. Sildenafilo, por tanto, eleva el GMPc en las células de la vasculatura muscular lisa pulmonar produciendo relajación. En pacientes con hipertensión pulmonar esto puede llevar a vasodilatación del lecho vascular pulmonar y, en menor grado, vasodilatación en la circulación sistémica.
Efectos farmacodinámicos
Los estudios in vitro han mostrado que sildenafilo es selectivo de la PDE5. Su efecto es más potente sobre la PDE5 que sobre otras fosfodiesterasas conocidas. Tiene una selectividad 10 veces mayor que por la PDE6, que participa en el mecanismo de fototransducción en la retina. Tiene una selectividad 80 veces superior por la PDE1 y 700 veces superior por la PDE2, 3, 4, 7, 8, 9, 10 y 11. Particularmente, sildenafilo es 4.000 veces más selectivo por la PDE5 que por la PDE3, la isoforma fosfodiesterasa específica del AMPc relacionada con el control de la contractilidad cardíaca.
Sildenafilo causa una disminución leve y transitoria en la presión arterial sistémica que, en la mayoría de los casos, no se traduce en efectos clínicos. Tras la administración oral crónica de 80 mg tres veces
al día en pacientes con hipertensión sistémica, el cambio medio desde la basal en las tensiones sanguíneas sistólica y diastólica fue una reducción de 9,4 mmHg y 9,1 mmHg, respectivamente. Tras la administración oral crónica de 80 mg tres veces al día en pacientes con hipertensión arterial pulmonar, se observaron menos efectos sobre la presión sanguínea (una reducción de 2 mmHg tanto en la presión sistólica como diastólica). Con la dosis oral recomendada de 20 mg tres veces al día, no se han observado reducciones de la presión sistólica o diastólica.
Dosis únicas orales de sildenafilo de hasta 100 mg en voluntarios sanos no produjeron efectos clínicamente relevantes sobre el ECG. Tras la administración crónica de 80 mg tres veces al día en pacientes con hipertensión arterial pulmonar no se comunicaron efectos clínicamente relevantes sobre el ECG.
En un ensayo sobre los efectos hemodinámicos de una dosis oral única de 100 mg de sildenafilo en 14 pacientes con cardiopatía coronaria grave (CC) (> 70% de estenosis de al menos una arteria coronaria), las presiones sanguíneas sistólica y diastólica en reposo se redujeron en un 7% y 6%, respectivamente comparadas con la basal. La presión sanguínea sistólica pulmonar media se redujo en un 9%. Sildenafilo no evidenció efectos sobre el gasto cardíaco, ni alteró al flujo sanguíneo en las arterias coronarias estenosadas.
En algunos pacientes, se han detectado diferencias leves y transitorias en la discriminación del color (azul/verde), cuando se utilizó la prueba de tinción Farnsworth-Munsell 100, una hora después de administrar una dosis de 100 mg, sin que se produjeran efectos evidentes a las dos horas de la administración. El mecanismo postulado para este cambio en la discriminación de color se relaciona con la inhibición de la PDE6, que participa en la cascada de fototransducción de la retina.
Sildenafilo no tiene efectos sobre la agudeza visual o sensibilidad al contraste. En un ensayo de pequeño tamaño controlado con placebo en pacientes con degeneración macular temprana documentada (n=9), se demostró que sildenafilo (dosis única, 100 mg) no produjo cambios significativos en las pruebas visuales realizadas (agudeza visual, test de Amsler, discriminación de los colores estimulados por las luces de tráfico, perímetro de Humphrey y fotoestrés).
Eficacia y seguridad clínicas
Eficacia de sildenafilo intravenoso en pacientes adultos con hipertensión arterial pulmonar (HAP)
Se estima que una dosis de 10 mg de Revatio solución inyectable proporciona una exposición total a sildenafilo libre y a su metabolito N-desmetil, con unos efectos farmacológicos combinados comparables a los de una dosis oral de 20 mg. Esto se basa solo en datos farmacocinéticos (ver sección 5.2. Propiedades farmacocinéticas). No se han documentado las consecuencias de una menor exposición al metabolito N-desmetil observada tras la administración intravenosa repetida de Revatio. No se han realizado ensayos clínicos para demostrar que estas formulaciones poseen una eficacia comparable.
El estudio A1481262 fue un ensayo monocéntrico, con dosis única, abierto para evaluar la seguridad, tolerancia y farmacocinética de una dosis única de sildenafilo intravenoso (10 mg) administrado como una inyección en bolo en pacientes con hipertensión arterial pulmonar (HAP) que estaban recibiendo Revatio 20 mg tres veces al día y estaban estables.
Se incluyeron un total de 10 sujetos con HAP que completaron el estudio. Ocho sujetos estaban tomando bosentan y un sujeto estaba tomando treprostinil además de bosentan y Revatio. Tras la administración, se registraron las presiones arteriales de pie y sentados, así como la frecuencia cardiaca, a los 30, 60, 120, 180 y 360 minutos de la administración. La media del cambio basal entre la presión sanguínea de pie y sentado fue mayor a la hora, -9,1 mmHg (SD ± 12,5) y -3,0 (SD ± 4,9) mmHg en la presión sistólica y diastólica, respectivamente. Los cambios medios posturales en la presión sanguínea sistólica y diastólica fueron pequeños (< 10 mmHg) y volvieron a los valores basales hacia las 2 horas.
Eficacia de sildenafilo oral en _ pacientes adultos con hipertensión arterial pulmonar (HAP)
Se realizó un ensayo aleatorizado, doble-ciego, controlado con placebo en 278 pacientes con hipertensión pulmonar primaria (idiopática), HAP asociada con enfermedad del tejido conectivo y HAP tras reparación quirúrgica de cardiopatías congénitas. Se asignaron aleatoriamente a uno de los cuatro grupos de tratamiento: placebo, sildenafilo 20 mg, sildenafilo 40 mg o sildenafilo 80 mg, tres veces al día. De los 278 pacientes aleatorizados, 277 pacientes recibieron al menos una dosis del medicamento en investigación. La población del ensayo consistía en 68 (25%) hombres y 209 (75%) mujeres con una edad media de 49 años (rango: 18-81 años) y distancia basal en la prueba de la distancia recorrida en 6 minutos entre 100 y 450 metros inclusive (media: 344 metros). 175 pacientes (63%) incluidos fueron diagnosticados de hipertensión pulmonar primaria, 84 (30%) fueron diagnosticados de HAP asociada a enfermedad del tejido conectivo y 18 (7%) de los pacientes fueron diagnosticados de HAP tras reparación quirúrgica de cardiopatías congénitas. La mayoría de los pacientes pertenecía a la Clase Funcional II de la OMS (107/277; 39%) o III (160/277; 58%) con una distancia basal media en la prueba la distancia recorrida en 6 minutos, de 378 metros y de 326 metros respectivamente; un menor número eran de la Clase funcional I (1/277; 0,4%) o IV (9/277; 3%) en el inicio. No se estudiaron pacientes con una fracción de eyección ventricular izquierda <45% o un acortamiento de la fracción ventricular izquierda <0,2.
Se añadió sildenafilo (o placebo) al tratamiento de base de los pacientes que incluía una combinación de anticoagulantes, digoxina, bloqueantes de los canales del calcio, diuréticos u oxígeno. No se permitió, como terapia añadida, el uso de prostaciclina, análogos de la prostaciclina y antagonistas de los receptores de la endotelina así como tampoco de los suplementos de arginina. Se excluyó del ensayo a los pacientes en los que previamente había fracasado bosentan.
La variable primaria de eficacia fue el cambio entre la distancia recorrida en 6 minutos (DR6M) basal y a las 12 semanas. Se observó un aumento estadísticamente significativo en la DR6Men todos (3) los grupos que recibían dosis de sildenafilo en comparación con placebo. Los aumentos, corregidos con placebo, en la DR6Meran 45 metros (p <0,0001), 46 (p<0,0001) y 50 metros (p<0,0001) con 20 mg,
40 mg y 80 mg de sildenafilo TID, respectivamente. No hubo diferencias significativas en los efectos entre las dosis de sildenafilo. En los pacientes con una DR6M basal <325 metros se observó una mejora en la eficacia con las dosis más altas (mejoras corregidas con placebo de 58 metros, 65 metros y 87 metros con 20 mg, 40 mg y 80 mg TID, respectivamente).
Cuando se analizaron, de acuerdo con la clase funcional de la OMS, se observó un aumento estadísticamente significativo en la DR6M del grupo tratado con dosis de 20 mg. Se observaron unos aumentos de la DR6M frente a placebo, para las clases funcionales II y III, de 49 metros (p=0,0007) y 45 metros (p=0,0031) respectivamente.
La mejoría en la DR6M era visible tras 4 semanas de tratamiento y este efecto se mantuvo durante las semanas 8 y 12. Los resultados fueron generalmente concordantes en los subgrupos de acuerdo con la etiología (HAP primaria y asociada a enfermedad del tejido conectivo), clase funcional de la OMS, sexo, raza, situación, PAP media y IRVP.
Los pacientes que recibían cualquier dosis de sildenafilo alcanzaron una reducción estadísticamente significativa en la presión arterial pulmonar media (PAPm) y la resistencia vascular pulmonar (RVP) en comparación con los tratados con placebo. Los efectos del tratamiento, corregidos con placebo, para la PAPm fueron de -2,7 mmHg (p =0,04), -3,0 mmHg (p =0,01) y -5,1 mmHg (p =0,0001), con 20 mg, 40 mg y 80 mg de sildenafilo TID, respectivamente. Los efectos del tratamiento corregidos con placebo en la RVP fueron de -178 dina.s/cm5 (p=0,0051), -195 dina.s/cm5 (p=0,0017) y -320 dina.s/cm5 (p<0,0001) con 20 mg, 40 mg y 80 mg TID de sildenafilo, respectivamente. El porcentaje de reducción a las 12 semanas con 20 mg, 40 mg y 80 mg TID de sildenafilo en la RVP (11,2%,
12,9%, 23,3%) era proporcionalmente mayor que la reducción en la resistencia vascular sistémica (RVS) (7,2%, 5,9 %, 14,4 %). Se desconoce el efecto de sildenafilo sobre la mortalidad.
Un mayor porcentaje de pacientes en cada dosis de sildenafilo (es decir, 28 %, 36 % y 42 % de los sujetos que recibieron dosis de 20 mg, 40 mg y 80 mg TID de sildenafilo, respectivamente) evidenció una mejoría de al menos una clase funcional de la OMS en la semana 12 comparado con placebo (7 %). Los respectivos odds ratios fUeron 2,92 (p=0,0087), 4,32 (p=0,0004) y 5,75 (p<0,0001).
Datos de supervivencia a largo plazo en población naive
Los pacientes que se incluyeron en el estudio pivotal utilizando la vía oral eran candidatos para entrar en un estudio de extensión, abierto, a largo plazo. A los 3 años, el 87% de los pacientes estaban recibiendo una dosis de 80 mg TID. En el estudio pivotal, un total de 207 pacientes fueron tratados con Revatio, y se evaluó su supervivencia a largo plazo durante un mínimo de 3 años. En esta población, las estimaciones de Kaplan-Meier de supervivencia a los 1, 2 y 3 años fueron de 96%, 91% y 82%, respectivamente. La supervivencia de los pacientes tipificados como clase funcional II de la OMS desde el inicio hasta 1,2 y 3 años fue de 99%, 91% y 84%, respectivamente y de los pacientes tipificados como la clase funcional III de la OMS desde el inicio hasta 1,2 y 3 años fue de 94%, 90% y 81%, respectivamente.
Eficacia de sildenafilo oral en _pacientes adultos con HAP (cuando se utiliza en combinación con epoprostenol)
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 267 pacientes con HAP que estaban estabilizados con epoprostenol intravenoso. Los pacientes con HAP incluidos padecían Hipertensión Arterial Pulmonar Primaria (212/267, 79%) y HAP asociada con enfermedad del tejido conectivo (55/267, 21%). Al inicio la mayoría de los pacientes estaban tipificados como clase funcional II (68/267, 26%) o III (175/267, 66%) de la OMS; pocos pacientes estaban tipificados como clase funcional I (3/267, 1%) o IV (16/267, 6%) de la OMS; en unos pocos pacientes (5/267, 2%) se desconocía la clase funcional de la OMS. Los pacientes fueron aleatorizados para recibir placebo o sildenafilo (en una titulación fija que se iniciaba con 20 mg, pasando a 40 mg y posteriormente a 80 mg, tres veces al día, si se toleraba) cuando se utilizaba en combinación con epoprostenol intravenoso.
La variable principal de eficacia era el cambio desde el inicio hasta la semana 16 en la prueba de la distancia recorrida en 6 minutos. Hubo un beneficio estadísticamente significativo en la DR6M para sildenafilo comparado con placebo. Se observó un aumento en la DR6M, corregida con placebo, de 26 metros a favor de sildenafilo (95% IC: 10,8; 41,2) (p=0,0009). En los pacientes que inicialmente alcanzaban una DR6M > 325 metros, el efecto del tratamiento era de 38,4 metros a favor de sildenafilo mientras que en los pacientes que inicialmente recorrían una DR6M <325 metros, el efecto del tratamiento fue de 2,3 metros a favor de placebo. En los pacientes con HAP primaria, el efecto del tratamiento fue de 31,1 metros comparado con 7,7 metros en los pacientes con HAP asociada a enfermedad del tejido conectivo. La diferencia en los resultados entre los subgrupos aleatorizados puede deberse a la casualidad a la vista del limitado tamaño de la muestra.
Los pacientes tratados con sildenafilo alcanzaron una reducción estadísticamente significativa de la Presión Arterial Pulmonar media (PAPm) en comparación con los tratados con placebo. Se observó un efecto medio del tratamiento, corregido con placebo, de -3,9 mmHg a favor de sildenafilo (95% IC: -5,7; -2,1) (p=0,00003). El tiempo hasta empeoramiento clínico era una variable secundaria que se definió como el tiempo desde la aleatorización hasta la aparición del primer acontecimiento de empeoramiento clínico (muerte, trasplante pulmonar, inicio del tratamiento con bosentan o un deterioro clínico que requiriese un cambio en el tratamiento con epoprostenol). El tratamiento con sildenafilo retrasó significativamente el tiempo hasta empeoramiento clínico de la HAP en comparación con placebo (p=0,0074). Veintitrés sujetos sufrieron acontecimientos de empeoramiento clínico en el grupo placebo (17,6%) en comparación con 8 sujetos en el grupo de sildenafilo (6,0%).
Datos de supervivencia a largo plazo en un estudio con epoprostenol de tratamiento base Los pacientes que entraron en el estudio de tratamiento añadido a epoprostenol eran elegibles para entrar en un estudio de extensión abierto a largo plazo. A los 3 años el 68% de los pacientes estaba recibiendo una dosis de 80 mg TID. En el estudio inicial se trataron un total de 134 pacientes con Revatio y se evaluó su estado de supervivencia a largo plazo durante un mínimo de 3 años. En esta población, las estimaciones de supervivencia de Kaplan-Meier a 1, 2 y 3 años fueron de 92 %, 81 % y 74 %, respectivamente.
Eficacia y seguridad en pacientes adultos con HAP (cuando se utiliza en combinación con bosentan)
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 103 sujetos con HAP (grado funcional II y III de la OMS) clínicamente estables, que llevaban en tratamiento con bosentan un mínimo de tres meses. Los pacientes con HAP incluían aquellos pacientes con HAP primaria y HAP asociada a enfermedad del tejido conectivo. Se aleatorizó a los pacientes para recibir placebo o sildenafilo (20 mg tres veces al día) en combinación con bosentan (62,5 - 125 mg dos veces al día). La variable principal de eficacia fue el cambio en la DR6M desde el inicio a la semana 12. Los resultados indican que no se observa una diferencia significativa en la media del cambio en la DR6M desde el inicio entre 20mg de sildenafilo y placebo (13,62 m (95% IC: -3,89 a 31,12) y 14,08 m (95% IC: -1,78 a 29,95), respectivamente).
Se observaron diferencias en la DR6M entre los pacientes con HAP primaria y los pacientes con HAP asociada a enfermedad del tejido conectivo. En el caso de los sujetos con HAP primaria (67 sujetos), la media del cambio desde el inicio fue de 26,39 m (95% IC: 10,70 a 42,08) y 11,84 m (95% IC: -8,83 a 32,52) para los grupos con sildenafilo y placebo, respectivamente. Sin embargo, en el caso de los sujetos con HAP asociada a enfermedad del tejido conectivo (36 sujetos), la media del cambio desde el inicio fue de -18,32 m (95% IC: -65,66 a 29,02) y 17,50 m (95% IC: -9,41 a 44,41) para los grupos con sildenafilo y placebo, respectivamente.
En conjunto, los acontecimientos adversos fueron, por lo general, similares entre ambos grupos de tratamiento (sildenafilo más bosentan frente a bosentan en monoterapia), y coherentes con el perfil de seguridad conocido de sildenafilo cuando se emplea en monoterapia (ver secciones 4.4 y 4.5).
5.2 Propiedades farmacocinéticas
Absorción
La biodisponibilidad oral media absoluta de sildenafilo es del 41% (rango 25-63%). En el estudio A1481262 se observaron una Cmax, Cl y AUC (0-8) de 248 ng/ml, 30,3 l/h y 330 ng h/ml, respectivamente. La Cmax y AUC (0-8) del metabolito N-desmetil fueron de 30,8 ng/ml y 147 ng h/ml, respectivamente.
Distribución
El volumen medio de distribución (Vdss) en estado de equilibrio para sildenafilo es de 105 l, indicando una distribución tisular del fármaco. Tras la administración de dosis orales de 20 mg tres veces al día, la concentración plasmática máxima total media de sildenafilo en el estado de equilibrio es aproximadamente 113 ng/ml. Sildenafilo y su metabolito principal circulante N-desmetil se encuentran unidos a proteínas plasmáticas en un 96%. La unión a proteínas es independiente de las concentraciones totales de ambos compuestos.
Biotransformación
Sildenafilo se metaboliza predominantemente por las isoenzimas microsomales hepáticas CYP3A4 (principalmente) y CYP2C9 (en menor medida). El metabolito principal circulante resulta de la N-desmetilación de sildenafilo. Este metabolito tiene un perfil de selectividad por las fosfodiesterasas similar a sildenafilo y la potencia in vitro por PDE5 es de aproximadamente el 50% de la del principio activo original. El metabolito N-desmetil continúa metabolizándose, con una vida media terminal de aproximadamente 4 horas. En pacientes con hipertensión pulmonar, las concentraciones plasmáticas del metabolito desmetilo son aproximadamente el 72% de las de sildenafilo tras una administración diaria de 20 mg oral tres veces al día (traduciéndose su contribución en un 36% de los efectos farmacológicos de sildenafilo). Se desconocen los efectos posteriores sobre la eficacia. En voluntarios sanos, los niveles plasmáticos del N-desmetil metabolito tras la administración de dosis intravenosas son significativamente inferiores a los observados tras la administración oral. Las concentraciones plasmáticas en estado de equilibrio del metabolito N-desmetil son de aproximadamente el 16% frente al 61% de las de sildenafilo tras la administración intravenosa y oral, respectivamente.
Eliminación
El aclaramiento total de sildenafilo es de 41 l/hora, con una fase terminal resultante en una vida media de 3-5 horas. Tras la administración oral o intravenosa, sildenafilo se excreta en forma de metabolitos predominantemente en heces (aproximadamente el 80% de la dosis oral administrada) y en menor medida en orina (aproximadamente el 13% de la dosis oral administrada).
Farmacocinética en grupos especiales de pacientes
Pacientes de edad avanzada:
Sildenafilo mostró un aclaramiento reducido en voluntarios sanos de edad avanzada (más de 65 años), siendo las concentraciones plasmáticas de sildenafilo y de su metabolito activo N-desmetil un 90% más altas que las observadas en voluntarios sanos jóvenes (18-45 años). La concentración de sildenafilo libre en el plasma fue aproximadamente un 40% mayor, debido al efecto que el envejecimiento ejerce sobre la unión a las proteínas plasmáticas.
Insuficiencia renal
En voluntarios con insuficiencia renal leve a moderada (aclaramiento de creatinina = 30-80 ml/min), no se alteró la farmacocinética de sildenafilo después de recibir una única dosis oral de 50 mg. En voluntarios con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min), se redujo el aclaramiento de sildenafilo, con un aumento del AUC y Cmax del 100% y del 88% respectivamente, en comparación a los voluntarios de la misma edad sin insuficiencia renal. Además, los valores de AUC y Cmax para el metabolito N-desmetil aumentaron significativamente en 200% y 79%, respectivamente en sujetos con insuficiencia renal grave en comparación con sujetos con función renal normal.
Insuficiencia hepática
En voluntarios con cirrosis hepática de leve a moderada (Child-Pugh clase A y B), el aclaramiento de sildenafilo se redujo, resultando en aumentos en el AUC (85%) y Cmax (47%) en comparación con voluntarios de la misma edad sin insuficiencia hepática. Además, los valores del AUC y Cmax para el metabolito N-desmetil estaban significativamente aumentados en un 154% y 87%, respectivamente en sujetos con cirrosis en comparación con sujetos con la función hepática normal. La farmacocinética de sildenafilo en pacientes con insuficiencia hepática grave no ha sido estudiada.
Farmacocinética en la _población
En pacientes con hipertensión arterial pulmonar, las concentraciones medias en el estado de equilibrio eran de 20-50% superiores en el rango de dosis oral estudiado de 20-80 mg tres veces al día en comparación con los voluntarios sanos. La Cmin era el doble en comparación con los voluntarios sanos. Ambos hallazgos sugieren un menor aclaramiento y/o una mayor biodisponibilidad de sildenafilo en pacientes con hipertensión arterial pulmonar en comparación con voluntarios sanos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción y el desarrollo.
En las crías de ratas que fueron tratadas pre- y postnatalmente con 60 mg/kg de sildenafilo, se observó una reducción del tamaño de la camada, un peso inferior en el día 1 y una reducción de la supervivencia en el día 4 con exposiciones que eran aproximadamente cincuenta veces la exposición intravenosa esperada en humanos con 10 mg tres veces al día. En los estudios preclínicos se han observado efectos con exposiciones que se consideraron suficientemente en exceso de la dosis máxima en humanos lo que indica poca relevancia para el uso clínico.
No hubo reacciones adveras, con posible relevancia para el uso clínico, observadas en animales con los niveles de exposición clínicamente relevantes que no hubieran sido observadas en los ensayos clínicos.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
Glucosa
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos o diluyentes para administración intravenosa, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Este medicamento no requiere ninguna condicional especial de conservación.
6.5 Naturaleza y contenido del envase
Cada envase contiene un vial de 20 ml claro, de vidrio tipo I con tapón de clorobutilo y cápsula de aluminio.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Este medicamento no requiere dilución o reconstitución antes de su uso.
Cada vial de 20 ml contiene 10 mg de sildenafilo (como citrato). La dosis recomendada de 10 mg requiere un volumen de 12,5 ml que se administra mediante una inyección intravenosa en bolo.
Se ha demostrado su compatibilidad química y física con los siguientes diluyentes:
suero glucosado al 5%
solución de 9 mg/ml de cloruro sódico (0,9%) solución de Ringer lactato
suero glucosado al 5% con cloruro sódico al 0,45% suero glucosado al 5% con solución de Ringer lactato suero glucosado al 5% con 20mEq de cloruro potásico
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited, Sandwich, Kent CT13 9NJ, Reino Unido.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/318/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 28/octubre/2005 Fecha de la última renovación: 23/septiembre/2010
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Revatio 10 mg/ml polvo para suspensión oral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Tras la reconstitución, cada ml de suspensión oral contiene 10 mg de sildenafilo (como citrato). Un frasco de suspensión oral reconstituida (112 ml) contiene 1,12 g de sildenafilo (como citrato)
Excipiente(s) con efecto conocido
Cada ml de suspensión oral contiene 250 mg de sorbitol.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para suspensión oral.
Polvo blanco o blanquecino.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Adultos
Tratamiento de pacientes adultos con hipertensión arterial pulmonar tipificada como grado funcional II y III de la OMS, para mejorar la capacidad de ejercicio. Se ha demostrado eficacia en hipertensión pulmonar primaria e hipertensión pulmonar asociada con enfermedades del tejido conjuntivo.
Población pediátrica
Tratamiento de pacientes pediátricos de 1 a 17 años con hipertensión arterial pulmonar. Se ha demostrado eficacia en términos de mejora de la capacidad de ejercicio o de hemodinámica pulmonar en hipertensión pulmonar primaria e hipertensión pulmonar asociada a enfermedad cardiaca congénita (ver sección 5.1).
4.2 Posología y forma de administración
El tratamiento sólo debe iniciarse y controlarse por un médico con experiencia en el tratamiento de la hipertensión arterial pulmonar. En caso de deterioro clínico, pese al tratamiento con Revatio, deberán considerarse terapias alternativas.
Posología
Adultos
La dosis recomendada es de 20 mg tres veces al día. Los médicos deben advertir a los pacientes que olviden tomar Revatio, que tomen una dosis tan pronto como sea posible y que después continúen con la dosis normal. Los pacientes no deben tomar una dosis doble para compensar la dosis olvidada.
Población pediátrica (de 1 a 17 años)
En pacientes pediátricos entre 1 a 17 años, la dosis recomendada para pacientes < 20 kg es de 10 mg (1 ml de la suspensión reconstituida) tres veces al día y para pacientes > 20 kg es de 20 mg (2 ml de la suspensión reconstituida) tres veces al día. En pacientes pediátricos con hipertensión arterial pulmonar (HAP) no deben utilizarse dosis superiores a las recomendadas (ver también secciones 4.4 y 5.1).
Pacientes en tratamiento con otros medicamentos
En general, cualquier ajuste de dosis sólo debe administrarse tras una cuidadosa evaluación del balance beneficio-riesgo. En el caso de administración conjunta con inhibidores del CYP3A4, como eritromicina o saquinavir, debe considerarse una reducción de la dosis a 20 mg dos veces al día. Se recomienda una reducción de la dosis a 20 mg una vez al día en el caso de la administración concomitante con inhibidores del CYP3A4 más potentes como claritromicina, telitromicina y nefazodona. Para el uso de sildenafilo con inhibidores mucho más potentes del CYAP3A4, ver información en la sección 4.3. Puede requerirse un ajuste de la dosis para sildenafilo cuando se administra conjuntamente con inductores del CYP3A4 (ser sección 4.5).
Poblaciones especiales
Pacientes de edad avanzada (> 65 años)
No se requiere ajuste de la dosis en pacientes de edad avanzada. La eficacia clínica, medida por la prueba de distancia recorrida en 6 minutos, puede ser menor en pacientes de edad avanzada.
Insuficiencia renal
No se requiere ajuste inicial de la dosis en pacientes con insuficiencia renal, incluyendo insuficiencia renal grave (aclaramiento de creatinina <30 ml/min). Unicamente si la terapia no es bien tolerada, debe considerarse un ajuste de dosis a 20 mg dos veces al día, tras una cuidadosa evaluación riesgo-beneficio.
Insuficiencia hepática
No se requiere ajuste inicial de la dosis en pacientes con insuficiencia hepática (Child-Pugh clase A y B). Únicamente si la terapia no es bien tolerada, debe considerarse un ajuste de dosis a 20 mg dos veces al día, tras una cuidadosa evaluación riesgo-beneficio.
Revatio está contraindicado en pacientes con insuficiencia hepática grave (Child-Pugh clase C), (ver sección 4.3).
Población pediátrica
No se ha establecido la seguridad y eficacia de Revatio en niños menores de 1 año. No hay datos disponibles.
Interrupción del tratamiento
Datos limitados sugieren que una interrupción abrupta del tratamiento con Revatio no se asocia con un empeoramiento de rebote de la hipertensión arterial pulmonar. No obstante para evitar la posible aparición de un deterioro repentino durante la interrupción, debe considerarse una reducción gradual de la dosis. Se recomienda un estrecho seguimiento durante el periodo de retirada.
Forma de administración
Revatio polvo para suspensión oral se administra solo por vía oral. La suspensión reconstituida (suspensión blanca, con aroma a uva) debe tomarse aproximadamente cada 6 a 8 horas con o sin alimentos.
Agite fuertemente el frasco durante un mínimo de 10 segundos antes de retirar la dosis necesaria.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Administración concomitante con dadores de óxido nítrico (como el nitrilo de amilo) o nitratos en cualquier forma debido a los efectos hipotensores de los nitratos (ver sección 5.1).
La administración conjunta de inhibidores de la PDE5, incluyendo sildenafilo, con estimuladores de la guanilato-ciclasa, como riociguat, está contraindicado ya que puede producir hipotensión sintomática de forma potencial (ver sección 4.5).
Combinación con los inhibidores más potentes del CYP3A4 (por ejemplo, ketoconazol, itraconazol, ritonavir) (ver sección 4.5).
Pacientes que han perdido la visión en un ojo debido neuropatía óptica isquémica anterior no arterítica (NOIA-NA), independientemente de si este episodio se asoció o no con la exposición previa a un inhibidor de la PDE5 (ver sección 4.4).
No se ha estudiado la seguridad de sildenafilo en los siguientes subgrupos de pacientes y por tanto su uso está contraindicado:
Insuficiencia hepática grave,
Antecedentes de ictus o infarto de miocardio reciente,
Hipotensión grave (presión sanguínea < 90/50 mmHg) al inicio.
4.4 Advertencias y precauciones especiales de empleo
No se ha establecido la eficacia de Revatio en pacientes con hipertensión arterial pulmonar grave (clase funcional IV). Si la situación clínica se deteriora, deben reconsiderarse las terapias que se recomiendan inicialmente en las etapas más graves de la enfermedad (por ejemplo, epoprostenol) (ver sección 4.2). No se ha establecido el balance beneficio-riesgo de sildenafilo en pacientes con hipertensión arterial pulmonar tipificada como clase funcional I de la OMS.
Se han realizado estudios con sildenafilo en hipertensión arterial pulmonar primaria (idiopática), asociada a enfermedades del tejido conectivo o asociada a cardiopatías congénitas como formas de HAP (ver sección 5.1). No se recomienda el uso de sildenafilo en otras formas de HAP.
En el estudio pediátrico de extensión a largo plazo se observó un aumento de mortalidad en los pacientes que recibieron dosis superiores a las recomendadas. Por tanto, no deben utilizarse dosis superiores a las recomendadas en pacientes pediátricos con HAP (ver también secciones 4.2 y 5.1).
Retinitis pigmentaria
La seguridad de sildenafilo no ha sido estudiada en pacientes con conocidos trastornos hereditarios degenerativos de la retina tales como retinitis pigmentaria (una minoría de estos pacientes tienen trastornos genéticos de las fosfodiesterasas de la retina) y por tanto no se recomienda su uso.
Acción vasodilatadora
Al prescribir sildenafilo, el médico debe considerar cuidadosamente si los pacientes con ciertas patologías subyacentes pueden verse afectados de forma adversa por los efectos vasodilatadores de carácter leve a moderado producidos por sildenafilo, por ejemplo pacientes con hipotensión, con depleción de volumen, obstrucción grave del flujo ventricular izquierdo o alteración del control autónomo (ver sección 4.4).
Factores de riesgo cardiovascular
En el seguimiento post-comercialización de sildenafilo para el tratamiento de la disfunción eréctil masculina, se ha notificado la asociación temporal del uso del sildenafilo con acontecimientos cardiovasculares graves, incluyendo infarto de miocardio, angina inestable, muerte cardíaca súbita, arritmia ventricular, hemorragia cerebrovascular, ataque isquémico transitorio, hipertensión e hipotensión. La mayoría de estos pacientes, aunque no todos, padecían factores de riesgo cardiovascular anteriores. Se ha informado que muchos acontecimientos tuvieron lugar durante o poco tiempo después de la relación sexual y unos pocos sucedieron poco después del uso de sildenafilo sin actividad sexual. No es posible determinar si estos acontecimientos están directamente relacionados con estos factores o con otros factores.
Priapismo
Sildenafilo debe utilizarse con precaución en pacientes con deformaciones anatómicas del pene (tales como angulación, fibrosis cavernosa o enfermedad de Peyronie), o en pacientes con enfermedades que les pueden predisponer a sufrir priapismo (tales como anemia falciforme, mieloma múltiple o leucemia).
Se han notificado casos de erección prolongada y priapismo con sildenafilo durante la experiencia post-comercialización. En caso de que la erección persista más de 4 horas, el paciente debe solicitar inmediatamente atención médica. Si el priapismo no se trata inmediatamente, se puede producir daño en el tejido peneano y una pérdida permanente de potencia (ver sección 4.8).
Crisis vaso-oclusivas en pacientes con anemia de células falciformes
Sildenafilo no se debe utilizar en pacientes con hipertensión arterial pulmonar secundaria a anemia de células falciformes. En un estudio clínico se notificaron más frecuentemente acontecimientos de crisis vaso-oclusivas que requirieron hospitalización en los pacientes que recibieron Revatio que en los del grupo placebo lo que condujo a una finalización precoz de este estudio.
Acontecimientos visuales
De forma espontánea, se han comunicado casos de defectos visuales en asociación con la toma de sildenafilo y de otros inhibidores de la PDE5. De forma espontánea y en un estudio observacional, se han comunicado casos de neuropatía óptica isquémica anterior no arterítica, una enfermedad rara, en asociación con la toma de sildenafilo y de otros inhibidores de la PDE5 (ver sección 4.8). En el caso de algún defecto visual repentino, el tratamiento debe interrumpirse inmediatamente y se debe considerar un tratamiento alternativo (ver sección 4.3).
Alfa-bloqueantes
Se recomienda precaución cuando se administra sildenafilo a pacientes que reciben un alfa-bloqueante dado que la administración concomitante puede producir hipotensión sintomática en pacientes sensibles (ver sección 4.5). Antes de iniciar el tratamiento con sildenafilo, los pacientes deben encontrarse hemodinámicamente estables con la terapia con alfa-bloqueantes, a fin de minimizar el potencial para desarrollar hipotensión postural. Los médicos deben indicar a los pacientes qué hacer en caso de que experimenten síntomas de hipotensión postural.
Trastornos hemorrágicos
Estudios con plaquetas humanas indican que sildenafilo potencia el efecto antiagregante del nitroprusiato sódico in vitro. No existen datos de seguridad sobre la administración de sildenafilo a pacientes con trastornos hemorrágicos o con úlcera péptica activa. Por lo tanto, sildenafilo se debe administrar a estos pacientes sólo tras una evaluación cuidadosa del beneficio-riesgo.
Antagonistas de la vitamina K
En pacientes con hipertensión arterial pulmonar, puede existir un mayor riesgo de hemorragia cuando se inicia el tratamiento con sildenafilo en pacientes que ya están tomando un antagonista de la vitamina K, especialmente en pacientes con hipertensión arterial pulmonar secundaria a enfermedad del tejido conjuntivo.
Enfermedad veno-oclusiva
No se dispone de información con sildenafilo en pacientes con hipertensión arterial pulmonar asociada con enfermedad pulmonar veno-oclusiva. No obstante, se han comunicado casos de edema pulmonar con amenaza de muerte cuando se han utilizado vasodilatadores (principalmente prostaciclina) en estos pacientes. En consecuencia, si se produjeran signos de edema pulmonar cuando se administra sildenafilo a pacientes con hipertensión pulmonar, debe considerarse la posibilidad de una enfermedad veno-oclusiva asociada.
Intolerancia a la fructosa
El polvo contiene sorbitol. Los pacientes con un raro problema hereditario de intolerancia a la fructosa no deben tomar este medicamento.
Uso de sildenafilo con bosentan
No se ha demostrado de forma concluyente la eficacia de sildenafilo en pacientes que ya están en tratamiento con bosentán (ver seciones 4.5 y 5.1).
Uso concomitante con otros inhibidores de la PDE5
No se ha estudiado la seguridad y eficacia de sildenafilo en pacientes con HAP cuando se administra conjuntamente con otros medicamentos inhibidores de la PDE5, incluyendo Viagra, y por tanto no se recomienda su uso concomitante (ver sección 4.5).
4.5 Interacción con otros medicamentos y otras formas de interacción
Efectos de otros medicamentos sobre sildenafilo
Estudios in vitro
El metabolismo de sildenafilo está mediado predominantemente por las isoformas 3A4 (principalmente) y 2C9 (en menor medida) del citocromo P450 (CYP). Por lo tanto, los inhibidores de estas isoenzimas pueden reducir el aclaramiento de sildenafilo y los inductores de estas isoenzimas pueden aumentar el aclaramiento de sildenafilo. Para recomendaciones posológicas, ver secciones 4.2 y 4.3.
Estudios in vivo
Se ha evaluado la administración concomitante de sildenafilo oral y epoprostenol intravenoso (ver secciones 4.8 y 5.1).
No se ha estudiado en ensayos clínicos controlados la eficacia y seguridad de sildenafilo administrado con otros tratamientos para la hipertensión arterial pulmonar (por ejemplo, ambrisentán, iloprost). Por tanto, se aconseja precaución en caso de administración conjunta.
No se ha estudiado la seguridad y eficacia de sildenafilo cuando se administra junto con otros inhibidores de la PDE5 en pacientes con hipertensión arterial pulmonar (ver sección 4.4)..
El análisis de los datos farmacocinéticos de la población de los ensayos clínicos en hipertensión arterial pulmonar, indicó una reducción del aclaramiento de sildenafilo y/o un aumento de la biodisponibilidad oral cuando se administró concomitantemente con sustratos del CYP3A4 y con la combinación de sustratos del CYP3A4 y beta-bloqueantes. Estos fueron los únicos factores con un impacto estadísticamente significativo sobre la farmacocinética de sildenafilo en pacientes con hipertensión arterial pulmonar. La exposición a sildenafilo en pacientes que recibían sustratos del CYP3A4 y sustratos del CYP3A4 junto con beta-bloqueantes fue un 43% y un 66% mayor, respectivamente, comparada con la de pacientes que no recibían este tipo de medicamentos. La exposición a sildenafilo fue 5 veces mayor con una dosis de 80 mg tres veces al día, en comparación a la exposición obtenida con la dosis de 20 mg tres veces al día. Este intervalo de concentración cubre el aumento en la exposición a sildenafilo observada en los estudios de interacción diseñados específicamente con inhibidores del CYP3A4 (excepto con los inhibidores más potentes del CYP3A4, por ejemplo ketoconazol, itraconazol, ritonavir).
Los inductores del CYP3A4 parecen tener un impacto substancial sobre la farmacocinética de sildenafilo en pacientes con hipertensión arterial pulmonar, que ha sido confirmado en un estudio de interacción in vivo con el inductor del CYP3A4, bosentan.
La administración concomitante de 125 mg de bosentan (un inductor moderado del CYP3A4,
CYP2C9 y posiblemente del CYP2C19) dos veces al día con 80 mg de sildenafilo tres veces al día (en estado de equilibrio) administrados de forma concomitante durante 6 días en voluntarios sanos produjo una reducción del 63% del AUC de sildenafilo. Un análisis farmacocinético poblacional de datos de sildenafilo en pacientes adultos con HAP que participaban en ensayos clínicos, entre los que se incluye un estudio de doce semanas destinado a evaluar la eficacia y la seguridad de 20 mg de sildenafilo oral tres veces al día añadidos a una dosis estable de bosentan (62,5 mg - 125 mg dos veces al día), indicó una reducción de la exposición a sildenafilo cuando se administraba conjuntamente con bosentan, similar a la observada en voluntarios sanos (ver secciones 4.4 y 5.1).
En aquellos pacientes que utilizan inductores potentes del CYP3A4, como carbamazepina, fenitoína, fenobarbital, hierba de San Juan y rifampicina, debe vigilarse estrechamente la eficacia de sildenafilo.
La administración conjunta de ritonavir, inhibidor de la proteasa del VIH, que es un potente inhibidor del citocromo P450, en el estado de equilibrio (500 mg dos veces al día) junto con sildenafilo (dosis única de 100 mg) produjo un aumento del 300% (4 veces) en la Cmax de sildenafilo y del 1000% (11 veces) en el AUC plasmática de sildenafilo. A las 24 horas, los niveles plasmáticos de sildenafilo eran todavía de aproximadamente de 200 ng/ml, en comparación con los aproximadamente 5 ng/ml cuando se administra sólo sildenafilo. Este hecho concuerda con los notables efectos de ritonavir sobre un gran número de sustratos del P450. En base a estos resultados farmacocinéticos está contraindicada la administración concomitante de sildenafilo y ritonavir en pacientes con hipertensión arterial pulmonar (ver sección 4.3).
La administración conjunta de saquinavir, inhibidor de la proteasa del VIH, un inhibidor del CYP3A4, en el estado de equilibrio (1200 mg tres veces al día), con sildenafilo (dosis única de 100 mg) produjo un aumento del 140% en la Cmax de sildenafilo y del 210% en el AUC de sildenafilo. Sildenafilo no tuvo efecto sobre la farmacocinética de saquinavir. Ver recomendaciones posológicas (ver sección 4.2).
Cuando se administró una dosis única de 100 mg de sildenafilo con eritromicina, un inhibidor moderado del CYP3A4, en el estado de equilibrio (500 mg dos veces al día durante 5 días) hubo un incremento del 182% en la exposición sistémica de sildenafilo (AUC). Para recomendaciones posológicas, ver sección 4.2. En voluntarios varones sanos, no se observó evidencia de un efecto de azitromicina (500 mg diarios durante 3 días) sobre el AUC, Cmax, Tmax, constante de velocidad de eliminación o la consiguiente semivida de sildenafilo o de su metabolito principal en sangre. No se requiere un ajuste de la dosis. Cimetidina (800 mg), un inhibidor del citocromo P450 e inhibidor no específico del CYP3A4, produjo un aumento del 56% de la concentración plasmática de sildenafilo cuando se administró concomitantemente con sildenafilo (50 mg) a voluntarios sanos. No se requiere un ajuste de la dosis.
Se espera que los inhibidores más potentes del CYP3A4 como ketoconazol e itraconazol tengan efectos similares a los de ritonavir (ser sección 4.3). De los inhibidores del CYP3A4 como claritromicina, telitromicina y nefazodona se espera que tengan un efecto entre el de ritonavir y el de los inhibidores del CYP3A4 como saquinavir o eritromicina y se asume un aumento de 7 veces en la exposición. Por tanto, se recomiendan ajustes de dosis cuando se utilizan inhibidores del CYP3A4 (ver sección 4.2).
El análisis farmacocinético de la población en los pacientes con hipertensión arterial pulmonar sugiere que la administración conjunta de beta-bloqueantes en combinación con sustratos del CYP3A4 puede producir un aumento adicional en la exposición a sildenafilo comparado con la administración de sustratos del CYP3A4 solo.
El zumo de pomelo es un inhibidor débil del metabolismo del citocromo CYP3A4 localizado en la pared intestinal que puede provocar pequeños incrementos de los niveles plasmáticos de sildenafilo. No se requiere un ajuste de la dosis, pero no se recomienda el uso concomitante de sildenafilo y zumo de pomelo.
Dosis únicas de antiácido (hidróxido magnésico/hidróxido de aluminio) no afectaron la biodisponibilidad de sildenafilo.
La administración concomitante de anticonceptivos orales (30 |j,g de etinilestradiol y 150 ^.g de levonorgestrel) no afectaron la farmacocinética de sildenafilo.
Nicorandil es un híbrido de activador de los canales de potasio y nitrato. Debido al componente nitrato, tiene potencial para presentar una interacción grave con sildenafilo (ver sección 4.3).
Efectos de sildenafilo sobre otros medicamentos
Estudios in vitro
Sildenafilo es un inhibidor débil de las isoformas 1A2, 2C9, 2C19, 2D6, 2E1 y 3A4 (IC50 > 150 pM) del citocromo P450.
No se dispone de datos sobre la interacción de sildenafilo e inhibidores no específicos de la fosfodiesterasa como teofilina o dipiridamol.
Estudios in vivo
No se han observado interacciones significativas cuando se administró sildenafilo (50 mg) concomitantemente con tolbutamida (250 mg) o warfarina (40 mg), metabolizándose ambos por el CYP2C9.
Sildenafilo no tuvo efectos significativos sobre la exposición a atorvastatina (el AUC aumentó un 11%), lo que sugiere que sildenafilo no tiene un efecto clínicamente relevante sobre el CYP3A4.
No se observaron interacciones entre sildenafilo (dosis única de 100 mg) y acenocumarol.
Sildenafilo (50 mg) no potenció el aumento del tiempo de hemorragia causado por ácido acetil salicílico (150 mg).
Sildenafilo (50 mg) no potenció los efectos hipotensores del alcohol en voluntarios sanos con niveles máximos medios de alcohol en sangre de 80 mg/dl.
En un estudio en voluntarios sanos, sildenafilo en el estado de equilibrio (80 mg tres veces al día), produjo un aumento del 50% en el AUC de bosentan (125 mg dos veces al día). Un análisis farmacocinético poblacional de datos procedentes de un estudio con pacientes adultos con HAP que recibían tratamiento de base con bosentan (65,5 mg - 125 mg dos veces al día) indicó un aumento (20% (95% IC: 9,8 - 30,8) del AUC de bosentan con la administración concomitante de sildenafilo en estado estacionario (20 mg tres veces al día) de magnitud inferior a la observada en voluntarios sanos cuando se administró conjuntamente con 80 mg de sildenafilo tres veces al día (ver secciones 4.4 y 5.1).
En un estudio de interacción específico, cuando se administró concomitantemente sildenafilo (100 mg) junto con amlodipino en pacientes hipertensos, hubo una reducción adicional de la presión sanguínea sistólica en posición supina de 8 mmHg. La correspondiente reducción adicional de la presión sanguínea diastólica en posición supina fue de 7 mmHg. Estas reducciones adicionales de la presión sanguínea eran de magnitud similar a las observadas con sildenafilo cuando se administró solo a voluntarios sanos.
En tres estudios específicos de interacción, se administraron simultáneamente el alfa-bloqueante doxazosina (4 mg y 8 mg) y sildenafilo (25 mg, 50 mg o 100 mg) a pacientes con hiperplasia prostática benigna (HPB) que estaban estabilizados con el tratamiento con doxazosina. En estas poblaciones del estudio, se observaron reducciones adicionales medias de las tensiones sanguínea sistólica y diastólica en posición supina de 7/7 mmHg, 9/5 mmHg y 8/4 mmHg, respectivamente, y reducciones adicionales medias de la presión sanguínea en bipedestación de 6/6 mmHg, 11/4 mmHg y 4/5 mmHg, respectivamente. Infrecuentemente se comunicaron casos de pacientes que sufrieran hipotensión postural sintomática, cuando se administran simultáneamente sildenafilo y doxazosina a pacientes estabilizados con tratamiento con doxazosina. Estos informes incluyeron mareos y vértigo, pero no síncope. La administración simultánea de sildenafilo a pacientes que recibían tratamiento con alfa-bloqueantes puede conducir a hipotensión sintomática en pacientes sensibles (ver sección 4.4).
Sildenafilo (dosis única de 100 mg) no afectó a la farmacocinética en estado de equilibrio del inhibidor de la proteasa del VIH, saquinavir, que es un substrato/inhibidor del CYP3A4.
Concordantemente con sus conocidos efectos sobre la vía óxido nítrico/GMPc (ver sección 5.1), sildenafilo ha mostrado potenciar los efectos hipotensores de los nitratos y por tanto está contraindicada su administración concomitante con dadores de óxido nítrico o nitratos en cualquier forma (ver sección 4.3).
Riociguat
Estudios preclínicos mostraron un efecto aditivo de la disminución de la presión arterial sistémica cuando se combinaron inhibidores de la PDE5 con riociguat. Riociguat ha mostrado en ensayos clínicos que aumenta los efectos hipotensores de los inhibidores de la PDE5. En la población estudiada no hubo indicios de un efecto clínico favorable de dicha combinación. El uso concomitante de riociguat con inhibidores de la PDE5, incluyendo sildenafilo, está contraindicado (ver sección 4.3).
Sildenafilo no tiene impacto clínicamente significativo sobre los niveles plasmáticos de los anticonceptivos orales (30 pg de etinilestradiol y 150 pg de levonorgestrel).
Población pediátrica
Sólo se han realizado estudios de interacción en adultos.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil y anticoncepción en hombres y mujeres.
A causa de la falta de datos sobre los efectos de Revatio en mujeres embarazadas, Revatio no está recomendado en mujeres en edad fértil a menos que se utilicen medidas anticonceptivas adecuadas.
Embarazo
No hay datos sobre el uso de sildenafilo en mujeres embarazadas. Los estudios en animales no indican efectos perjudiciales directos o indirectos respecto al embarazo y desarrollo embrionario/fetal. Los estudios en animales han revelado toxicidad respecto al desarrollo postnatal (ver sección 5.3).
A causa de la falta de datos, Revatio no debe utilizarse en mujeres embarazadas a menos que sea estrictamente necesario.
Lactancia
No se sabe si sildenafilo penetra en la leche materna. Revatio no debe administrarse a mujeres lactantes.
Fertilidad
Los estudios preclínicos no han revelado un riesgo especial para los humanos en base a los estudios convencionales de fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Revatio sobre la capacidad para conducir y utilizar máquinas es moderada.
Como en los ensayos clínicos con sildenafilo se notificaron mareos y trastornos visuales, los pacientes deben saber cómo les puede afectar Revatio antes de conducir vehículos o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En el ensayo pivotal de Revatio en hipertensión arterial pulmonar , controlado con placebo, un total de 207 pacientes fueron aleatorizados para ser tratados con dosis de 20 mg, 40 mg u 80 mg de Revatio TID y 70 pacientes fueron aleatorizados para recibir placebo. La duración del tratamiento fue de 12 semanas. La frecuencia global de abandonos en el grupo de pacientes tratados con dosis de 20 mg, 40 mg y 80 mg de sildenafilo TID fue de 2,9%, 3,0% y 8,5% respectivamente, en comparación con el 2,9% con placebo. De los 277sujetos tratados en el ensayo pivotal, 259 entraron en un ensayo de extensión a largo plazo. Se administraron dosis de hasta 80 mg tres veces al día (4 veces superiores a la dosis recomendada de 20 mg tres veces al día) y tras 3 años, un 87% de los 183 pacientes en tratamiento del estudio estaban recibiendo 80 mg TID de Revatio.
En un ensayo controlado con placebo de Revatio como terapia adyuvante a epoprostenol intravenoso en hipertensión arterial pulmonar, un total de 134 pacientes fueron tratados con Revatio (en una titulación fija que se iniciaba con 20 mg pasando a 40 mg y posteriormente a 80 mg, tres veces al día, si se toleraba) y epoprostenol y 131 pacientes fueron tratados con placebo y epoprostenol. La duración del tratamiento fue de 16 semanas. La tasa global de retirada de los pacientes tratados con sildenafilo/epoprostenol debido a acontecimientos adversos fue del 5,2% en comparación con la del 10,7% en los pacientes tratados con placebo/epoprostenol. Las nuevas reacciones adversas que se notificaron con mayor frecuencia en el grupo de silfenafilo/epoprostenol, fueron: hiperemia ocular, visión borrosa, congestión nasal, sudores nocturnos, dolor de espalda y sequedad de boca. Las reacciones adversas conocidas: cefalea, rubefacción, dolor en las extremidades y edema se observaron con mayor frecuencia en los pacientes tratados con sildenafilo/epoprostenol en comparación con los pacientes que recibían placebo/epoprostenol. De los sujetos que completaron el estudio inicial, 242 entraron en un estudio de extensión a largo plazo. Se administraron dosis de hasta 80 mg TID, y tras 3 años el 68% de los 133 pacientes en tratamiento del estudio estaban recibiendo 80 mg TID de Revatio.
En los dos ensayos controlados con placebo, los efectos adversos fueron generalmente de leves a moderados. Los efectos adversos más comúnmente comunicados que se produjeron con mayor frecuencia (mayor o igual a 10%) con Revatio en comparación con placebo eran cefalea, rubefacción, dispepsia, diarrea y dolor en una extremidad.
Tabla de reacciones adversas
Las reacciones adversas, que se produjeron en > 1% de los pacientes tratados con Revatio y que eran más frecuentes (> 1% de diferencia) con Revatio en el ensayo pivotal o en el conjunto de los datos combinados de los dos ensayos de Revatio controlados con placebo en hipertensión arterial pulmonar, con dosis de 20, 40 ó 80 mg TID, se muestran en la siguiente tabla agrupadas por grupos y frecuencias (muy frecuente (> 1/10), frecuente (> 1/100 a < 1/10), poco frecuente ((> 1/1000 a < 1/100) y frecuencia no conocida (no puede estimarse con los datos disponibles)). Dentro de cada grupo de frecuencias, se presentan las reacciones adversas en orden descendente de gravedad.
Las reacciones adversas notificadas durante la experiencia post-comercialización se incluyen en cursiva.
|
Clasificación de Órganos del Sistema MedDRA (V.14.0) |
Reacción adversa |
|
Infecciones e infestaciones Frecuentes |
celulitis, gripe, bronquitis, sinusitis, rinitis, gastroenteritis |
|
Trastornos de la sangre y del sistema linfático Frecuentes |
anemia |
|
Trastornos del metabolismo y de la nutrición Frecuentes |
retención de líquidos |
|
Trastornos psiquiátricos Frecuentes |
insomnio, ansiedad |
|
Trastornos del sistema nervioso Muy frecuentes |
cefalea |
|
Frecuentes |
migraña, temblor, parestesia, sensación de ardor, hipoestesia |
Trastornos del oído y del laberinto
Frecuentes
Frecuencia no conocida
Trastornos vasculares
Muy frecuentes
Frecuencia no conocida
Trastornos respiratorios, torácicos y
mediastínicos
Frecuentes
Trastornos gastrointestinales
Muy frecuentes Frecuentes
Trastornos de la piel y del tejido subcutáneo
Frecuentes
Frecuencia no conocida
Trastornos musculoesqueléticos y del tejido
conjuntivo
Muy frecuentes Frecuentes
Trastornos renales y urinarios
Poco frecuentes
Trastornos del aparato reproductor y de la mama
Poco frecuentes Frecuencia no conocida
Trastornos generales y alteraciones en el lugar de administración
Frecuentes
hemorragia retiniana, alteración visual, visión borrosa, fotofobia, cromatopsia, cianopsia, irritación ocular, hiperemia ocular
reducción de la agudeza visual, diplopía, sensación anormal en el ojo
Neuropatía óptica isquémica anterior no arterítica (NOIA-NA)*, Oclusión vascular retiniana*, Defectos del campo visual*
vértigo
pérdida súbita de la audición
rubefacción
hipotensión
epistaxis, tos, congestión nasal
diarrea, dispepsia
gastritis, enfermedad por reflujo gastroesofágico, hemorroides, distensión abdominal, sequedad de boca
alopecia, eritema, sudores nocturnos
erupción
dolor en una extremidad mialgia, dolor de espalda
hematuria
hemorragia del pene, hematospermia, ginecomastia
priapismo, erección aumentada
pirexia
*Estos efectos/reacciones adversos/as se han notificado en los pacientes que recibían sildenafilo para el tratamiento de la disfunción eréctil en varones (DE).
Población pediátrica
En el estudio controlado con placebo de Revatio en pacientes de 1 a 17 años con hipertensión arterial pulmonar , se trataron, un total de 174 pacientes, tres veces al día con regímenes de dosis baja (10 mg en pacientes > 20 kg; ningún paciente < 20 kg recibió la dosis baja), media (10 mg en pacientes > 820 kg; 20 mg en pacientes > 20-45 kg; 40 mg en pacientes > 45 kg) o dosis alta (20 mg en pacientes
> 8-20 kg; 40 mg en pacientes > 20-45 kg; 80 mg en pacientes > 45 kg) de Revatio y 60 fueron tratados con placebo.
El perfil de reacciones adversas en este estudio pediátrico fue en general concordante con el de los adultos (ver tabla más arriba). Las reacciones adversas más frecuentes que se produjeron (con una frecuencia > 1%) en los pacientes que recibieron Revatio (dosis combinadas) y con una frecuencia
> 1% con respecto a los pacientes que recibieron placebo fueron pirexia, infección del tracto
respiratorio superior (11,5% cada una), vómitos (10,9%), erección aumentada (incluidas erecciones espontáneas del pene en los sujetos varones) (9,0%), náuseas, bronquitis (4,6% cada una), faringitis (4,0%), rinorrea (3,4%) y neumonía, rinitis (2,9% cada una).
De los 234 sujetos pediátricos tratados en el estudio a corto plazo, controlado mediante placebo, 220 participaron en el estudio de extensión a largo plazo. Los sujetos en tratamiento activo con sildenafilo continuaron con el mismo régimen de tratamiento, mientras que los sujetos del grupo placebo en el estudio a corto plazo, fueron reasignados aleatoriamente a tratamiento con sildenafilo.
En general, las reacciones adversas más frecuentes notificadas a lo largo del tiempo que duraron los estudios de corto y largo plazo fueron similares a las observadas en el estudio a corto plazo. Las reacciones adversas notificadas en > 10% de los 229 sujetos tratados con sildenafilo (grupo de dosis combinadas, incluyendo 9 pacientes que no continuaron en el estudio a largo plazo) fueron infección de las vías respiratorias superiores (31%), cefalea (26%), vómitos (22%), bronquitis (20%), faringitis (18%), pirexia (17%), diarrea (15%), gripe (12%) y epistaxis (12%). La mayoría de estas reacciones adversas se consideraron de intensidad leve a moderada.
Se notificaron efectos adversos graves en 94 (41%) de los 229 sujetos que recibían sildenafilo. De los 94 sujetos que notificaron un efecto adverso grave, 14/55 (25,5%) sujetos estaban en el grupo de dosis baja, 35/74 (47,3%) en el grupo de dosis media y 45/100 (45%) en el grupo de dosis alta. Los efectos adversos graves más frecuentes que se produjeron con una frecuencia > 1% en los pacientes tratados con sildenafilo (dosis combinadas) fueron: neumonía (7,4%), insuficiencia cardiaca, hipertensión pulmonar (cada uno 5,2%), infección del tracto respiratorio superior (3,1%), insuficiencia ventricular derecha, gastroenteritis (cada uno 2,2%), dolor torácico, caries dental (cada uno 1,7%) y shock cardiogénico, gastroenteritis vírica e infección del tracto urinario (cada uno 1,3%).
Los siguientes efectos adversos graves se consideraron relacionados con el tratamiento: enterocolitis, convulsión, hipersensibilidad, estridor, hipoxia, sordera neurosensorial y arritmia ventricular.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
En ensayos realizados en voluntarios sanos con dosis únicas de hasta 800 mg, las reacciones adversas fueron similares a las observadas con dosis más bajas, pero la incidencia y gravedad aumentó. Con dosis únicas de 200 mg aumentó la incidencia de reacciones adversas (cefalea, rubefacción, mareos, dispepsia, congestión nasal y trastornos visuales).
En caso de sobredosis, se deben tomar medidas normales de apoyo. Dado que sildenafilo se une intensamente a proteínas plasmáticas y no se elimina por orina, no se espera que la diálisis renal acelere el aclaramiento del fármaco.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Urológicos, Fármacos utilizados en disfunción eréctil, código ATC: G04B E03
Mecanismo de acción
Sildenafilo es un inhibidor potente y selectivo de la fosfodiesterasa tipo 5 (PDE5) específica de la guanosina monofosfatasa cíclica (GMPc) que es la enzima responsable de la degradación del GMPc.
Además de la presencia de esta enzima en el cuerpo cavernoso del pene, la PDE5 está presente en la vasculatura pulmonar. Sildenafilo, por tanto, eleva el GMPc en las células de la vasculatura muscular lisa pulmonar produciendo relajación. En pacientes con hipertensión pulmonar esto puede llevar a vasodilatación del lecho vascular pulmonar y, en menor grado, vasodilatación en la circulación sistémica.
Efectos farmacodinámicos
Los estudios in vitro han mostrado que sildenafilo es selectivo de la PDE5. Su efecto es más potente sobre la PDE5 que sobre otras fosfodiesterasas conocidas. Tiene una selectividad 10 veces mayor que por la PDE6, que participa en el mecanismo de fototransducción en la retina. Tiene una selectividad 80 veces superior por la PDE1 y 700 veces superior por la PDE2, 3, 4, 7, 8, 9, 10 y 11. Particularmente, sildenafilo es 4.000 veces más selectivo por la PDE5 que por la PDE3, la isoforma fosfodiesterasa específica del AMPc relacionada con el control de la contractilidad cardíaca.
Sildenafilo causa una disminución leve y transitoria en la presión arterial sistémica que, en la mayoría de los casos, no se traduce en efectos clínicos. Tras la administración crónica de 80 mg tres veces al día en pacientes con hipertensión sistémica, el cambio medio desde la basal en las tensiones sanguíneas sistólica y diastólica fue una reducción de 9,4 mm Hg y 9,1 mm Hg, respectivamente. Tras la administración crónica de 80 mg tres veces al día en pacientes con hipertensión arterial pulmonar , se observaron menos efectos sobre la presión sanguínea (una reducción de 2 mm Hg tanto en la presión sistólica como diastólica). Con la dosis recomendada de 20 mg tres veces al día, no se han observado reducciones de la presión sistólica o diastólica.
Dosis únicas orales de sildenafilo de hasta 100 mg en voluntarios sanos no produjeron efectos clínicamente relevantes sobre el ECG. Tras la administración crónica de 80 mg tres veces al día en pacientes con hipertensión arterial pulmonar no se comunicaron efectos clínicamente relevantes sobre el ECG.
En un ensayo sobre los efectos hemodinámicos de una dosis oral única de 100 mg de sildenafilo en 14 pacientes con cardiopatía coronaria grave (CC) (> 70% de estenosis de al menos una arteria coronaria), las presiones sanguíneas sistólica y diastólica en reposo se redujeron en un 7% y 6%, respectivamente comparadas con la basal. La presión sanguínea sistólica pulmonar media se redujo en un 9%. Sildenafilo no evidenció efectos sobre el gasto cardíaco, ni alteró al flujo sanguíneo en las arterias coronarias estenosadas.
En algunos pacientes, se han detectado diferencias leves y transitorias en la discriminación del color (azul/verde), cuando se utilizó la prueba de tinción Farnsworth-Munsell 100, una hora después de administrar una dosis de 100 mg, sin que se produjeran efectos evidentes a las dos horas de la administración. El mecanismo postulado para este cambio en la discriminación de color se relaciona con la inhibición de la PDE6, que participa en la cascada de fototransducción de la retina.
Sildenafilo no tiene efectos sobre la agudeza visual o sensibilidad al contraste. En un ensayo controlado con placebo de pequeño tamaño en pacientes con degeneración macular temprana documentada (n=9), se demostró que sildenafilo (dosis única, 100 mg) no produjo cambios significativos en las pruebas visuales realizadas (agudeza visual, test de Amsler, discriminación de los colores estimulados por las luces de tráfico, perímetro de Humphrey y fotoestrés).
Eficacia y seguridad clínicas
Eficacia en pacientes adultos con hipertensión arterial pulmonar (HAP)
Se realizó un ensayo aleatorizado, doble-ciego, controlado con placebo en 278 pacientes con hipertensión pulmonar primaria (idiopática), HAP asociada con enfermedad del tejido conectivo y HAP tras reparación quirúrgica de cardiopatías congénitas. Se asignaron aleatoriamente a uno de los cuatro grupos de tratamiento: placebo, sildenafilo 20 mg, sildenafilo 40 mg o sildenafilo 80 mg, tres veces al día. De los 278 pacientes aleatorizados, 277 pacientes recibieron al menos una dosis del medicamento en investigación. La población del ensayo consistía en 68 (25%) hombres y 209 (75%) mujeres con una edad media de 49 años (rango: 18-81 años) y distancia basal en la prueba de la distancia recorrida en 6 minutos entre 100 y 450 metros inclusive (media: 344 metros). 175 pacientes (63%) incluidos fueron diagnosticados de hipertensión pulmonar primaria, 84 (30%) fueron diagnosticados de HAP asociada a enfermedad del tejido conectivo y 18 (7%) de los pacientes fueron diagnosticados de HAP tras reparación quirúrgica de cardiopatías congénitas. La mayoría de los pacientes pertenecía a la Clase Funcional II de la OMS (107/277; 39%) o III (160/277; 58%) con una distancia basal media en la prueba de la distancia recorrida en 6 minutos, de 378 metros y de 326 metros respectivamente; un menor número eran de la Clase funcional I (1/277; 0,4%) o IV (9/277; 3%) en el inicio. No se estudiaron pacientes con una fracción de eyección ventricular izquierda <45% o un acortamiento de la fracción ventricular izquierda <0,2.
Se añadió sildenafilo (o placebo) al tratamiento de base de los pacientes que incluía una combinación de anticoagulantes, digoxina, bloqueantes de los canales del calcio, diuréticos u oxígeno. No se permitió, como terapia añadida, el uso de prostaciclina, análogos de la prostaciclina y antagonistas de los receptores de la endotelina así como tampoco de los suplementos de arginina. Se excluyó del ensayo a los pacientes en los que previamente había fracasado bosentan.
La variable primaria de eficacia fue el cambio entre la distancia recorrida en 6 minutos (DR6M) basal y a las 12 semanas Se observó un aumento estadísticamente significativo en la DR6M en todos (3) los grupos que recibían dosis de sildenafilo en comparación con placebo. Los aumentos, corregidos con placebo, en la DR6M eran 45 metros (p <0,0001), 46 (p<0,0001) y 50 metros (p<0,0001) con 20 mg, 40 mg y 80 mg de sildenafilo TID, respectivamente. No hubo diferencias significativas en los efectos entre las dosis de sildenafilo. En los pacientes con una DR6M basal <325 metros se observó una mejora en la eficacia con las dosis más altas (mejoras corregidas con placebo de 58 metros, 65 metros y 87 metros con 20 mg, 40 mg y 80 mg TID, respectivamente).
Cuando se analizaron, de acuerdo con la clase funcional de la OMS, se observó un aumento estadísticamente significativo en la DR6M del grupo tratado con dosis de 20 mg. Se observaron unos aumentos de la DR6M frente a placebo, para las clases funcionales II y III, de 49 metros (p=0,0007) y 45 metros (p=0,0031) respectivamente.
La mejoría en la DR6M era visible tras 4 semanas de tratamiento y este efecto se mantuvo durante las semanas 8 y 12. Los resultados fueron generalmente concordantes en los subgrupos de acuerdo con la etiología (HAP primaria y asociada a enfermedad del tejido conectivo), clase funcional de la OMS, sexo, raza, situación, PAP media y IRVP.
Los pacientes que recibían cualquier dosis de sildenafilo alcanzaron una reducción estadísticamente significativa en la presión arterial pulmonar media (PAPm) y la resistencia vascular pulmonar (RVP) en comparación con los tratados con placebo. Los efectos del tratamiento, corregidos con placebo, para la PAPm fueron de -2,7 mmHg (p =0,04), -3,0 mmHg (p =0,01) y -5,1 mmHg (p =0,0001), con 20 mg, 40 mg y 80 mg de sildenafilo TID, Los efectos del tratamiento corregidos con placebo en la RVP fueron de -178 dina.s/cm5 (p=0,0051), -195 dina.s/cm5 (p=0,0017) y -320 dina.s/cm5 (p<0,0001) con 20 mg, 40 mg y 80 mg TID de sildenafilo, respectivamente. El porcentaje de reducción a las 12 semanas con 20 mg 40 mg y 80 mg TID de sildenafilo en la RVP (11,2%, 12,9%, 23,3%) era proporcionalmente mayor que la reducción en la resistencia vascular sistémica (RVS) (7,2%, 5,9 %, 14,4 %). Se desconoce el efecto de sildenafilo sobre la mortalidad.
Un mayor porcentaje de pacientes en cada dosis de sildenafilo (es decir, 28 %, 36 % y 42 % de los sujetos que recibieron dosis de 20 mg, 40 mg y 80 mg TID de sildenafilo, respectivamente) evidenció una mejoría de al menos una clase funcional de la OMS en la semana 12 comparado con placebo (7 %). Los respectivos odds ratios fueron 2,92 (p=0,0087), 4,32 (p=0,0004) y 5,75 (p<0,0001).
Datos de supervivencia a largo _plazo en _población naive
Los pacientes que se incluyeron en el estudio pivotal eran candidatos para entrar en un estudio de extensión, abierto, a largo plazo. A los 3 años, el 87% de los pacientes estaban recibiendo una dosis de 80 mg TID. En el estudio pivotal, un total de 207 pacientes fueron tratados con Revatio, y se evaluó su supervivencia a largo plazo durante un mínimo de 3 años. En esta población, las estimaciones de Kaplan-Meier de supervivencia a los 1, 2 y 3 años fueron de 96%, 91% y 82%, respectivamente. La supervivencia de los pacientes tipificados como clase funcional II de la OMS desde el inicio hasta 1,2 y 3 años fue de 99%, 91% y 84%, respectivamente y de los pacientes tipificados como la clase funcional III de la OMS desde el inicio hasta 1,2 y 3 años fue de 94%, 90% y 81%, respectivamente.
Eficacia en _pacientes adultos con HAP (cuando se utiliza en combinación con epoprostenol)
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 267 pacientes con HAP que estaban estabilizados con epoprostenol intravenoso. Los pacientes con HAP incluidos padecían Hipertensión arterial pulmonar primaria (212/267, 79%) y HAP asociada con enfermedad del tejido conectivo (55/267, 21%). Al inicio la mayoría de los pacientes estaban tipificados como clase funcional II (68/267, 26%) o III (175/267, 66%) de la OMS; pocos pacientes estaban tipificados como clase funcional I (3/267, 1%) o IV (16/267, 6%) de la OMS; en unos pocos pacientes (5/267, 2%) se desconocía la clase funcional de la OMS. Los pacientes fueron aleatorizados para recibir placebo o sildenafilo (en una titulación fija que se iniciaba con 20 mg, pasando a 40 mg y posteriormente a 80 mg, tres veces al día, si se toleraba) cuando se utilizaba en combinación con epoprostenol intravenoso.
La variable principal de eficacia era el cambio desde el inicio hasta la semana 16 en la prueba de la distancia recorrida en 6 minutos. Hubo un beneficio estadísticamente significativo en la DR6M para sildenafilo comparado con placebo. Se observó un aumento en la DR6M, corregida con placebo, de 26 metros a favor de sildenafilo (95% IC: 10,8; 41,2) (p=0,0009). En los pacientes que inicialmente alcanzaban una DR6M > 325 metros, el efecto del tratamiento era de 38,4 metros a favor de sildenafilo mientras que en los pacientes que inicialmente recorrían una DR6M <325 metros, el efecto del tratamiento fue de 2,3 metros a favor de placebo. En los pacientes con HAP primaria, el efecto del tratamiento fue de 31,1 metros comparado con 7,7 metros en los pacientes con HAP asociada a enfermedad del tejido conectivo. La diferencia en los resultados entre los subgrupos aleatorizados puede deberse a la casualidad a la vista del limitado tamaño de la muestra.
Los pacientes tratados con sildenafilo alcanzaron una reducción estadísticamente significativa de la Presión Arterial Pulmonar media (PAPm) en comparación con los tratados con placebo. Se observó un efecto medio del tratamiento, corregido con placebo, de -3,9 mmHg a favor de sildenafilo (95% IC: -5,7; -2,1) (p=0,00003). El tiempo hasta empeoramiento clínico era una variable secundaria que se definió como el tiempo desde la aleatorización hasta la aparición del primer acontecimiento de empeoramiento clínico (muerte, trasplante pulmonar, inicio del tratamiento con bosentan o un deterioro clínico que requiriese un cambio en el tratamiento con epoprostenol). El tratamiento con sildenafilo retrasó significativamente el tiempo hasta empeoramiento clínico de la HAP en comparación con placebo (p=0,0074). Veintitrés sujetos sufrieron acontecimientos de empeoramiento clínico en el grupo placebo (17,6%) en comparación con 8 sujetos en el grupo de sildenafilo (6,0%).
Datos de supervivencia a largo plazo en un estudio con epoprostenol de tratamiento base Los pacientes que entraron en el estudio de tratamiento añadido a epoprostenol eran elegibles para entrar en un estudio de extensión abierto a largo plazo. A los 3 años el 68% de los pacientes estaba recibiendo una dosis de 80 mg TID. En el estudio inicial se trataron un total de 134 pacientes con Revatio y se evaluó su estado de supervivencia a largo plazo durante un mínimo de 3 años. En esta población, las estimaciones de supervivencia de Kaplan-Meier a 1, 2 y 3 años fueron de 92 %, 81 % y 74 %, respectivamente.
Eficacia y seguridad en pacientes adultos con HAP (cuando se utiliza en combinación con bosentan)
Se realizó un ensayo aleatorizado, doble ciego, controlado con placebo en 103 sujetos con HAP (grado funcional II y III de la OMS) clínicamente estables, que llevaban en tratamiento con bosentan un mínimo de tres meses. Los pacientes con HAP incluían aquellos pacientes con HAP primaria, y HAP asociada a enfermedad del tejido conectivo. Se aleatorizó a los pacientes para recibier placebo o sildenafilo (20 mg tres veces al día) en combinación con bosentan (62,5 - 125 mg dos veces al día). La variable principal de eficacia fue el cambio en la DR6M desde el inicio a la semana 12. Los resultados indican que no se observa una diferencia significativa en la media del cambio en la DR6M desde el inicioentre 20 mg de sildenafilo y placebo (13,62 m (95% IC: -3,89 a 31,12) y 14,08 m (95% IC: -3,89 a 31,12), respectivamente).
Se observaron diferencias en la DR6M entre los pacientes con HAP primaria y los pacientes con HAP asociada a enfermedad del tejido conectivo. En el caso de los sujetos con HAP primaria (67 sujetos), la media del cambio desde el inicio fuede 26,39 m (95% IC: 10,70 a 42,08) y 11,84 m (95% IC: -8,83 a 32,52) para los grupos con sildenafilo y placebo, respectivamente. Sin embargo, en el caso de los sujetos con HAP asociada a enfermedad del tejido conectivo (36 sujetos), la media del cambio desde el inicio fue de -18,32 m (95% IC: -65,66 a 29,02) y 17,50 m (95% IC: -9,41 a 44,41) para los grupos con sildenafilo y placebo, respectivamente.
En conjunto, los acontecimientos adversos fueron, por lo general, similares entre ambos grupos de tratamiento (sildenafilo más bosentan frente a bosentan en monoterapia), y coherentes con el perfil de seguridad conocido de sildenafilo cuando se emplea en monoterapia (ver secciones 4.4 y 4.5).
Población pediátrica
Un total de 234 sujetos de edades entre 1 y 17 años fueron tratados en un estudio aleatorizado, doble ciego, multicéntrico, controlado con placebo de grupos paralelos de rango de dosis. Los sujetos (38% varones y 62% mujeres) tenían un peso corporal > 8 kg, y tenían hipertensión arterial pulmonar primaria (HPP) [33%], o HAP secundaria a cardiopatía congénita [shunt sistémico pulmonar_37%, reparación quirúrgica 30%]. En este estudio, 63 de los 234 (27 %) pacientes eran < 7 años (dosis baja de sildenafilo = 2; dosis media = 17; dosis alta = 28; placebo = 16) y 171 de los 234 (73%) pacientes tenían 7 años o más (dosis baja de sildenafilo = 40; dosis media = 38; y dosis alta = 49; placebo = 44). En el momento basal, la mayoría de los sujetos estaban en clase funcional I (75/234, 32%) o II de la OMS (120/234, 51%); menos pacientes estaban en clase funcional III (35/234, 15%) o IV (1/234, 0.4%); en unos pocos pacientes (3/234, 1.3%), se desconocía la clase funcional de la OMS.
Los pacientes eran naíve a tratamientos específicos para la HAP y no se permitió en el estudio el uso de prostaciclina, análogos de la prostaciclina y antagonistas de los receptores de endotelina, ni de suplementos de arginina, nitratos, alfa-bloqueantes e inhibidores potentes del CYP450 3A4.
El objetivo primario del estudio era evaluar la eficacia a 16 semanas del tratamiento crónico con sildenafilo oral en sujetos pediátricos para mejorar la capacidad de ejercicio medida por el Test de Ejercicio Cardiopulmonar (TECP) en sujetos que estaban lo bastante desarrollados para realizar el test (n=115). Las variables secundarias incluían monitorización hemodinámica, evaluación de síntomas, clase funcional de la OMS, cambios en el tratamiento basal y determinaciones de calidad de vida.
Los sujetos fueron aleatorizados a uno de los tres grupos de tratamiento de sildenafilo con regímenes de dosis baja (10 mg), media (10-40 mg) o alta (20-80 mg) de Revatio administrado tres veces al día, o placebo. Las dosis realmente administradas en cada grupo dependieron del peso corporal (ver sección 4.8). La proporción de sujetos que recibieron medicación de soporte al inicio (anticoagulantes, digoxina, bloqueantes de los canales del calcio, diuréticos y/o oxígeno) fue similar en los grupos de sildenafilo combinados (47,7%) y grupo tratados con placebo (41,7%).
La variable principal fue el porcentaje de cambio corregido con placebo en el VO2 pico desde la basal hasta la semana 16 evaluado por el TECP en los grupos combinados de dosis (Tabla 2). Un total de 106 de 234 (45%) sujetos fueron evaluables por el TECP, que incluía aquellos niños > 7 años y con un desarrollo capaz de realizar el test. Los niños < 7 años (dosis combinadas de sildenafilo = 47; placebo = 16) solo fueron evaluados para las variables secundarias. Los volúmenes medios basales del consumo pico de oxígeno (VO2) fueron comparables en todos los grupos de tratamiento de sildenafilo (17,37 a 18,03 ml/kg/min) y ligeramente superior en el grupo tratado con placebo (20,02 ml/kg/min). Los resultados del análisis principal (grupos de dosis combinados versus placebo) no fueron estadísticamente significativos (p = 0,056) (ver Tabla 2). La diferencia estimada entre la dosis media de sildenafilo y placebo fue de 11,33% (IC 95%: 1,72 a 20,94) (ver Tabla 2).
Tabla 2: Porcentaje de cambio corregido con placebo en el VO2 pico por grupo de tratamiento activo
Grupo de tratamiento
Diferencia estimada Intervalo de confianza del
95%
Dosis baja 3,81 -6,11; 13,73
(n=24)
Dosis media 11,33 1,72; 20,94
(n=26)
Dosis alta 7.98 -1,64; 17,60
(n=27)
Grupos de dosis 7,71 -0,19; 15,60
combinados (n=77) (p = 0,056)
n=29 para el grupo de placebo
Estimados basados en el ANCOVA con ajustes para las covarianzas del VO2 máximo en la basal, etiología y grupo de peso.
Se observaron mejorías relacionadas con la dosis en el índice de resistencia vascular pulmonar (IPVR) y presión arterial pulmonar media (PAPm). Los grupos de dosis media y alta de sildenafilo mostraron reducciones del IPVR comparados con placebo, del 18% (IC 95%: 2% a 32%) y 27% (IC 95%: 14% a 39%), respectivamente; mientras que el grupo de dosis baja no mostró diferencia significativa con placebo (diferencia del 2%). Los grupos de dosis media y alta de sildenafilo mostraron cambios en la PAPm respecto a la basal en comparación con placebo, de -3,5 mmHg (IC 95%: -8,9; 1,9) y -
7,3 mmHg (IC 95%: -12,4; -2,1), respectivamente; mientras que el grupo de dosis baja mostró poca diferencia con placebo (diferencia de 1,6 mmHg). Se observaron mejorías en el índice cardiaco en los tres grupos de sildenafilo sobre placebo, 10%, 4% y 15% para los grupos de dosis baja, media y alta, respectivamente.
Sólo se demostraron mejorías significativas en la clase funcional en los sujetos con dosis alta de sildenafilo comparados con los de placebo. Los cocientes de Odds para los grupos de dosis baja, media y alta de sildenafilo comparados con placebo fueron de 0,6 (IC 95%: 0,18; 2,01), 2,25 (IC 95%: 0,75; 6,69) y 4,52 (IC 95%: 1,56; 13,10), respectivamente.
Datos de la extensión a largo plazo
De los 234 sujetos pediátricos tratados en el estudio a corto plazo, controlado mediante placebo, 220 participaron en el estudio de extensión a largo plazo del estudio. Los sujetos en el grupo del placebo en el estudio a corto plazo se les reasignó aleatoriamente a tratamiento con sildenafilo; a los sujetos con peso corporal < 20 kg se les englobó en los grupos de dosis intermedia o alta (1:1), mientras que a los sujetos con peso corporal > 20 kg se les englobó en los grupos de dosis baja, intermedia o alta (1:1:1). Del total de 229 sujetos a quienes se administró sildenafilo, hubo 55, 74 y 100 sujetos en los grupos de dosis baja, intermedia o alta, respectivamente. A lo largo del estudio de corto plazo y de largo plazo, la duración total del tratamiento desde el inicio del doble ciego para cada sujeto individual osciló entre 3 y 3129 días. Por grupo de tratamiento con sildenafilo, la duración mediana del tratamiento con sildenafilo fue de 1696 días (excluidos los 5 sujetos que recibieron placebo en el doble ciego y que no fueron tratados en la extensión de largo plazo del estudio).
La estimación de la supervivencia de Kaplan-Meier a los 3 años en pacientes con un peso corporal > 20 kg al inicio, fue del 94%, 93% y 85% en los grupos de dosis baja, media y alta, respectivamente; en pacientes con un peso corporal < 20 kg al inicio, la estimación de la supervivencia fue del 94% y 93% para los pacientes incluidos en los grupos de dosis media y alta, respectivamente (ver secciones
4.4 y 4.8).
Durante la realización del estudio, se notificaron un total de 42 muertes tanto durante el tratamiento como las notificadas durante el seguimiento de la supervivencia. 37 muertes se produjeron antes de la decisión del Comité de Control de los Datos de reducir la dosis hasta la dosis baja, como resultado del balance de muertes observado con el incremento de dosis de sildenafilo. Entre estas 37 muertes, el número (%) de muertes era de 5/55 (9,1%), 10/74 (13,5%) y 22/100 (22%) en los grupos de dosis baja, media y alta de sildenafilo, respectivamente. Posteriormente se notificaron 5 muertes adicionales. Las causas de estas muertes estaban relacionadas con la HAP. No deben utilizarse dosis superiores a las recomendadas en pacientes pediátricos con HAP (ver secciones 4.2 y 4.4).
Se evaluó el VO2 pico un año después del inicio del estudio controlado con placebo. De los sujetos tratados con sildenafilo cuyo desarrollo permitía realizar el TECP, en 59/114 sujetos (52%) no se evidenció ningún deterioro del VO2 máximo desde el inicio del tratamiento con sildenafilo. De forma similar, 191 de 229 sujetos (83%) que habían recibido sildenafilo durante el estudio controlado con placebo habían mantenido o mejorado su clase funcional de la OMS en el momento de la evaluación realizada tras un año.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Revatio en recién nacidos con hipertensión arterial pulmonar (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Sildenafilo se absorbe rápidamente. Tras la administración oral, en ayunas, se observan concentraciones plasmáticas máximas entre 30 y 120 minutos (mediana de 60 minutos) post-dosis. La biodisponibilidad oral absoluta media es del 41% (rango del 25 al 63%). Tras la administración oral tres veces al día de sildenafilo, el AUC y Cmax aumentaron en proporción a la dosis en el rango de dosis de 20-40 mg. Tras la administración de dosis orales de 80 mg tres veces al día, se observaron niveles plasmáticos de sildenafilo superiores a los proporcionales a la dosis. En pacientes con hipertensión arterial pulmonar, la biodisponibilidad oral de sildenafilo tras 80 mg tres veces al día fue de media un 43% (90% IC: 27% - 60%) mayor comparada con las dosis inferiores.
Cuando sildenafilo se administra con alimentos, la velocidad de absorción disminuye con un retraso medio en la Tmax de 60 minutos y una reducción media en la Cmax del 29%. No obstante, el grado de absorción no se vio significativamente afectado (el AUC se redujo en un 11%).
Distribución
El volumen medio de distribución (Vdss) en estado de equilibrio para sildenafilo es de 105 l, indicando una distribución tisular del fármaco. Tras la administración de dosis orales de 20 mg tres veces al día, la concentración plasmática máxima total media de sildenafilo en el estado de equilibrio es aproximadamente 113 ng/ml. Sildenafilo y su metabolito principal circulante N-desmetil se encuentran unidos a proteínas plasmáticas en un 96%. La unión a proteínas es independiente de las concentraciones totales de ambos compuestos.
Biotransformación
Sildenafilo se metaboliza predominantemente por las isoenzimas microsomales hepáticas CYP3A4 (principalmente) y CYP2C9 (en menor medida). El metabolito principal circulante resulta de la N-desmetilación de sildenafilo. Este metabolito tiene un perfil de selectividad por las fosfodiesterasas similar a sildenafilo y la potencia in vitro por PDE5 es de aproximadamente el 50% de la del principio activo original. El metabolito N-desmetil continúa metabolizándose, con una vida media terminal de aproximadamente 4 horas. En pacientes con hipertensión pulmonar, las concentraciones plasmáticas del metabolito desmetilo son aproximadamente el 72% de las de sildenafilo tras una administración diaria de 20 mg tres veces al día (traduciéndose su contribución en un 36% de los efectos farmacológicos de sildenafilo). Se desconocen los efectos posteriores sobre la eficacia.
Eliminación
El aclaramiento total de sildenafilo es de 41 l/hora, con una fase terminal resultante en una vida media de 3-5 horas. Tras la administración oral o intravenosa, sildenafilo se excreta en forma de metabolitos predominantemente en heces (aproximadamente el 80% de la dosis oral administrada) y en menor medida en orina (aproximadamente el 13% de la dosis oral administrada).
Farmacocinética en grupos especiales de pacientes
Pacientes de edad avanzada
Sildenafilo mostró un aclaramiento reducido en voluntarios sanos de edad avanzada (más de 65 años), siendo las concentraciones plasmáticas de sildenafilo y de su metabolito activo N-desmetil un 90% más altas que las observadas en voluntarios sanos jóvenes (18-45 años). La concentración de sildenafilo libre en el plasma fue aproximadamente un 40% mayor, debido al efecto que el envejecimiento ejerce sobre la unión a las proteínas plasmáticas.
Insuficiencia renal
En voluntarios con insuficiencia renal leve a moderada (aclaramiento de creatinina = 30-80 ml/min), no se alteró la farmacocinética de sildenafilo después de recibir una única dosis oral de 50 mg. En voluntarios con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min), se redujo el aclaramiento de sildenafilo, con un aumento del AUC y Cmax del 100% y del 88% respectivamente, en comparación a los voluntarios de la misma edad sin insuficiencia renal. Además, los valores de AUC y Cmax para el metabolito N-desmetil aumentaron significativamente en 200% y 79%, respectivamente en sujetos con insuficiencia renal grave en comparación con sujetos con función renal normal.
Insuficiencia hepática
En voluntarios con cirrosis hepática de leve a moderada (Child-Pugh clase A y B), el aclaramiento de sildenafilo se redujo, resultando en aumentos en el AUC (85%) y Cmax (47%) en comparación con voluntarios de la misma edad sin insuficiencia hepática. Además, los valores del AUC y Cmax para el metabolito N-desmetil estaban significativamente aumentados en un 154% y 87%, respectivamente en sujetos con cirrosis en comparación con sujetos con la función hepática normal. La farmacocinética de sildenafilo en pacientes con insuficiencia hepática grave no ha sido estudiada.
Farmacocinética en la población
En pacientes con hipertensión arterial pulmonar, las concentraciones medias en el estado de equilibrio eran de 20-50% superiores en el rango de dosis estudiado de 20-80 mg tres veces al día en comparación con los voluntarios sanos. La Cmin era el doble en comparación con los voluntarios sanos. Ambos hallazgos sugieren un menor aclaramiento y/o una mayor biodisponibilidad de sildenafilo en pacientes con hipertensión arterial pulmonar en comparación con voluntarios sanos.
Población pediátrica
A partir de los análisis del perfil farmacocinético de sildenafilo en pacientes incluidos en los estudios clínicos pediátricos, se demostró que el peso corporal era un buen valor predictivo de la exposición al fármaco en niños. Se estimó que los valores de la semivida de las concentraciones plasmáticas de sildenafilo oscilaban entre 4,2 y 4,4 horas para un intervalo de 10 a 70 kg de peso corporal y no mostraron ninguna diferencia que pudiera parecer como clínicamente importante. Se estimó que la Cmax tras una dosis única de 20 mg de sildenafilo administrada oralmente era de 49, 104 y 165 ng/ml en pacientes de 70, 20 y 10 kg, respectivamente. Se estimó que la Cmax tras una dosis única de 10 mg de sildenafilo administrada oralmente era de 24, 53 y 85 ng/ml en pacientes de 70, 20 y 10 kg, respectivamente. Se estimó la Tmax aproximadamente en 1 hora y era casi independiente del peso corporal.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción y el desarrollo.
En las crías de ratas que fueron tratadas pre- y postnatalmente con 60 mg/kg de sildenafilo, se observó una reducción del tamaño de la camada, un peso inferior en el día 1 y una reducción de la supervivencia en el día 4 con exposiciones que eran aproximadamente cincuenta veces la exposición esperada en humanos con 20 mg tres veces al día. En los estudios preclínicos se han observado efectos con exposiciones que se consideraron suficientemente en exceso de la dosis máxima en humanos lo que indica poca relevancia para el uso clínico.
No hubo reacciones adversas, con posible relevancia para el uso clínico, observadas en animales con niveles de exposición clínicamente relevantes que no hubieran sido observadas en los ensayos clínicos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo para suspensión oral:
Sorbitol
Ácido cítrico anhidro Sucralosa Citrato de sodio Goma xantana Dióxido de titanio (E 171) Benzoato de sodio (E21)
Sílice coloidal anhidra
Aroma de uva:
Maltodextrina
Concentrado de zumo de uva Goma de acacia Concentrado de zumo de piña Ácido cítrico anhidro Aromas naturales
6.2 Incompatibilidades
No procede.
6.3 Período de validez
2 años
Tras la reconstitución, la suspensión oral es estable durante 30 días.
6.4 Precauciones especiales de conservación Polvo
No conservar a temperatura superior a 30°C.
Conservar en el envase original para protegerlo de la humedad.
Suspensión oral
Conservar por debajo de 30°C o en nevera entre 2°C y 8°C. No congelar.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Frasco de vidrio ámbar de 125 ml (con tapón a rosca de polipropileno) que contiene 32.27 g de polvo para suspensión oral.
Una vez reconstituido el frasco contiene 112 ml de suspensión oral, de los que 90 ml se utilizarán para administrar las dosis.
Formato: 1 frasco
Cada envase también contiene un vasito de medida de polipropileno (graduado para marcar 30 ml), una jeringa dosificadora oral de polipropileno (3 ml) con un émbolo de HDPE y un adaptador a presión para el frasco de LDPE.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Se recomienda que el farmacéutico reconstituya Revatio suspensión oral antes de su administración al paciente.
Instrucciones de reconstitución
Nota: Independientemente de la dosis a tomar, se debe utilizar un volumen total de 90 ml (3 x 30 ml) de agua para reconstituir el contenido del frasco.
1. Golpear suavemente el frasco para soltar el polvo.
2. Quitar el tapón.
3. Medir 30 ml de agua llenando el vasito de medida (incluido en el estuche) hasta la marca y añadir al frasco. Medir otros 30 ml de agua utilizando el vasito de medida y añadir al frasco. (figura 1)
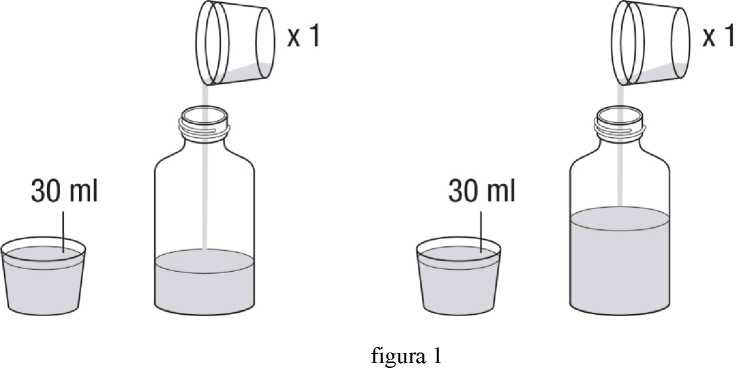
4. Volver a tapar y agitar con fuerza durante un mínimo de 30 segundos. (figura 2)
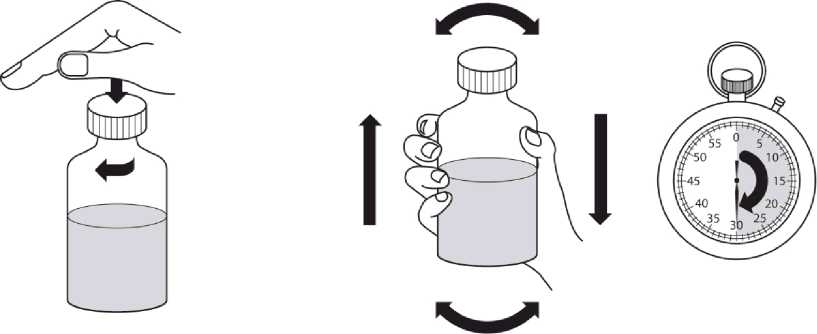
5. Quitar el tapón.
6. Utilizando el vasito, medir otros 30 ml de agua y añadir al frasco. Siempre se debe añadir un total de 90 ml (3 x 30 ml) de agua, independientemente de la dosis que se vaya a tomar (figura 3).
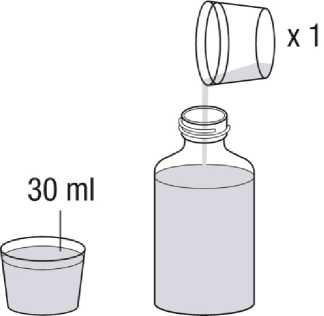
figura 3
7. Volver a tapar y agitar el frasco con fuerza durante un mínimo de 30 segundos. (figura 4).
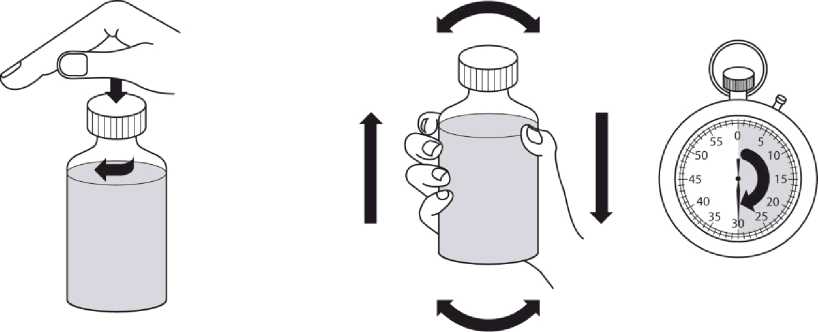
figura 4
8. Quitar el tapón.
9. Meter a presión el adaptador en el cuello del frasco (como se indica en la figura 5 a continuación). Se proporciona un adaptador de modo que pueda llenar la jeringa dosificadora oral con el medicamento del frasco. Vuelva a poner el tapón.
10. El polvo reconstituido da una suspensión oral blanca con aroma a uva. Escriba la fecha de
caducidad de la suspensión oral reconstituida en la etiqueta del frasco (la fecha de caducidad de la suspensión oral reconstituida es de 30 días desde la fecha de reconstitución). Después de esta fecha, la suspensión oral no utilizada se debe eliminar o ser devuelta a su farmacéutico
Instrucciones de uso
1. Agite fuertemente el frasco de suspensión oral reconstituida cerrado, durante un mínimo de
10 segundos
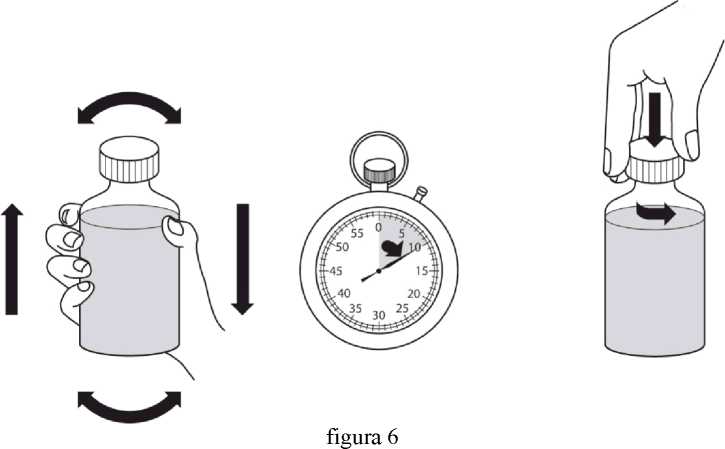
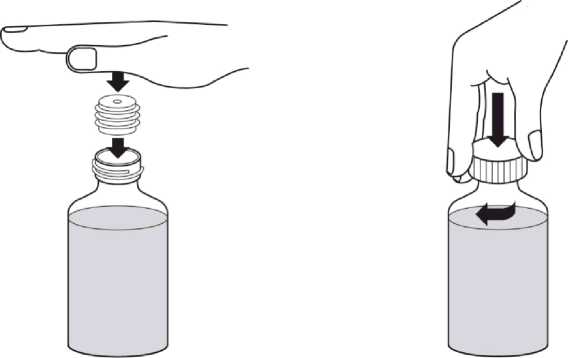
figura 5
2. Con el frasco recto, sobre una superficie plana, inserte la punta de la jeringa dosificadora en el adaptador (figura 7).
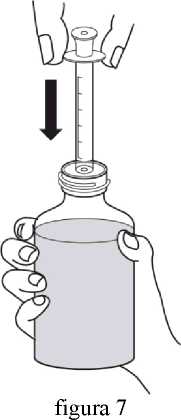
3. Invierta el frasco sujetando la jeringa dosificadora en su sitio. Tire lentamente del émbolo de la jeringa dosificadora hasta la marca que indica su dosis (tomando 1 ml se consigue una dosis de 10 mg, tomando 2 ml se consigue una dosis de 20 mg). Para medir exactamente la dosis, el borde superior del émbolo debe estar alineado con la marca adecuada en la jeringa dosificadora oral (figura 8).
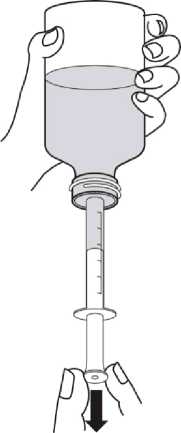
figura 8
4. Si ve grandes burbujas, empuje suavemente el émbolo dentro de la jeringa. Esto introducirá de nuevo el medicamento en el frasco. Repita este paso 3 veces.
5. Vuelva poner el frasco hacia arriba con la jeringa dosificadora oral aún en su sitio. Retire la jeringa dosificadora oral del frasco.
6. Introduzca la punta de la jeringa dosificadora oral en la boca. Apunte con la punta de la jeringa dosificadora oral hacia dentro de la mejilla. Empuje LENTAMENTE el émbolo de la jeringa dosificadora oral. No haga salir rápidamente el medicamento. Si el medicamento se administra a un niño, asegúrese de que está sentado o incorporado antes de administrar el medicamento (figura 9)
7. Vuelva a poner la tapa del frasco, dejando el adaptador del frasco en su sitio. Lave la jeringa dosificadora oral como se indica a continuación.
Limpieza y conservación de la jeringa:
1. Después de cada administración lave la jeringa. Saque el émbolo de la jeringa y lave ambas partes con agua.
2. Seque las dos partes. Empuje el émbolo dentro de la jeringa. Mantenga en un lugar limpio y seguro junto con el medicamento.
Una vez reconstituida la suspensión oral solo debe administrarse utilizando la jeringa dosificadora oral
que se incluye en cada estuche. Ver las instrucciones más detalladas en el prospecto para el paciente.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited, Sandwich, Kent CT13 9NJ, Reino Unido.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/318/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 28/octubre/2005 Fecha de la última renovación: 23/septiembre/2010
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricante(s) responsable(s) de la liberación de los lotes
Fareva Amboise Zone Industrielle 29 route des Industries 37530 Pocé-sur-Cisse Francia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Medidas adicionales de minimización de riesgos
El Titular de la Autorización de Comercialización (TAC) acordará los detalles de un sistema de distribución controlada para los viales de 20 ml de Revatio 0,8 mg/ml solución inyectable con las Autoridades nacionales competentes y debe implementar nacionalmente este programa para asegurar que antes de la prescripción todos los profesionales sanitarios que vayan a prescribir y/o dispensar Revatio 0,8 mg/ml solución inyectable hayan recibido lo siguiente:
• Información para profesionales sanitarios
• Copia de la ficha técnica/resumen de las características del producto (RCP)
• Modelo de recogida de datos (MRD) diseñado para facilitar la notificación de casos de hipotensión y problemas asociados
La información para profesionales sanitarios debe incluir los siguientes elementos clave:
• Información sobre el Programa de Monitorización de la Farmacovigilancia respecto al riesgo potencial de hipotensión clínicamente relevante y problemas asociados que deba implementarse con el uso del modelo de recogida de datos (MRD).
El TAC acordará con las Autoridades nacionales competentes la Información a los Profesionales Sanitarios y los profesionales sanitarios diana antes del lanzamiento del vial de 20 ml de Revatio 0,8 mg/ml solución inyectable en ese país.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CARTONAJE EXTERIOR/ESTUCHE
1. NOMBRE DEL MEDICAMENTO
Revatio 20 mg comprimidos recubiertos con película Sildenafilo
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido contiene 20 mg de sildenafilo (como citrato).
3. LISTA DE EXCIPIENTES
Contiene lactosa monohidrato.
Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
90 comprimidos recubiertos con película 300 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C. Conservar en el envase original para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/318/001
EU/1/05/318/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Revatio 20 mg
ESTUCHE DEL VIAL Y ETIQUETA DEL VIAL
1. NOMBRE DEL MEDICAMENTO
Revatio 0,8 mg/ml solución inyectable Sildenafilo
2. PRINCIPIO(S) ACTIVO(S)
Cadaml de solución contiene 0,8 mg de sildenafilo (como citrato). Cada vial de 20 ml contiene 12,5 ml (10 mg de sildenafilo, como citrato).
3. LISTA DE EXCIPIENTES
Contiene glucosa y agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable 1 vial de 10 mg/12,5 ml
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/318/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Revatio 0,8 mg/ml
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS
ACONDICIONAMIENTO PRIMARIO/BLISTER
1. NOMBRE DEL MEDICAMENTO
Revatio 20 mg comprimidos Sildenafilo
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
LOT
5. OTROS
ESTUCHE DE CARTÓN
1. NOMBRE DEL MEDICAMENTO
Revatio 10 mg/ml polvo para suspensión oral Sildenafilo
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, cada ml de suspensión oral contiene 10 mg de sildenafilo (como citrato). Un frasco de suspensión oral reconstituida (112 ml) contiene 1,12 g de sildenafilo (como citrato).
3. LISTA DE EXCIPIENTES
Contiene sorbitol.
Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo para suspensión oral.
1 frasco
1 adaptador, 1 vasito de medida y 1 jeringa dosificadora oral
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Agitar el frasco antes de usar.
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Polvo: No conservar a temperatura superior a 30°C. Conservar en el envase original para protegerlo de la humedad.
Tras la reconstitución: Conservar por debajo de 30°C o en nevera entre 2°C y 8°C. No congelar. A los 30 días de la reconstitución eliminar cualquier resto de la suspensión oral.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/318/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Revatio 10 mg/ml
INFORMACIÓN QUE DEBE FIGURAR EN EL ACONDICIONAMIENTO PRIMARIO FRASCO
1. NOMBRE DEL MEDICAMENTO
Revatio 10 mg/ml polvo para suspensión oral Sildenafilo
2. PRINCIPIO(S) ACTIVO(S)
Un frasco de suspensión oral reconstituida (112 ml) contiene 1,12 g de sildenafilo (como citrato). Tras la reconstitución 1 ml contiene 10 mg de sildenafilo (como citrato).
3. LISTA DE EXCIPIENTES
Contiene sorbitol.
Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo para suspensión oral
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Agitar el frasco antes de usar.
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Polvo: No conservar a temperatura superior a 30°C. Conservar en el envase original para protegerlo de la humedad.
Tras la reconstitución: Conservar por debajo de 30°C o en nevera entre 2°C y 8°C. No congelar. A los 30 días de la reconstitución eliminar cualquier resto de la suspensión oral.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/05/318/003
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
B. PROSPECTO
Prospecto: Información para el paciente
Revatio 20 mg comprimidos recubiertos con película
Sildenafilo
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Revatio y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Revatio
3. Cómo tomar Revatio
4. Posibles efectos adversos
5. Conservación de Revatio
6. Contenido del envase e información adicional
1. Qué es Revatio y para qué se utiliza
Revatio contiene el principio activo sildenafilo que pertenece a un grupo de medicamentos denominados inhibidores de la fosfodiesterasa tipo 5 (PDE5).
Revatio reduce la tensión sanguínea en los pulmones dilatando los vasos sanguíneos de los pulmones. Revatio se utiliza para tratar la tensión sanguínea elevada en los vasos sanguíneos del pulmón (hipertensión arterial pulmonar) en adultos y niños y adolescentes entre 1 a 17 años.
2. Qué necesita saber antes de empezar a tomar Revatio
No tome Revatio:
- si es alérgico a sildenafilo o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si está tomando medicamentos que contienen nitratos o dadores de óxido nítrico tales como nitrito de amilo (“poppers”). Estos medicamentos, a menudo, se administran para aliviar el dolor de pecho (o angina de pecho). Revatio puede producir un aumento importante de los efectos de estos medicamentos. Debe informar a su médico si está tomando alguno de estos medicamentos. Si no está seguro, consulte con su médico o farmacéutico.
- si está tomando riociguat. Este medicamento se utiliza para tratar la hipertensión arterial pulmonar (es decir, tensión alta en los pulmones) y la hipertensión pulmonar tromboembólica crónica (es decir, tensión alta en los pulmones provocada por coágulos). Los inhibidores de la PDE5, como Revatio, han mostrado que producen un incremento del efecto hipotensivo de este medicamento. Si está tomando riociguat o no está seguro consulte a su médico.
- si recientemente ha tenido un ictus, un infarto de miocardio o si tiene una enfermedad hepática grave o la tensión sanguínea muy baja (<90/50 mmHg).
- si está tomando un medicamento para tratar las infecciones por hongos como ketoconazol o itraconazol o medicamentos que contengan ritonavir (para el SIDA).
- si ha experimentado anteriormente una pérdida de la visión debido a un problema con el flujo sanguíneo en un nervio del ojo llamado neuropatía óptica isquémica anterior no arterítica (NOIA-NA).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Revatio si
- tiene una enfermedad debida a un bloqueo o estrechamiento de una vena en los pulmones en lugar de al bloqueo o estrechamiento de una arteria.
- tiene un problema grave de corazón.
- tiene un problema con las cámaras de bombeo del corazón.
- tiene una tensión sanguínea elevada en los vasos sanguíneos de los pulmones.
- tiene baja tensión sanguínea en descanso.
- pierde una gran cantidad de fluidos corporales (deshidratación) que se puede producir cuando suda mucho o no bebe suficientes líquidos. Esto puede suceder si está enfermo con fiebre, vómitos o diarrea.
- padece una rara enfermedad ocular hereditaria (retinitis pigmentaria).
- padece una anormalidad de los glóbulos rojos (anemia falciforme), cáncer de las células sanguíneas (leucemia), cáncer de médula ósea (mieloma múltiple) o cualquier enfermedad o deformidad del pene.
- padece actualmente úlcera de estómago o alteraciones hemorrágicas (tales como hemofilia) o sangrado de nariz.
- usa medicamentos para la disfunción eréctil.
Cuando los inhibidores de la PDE5, incluyendo sildenafilo, se utilizan para tratar la disfunción eréctil (DE) se han comunicado los siguientes efectos adversos visuales con una frecuencia no conocida: disminución o pérdida parcial, repentina, temporal o permanente de la visión de uno o ambos ojos. Si experimenta una reducción o pérdida repentina de la visión, deje de tomar Revatio y avise a su médico inmediatamente (ver también sección 4).
Se han observado erecciones prolongadas, y a veces dolorosas, en hombres que tomaban sildenafilo. Si tiene una erección que se prolongue durante más de 4 horas, deje de tomar Revatio y consulte inmediatamente con su médico (ver también sección 4).
Precauciones especiales en pacientes con problemas de riñón o hígado
Debe informar a su médico si tiene problemas de riñón o hígado, ya que puede ser necesario un ajuste de dosis.
Niños
Revatio no debe administrarse a niños menores de 1 año.
Toma de Revatio con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
- Medicamentos que contienen nitratos o dadores de óxido nítrico tales como nitrito de amilo (“poppers”). Estos medicamentos, a menudo, se administran para aliviar el dolor de pecho o angina de pecho (ver sección 2. Qué necesita saber antes de empezar a tomar Revatio).
- Informe a su médico o farmacéutico si está tomando riociguat.
- Tratamientos para la hipertensión pulmonar (por ejemplo, bosentan, iloprost).
- Medicamentos que contienen hierba de San Juan (planta medicinal), rifampicina (utilizada para tratar las infecciones bacterianas), carbamazepina, fenitoína y fenobarbital (utilizados, entre otros, para tratar la epilepsia).
- Medicamentos que inhiben la coagulación sanguínea (por ejemplo, warfarina) aunque no han provocado ningún efecto adverso.
- Medicamentos que contienen eritromicina, daritromicina, telitromicina (antibióticos utilizados para tratar ciertas infecciones bacterianas), saquinavir (para el SIDA) o nefazodona (para la depresión) ya que puede ser necesario un ajuste de dosis.
- Terapia con alfa-bloqueante (por ejemplo, doxazosina) para el tratamiento de problemas de hipertensión o de próstata, ya que la combinación de los dos medicamentos puede causar síntomas de reducción en la tensión sanguínea (por ejemplo, mareo, desvanecimiento).
Toma de Revatio con alimentos y bebidas
No debe tomar zumo de pomelo cuando esté siendo tratado con Revatio.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. Revatio no debe utilizarse durante el embarazo a menos que sea absolutamente necesario.
Revatio no debe administrarse a mujeres en edad fértil a menos que se utilicen métodos anticonceptivos adecuados.
Interrumpa la lactancia cuando inicie el tratamiento con Revatio. Revatio no debe administrarse a mujeres lactantes dado que no se conoce si este medicamento pasa a la leche materna.
Conducción y uso de máquinas
Revatio puede producir mareos y afectar a la visión. Debe saber cómo reacciona usted a este medicamento antes de conducir vehículos o utilizar maquinaria.
Revatio contiene lactosa
Antes de tomar este medicamento consulte con su médico, si éste le ha indicado que tiene intolerancia a algunos azúcares.
3. Cómo tomar Revatio
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Para adultos, la dosis recomendada es 20 mg tres veces al día (tomada a intervalos de 6 a 8 horas) tomada con o sin alimentos.
Uso en niños y adolescentes
Para niños y adolescentes de 1 a 17 años, la dosis recomendada es de 10 mg tres veces al día para niños y adolescentes < 20 kg ó de 20 mg tres veces al día en niños y adolescentes > 20 kg, administrados con o sin alimentos. En niños, no se deben utilizar dosis más altas de las recomendadas. Este medicamento solo se debe utilizar para los casos en que debe administrarse 20 mg tres veces al día. Para la administración en pacientes de < 20 kg y en otros pacientes más jóvenes que no pueden tragar los comprimidos pueden utilizarse otras formas farmacéuticas más adecuadas.
Si toma más Revatio del que debe
No debe tomar más medicamento del que le indique su médico.
Si ha tomado más medicamento del aconsejado, consulte a su médico inmediatamente.
Tomar más Revatio del que debiera puede aumentar el riesgo de efectos adversos conocidos.
Si olvidó tomar Revatio
Si ha olvidado tomar Revatio, tome la dosis tan pronto como se acuerde y continúe tomando su medicamento a las horas normales. No tome una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Revatio
La interrupción repentina del tratamiento con Revatio puede llevar al empeoramiento de sus síntomas. No deje de tomar Revatio a menos que su médico se lo indique. Su médico le indicará como reducir la dosis durante unos días antes de interrumpirlo completamente.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Revatio puede producir efectos adversos, aunque no todas las personas los sufran.
Si sufre alguno de los siguientes efectos adversos, deje de tomar Revatio e informe a su médico inmediatamente (ver también sección 2):
- si sufre una reducción o pérdida repentina de la visión (frecuencia no conocida).
- si tiene una erección, que dura continuada durante más de 4 horas. Se han comunicado erecciones prolongadas y a veces dolorosas después de tomar sildenafilo en hombres (frecuencia no conocida).
Adultos
Los efectos adversos comunicados muy frecuentemente (pueden afectar a más de 1 de cada 10 pacientes) fueron, dolor de cabeza o enrojecimiento facial, indigestión, diarrea y dolor en brazos y piernas.
Los efectos adversos comunicados frecuentemente (pueden afectar hasta 1 de cada 10 pacientes) son: infección bajo la piel, síntomas de tipo gripal, inflamación de los senos nasales, reducción del número de glóbulos rojos (anemia), retención de líquidos, dificultad para dormir, ansiedad, migraña, temblor, sensación de cosquilleo, sensación de ardor, reducción del sentido del tacto, sangrado de la parte posterior del ojo, alteraciones en la visión, visión borrosa y sensibilidad a la luz, efectos sobre la percepción de los colores, irritación ocular, ojos enrojecidos/ojos rojos, vértigo, bronquitis, hemorragia nasal, rinorrea, tos, nariz taponada, inflamación de estómago, gastroenteritis, ardor, almorranas, distensión abdominal, sequedad de boca, caída del cabello, enrojecimiento de la piel, sudores nocturnos, dolor muscular, dolor de espalda y aumento de la temperatura corporal.
Los efectos adversos comunicados poco frecuentemente (pueden afectar hasta 1 de cada 100 pacientes) incluyeron: reducción de la agudeza visual, visión doble, sensación anormal en el ojo, sangrado del pene, presencia de sangre en el semen y/o en la orina y aumento de las mamas en hombres.
También se han comunicado erupciones cutáneas, disminución o pérdida repentina de la audición y reducción de la tensión sanguínea con una frecuencia no conocida (la frecuencia no puede estimarse con los datos disponibles).
Niños y adolescentes
Se han comunicado de forma frecuente (pueden afectar hasta 1 de cada 10 pacientes) los siguientes efectos adversos graves: neumonía, insuficiencia cardiaca derecha, shock cardiaco, presión sanguínea elevada en los pulmones, dolor en el pecho, mareo, infecciones respiratorias, bonquitis, infección vírica en el estómago e intestino, infecciones del tracto urinario y perforaciones en los dientes.
Los siguientes efectos adversos graves se consideraron relacionados con el tratamiento y comunicaron de forma poco frecuente (pueden afectar hasta 1 de cada 100 pacientes): reacción alérgica, (como erupción cutánea, inflamación de cara, labios y lengua, estornudos, dificultad para respirar o tragar), convulsiones, latidos irregulares, alteraciones de la audición, falta de aliento, inflamación del tracto digestivo y estornudos por alteraciones en el flujo aéreo.
Los efectos adversos comunicados de forma muy frecuente (pueden afectar a más de 1 de cada 10
personas) fueron dolor de cabeza, vómitos, infección de la garganta, fiebre, diarrea, gripe y sangrado de nariz.
Los efectos adversos comunicados de forma frecuente (pueden afectar hasta 1 de cada 10 pacientes) fueron náuseas, aumento de las erecciones, neumonía y moqueo.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Revatio
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C. Conservar en el envase original para protegerlo de la humedad.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Revatio
- El principio activo es sildenafilo. Cada comprimido contiene 20 mg de sildenafilo (como citrato).
- Los demás componentes son:
Núcleo del comprimido: celulosa microcristalina, fosfato cálcico dibásico (anhidro), croscarmelosa sódica, estearato magnésico.
Recubrimiento: hipromelosa, dióxido de titanio (E171), lactosa monohidratada, triacetato de glicerol.
Aspecto de Revatio y contenido del envase
Los comprimidos recubiertos con película de Revatio, son de color blanco y de forma redonda. Los comprimidos llevan marcado “PFIZER” en una cara y “RVT 20” en la otra. Los comprimidos se presentan en blísteres conteniendo 90 comprimidos y en blísteres conteniendo 300 comprimidos. Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Pfizer Limited, Sandwich, Kent, CT13 9NJ, Reino Unido.
Fabricante:
Fareva Amboise, Zone Industrielle, 29 route des Industries, 37530 Pocé-sur-Cisse, Francia.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Lietuva
Belgie /Belgique / Belgien
Pfizer S.A./N.V.
Tél/Tel: +32 (0)2 554 62 11
Pfizer Luxembourg SARL filialas Lietuvoje Tel. +3705 2514000
|
Etnrapna n^aroep HroKceMÓypr CAPH, KnoH Etnrapna Ten.: +359 2 970 4333 |
Luxembourg/Luxemburg Pfizer S.A. Tél/Tel: +32 (0)2 554 62 11 |
|
Ceská republika Pfizer s r.o. Tel: +420-283-004-111 |
Magyarország Pfizer Kft. Tel.: + 36 1 488 37 00 |
|
Danmark |
Malta |
|
Pfizer ApS Tlf: +45 44 20 11 00 |
V.J. Salomone Pharma Ltd. Tel : + 356 21 22 01 74 |
|
Deutschland Pfizer Pharma PFE GmbH Tel: +49 (0)800 8535555 |
Nederland Pfizer bv Tel: +31 (0)10 406 43 01 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 |
Norge Pfizer AS Tlf: +47 67 52 61 00 |
|
EXXáSa Pfizer EMá; A.E. Tp^: +30 210 678 5800 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
España Pfizer GEP, S.L. Tel: +34 91 490 99 00 |
Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
|
France Pfizer PFE France Tél: +33 (0)1 58 07 34 40 |
Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: +385 1 3908 777 |
Romania Pfizer Romania S.R.L. Tel: +40 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podruznica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0) 1 52 11 400 |
|
Ísland Icepharma hf. Sími: + 354 540 8000 |
Slovenská republika Pfizer Luxembourg SARL, organizacná zlozka Tel: +421-2-3355 5500 |
|
Italia Pfizer Italia S.r.l. Tel: +39 06 33 18 21 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 43 00 40 |
Kúrcpog
Sverige
Pfizer AB
Tel: + 46 (0)8 550 520 00
PFIZER EAAAI A.E. (CYPRUS BRANCH) T^: +357 22 817690
Latvija
Pfizer Luxembourg SARL filiale Latvija
Tel: +371 670 35 775
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
Prospecto: Información para el paciente
Revatio 0,8 mg/ml solución inyectable
Sildenafilo
Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Revatio y para qué se utiliza
2. Qué necesita saber antes de que le administren Revatio
3. Cómo se administra Revatio
4. Posibles efectos adversos
5. Conservación de Revatio
6. Contenido del envase e información adicional
1. Qué es Revatio y para qué se utiliza
de medicamentos sanguíneos de los pulmones.
Revatio contiene el principio activo sildenafilo que pertenece a un grupo denominados inhibidores de la fosfodiesterasa tipo 5 (PDE5).
Revatio reduce la tensión sanguínea en los pulmones dilatando los vasos Revatio se utiliza para tratar la tensión sanguínea elevada en los vasos sanguíneos del pulmón (hipertensión arterial pulmonar).
Revatio solución inyectable es una formulación alternativa de Revatio para pacientes que temporalmente no pueden tomar sus comprimidos de Revatio.
2. Qué necesita saber antes de que le administren Revatio
No deben administrarle Revatio:
- si es alérgico a sildenafilo o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si está tomando medicamentos que contienen nitratos o dadores de óxido nítrico tales como nitrito de amilo (“poppers”). Estos medicamentos, a menudo, se administran para aliviar el dolor de pecho (o angina de pecho). Revatio puede producir un aumento importante de los efectos de estos medicamentos. Debe informar a su médico si está tomando alguno de estos medicamentos. Si no está seguro, consulte con su médico o farmacéutico.
- si está tomando riociguat. Este medicamento se utiliza para tratar la hipertensión arterial pulmonar (es decir, tensión alta en los pulmones) y la hipertensión pulmonar tromboembólica crónica (es decir, tensión alta en los pulmones provocada por coágulos). Los inhibidores de la PDE5, como Revatio, han mostrado que producen un incremento del efecto hipotensivo de este medicamento. Si está tomando riociguat o no está seguro consulte a su médico.
- si recientemente ha tenido un ictus, un infarto de miocardio o si tiene una enfermedad hepática grave o la tensión sanguínea muy baja (<90/50 mmHg).
- si está tomando un medicamento para tratar las infecciones por hongos como ketoconazol o itraconazol o medicamentos que contengan ritonavir (para el SIDA).
- si ha experimentado anteriormente una pérdida de la visión debido a un problema con el flujo sanguíneo en un nervio del ojo llamado neuropatía óptica isquémica anterior no arterítica (NOIA-NA).
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Revatio si:
- tiene una enfermedad debida a un bloqueo o estrechamiento de una vena en los pulmones en lugar de al bloqueo o estrechamiento de una arteria.
- tiene un problema grave de corazón.
- tiene un problema con las cámaras de bombeo del corazón.
- tiene una tensión sanguínea elevada en los vasos sanguíneos de los pulmones.
- tiene baja tensión sanguínea en descanso.
- pierde una gran cantidad de fluidos corporales (deshidratación) que se puede producir cuando suda mucho o no bebe suficientes líquidos. Esto puede suceder si está enfermo con fiebre, vómitos o diarrea.
- padece una rara enfermedad ocular hereditaria (retinitis pigmentaria).
- padece una anormalidad de los glóbulos rojos (anemia falciforme), cáncer de las células sanguíneas (leucemia), cáncer de médula ósea (mieloma múltiple) o cualquier enfermedad o deformidad del pene.
- padece actualmente úlcera de estómago o alteraciones hemorrágicas (tales como hemofilia) o sangrado de nariz.
- usa medicamentos para la disfunción eréctil.
Cuando los inhibidores de la PDE5, incluyendo sildenafilo, se utilizan para tratar la disfunción eréctil (DE) se han comunicado los siguientes efectos adversos visuales con una frecuencia no conocida: disminución o pérdida parcial, repentina, temporal o permanente de la visión de uno o ambos ojos. Si experimenta una reducción o pérdida repentina de la visión, deje de tomar Revatio y avise a su médico inmediatamente (ver también sección 4).
Se han observado erecciones prolongadas, y a veces dolorosas, en hombres que tomaban sildenafilo. Si tiene una erección que se prolongue durante más de 4 horas, deje de tomar Revatio y consulte inmediatamente con su médico (ver también sección 4).
Precauciones especiales en pacientes con problemas de riñón o hígado
Debe informar a su médico si tiene problemas de riñón o hígado, ya que puede ser necesario un ajuste de dosis.
Niños y adolescentes
Revatio no debe administrarse a niños y adolescentes menores de 18 años.
Uso de Revatio con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
- Medicamentos que contienen nitratos o dadores de óxido nítrico tales como nitrito de amilo (“poppers”). Estos medicamentos, a menudo, se administran para aliviar el dolor de pecho o angina de pecho (ver sección 2. Qué necesita saber antes de que le administren Revatio).
- Informe a su médico o farmacéutico si está tomando riociguat.
- Tratamientos para la hipertensión pulmonar (por ejemplo, bosentan, iloprost).
- Medicamentos que contienen hierba de San Juan (planta medicinal), rifampicina (utilizada para tratar las infecciones bacterianas), carbamazepina, fenitoína y fenobarbital (utilizados, entre otros, para tratar la epilepsia).
- Medicamentos que inhiben la coagulación sanguínea (por ejemplo, warfarina) aunque no han provocado ningún efecto adverso.
- Medicamentos que contienen eritromicina, claritromicina, telitromicina (antibióticos utilizados para tratar ciertas infecciones bacterianas), saquinavir (para el SIDA) o nefazodona (para la depresión), ya que puede ser necesario un ajuste de dosis.
- Terapia con alfa-bloqueante (por ejemplo, doxazosina) para el tratamiento de problemas de hipertensión o de próstata, ya que la combinación de los dos medicamentos puede causar síntomas de reducción en la baja tensión sanguínea (por ejemplo, mareo, desvanecimiento).
Uso de Revatio con alimentos y bebidas
No debe tomar zumo de pomelo cuando esté siendo tratado con Revatio.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de que le administren este medicamento. Revatio no debe utilizarse durante el embarazo a menos que sea absolutamente necesario.
Revatio no debe administrarse a mujeres en edad fértil a menos que se utilicen métodos anticonceptivos adecuados.
Interrumpa la lactancia cuando inicie el tratamiento con Revatio. Revatio no debe administrarse a mujeres lactantes dado que no se conoce si este medicamento pasa a la leche materna.
Conducción y uso de máquinas
Revatio puede producir mareos y afectar a la visión. Debe saber cómo reacciona usted a este medicamento antes de conducir vehículos o utilizar maquinaria.
3. Cómo se administra Revatio
Revatio se administra como una inyección intravenosa y será siempre administrado por un médico o enfermero. Su médico decidirá la duración del tratamiento y la cantidad de Revatio solución inyectable que debe recibir diariamente y controlará su respuesta y su enfermedad. La dosis recomendada es 10 mg (correspondiente a 12,5 ml) tres veces al día.
Deben administrarle una inyección intravenosa de Revatio en lugar de Revatio comprimidos.
Si recibe más Revatio del que debe
Si le preocupa haber recibido demasiado Revatio, informe a su médico o enfermero inmediatamente. Tomar más Revatio del que debiera puede aumentar el riesgo de efectos adversos conocidos.
Si no recibe una dosis de Revatio
Como recibirá este medicamento bajo estrecha supervisión médica, es poco probable que no reciba una dosis. No obstante, informe a su médico o farmacéutico si cree que han olvidado una dosis. No deben administrarle una dosis doble para compensar las dosis olvidadas.
Si se interrumpe el tratamiento con Revatio
La interrupción repentina del tratamiento con Revatio puede llevar al empeoramiento de sus síntomas. Su médico puede reducir la dosis durante unos días antes de interrumpirlo completamente.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Revatio puede producir efectos adversos, aunque no todas las personas los sufran.
Si sufre alguno de los siguientes efectos adversos, deje de tomar Revatio e informe a su médico inmediatamente (ver también sección 2):
- si sufre una reducción o pérdida repentina de la visión (frecuencia no conocida).
- si tiene una erección, que dura continuada durante más de 4 horas. Se han comunicado erecciones prolongadas y a veces dolorosas después de tomar sildenafilo en hombres (frecuencia no conocida).
Adultos
Los efectos adversos observados en un ensayo clínico con Revatio intravenoso fueron similares a los observados en los ensayos clínicos con Revatio comprimidos. En ensayos clínicos, los efectos adversos comunicados frecuentemente (pueden afectar hasta 1 de cada 10 pacientes) fueron rubefacción facial, dolor de cabeza, baja tensión arterial y náuseas.
En ensayos clínicos, los efectos adversos comunicados frecuentemente (pueden afectar hasta 1 de cada 10 pacientes) por los pacientes con hipertensión arterial pulmonar fueron rubefacción facial y náuseas.
En ensayos clínicos con Revatio comprimidos, los efectos adversos comunicados muy frecuentemente (pueden afectar a más de 1 de cada 10 pacientes) fueron, dolor de cabeza o enrojecimiento facial, indigestión, diarrea y dolor en brazos y piernas.
Los efectos adversos comunicados frecuentemente (pueden afectar hasta 1de cada 10 pacientes) son: infección bajo la piel, síntomas de tipo gripal, inflamación de los senos nasales, reducción del número de glóbulos rojos (anemia), retención de líquidos, dificultad para dormir, ansiedad, migraña, temblor, sensación de cosquilleo, sensación de ardor, disminución del sentido del tacto, sangrado de la parte posterior del ojo, alteraciones en la visión, visión borrosa y sensibilidad a la luz, efectos sobre la percepción de los colores, irritación ocular, ojos enrojecidos/ojos rojos, vértigo, bronquitis, hemorragia nasal, rinorrea, tos, nariz taponada, inflamación de estómago, gastroenteritis, ardor, almorranas, distensión abdominal, sequedad de boca, caída del cabello, enrojecimiento de la piel, sudores nocturnos, dolor muscular, dolor de espalda y aumento de la temperatura corporal.
Los efectos adversos comunicados poco frecuentemente (pueden afectar hasta 1 de cada 100 pacientes) incluyeron: reducción de la agudeza visual, visión doble, sensación anormal en el ojo, sangrado del pene, presencia de sangre en el semen y/o en la orina y aumento de las mamas en hombres.
También se han comunicado erupciones cutáneas, disminución o pérdida repentina de la audición y reducción de la tensión sanguínea con una frecuencia no conocida (la frecuencia no puede estimarse con los datos disponibles).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Revatio
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del vial y en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Revatio no requiere condiciones de conservación especiales.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Revatio
El principio activo es sildenafilo. Cada ml de solución contiene 0,8 mg de sildenafilo (como citrato). Cada vial de 20 ml contiene 10 mg de sildenafilo (como citrato).
Los demás componentes son: glucosa y agua para preparaciones inyectables.
Aspecto de Revatio y contenido del envase
Cada envase de Revatio solución inyectable contiene un vial de 20 ml de vidrio claro, que está cerrado con un tapón de goma clorobutilo y con un sello de aluminio.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Pfizer Limited, Sandwich, Kent, CT13 9NJ, Reino Unido.
Responsable de la fabricación:
Fareva Amboise, Zone Industrielle, 29 route des Industries, 37530 Pocé-sur-Cisse, Francia.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie /Belgique / Belgien
Pfizer S.A./N.V.
Tél/Tel: +32 (0)2 554 62 11
Etarapna
n^aroep HmKceMÓypr CAPH, KaoH Etarapna Tea.: +359 2 970 4333
Ceská republika
Pfizer s r.o.
Tel: +420-283-004-111
Danmark
Pfizer ApS
Tlf: +45 44 20 11 00
Deutschland
Pfizer Pharma PFE GmbH Tel: +49 (0)800 8535555
Eesti
Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500
EXXáSa
Pfizer EA^ág A.E.
Tp^: +30 210 678 5800
Lietuva
Pfizer Luxembourg SARL filialas Lietuvoje Tel. +3705 2514000
Luxembourg/Luxemburg
Pfizer S.A.
Tél/Tel: +32 (0)2 554 62 11
Magyarország
Pfizer Kft.
Tel.: + 36 1 488 37 00
Malta
V.J. Salomone Pharma Ltd.
Tel : + 356 21 22 01 74
Nederland
Pfizer bv
Tel: +31 (0)10 406 43 01
Norge
Pfizer AS
Tlf: +47 67 52 61 00 Osterreich
Pfizer Corporation Austria Ges.m.b.H.
Tel: +43 (0)1 521 15-0
|
España Pfizer GEP, S.L. Tel: +34 91 490 99 00 |
Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
|
France Pfizer PFE France Tél: +33 (0)1 58 07 34 40 |
Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: +385 1 3908 777 |
Romania Pfizer Romania S.R.L. Tel: +40 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podruznica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0) 1 52 11 400 |
|
Ísland Icepharma hf. Sími: + 354 540 8000 |
Slovenská republika Pfizer Luxembourg SARL, organizacná zlozka Tel: +421-2-3355 5500 |
|
Italia Pfizer Italia S.r.l. Tel: +39 06 33 18 21 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 43 00 40 |
|
Kúnpoq PFIZER EAAAI A.E. (CYPRUS BRANCH) Tn^: +357 22 817690 |
Sverige Pfizer AB Tel: + 46 (0)8 550 520 00 |
|
Latvija Pfizer Luxembourg SARL filiale Latvija Tel: +371 670 35 775 |
United Kingdom Pfizer Limited Tel: +44 (0)1304 616161 |
|
Fecha de la última revisión de este prospecto: |
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
Prospecto: Información para el paciente
Revatio 10 mg/ml polvo para suspensión oral
Sildenafilo
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Revatio y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Revatio
3. Cómo tomar Revatio
4. Posibles efectos adversos
5. Conservación de Revatio
6. Contenido del envase e información adicional
1. Qué es Revatio y para qué se utiliza
Revatio contiene el principio activo sildenafilo que pertenece a un grupo de medicamentos denominados inhibidores de la fosfodiesterasa tipo 5 (PDE5).
Revatio reduce la tensión sanguínea en los pulmones dilatando los vasos sanguíneos de los pulmones. Revatio se utiliza para tratar la tensión sanguínea elevada en los vasos sanguíneos del pulmón (hipertensión arterial pulmonar) en adultos y niños y adolescentes entre 1 a 17 años.
2. Qué necesita saber antes de tomar Revatio
No tome Revatio:
- si es alérgico a sildenafilo o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si está tomando medicamentos que contienen nitratos o dadores de óxido nítrico tales como nitrito de amilo (“poppers”). Estos medicamentos, a menudo, se administran para aliviar el dolor de pecho (o angina de pecho). Revatio puede producir un aumento importante de los efectos de estos medicamentos. Debe informar a su médico si está tomando alguno de estos medicamentos. Si no está seguro, consulte con su médico o farmacéutico.
- si está tomando riociguat. Este medicamento se utiliza para tratar la hipertensión arterial pulmonar (es decir, tensión alta en los pulmones) y la hipertensión pulmonar tromboembólica crónica (es decir, tensión alta en los pulmones provocada por coágulos). Los inhibidores de la PDE5, como Revatio, han mostrado que producen un incremento del efecto hipotensivo de este medicamento. Si está tomando riociguat o no está seguro consulte a su médico.
- si recientemente ha tenido un ictus, un infarto de miocardio o si tiene una enfermedad hepática grave o la tensión sanguínea muy baja (<90/50 mmHg).
- si está tomando un medicamento para tratar las infecciones por hongos como ketoconazol o itraconazol o medicamentos que contengan ritonavir (para el SIDA).
- si ha experimentado anteriormente una pérdida de la visión debido a un problema con el flujo sanguíneo en un nervio del ojo llamado neuropatía óptica isquémica anterior no arterítica (NOIA-NA).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Revatio si:
- tiene una enfermedad debida a un bloqueo o estrechamiento de una vena en los pulmones en lugar de al bloqueo o estrechamiento de una arteria.
- tiene un problema grave de corazón.
- tiene un problema con las cámaras de bombeo del corazón.
- tiene una tensión sanguínea elevada en los vasos sanguíneos de los pulmones.
- tiene baja tensión sanguínea en descanso.
- pierde una gran cantidad de fluidos corporales (deshidratación) que se puede producir cuando suda mucho o no bebe suficientes líquidos. Esto puede suceder si está enfermo con fiebre, vómitos o diarrea.
- padece una rara enfermedad ocular hereditaria (retinitis pigmentaria).
- padece una anormalidad de los glóbulos rojos (anemia falciforme), cáncer de las células sanguíneas (leucemia), cáncer de médula ósea (mieloma múltiple) o cualquier enfermedad o deformidad del pene.
- padece actualmente úlcera de estómago o alteraciones hemorrágicas (tales como hemofilia) o sangrado de nariz.
- usa medicamentos para la disfunción eréctil.
Cuando los inhibidores de la PDE5, incluyendo sildenafilo, se utilizan para tratar la disfunción eréctil (DE) se han comunicado los siguientes efectos adversos visuales con una frecuencia no conocida: disminución o pérdida parcial, repentina, temporal o permanente de la visión de uno o ambos ojos. Si experimenta una reducción o pérdida repentina de la visión, deje de tomar Revatio y avise a su médico inmediatamente (ver también sección 4).
Se han observado erecciones prolongadas, y a veces dolorosas, en hombres que tomaban sildenafilo. Si tiene una erección que se prolongue durante más de 4 horas, deje de tomar Revatio y consulte inmediatamente con su médico (ver también sección 4).
Precauciones especiales en pacientes con problemas de riñón o hígado
Debe informar a su médico si tiene problemas de riñón o hígado, ya que puede ser necesario un ajuste de dosis.
Niños
Revatio no debe administrarse a niños menores de 1 año.
Toma de Revatio con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
• Medicamentos que contienen nitratos o dadores de óxido nítrico tales como nitrito de amilo (“poppers”). Estos medicamentos, a menudo, se administran para aliviar el dolor de pecho o angina de pecho (ver sección 2. Antes de tomar Revatio).
• Informe a su médico o farmacéutico si está tomando riociguat.
• Tratamientos para la hipertensión pulmonar (por ejemplo, bosentan, iloprost).
• Medicamentos que contienen hierba de San Juan (planta medicinal), rifampicina (utilizada para tratar las infecciones bacterianas), carbamazepina, fenitoína y fenobarbital (utilizados, entre otros, para tratar la epilepsia).
• Medicamentos que inhiben la coagulación sanguínea (por ejemplo, warfarina) aunque no han provocado ningún efecto adverso.
• Medicamentos que contienen eritromicina, daritromicina, telitromidna (antibióticos utilizados para tratar ciertas infecciones bacterianas), saquinavir (para el SIDA) o nefazodona (para la depresión), ya que puede ser necesario un ajuste de dosis.
• Terapia con alfa-bloqueantes (por ejemplo, doxazosina) para el tratamiento de problemas de hipertensión o de próstata, ya que la combinación de los dos medicamentos puede causar síntomas de reducción en la tensión sanguínea (por ejemplo, mareo, desvanecimiento).
Toma de Revatio con alimentos y bebidas
No debe tomar zumo de pomelo cuando esté siendo tratado con Revatio.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. Revatio no debe utilizarse durante el embarazo a menos que sea absolutamente necesario.
Revatio no debe administrarse a mujeres en edad fértil a menos que se utilicen métodos anticonceptivos adecuados.
Interrumpa la lactancia cuando inicie el tratamiento con Revatio. Revatio no debe administrarse a mujeres lactantes dado que no se conoce si este medicamento pasa a la leche materna.
Conducción y uso de máquinas
Revatio puede producir mareos y afectar a la visión. Debe saber cómo reacciona usted a este medicamento antes de conducir vehículos o utilizar maquinaria.
Revatio contiene sorbitol
Antes de tomar este medicamento consulte con su médico, si éste le ha indicado que tiene intolerancia a algunos azúcares.
3. Cómo tomar Revatio
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Para adultos, la dosis recomendada es 20 mg tres veces al día (tomada a intervalos de 6 a 8 horas) tomada con o sin alimentos.
Uso en niños y adolescentes
Para niños y adolescentes de 1 a 17 años, la dosis recomendada es de 10 mg (1 ml de suspensión oral) tres veces al día para niños y adolescentes que pesen 20 kg o menos, o de 20 mg (2 ml de suspensión oral) tres veces al día en niños y adolescentes que pesen más de 20 kg, administrados con o sin alimentos. En niños, no se deben utilizar dosis más altas de las recomendadas.
La suspensión oral debe agitarse bien durante un mínimo de 10 segundos antes de utilizar.
Instrucciones para reconstituir la suspensión oral
Se recomienda que su farmacéutico reconstituya (prepare) la suspensión oral antes de que se la administren.
Cuando se reconstituye la suspensión oral es un líquido. Si no se ha reconstituido el polvo, debe reconstituir la suspensión oral siguiendo las siguientes instrucciones.
Nota: Independientemente de la dosis que tome, debe utilizar un volumen total de 90 ml (3 x 30 ml) de agua para reconstituir el contenido del frasco.
1. Golpear suavemente el frasco para soltar el polvo.
2. Quitar el tapón.
3. Medir 30 ml de agua llenando el vasito de medida (incluido en el estuche) hasta la marca y añadir al frasco. Medir otros 30 ml de agua utilizando el vasito de medida y añadir al frasco. (figura 1)

figura 1
4.
Volver a tapar y agitar con fuerza durante un mínimo de 30 segundos. (figura 2)
5.

figura 2
Quitar el tapón.
6. Utilizando el vasito medir otros 30 ml de agua y añadir al frasco. Siempre debe añadir un total de 90 ml (3 x 30 ml) de agua, independientemente de la dosis que tome. (figura 3)

figura 3
7. Volver a tapar y agitar el frasco con fuerza durante un mínimo de 30 segundos. (figura 4)

figura 4
8. Quitar el tapón.
9. Meter a presión el adaptador en el cuello del frasco (como se indica en la figura 5 a continuación). Se proporciona un adaptador de modo que pueda llenar la jeringa dosificadora oral con el medicamento del frasco. Vuelva a poner el tapón.

figura 5
10. Escriba la fecha de caducidad de la suspensión oral reconstituida en la etiqueta del frasco (la fecha de caducidad de la suspensión oral reconstituida es de 30 días desde la fecha de reconstitución). Después de esta fecha, la suspensión oral no utilizada se debe eliminar o ser devuelta a su farmacéutico
Instrucciones de uso
Su farmacéutico le indicará como medir el medicamento utilizando la jeringa dosificadora oral que se incluye en el estuche. Una vez reconstituida la suspensión oral solo se debe administrar utilizando la jeringa dosificadora oral incluida en cada estuche. Vea las siguientes instrucciones antes de utilizar la suspensión oral.
1. Agite fuertemente el frasco de suspensión oral reconstituida cerrado, durante un mínimo de 10 segundos antes de utilizarlo. Quite el tapón, (figura 6)

2. Con el frasco recto, sobre una superficie plana, inserte la punta de la jeringa dosificadora en el adaptador. (figura 7)

3. Invierta el frasco sujetando la jeringa dosificadora en su sitio. Tire lentamente del émbolo de la jeringa dosificadora hasta la marca que indica su dosis (tomando 1 ml se consigue una dosis de 10 mg, tomando 2 ml se consigue una dosis de 20 mg). Para medir exactamente la dosis, el borde superior del émbolo debe estar alineado con la marca adecuada en la jeringa dosificadora oral, (figura 8)

figura 8
4. Si ve grandes burbujas, empuje suavemente el émbolo dentro de la jeringa. Esto introducirá de nuevo el medicamento en el frasco. Repita este paso 3 veces.
5. Vuelva poner el frasco hacia arriba con la jeringa dosificadora oral aún en su sitio. Retire la jeringa dosificadora oral del frasco.
6. Introduzca la punta de la jeringa dosificadora oral en la boca. Apunte con la punta de la jeringa dosificadora oral hacia dentro de la mejilla. Empuje LENTAMENTE el émbolo de la jeringa dosificadora oral. No haga salir rápidamente el medicamento. Si el medicamento se administra a un niño, asegúrese de que está sentado o incorporado antes de administrar el medicamento. (figura 9)

figura 9
7. Vuelva a poner la tapa del frasco, dejando el adaptador del frasco en su sitio. Lave la jeringa dosificadora oral como se indica a continuación.
Limpieza y conservación de la jeringa:
1. Después de cada administración lave la jeringa. Saque el émbolo de la jeringa y lave ambas partes con agua.
2. Seque las dos partes. Empuje el émbolo dentro de la jeringa. Mantenga en un lugar limpio y seguro junto con el medicamento.
Si toma más Revatio del que debe
No debe tomar más medicamento del que le indique su médico.
Si ha tomado más medicamento del aconsejado, consulte a su médico inmediatamente.
Tomar más Revatio del que debiera puede aumentar el riesgo de efectos adversos conocidos.
Si olvidó tomar Revatio
Si ha olvidado tomar Revatio, tome la dosis tan pronto como se acuerde y continúe tomando su medicamento a las horas normales. No tome una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Revatio
La interrupción repentina del tratamiento con Revatio puede llevar al empeoramiento de sus síntomas. No deje de tomar Revatio a menos que su médico se lo indique. Su médico le indicará como reducir la dosis durante unos días antes de interrumpirlo completamente.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si sufre alguno de los siguientes efectos adversos, deje de tomar Revatio e informe a su médico inmediatamente (ver también sección 2):
- si sufre una reducción o pérdida repentina de la visión (frecuencia no conocida)
- si tiene una erección, que dura continuada durante más de 4 horas. Se han comunicado erecciones prolongadas y a veces dolorosas después de tomar sildenafilo en hombres (frecuencia no conocida)
Adultos
Los efectos adversos comunicados muy frecuentemente (pueden afectar a más de 1 de cada 10 pacientes) fueron, dolor de cabeza o enrojecimiento facial, indigestión, diarrea y dolor en brazos y piernas.
Los efectos adversos comunicados frecuentemente (pueden afectar hasta 1 de cada 10 pacientes) son: infección bajo la piel, síntomas de tipo gripal, inflamación de los senos nasales, reducción del número de glóbulos rojos (anemia), retención de líquidos, dificultad para dormir, ansiedad, migraña, temblor, sensación de cosquilleo, sensación de ardor, reducción del sentido del tacto, sangrado de la parte posterior del ojo, alteraciones en la visión, visión borrosa y sensibilidad a la luz, efectos sobre la percepción de los colores, irritación ocular, ojos enrojecidos/ojos rojos, vértigo, bronquitis, hemorragia nasal, rinorrea, tos, nariz taponada, inflamación de estómago, gastroenteritis, ardor, hemorroides, distensión abdominal, sequedad de boca, caída del cabello, enrojecimiento de la piel, sudores nocturnos, dolor muscular, dolor de espalda y aumento de la temperatura corporal.
Los efectos adversos comunicados poco frecuentemente (pueden afectar hasta 1 de cada 100 pacientes) incluyeron: reducción de la agudeza visual, visión doble, sensación anormal en el ojo, sangrado del pene, presencia de sangre en el semen y/o en la orina y aumento de las mamas en hombres.
También se han comunicado erupciones cutáneas, disminución o pérdida repentina de la audición y reducción de la tensión sanguínea con una frecuencia no conocida (la frecuencia no puede estimarse con los datos disponibles).
Niños y adolescentes
Se han comunicado de forma frecuente (pueden afectar hasta 1 de cada 10 pacientes) los siguientes efectos adversos graves: neumonía, insuficiencia cardiaca derecha, shock cardiaco, presión sanguínea elevada en los pulmones, dolor en el pecho, mareo, infecciones respiratorias, bonquitis, infección vírica en el estómago e intestino, infecciones del tracto urinario y perforaciones en los dientes.
Los siguientes efectos adversos graves se consideraron relacionados con el tratamiento y comunicaron de forma poco frecuente (pueden afectar hasta 1 de cada 100 pacientes): reacción alérgica (como erupción cutánea, inflamación de cara, labios y lengua, estornudos, dificultad para respirar o tragar), convulsiones, latidos irregulares, alteraciones de la audición, falta de aliento, inflamación del tracto digestivo y estornudos por alteraciones en el flujo aéreo.
Los efectos adversos comunicados de forma muy frecuente (pueden afectar a más de 1 de cada 10 pacientes) fueron dolor de cabeza, vómitos, infección de la garganta, fiebre, diarrea, gripe y sangrado de nariz.
Los efectos adversos comunicados de forma frecuente (pueden afectar hasta 1 de cada 10 pacientes) fueron náuseas, aumento de las erecciones, neumonía y moqueo.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Revatio
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el frasco después de CAD. La fecha de caducidad es el último día del mes que se indica.
Polvo
No conservar a temperatura superior a 30°C.
Conservar en el envase original para protegerlo de la humedad.
Suspensión oral reconstituida
Conservar por debajo de 30°C o en nevera entre 2°C y 8°C. No congelar. A los 30 días de la reconstitución eliminar cualquier resto de la suspensión oral.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Revatio
- El principio activo es sildenafilo (como citrato de sildenafilo).
Tras la reconstitución, cada ml de suspensión oral contiene 10 mg de sildenafilo (como citrato). Un frasco de suspensión oral reconstituida (112 ml) contiene 1,12 g de sildenafilo (como citrato).
- Los demás componentes son: Polvo para suspensión oral: sorbitol, ácido cítrico anhidro, sucralosa, citrato de sodio, goma xantana, dióxido de titanio (E171), benzoato de sodio (E211) y sílice coloidal anhidra; Aroma de uva: maltodextrina, concentrado de zumo de uva, goma de acacia, concentrado de zumo de piña, ácido cítrico anhidro, aromas naturales.
Aspecto de Revatio y contenido del envase
Revatio se presenta como un polvo para suspensión oral de color blanco a blanquecino que cuando se reconstituye con agua da una suspensión oral blanca, con aroma a uva.
Un frasco de vidrio ámbar de 125 ml (con tapón a rosca de polipropileno) contiene 32,27 g de polvo para suspensión oral.
Una vez reconstituido el frasco contiene 112 ml de suspensión oral, de los que 90 ml se utilizarán para administrar las dosis.
Formato: 1 frasco.
Cada envase también contiene un vasito de medida de polipropileno (graduado para marcar 30 ml), una jeringa dosificadora oral de polipropileno (3 ml) con un émbolo de HDPE y un adaptador a presión para el frasco de LDPE.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Pfizer Limited, Sandwich, Kent, CT13 9NJ, Reino Unido.
Fabricante:
Fareva Amboise, Zone Industrielle, 29 route des Industries, 37530 Pocé-sur-Cisse, Francia.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie /Belgique / Belgien
Pfizer S.A./N.V.
Tél/Tel: +32 (0)2 554 62 11
Etarapna
n$au3ep HroKceMÓypr CAPH, KaoH Etarapua Tea.: +359 2 970 4333
Ceská republika
Pfizer s r.o.
Tel: +420-283-004-111
Danmark
Pfizer ApS
Tlf: +45 44 20 11 00
Deutschland
Pfizer Pharma PFE GmbH Tel: +49 (0)800 8535555
Eesti
Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500
EXXáSa
Pfizer E^^ág A.E.
TpT,: +30 210 678 5800
Lietuva
Pfizer Luxembourg SARL filialas Lietuvoje Tel. +3705 2514000
Luxembourg/Luxemburg
Pfizer S.A.
Tél/Tel: +32 (0)2 554 62 11
Magyarország
Pfizer Kft.
Tel.: + 36 1 488 37 00
Malta
V.J. Salomone Pharma Ltd.
Tel : + 356 21 22 01 74
Nederland
Pfizer bv
Tel: +31 (0)10 406 43 01
Norge
Pfizer AS
Tlf: +47 67 52 61 00 Osterreich
Pfizer Corporation Austria Ges.m.b.H.
Tel: +43 (0)1 521 15-0
|
España Pfizer GEP, S.L. Tel: +34 91 490 99 00 |
Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
|
France Pfizer PFE France Tél: +33 (0)1 58 07 34 40 |
Portugal Laboratórios Pfizer, Lda. Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: +385 1 3908 777 |
Romania Pfizer Romania S.R.L. Tel: +40 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podruznica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0) 1 52 11 400 |
|
Ísland Icepharma hf. Sími: + 354 540 8000 |
Slovenská republika Pfizer Luxembourg SARL, organizacná zlozka Tel: +421-2-3355 5500 |
|
Italia Pfizer Italia S.r.l. Tel: +39 06 33 18 21 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 43 00 40 |
|
Kúnpoq PFIZER EAAAI A.E. (CYPRUS BRANCH) Tn^: +357 22 817690 |
Sverige Pfizer AB Tel: + 46 (0)8 550 520 00 |
|
Latvija Pfizer Luxembourg SARL filiale Latvija Tel: +371 670 35 775 |
United Kingdom Pfizer Limited Tel: +44 (0)1304 616161 |
|
Fecha de la última revisión de este prospecto: |
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
102