Removab 10 Microgramos Concentrado Para Solucion Para Perfusion
Información obsoleta, busque otroANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Removab 10 microgramos concentrado para solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Una jeringa precargada contiene 10 microgramos de catumaxomab* en 0,1 ml de solución, que corresponde a 0,1 mg/ml.
*anticuerpo monoclonal IgG2 híbrido rata-ratón producido en una línea celular de hibridoma híbrido de rata-ratón
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado para solución para perfusión. Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Removab está indicado para el tratamiento intraperitoneal de la ascitis maligna en adultos con carcinomas EpCAM positivos para los que no hay un tratamiento rutinario o ya no es viable.
4.2 Posología y forma de administración
Removab se debe administrar bajo la supervisión de un médico con experiencia en el uso de medicamentos antineoplásicos.
Posología
Antes de administrar la perfusión intraperitoneal, se recomienda una premedicación con productos analgésicos, antipiréticos o antiinflamatorios no esteroideos (ver sección 4.4).
La pauta de administración de Removab comprende las siguientes cuatro perfusiones intraperitoneales:
1a dosis 10 microgramos en el día 0
2a dosis 20 microgramos en el día 3
3a dosis 50 microgramos en el día 7
4a dosis 150 microgramos en el día 10
Removab se tiene que administrar como perfusión intraperitoneal a velocidad constante con un tiempo de perfusión de al menos 3 horas. En los ensayos clínicos se investigaron tiempos de perfusión de 3 horas y de 6 horas. Para la primera de las cuatro dosis puede considerarse un tiempo de perfusión de 6 horas, dependiendo del estado de salud del paciente.
Debe dejarse un intervalo de al menos dos días naturales sin perfusión entre los días con perfusión. El intervalo entre los días de perfusión puede prolongarse en caso de reacciones adversas relevantes. El periodo global de tratamiento no debe superar los 20 días.
Vigilancia
Se recomienda una adecuada vigilancia del paciente tras la finalización de la perfusión de Removab. En el estudio pivotal se realizó seguimiento a los pacientes durante 24 h después de cada perfusión.
Poblaciones especiales
Deterioro hepático
Los pacientes con deterioro hepático de un grado de gravedad mayor que moderado y/o más del 70% del hígado metastatizado y/o trombosis/obstrucción de la vena porta no se han estudiado. El tratamiento de estos pacientes con Removab sólo debe plantearse después de una minuciosa evaluación de la relación beneficio-riesgo (ver sección 4.4)
Deterioro renal
Los pacientes con deterioro renal de un grado de gravedad mayor que leve no han sido estudiados. El tratamiento de estos pacientes con Removab sólo debe plantearse después de una minuciosa evaluación de la relación beneficio-riesgo (ver sección 4.4).
Población pediátrica
No existe una recomendación de uso específica para Removab en la población pediátrica para la indicación autorizada.
Forma de administración
Removab se debe administrar únicamente como perfusión intraperitoneal.
Removab no debe administrarse en forma de bolo intraperitoneal o por cualquier otra vía de administración.
Para obtener información sobre el sistema de perfusión que se debe utilizar, ver la sección 4.4.
Precauciones que deben tomarse antes de administrar este medicamento
Antes de la administración de Removab concentrado para solución para perfusión se diluye en una solución inyectable de cloruro sódico a 9 mg/ml (0,9%). La solución para perfusión diluida de Removab se administra a continuación intraperitonealmente como una perfusión a velocidad constante utilizando un sistema de bomba adecuado.
Para consultar las instrucciones de dilución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Hipersensibilidad a proteínas murinas (rata y/o ratón).
4.4 Advertencias y precauciones especiales de empleo
Removab no debe administrarse en forma de bolo o por cualquier otra vía de administración que no sea la intraperitoneal.
Síntomas relacionados con la liberación de citocinas
Dado que la liberación de citocinas proinflamatorias y citotóxicas se inicia con la unión de catumaxomab a las células inmunitarias y tumorales, se han notificado muy frecuentemente síntomas clínicos relacionados con la liberación de citocinas como fiebre, náuseas, vómitos y escalofríos durante y después de la administración de Removab (ver sección 4.8). Frecuentemente se observan disnea e hipo o hipertensión. En los estudios clínicos de pacientes con ascitis maligna se administró sistemáticamente 1.000 mg de paracetamol vía intravenosa antes de la perfusión de Removab para controlar el dolor y la pirexia. A pesar de la premedicación, los pacientes tuvieron las reacciones adversas descritas anteriormente con una intensidad hasta de grado 3, según los Criterios de Terminología Comunes de Acontecimientos Adversos (CTCAE) del National Cancer Institute de
EE.UU, versión 3.0. Se recomienda una pre-medicación estándar diferente o adicional con medicamentos analgésicos, antipiréticos, antiinflamatorios no esteroideos.
El síndrome de reacción inflamatoria sistémica (SRIS) que también puede ocurrir frecuentemente debido al mecanismo de acción de catumaxomab se desarrolla, en general, en las 24 horas siguientes a la perfusión de Removab, con síntomas de fiebre, taquicardia, taquipnea y leucocitosis (ver sección 4.8). Para limitar el riesgo procede usar el tratamiento o la premedicación habituales, por ejemplo analgésicos, antipiréticos, antiinflamatorios no esteroideos.
Dolor abdominal
Se notificó dolor abdominal frecuentemente como reacción adversa. Este efecto transitorio se considera en parte una consecuencia de la vía de administración intraperitoneal.
Estado general e IMC
Antes del tratamiento con Removab se requiere una situación funcional adecuada expresada como un índice de masa corporal (IMC) >17 (que será valorado tras el drenaje del líquido ascítico) y un índice de Karnofsky >60.
Infecciones agudas
La administración de Removab no se recomienda en presencia de factores que interfieran con el sistema inmunitario, en particular las infecciones agudas.
Drenaje de la ascitis
El tratamiento médico apropiado del drenaje de la ascitis es un requisito previo para el tratamiento con Removab, para garantizar unas funciones circulatoria y renal estables. Dicho tratamiento debe incluir, como mínimo, el drenaje de la ascitis hasta la detención del flujo espontáneo o el alivio de los síntomas y, si procede, el tratamiento de soporte apropiado con cristaloides y/o coloides.
Pacientes con insuficiencia hemodinámica, edema o hipoproteinemia
Antes de cada perfusión de Removab se deben evaluar el volumen sanguíneo, las proteínas en sangre, la presión arterial, el pulso y la función renal. Antes de cada perfusión de Removab se tienen que solucionar otras afecciones como hipovolemia, hipoproteinemia, hipotensión, descompensación circulatoria y deficiencia renal aguda.
Deficiencia hepática o renal o trombosis u obstrucción de la vena porta
No se han estudiado pacientes con una deficiencia hepática de un grado de gravedad mayor que moderado y/o con más del 70% del hígado con metástasis, o trombosis u obstrucción de la vena porta. El tratamiento de esos pacientes con Removab sólo debe plantearse después de una minuciosa evaluación de la relación beneficio-riesgo.
Deficiencia renal
Los pacientes con una deficiencia renal de un grado de gravedad mayor que leve no han sido estudiados. El tratamiento de esos pacientes con Removab sólo debe plantearse después de una minuciosa evaluación de la relación beneficio-riesgo.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de catumaxomab en mujeres embarazadas.
Los estudios realizados en animales son insuficientes en términos de toxicidad para la reproducción (ver sección 5.3).
No se recomienda utilizar Removab durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Lactancia
Se desconoce si catumaxomab/metabolitos se excreta en la leche materna. No se puede excluir el riesgo en recién nacidos/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras consideran el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
No se dispone de datos acerca del efecto del catumaxomab sobre la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Removab sobre la capacidad para conducir y utilizar máquinas es de pequeña a moderada.
Se aconsejará a los pacientes que tengan síntomas relacionados con la perfusión que no conduzcan ni utilicen máquinas hasta que desaparezcan los síntomas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas que aparecen a continuación derivan de un análisis de seguridad integrado que abarcaba 12 estudios clínicos. 728 pacientes recibieron catumaxomab por vía intraperitoneal,
293 pacientes en perfusión de 6 horas y 435 pacientes en perfusión de 3 horas.
El perfil de seguridad global de Removab se caracteriza por síntomas relacionados con la liberación de citocinas y por reacciones gastrointestinales.
Reacciones relacionadas con la liberación de citoquinas: SIRS, una combinación potencialmente mortal de taquicardia, fiebre y/o disnea, puede desarrollarse en las 24 horas siguientes a una perfusión de catumaxomab y se resuelve con tratamiento sintomático. Otras reacciones relacionadas con la liberación de citocinas, como fiebre, escalofríos, náuseas y vómitos, son reacciones notificadas muy frecuentemente con una intensidad de grado 1 y 2, según los Criterios de Terminología Comunes de Acontecimientos Adversos (CTCAE) (National Cancer Institute de EE.UU., versión 4.0). Estos síntomas reflejan el mecanismo de acción del catumaxomab y en general son totalmente reversibles. Las reacciones gastrointestinales como dolor abdominal, náuseas, vómitos y diarrea son muy frecuentes y ocurren principalmente con una intensidad de grado 1 o 2 según los CTCAE, pero también se observaron con mayores grados de intensidad, y responden al tratamiento sintomático adecuado.
El perfil de seguridad de catumaxomab utilizando un tiempo de perfusión de 3 h en comparación con un tiempo de perfusión de 6 h en general es comparable en cuanto a naturaleza, frecuencia e intensidad. Se observó una mayor frecuencia de algunas reacciones adversas en la administración de 3 h, como escalofríos e hipotensión (grados 1/2), diarrea (todos los grados) y fatiga (grado 1/2).
Tabla de reacciones adversas
En la Tabla 1 se presentan las reacciones adversas por clase orgánica. Los grupos de frecuencia se definen de la forma siguiente: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100).
Tabla 1 Reacciones adversas notificadas de pacientes en tratamiento con catumaxomab
|
Infecciones e infestaciones | ||
|
Frecuentes |
Infección. | |
|
Poco ^ frecuentes |
Eritema indurado*, infección relacionada con el dispositivo*. | |
|
Trastornos de la |
sangre y del sistema linfático | |
|
Frecuentes |
Anemia*, linfopenia, leucocitosis, neutrofilia. |
|
Poco frecuentes |
Tombocitopenia*, coagulopatía*. |
|
Trastornos del sistema inmunológico | |
|
Frecuentes |
Síndrome de liberación de citocinas*, hipersensibilidad*. |
|
Trastornos del metabolismo y de la nutrición | |
|
Frecuentes |
Disminución del apetito*/anorexia, deshidratación*, hipopotasemia, hipoalbuminemia, hiponatremia*, hipocalcemia*, hipoproteinemia. |
|
Trastornos psiquiátricos | |
|
Frecuentes |
Ansiedad, insomnio. |
|
Trastornos del sistema nervioso | |
|
Frecuentes |
Cefalea, mareos. |
|
Poco f frecuentes |
Convulsiones*. |
|
Trastornos del oído |
y del laberinto |
|
Frecuentes |
Vértigo. |
|
Trastornos cardiacos | |
|
Frecuentes |
Taquicardia*, incluida taquicardia sinusal. |
|
Trastornos vasculares | |
|
Frecuentes |
Hipotensión*, hipertensión*, enrojecimiento cutáneo. |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes |
Disnea*, derrame pleural*, tos. |
|
Poco f frecuentes |
Embolia de pulmón*, hipoxia*. |
|
Trastornos gastrointestinales | |
|
Muy frecuentes |
Dolor abdominal*, náuseas*, vómitos*, diarrea*. |
|
Frecuentes |
Estreñimiento*, dispepsia, distensión abdominal, subíleo*,flatulencia, trastornos gástricos, íleo*, enfermedad por reflujo gastroesofágico, boca |
|
seca. | |
|
Poco f frecuentes |
Hemorragia gastrointestinal*, obstrucción intestinal*. |
|
Trastornos hepatobiliares | |
|
Frecuentes |
Colangitis*, hiperbilirrubinemia. |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes |
Exantema*, eritema*, hiperhidrosis, prurito. |
|
Poco f frecuentes |
Reacción cutánea*, dermatitis alérgica*. |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Frecuentes |
Lumbalgia, mialgia, artralgia. |
|
Trastornos renales |
y urinarios |
|
Frecuentes |
Proteinuria. |
|
Poco frecuentes |
Insuficiencia renal aguda*. |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes |
Pirexia*, cansancio*, escalofríos*. |
|
Frecuentes |
Dolor, astenia*, síndrome de respuesta inflamatoria sistémica*, edema |
|
incluido edema periférico*, deterioro general del estado físico*, dolor torácico, síndrome gripal, malestar*, eritema en el sitio del catéter. | |
|
Poco f frecuentes |
Extravasación*, inflamación en el lugar de aplicación*. |
*También notificados como reacciones adversas graves.
Subrayado: ver la sección ‘Descripción de reacciones adversas seleccionadas’
Descripción de reacciones adversas seleccionadas
Son válidas las definiciones siguientes de criterios de CTCAE del National Cancer Institute de EE.UU. (versión 4.0):
CTCAE grado 1 = leve, CTCAE grado 2 = moderado, CTCAE grado 3 = grave, CTCAE grado 4 = potencialmente mortal
Síntomas relacionados con la liberación de citocinas de mayor intensidad
En el 5,1% de los pacientes, la pirexia alcanzó una intensidad de grado 3 según los CTCAE, al igual que el síndrome de liberación de citocinas (1,0%), los escalofríos (0,8%), las náuseas (3,4%), los vómitos (4,4%), la disnea (1,6%) y la hipo-/hipertensión (2,1%/0,8%). En un paciente (0,1%) la disnea y en 3 pacientes (0,4%) la hipotensión se notificaron con una intensidad de grado 4 según los CTCAE. Los síntomas de dolor y pirexia pueden mejorar o evitarse con premedicación (ver las secciones 4.2 y 4.4).
Síndrome de respuesta inflamatoria sistémica (SRIS)
En el 3,8% de los pacientes se observaron síntomas de SRIS en las siguientes 24 horas tras la perfusión de catumaxomab. En tres pacientes (0,4%) se observó una intensidad de grado 4 según los CTCAE. Las reacciones se resolvieron con tratamiento sintomático.
Dolor abdominal
El 43,7% de los pacientes notificó dolor abdominal como reacción adversa alcanzando grado 3 en el 8,2% de los casos, pero se resolvió con tratamiento sintomático.
Enzimas hepáticas
Se ha observado con frecuencia un aumento transitorio en las enzimas hepáticas después de la administración de Removab. En general, los cambios en los parámetros de laboratorio no fueron relevantes desde el punto de vista clínico y en su mayor parte volvieron a los valores basales después de finalizar el tratamiento.
Solamente en casos de aumento persistente o clínicamente relevante deberán considerarse diagnósticos o tratamientos adicionales.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
No se han notificado casos de sobredosis. Los pacientes tratados con una dosis de catumaxomab mayor de la recomendada tuvieron reacciones adversas más intensas (grado 3).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos antineoplásicos, anticuerpos monoclonales; código ATC: L01XC09
Mecanismo de acción
Catumaxomab es un anticuerpo monoclonal híbrido de rata-ratón trifuncional que se dirige específicamente contra la molécula de adhesión de las células epiteliales (EpCAM) y el antígeno CD3.
El antígeno EpCAM se sobreexpresa en la mayoría de los carcinomas (Tabla 2). El CD3 se expresa en las células T maduras como componente del receptor de la célula T. El tercer lugar de unión funcional de la región Fc de catumaxomab permite su interacción con las células inmunitarias accesorias a través de los receptores Fcy.
Debido a las propiedades de unión de catumaxomab, se consigue que las células tumorales, las células T y las células inmunitarias accesorias entren en estrecho contacto. En consecuencia, se induce una reacción inmunitaria concertada frente a las células tumorales con diferentes mecanismos de acción, como la activación de las células T, citotoxicidad celular mediada por anticuerpos (ADCC), citotoxicidad dependiente del complemento (CDC) y fagocitosis. Esto da como resultado la destrucción de células tumorales.
Table 2 La expresión de EpCAM en los tipos de ascitis más importantes que producen cáncer
|
Datos bibliográficos |
Datos retrospectivos del estudio IP-CAT-AC-03 | ||
|
Tipo de cáncer |
Porcentaje de tumores que expresan EpCAM |
Porcentaje de derrames positivos para EpCAM |
Porcentaje de derrames positivos para EpCAM |
|
Ovárico |
90-92 |
79-100 |
98 |
|
Gástrico |
96 |
75-100 |
100 |
|
De colon |
100 |
87-100 |
100 |
|
Pancreático |
98 |
83-100 |
80 |
|
De mama |
45*-81 |
71-100 |
86 |
|
Endometrial |
94 |
100 |
100 |
*= cáncer de mama lobular
Efectos farmacodinámicos
La actividad antitumoral de catumaxomab se ha demostrado in vitro e in vivo. Se observó in vitro la muerte efectiva mediada por catumaxomab de las células tumorales con expresión baja y alta del antígeno EpCAM, con independencia del tipo tumoral primario. La actividad antitumoral in vivo de catumaxomab se confirmó en un modelo de compromiso inmunitario de carcinoma de ovario en ratón, donde el desarrollo tumoral se retrasó mediante el tratamiento intraperitoneal con catumaxomab y células mononucleadas humanas en sangre periférica.
Eficacia clínica
La eficacia de catumaxomab se demostró en dos estudios clínicos de fase III. No se ha incluido a pacientes de origen no caucásico en estos estudios clínicos.
IP-REM-AC-01
Un estudio clínico pivotal de fase II/III, aleatorizado y abierto con dos grupos de tratamiento con 258 pacientes con ascitis maligna sintomática debida a carcinomas EpCAM positivos, de los cuales 170 fueron aleatorizados para recibir tratamiento con catumaxomab. En este estudio se comparó el efecto de paracentesis más catumaxomab frente a paracentesis sola (control).
Catumaxomab se administró a los pacientes cuando no existía un tratamiento establecido o ya no era viable, y en los que la situación funcional de Karnofsky era al menos de 60. Catumaxomab se administró como cuatro perfusiones intraperitoneales con dosis en aumento de 10, 20, 50 y 150 microgramos en el día 0, 3, 7 y 10, respectivamente (ver sección 4.2). En el estudio pivotal IP-REM-AC-01 el 98,1% de los pacientes fueron hospitalizados durante una media de 11 días.
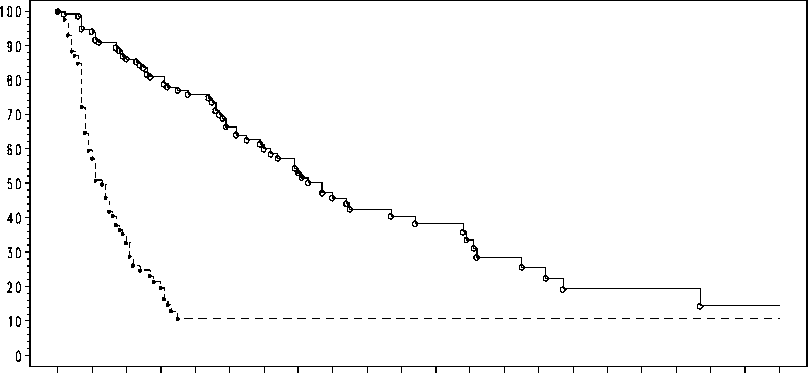
En este estudio, el criterio de valoración principal de la eficacia fue la supervivencia sin paracentesis, que fue un criterio de valoración compuesto definido como el tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis o hasta la muerte, lo que primero sucediera. Los resultados de la supervivencia media sin paracentesis y el tiempo hasta necesitar la primera paracentesis de la ascitis en términos de medianas e índices de riesgo relativo se presentan en la Tabla 3. Las estimaciones de Kaplan Meier para el tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis se proporcionan en la Figura 1.
|
necesitar la primera paracentesis tera |
péutica de la ascitis) del estut |
io IP-REM-AC-01 |
|
Variable |
Paracentesis + catumaxomab (N=170) |
Paracentesis (control) (N=88) |
|
Supervivencia sin paracentesis | ||
|
Mediana de supervivencia sin paracentesis (días) |
44 |
11 |
|
IC del 95% para la mediana(días) |
[31; 49] |
[9; 16] |
|
Valor de p (prueba del logaritmo del rango) |
< 0,0001 | |
|
Riesgo relativo (Hazard ratio, HR) |
0,310 | |
|
IC del 95% para HR |
[0,228; 0,423] | |
|
Tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis | ||
|
Mediana del tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis (días) |
77 |
13 |
|
IC del 95% para la mediana(días) |
[62;104] |
[9; 17] |
|
Valor de p (prueba del logaritmo del rango) |
< 0,0001 | |
|
Riesgo relativo (Hazard ratio, HR) |
0,169 | |
|
IC del 95% para HR |
[0,114; 0,251] | |
Figura 1 Estimaciones de Kaplan Meier para el tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis del estudio IP-REM-AC-01
Probabilidad estimada de estar sin paracentesis %

0 10 20 30
40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210
Tiempo (días) hasta el acontecimiento
Tratamiento:
-e—a—a- Catumaxomab (N=170)
----- Control (N=88)
N: número de pacientes en un grupo de tratamiento.
La eficacia del tratamiento con paracentesis y catumaxomab en pacientes con ascitis maligna debida a carcinomas EpCAM positivos fue significativamente mejor a la obtenida con la paracentesis sola, medida por la supervivencia sin paracentesis y por el tiempo hasta necesitar la primera paracentesis de la ascitis.
Después de completarse el estudio, se realizó un seguimiento adicional a los pacientes hasta el final de su vida para una valoración sobre la supervivencia global (Tabla 4).
Tabla 4 Resultados de eficacia (supervivencia global y tiempo hasta la progresión) del estudio IP-REM-AC-01 en la fase postestudio
|
Paracentesis + catumaxomab (N=170) |
Paracentesis (control) (N=88) | |
|
Riesgo relativo (Hazard ratio, HR) |
0,798 | |
|
IC del 95% para HR |
[0,606; 1,051] | |
|
Tasa de supervivencia a los 6 meses |
27,5% |
17,1% |
|
Tasa de supervivencia después de 1 año |
11,4% |
2,6% |
|
Mediana de la supervivencia global (días) |
72 |
71 |
|
IC del 95% para la mediana (días) |
[61; 98] |
[54; 89] |
|
Valor de p (prueba del orden logarítmico) |
0,1064 | |
En conjunto, 45 de 88 (51%) pacientes del grupo de control cambiaron de grupo para recibir tratamiento activo con catumaxomab.
IP-CAT-AC-03
Este estudio de confirmación de fase IIIb, aleatorizado y abierto con dos grupos de tratamiento en 219 pacientes con ascitis maligna sintomática que requería paracentesis terapéutica de la ascitis, investigó el tratamiento con catumaxomab y medicación previa con 25 mg de prednisolona en comparación con catumaxomab solo. Catumaxomab se administró en ambos grupos en cuatro perfusiones intraperitoneales de 3 horas a velocidad constante en dosis en aumento de 10, 20, 50 y 150 microgramos en el día 0, 3, 7 y 10, respectivamente. La población de pacientes fue comparable a la del estudio pivotal.
Con el fin de evaluar el efecto de la medicación previa de prednisolona sobre la seguridad y eficacia, se estudió “la puntuación compuesta de la seguridad” como criterio de valoración principal de la seguridad y “la supervivencia sin paracentesis” como criterio de valoración coprincipal de la eficacia. La puntuación compuesta de seguridad evaluaba en ambos grupos de tratamiento la frecuencia y gravedad de las principales reacciones adversas conocidas: pirexia, náuseas, vómitos y dolor abdominal. La administración de prednisolona como medicación previa no produjo una reducción de estas reacciones adversas.
El criterio de valoración principal de la eficacia, la supervivencia sin paracentesis, fue un criterio de valoración compuesto definido como el tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis o hasta la muerte, lo que primero sucediera (idéntico al del estudio pivotal).
Tabla 5 Resultados de eficacia (supervivencia sin paracentesis y tiempo hasta necesitar la primera paracentesis de la ascitis) del estudio IP-CAT-AC-03__
|
Variable |
Catumaxomab + prednisolona (N=111) |
Catumaxomab (N=108) |
Conjunto de la población (N=219) |
|
Supervivencia sin paracentesis | |||
|
Mediana de la supervivencia sin paracentesis (días) |
30 |
37 |
35 |
|
IC del 95% para la mediana (días) |
[23; 671 |
[24; 611 |
[26; 59] |
|
Valor de p (prueba del logaritmo del rango) |
0,402 | ||
|
Riesgo relativo (Hazard ratio,HR) (catumaxomab comparado con catumaxomab + prednisolona) |
1,130 | ||
|
IC del 95% para HR |
[0,845; 1,511] | ||
|
Tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis | |||
|
Mediana del tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis (días) |
78 |
102 |
97 |
|
IC del 95% para la mediana (días) |
[30; 223] |
[69; 159] |
[67; 155] |
|
Valor de p (prueba del logaritmo del rango) |
0,599 | ||
|
Riesgo relativo (Hazard ratio, HR) (catumaxomab comparado con catumaxomab + prednisolona) |
0,901 | ||
|
IC del 95% para HR |
[0,608; 1,335] | ||
Como criterio de valoración secundario de la eficacia se calculó la supervivencia global (Tabla 6).
|
Tabla 6 Supervivencia global del estudio IP-CAr |
-AC-03 en la fase postestudio | ||
|
Catumaxomab + prednisolona (N=111) |
Catumaxomab (N=108) |
Conjunto de la población (N=219) | |
|
Mediana de la supervivencia global (días) |
124 |
86 |
103 |
|
IC del 95% para la mediana (días) |
[97,0; 169,0] |
[72,0, 126,0] |
[82; 133] |
|
Valor de p (prueba del logaritmo del rango) |
0,186 | ||
|
Riesgo relativo (Hazard ratio, HR) (catumaxomab comparado con catumaxomab + prednisolona) |
1,221 | ||
|
IC del 95% para HR |
[0,907 ; 1,645] | ||
Inmunogenicidad
La inducción de los anticuerpos anti-múridos (rata y/o ratón) humanos (HAMA/HARA) es un efecto intrínseco de los anticuerpos monoclonales murinos. Los datos actuales sobre catumaxomab obtenidos en el estudio pivotal demuestran que solamente el 5,6% de los pacientes (7/124 pacientes) fueron positivos para HAMA antes de la 4a perfusión. Hubo presencia de los HAMA en el 94% de los pacientes un mes después de la última perfusión. No se observaron reacciones de hipersensibilidad. Los pacientes que desarrollaron HAMA 8 días después del tratamiento con catumaxomab mostraron un mejor desenlace clínico, medido por la supervivencia sin paracentesis, el tiempo hasta la siguiente paracentesis y la supervivencia global, en comparación con los pacientes negativos para HAMA.
En un estudio de viabilidad para evaluar un segundo ciclo de perfusión intraperitoneal consistente en 10, 20, 50 y 150 microgramos de catumaxomab en 8 pacientes con ascitis maligna sintomática por carcinoma (IP-CAT-AC-04), la ADA fue detectable en todas las muestras disponibles de líquido ascítico y plasma durante la preselección. Los pacientes continuaron teniendo resultados ADA positivos durante las fases de tratamiento y seguimiento. A pesar de los valores de ADA preexistentes, todos los pacientes recibieron las 4 perfusiones de catumaxomab.La mediana del periodo de supervivencia sin paracentesis fue de 47,5 días, la mediana del periodo hasta la primera paracentesis terapéutica de la ascistis fue de 60,0 días y la mediana de la supervivencia global fue de 406,5 días. Todos los pacientes presentaron síntomas relacionados con el modo de acción del catumaxomab con un perfil de seguridad de naturaleza comparable con el primer ciclo de tratamiento intraperitoneal. No se observaron reacciones de hipersensibilidad.
5.2 Propiedades farmacocinéticas
Se investigó la farmacocinética de catumaxomab durante y después de cuatro perfusiones intraperitoneales de 10, 20, 50 y 150 microgramos de catumaxomab en 13 pacientes con ascitis maligna sintomática debida a carcinomas EpCAM positivos.
La variabilidad entre los sujetos fue alta. La media geométrica de la Cmax en plasma fue de aproximadamente 0,5 ng/ml (intervalo de 0 a 2,3) y la media geométrica del AUC en plasma fue de aproximadamente 1,7 días*ng/ml (intervalo <LIDC (límite inferior de cuantificación) hasta 13,5). La media geométrica de la semivida de eliminación terminal aparente en plasma (t1/2) fue de aproximadamente 2,5 días (intervalo 0,7 a 17).
Catumaxomab fue detectable en el líquido ascítico y en plasma. Las concentraciones aumentaron con el número de perfusiones y dosis aplicadas en la mayoría de los pacientes. Los niveles plasmáticos tendieron a disminuir después de haber alcanzado un máximo tras cada dosis.
Poblaciones especiales No se han realizado estudios.
5.3 Datos preclínicos sobre seguridad
La administración de catumaxomab en modelos de animales no dio lugar a signos de toxicidad aguda anormal o relacionada con el fármaco ni a signos de intolerancia local en el lugar de la inyección o perfusión. No obstante, estos resultados tienen un escaso valor por la elevada especificidad de especie de catumaxomab.
No se han realizado estudios de toxicidad a dosis repetidas, genotoxicidad, carcinogenicidad, toxicidad para la reproducción y toxicidad para el desarrollo.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Citrato sódico
Ácido cítrico monohidrato
Polisorbato 80
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
Tras la dilución
La solución para perfusión preparada es física y químicamente estable durante 48 horas entre 2°C y 8°C y durante 24 horas a una temperatura no superior a 25°C. Desde el punto de vista microbiológico, el producto debería utilizarse inmediatamente. De lo contrario, el tiempo y las condiciones de conservación del producto antes de su uso son responsabilidad del usuario y, normalmente, no deben superar las 24 horas a entre 2°C y 8°C, salvo que la dilución se haya realizado en condiciones asépticas controladas y validadas.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C). No congelar. Conservar en el embalaje original para protegerlo de la luz.
Para las condiciones de conservación tras la dilución del medicamento , ver sección 6.3.
6.5 Naturaleza y contenido del envase
0,1 ml del concentrado para solución para perfusión en una jeringa precargada (vidrio tipo I, siliconizado) con tapón del émbolo (goma de bromobutilo) y sistema de cierre luer (polipropileno siliconizado y policarbonato) con cápsula de cierre de la punta (goma de butadieno estireno) con cánula; tamaño del envase: 1 unidad.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Eliminación Ninguna especial.
Material y equipo necesario
puesto 150 cm
Se deben utilizar los siguientes componentes para la dilución y administración de Removab que Removab solamente es compatible con:
• jeringas de polipropileno de 50 ml
• tubos de perfusión de polietileno con un diámetro interno de 1 mm y una longitud de
• válvulas de perfusión de policarbonato / conexiones en Y
• catéteres de poliuretano, catéteres de poliuretano recubiertos de silicona
Adicionalmente se necesita lo siguiente:
• solución inyectable de cloruro sódico a 9 mg/ml (0,9%)
• bomba de precisión para perfusión
Instrucciones para la dilución previa a la administración Removab debe ser preparado por un profesional sanitario utilizando una técnica aséptica apropiada. La superficie exterior de la jeringa precargada no está estéril.
• Dependiendo de la dosis, se extrae la cantidad apropiada de una solución inyectable de cloruro sódico a 9 mg/ml (0,9%) con una jeringa de 50 ml (Tabla 7).
• Se debe añadir al menos 3ml de aire como amortiguador en la jeringa de 50 ml.
• Se quita la cápsula de cierre de la punta de la jeringa precargada de Removab, dirigiendo la punta hacia arriba.
• La cánula que se adjunta se conecta a la jeringa precargada de Removab. Para cada jeringa se utiliza una nueva cánula.
• Se inserta la cánula de la jeringa precargada a través de la apertura de la jeringa de 50 ml, de forma que la cánula se sumerja en la solución inyectable de cloruro sódico a 9 mg/ml (0,9%) (Figura 2).
• Se inyecta todo el contenido de la jeringa (concentrado de Removab más amortiguador de aire) desde la jeringa precargada directamente a la solución inyectable de cloruro sódico a 9 mg/ml (0,9%).
• NO SE DEBE tirar del émbolo hacia atrás para aclarar la jeringa precargada, para evitar la contaminación y garantizar que se inyecta el volumen correcto.
• Se tapa la jeringa de 50 ml y se agita suavemente para mezclar la solución. Se eliminan las burbujas de aire que pudiera haber en la jeringa de 50 ml.
• La etiqueta adhesiva, que se proporciona en la cara interior de la caja de cartón de Removab, que muestra el texto “Removab diluido. Para vía intraperitoneal únicamente” se debe adherir a la jeringa de 50 ml que contiene la solución de Removab diluido para la perfusión intraperitoneal. Ésta es una medida de precaución para asegurar que Removab se perfunde únicamente a través de la vía de administración intraperitoneal.
• La jeringa de 50 ml se inserta en la bomba de perfusión.
Tabla 7 Preparación de la solución para perfusión de Removab intraperitoneal
|
Número de perfusión / Dosis |
Número de jeringas precargadas de Removab |
Volumen total de Removab concentrado para solución para perfusión |
Cloruro de sodio 9 mg/ml(0,9%) solución inyectable |
Volumen de administración final | |
|
Jeringas precargadas de 10 micro-gramos |
Jeringas precargadas de 50 micro-gramos | ||||
|
1a perfusión 10 microgramos |
1 |
0,1 ml |
10 ml |
10,1 ml | |
|
2a perfusión 20 microgramos |
2 |
0,2 ml |
20 ml |
20,2 ml | |
|
3a perfusión 50 microgramos |
1 |
0,5 ml |
49,5 ml |
50 ml | |
|
4a perfusión 150 microgramos |
3 |
1,5 ml |
48,5 ml |
50 ml | |
Figura 2 Representación de la transferencia de Removab desde la jeringa precargada a la jeringa de 50 ml
Jeringa precargada
¥
Aire amortiguador Solución de Removab
Aire amortiguador
Cloruro sódico a 9 mg/ml (0,9%)
#
Jeringa de 50 ml
Método de administración
Para la administración intraperitoneal, el catéter debe introducirse bajo guía ecográfica por un médico con experiencia en procedimientos de administración intraperitoneal. El catéter se usa para el drenaje de la ascitis y la perfusión de Removab y de una solución de cloruro sódico a 9 mg/ml (0,9%). Se recomienda mantener el catéter en la cavidad abdominal durante todo el periodo de tratamiento. Se puede extraer el día siguiente de la última perfusión.
Antes de cada administración de Removab se debe drenar el líquido ascítico hasta la detención del flujo espontáneo o el alivio de los síntomas (ver sección 4.4). Posteriormente, antes de cada administración de Removab se deben infundir 500 ml de solución de cloruro sódico a 9 mg/ml (0,9%) para permitir la distribución del anticuerpo en la cavidad abdominal.
Removab se debe administrar por vía intraperitoneal durante un tiempo de perfusión de al menos 3 horas mediante un sistema con bomba de perfusión constante, como se describe a continuación:
• La jeringa de perfusión de 50 ml que contiene Removab diluido solución para perfusión se instala en la bomba de precisión.
• El equipamiento de tubos de perfusión conectado a la bomba de precisión se precarga con Removab diluido solución para perfusión. Se debe utilizar un tubo de perfusión de un diámetro interno de 1 mm y una longitud de 150 cm.
• El tubo de perfusión se conecta a la conexión en Y.
• En paralelo a cada aplicación de Removab se perfunden 250 ml de solución inyectable de cloruro sódico a 9 mg/ml (0,9%) vía una válvula de perfusión / conexión en Y en la guía de perfusión del catéter.
• La velocidad de la bomba se ajusta según el volumen que se va administrar y el tiempo de perfusión programado.
• Cuando la jeringa de 50 ml con la solución para perfusión de Removab diluida esté vacía, se sustituye por una jeringa de 50 ml con 20 ml de solución inyectable de cloruro de sodio a
9 mg/ml (0,9%) hasta el final del tiempo de perfusión programado para limpiar el volumen muerto de la guía de perfusión (aproximadamente 2 ml) en condiciones sin cambios. El resto de solución inyectable de cloruro de sodio a 9 mg/ml (0,9%) puede desecharse.
• .El catéter se mantiene cerrado hasta la siguiente perfusión.
• El día después de la última perfusión se realiza un drenaje de la ascitis hasta la detención del flujo espontáneo. Posteriormente, se puede quitar el catéter.
Figura 3 Esquema del sistema de perfusión
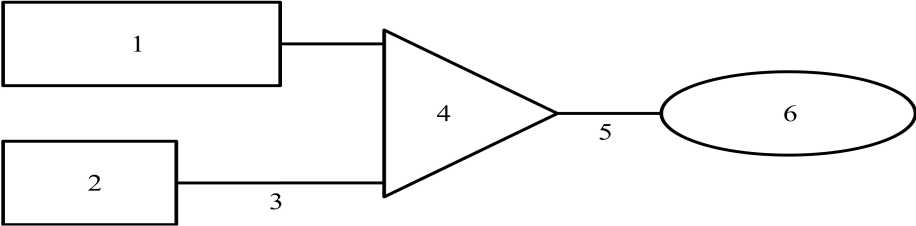
1 250 ml Cloruro sódico a 9 mg/ml (0,9% )
2 Removab solución para perfusión i.p.
3 Conducto para perfusión (1 mm diámetro interior, 150 cm longitud)
4 Válvula de perfusión
5 Guía de perfusión
6 Catéter
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Neovii Biotech GmbH Am Haag 6-7 82166 Graefelfing Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/512/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20 de abril de 2009 Fecha de la última renovación: 18 de diciembre de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
1. NOMBRE DEL MEDICAMENTO
Removab 50 microgramos concentrado para solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Una jeringa precargada contiene 50 microgramos de catumaxomab* en 0,5 ml de solución, que corresponde a 0,1 mg/ml.
*anticuerpo monoclonal IgG2 híbrido rata-ratón producido en una línea celular de hibridoma híbrido de rata-ratón
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado para solución para perfusión. Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Removab está indicado para el tratamiento intraperitoneal de la ascitis maligna en adultos con carcinomas EpCAM positivos para los que no hay un tratamiento rutinario o ya no es viable.
4.2 Posología y forma de administración
Removab se debe administrar bajo la supervisión de un médico con experiencia en el uso de medicamentos antineoplásicos.
Posología
Antes de administrar la perfusión intraperitoneal, se recomienda una premedicación con productos analgésicos, antipiréticos o antiinflamatorios no esteroideos (ver sección 4.4).
La pauta de administración de Removab comprende las siguientes cuatro perfusiones intraperitoneales:
1a dosis 10 microgramos en el día 0
2a dosis 20 microgramos en el día 3
3a dosis 50 microgramos en el día 7
4a dosis 150 microgramos en el día 10
Removab se tiene que administrar como perfusión intraperitoneal a velocidad constante con un tiempo de perfusión de al menos 3 horas. En los ensayos clínicos se investigaron tiempos de perfusión de 3 horas y de 6 horas. Para la primera de las cuatro dosis puede considerarse un tiempo de perfusión de 6 horas, dependiendo del estado de salud del paciente.
Debe dejarse un intervalo de al menos dos días naturales sin perfusión entre los días con perfusión. El intervalo entre los días de perfusión puede prolongarse en caso de reacciones adversas relevantes. El periodo global de tratamiento no debe superar los 20 días.
Vigilancia
Se recomienda una adecuada vigilancia del paciente tras la finalización de la perfusión de Removab. En el estudio pivotal se realizó seguimiento a los pacientes durante 24 h después de cada perfusión.
Poblaciones especiales
Deterioro hepático
Los pacientes con deterioro hepático de un grado de gravedad mayor que moderado y/o más del 70% del hígado metastatizado y/o trombosis/obstrucción de la vena porta no se han estudiado. El tratamiento de estos pacientes con Removab sólo debe plantearse después de una minuciosa evaluación de la relación beneficio-riesgo (ver sección 4.4)
Deterioro renal
Los pacientes con deterioro renal de un grado de gravedad mayor que leve no han sido estudiados. El tratamiento de estos pacientes con Removab sólo debe plantearse después de una minuciosa evaluación de la relación beneficio-riesgo (ver sección 4.4).
Población pediátrica
No existe una recomendación de uso específica para Removab en la población pediátrica para la indicación autorizada.
Forma de administración
Removab se debe administrar únicamente como perfusión intraperitoneal.
Removab no debe administrarse en forma de bolo intraperitoneal o por cualquier otra vía de administración.
Para obtener información sobre el sistema de perfusión que se debe utilizar, ver la sección 4.4.
Precauciones que deben tomarse antes de administrar este medicamento
Antes de la administración de Removab concentrado para solución para perfusión se diluye en una solución inyectable de cloruro sódico a 9 mg/ml (0,9%). La solución para perfusión diluida de Removab se administra a continuación intraperitonealmente como una perfusión a velocidad constante utilizando un sistema de bomba adecuado.
Para consultar las instrucciones de dilución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Hipersensibilidad a proteínas murinas (rata y/o ratón).
4.4 Advertencias y precauciones especiales de empleo
Removab no debe administrarse en forma de bolo o por cualquier otra vía de administración que no sea la intraperitoneal.
Síntomas relacionados con la liberación de citocinas
Dado que la liberación de citocinas proinflamatorias y citotóxicas se inicia con la unión de catumaxomab a las células inmunitarias y tumorales, se han notificado muy frecuentemente síntomas clínicos relacionados con la liberación de citocinas como fiebre, náuseas, vómitos y escalofríos durante y después de la administración de Removab (ver sección 4.8). Frecuentemente se observan disnea e hipo o hipertensión. En los estudios clínicos de pacientes con ascitis maligna se administró sistemáticamente 1.000 mg de paracetamol vía intravenosa antes de la perfusión de Removab para controlar el dolor y la pirexia. A pesar de la premedicación, los pacientes tuvieron las reacciones adversas descritas anteriormente con una intensidad hasta de grado 3, según los Criterios de Terminología Comunes de Acontecimientos Adversos (CTCAE) del National Cancer Institute de
EE.UU, versión 3.0. Se recomienda una pre-medicación estándar diferente o adicional con medicamentos analgésicos, antipiréticos, antiinflamatorios no esteroideos.
El síndrome de reacción inflamatoria sistémica (SRIS) que también puede ocurrir frecuentemente debido al mecanismo de acción de catumaxomab se desarrolla, en general, en las 24 horas siguientes a la perfusión de Removab, con síntomas de fiebre, taquicardia, taquipnea y leucocitosis (ver sección 4.8). Para limitar el riesgo procede usar el tratamiento o la premedicación habituales, por ejemplo analgésicos, antipiréticos, antiinflamatorios no esteroideos.
Dolor abdominal
Se notificó dolor abdominal frecuentemente como reacción adversa. Este efecto transitorio se considera en parte una consecuencia de la vía de administración intraperitoneal.
Estado general e IMC
Antes del tratamiento con Removab se requiere una situación funcional adecuada expresada como un índice de masa corporal (IMC) >17 (que será valorado tras el drenaje del líquido ascítico) y un índice de Karnofsky >60.
Infecciones agudas
La administración de Removab no se recomienda en presencia de factores que interfieran con el sistema inmunitario, en particular las infecciones agudas.
Drenaje de la ascitis
El tratamiento médico apropiado del drenaje de la ascitis es un requisito previo para el tratamiento con Removab, para garantizar unas funciones circulatoria y renal estables. Dicho tratamiento debe incluir, como mínimo, el drenaje de la ascitis hasta la detención del flujo espontáneo o el alivio de los síntomas y, si procede, el tratamiento de soporte apropiado con cristaloides y/o coloides.
Pacientes con insuficiencia hemodinámica, edema o hipoproteinemia
Antes de cada perfusión de Removab se deben evaluar el volumen sanguíneo, las proteínas en sangre, la presión arterial, el pulso y la función renal. Antes de cada perfusión de Removab se tienen que solucionar otras afecciones como hipovolemia, hipoproteinemia, hipotensión, descompensación circulatoria y deficiencia renal aguda.
Deficiencia hepática o renal o trombosis u obstrucción de la vena porta
No se han estudiado pacientes con una deficiencia hepática de un grado de gravedad mayor que moderado y/o con más del 70% del hígado con metástasis, o trombosis u obstrucción de la vena porta. El tratamiento de esos pacientes con Removab sólo debe plantearse después de una minuciosa evaluación de la relación beneficio-riesgo.
Deficiencia renal
Los pacientes con una deficiencia renal de un grado de gravedad mayor que leve no han sido estudiados. El tratamiento de esos pacientes con Removab sólo debe plantearse después de una minuciosa evaluación de la relación beneficio-riesgo.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de catumaxomab en mujeres embarazadas.
Los estudios realizados en animales son insuficientes en términos de toxicidad para la reproducción (ver sección 5.3).
No se recomienda utilizar Removab durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Lactancia
Se desconoce si catumaxomab/metabolitos se excreta en la leche materna. No se puede excluir el riesgo en recién nacidos/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras consideran el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
No se dispone de datos acerca del efecto del catumaxomab sobre la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Removab sobre la capacidad para conducir y utilizar máquinas es de pequeña a moderada.
Se aconsejará a los pacientes que tengan síntomas relacionados con la perfusión que no conduzcan ni utilicen máquinas hasta que desaparezcan los síntomas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas que aparecen a continuación derivan de un análisis de seguridad integrado que abarcaba 12 estudios clínicos. 728 pacientes recibieron catumaxomab por vía intraperitoneal,
293 pacientes en perfusión de 6 horas y 435 pacientes en perfusión de 3 horas.
El perfil de seguridad global de Removab se caracteriza por síntomas relacionados con la liberación de citocinas y por reacciones gastrointestinales.
Reacciones relacionadas con la liberación de citoquinas: SIRS, una combinación potencialmente mortal de taquicardia, fiebre y/o disnea, puede desarrollarse en las 24 horas siguientes a una perfusión de catumaxomab y se resuelve con tratamiento sintomático. Otras reacciones relacionadas con la liberación de citocinas, como fiebre, escalofríos, náuseas y vómitos, son reacciones notificadas muy frecuentemente con una intensidad de grado 1 y 2, según los Criterios de Terminología Comunes de Acontecimientos Adversos (CTCAE) (National Cancer Institute de EE.UU., versión 4.0). Estos síntomas reflejan el mecanismo de acción del catumaxomab y en general son totalmente reversibles. Las reacciones gastrointestinales como dolor abdominal, náuseas, vómitos y diarrea son muy frecuentes y ocurren principalmente con una intensidad de grado 1 o 2 según los CTCAE, pero también se observaron con mayores grados de intensidad, y responden al tratamiento sintomático adecuado.
El perfil de seguridad de catumaxomab utilizando un tiempo de perfusión de 3 h en comparación con un tiempo de perfusión de 6 h en general es comparable en cuanto a naturaleza, frecuencia e intensidad. Se observó una mayor frecuencia de algunas reacciones adversas en la administración de 3 h, como escalofríos e hipotensión (grados 1/2), diarrea (todos los grados) y fatiga (grado 1/2).
Tabla de reacciones adversas
En la Tabla 1 se presentan las reacciones adversas por clase orgánica. Los grupos de frecuencia se definen de la forma siguiente: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100).
Tabla 1 Reacciones adversas notificadas de pacientes en tratamiento con catumaxomab
|
Infecciones e infestaciones | ||
|
Frecuentes |
Infección. | |
|
Poco ^ frecuentes |
Eritema indurado*, infección relacionada con el dispositivo*. | |
|
Trastornos de la |
sangre y del sistema linfático | |
|
Frecuentes |
Anemia*, linfopenia, leucocitosis, neutrofilia. |
|
Poco frecuentes |
Tombocitopenia*, coagulopatía*. |
|
Trastornos del sistema inmunológico | |
|
Frecuentes |
Síndrome de liberación de citocinas*, hipersensibilidad*. |
|
Trastornos del metabolismo y de la nutrición | |
|
Frecuentes |
Disminución del apetito*/anorexia, deshidratación*, hipopotasemia, hipoalbuminemia, hiponatremia*, hipocalcemia*, hipoproteinemia. |
|
Trastornos psiquiátricos | |
|
Frecuentes |
Ansiedad, insomnio. |
|
Trastornos del sistema nervioso | |
|
Frecuentes |
Cefalea, mareos. |
|
Poco f frecuentes |
Convulsiones*. |
|
Trastornos del oído |
y del laberinto |
|
Frecuentes |
Vértigo. |
|
Trastornos cardiacos | |
|
Frecuentes |
Taquicardia*, incluida taquicardia sinusal. |
|
Trastornos vasculares | |
|
Frecuentes |
Hipotensión*, hipertensión*, enrojecimiento cutáneo. |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes |
Disnea*, derrame pleural*, tos. |
|
Poco f frecuentes |
Embolia de pulmón*, hipoxia*. |
|
Trastornos gastrointestinales | |
|
Muy frecuentes |
Dolor abdominal*, náuseas*, vómitos*, diarrea*. |
|
Frecuentes |
Estreñimiento*, dispepsia, distensión abdominal, subíleo*,flatulencia, trastornos gástricos, íleo*, enfermedad por reflujo gastroesofágico, boca |
|
seca. | |
|
Poco f frecuentes |
Hemorragia gastrointestinal*, obstrucción intestinal*. |
|
Trastornos hepatobiliares | |
|
Frecuentes |
Colangitis*, hiperbilirrubinemia. |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes |
Exantema*, eritema*, hiperhidrosis, prurito. |
|
Poco f frecuentes |
Reacción cutánea*, dermatitis alérgica*. |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Frecuentes |
Lumbalgia, mialgia, artralgia. |
|
Trastornos renales |
y urinarios |
|
Frecuentes |
Proteinuria. |
|
Poco frecuentes |
Insuficiencia renal aguda*. |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes |
Pirexia*, cansancio*, escalofríos*. |
|
Frecuentes |
Dolor, astenia*, síndrome de respuesta inflamatoria sistémica*, edema |
|
incluido edema periférico*, deterioro general del estado físico*, dolor torácico, síndrome gripal, malestar*, eritema en el sitio del catéter. | |
|
Poco f frecuentes |
Extravasación*, inflamación en el lugar de aplicación*. |
*También notificados como reacciones adversas graves.
Subrayado: ver la sección ‘Descripción de reacciones adversas seleccionadas’
Descripción de reacciones adversas seleccionadas
Son válidas las definiciones siguientes de criterios de CTCAE del National Cancer Institute de EE.UU. (versión 4.0):
CTCAE grado 1 = leve, CTCAE grado 2 = moderado, CTCAE grado 3 = grave, CTCAE grado 4 = potencialmente mortal
Síntomas relacionados con la liberación de citocinas de mayor intensidad
En el 5,1% de los pacientes, la pirexia alcanzó una intensidad de grado 3 según los CTCAE, al igual que el síndrome de liberación de citocinas (1,0%), los escalofríos (0,8%), las náuseas (3,4%), los vómitos (4,4%), la disnea (1,6%) y la hipo-/hipertensión (2,1%/0,8%). En un paciente (0,1%) la disnea y en 3 pacientes (0,4%) la hipotensión se notificaron con una intensidad de grado 4 según los CTCAE. Los síntomas de dolor y pirexia pueden mejorar o evitarse con premedicación (ver las secciones 4.2 y 4.4).
Síndrome de respuesta inflamatoria sistémica (SRIS)
En el 3,8% de los pacientes se observaron síntomas de SRIS en las siguientes 24 horas tras la perfusión de catumaxomab. En tres pacientes (0,4%) se observó una intensidad de grado 4 según los CTCAE. Las reacciones se resolvieron con tratamiento sintomático.
Dolor abdominal
El 43,7% de los pacientes notificó dolor abdominal como reacción adversa alcanzando grado 3 en el 8,2% de los casos, pero se resolvió con tratamiento sintomático.
Enzimas hepáticas
Se ha observado con frecuencia un aumento transitorio en las enzimas hepáticas después de la administración de Removab. En general, los cambios en los parámetros de laboratorio no fueron relevantes desde el punto de vista clínico y en su mayor parte volvieron a los valores basales después de finalizar el tratamiento.
Solamente en casos de aumento persistente o clínicamente relevante deberán considerarse diagnósticos o tratamientos adicionales.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
No se han notificado casos de sobredosis. Los pacientes tratados con una dosis de catumaxomab mayor de la recomendada tuvieron reacciones adversas más intensas (grado 3).
5. PROPIEDADES FARMACOLÓGICAS 5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos antineoplásicos, anticuerpos monoclonales; código ATC: L01XC09
Mecanismo de acción
Catumaxomab es un anticuerpo monoclonal híbrido de rata-ratón trifuncional que se dirige específicamente contra la molécula de adhesión de las células epiteliales (EpCAM) y el antígeno CD3.
El antígeno EpCAM se sobreexpresa en la mayoría de los carcinomas (Tabla 2). El CD3 se expresa en las células T maduras como componente del receptor de la célula T. El tercer lugar de unión funcional de la región Fc de catumaxomab permite su interacción con las células inmunitarias accesorias a través de los receptores Fcy.
Debido a las propiedades de unión de catumaxomab, se consigue que las células tumorales, las células T y las células inmunitarias accesorias entren en estrecho contacto. En consecuencia, se induce una reacción inmunitaria concertada frente a las células tumorales con diferentes mecanismos de acción, como la activación de las células T, citotoxicidad celular mediada por anticuerpos (ADCC),
citotoxicidad dependiente del complemento (CDC) y fagocitosis. Esto da como resultado la destrucción de células tumorales.
Table 2 La expresión de EpCAM en los tipos de ascitis más importantes que producen cáncer
|
Datos bibliográficos |
Datos retrospectivos del estudio IP-CAT-AC-03 | ||
|
Tipo de cáncer |
Porcentaje de tumores que expresan EpCAM |
Porcentaje de derrames positivos para EpCAM |
Porcentaje de derrames positivos para EpCAM |
|
Ovárico |
90-92 |
79-100 |
98 |
|
Gástrico |
96 |
75-100 |
100 |
|
De colon |
100 |
87-100 |
100 |
|
Pancreático |
98 |
83-100 |
80 |
|
De mama |
45*-81 |
71-100 |
86 |
|
Endometrial |
94 |
100 |
100 |
*= cáncer de mama lobular
Efectos farmacodinámicos
La actividad antitumoral de catumaxomab se ha demostrado in vitro e in vivo. Se observó in vitro la muerte efectiva mediada por catumaxomab de las células tumorales con expresión baja y alta del antígeno EpCAM, con independencia del tipo tumoral primario. La actividad antitumoral in vivo de catumaxomab se confirmó en un modelo de compromiso inmunitario de carcinoma de ovario en ratón, donde el desarrollo tumoral se retrasó mediante el tratamiento intraperitoneal con catumaxomab y células mononucleadas humanas en sangre periférica.
Eficacia clínica
La eficacia de catumaxomab se demostró en dos estudios clínicos de fase III. No se ha incluido a pacientes de origen no caucásico en estos estudios clínicos.
IP-REM-AC-01
Un estudio clínico pivotal de fase II/III, aleatorizado y abierto con dos grupos de tratamiento con 258 pacientes con ascitis maligna sintomática debida a carcinomas EpCAM positivos, de los cuales 170 fueron aleatorizados para recibir tratamiento con catumaxomab. En este estudio se comparó el efecto de paracentesis más catumaxomab frente a paracentesis sola (control).
Catumaxomab se administró a los pacientes cuando no existía un tratamiento establecido o ya no era viable, y en los que la situación funcional de Karnofsky era al menos de 60. Catumaxomab se administró como cuatro perfusiones intraperitoneales con dosis en aumento de 10, 20, 50 y 150 microgramos en el día 0, 3, 7 y 10, respectivamente (ver sección 4.2). En el estudio pivotal IP-REM-AC-01 el 98,1% de los pacientes fueron hospitalizados durante una media de 11 días.
En este estudio, el criterio de valoración principal de la eficacia fue la supervivencia sin paracentesis, que fue un criterio de valoración compuesto definido como el tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis o hasta la muerte, lo que primero sucediera. Los resultados de la supervivencia media sin paracentesis y el tiempo hasta necesitar la primera paracentesis de la ascitis en términos de medianas e índices de riesgo relativo se presentan en la Tabla 3. Las estimaciones de Kaplan Meier para el tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis se proporcionan en la Figura 1.
|
necesitar la primera paracentesis tera |
péutica de la ascitis) del estut |
io IP-REM-AC-01 |
|
Variable |
Paracentesis + catumaxomab (N=170) |
Paracentesis (control) (N=88) |
|
Supervivencia sin paracentesis | ||
|
Mediana de supervivencia sin paracentesis (días) |
44 |
11 |
|
IC del 95% para la mediana(días) |
[31; 49] |
[9; 16] |
|
Valor de p (prueba del logaritmo del rango) |
< 0,0001 | |
|
Riesgo relativo (Hazard ratio, HR) |
0,310 | |
|
IC del 95% para HR |
[0,228; 0,423] | |
|
Tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis | ||
|
Mediana del tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis (días) |
77 |
13 |
|
IC del 95% para la mediana(días) |
[62;104] |
[9; 17] |
|
Valor de p (prueba del logaritmo del rango) |
< 0,0001 | |
|
Riesgo relativo (Hazard ratio, HR) |
0,169 | |
|
IC del 95% para HR |
[0,114; 0,251] | |
Figura 1 Estimaciones de Kaplan Meier para el tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis del estudio IP-REM-AC-01
Probabilidad estimada de estar sin paracentesis %
0 10 20 30
40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210
Tiempo (días) hasta el acontecimiento
Tratamiento:
-e—a—a- Catumaxomab (N=170)
----- Control (N=88)
N: número de pacientes en un grupo de tratamiento.
La eficacia del tratamiento con paracentesis y catumaxomab en pacientes con ascitis maligna debida a carcinomas EpCAM positivos fue significativamente mejor a la obtenida con la paracentesis sola, medida por la supervivencia sin paracentesis y por el tiempo hasta necesitar la primera paracentesis de la ascitis.
Después de completarse el estudio, se realizó un seguimiento adicional a los pacientes hasta el final de su vida para una valoración sobre la supervivencia global (Tabla 4).
Tabla 4 Resultados de eficacia (supervivencia global y tiempo hasta la progresión) del estudio IP-REM-AC-01 en la fase postestudio
|
Paracentesis + catumaxomab (N=170) |
Paracentesis (control) (N=88) | |
|
Riesgo relativo (Hazard ratio, HR) |
0,798 | |
|
IC del 95% para HR |
[0,606; 1,051] | |
|
Tasa de supervivencia a los 6 meses |
27,5% |
17,1% |
|
Tasa de supervivencia después de 1 año |
11,4% |
2,6% |
|
Mediana de la supervivencia global (días) |
72 |
71 |
|
IC del 95% para la mediana (días) |
[61; 98] |
[54; 89] |
|
Valor de p (prueba del orden logarítmico) |
0,1064 | |
En conjunto, 45 de 88 (51%) pacientes del grupo de control cambiaron de grupo para recibir tratamiento activo con catumaxomab.
IP-CAT-AC-03
Este estudio de confirmación de fase IIIb, aleatorizado y abierto con dos grupos de tratamiento en 219 pacientes con ascitis maligna sintomática que requería paracentesis terapéutica de la ascitis, investigó el tratamiento con catumaxomab y medicación previa con 25 mg de prednisolona en comparación con catumaxomab solo. Catumaxomab se administró en ambos grupos en cuatro perfusiones intraperitoneales de 3 horas a velocidad constante en dosis en aumento de 10, 20, 50 y 150 microgramos en el día 0, 3, 7 y 10, respectivamente. La población de pacientes fue comparable a la del estudio pivotal.
Con el fin de evaluar el efecto de la medicación previa de prednisolona sobre la seguridad y eficacia, se estudió “la puntuación compuesta de la seguridad” como criterio de valoración principal de la seguridad y “la supervivencia sin paracentesis” como criterio de valoración coprincipal de la eficacia. La puntuación compuesta de seguridad evaluaba en ambos grupos de tratamiento la frecuencia y gravedad de las principales reacciones adversas conocidas: pirexia, náuseas, vómitos y dolor abdominal. La administración de prednisolona como medicación previa no produjo una reducción de estas reacciones adversas.
El criterio de valoración principal de la eficacia, la supervivencia sin paracentesis, fue un criterio de valoración compuesto definido como el tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis o hasta la muerte, lo que primero sucediera (idéntico al del estudio pivotal).
Tabla 5 Resultados de eficacia (supervivencia sin paracentesis y tiempo hasta necesitar la primera paracentesis de la ascitis) del estudio IP-CAT-AC-03__
|
Variable |
Catumaxomab + prednisolona (N=111) |
Catumaxomab (N=108) |
Conjunto de la población (N=219) |
|
Supervivencia sin paracentesis | |||
|
Mediana de la supervivencia sin paracentesis (días) |
30 |
37 |
35 |
|
IC del 95% para la mediana (días) |
[23; 671 |
[24; 611 |
[26; 59] |
|
Valor de p (prueba del logaritmo del rango) |
0,402 | ||
|
Riesgo relativo (Hazard ratio,HR) (catumaxomab comparado con catumaxomab + prednisolona) |
1,130 | ||
|
IC del 95% para HR |
[0,845; 1,511] | ||
|
Tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis | |||
|
Mediana del tiempo hasta necesitar la primera paracentesis terapéutica de la ascitis (días) |
78 |
102 |
97 |
|
IC del 95% para la mediana (días) |
[30; 223] |
[69; 159] |
[67; 155] |
|
Valor de p (prueba del logaritmo del rango) |
0,599 | ||
|
Riesgo relativo (Hazard ratio, HR) (catumaxomab comparado con catumaxomab + prednisolona) |
0,901 | ||
|
IC del 95% para HR |
[0,608; 1,335] | ||
Como criterio de valoración secundario de la eficacia se calculó la supervivencia global (Tabla 6).
|
Tabla 6 Supervivencia global del estudio IP-CAr |
-AC-03 en la fase postestudio | ||
|
Catumaxomab + prednisolona (N=111) |
Catumaxomab (N=108) |
Conjunto de la población (N=219) | |
|
Mediana de la supervivencia global (días) |
124 |
86 |
103 |
|
IC del 95% para la mediana (días) |
[97,0; 169,0] |
[72,0, 126,0] |
[82; 133] |
|
Valor de p (prueba del logaritmo del rango) |
0,186 | ||
|
Riesgo relativo (Hazard ratio, HR) (catumaxomab comparado con catumaxomab + prednisolona) |
1,221 | ||
|
IC del 95% para HR |
[0,907 ; 1,645] | ||
Inmunogenicidad
La inducción de los anticuerpos anti-múridos (rata y/o ratón) humanos (HAMA/HARA) es un efecto intrínseco de los anticuerpos monoclonales murinos. Los datos actuales sobre catumaxomab obtenidos en el estudio pivotal demuestran que solamente el 5,6% de los pacientes (7/124 pacientes) fueron positivos para HAMA antes de la 4a perfusión. Hubo presencia de los HAMA en el 94% de los pacientes un mes después de la última perfusión. No se observaron reacciones de hipersensibilidad. Los pacientes que desarrollaron HAMA 8 días después del tratamiento con catumaxomab mostraron un mejor desenlace clínico, medido por la supervivencia sin paracentesis, el tiempo hasta la siguiente paracentesis y la supervivencia global, en comparación con los pacientes negativos para HAMA.
En un estudio de viabilidad para evaluar un segundo ciclo de perfusión intraperitoneal consistente en 10, 20, 50 y 150 microgramos de catumaxomab en 8 pacientes con ascitis maligna sintomática por carcinoma (IP-CAT-AC-04), la ADA fue detectable en todas las muestras disponibles de líquido ascítico y plasma durante la preselección. Los pacientes continuaron teniendo resultados ADA positivos durante las fases de tratamiento y seguimiento. A pesar de los valores de ADA preexistentes, todos los pacientes recibieron las 4 perfusiones de catumaxomab.La mediana del periodo de supervivencia sin paracentesis fue de 47,5 días, la mediana del periodo hasta la primera paracentesis terapéutica de la ascistis fue de 60,0 días y la mediana de la supervivencia global fue de 406,5 días. Todos los pacientes presentaron síntomas relacionados con el modo de acción del catumaxomab con un perfil de seguridad de naturaleza comparable con el primer ciclo de tratamiento intraperitoneal. No se observaron reacciones de hipersensibilidad.
5.2 Propiedades farmacocinéticas
Se investigó la farmacocinética de catumaxomab durante y después de cuatro perfusiones intraperitoneales de 10, 20, 50 y 150 microgramos de catumaxomab en 13 pacientes con ascitis maligna sintomática debida a carcinomas EpCAM positivos.
La variabilidad entre los sujetos fue alta. La media geométrica de la Cmax en plasma fue de aproximadamente 0,5 ng/ml (intervalo de 0 a 2,3) y la media geométrica del AUC en plasma fue de aproximadamente 1,7 días*ng/ml (intervalo <LIDC (límite inferior de cuantificación) hasta 13,5). La media geométrica de la semivida de eliminación terminal aparente en plasma (t1/2) fue de aproximadamente 2,5 días (intervalo 0,7 a 17).
Catumaxomab fue detectable en el líquido ascítico y en plasma. Las concentraciones aumentaron con el número de perfusiones y dosis aplicadas en la mayoría de los pacientes. Los niveles plasmáticos tendieron a disminuir después de haber alcanzado un máximo tras cada dosis.
Poblaciones especiales No se han realizado estudios.
5.3 Datos preclínicos sobre seguridad
La administración de catumaxomab en modelos de animales no dio lugar a signos de toxicidad aguda anormal o relacionada con el fármaco ni a signos de intolerancia local en el lugar de la inyección o perfusión. No obstante, estos resultados tienen un escaso valor por la elevada especificidad de especie de catumaxomab.
No se han realizado estudios de toxicidad a dosis repetidas, genotoxicidad, carcinogenicidad, toxicidad para la reproducción y toxicidad para el desarrollo.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Citrato sódico
Ácido cítrico monohidrato
Polisorbato 80
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
Tras la dilución
La solución para perfusión preparada es física y químicamente estable durante 48 horas entre 2°C y 8°C y durante 24 horas a una temperatura no superior a 25°C. Desde el punto de vista microbiológico, el producto debería utilizarse inmediatamente. De lo contrario, el tiempo y las condiciones de conservación del producto antes de su uso son responsabilidad del usuario y, normalmente, no deben superar las 24 horas a entre 2°C y 8°C, salvo que la dilución se haya realizado en condiciones asépticas controladas y validadas.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C). No congelar. Conservar en el embalaje original para protegerlo de la luz.
Para las condiciones de conservación tras la dilución del medicamento , ver sección 6.3.
6.5 Naturaleza y contenido del envase
0,5 ml del concentrado para solución para perfusión en una jeringa precargada (vidrio tipo I, siliconizado) con tapón del émbolo (goma de bromobutilo) y sistema de cierre luer (polipropileno siliconizado y policarbonato) con cápsula de cierre de la punta (goma de butadieno estireno) con cánula; tamaño del envase: 1 unidad.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Eliminación Ninguna especial.
Material y equipo necesario
puesto 150 cm
Se deben utilizar los siguientes componentes para la dilución y administración de Removab que Removab solamente es compatible con:
• jeringas de polipropileno de 50 ml
• tubos de perfusión de polietileno con un diámetro interno de 1 mm y una longitud de
• válvulas de perfusión de policarbonato / conexiones en Y
• catéteres de poliuretano, catéteres de poliuretano recubiertos de silicona
Adicionalmente se necesita lo siguiente:
• solución inyectable de cloruro sódico a 9 mg/ml (0,9%)
• bomba de precisión para perfusión
Instrucciones para la dilución previa a la administración Removab debe ser preparado por un profesional sanitario utilizando una técnica aséptica apropiada. La superficie exterior de la jeringa precargada no está estéril.
• Dependiendo de la dosis, se extrae la cantidad apropiada de una solución inyectable de cloruro sódico a 9 mg/ml (0,9%) con una jeringa de 50 ml (Tabla 7).
• Se debe añadir al menos 3ml de aire como amortiguador en la jeringa de 50 ml.
• Se quita la cápsula de cierre de la punta de la jeringa precargada de Removab, dirigiendo la punta hacia arriba.
• La cánula que se adjunta se conecta a la jeringa precargada de Removab. Para cada jeringa se utiliza una nueva cánula.
• Se inserta la cánula de la jeringa precargada a través de la apertura de la jeringa de 50 ml, de forma que la cánula se sumerja en la solución inyectable de cloruro sódico a 9 mg/ml (0,9%) (Figura 2).
• Se inyecta todo el contenido de la jeringa (concentrado de Removab más amortiguador de aire) desde la jeringa precargada directamente a la solución inyectable de cloruro sódico a 9 mg/ml (0,9%).
• NO SE DEBE tirar del émbolo hacia atrás para aclarar la jeringa precargada, para evitar la contaminación y garantizar que se inyecta el volumen correcto.
• Se tapa la jeringa de 50 ml y se agita suavemente para mezclar la solución. Se eliminan las burbujas de aire que pudiera haber en la jeringa de 50 ml.
• La etiqueta adhesiva, que se proporciona en la cara interior de la caja de cartón de Removab, que muestra el texto “Removab diluido. Para vía intraperitoneal únicamente” se debe adherir a la jeringa de 50 ml que contiene la solución de Removab diluido para la perfusión intraperitoneal. Ésta es una medida de precaución para asegurar que Removab se perfunde únicamente a través de la vía de administración intraperitoneal.
• La jeringa de 50 ml se inserta en la bomba de perfusión.
Tabla 7 Preparación de la solución para perfusión de Removab intraperitoneal
|
Número de perfusión / Dosis |
Número de jeringas precargadas de Removab |
Volumen total de Removab concentrado para solución para perfusión |
Cloruro de sodio 9 mg/ml(0,9%) solución inyectable |
Volumen de administración final | |
|
Jeringas precargadas de 10 micro-gramos |
Jeringas precargadas de 50 micro-gramos | ||||
|
1a perfusión 10 microgramos |
1 |
0,1 ml |
10 ml |
10,1 ml | |
|
2a perfusión 20 microgramos |
2 |
0,2 ml |
20 ml |
20,2 ml | |
|
3a perfusión 50 microgramos |
1 |
0,5 ml |
49,5 ml |
50 ml | |
|
4a perfusión 150 microgramos |
3 |
1,5 ml |
48,5 ml |
50 ml | |
Figura 2 Representación de la transferencia de Removab desde la jeringa precargada a la jeringa de 50 ml
Jeringa precargada
¥
Aire amortiguador Solución de Removab
Aire amortiguador
Cloruro sódico a 9 mg/ml (0,9%)
#
Jeringa de 50 ml
Método de administración
Para la administración intraperitoneal, el catéter debe introducirse bajo guía ecográfica por un médico con experiencia en procedimientos de administración intraperitoneal. El catéter se usa para el drenaje de la ascitis y la perfusión de Removab y de una solución de cloruro sódico a 9 mg/ml (0,9%). Se recomienda mantener el catéter en la cavidad abdominal durante todo el periodo de tratamiento. Se puede extraer el día siguiente de la última perfusión.
Antes de cada administración de Removab se debe drenar el líquido ascítico hasta la detención del flujo espontáneo o el alivio de los síntomas (ver sección 4.4). Posteriormente, antes de cada administración de Removab se deben infundir 500 ml de solución de cloruro sódico a 9 mg/ml (0,9%) para permitir la distribución del anticuerpo en la cavidad abdominal.
Removab se debe administrar por vía intraperitoneal durante un tiempo de perfusión de al menos 3 horas mediante un sistema con bomba de perfusión constante, como se describe a continuación:
• La jeringa de perfusión de 50 ml que contiene Removab diluido solución para perfusión se instala en la bomba de precisión.
• El equipamiento de tubos de perfusión conectado a la bomba de precisión se precarga con Removab diluido solución para perfusión. Se debe utilizar un tubo de perfusión de un diámetro interno de 1 mm y una longitud de 150 cm.
• El tubo de perfusión se conecta a la conexión en Y.
• En paralelo a cada aplicación de Removab se perfunden 250 ml de solución inyectable de cloruro sódico a 9 mg/ml (0,9%) vía una válvula de perfusión / conexión en Y en la guía de perfusión del catéter.
• La velocidad de la bomba se ajusta según el volumen que se va administrar y el tiempo de perfusión programado.
• Cuando la jeringa de 50 ml con la solución para perfusión de Removab diluida esté vacía, se sustituye por una jeringa de 50 ml con 20 ml de solución inyectable de cloruro de sodio a
9 mg/ml (0,9%) hasta el final del tiempo de perfusión programado para limpiar el volumen muerto de la guía de perfusión (aproximadamente 2 ml) en condiciones sin cambios. El resto de solución inyectable de cloruro de sodio a 9 mg/ml (0,9%) puede desecharse.
• .El catéter se mantiene cerrado hasta la siguiente perfusión.
• El día después de la última perfusión se realiza un drenaje de la ascitis hasta la detención del flujo espontáneo. Posteriormente, se puede quitar el catéter.
Figura 3 Esquema del sistema de perfusión
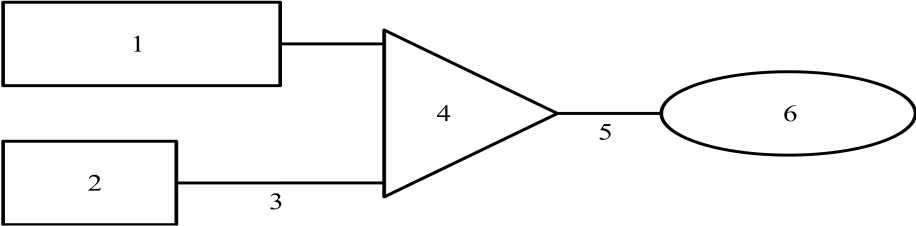
1 250 ml Cloruro sódico a 9 mg/ml (0,9% )
2 Removab solución para perfusión i.p.
3 Conducto para perfusión (1 mm diámetro interior, 150 cm longitud)
4 Válvula de perfusión
5 Guía de perfusión
6 Catéter
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Neovii Biotech GmbH Am Haag 6-7 82166 Graefelfing Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/512/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20 de abril de 2009 Fecha de la última renovación: 18 de diciembre de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico.
Trion Pharma GmbH Frankfurter Ring 193a DE-80807 Múnich Alemania
Nombre y dirección del fabricante responsable de la liberación de los lotes
Neovii Biotech GmbH Am Haag 6-7 82166 Graefelfing Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
1. NOMBRE DEL MEDICAMENTO
Removab 10 microgramos concentrado para solución para perfusión catumaxomab
2. PRINCIPIO(S) ACTIVO(S)
Una jeringa precargada contiene 10 microgramos de catumaxomab en 0,1 ml de solución, que corresponde a 0,1 mg/ml.
3. LISTA DE EXCIPIENTES
Citrato sódico, ácido cítrico monohidrato, polisorbato 80, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Concentrado para solución para perfusión. 1 jeringa precargada.
1 cánula estéril
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Para vía intraperitoneal únicamente, después de su dilución.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. No congelar. Conservar en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Neovii Biotech GmbH Am Haag 6-7 82166 Graefelfing Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/512/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
1. NOMBRE DEL MEDICAMENTO
Removab 10 microgramos concentrado para solución para perfusión catumaxomab
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Neovii Biotech GmbH
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
1 jeringa precargada.
Para vía intraperitoneal únicamente, después de su dilución. Leer el prospecto antes de utilizar este medicamento.
Conservar en nevera. No congelar. Conservar en el embalaje original para protegerlo de la luz.
Jeringa precargada: Removab 10 microgramos_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Removab 10 microgramos concentrado para solución para perfusión catumaxomab
Para vía intraperitoneal únicamente, después de su dilución.
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,1 ml
6. OTROS
Neovii Biotech GmbH
1. NOMBRE DEL MEDICAMENTO
Removab 50 microgramos concentrado para solución para perfusión catumaxomab
2. PRINCIPIO(S) ACTIVO(S)
Una jeringa precargada contiene 50 microgramos de catumaxomab en 0,5 ml de solución, que corresponde a 0,1 mg/ml.
3. LISTA DE EXCIPIENTES
Citrato sódico, ácido cítrico monohidrato, polisorbato 80, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Concentrado para solución para perfusión. 1 jeringa precargada.
1 cánula estéril
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Para vía intraperitoneal únicamente, después de su dilución.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. No congelar. Conservar en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Neovii Biotech GmbH Am Haag 6-7 82166 Graefelfing Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/512/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
1. NOMBRE DEL MEDICAMENTO
Removab 50 microgramos concentrado para solución para perfusión catumaxomab
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Neovii Biotech GmbH
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
1 jeringa precargada.
Para vía intraperitoneal únicamente, después de su dilución. Leer el prospecto antes de utilizar este medicamento.
Conservar en nevera. No congelar. Conservar en el embalaje original para protegerlo de la luz.
Jeringa precargada: Removab 50 microgramos_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Removab 50 microgramos concentrado para solución para perfusión catumaxomab
Para vía intraperitoneal únicamente, después de su dilución.
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,5 ml
6. OTROS
Neovii Biotech GmbH
TEXTO DE ADVERTENCIA PARA LA ETIQUETA ADHESIVA QUE SE DEBE ADHERIR A LA JERINGA DE 50 ml QUE CONTIENE REMOVAB DILUIDO SOLUCIÓN PARA LA PERFUSIÓN
(Parte del embajaje de cartón exterior)_
Removab diluido.
Para vía intraperitoneal únicamente.
B. PROSPECTO
Prospecto: información para el paciente
Removab 10 microgramos, concentrado para solución para perfusión
catumaxomab
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Removab y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Removab
3. Cómo usar Removab
4. Posibles efectos adversos
5. Conservación de Removab
6. Contenido del envase e información adicional
1. Qué es Removab y para qué se utiliza
Removab contiene el principio activo catumaxomab, un anticuerpo monoclonal. Reconoce una proteína de superficie de las células cancerosas y recluta células inmunitarias para destruirlas.
Removab se usa para tratar ascitis maligna, cuando no existe un tratamiento establecido o ya no es viable.
La ascitis maligna es la acumulación de líquido en el espacio abdominal (cavidad peritoneal) como consecuencia de algunos tipos de cáncer.
2. Qué necesita saber antes de empezar a usar Removab No use Removab
- si es alérgico a catumaxomab o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a las proteínas murinas (de ratón y/o rata).
Advertencias y precauciones
Consulte a su médico o enfermero antes de empezar a usar Removab.Es importante que comente con su médico si tiene alguno de los problemas siguientes:
- líquido acumulado no drenado en su cavidad abdominal.
- manos y pies fríos, sensación de mareo, dificultad para orinar, aumento de la frecuencia cardiaca y debilidad (síntomas de volumen sanguíneo bajo).
- aumento de peso, debilidad, disnea y retención de líquidos (síntomas de niveles bajos de proteínas en la sangre).
- Se siente mareado o se desmaya (síntomas de baja presión arterial).
- problemas de corazón y circulación.
- problemas hepáticos o renales.
- una infección.
Antes de usar Removab, su médico comprobará:
- Su índice de masa corporal (IMC), que depende de la talla y el peso.
- Su índice de Karnofsky, que es una medición de su estado general.
Para poder usar este medicamento, debe tener un IMC mayor de 17 (tras el drenaje del líquido ascítico) y un índice de Karnofsky mayor de 60.
Los efectos adversos relacionados con la perfusión y el dolor abdominal son muy frecuentes (ver sección 4). Se le administrarán otros medicamentos para reducir la fiebre, el dolor o la inflamación causada por Removab (ver sección 3).
Niños y adolescentes
Removab no se debe utilizar en niños ni en adolescentes menores de 18 años de edad.
Uso de Removab con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. No debe usar Removab si está embarazada a menos que sea estrictamente necesario.
Conducción y uso de máquinas
Si sufre efectos adversos como mareos o escalofríos durante o después de la administración, no debe conducir o usar herramientas o máquinas hasta que desaparezcan.
3. Cómo usar Removab
Se le administrará Removab bajo la supervisión de un médico con experiencia en el tratamiento del cáncer. Tras la perfusión de Removab usted quedará bajo observación según lo decida su médico.
Antes de empezar el tratamiento y durante el mismo, pueden darle otros medicamentos para reducir la fiebre, el dolor o la inflamación producida por Removab.
Removab se administra como 4 perfusiones intraperitoneales con dosis crecientes (10, 20, 50 y 150 microgramos) separadas por lo menos por 2 días naturales sin perfusión (por ejemplo, se le administrará perfusión el día 0, 3, 7 y 10). La perfusión debe administrarse a una velocidad constante con un tiempo de duración de al menos 3 horas. La duración total del tratamiento no debe ser mayor de 20 días.
Se introducirá un catéter en su espacio abdominal (intraperitoneal) durante toda la duración del tratamiento, hasta el día después de la última perfusión.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos graves más frecuentes de Removab son los efectos adversos relacionados con la perfusión y los efectos adversos relacionados con el sistema gastrointestinal (estómago e intestino).
Efectos adversos relacionados con la perfusión
Durante y después de la perfusión de Removab más de 1 de cada 10 pacientes (muy frecuente) probablemente experimentará efectos adversos relacionados con la perfusión. Los efectos adversos más frecuentes, relacionados con la perfusión, que en su mayor parte son de leves a moderados, son fiebre, escalofríos, náuseas y vómitos.
Si aparecen estos síntomas, informe a su médico lo antes posible. Su médico puede considerar reducir la velocidad de perfusión de Removab o administrarle un tratamiento adicional para reducir dichos síntomas.
En hasta 4 de cada 100 pacientes se puede desarrollar un conjunto de síntomas que incluyen latido muy rápido del corazón, fiebre y falta de aliento. Estos síntomas aparecen en su mayor parte dentro de las 24 horas siguientes a la perfusión de Removab y pueden llegar a ser potencialmente mortales, pero se pueden tratar bien con un tratamiento adicional.
Si aparecen estos síntomas, consulte a un médico inmediatamente, ya que estos efectos adversos requieren una atención y un tratamiento inmediatos.
Efectos adversos relacionados con el sistema gastrointestinal
En más de 1 de cada 10 pacientes (muy frecuente) se producen reacciones gastrointestinales tales como dolor abdominal, náuseas, vómitos y diarrea, pero en su mayor parte son de leves a moderadas y responden bien al tratamiento adicional.
Si aparecen estos síntomas, informe a su médico lo antes posible. Su médico puede considerar reducir la velocidad de perfusión de Removab o administrarle un tratamiento adicional para reducir dichos síntomas.
Otros efectos adversos graves
Efectos adversos graves muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- Cansancio
Efectos adversos graves frecuentes (pueden afectar a hasta 1 de cada 10 personas):
- Pérdida del apetito
- Deshidratación
- Reducción de los eritrocitos (anemia)
- Disminución de niveles de calcio y sodio en sangre
- Latido cardíaco muy rápido
- Presión arterial alta o baja
- Dolor abdominal acompañado por defecaciones difíciles o bloqueo de la defecación,
estreñimiento
- Dificultad respiratoria
- Acumulación de líquido alrededor de los pulmones que causa dolor pecho y dificultad para respirar
- Inflamación de los conductos biliares
- Enrojecimiento de la piel, erupción
- Latido cardíaco muy rápido, fiebre, dificultad respiratoria, sensación de mareo o de inestabilidad
- Complejo de reacciones debidas a la liberación de mediadores de la inflamación
- Empeoramiento del estado general de salud, por lo general, sintiendo malestar y debilidad
- Retención de líquidos
- Hipersensibilidad
Efectos adversos graves poco frecuentes (pueden afectar a hasta 1 de cada 100 personas):
- Bultos bajo la piel en la cara posterior de las piernas que pueden convertirse en llagas y dejar cicatrices
- Inflamación y dolor o sensación de quemazón y escozor en la zona que rodea el catéter
- Reducción del número de plaquetas sanguíneas, problemas de coagulación de la sangre
- Hemorragia gástrica o intestinal, manifestada con vómitos de sangre o heces rojas o negras
- Reacción cutánea, reacción cutánea alérgica grave (dermatitis)
- Crisis convulsivas
- Problemas pulmonares, como coagulación de la sangre en los pulmones
- Nivel bajo de oxígeno en la sangre
- Problemas graves de riñón
- Extravasación (escape inadvertido del medicamento administrado desde el sistema de catéter intraperitoneal al tejido circundante)
Si aparecen estos síntomas, informe a su médico lo antes posible. Algunos de estos efectos adversos pueden requerir tratamiento médico.
Otros efectos adversos
Efectos adversos frecuentes (pueden afectar a hasta 1 de cada 10 personas):
- Dolor
- Reducción o aumento de leucocitos
- Disminución de niveles de potasio en sangre
- Disminución de los niveles de proteínas en sangre
- Aumento de la bilirrubina sanguínea
- Sensación de mareo
- Indigestión, problemas gástricos, ardor de estómago, sensación de hinchazón, ventosidades, boca seca
- Síntomas gripales
- Mareo o dolor de cabeza
- Dolor torácico
- Sudoración aumentada
- Infecciones
- Aumento de niveles de proteínas en orina
- Dolor de espalda, dolores musculares y articulares
- Ansiedad y problemas para dormir
- Erupciones con picor o urticaria
- Enrojecimiento de la piel en la zona alrededor del catéter
- Enrojecimiento cutáneo
- Tos
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Removab
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C). No congelar. Conservar en el embalaje original para protegerlo de la luz.
La solución para perfusión preparada debe usarse inmediatamente.
6. Contenido del envase e información adicional
Composición de Removab
- El principio activo es catumaxomab (10 microgramos en 0,1 ml, que corresponde a 0,1 mg/ml).
- Los demás componentes son citrato sódico, ácido cítrico monohidrato, polisorbato 80 y agua para inyecciones.
Aspecto del producto y contenido del envase
Removab se presenta como concentrado para solución para perfusión transparente e incoloro en una jeringa precargada con una cánula. Tamaño del envase: 1 unidad.
Titular de la autorización de comercialización y responsable de la fabricación
Neovii Biotech GmbH Am Haag 6-7 82166 Graefelfing Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al titular de la autorización de comercialización:
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
Para información sobre la dilución y administración de Removab consulte la sección 6.6 del Resumen de las Características del Producto (RCP) incluido en cada envase de Removab 10 microgramos y Removab 50 microgramos, respectivamente.
Prospecto: información para el paciente
Removab 50 microgramos, concentrado para solución para perfusión
catumaxomab
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Removab y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Removab
3. Cómo usar Removab
4. Posibles efectos adversos
5. Conservación de Removab
6. Contenido del envase e información adicional
1. Qué es Removab y para qué se utiliza
Removab contiene el principio activo catumaxomab, un anticuerpo monoclonal. Reconoce una proteína de superficie de las células cancerosas y recluta células inmunitarias para destruirlas.
Removab se usa para tratar ascitis maligna, cuando no existe un tratamiento establecido o ya no es viable.
La ascitis maligna es la acumulación de líquido en el espacio abdominal (cavidad peritoneal) como consecuencia de algunos tipos de cáncer.
2. Qué necesita saber antes de empezar a usar Removab No use Removab
- si es alérgico a catumaxomab o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a las proteínas murinas (de ratón y/o rata).
Advertencias y precauciones
Consulte a su médico o enfermero antes de empezar a usar Removab.Es importante que comente con su médico si tiene alguno de los problemas siguientes:
- líquido acumulado no drenado en su cavidad abdominal.
- manos y pies fríos, sensación de mareo, dificultad para orinar, aumento de la frecuencia cardiaca y debilidad (síntomas de volumen sanguíneo bajo).
- aumento de peso, debilidad, disnea y retención de líquidos (síntomas de niveles bajos de proteínas en la sangre).
- Se siente mareado o se desmaya (síntomas de baja presión arterial).
- problemas de corazón y circulación.
- problemas hepáticos o renales.
- una infección.
Antes de usar Removab, su médico comprobará:
- Su índice de masa corporal (IMC), que depende de la talla y el peso.
- Su índice de Karnofsky, que es una medición de su estado general.
Para poder usar este medicamento, debe tener un IMC mayor de 17 (tras el drenaje del líquido ascítico) y un índice de Karnofsky mayor de 60.
Los efectos adversos relacionados con la perfusión y el dolor abdominal son muy frecuentes (ver sección 4). Se le administrarán otros medicamentos para reducir la fiebre, el dolor o la inflamación causada por Removab (ver sección 3).
Niños y adolescentes
Removab no se debe utilizar en niños ni en adolescentes menores de 18 años de edad.
Uso de Removab con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. No debe usar Removab si está embarazada a menos que sea estrictamente necesario.
Conducción y uso de máquinas
Si sufre efectos adversos como mareos o escalofríos durante o después de la administración, no debe conducir o usar herramientas o máquinas hasta que desaparezcan.
3. Cómo usar Removab
Se le administrará Removab bajo la supervisión de un médico con experiencia en el tratamiento del cáncer. Tras la perfusión de Removab usted quedará bajo observación según lo decida su médico.
Antes de empezar el tratamiento y durante el mismo, pueden darle otros medicamentos para reducir la fiebre, el dolor o la inflamación producida por Removab.
Removab se administra como 4 perfusiones intraperitoneales con dosis crecientes (10, 20, 50 y 150 microgramos) separadas por lo menos por 2 días naturales sin perfusión (por ejemplo, se le administrará perfusión el día 0, 3, 7 y 10). La perfusión debe administrarse a una velocidad constante con un tiempo de duración de al menos 3 horas. La duración total del tratamiento no debe ser mayor de 20 días.
Se introducirá un catéter en su espacio abdominal (intraperitoneal) durante toda la duración del tratamiento, hasta el día después de la última perfusión.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos graves más frecuentes de Removab son los efectos adversos relacionados con la perfusión y los efectos adversos relacionados con el sistema gastrointestinal (estómago e intestino).
Efectos adversos relacionados con la perfusión
Durante y después de la perfusión de Removab más de 1 de cada 10 pacientes (muy frecuente) probablemente experimentará efectos adversos relacionados con la perfusión. Los efectos adversos más frecuentes, relacionados con la perfusión, que en su mayor parte son de leves a moderados, son fiebre, escalofríos, náuseas y vómitos.
Si aparecen estos síntomas, informe a su médico lo antes posible. Su médico puede considerar reducir la velocidad de perfusión de Removab o administrarle un tratamiento adicional para reducir dichos síntomas.
En hasta 4 de cada 100 pacientes se puede desarrollar un conjunto de síntomas que incluyen latido muy rápido del corazón, fiebre y falta de aliento. Estos síntomas aparecen en su mayor parte dentro de las 24 horas siguientes a la perfusión de Removab y pueden llegar a ser potencialmente mortales, pero se pueden tratar bien con un tratamiento adicional.
Si aparecen estos síntomas, consulte a un médico inmediatamente, ya que estos efectos adversos requieren una atención y un tratamiento inmediatos.
Efectos adversos relacionados con el sistema gastrointestinal
En más de 1 de cada 10 pacientes (muy frecuente) se producen reacciones gastrointestinales tales como dolor abdominal, náuseas, vómitos y diarrea, pero en su mayor parte son de leves a moderadas y responden bien al tratamiento adicional.
Si aparecen estos síntomas, informe a su médico lo antes posible. Su médico puede considerar reducir la velocidad de perfusión de Removab o administrarle un tratamiento adicional para reducir dichos síntomas.
Otros efectos adversos graves
Efectos adversos graves muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- Cansancio
Efectos adversos graves frecuentes (pueden afectar a hasta 1 de cada 10 personas):
- Pérdida del apetito
- Deshidratación
- Reducción de los eritrocitos (anemia)
- Disminución de niveles de calcio y sodio en sangre
- Latido cardíaco muy rápido
- Presión arterial alta o baja
- Dolor abdominal acompañado por defecaciones difíciles o bloqueo de la defecación,
estreñimiento
- Dificultad respiratoria
- Acumulación de líquido alrededor de los pulmones que causa dolor pecho y dificultad para respirar
- Inflamación de los conductos biliares
- Enrojecimiento de la piel, erupción
- Latido cardíaco muy rápido, fiebre, dificultad respiratoria, sensación de mareo o de inestabilidad
- Complejo de reacciones debidas a la liberación de mediadores de la inflamación
- Empeoramiento del estado general de salud, por lo general, sintiendo malestar y debilidad
- Retención de líquidos
- Hipersensibilidad
Efectos adversos graves poco frecuentes (pueden afectar a hasta 1 de cada 100 personas):
- Bultos bajo la piel en la cara posterior de las piernas que pueden convertirse en llagas y dejar cicatrices
- Inflamación y dolor o sensación de quemazón y escozor en la zona que rodea el catéter
- Reducción del número de plaquetas sanguíneas, problemas de coagulación de la sangre
- Hemorragia gástrica o intestinal, manifestada con vómitos de sangre o heces rojas o negras
- Reacción cutánea, reacción cutánea alérgica grave (dermatitis)
- Crisis convulsivas
- Problemas pulmonares, como coagulación de la sangre en los pulmones
- Nivel bajo de oxígeno en la sangre
- Problemas graves de riñón
- Extravasación (escape inadvertido del medicamento administrado desde el sistema de catéter intraperitoneal al tejido circundante)
Si aparecen estos síntomas, informe a su médico lo antes posible. Algunos de estos efectos adversos pueden requerir tratamiento médico.
Otros efectos adversos
Efectos adversos frecuentes (pueden afectar a hasta 1 de cada 10 personas):
- Dolor
- Reducción o aumento de leucocitos
- Disminución de niveles de potasio en sangre
- Disminución de los niveles de proteínas en sangre
- Aumento de la bilirrubina sanguínea
- Sensación de mareo
- Indigestión, problemas gástricos, ardor de estómago, sensación de hinchazón, ventosidades, boca seca
- Síntomas gripales
- Mareo o dolor de cabeza
- Dolor torácico
- Sudoración aumentada
- Infecciones
- Aumento de niveles de proteínas en orina
- Dolor de espalda, dolores musculares y articulares
- Ansiedad y problemas para dormir
- Erupciones con picor o urticaria
- Enrojecimiento de la piel en la zona alrededor del catéter
- Enrojecimiento cutáneo
- Tos
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Removab
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C). No congelar. Conservar en el embalaje original para protegerlo de la luz.
La solución para perfusión preparada debe usarse inmediatamente.
6. Contenido del envase e información adicional
Composición de Removab
- El principio activo es catumaxomab (50 microgramos en 0,5 ml, que corresponde a 0,1 mg/ml).
- Los demás componentes son citrato sódico, ácido cítrico monohidrato, polisorbato 80 y agua para inyecciones.
Aspecto del producto y contenido del envase
Removab se presenta como concentrado para solución para perfusión transparente e incoloro en una jeringa precargada con una cánula. Tamaño del envase: 1 unidad.
Titular de la autorización de comercialización y responsable de la fabricación
Neovii Biotech GmbH Am Haag 6-7 82166 Graefelfing Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al titular de la autorización de comercialización:
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
Para información sobre la dilución y administración de Removab consulte la sección 6.6 del Resumen de las Características del Producto (RCP) incluido en cada envase de Removab 10 microgramos y Removab 50 microgramos, respectivamente.
ANEXO IV
MOTIVOS DE UNA RENOVACIÓN ADICIONAL
• Motivos de una renovación adicional
Teniendo en cuenta los datos que han ido apareciendo desde la concesión de la Autorización de Comercialización inicial, el CHMP considera que la relación riesgo/beneficio de Removab sigue siendo positiva, si bien considera que su perfil de seguridad debe monitorizarse estrechamente por las siguientes razones:
• Incertidumbre en la determinación de los efectos adversos raros, ya que la base de datos de seguridad es muy limitada aún, debido al reducido número de pacientes que han sido tratados con Removab.
Por lo tanto, teniendo en cuenta el perfil de seguridad de Removab, que requiere la presentación de IPS anuales, el CHMP ha decidido que el TAC debe presentar una solicitud de renovación adicional dentro de 5 años.
57