Puregon 600 Ui/0,72 Ml Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Puregon 50 UI/0,5 ml solución inyectable Puregon 75 UI/0,5 ml solución inyectable Puregon 100 UI/0,5 ml solución inyectable Puregon 150 UI/0,5 ml solución inyectable Puregon 200 UI/0,5 ml solución inyectable Puregon 225 UI/0,5 ml solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Puregon 50 UI/0,5 ml solución inyectable
Un vial contiene 50 UI de hormona estimulante del folículo recombinante (FSH) en 0,5 ml de solución acuosa, lo que corresponde a una concentración de 100 UI/ml. Cada vial contiene 5 microgramos de proteína (la actividad biológica específica in vivo equivale a aproximadamente 10.000 UI de FSH / mg de proteína). La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO).
Puregon 75 UI/0,5 ml solución inyectable
Un vial contiene 75 UI de hormona estimulante del folículo recombinante (FSH) en 0,5 ml de solución acuosa, lo que corresponde a una concentración de 150 UI/ml. Cada vial contiene 7,5 microgramos de proteína (la actividad biológica específica in vivo equivale a aproximadamente 10.000 UI de FSH / mg de proteína). La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO).
Puregon 100 UI/0,5 ml solución inyectable
Un vial contiene 100 UI de hormona estimulante del folículo recombinante (FSH) en 0,5 ml de solución acuosa, lo que corresponde a una concentración de 200 UI/ml. Cada vial contiene 10 microgramos de proteína (la actividad biológica específica in vivo equivale a aproximadamente
10.000 UI de FSH / mg de proteína). La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO).
Puregon 150 UI/0,5 ml solución inyectable
Un vial contiene 150 UI de hormona estimulante del folículo recombinante (FSH) en 0,5 ml de solución acuosa, lo que corresponde a una concentración de 300 UI/ml. Cada vial contiene 15 microgramos de proteína (la actividad biológica específica in vivo equivale a aproximadamente
10.000 UI de FSH / mg de proteína). La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO).
Puregon 200 UI/0,5 ml solución inyectable
Un vial contiene 200 UI de hormona estimulante del folículo recombinante (FSH) en 0,5 ml de solución acuosa, lo que corresponde a una concentración de 400 UI/ml. Cada vial contiene 20 microgramos de proteína (la actividad biológica específica in vivo equivale a aproximadamente
10.000 UI de FSH / mg de proteína). La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO).
Puregon 225 UI/0,5 ml solución inyectable
Un vial contiene 225 UI de hormona estimulante del folículo recombinante (FSH) en 0,5 ml de
solución acuosa, lo que corresponde a una concentración de 450 UI/ml. Cada vial contiene
22,5 microgramos de proteína (la actividad biológica específica in vivo equivale a aproximadamente
10.000 UI de FSH / mg de proteína). La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO).
Excipiente(s) con efecto conocido
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por inyectable, por lo que se considera esencialmente "exento de sodio".
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable). Solución transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
En mujeres adultas:
Puregon está indicado para el tratamiento de la infertilidad femenina en las siguientes situaciones clínicas:
• Anovulación (incluyendo el síndrome del ovario poliquístico, SOP), en mujeres que no hayan respondido al tratamiento con citrato de clomifeno.
• Hiperestimulación ovárica controlada para inducir el desarrollo de folículos múltiples en programas de reproducción asistida [por ejemplo, fecundación in vitro / transferencia de embriones (FIV/TE), transferencia intratubárica de gametos (GIFT) e inyección intracitoplasmática de esperma (ICSI)].
En varones adultos:
• Espermatogénesis deficiente debida a hipogonadismo hipogonadotrófico.
4.2 Posología y forma de administración
El tratamiento con Puregon debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de los problemas de la fertilidad.
La primera inyección de Puregon debe administrarse bajo supervisión médica directa.
Posología
Dosificación en la mujer
Existen grandes variaciones inter e intraindividuales en la respuesta de los ovarios a las gonadotrofinas exógenas, por lo que se hace imposible establecer un esquema de dosificación uniforme. Por tanto, la dosis debe ajustarse individualmente dependiendo de la respuesta del ovario. Para ello se requiere una evaluación ecográfica del desarrollo folicular. También puede ser útil la determinación simultánea de los niveles séricos de estradiol.
En base a los resultados de ensayos clínicos comparativos, se recomienda administrar una dosis total menor de Puregon durante un período de tratamiento más corto que el que se utiliza habitualmente para la FSH urinaria, no sólo para optimizar el desarrollo folicular, sino también para reducir el riesgo de hiperestimulación ovárica indeseada (ver sección 5.1).
La experiencia clínica con Puregon se basa en datos de hasta tres ciclos de tratamiento en ambas indicaciones. La experiencia global con la FIV indica que en general, el índice de éxito con el tratamiento se mantiene estable en los cuatro primeros intentos y posteriormente declina gradualmente.
• Anovulación
En general se recomienda un esquema de tratamiento secuencial, empezando con la administración diaria de 50 UI de Puregon, dosis que se mantiene durante al menos 7 días. Si no se detecta respuesta ovárica, la dosis diaria se incrementa gradualmente hasta que el crecimiento folicular y/o los niveles plasmáticos de estradiol indiquen una respuesta farmacodinámica adecuada. Se considera óptima una velocidad de aumento de los niveles de estradiol del 40-100% al día. Entonces, se mantiene esta dosis diaria hasta que se alcancen las condiciones de preovulación, es decir cuando se obtengan pruebas ecográficas de un folículo dominante de al menos 18 mm de diámetro y/o cuando los niveles plasmáticos de estradiol sean de 300-900 picogramos/ml (1.000-3.000 pmol/l). Normalmente, son suficientes 7 a 14 días de tratamiento para alcanzar este estado. Se interrumpe entonces la administración de Puregon y puede inducirse la ovulación administrando gonadotrofina coriónica humana (hCG).
Si el número de folículos que responden es demasiado alto, o si los niveles de estradiol aumentan demasiado rápido, es decir más del doble diariamente durante 2 ó 3 días consecutivos, debe disminuirse la dosis diaria.
Como los folículos de más de 14 mm pueden producir embarazos, los folículos múltiples preovulatorios que excedan de 14 mm presentan riesgo de gestaciones múltiples. En este caso, debe suspenderse la hCG y evitarse el embarazo para evitar gestaciones múltiples.
• Hiperestimulación ovárica controlada en programas de reproducción asistida
Se pueden aplicar diversos protocolos de estimulación. Se recomienda una dosis inicial de 100-225 UI durante los primeros 4 días, como mínimo. Posteriormente, la dosis puede ajustarse individualmente, en función de la respuesta del ovario. En los estudios clínicos se mostró que son suficientes dosis de mantenimiento de 75-375 UI durante 6 a 12 días, aunque puede ser necesario prolongar el tratamiento.
Puregon puede administrarse solo o, para evitar una luteinización prematura, en asociación con un agonista o antagonista de la GnRH. Si se usa un agonista de la GnRH, puede ser necesaria una mayor dosis total de tratamiento de Puregon para conseguir una respuesta folicular adecuada.
La respuesta ovárica se controla por evaluación ecográfica. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. Cuando la evaluación ecográfica indica la presencia de al menos tres folículos de 16-20 mm, y la respuesta al estradiol es buena (niveles plasmáticos de aproximadamente 300-400 picogramos/ml (1.000-1.300 pmol/l) para cada folículo con un diámetro mayor de
18 mm), se induce la fase final de la maduración folicular administrando hCG. La recuperación de los oocitos se realiza 34-35 horas después.
Dosificación en el varón
Puregon debe administrarse a una dosificación de 450 UI/semana, preferiblemente dividida en tres dosis de 150 UI, en asociación con hCG. Debe mantenerse el tratamiento con Puregon y hCG durante al menos de 3 a 4 meses para poder conseguir alguna mejoría en la espermatogénesis. Se recomienda un análisis del semen de 4 a 6 meses después de iniciar el tratamiento, para evaluar la respuesta. Si un paciente no ha respondido después de este periodo, se puede continuar la terapia de asociación; la experiencia clínica actual indica que puede ser necesario tratamiento durante 18 meses o más para conseguir espermatogénesis.
Población pediátrica
No existe una recomendación específica de uso para Puregon en la indicación aprobada en la población pediátrica.
Forma de administración
Con el fin de evitar que las inyecciones sean dolorosas y minimizar las pérdidas en el lugar de la inyección, Puregon debe administrarse lentamente por vía intramuscular o subcutánea. Debe alternarse el lugar de la inyección por vía subcutánea para prevenir que se produzca lipoatrofia. Una vez administrada la inyección, desechar la solución sobrante.
La inyección subcutánea de Puregon la puede realizar el mismo paciente u otra persona, siempre que el médico dé las instrucciones adecuadas. La autoadministración de Puregon sólo debe tener lugar en el caso de pacientes que se encuentren bien motivadas, que hayan sido formadas adecuadamente y que tengan acceso al consejo de un experto.
4.3 Contraindicaciones
Para varones y mujeres
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Tumores ováricos, de la mama, útero, testículos, hipófisis o hipotálamo.
Insuficiencia gonadal primaria.
Adicionalmente para mujeres
• Sangrado vaginal sin diagnosticar.
• Quistes ováricos o aumento del tamaño de los ovarios, no relacionados con un síndrome del ovario poliquístico (SOP).
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Miomas uterinos incompatibles con el embarazo.
4.4 Advertencias y precauciones especiales de empleo
Reacciones de hipersensibilidad a los antibióticos
• Puregon puede contener trazas de estreptomicina y/o neomicina. Estos antibióticos pueden causar reacciones de hipersensibilidad en personas predispuestas.
Evaluación de la infertilidad antes de iniciar el tratamiento
• Antes de comenzar el tratamiento, debe valorarse adecuadamente la infertilidad de la pareja. En particular, debe evaluarse si el paciente padece hipotiroidismo, insuficiencia suprarrenal, hiperprolactinemia y tumores hipofisarios o hipotalámicos, proporcionándole un tratamiento específico adecuado.
En mujeres
Síndrome de Hiperestimulación Ovárica (SHO)
El SHO es una enfermedad distinta al aumento del tamaño de los ovarios sin complicaciones. Los signos y síntomas clínicos del SHO leve y moderado son dolor abdominal, náuseas, diarrea, aumento de leve a moderado del tamaño de los ovarios y quistes ováricos. El SHO grave puede ser potencialmente mortal. Los signos y síntomas clínicos del SHO grave son quistes ováricos grandes , dolor abdominal agudo, ascitis, derrame pleural, hidrotórax, disnea, oliguria, alteraciones hematológicas y aumento de peso. En casos raros, puede producirse tromboembolismo venoso o arterial junto con el SHO. También se han notificado alteraciones transitorias de las pruebas de función hepática asociadas al SHO, que indican una disfunción hepática con o sin cambios morfológicos en la biopsia de hígado.
El SHO puede producirse por la administración de Gonadotropina Coriónica humana (hCG) y por el embarazo (hCG endógena). El SHO incipiente generalmente se produce dentro de los 10 días después de la administración de hCG y puede estar asociado a una respuesta ovárica excesiva a la estimulación de la gonadotropina. El SHO tardío se produce más de 10 días después de la administración de hCG, como consecuencia de las alteraciones hormonales del embarazo. Debido al riesgo de desarrollar SHO, se debe controlar a las pacientes durante al menos dos semanas después de la administración de hCG.
Las mujeres con factores de riesgo conocidos a una respuesta ovárica alta, pueden ser especialmente propensas al desarrollo de SHO durante o después del tratamiento con Puregon. En mujeres que tienen su primer ciclo de estimulación ovárica, para quienes los factores de riesgo sólo se conocen parcialmente, se recomienda la estrecha observación de los primeros signos y síntomas del SHO.
Para reducir el riesgo de SHO, se deben realizar evaluaciones ecográficas del desarrollo folicular antes del tratamiento y a intervalos regulares durante el tratamiento. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. En las TRA se produce un aumento del riesgo de SHO cuando hay 18 o más folículos de un diámetro de 11 mm o más. Cuando haya 30 o más folículos en total se aconseja interrumpir la administración de hCG.
En función de la respuesta ovárica, se pueden tener en cuenta las siguientes medidas para reducir el riesgo del SHO:
- interrumpir la estimulación posterior con una gonadotropina durante un máximo de 3 días (coasting);
- interrumpir la hCG y cancelar el ciclo de tratamiento;
- administrar una dosis inferior a 10.000 UI de hCG urinaria para desencadenar la maduración final de los ovocitos, por ejemplo 5.000 UI de hCG urinaria o
250 microgramos de hCG-rec (que es equivalente a aproximadamente 6.500 UI de hCG urinaria);
- cancelar la transferencia de embriones frescos y crioconservar los embriones;
- evitar la administración de la hCG para facilitar la fase lútea.
Si se desarrolla SHO, se debe aplicar un sistema estándar apropiado de gestión y seguimiento del SHO.
Embarazo múltiple
Se han notificado embarazos y nacimientos múltiples con todos los tratamientos con gonadotropina, incluyendo Puregon. Los embarazos múltiples, sobre todo los de orden superior, conllevan un riesgo aumentado de resultados adversos tanto maternales (complicaciones en el embarazo y en el parto) como perinatales (bajo peso al nacer). En el caso de mujeres con anovulación y sometidas a la inducción de la ovulación, el seguimiento del desarrollo folicular mediante ecografía vaginal puede ayudar a determinar si debe o no continuar el ciclo con el fin de reducir el riesgo de embarazos múltiples. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. Deberá informarse a los pacientes del potencial riesgo de nacimientos múltiples antes de iniciar el tratamiento.
En las mujeres que se someten a Técnicas de Reproducción Asistida (TRA), el riesgo de embarazo múltiple está principalmente relacionado con el número de embriones transferidos. Cuando se usa para un ciclo de inducción de la ovulación, un adecuado ajuste de la dosis de FSH debe prevenir el desarrollo de folículos múltiples.
Embarazo ectópico
Las mujeres infértiles que se someten a TRA tienen una mayor incidencia de embarazos ectópicos. Por tanto, es importante confirmar cuanto antes mediante ecografía que el embarazo sea intrauterino.
Aborto espontáneo
Los índices de embarazos fallidos en mujeres sometidas a reproducción asistida son más altos que los de la población normal.
Complicaciones vasculares
Se han notificado acontecimientos tromboembólicos, tanto en asociación como independientes del SHO después del tratamiento con gonadotropinas, incluyendo Puregon. La trombosis intravascular, que puede tener su origen en vasos venosos o arteriales, puede dar lugar a una reducción del flujo sanguíneo a los órganos vitales o a las extremidades. En mujeres con factores de riesgo de trombosis generalmente reconocidos, como antecedentes personales o familiares, obesidad grave o trombofilia, el tratamiento con gonadotropinas, incluyendo Puregon, puede aumentar aún más este riesgo. En estas mujeres se sopesarán los beneficios de la administración de gonadotropinas, incluyendo Puregon, frente a los riesgos. Sin embargo, debe tenerse en cuenta que el embarazo por si solo también conlleva un aumento del riesgo de trombosis.
Malformaciones congénitas
La incidencia de malformaciones congénitas tras la aplicación de TRA puede ser algo más elevada que con la concepción espontánea. Esto puede ser debido a diferencias en las características de los progenitores (p. ej. edad de la madre, características del semen) y embarazos múltiples.
Torsión ovárica
Se han notificado casos de torsión ovárica después del tratamiento con gonadotropinas, incluyendo Puregon. La torsión ovárica puede estar asociada con otros factores de riesgo tales como el SHO, embarazo, cirugía abdominal previa, antecedentes de torsión ovárica, quistes ováricos anteriores o actuales y ovarios poliquísticos. Debido a la reducción del riego sanguíneo, el daño en los ovarios puede ser limitado con un diagnóstico precoz y una distorsión inmediata.
Neoplasias de ovario y otras neoplasias del sistema reproductor
Se han notificado neoplasias oválicas y otras neoplasias del sistema reproductor, benignas y malignas, en mujeres que se han sometido a múltiples terapias para el tratamiento de la infertilidad. No está establecido si el tratamiento con gonadotrofinas aumenta el riesgo de estos tumores en mujeres infértiles.
Otras enfermedades
También se deben evaluar enfermedades que contraindiquen el embarazo antes de iniciar el tratamiento con Puregon.
En varones
Insuficiencia testicular primaria
En el varón, niveles elevados de FSH endógena son indicativos de insuficiencia testicular primaria. Tales pacientes no responden a la terapia con Puregon/hCG.
4.5 Interacción con otros medicamentos y otras formas de interacción
El uso conjunto de Puregon y citrato de clomifeno puede mejorar la respuesta folicular. Después de la desensibilización hipofisaria mediante un agonista de la GnRH, puede ser necesaria una dosis mayor de Puregon para producir una respuesta folicular adecuada.
4.6 Fertilidad, embarazo y lactancia
Fertilidad
Puregon se utiliza en el tratamiento de mujeres sometidas a una inducción de la ovulación o una hiperestimulación ovárica controlada en programas de reproducción asistida. En los varones, Puregon se utiliza en el tratamiento de la espermatogénesis deficiente debido a hipogonadismo hipogonadotrófico. Para la posología y forma de administración, ver sección 4.2.
Embarazo
El uso de Puregon no está indicado durante el embarazo. En caso de exposición involuntaria durante el embarazo, los datos clínicos no son suficientes para excluir un efecto teratogénico de la FSH recombinante. Sin embargo, no se ha citado ninguna malformación concreta hasta la fecha. No se observaron efectos teratogénicos en los estudios con animales.
Lactancia
No se dispone de información de ensayos clínicos o de estudios en animales sobre la excreción de folitropina beta en la leche. Es poco probable que folitropina beta se excrete en la leche humana debido a su alto peso molecular. Si folitropina beta se excretase en la leche humana, se degradaría en el tracto gastrointestinal del niño. Folitropina beta puede afectar a la producción de leche.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Puregon sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
La utilización clínica de Puregon por vía intramuscular o subcutánea puede dar lugar a reacciones en la zona de la inyección (3% de todos los pacientes tratados). La mayoría de estas reacciones locales son de carácter leve y transitorio. Se han observado poco frecuentemente (aproximadamente en un 0,2% de todos los pacientes tratados con folitropina beta) reacciones generalizadas de hipersensibilidad.
Tratamiento en la mujer:
En los ensayos clínicos, se han notificado signos y síntomas relacionados con el síndrome de hiperestimulación ovárica (SHO) aproximadamente en el 4% de las mujeres tratadas con folitropina beta (véase sección 4.4). Las reacciones adversas relacionadas con este síndrome son dolor y/o congestión pélvica, dolor y/o distensión abdominal, molestias mamarias y aumento del tamaño ovárico.
La siguiente tabla enumera las reacciones adversas relacionadas con folitropina beta notificadas en ensayos clínicos en mujeres, conforme a la clasificación por órganos y sistemas y su frecuencia; frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100).
|
Clasificación por órganos y sistemas |
Frecuencia |
Reacción adversa |
|
Trastornos del sistema nervioso |
Frecuente |
Cefalea |
|
Trastornos gastrointestinales |
Frecuente |
Distensión abdominal Dolor abdominal |
|
Poco frecuente |
Molestia abdominal Estreñimiento Diarrea Náuseas | |
|
Trastornos del aparato reproductor y de la mama |
Frecuente |
Síndrome de hiperestimulación ovárica Dolor pélvico |
|
Poco frecuente |
Molestia en mama1 Metrorragia Quiste ovárico Aumento del tamaño ovárico Torsión ovárica Aumento del tamaño uterino Hemorragia vaginal | |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente |
Reacción en la zona de inyección2 |
|
Poco frecuente |
Reacción de hipersensibilidad generalizada3 |
1. Las molestias en la mama son tensión, dolor y/o congestión y dolor en el pezón.
2. Las reacciones en la zona de inyección son: cardenales, dolor, enrojecimiento, hinchazón y picazón.
3. Reacción de hipersensibilidad generalizada incluye: eritema, urticaria, erupción y prurito.
Además, se han notificado casos de embarazo ectópico, aborto y gestaciones múltiples. Estos casos se consideran relacionados con las TRA o con el embarazo posterior.
En casos raros, se ha asociado la aparición de tromboembolismo con la terapia con folitropina beta /hCG, lo que también se ha observado durante el tratamiento con otras gonadotrofinas.
Tratamiento en el varón:
La siguiente tabla enumera las reacciones adversas relacionadas con folitropina beta notificadas en ensayos clínicos en varones (30 pacientes tratados), conforme a la clasificación por órganos y sistemas y su frecuencia; frecuentes (>1/100 a <1/10).
|
Clasificación por órganos y sistemas |
Frecuencia1 |
Reacción adversa |
|
Trastornos del sistema nervioso |
Frecuente |
Cefalea |
|
Trastornos de la piel y del tejido |
Frecuente |
Acné |
|
subcutáneo |
Erupción | |
|
Trastornos del aparato reproductor y de la mama |
Frecuente |
Quiste epididimal Ginecomastia |
|
Trastornos generales y alteraciones |
Frecuente |
Reacción en la zona de |
en el lugar de administración
inyección2
1. Las reacciones adversas que se notifican sólo una vez se muestran en la tabla como frecuentes, ya que un sólo informe eleva la frecuencia por encima del 1%.
2. Las reacciones en la zona de inyección incluyen endurecimiento y dolor.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay datos sobre la toxicidad aguda de Puregon en humanos, pero se ha demostrado que la toxicidad aguda de Puregon y de las preparaciones de gonadotrofinas urinarias en animales es muy baja. Sin embargo, una dosis demasiado alta de FSH puede conducir a hiperestimulación de los ovarios (ver sección 4.4).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotrofinas, código ATC: G03G A06.
Puregon contiene FSH recombinante, que se obtiene por tecnología del DNA recombinante, utilizando una línea celular de ovario de hámster chino transfectada con los genes de las subunidades de la FSH humana. La secuencia de aminoácidos principal es idéntica a la de la FSH humana natural. Se sabe que existen pequeñas diferencias en la cadena de carbohidratos.
Mecanismo de acción
La FSH es indispensable para el crecimiento y maduración folicular normal y en la producción de esteroides gonadales. En la mujer, el nivel de FSH es determinante en el inicio y mantenimiento del desarrollo folicular y en consecuencia, en el tiempo y número de folículos que alcanzan la madurez. Por tanto, Puregon puede utilizarse para estimular el desarrollo folicular y la producción de esteroides en casos seleccionados de alteraciones de la función gonadal. Además, Puregon puede utilizarse para promover el desarrollo folicular múltiple en programas de reproducción asistida [por ejemplo, fecundación in vitro / transferencia de embriones (FIV/TE), transferencia intratubárica de gametos (GIFT) e inyección intracitoplasmática de esperma (ICSI)]. El tratamiento con Puregon generalmente es seguido por la administración de hCG para inducir la fase final de la maduración folicular, reanudación de la meiosis y ruptura del folículo.
Eficacia clínica y seguridad
En los ensayos clínicos que comparan la FSH(rec) (folitropina beta) y la FSH urinaria para la estimulación ovárica controlada en mujeres que participan en un programa de técnicas de reproducción asistida (TRA) y para la inducción de la ovulación (ver tablas 1 y 2 adjuntas), Puregon fue más potente que la FSH urinaria, por requerir una dosis total menor y un período de tratamiento más corto para desencadenar la maduración folicular.
Para la estimulación ovárica controlada, Puregon proporcionó un mayor número de ovocitos recuperados a una dosis total menor y con un período de tratamiento más corto, en comparación con la FSH urinaria.
Tabla 1: Resultados del estudio 37.608 (estudio aleatorizado comparativo entre grupos de la seguridad y eficacia de Puregon frente a la FSH urinaria en la estimulación ovárica controlada).
Puregon
|
(n = 546) |
(n = 361) | |
|
Cifra media de ovocitos recuperados |
10,84* |
8,95 |
|
Dosis media total (n° de ampollas de 75 UI) |
28,5* |
31,8 |
|
Media de duración de la estimulación de la FSH (días) |
10,7* |
11,3 |
* Las diferencias entre los 2 grupos fueron estadísticamente significativas (p<0,05).
Para la inducción de la ovulación, la mediana de la dosis total fue inferior y la mediana de la duración del tratamiento fue más corta con Puregon comparado con la FSH urinaria.
Tabla 2: Resultados del estudio 37.609 (estudio aleatorizado comparativo entre grupos de la seguridad y eficacia de Puregon frente a la FSH urinaria en la inducción de la ovulación)._
|
Puregon (n = 105) |
u-FSH (n = 66) | |
|
Cifra media de folículos > 12 mm |
3,6* |
2,6 |
|
> 15 mm |
2,0 |
1,7 |
|
> 18 mm |
1,1 |
0,9 |
|
Mediana de dosis total (UI)a |
750* |
1.035 |
|
Mediana de duración del tratamiento (días)a |
10,0* |
13,0 |
* Las diferencias entre los 2 grupos fueron estadísticamente significativas (p<0,05). a Limitado a mujeres con inducción de la ovulación (Puregon, n = 76; u-FSH, n = 42).
5.2 Propiedades farmacocinéticas
Absorción
Después de la administración intramuscular o subcutánea de Puregon, se alcanzan concentraciones máximas de FSH en aproximadamente 12 horas. Tras la administración intramuscular de Puregon, las concentraciones máximas de FSH son más altas y se alcanzan antes en varones en comparación con las mujeres. Debido a la liberación sostenida desde el lugar de la inyección y a la semivida de eliminación de aproximadamente 40 horas (de 12 a 70 horas), los niveles de FSH permanecen altos durante 24-48 horas. Debido a la relativamente larga semivida de eliminación, la administración repetida de la misma dosis conduce a concentraciones de FSH en plasma aproximadamente 1,5-2,5 veces mayores que después de administración única, lo que contribuye a alcanzar concentraciones terapéuticas de FSH.
No existen diferencias farmacocinéticas significativas entre la administración subcutánea e intramuscular de Puregon. Ambas tienen una biodisponibilidad absoluta de aproximadamente 77%.
Distribución, biotransformación y eliminación
La FSH recombinante es bioquímicamente muy similar a la FSH urinaria humana, y se distribuye, metaboliza y excreta de la misma manera.
5.3 Datos preclínicos sobre seguridad
La administración de Puregon en dosis única a ratas no indujo efectos toxicológicos significativos. En estudios de dosis repetidas en ratas (2 semanas) y perros (13 semanas), con una dosis de hasta 100 veces la dosis máxima en humanos, Puregon no indujo efectos toxicológicos significativos. Puregon no mostró potencial mutagénico en el test de Ames ni en el test de aberración cromosómica in vitro con linfocitos humanos.
6.1 Lista de excipientes
Puregon solución inyectable contiene:
Sacarosa Citrato de sodio L-metionina Polisorbato 20
Agua para preparaciones inyectables.
Puede ajustarse el pH con hidróxido de sodio y/o ácido clorhídrico.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 3 años.
El contenido de un vial debe utilizarse inmediatamente después de perforar el tapón de goma.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar los viales en el embalaje exterior.
Para comodidad de la paciente, ésta puede conservar Puregon por debajo o a 25°C durante un único periodo de 3 meses como máximo.
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
0,5 ml de solución en vial de 3 ml (vidrio tipo I) con tapón (goma clorobutilo).
Envases de 1, 5 ó 10 viales.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
No utilizar la solución si contiene partículas o si no es transparente.
El contenido de un vial debe utilizarse inmediatamente después de perforar el tapón de goma.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Puregon 50 UI/0,5 ml solución inyectable EU/1/96/008/017
EU/1/96/008/018
EU/1/96/008/019
Puregon 75 UI/0,5 ml solución inyectable
EU/1/96/008/020
EU/1/96/008/021
EU/1/96/008/022
Puregon 100 UI/0,5 ml solución inyectable
EU/1/96/008/023
EU/1/96/008/024
EU/1/96/008/025
Puregon 150 UI/0,5 ml solución inyectable
EU/1/96/008/026
EU/1/96/008/027
EU/1/96/008/028
Puregon 200 UI/0,5 ml solución inyectable
EU/1/96/008/029
EU/1/96/008/030
EU/1/96/008/031
Puregon 225 UI/0,5 ml solución inyectable
EU/1/96/008/032
EU/1/96/008/033
EU/1/96/008/034
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización 03/mayo/1996 Fecha de la última renovación 29/mayo/2006
10. FECHA DE LA REVISIÓN DEL TEXTO
DD/mes/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Puregon 150 UI/0,18 ml solución inyectable Puregon 300 UI/0,36 ml solución inyectable Puregon 600 UI/0,72 ml solución inyectable Puregon 900 UI/1,08 ml solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Puregon 150 UI/0,18 ml solución inyectable
Un cartucho contiene una dosis total neta de 150 UI de hormona estimulante del folículo recombinante (FSH) en 0,18 ml de solución acuosa. La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO), a una concentración de 833 UI/ml de solución acuosa, lo que corresponde a 83,3 microgramos de proteína/ml (la actividad biológica específica in vivo equivale a aproximadamente 10.000 UI de FSH / mg de proteína).
Puregon 300 UI/0,36 ml solución inyectable
Un cartucho contiene una dosis total neta de 300 UI de hormona estimulante del folículo recombinante (FSH) en 0,36 ml de solución acuosa. La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO), a una concentración de 833 UI/ml de solución acuosa, lo que corresponde a 83,3 microgramos de proteína/ml (la actividad biológica específica in vivo equivale a aproximadamente 10.000 UI de FSH / mg de proteína).
Puregon 600 UI/0,72 ml solución inyectable
Un cartucho contiene una dosis total neta de 600 UI de hormona estimulante del folículo recombinante (FSH) en 0,72 ml de solución acuosa. La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO), a una concentración de 833 UI/ml de solución acuosa, lo que corresponde a 83,3 microgramos de proteína/ml (la actividad biológica específica in vivo equivale a aproximadamente 10.000 UI de FSH / mg de proteína).
Puregon 900 UI/1,08 ml solución inyectable
Un cartucho contiene una dosis total neta de 900 UI de hormona estimulante del folículo recombinante (FSH) en 1,08 ml de solución acuosa. La solución inyectable contiene el principio activo folitropina beta, fabricada mediante ingeniería genética de una línea celular de ovario de hámster chino (CHO), a una concentración de 833 UI/ml de solución acuosa, lo que corresponde a 83,3 microgramos de proteína/ml (la actividad biológica específica in vivo equivale a aproximadamente 10.000 UI de FSH / mg de proteína).
Excipiente(s) con efecto conocido
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por inyectable, por lo que se considera esencialmente "exento de sodio".
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable (inyectable).
Solución transparente e incolora.
En cartuchos, diseñados para usar conjuntamente con un inyector tipo pluma.
4.1 Indicaciones terapéuticas
En mujeres adultas:
Puregon está indicado para el tratamiento de la infertilidad femenina en las siguientes situaciones clínicas:
• Anovulación (incluyendo el síndrome del ovario poliquístico, SOP), en mujeres que no hayan respondido al tratamiento con citrato de clomifeno.
• Hiperestimulación ovárica controlada para inducir el desarrollo de folículos múltiples en programas de reproducción asistida [por ejemplo, fecundación in vitro / transferencia de embriones (FIV/TE), transferencia intratubárica de gametos (GIFT) e inyección intracitoplasmática de esperma (ICSI)].
En varones adultos:
• Espermatogénesis deficiente debida a hipogonadismo hipogonadotrófico.
4.2 Posología y forma de administración
El tratamiento con Puregon debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de los problemas de la fertilidad.
La primera inyección de Puregon debe administrarse bajo supervisión médica directa.
Posología
Dosificación en la mujer
Existen grandes variaciones inter e intraindividuales en la respuesta de los ovarios a las gonadotrofinas exógenas, por lo que se hace imposible establecer un esquema de dosificación uniforme. Por tanto, la dosis debe ajustarse individualmente dependiendo de la respuesta del ovario. Para ello se requiere una evaluación ecográfica del desarrollo folicular. También puede ser útil la determinación simultánea de los niveles séricos de estradiol.
Al utilizar el inyector tipo pluma debe tenerse en cuenta que se trata de un dispositivo de precisión que dispensa con exactitud la dosis que se ha fijado. Se demostró que, por término medio, la pluma administra una cantidad de FSH un 18% mayor que una jeringa convencional. Esto puede ser particularmente importante si se cambia de una jeringa convencional al inyector tipo pluma o viceversa en el transcurso de un ciclo. Sobre todo al pasar de jeringa a pluma pueden ser necesarios pequeños ajustes de la dosis, para prevenir la administración de una dosis demasiado alta.
En base a los resultados de ensayos clínicos comparativos, se recomienda administrar una dosis total menor de Puregon durante un período de tratamiento más corto que el que se utiliza habitualmente para la FSH urinaria, no sólo para optimizar el desarrollo folicular, sino también para reducir el riesgo de hiperestimulación ovárica indeseada (ver sección 5.1).
La experiencia clínica con Puregon se basa en datos de hasta tres ciclos de tratamiento en ambas indicaciones. La experiencia global con la FIV indica que en general, el índice de éxito con el tratamiento se mantiene estable en los cuatro primeros intentos y posteriormente declina gradualmente.
• Anovulación
En general se recomienda un esquema de tratamiento secuencial, empezando con la administración diaria de 50 UI de Puregon, dosis que se mantiene durante al menos 7 días. Si no se detecta respuesta ovárica, la dosis diaria se incrementa gradualmente hasta que el crecimiento folicular y/o los niveles plasmáticos de estradiol indiquen una respuesta farmacodinámica adecuada. Se considera óptima una velocidad de aumento de los niveles de estradiol del 40-100% al día. Entonces, se mantiene esta dosis diaria hasta que se alcancen las condiciones de preovulación, es decir cuando se obtengan pruebas ecográficas de un folículo dominante de al menos 18 mm de diámetro y/o cuando los niveles plasmáticos de estradiol sean de 300-900 picogramos/ml (1.000-3.000 pmol/l). Normalmente, son suficientes 7 a 14 días de tratamiento para alcanzar este estado. Se interrumpe entonces la administración de Puregon y puede inducirse la ovulación administrando gonadotrofina coriónica humana (hCG).
Si el número de folículos que responden es demasiado alto, o si los niveles de estradiol aumentan demasiado rápido, es decir más del doble diariamente durante 2 ó 3 días consecutivos, debe disminuirse la dosis diaria.
Como los folículos de más de 14 mm pueden producir embarazos, los folículos múltiples preovulatorios que excedan de 14 mm presentan riesgo de gestaciones múltiples. En este caso, debe suspenderse la hCG y evitarse el embarazo para evitar gestaciones múltiples.
• Hiperestimulación ovárica controlada en programas de reproducción asistida
Se pueden aplicar diversos protocolos de estimulación. Se recomienda una dosis inicial de 100-225 UI durante los primeros 4 días, como mínimo. Posteriormente, la dosis puede ajustarse individualmente, en función de la respuesta del ovario. En los estudios clínicos se mostró que son suficientes dosis de mantenimiento de 75-375 UI durante 6 a 12 días, aunque puede ser necesario prolongar el tratamiento.
Puregon puede administrarse solo o, para evitar una luteinización prematura, en asociación con un agonista o antagonista de la GnRH. Si se usa un agonista de la GnRH, puede ser necesaria una mayor dosis total de tratamiento de Puregon para conseguir una respuesta folicular adecuada.
La respuesta ovárica se controla por evaluación ecográfica. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. Cuando la evaluación ecográfica indica la presencia de al menos tres folículos de 16-20 mm, y la respuesta al estradiol es buena (niveles plasmáticos de aproximadamente 300-400 picogramos/ml (1.000-1.300 pmol/l) para cada folículo con un diámetro mayor de
18 mm), se induce la fase final de la maduración folicular administrando hCG. La recuperación de los oocitos se realiza 34-35 horas después.
Dosificación en el varón
Puregon debe administrarse a una dosificación de 450 UI/semana, preferiblemente dividida en tres dosis de 150 UI, en asociación con hCG. Debe mantenerse el tratamiento con Puregon y hCG durante al menos de 3 a 4 meses para poder conseguir alguna mejoría en la espermatogénesis. Se recomienda un análisis del semen de 4 a 6 meses después de iniciar el tratamiento, para evaluar la respuesta. Si un paciente no ha respondido después de este periodo, se puede continuar la terapia de asociación; la experiencia clínica actual indica que puede ser necesario tratamiento durante 18 meses o más para conseguir espermatogénesis.
Población pediátrica
No existe una recomendación específica de uso para Puregon en la indicación aprobada en la población pediátrica.
Forma de administración
Puregon solución inyectable en cartuchos se ha desarrollado para su administración mediante el inyector tipo pluma Puregon Pen, por vía subcutánea. Debe alternarse el lugar de la inyección para prevenir que se produzca lipoatrofia.
La paciente puede inyectarse Puregon con el inyector tipo pluma, siempre que el médico le proporcione las instrucciones adecuadas.
4.3 Contraindicaciones
Para varones y mujeres
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Tumores ováricos, de la mama, útero, testículos, hipófisis o hipotálamo.
• Insuficiencia gonadal primaria.
Adicionalmente para mujeres
• Sangrado vaginal sin diagnosticar.
• Quistes ováricos o aumento del tamaño de los ovarios, no relacionados con un síndrome del ovario poliquístico (SOP).
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
Miomas uterinos incompatibles con el embarazo.
4.4 Advertencias y precauciones especiales de empleo
Reacciones de hipersensibilidad a los antibióticos
• Puregon puede contener trazas de estreptomicina y/o neomicina. Estos antibióticos pueden causar reacciones de hipersensibilidad en personas predispuestas.
Evaluación de la infertilidad antes de iniciar el tratamiento
• Antes de comenzar el tratamiento, debe valorarse adecuadamente la infertilidad de la pareja. En particular, debe evaluarse si el paciente padece hipotiroidismo, insuficiencia suprarrenal, hiperprolactinemia y tumores hipofisarios o hipotalámicos, proporcionándole un tratamiento específico adecuado.
En mujeres
Síndrome de Hiperestimulación Ovárica (SHO)
El SHO es una enfermedad distinta al aumento del tamaño de los ovarios sin complicaciones. Los signos y síntomas clínicos del SHO leve y moderado son dolor abdominal, náuseas, diarrea, aumento de leve a moderado del tamaño de los ovarios y quistes ováricos. El SHO grave puede ser potencialmente mortal. Los signos y síntomas clínicos del SHO grave son quistes ováricos grandes , dolor abdominal agudo, ascitis, derrame pleural, hidrotórax, disnea, oliguria, alteraciones hematológicas y aumento de peso. En casos raros, puede producirse tromboembolismo venoso o arterial junto con el SHO. También se han notificado alteraciones transitorias de las pruebas de función hepática asociadas al SHO, que indican una disfunción hepática con o sin cambios morfológicos en la biopsia de hígado.
El SHO puede producirse por la administración de Gonadotropina Coriónica humana (hCG) y por el embarazo (hCG endógena). El SHO incipiente generalmente se produce dentro de los 10 días después de la administración de hCG y puede estar asociado a una respuesta ovárica excesiva a la estimulación de la gonadotropina. El SHO tardío se produce más de 10 días después de la administración de hCG, como consecuencia de las alteraciones hormonales del embarazo. Debido al riesgo de desarrollar SHO, se debe controlar a las pacientes durante al menos dos semanas después de la administración de hCG.
Las mujeres con factores de riesgo conocidos a una respuesta ovárica alta, pueden ser especialmente propensas al desarrollo de SHO durante o después del tratamiento con Puregon. En mujeres que tienen su primer ciclo de estimulación ovárica, para quienes los factores de riesgo sólo se conocen parcialmente, se recomienda la estrecha observación de los primeros signos y síntomas del SHO.
Para reducir el riesgo de SHO, se deben realizar evaluaciones ecográficas del desarrollo folicular antes del tratamiento y a intervalos regulares durante el tratamiento. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. En las TRA se produce un aumento del riesgo de SHO cuando hay 18 o más folículos de un diámetro de 11 mm o más. Cuando haya 30 o más folículos en total se aconseja interrumpir la administración de hCG.
En función de la respuesta ovárica, se pueden tener en cuenta las siguientes medidas para reducir el riesgo del SHO:
- interrumpir la estimulación posterior con una gonadotropina durante un máximo de 3 días (coasting);
- interrumpir la hCG y cancelar el ciclo de tratamiento;
- administrar una dosis inferior a 10.000 UI de hCG urinaria para desencadenar la maduración final de los ovocitos, por ejemplo 5.000 UI de hCG urinaria o
250 microgramos de hCG-rec (que es equivalente a aproximadamente 6.500 UI de hCG urinaria);
- cancelar la transferencia de embriones frescos y crioconservar los embriones;
- evitar la administración de la hCG para facilitar la fase lútea.
Si se desarrolla SHO, se debe aplicar un sistema estándar apropiado de gestión y seguimiento del SHO.
Embarazo múltiple
Se han notificado embarazos y nacimientos múltiples con todos los tratamientos con gonadotropina, incluyendo Puregon. Los embarazos múltiples, sobre todo los de orden superior, conllevan un riesgo aumentado de resultados adversos tanto maternales (complicaciones en el embarazo y en el parto) como perinatales (bajo peso al nacer). En el caso de mujeres con anovulación y sometidas a la inducción de la ovulación, el seguimiento del desarrollo folicular mediante ecografía vaginal puede ayudar a determinar si debe o no continuar el ciclo con el fin de reducir el riesgo de embarazos múltiples. También puede ser útil la determinación simultánea de los niveles séricos de estradiol. Deberá informarse a los pacientes del potencial riesgo de nacimientos múltiples antes de iniciar el tratamiento.
En las mujeres que se someten a Técnicas de Reproducción Asistida (TRA), el riesgo de embarazo múltiple está principalmente relacionado con el número de embriones transferidos. Cuando se usa para un ciclo de inducción de la ovulación, un adecuado ajuste de la dosis de FSH debe prevenir el desarrollo de folículos múltiples.
Embarazo ectópico
Las mujeres infértiles que se someten a TRA tienen una mayor incidencia de embarazos ectópicos. Por tanto, es importante confirmar cuanto antes mediante ecografía que el embarazo sea intrauterino.
Aborto espontáneo
Los índices de embarazos fallidos en mujeres sometidas a reproducción asistida son más altos que los de la población normal.
Complicaciones vasculares
Se han notificado acontecimientos tromboembólicos, tanto en asociación como independientes del SHO después del tratamiento con gonadotropinas, incluyendo Puregon. La trombosis intravascular, que puede tener su origen en vasos venosos o arteriales, puede dar lugar a una reducción del flujo sanguíneo a los órganos vitales o a las extremidades. En mujeres con factores de riesgo de trombosis generalmente reconocidos, como antecedentes personales o familiares, obesidad grave o trombofilia, el tratamiento con gonadotropinas, incluyendo Puregon, puede aumentar aún más este riesgo. En estas mujeres se sopesarán los beneficios de la administración de gonadotropinas, incluyendo Puregon, frente a los riesgos. Sin embargo, debe tenerse en cuenta que el embarazo por si solo también conlleva un aumento del riesgo de trombosis.
Malformaciones congénitas
La incidencia de malformaciones congénitas tras la aplicación de TRA puede ser algo más elevada que con la concepción espontánea. Esto puede ser debido a diferencias en las características de los progenitores (p. ej. edad de la madre, características del semen) y embarazos múltiples.
Torsión ovárica
Se han notificado casos de torsión ovárica después del tratamiento con gonadotropinas, incluyendo Puregon. La torsión ovárica puede estar asociada con otros factores de riesgo tales como el SHO, embarazo, cirugía abdominal previa, antecedentes de torsión ovárica, quistes ováricos anteriores o actuales y ovarios poliquísticos. Debido a la reducción del riego sanguíneo, el daño en los ovarios puede ser limitado con un diagnóstico precoz y una distorsión inmediata.
Neoplasias de ovario y otras neoplasias del sistema reproductor
Se han notificado neoplasias ováricas y otras neoplasias del sistema reproductor, benignas y malignas, en mujeres que se han sometido a múltiples terapias para el tratamiento de la infertilidad. No está establecido si el tratamiento con gonadotrofinas aumenta el riesgo de estos tumores en mujeres infértiles.
Otras enfermedades
También se deben evaluar enfermedades que contraindiquen el embarazo antes de iniciar el tratamiento con Puregon.
En varones
Insuficiencia testicular primaria
En el varón, niveles elevados de FSH endógena son indicativos de insuficiencia testicular primaria. Tales pacientes no responden a la terapia con Puregon/hCG.
4.5 Interacción con otros medicamentos y otras formas de interacción
El uso conjunto de Puregon y citrato de clomifeno puede mejorar la respuesta folicular. Después de la desensibilización hipofisaria mediante un agonista de la GnRH, puede ser necesaria una dosis mayor de Puregon para producir una respuesta folicular adecuada.
4.6 Fertilidad, embarazo y lactancia
Fertilidad
Puregon se utiliza en el tratamiento de mujeres sometidas a una inducción de la ovulación o una hiperestimulación ovárica controlada en programas de reproducción asistida. En los varones, Puregon se utiliza en el tratamiento de la espermatogénesis deficiente debido a hipogonadismo hipogonadotrófico. Para la posología y forma de administración, ver sección 4.2.
Embarazo
El uso de Puregon no está indicado durante el embarazo. En caso de exposición involuntaria durante el embarazo, los datos clínicos no son suficientes para excluir un efecto teratogénico de la FSH recombinante. Sin embargo, no se ha citado ninguna malformación concreta hasta la fecha. No se observaron efectos teratogénicos en los estudios con animales.
Lactancia
No se dispone de información de ensayos clínicos o de estudios en animales sobre la excreción de folitropina beta en la leche. Es poco probable que folitropina beta se excrete en la leche humana debido a su alto peso molecular. Si folitropina beta se excretase en la leche humana, se degradaría en el tracto gastrointestinal del niño. Folitropina beta puede afectar a la producción de leche.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Puregon sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
La utilización clínica de Puregon por vía intramuscular o subcutánea puede dar lugar a reacciones en la zona de la inyección (3% de todos los pacientes tratados). La mayoría de estas reacciones locales son de carácter leve y transitorio. Se han observado poco frecuentemente (aproximadamente en un 0,2% de todos los pacientes tratados con folitropina beta) reacciones generalizadas de hipersensibilidad.
Tratamiento en la mujer:
En los ensayos clínicos, se han notificado signos y síntomas relacionados con el síndrome de hiperestimulación ovárica (SHO) aproximadamente en el 4% de las mujeres tratadas con folitropina beta (véase sección 4.4). Las reacciones adversas relacionadas con este síndrome son dolor y/o congestión pélvica, dolor y/o distensión abdominal, molestias mamarias y aumento del tamaño ovárico.
La siguiente tabla enumera las reacciones adversas relacionadas con folitropina beta notificadas en ensayos clínicos en mujeres, conforme a la clasificación por órganos y sistemas y su frecuencia; frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100).
|
Clasificación por órganos y sistemas |
Frecuencia |
Reacción adversa |
|
Trastornos del sistema nervioso |
Frecuente |
Cefalea |
|
Trastornos gastrointestinales |
Frecuente |
Distensión abdominal Dolor abdominal |
|
Poco frecuente |
Molestia abdominal Estreñimiento Diarrea Náuseas | |
|
Trastornos del aparato reproductor y de la mama |
Frecuente |
Síndrome de hiperestimulación ovárica Dolor pélvico |
|
Poco frecuente |
Molestia en mama1 Metrorragia Quiste ovárico Aumento del tamaño ovárico Torsión ovárica Aumento del tamaño uterino Hemorragia vaginal | |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente |
Reacción en la zona de inyección2 |
|
Poco frecuente |
Reacción de hipersensibilidad generalizada3 |
1. Las molestias en la mama son tensión, dolor y/o congestión y dolor en el pezón.
2. Las reacciones en la zona de inyección son: cardenales, dolor, enrojecimiento, hinchazón y picazón.
3. Reacción de hipersensibilidad generalizada incluye: eritema, urticaria, erupción y prurito.
Además, se han notificado casos de embarazo ectópico, aborto y gestaciones múltiples. Estos casos se consideran relacionados con las TRA o con el embarazo posterior.
En casos raros, se ha asociado la aparición de tromboembolismo con la terapia con folitropina beta/hCG, lo que también se ha observado durante el tratamiento con otras gonadotrofinas.
Tratamiento en el varón:
La siguiente tabla enumera las reacciones adversas relacionadas con folitropina beta notificadas en ensayos clínicos en varones (30 pacientes tratados), conforme a la clasificación por órganos y sistemas y su frecuencia; frecuentes (>1/100 a <1/10).
|
Clasificación por órganos y sistemas |
Frecuencia1 |
Reacción adversa |
|
Trastornos del sistema nervioso |
Frecuente |
Cefalea |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuente |
Acné Erupción |
|
Trastornos del aparato reproductor y de la mama |
Frecuente |
Quiste epididimal Ginecomastia |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuente |
Reacción en la zona de inyección2 |
1. Las reacciones adversas que se notifican sólo una vez se muestran en la tabla como frecuentes, ya que
un sólo informe eleva la frecuencia por encima del 1%.
2. Las reacciones en la zona de inyección incluyen endurecimiento y dolor.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay datos sobre la toxicidad aguda de Puregon en humanos, pero se ha demostrado que la toxicidad aguda de Puregon y de las preparaciones de gonadotrofinas urinarias en animales es muy baja. Sin embargo, una dosis demasiado alta de FSH puede conducir a hiperestimulación de los ovarios (ver sección 4.4).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotrofinas, código ATC: G03G A06.
Puregon contiene FSH recombinante, que se obtiene por tecnología del DNA recombinante, utilizando una línea celular de ovario de hámster chino transfectada con los genes de las subunidades de la FSH humana. La secuencia de aminoácidos principal es idéntica a la de la FSH humana natural. Se sabe que existen pequeñas diferencias en la cadena de carbohidratos.
Mecanismo de acción
La FSH es indispensable para el crecimiento y maduración folicular normal y en la producción de esteroides gonadales. En la mujer, el nivel de FSH es determinante en el inicio y mantenimiento del desarrollo folicular y en consecuencia, en el tiempo y número de folículos que alcanzan la madurez. Por tanto, Puregon puede utilizarse para estimular el desarrollo folicular y la producción de esteroides en casos seleccionados de alteraciones de la función gonadal. Además, Puregon puede utilizarse para promover el desarrollo folicular múltiple en programas de reproducción asistida [por ejemplo, fecundación in vitro / transferencia de embriones (FIV/TE), transferencia intratubárica de gametos (GIFT) e inyección intracitoplasmática de esperma (ICSI)]. El tratamiento con Puregon generalmente es seguido por la administración de hCG para inducir la fase final de la maduración folicular, reanudación de la meiosis y ruptura del folículo.
Eficacia clínica y seguridad
En los ensayos clínicos que comparan la FSH(rec) (folitropina beta) y la FSH urinaria para la estimulación ovárica controlada en mujeres que participan en un programa de técnicas de reproducción asistida (TRA) y para la inducción de la ovulación (ver tablas 1 y 2 adjuntas), Puregon fue más potente que la FSH urinaria, por requerir una dosis total menor y un período de tratamiento más corto para desencadenar la maduración folicular.
Para la estimulación ovárica controlada, Puregon proporcionó un mayor número de ovocitos recuperados a una dosis total menor y con un período de tratamiento más corto, en comparación con la FSH urinaria.
Tabla 1: Resultados del estudio 37.608 (estudio aleatorizado comparativo entre grupos de la seguridad y eficacia de Puregon frente a la FSH urinaria en la estimulación ovárica controlada)._
|
Puregon (n = 546) |
u-FSH (n = 361) | |
|
Cifra media de ovocitos recuperados |
10,84* |
8,95 |
|
Dosis media total (n° de ampollas de 75 UI) |
28,5* |
31,8 |
Media de duración de la estimulación de la FSH (días) 10,7*
* Las diferencias entre los 2 grupos fueron estadísticamente significativas (p<0,05).
Para la inducción de la ovulación, la mediana de la dosis total fue inferior y la mediana de la duración del tratamiento fue más corta con Puregon comparado con la FSH urinaria.
Tabla 2: Resultados del estudio 37.609 (estudio aleatorizado comparativo entre grupos de la seguridad y eficacia de Puregon frente a la FSH urinaria en la inducción de la ovulación)._
|
Puregon (n = 105) |
u-FSH (n = 66) | |
|
Cifra media de folículos > 12 mm |
3,6* |
2,6 |
|
> 15 mm |
2,0 |
1,7 |
|
> 18 mm |
1,1 |
0,9 |
|
Mediana de dosis total (UI)a |
750* |
1.035 |
|
Mediana de duración del tratamiento (días)a |
10,0* |
13,0 |
* Las diferencias entre los 2 grupos fueron estadísticamente significativas (p<0,05). a Limitado a mujeres con inducción de la ovulación (Puregon, n = 76; u-FSH, n = 42).
5.2 Propiedades farmacocinéticas
Absorción
Después de la administración subcutánea de Puregon, se alcanza la concentración máxima de FSH en aproximadamente 12 horas. Debido a la liberación sostenida desde el lugar de la inyección y a la semivida de eliminación de aproximadamente 40 horas (de 12 a 70 horas), los niveles de FSH permanecen altos durante 24-48 horas. Debido a la relativamente larga semivida de eliminación, la administración repetida de la misma dosis conduce a concentraciones de FSH en plasma aproximadamente 1,5-2,5 veces mayores que después de administración única, lo que contribuye a alcanzar concentraciones terapéuticas de FSH.
La biodisponibilidad absoluta de Puregon cuando se administra por vía subcutánea es de aproximadamente un 77%.
Distribución, biotransformación y eliminación
La FSH recombinante es bioquímicamente muy similar a la FSH urinaria humana, y se distribuye, metaboliza y excreta de la misma manera.
5.3 Datos preclínicos sobre seguridad
La administración de Puregon en dosis única a ratas no indujo efectos toxicológicos significativos. En estudios de dosis repetidas en ratas (2 semanas) y perros (13 semanas), con una dosis de hasta 100 veces la dosis máxima en humanos, Puregon no indujo efectos toxicológicos significativos. Puregon no mostró potencial mutagénico en el test de Ames ni en el test de aberración cromosómica in vitro con linfocitos humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Puregon solución inyectable contiene:
Sacarosa
Citrato de sodio
L-metionina
Polisorbato 20
Alcohol bencílico
Agua para preparaciones inyectables.
Puede ajustarse el pH con hidróxido de sodio y/o ácido clorhídrico.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 3 años.
Una vez perforada la membrana de goma del cartucho con una aguja, el producto puede guardarse durante 28 días, como máximo.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar el cartucho en el embalaje exterior.
Para comodidad de la paciente, ésta puede conservar Puregon por debajo o a 25°C durante un único periodo de 3 meses como máximo.
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase Puregon 150 UI/0,18 ml solución inyectable
0,18 ml de solución en cartucho de 1,5 ml (vidrio tipo I) con un pistón de goma gris y una cápsula precinto de aluminio y membrana interna de goma.
Envase de 1 cartucho y 3 agujas para usar con el inyector tipo pluma Puregon Pen.
Los cartuchos contienen como mínimo 225 UI de actividad FSH en 0,270 ml de solución acuosa, suficiente para una dosis neta total de 150 UI.
Puregon 300 UI/0,36 ml solución inyectable
0,36 ml de solución en cartucho de 1,5 ml (vidrio tipo I) con un pistón de goma gris y una cápsula precinto de aluminio y membrana interna de goma.
Envase de 1 cartucho y 6 agujas para usar con el inyector tipo pluma Puregon Pen.
Los cartuchos contienen como mínimo 400 UI de actividad FSH en 0,480 ml de solución acuosa, suficiente para una dosis neta total de 300 UI.
Puregon 600 UI/0,72 ml solución inyectable
0,72 ml de solución en cartucho de 1,5 ml (vidrio tipo I) con un pistón de goma gris y una cápsula precinto de aluminio y membrana interna de goma.
Envase de 1 cartucho y 6 agujas para usar con el inyector tipo pluma Puregon Pen.
Los cartuchos contienen como mínimo 700 UI de actividad FSH en 0,840 ml de solución acuosa, suficiente para una dosis neta total de 600 UI.
Puregon 900 UI/1,08 ml solución inyectable
1,08 ml de solución en cartucho de 1,5 ml (vidrio tipo I) con un pistón de goma gris y una cápsula precinto de aluminio y membrana interna de goma.
Envase de 1 cartucho y 9 agujas para usar con el inyector tipo pluma Puregon Pen.
Los cartuchos contienen 1.025 UI de actividad FSH en 1,230 ml de solución acuosa, suficiente para una dosis neta total de 900 UI.
6.6 Precauciones especiales de eliminación y otras manipulaciones
No utilizar la solución si contiene partículas o si no es transparente.
Puregon solución inyectable se ha diseñado para usarse conjuntamente con el inyector tipo pluma Puregon Pen. Deben seguirse cuidadosamente las instrucciones de uso del inyector.
Eliminar las burbujas de aire del cartucho antes de inyectar (ver instrucciones de uso del inyector). No rellenar los cartuchos vacíos.
El diseño de los cartuchos de Puregon no permite mezclar ningún otro medicamento en el cartucho. Desechar las agujas usadas inmediatamente después de la inyección.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Puregon 150 UI/0,18 ml solución inyectable EU/1/96/008/040
Puregon 300 UI/0,36 ml solución inyectable EU/1/96/008/038
Puregon 600 UI/0,72 ml solución inyectable EU/1/96/008/039
Puregon 900 UI/1,08 ml solución inyectable EU/1/96/008/041
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización 03/mayo/1996 Fecha de la última renovación 29/mayo/2006
10. FECHA DE LA REVISIÓN DEL TEXTO
DD/mes/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico N.V. Organon
Kloosterstraat 6, 5349 AB Oss Veersemeer 4, 5347 JN Oss Países Bajos
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
Puregon solución inyectable en viales 50 UI/0,5 ml, 75 UI/0,5 ml, 100 UI/0,5 ml, 150 UI/0,5 ml, 200 UI/0,5 ml, 225 UI/0,5 ml:
N.V. Organon Kloosterstraat 6 5349 AB Oss Países Bajos
Puregon solución inyectable en cartuchos 150 UI/0,18 ml, 300 UI/0,36 ml, 600 UI/0,72 ml, 900 UI/1,08 ml:
N.V. Organon Kloosterstraat 6 5349 AB Oss Países Bajos
Organon (Ireland) Ltd.
P.O. Box 2857 Swords, Co. Dublín Irlanda
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107 quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
No procede.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Puregon 50 UI/0,5 ml solución inyectable folitropina beta
1 vial contiene 0,5 ml de folitropina beta, que corresponde a:
50 UI (100 UI/ml) de actividad hormona estimulante del folículo recombinante (FSH).
Excipientes: sacarosa, citrato de sodio, L-metionina y polisorbato 20 en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable 1 vial de 0,5 ml 5 viales de 0,5 ml 10 viales de 0,5 ml
Vía intramuscular (IM) y subcutánea
Usar inmediatamente el contenido del vial una vez perforado el tapón de goma. Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el vial en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/017
EU/1/96/008/018
EU/1/96/008/019
Lote
VIAL TEXTO Puregon 50 UI/0,5 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 50 UI/0,5 ml inyectable folitropina beta
IM y vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
MSD
Puregon 75 UI/0,5 ml solución inyectable folitropina beta
1 vial contiene 0,5 ml de folitropina beta, que corresponde a:
75 UI (150 UI/ml) de actividad hormona estimulante del folículo recombinante (FSH).
Excipientes: sacarosa, citrato de sodio, L-metionina y polisorbato 20 en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable 1 vial de 0,5 ml 5 viales de 0,5 ml 10 viales de 0,5 ml
Vía intramuscular (IM) y subcutánea
Usar inmediatamente el contenido del vial una vez perforado el tapón de goma. Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el vial en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/020
EU/1/96/008/021
EU/1/96/008/022
Lote
VIAL TEXTO Puregon 75 UI/0,5 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 75 UI/0,5 ml inyectable folitropina beta
IM y vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
MSD
Puregon 100 UI/0,5 ml solución inyectable folitropina beta
1 vial contiene 0,5 ml de folitropina beta, que corresponde a:
100 UI (200 UI/ml) de actividad hormona estimulante del folículo recombinante (FSH).
Excipientes: sacarosa, citrato de sodio, L-metionina y polisorbato 20 en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable 1 vial de 0,5 ml 5 viales de 0,5 ml 10 viales de 0,5 ml
Vía intramuscular (IM) y subcutánea
Usar inmediatamente el contenido del vial una vez perforado el tapón de goma. Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Almacenamiento por el farmacéutico
Conservar entre 2°C - 8°C (en nevera). No congelar.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el vial en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/023
EU/1/96/008/024
EU/1/96/008/025
Lote
VIAL TEXTO Puregon 100 UI/0,5 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 100 UI/0,5 ml inyectable folitropina beta
IM y vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE DEL FABRICANTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
MSD
Puregon 150 UI/0,5 ml solución inyectable folitropina beta
1 vial contiene 0,5 ml de folitropina beta, que corresponde a:
150 UI (300 UI/ml) de actividad hormona estimulante del folículo recombinante (FSH).
Excipientes: sacarosa, citrato de sodio, L-metionina y polisorbato 20 en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable 1 vial de 0,5 ml 5 viales de 0,5 ml 10 viales de 0,5 ml
Vía intramuscular (IM) y subcutánea
Usar inmediatamente el contenido del vial una vez perforado el tapón de goma. Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Almacenamiento por el farmacéutico
Conservar entre 2°C - 8°C (en nevera). No congelar.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera).No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el vial en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/026
EU/1/96/008/027
EU/1/96/008/028
Lote
VIAL TEXTO Puregon 150 UI/0,5 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 150 UI/0,5 ml inyectable folitropina beta
IM y vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
MSD
Puregon 200 UI/0,5 ml solución inyectable folitropina beta
1 vial contiene 0,5 ml de folitropina beta, que corresponde a:
200 UI (400 UI/ml) de actividad hormona estimulante del folículo recombinante (FSH).
Excipientes: sacarosa, citrato de sodio, L-metionina y polisorbato 20 en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable 1 vial de 0,5 ml 5 viales de 0,5 ml 10 viales de 0,5 ml
Vía intramuscular (IM) y subcutánea
Usar inmediatamente el contenido del vial una vez perforado el tapón de goma. Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el vial en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/029
EU/1/96/008/030
EU/1/96/008/031
Lote
VIAL TEXTO Puregon 200 UI/0,5 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 200 UI/0,5 ml inyectable folitropina beta
IM y vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
MSD
Puregon 225 UI/0,5 ml solución inyectable folitropina beta
1 vial contiene 0,5 ml de folitropina beta, que corresponde a:
225 UI (450 UI/ml) de actividad hormona estimulante del folículo recombinante (FSH).
Excipientes: sacarosa, citrato de sodio, L-metionina y polisorbato 20 en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable 1 vial de 0,5 ml 5 viales de 0,5 ml 10 viales de 0,5 ml
Vía intramuscular (IM) y subcutánea
Usar inmediatamente el contenido del vial una vez perforado el tapón de goma. Para un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el vial en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/032
EU/1/96/008/033
EU/1/96/008/034
Lote
VIAL TEXTO Puregon 225 UI/0,5 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 225 UI/0,5 ml inyectable folitropina beta
IM y vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
MSD
Puregon 150 UI/0,18 ml solución inyectable folitropina beta
225 UI de actividad recombinante FSH/0,270 ml Contenido neto 150 UI
Excipientes: sacarosa, citrato de sodio, L-metionina, polisorbato 20 y alcohol bencílico en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable 1 cartucho
1 envase con 3 agujas para el inyector
Vía subcutánea
Sólo se puede usar con la pluma Puregon Pen.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Almacenamiento por el farmacéutico
Conservar entre 2°C - 8°C (en nevera). No congelar.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el cartucho en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/040
Lote
Se acepta la justificación para no incluir la información en Braille
CARTUCHO TEXTO Puregon 150 UI/0,18 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 150 UI/0,18 ml inyectable folitropina beta
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,270 ml
6. OTROS
MSD
Puregon 300 UI/0,36 ml solución inyectable folitropina beta
400 UI de actividad recombinante FSH/0,480 ml Contenido neto 300 UI
Excipientes: sacarosa, citrato de sodio, L-metionina, polisorbato 20 y alcohol bencílico en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable
1 cartucho
2 envases con 3 agujas para el inyector
Vía subcutánea
Sólo se puede usar con la pluma Puregon Pen.
Leer el prospecto antes de utilizar este medicamento
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Almacenamiento por el farmacéutico
Conservar entre 2°C - 8°C (en nevera). No congelar.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el cartucho en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/038
Lote
Se acepta la justificación para no incluir la información en Braille
CARTUCHO TEXTO Puregon 300 UI/0,36 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 300 UI/0,36 ml inyectable folitropina beta
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,480 ml
6. OTROS
MSD
Puregon 600 UI/0,72 ml solución inyectable folitropina beta
700 UI de actividad recombinante FSH/0,840 ml Contenido neto 600 UI
Excipientes: sacarosa, citrato de sodio, L-metionina, polisorbato 20 y alcohol bencílico en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable
1 cartucho
2 envases con 3 agujas para el inyector
Vía subcutánea
Sólo se puede usar con la pluma Puregon Pen.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Almacenamiento por el farmacéutico
Conservar entre 2°C - 8°C (en nevera). No congelar.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el cartucho en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/039
Lote
Se acepta la justificación para no incluir la información en Braille
CARTUCHO TEXTO Puregon 600 UI/0,72 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 600 UI/0,72 ml inyectable folitropina beta
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,840 ml
6. OTROS
MSD
Puregon 900 UI/1,08 ml solución inyectable folitropina beta
1.025 UI de actividad recombinante FSH/1,230 ml Contenido neto 900 UI
Excipientes: sacarosa, citrato de sodio, L-metionina, polisorbato 20 y alcohol bencílico en agua para inyección; ajuste del pH: hidróxido de sodio y/o ácido clorhídrico.
Solución inyectable 1 cartucho
3 envases con 3 agujas para el inyector
Vía subcutánea
Sólo se puede usar con la pluma Puregon Pen.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Almacenamiento por el farmacéutico
Conservar entre 2°C - 8°C (en nevera). No congelar.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo. Conservar el cartucho en el embalaje exterior.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/96/008/041
Lote
Se acepta la justificación para no incluir la información en Braille
CARTUCHO TEXTO Puregon 900 UI/1,08 ml_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Puregon 900 UI/1,08 ml inyectable folitropina beta
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1,230 ml
6. OTROS
MSD
B. PROSPECTO
Prospecto: información para el usuario
Puregon 50 UI/0,5 ml solución inyectable Puregon 75 UI/0,5 ml solución inyectable Puregon 100 UI/0,5 ml solución inyectable Puregon 150 UI/0,5 ml solución inyectable Puregon 200 UI/0,5 ml solución inyectable Puregon 225 UI/0,5 ml solución inyectable folitropina beta
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Puregon y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Puregon
3. Cómo usar Puregon
4. Posibles efectos adversos
5. Conservación de Puregon
6. Contenido del envase e información adicional
1. Qué es Puregon y para qué se utiliza
Puregon solución inyectable contiene folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH).
La FSH pertenece al grupo de las gonadotrofinas, que desempeñan un importante papel en la fertilidad y en la reproducción humanas. En las mujeres, la FSH es necesaria para el crecimiento y desarrollo de los folículos en los ovarios. Los folículos son pequeñas vesículas redondeadas que contienen los óvulos. En el hombre, la FSH es necesaria para la producción de esperma.
Puregon se utiliza para tratar la infertilidad en cualquiera de las siguientes situaciones:
Mujeres
En mujeres que no ovulan y que no responden al tratamiento con citrato de clomifeno, Puregon puede utilizarse para provocar la ovulación.
En mujeres sometidas a técnicas de reproducción asistida, como fecundación in vitro (FIV) y otros métodos, Puregon puede producir el desarrollo de múltiples folículos.
Varones
En hombres infértiles debido a niveles de hormonas bajos, Puregon puede utilizarse para producir esperma.
2. Qué necesita saber antes de empezar a usar Puregon
No use Puregon
Si:
• es alérgico a folitropina beta o a cualquiera de los demás componentes de Puregon (incluidos en la sección 6)
• tiene un tumor en el ovario, en la mama, en el útero, en los testículos o en el cerebro (glándula pituitaria o hipotálamo)
• tiene un sangrado vaginal abundante o irregular por causas desconocidas
• sus ovarios no funcionan a causa de una enfermedad llamada insuficiencia ovárica primaria
• presenta quistes ováricos o aumento del tamaño de los ovarios, que no son debidos al síndrome del ovario poliquístico (SOP)
• tiene malformaciones de los órganos sexuales que hacen imposible un embarazo normal
• presenta tumores fibroides en el útero que hacen imposible un embarazo normal
• es un hombre, infértil a causa de una enfermedad llamada insuficiencia testicular primaria.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Puregon si:
• ha tenido una reacción alérgica a determinados antibióticos (neomicina y/o a la estreptomicina)
• no tiene controlada la glándula pituitaria o tiene problemas hipotálamicos
• tiene poco activa la glándula tiroides (hipotiroidismo)
• las glándulas suprarrenales no le funcionan adecuadamente (insuficiencia suprarrenal)
• tiene niveles altos de prolactina en la sangre (hiperprolactinemia)
• tiene cualquier otra enfermedad (por ejemplo, diabetes, enfermedad del corazón, o cualquier otra enfermedad de larga duración)
Si es usted mujer:
Síndrome de hiperestimulación ovárica (SHO)
Su médico comprobará con regularidad los efectos del tratamiento para poder escoger la dosis adecuada de Puregon en cada momento. De forma regular se le realizarán ecografías de los ovarios. Su médico también puede comprobar los niveles de hormonas en sangre. Esto es muy importante, porque una dosis excesiva de FSH puede conducir a complicaciones raras pero graves, en las que los ovarios se sobreestimulan y los folículos en crecimiento se hacen más grandes de lo normal. Esta enfermedad es grave y se denomina síndrome de hiperestimulación ovárica (SHO). En casos raros, el SHO grave puede ser potencialmente mortal. El SHO hace que se acumule líquido de forma repentina en su estómago y en zonas del pecho, lo que puede causar la formación de coágulos de sangre. Contacte con su médico inmediatamente si siente una hinchazón intensa del abdomen, dolor en la zona del estómago (abdomen), malestar (náuseas), vómitos, aumento repentino de peso debido a la acumulación de líquido, diarrea, disminución del volumen de orina o dificultad para respirar (ver también sección 4, Posibles efectos adversos).
El control periódico de la respuesta al tratamiento con FSH ayuda a prevenir la sobreestimulación ovárica. Contacte con su médico inmediatamente si siente dolores en el estómago, y también si se presentan unos días después de la administración de la última inyección.
Embarazo múltiple o defectos de nacimiento
Después del tratamiento con gonadotropinas existe una mayor posibilidad de tener embarazos múltiples, incluso cuando un sólo embrión se transfiere al útero. Los embarazos múltiples suponen un aumento del riesgo para la salud, tanto de la madre como de los niños en los días previos y posteriores al nacimiento. Además, el embarazo múltiple y las características de los pacientes sometidos a un tratamiento de fertilidad (p. ej. edad de la mujer, características del semen, antecedentes genéticos de ambos padres) pueden estar asociados a un mayor riesgo de defectos de nacimiento
Complicaciones en el embarazo
El riesgo de un embarazo fuera del útero (embarazo ectópico) es ligeramente mayor. Por lo tanto, su médico debe hacerle una ecografía al principio para excluir la posibilidad de embarazo fuera del útero. En las mujeres sometidas a tratamiento para la fertilidad, existe un riesgo ligeramente mayor de aborto.
Coágulos de sangre (Trombosis)
El tratamiento con Puregon, como el embarazo en si mismo, puede aumentar el riesgo de presentar coágulos de sangre (trombosis). La trombosis es la formación de un coágulo en un vaso sanguíneo.
Los coágulos de sangre pueden producir enfermedades graves, como:
• obstrucción en sus pulmones (embolia pulmonar)
• ictus
• ataque al corazón
• problemas de los vasos sanguíneos (tromboflebitis)
• falta de flujo de sangre (trombosis venosa profunda), que puede producir la pérdida de su brazo o pierna.
Trate este tema con su médico antes de empezar el tratamiento, sobre todo en los siguientes casos:
• si ya sabe que tiene una posibilidad mayor de padecer trombosis
• si usted o alguno de sus familiares directos ha tenido alguna vez trombosis
• si tiene un sobrepeso importante.
Torsión ovárica
La torsión puede producirse despúes del tratamiento con gonadotropinas, incluyendo Puregon. La torsión ovárica es el retorcimiento de un ovario. El retorcimiento del ovario podría provocar que el flujo de sangre al ovario se corte.
Antes de empezar a usar este medicamento, informe a su médico si:
• ha tenido alguna vez el síndrome de hiperestimulación ovárica (SHO)
• está embarazada o cree que podría estarlo
• le han operado alguna vez del estómago (cirugía abdominal)
• ha tenido alguna vez una torsión de un ovario
• ha tenido o tiene quistes en su ovario u ovarios.
Tumores de ovario y otros tumores del sistema reproductor
Se han comunicado casos de tumores de ovario y otros tumores del sistema reproductor en mujeres que han seguido un tratamiento de infertilidad. No se sabe si el tratamiento con medicamentos para la fertilidad aumenta el riesgo de estos tumores en mujeres infértiles.
Otras enfermedades
Además, antes de empezar a usar este medicamento, informe a su médico si:
• su médico le ha informado que un embarazo podría ser peligroso para usted.
Si es usted varón:
Varones con exceso de FSH en su sangre
El aumento de los niveles en sangre de FSH es una señal de lesión en los testículos. En tales casos, normalmente Puregon no es eficaz. Para controlar los efectos del tratamiento, su médico puede pedirle una muestra de semen para analizarla, de cuatro a seis meses después del comienzo del tratamiento.
Uso de Puregon con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Si Puregon se administra conjuntamente con citrato de clomifeno, el efecto de Puregon puede aumentar. Si se ha administrado un agonista de la GnRH (medicamento para prevenir la ovulación precoz o temprana), pueden ser necesarias dosis más altas de Puregon.
Embarazo y lactancia
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento. No debe usar Puregon si ya está embarazada, o cree que podría estarlo.
Puregon puede afectar a la producción de la leche. Es poco probable que Puregon pase a la leche materna. Si está dando el pecho, consulte a su médico antes de usar Puregon.
Conducción y uso de máquinas
Es poco probable que Puregon afecte a su capacidad para conducir o para utilizar máquinas. Información importante sobre algunos de los componentes de Puregon
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por inyectable, por lo que se considera esencialmente “exento de sodio”.
Niños
No procede el uso de Puregon en niños.
3. Cómo usar Puregon
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Dosificación en la mujer
Su médico decidirá la dosis inicial. Esta dosis puede ajustarse a medida que avance su tratamiento. Seguidamente se proporcionan más detalles sobre el esquema de dosificación.
Existen grandes variaciones en la respuesta de los ovarios a la FSH entre las mujeres, por lo que se hace imposible establecer un esquema de dosificación adecuado para todas las pacientes. Para encontrar la dosificación correcta, su médico controlará el crecimiento del folículo con ecografías y midiendo la cantidad de estradiol (hormona sexual femenina) en la sangre.
• Mujeres que no ovulan
Su médico establece una dosis inicial que se mantiene durante al menos siete días. Si no se detecta respuesta ovárica, la dosis diaria se incrementa gradualmente hasta que el crecimiento del folículo y/o los niveles plasmáticos de estradiol indiquen una respuesta apropiada y se mantiene esta dosis diaria hasta que se detecte la presencia de un folículo del tamaño apropiado. Normalmente, son suficientes de 7 a 14 días de tratamiento. Se interrumpe entonces el tratamiento de Puregon y se inducirá la ovulación proporcionando gonadotrofina coriónica humana (hCG).
• Programas de reproducción asistida, como fecundación in vitro
Su médico establece una dosis inicial que se mantiene durante los primeros cuatro días, como mínimo. Posteriormente, su dosis puede ajustarse, en función de la respuesta de su ovario. Cuando se detecta un número suficiente de folículos del tamaño apropiado, se induce la fase final de la maduración folicular proporcionando hCG. La recuperación de los oocitos (óvulos) se realiza 34-35 horas después.
Dosificación en el varón
Normalmente, Puregon se receta a una dosis de 450 UI cada semana, casi siempre en tres inyecciones de 150 UI, junto con otra hormona (hCG), durante al menos 3 a 4 meses. El periodo de tratamiento es igual al tiempo necesario para el desarrollo de los espermatozoides y al plazo en el que se espera que
se produzca una mejora. Si su producción de esperma no ha comenzado después de este periodo, su tratamiento puede continuar durante al menos 18 meses.
Cómo administrar la inyección
La primera inyección de Puregon se administrará sólo si está en presencia de un médico o una enfermera.
Las inyecciones deben administrarse lentamente por vía intramuscular (en un músculo) (por ejemplo en las nalgas, en la parte superior de la pierna o en la parte superior del brazo), o subcutánea (bajo la piel) (por ejemplo en la parte inferior del estómago). Las inyecciones en un músculo deben administrarlas únicamente el médico o la enfermera.
Las inyecciones bajo la piel pueden administrarse en algunos casos por usted o su pareja. Su médico le dirá cuándo y cómo tiene que hacerlo. Si se inyecta a si mismo Puregon, siga las instrucciones de uso indicadas a continuación, para que la aplicación de Puregon sea correcta y las molestias sean mínimas.
Instrucciones de uso
1 - Preparación de la jeringa
Debe utilizar jeringas y agujas desechables estériles para la administración de Puregon. El volumen de la jeringa debe ser lo suficientemente pequeño para que la dosis prescrita pueda administrarse con una exactitud razonable.
Puregon solución inyectable se presenta en un vial de vidrio. No utilizar la solución si contiene partículas o no es transparente. En primer lugar, quite la tapa del precinto del vial. Coloque una aguja en una jeringa e introduzca la aguja a través del tapón de goma del vial (a). Aspire la solución a la jeringa (b), y sustituya la aguja por una aguja para inyección (c). Finalmente, mantenga la jeringa con la aguja hacia arriba y golpee suavemente en un costado para que suban las posibles burbujas de aire; a continuación presione el émbolo hasta que se haya expulsado todo el aire, de forma que sólo quede la solución de Puregon en la jeringa (d). Si es necesario, se puede presionar el émbolo un poco más, para ajustar el volumen que se tiene que administrar.
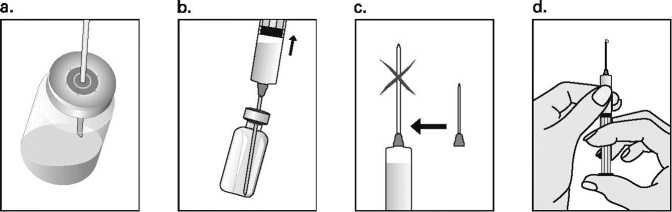
2 - Lugar de inyección
El mejor sitio para una inyección bajo la piel es la zona de la parte inferior del estómago alrededor del ombligo (e), donde existe una gran cantidad de tejido blando y capas de tejido graso. Deberá cambiar de sitio dentro de la misma zona cada vez que aplique una nueva inyección. Es posible poner las inyecciones en otros sitios. Su médico o enfermera le indicará dónde inyectar.
3 - Preparación de la zona
Unos pocos golpes suaves en el lugar de la inyección estimularán minúsculas terminaciones nerviosas y ayudarán a reducir la molestia cuando se introduce la aguja. Lávese las manos y frote el lugar de la inyección con un algodón empapado en desinfectante (por ejemplo clorhexidina al 0,5%) para eliminar cualquier bacteria de la superficie. Limpie de esta forma una zona de aproximadamente 5 cm alrededor del punto donde introducirá la aguja y deje que el desinfectante se seque durante un minuto como mínimo antes de aplicar la inyección.
4 - Introducción de la aguja
Pellizque un poco la piel; con la otra mano introduzca la aguja con un ángulo de 90° respecto a la superficie de la piel, como muestra el dibujo (f).
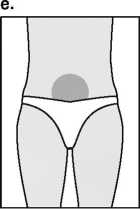
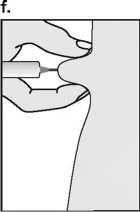
5 - Comprobar que la posición de la aguja sea correcta
Si la posición de la aguja es correcta, será bastante difícil retirar el émbolo. Si se aspira sangre en la jeringa significa que la punta de la aguja ha penetrado en una vena o arteria. Si esto ocurre, extraiga la jeringa, aplique en el lugar de la inyección un algodón con desinfectante y presione; cesará de sangrar en un minuto o dos. La solución de la jeringa no se puede usar. Empiece de nuevo en el punto 1 utilizando una nueva jeringa, nuevas agujas y otro vial de Puregon.
6 - Inyección de la solución
Presione sobre el émbolo lenta y continuamente, de esta forma la solución se inyecta correctamente y el tejido cutáneo no sufre.
7 - Extracción de la jeringa
Extraiga la jeringa rápidamente y presione el lugar de inyección con un algodón con desinfectante. Manteniendo la presión, aplique un suave masaje en el lugar para ayudar a dispersar la solución de Puregon y aliviar las molestias.
Si queda solución en la jeringa debe desecharse.
No mezcle Puregon con otros medicamentos.
Si usa más Puregon del que debe
Informe a su médico inmediatamente.
Una dosis demasiado alta de Puregon puede causar estimulación excesiva de los ovarios (SHO), que puede manifestarse como dolor en el estómago. Si siente malestar por dolor en el estómago, informe a su médico inmediatamente. Ver también la sección 4 sobre posibles efectos adversos.
Si olvidó usar Puregon
Si olvidó una dosis, no se aplique una dosis doble para compensar las dosis olvidadas.
Póngase en contacto con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves en mujeres
Una complicación de la FSH es la hiperestimulación de los ovarios. La sobreestimulación ovárica puede desencadenar una enfermedad llamada síndrome de hiperestimulación ovárica (SHO), que puede ser un problema clínico grave. Puede reducirse el riesgo de que se produzca controlando cuidadosamente el desarrollo de los folículos durante el tratamiento. Su médico le hará ecografías de sus ovarios para controlar minuciosamente el número de folículos maduros. Su médico también puede verificar los niveles de hormonas en la sangre. Los primeros síntomas son dolor en el estómago, malestar o diarrea. En casos más graves puede experimentarse aumento del tamaño de los ovarios, acumulación de líquido en el abdomen y/o pecho (que puede causar aumento repentino de peso debido a la acumulación de líquido) o la aparición de coágulos de sangre en el sistema circulatorio. Ver sección 2 Advertencias y precauciones.
Contacte con su médico inmediatamente si experimenta dolor en el estómago o cualquiera de estos síntomas de hiperestimulación de los ovarios, incluso si se producen algunos días después de la última inyección.
Si es usted mujer:
Reacciones adversas frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Dolor de cabeza
- Reacciones en el lugar de la inyección (como cardenales, dolor, enrojecimiento, hinchazón y picor)
- Síndrome de hiperestimulación ovárica (SHO)
- Dolor en la pelvis
- Dolor en el estómago y/o distensión abdominal
Reacciones adversas poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- Molestias en las mamas (incluyendo dolor al tocarlas).
- Diarrea, estreñimiento y molestias en el estómago
- Aumento del tamaño del útero
- Náuseas
- Reacciones de hipersensibilidad (como erupción cutánea, enrojecimiento, urticaria y picor)
- Quistes en los ovarios o aumento del tamaño de los ovarios
- Torsión ovárica (retorcimiento de los ovarios)
- Sangrado vaginal
Reacciones adversas raras (pueden afectar hasta 1 de cada 1.000 personas):
- Coágulos (esto también puede producirse inpendientemente de que ocurra una sobreestimulación no deseada de los ovarios, ver sección 2, Advertencias y precauciones)
También han sido comunicados embarazos fuera del útero (un embarazo ectópico), abortos involuntarios y embarazos múltiples. Estos efectos adversos no se consideran relacionados con el uso de Puregon, sino con las Técnicas de Reproducción Asistida (TRA) o con un embarazo posterior.
Si es usted varón:
Reacciones adversas frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Acné
- Reacciones en la zona de inyección (como endurecimiento y dolor)
- Dolor de cabeza
- Erupción cutánea
- Desarrollo de los pechos
- Quistes en los testículos
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Puregon
Mantener este medicamento fuera de la vista y del alcance de los niños.
Almacenamiento por el farmacéutico
Conservar entre 2°C - 8°C (en nevera). No congelar.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo.
Anote el día que empiece a guardar el producto fuera de la nevera.
Conservar los viales en el embalaje exterior.
El contenido del vial debe utilizarse inmediatamente después de perforar el tapón de goma.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de ‘CAD’. La fecha de caducidad es el último día del mes que se indica.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Puregon
El principio activo es folitropina beta.
Puregon 50 UI/0,5 ml solución inyectable: Cada vial contiene el principio activo folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH) a una dosis de 50 UI en 0,5 ml de solución acuosa por vial.
Puregon 75 UI/0,5 ml solución inyectable: Cada vial contiene el principio activo folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH) a una dosis de 75 UI en 0,5 ml de solución acuosa por vial.
Puregon 100 UI/0,5 ml solución inyectable: Cada vial contiene el principio activo folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH) a una dosis de 100 UI en 0,5 ml de solución acuosa por vial.
Puregon 150 UI/0,5 ml solución inyectable: Cada vial contiene el principio activo folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH) a una dosis de 150 UI en 0,5 ml de solución acuosa por vial.
Puregon 200 UI/0,5 ml solución inyectable: Cada vial contiene el principio activo folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH) a una dosis de 200 UI en 0,5 ml de solución acuosa por vial.
Puregon 225 UI/0,5 ml solución inyectable: Cada vial contiene el principio activo folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH) a una dosis de 225 UI en 0,5 ml de solución acuosa por vial.
Los demás componentes son sacarosa, citrato de sodio, L-metionina y polisorbato 20 en agua para inyección. El pH puede haberse ajustado con hidróxido de sodio y ácido clorhídrico.
Aspecto del producto y contenido del envase
Puregon solución inyectable (inyectable) es un líquido transparente e incoloro, que se presenta en un vial de vidrio. Está disponible en envases de 1, 5 y 10 viales.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
Responsable de la fabricación
N.V. Organon Kloosterstraat 6 5349 AB Oss Países Bajos
medicamento dirigiéndose al representante local del
Lietuva
UAB Merck Sharp & Dohme Tel: + 370 5 2780247 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL Tel/Tél: +32(0)27766211 dpoc_belux@merck.com
Magyarország
MSD Pharma Hungary Kft.
Tel.: + 36 1 888 5300 hungary_msd@merck.com
Malta
Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com
Nederland
Merck Sharp & Dohme BV
Tel: 0800 99 99 000 (+ 31 23 5153153)
Norge
MSD (Norge) AS Tlf: + 47 32 20 73 00 msdnorge@msd.no
Osterreich
Merck Sharp & Dohme Ges.m.b.H.
Tel: +43 (0) 1 26 044 msd-medizin@merck.com
Polska
MSD Polska Sp. z o.o.
Tel.: +48 22 549 51 00 msdpolska@merck.com
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tel/Tél: 0800 38 693 (+32(0)27766211)
Bt^rapna
MepK fflapn u floyM Etnrapua EOOfl Tea.: + 359 2 819 37 37 info-msdbg@merck.com
Ceská republika
Merck Sharp & Dohme s.r.o.
Tel.: +420 233 010 111 dpoc_czechslovak@merck.com
Danmark
MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com
Deutschland
MSD SHARP & DOHME GMBH
Tel: 0800 673 673 673 (+49 (0) 89 4561 2612)
Eesti
Merck Sharp & Dohme OÜ Tel: + 372 6144 200 msdeesti@merck.com
EkláSa
MSD A.O.B.EE.
Tpk: + 30 210 98 97 300 dpoc_greece@merck.com
España
Merck Sharp & Dohme de España, S.A.
Tel.: +34 91 321 06 00 msd_info@merck.com
|
France MSD France Tél + 33 (0)1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: + 351 214 465700 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia info@merck.com |
Romania Merck Sharp & Dohme Romania S.R.L. Tel: + 40 21 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o. Tel: + 386 1 5204201 msd.slovenia@merck.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: + 421 2 58282010 dpoc_czechslovak@merck.com |
|
Italia MSD Italia S.r.l. Tel: +39 06 361911 medicalinformation.it@merck.com |
Suomi/Finland MSD Finland Oy Puh/Tel: + 358 (0)9 804650 info@msd.fi |
|
Kúnpoq Merck Sharp & Dohme Cyprus Limited Tpk: 800 00 673 (+357 22866700) cyprus info@merck.com |
Sverige Merck Sharp & Dohme (Sweden) AB Tel: + 46 77 5700488 medicinskinfo@merck.com |
|
Latvija SIA Merck Sharp & Dohme Latvija Tel: + 371 67 364224 msd lv@merck.com |
United Kingdom Merck Sharp & Dohme Limited Tel: + 44 (0) 1992 467272 medicalinformationuk@merck.com |
Fecha de la última revisión de este prospecto: mes AAAA Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Prospecto: información para el usuario
Puregon 150 UI/0,18 ml solución inyectable Puregon 300 UI/0,36 ml solución inyectable Puregon 600 UI/0,72 ml solución inyectable Puregon 900 UI/1,08 ml solución inyectable folitropina beta
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Puregon y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Puregon
3. Cómo usar Puregon
4. Posibles efectos adversos
5. Conservación de Puregon
6. Contenido del envase e información adicional 1. Qué es Puregon y para qué se utiliza
Puregon solución inyectable contiene folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH).
La FSH pertenece al grupo de las gonadotrofinas, que desempeñan un importante papel en la fertilidad y en la reproducción humanas. En las mujeres, la FSH es necesaria para el crecimiento y desarrollo de los folículos en los ovarios. Los folículos son pequeñas vesículas redondeadas que contienen los óvulos. En el hombre, la FSH es necesaria para la producción de esperma.
Puregon se utiliza para tratar la infertilidad en cualquiera de las siguientes situaciones:
Mujeres
En mujeres que no ovulan y que no responden al tratamiento con citrato de clomifeno, Puregon puede utilizarse para provocar la ovulación.
En mujeres sometidas a técnicas de reproducción asistida, como fecundación in vitro (FIV) y otros métodos, Puregon puede producir el desarrollo de múltiples folículos.
Varones
En hombres infértiles debido a niveles de hormonas bajos, Puregon puede utilizarse para producir esperma.
2. Qué necesita saber antes de empezar a usar Puregon
No use Puregon
Si:
• es alérgico a folitropina beta o a cualquiera de los demás componentes de Puregon (incluidos en la sección 6)
• tiene un tumor en el ovario, en la mama, en el útero, en los testículos o en el cerebro (glándula pituitaria o hipotálamo)
• tiene un sangrado vaginal abundante o irregular por causas desconocidas
• sus ovarios no funcionan a causa de una enfermedad llamada insuficiencia ovárica primaria
• presenta quistes ováricos o aumento del tamaño de los ovarios, que no son debidos al síndrome del ovario poliquístico (SOP)
• tiene malformaciones de los órganos sexuales que hacen imposible un embarazo normal
• presenta tumores fibroides en el útero que hacen imposible un embarazo normal
• es un hombre, infértil a causa de una enfermedad llamada insuficiencia testicular primaria.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Puregon si:
• ha tenido una reacción alérgica a determinados antibióticos (neomicina y/o a la estreptomicina)
• no tiene controlada la glándula pituitaria o tiene problemas hipotálamicos
• tiene poco activa la glándula tiroides (hipotiroidismo)
• las glándulas suprarrenales no le funcionan adecuadamente (insuficiencia suprarrenal)
• tiene niveles altos de prolactina en la sangre (hiperprolactinemia)
• tiene cualquier otra enfermedad (por ejemplo, diabetes, enfermedad del corazón, o cualquier otra enfermedad de larga duración)
Si es usted mujer:
Síndrome de hiperestimulación ovárica (SHO)
Su médico comprobará con regularidad los efectos del tratamiento para poder escoger la dosis adecuada de Puregon en cada momento. De forma regular se le realizarán ecografías de los ovarios. Su médico también puede comprobar los niveles de hormonas en sangre. Esto es muy importante, porque una dosis excesiva de FSH puede conducir a complicaciones raras pero graves, en las que los ovarios se sobreestimulan y los folículos en crecimiento se hacen más grandes de lo normal. Esta enfermedad es grave y se denomina síndrome de hiperestimulación ovárica (SHO). En casos raros, el SHO grave puede ser potencialmente mortal. El SHO hace que se acumule líquido de forma repentina en su estómago y en zonas del pecho, lo que puede causar la formación de coágulos de sangre. Contacte con su médico inmediatamente si siente una hinchazón intensa del abdomen, dolor en la zona del estómago (abdomen), malestar (náuseas), vómitos, aumento repentino de peso debido a la acumulación de líquido, diarrea, disminución del volumen de orina o dificultad para respirar (ver también sección 4, Posibles efectos adversos).
El control periódico de la respuesta al tratamiento con FSH ayuda a prevenir la sobreestimulación ovárica. Contacte con su médico inmediatamente si siente dolores en el estómago, y también si se presentan unos días después de la administración de la última inyección.
Embarazo múltiple o defectos de nacimiento
Después del tratamiento con gonadotropinas existe una mayor posibilidad de tener embarazos múltiples, incluso cuando un sólo embrión se transfiere al útero. Los embarazos múltiples suponen un aumento del riesgo para la salud, tanto de la madre como de los niños en los días previos y posteriores al nacimiento. Además, el embarazo múltiple y las características de los pacientes sometidos a un tratamiento de fertilidad (p. ej. edad de la mujer, características del semen, antecedentes genéticos de ambos padres) pueden estar asociados a un mayor riesgo de defectos de nacimiento.
Complicaciones en el embarazo
El riesgo de un embarazo fuera del útero (embarazo ectópico) es ligeramente mayor. Por lo tanto, su médico debe hacerle una ecografía al principio para excluir la posibilidad de embarazo fuera del útero. En las mujeres sometidas a tratamiento para la fertilidad, existe un riesgo ligeramente mayor de aborto.
Coágulos de sangre (Trombosis)
El tratamiento con Puregon, como el embarazo en si mismo, puede aumentar el riesgo de presentar coágulos de sangre (trombosis). La trombosis es la formación de un coágulo en un vaso sanguíneo.
Los coágulos de sangre pueden producir enfermedades graves, como:
• obstrucción en sus pulmones (embolia pulmonar)
• ictus
• ataque al corazón
• problemas de los vasos sanguíneos (tromboflebitis)
• falta de flujo de sangre (trombosis venosa profunda), que puede producir la pérdida de su brazo o pierna.
Trate este tema con su médico antes de empezar el tratamiento, sobre todo en los siguientes casos:
• si ya sabe que tiene una posibilidad mayor de padecer trombosis
• si usted o alguno de sus familiares directos ha tenido alguna vez trombosis
• si tiene un sobrepeso importante.
Torsión ovárica
La torsión puede producirse despúes del tratamiento con gonadotropinas, incluyendo Puregon. La torsión ovárica es el retorcimiento de un ovario. El retorcimiento del ovario podría provocar que el flujo de sangre al ovario se corte.
Antes de empezar a usar este medicamento, informe a su médico si:
• ha tenido alguna vez el síndrome de hiperestimulación ovárica (SHO)
• está embarazada o cree que podría estarlo
• le han operado alguna vez del estómago (cirugía abdominal)
• ha tenido alguna vez una torsión de un ovario
• ha tenido o tiene quistes en su ovario u ovarios.
Tumores de ovario y otros tumores del sistema reproductor
Se han comunicado casos de tumores de ovario y otros tumores del sistema reproductor en mujeres que han seguido un tratamiento de infertilidad. No se sabe si el tratamiento con medicamentos para la fertilidad aumenta el riesgo de estos tumores en mujeres infértiles.
Otras enfermedades
Además, antes de empezar a usar este medicamento, informe a su médico si:
• su médico le ha informado que un embarazo podría ser peligroso para usted.
Si es usted varón:
Varones con exceso de FSH en su sangre
El aumento de los niveles en sangre de FSH es una señal de lesión en los testículos. En tales casos, normalmente Puregon no es eficaz. Para controlar los efectos del tratamiento, su médico puede pedirle una muestra de semen para analizarla, de cuatro a seis meses después del comienzo del tratamiento.
Uso de Puregon con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Si Puregon se administra conjuntamente con citrato de clomifeno, el efecto de Puregon puede aumentar. Si se ha administrado un agonista de la GnRH (medicamento para prevenir la ovulación precoz o temprana), pueden ser necesarias dosis más altas de Puregon.
Embarazo y lactancia
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento. No debe usar Puregon si ya está embarazada, o cree que podría estarlo.
Puregon puede afectar a la producción de la leche. Es poco probable que Puregon pase a la leche materna. Si está dando el pecho, consulte a su médico antes de usar Puregon.
Conducción y uso de máquinas
Es poco probable que Puregon afecte a su capacidad para conducir o para utilizar máquinas. Información importante sobre algunos de los componentes de Puregon
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por inyectable, por lo que se considera esencialmente “exento de sodio”.
Niños
No procede el uso de Puregon en niños.
3. Cómo usar Puregon
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Dosificación en la mujer
Su médico decidirá la dosis inicial. Esta dosis puede ajustarse a medida que avance su tratamiento. Seguidamente se proporcionan más detalles sobre el esquema de dosificación.
Existen grandes variaciones en la respuesta de los ovarios a la FSH entre las mujeres, por lo que se hace imposible establecer un esquema de dosificación adecuado para todas las pacientes. Para encontrar la dosificación correcta, su médico controlará el crecimiento del folículo con ecografías y midiendo la cantidad de estradiol (hormona sexual femenina) en la sangre.
• Mujeres que no ovulan
Su médico establece una dosis inicial que se mantiene durante al menos siete días. Si no se detecta respuesta ovárica, la dosis diaria se incrementa gradualmente hasta que el crecimiento del folículo y/o los niveles plasmáticos de estradiol indiquen una respuesta apropiada y se mantiene esta dosis diaria hasta que se detecte la presencia de un folículo del tamaño apropiado. Normalmente, son suficientes de 7 a 14 días de tratamiento. Se interrumpe entonces el tratamiento de Puregon y se inducirá la ovulación proporcionando gonadotrofina coriónica humana (hCG).
• Programas de reproducción asistida, como fecundación in vitro
Su médico establece una dosis inicial que se mantiene durante los primeros cuatro días, como mínimo. Posteriormente, su dosis puede ajustarse, en función de la respuesta de su ovario. Cuando se detecta un número suficiente de folículos del tamaño apropiado, se induce la fase final de la maduración folicular proporcionando hCG. La recuperación de los oocitos (óvulos) se realiza 34-35 horas después.
Dosificación en el varón
Normalmente, Puregon se receta a una dosis de 450 UI cada semana, casi siempre en tres inyecciones de 150 UI, junto con otra hormona (hCG), durante al menos 3 a 4 meses. El periodo de tratamiento es igual al tiempo necesario para el desarrollo de los espermatozoides y al plazo en el que se espera que se produzca una mejora. Si su producción de esperma no ha comenzado después de este periodo, su tratamiento puede continuar durante al menos 18 meses.
Cómo administrar la inyección
Puregon solución inyectable en cartuchos se ha desarrollado para usar con el inyector tipo pluma Puregon Pen. Deben seguirse cuidadosamente las instrucciones para usar el inyector, que se adjuntan por separado. No use el cartucho si la solución contiene partículas o no es transparente.
Con el inyector tipo pluma, las inyecciones bajo la piel (en la parte inferior del estómago, por ejemplo) pueden administrarse por usted mismo o su pareja. Su médico le dirá cuándo y cómo tiene que hacerlo. Si se inyecta a si mismo Puregon, siga cuidadosamente las instrucciones para administrar Puregon correctamente y con las mínimas molestias.
La primera inyección de Puregon únicamente debe administrarse en presencia de un médico o una enfermera.
Si usa más Puregon del que debe
Informe a su médico inmediatamente.
Una dosis demasiado alta de Puregon puede causar estimulación excesiva de los ovarios (SHO), que puede manifestarse como dolor en el estómago. Si siente malestar por dolor en el estómago, informe a su médico inmediatamente. Ver también la sección 4 sobre posibles efectos adversos.
Si olvidó usar Puregon
Si olvidó una dosis, no se aplique una dosis doble para compensar las dosis olvidadas.
Póngase en contacto con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves en mujeres
Una complicación de la FSH es la hiperestimulación de los ovarios. La sobreestimulación ovárica puede desencadenar una enfermedad llamada síndrome de hiperestimulación ovárica (SHO), que puede ser un problema clínico grave. Puede reducirse el riesgo de que se produzca controlando cuidadosamente el desarrollo de los folículos durante el tratamiento. Su médico le hará ecografías de sus ovarios para controlar minuciosamente el número de folículos maduros. Su médico también puede verificar los niveles de hormonas en la sangre. Los primeros síntomas son dolor en el estómago, malestar o diarrea. En casos más graves puede experimentarse aumento del tamaño de los ovarios, acumulación de líquido en el abdomen y/o pecho, (que puede causar aumento repentino de peso debido a la acumulación de líquido) o la aparición de coágulos de sangre en el sistema circulatorio. Ver sección 2 Advertencias y precauciones.
Contacte con su médico inmediatamente si experimenta dolor en el estómago o cualquiera de estos síntomas de hiperestimulación de los ovarios, incluso si se producen algunos días después de la última inyección.
Si es usted mujer:
Reacciones adversas frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Dolor de cabeza
- Reacciones en el lugar de la inyección (como cardenales, dolor, enrojecimiento, hinchazón y picor)
- Síndrome de hiperestimulación ovárica (SHO)
- Dolor en la pelvis
- Dolor en el estómago y/o distensión abdominal
Reacciones adversas poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- Molestias en las mamas (incluyendo dolor al tocarlas).
- Diarrea, estreñimiento y molestias en el estómago
- Aumento del tamaño del útero
- Náuseas
- Reacciones de hipersensibilidad (como erupción cutánea, enrojecimiento, urticaria y picor)
- Quistes en los ovarios o aumento del tamaño de los ovarios
- Torsión ovárica (retorcimiento de los ovarios)
- Sangrado vaginal
Reacciones adversas raras (pueden afectar hasta 1 de cada 1.000 personas):
- Coágulos (esto también puede producirse inpendientemente de que ocurra una sobreestimulación no deseada de los ovarios, ver sección 2, Advertencias y precauciones)
También han sido comunicados embarazos fuera del útero (un embarazo ectópico), abortos involuntarios y embarazos múltiples. Estos efectos adversos no se consideran relacionados con el uso de Puregon, sino con las Técnicas de Reproducción Asistida (TRA) o con un embarazo posterior.
Si es usted varón:
Reacciones adversas frecuentes (pueden afectar hasta 1 de cada 10 personas):
- Acné
- Reacciones en la zona de inyección (como endurecimiento y dolor)
- Dolor de cabeza
- Erupción cutánea
- Desarrollo de los pechos
- Quistes en los testículos
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Puregon
Mantener este medicamento fuera de la vista y del alcance de los niños.
Almacenamiento por el farmacéutico
Conservar entre 2°C - 8°C (en nevera). No congelar.
Almacenamiento por el paciente
Tiene dos opciones:
1. Conservar entre 2°C - 8°C (en nevera). No congelar.
2. Conservar por debajo o a 25°C durante un único periodo de 3 meses como máximo.
Anote el día que empiece a guardar el producto fuera de la nevera.
Conservar el cartucho en el embalaje exterior.
Una vez perforada la membrana de goma del cartucho con una aguja, el producto puede guardarse durante 28 días, como máximo.
Por favor, anote el primer día de uso del cartucho en la tabla de control, tal como se muestra en el Manual de Instrucciones de la pluma Puregon Pen.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de ‘CAD’. La fecha de caducidad es el último día del mes que se indica.
Desechar las agujas usadas inmediatamente después de la inyección.
No mezclar ningún otro medicamento en los cartuchos. No rellenar los cartuchos vacíos.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Puregon
• Cada cartucho contiene el principio activo folitropina beta, una hormona conocida como hormona estimulante del folículo (FSH) a una dosis de 833 UI/ml de solución acuosa.
• Los demás componentes son sacarosa, citrato de sodio, L-metionina, polisorbato 20 y alcohol bencílico en agua para inyección. El pH puede haberse ajustado con hidróxido de sodio y ácido clorhídrico.
Aspecto del producto y contenido del envase
Puregon solución inyectable (inyectable) es un líquido transparente e incoloro, que se presenta en un cartucho de vidrio. Está disponible en envases de 1 cartucho.
Titular de la autorización de comercialización
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
Responsable de la fabricación
N.V. Organon Kloosterstraat 6 5349 AB Oss Países Bajos
Organon (Ireland) Ltd.
P.O. Box 2857 Drynam Road Swords, Co. Dublín Irlanda
medicamento dirigiéndose al representante local del
Lietuva
UAB Merck Sharp & Dohme Tel: + 370 5 2780247 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL Tel/Tél: +32(0)27766211 dpoc_belux@merck.com
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tel/Tél: 0800 38 693 (+32(0)27766211)
Etarapna
MepK fflapn h floyM Etarapua EOOfl Tea.: + 359 2 819 37 37 info-msdbg@merck.com
|
Ceská republika Merck Sharp & Dohme s.r.o. Tel.: +420 233 010 111 dpoc_czechslovak@merck.com |
Magyarország MSD Pharma Hungary Kft. Tel.: + 36 1 888 5300 hungary_msd@merck.com |
|
Danmark MSD Danmark ApS Tlf: + 45 4482 4000 dkmail@merck.com |
Malta Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com |
|
Deutschland MSD SHARP & DOHME GMBH Tel: 0800 673 673 673 (+49 (0) 89 4561 2612) |
Nederland Merck Sharp & Dohme BV Tel: 0800 99 99 000 (+ 31 23 5153153) |
|
Eesti Merck Sharp & Dohme OÜ Tel: + 372 6144 200 msdeesti@merck.com |
Norge MSD (Norge) AS Tlf: + 47 32 20 73 00 msdnorge@msd.no |
|
EkláSa MSD A.O.B.EE. Tpk: + 30 210 98 97 300 dpoc_greece@merck.com |
Osterreich Merck Sharp & Dohme Ges.m.b.H. Tel: +43 (0) 1 26 044 msd-medizin@merck.com |
|
España Merck Sharp & Dohme de España, S.A. Tel.: +34 91 321 06 00 msd info@merck.com |
Polska MSD Polska Sp. z o.o. Tel.: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél + 33 (0)1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: + 351 214 465700 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia_info@merck.com |
Romanía Merck Sharp & Dohme Romania S.R.L. Tel: + 40 21 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo_ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o Tel: + 386 1 5204201 msd.slovenia@merck.com |
|
Ísland Vistor hf. Sími: + 354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: + 421 2 58282010 dpoc_czechslovak@merck.com |
|
Italia MSD Italia S.r.l. Tel: +39 06 361911 medicalinformation.it@merck.com |
Suomi/Finland MSD Finland Oy Puh/Tel: + 358 (0)9 804650 info@msd.fi |
Kúrcpog
Merck Sharp & Dohme Cyprus Limited Tqk 800 00 673
(+357 22866700) cyprus_info@merck.com
Latvija
SIA Merck Sharp & Dohme Latvija Tel: + 371 67 364224 msd_lv@merck.com
Sverige
Merck Sharp & Dohme (Sweden) AB Tel: + 46 77 5700488 medicinskinfo@merck.com
United Kingdom
Merck Sharp & Dohme Limited Tel: + 44 (0) 1992 467272 medicalinformationuk@merck.com
Fecha de la última revisión de este prospecto: mes AAAA
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
79