Primovist 0,25 Mmol/Ml, Solucion Inyectable En Jeringa Precargada
Prospecto: información para el usuario Primovist 0,25 mmol/ml, solución inyectable en jeringa precargada
Gadoxetato de disodio
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte al médico que le administra Primovist (el radiólogo) o al personal del hospital o centro donde se realice la RM (resonancia magnética).
- Si experimenta efectos adversos, consulte a su médico o radiólogo, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Primovist y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Primovist
3. Cómo usar Primovist
4. Posibles efectos adversos
5. Conservación de Primovist
6. Contenido del envase e información adicional
1. Qué es Primovist y para qué se utiliza
Primovist es un medio de contraste para el diagnóstico por imagen mediante resonancia magnética (RM) del hígado. Se utiliza para contribuir a detectar y diagnosticar alteraciones que pueden aparecer en el hígado. Se pueden evaluar mejor (número, tamaño y distribución) signos anormales del hígado. Primovist también puede ayudar al médico a determinar la naturaleza de cualquier anormalidad, aumentando de ese modo su confianza en el diagnóstico. Se suministra como solución inyectable. Este medicamento es únicamente para uso diagnóstico.
La RM (resonancia magnética) es un método de diagnóstico por imagen que forma las mismas mediante la detección de moléculas de agua en los tejidos normales y anormales. Esto se realiza mediante un complejo sistema de imanes y ondas de radio.
2. Qué necesita saber antes de empezar a usar Primovist No use Primovist
- Si usted es alérgico al gadoxetato de disodio o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico antes de empezar a usar Primovist si usted
- padece o ha padecido alergia (por ejemplo; fiebre del heno, urticaria) o asma.
- previamente ha padecido alguna reacción a los medios de contraste.
- padece una función renal alterada.
El uso de algunos agentes de contraste conteniendo gadolinio en pacientes con esta enfermedad se ha asociado con la enfermedad conocida como Fibrosis Nefrogénica Sistémica (FNS). La FNS es una enfermedad que da lugar a un engrasamiento de la piel y los tejidos conectivos. La FNS puede llegar a
producir una disminución de la movilidad de articulaciones, debilitación de los músculos o alteración de la función de los órganos internos, lo cual puede poner en peligro la vida.
- padece alguna enfermedad grave del corazón o de los vasos sanguíneos.
- tiene los niveles de potasio en sangre bajos.
- o alguien de su familia ha tenido alguna vez problemas de ritmo cardíaco (síndrome del QT largo).
- ha tenido alteraciones del ritmo o cadencia de los latidos del corazón debido a algún medicamento.
Antes de que le administren Primovist, informe a su médico si le afecta cualquiera de los trastornos mencionados anteriormente. Su médico decidirá si la prueba que se pretende realizar es posible o no.
- Pueden ocurrir reacciones alérgicas/alergoides tras la administración de Primovist. Es posible que las reacciones sean graves y también que sean retardadas (horas o días después) (ver sección 4 “Posibles efectos adversos”).
- Informe a su médico si lleva marcapasos o algún tipo de implante metálico en su organismo.
Informe a su médico si:
- sus riñones no funcionan correctamente
- recientemente se le ha realizado, o pronto se le va a realizar, un trasplante de hígado
Su médico puede decidir realizarle un análisis de sangre para comprobar el funcionamiento correcto de sus riñones antes de decidir el uso de Primovist, especialmente si usted tiene 65 años o es mayor.
Niños y adolescentes
No se ha establecido la seguridad y eficacia de Primovist en pacientes menores de 18 años ya que la experiencia de este uso es limitada. Se proporciona información adicional sobre el uso de Primovist en niños al final del prospecto.
Uso de Primovist con otros medicamentos
Comunique a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que tomar cualquier otro medicamento. Se incluyen especialmente:
- betabloqueantes, medicamentos que se utilizan para el tratamiento de la tensión arterial alta y otras enfermedades cardíacas
- medicamentos que alteran el ritmo o cadencia de los latidos del corazón (p.ej. amiodarona, sotalol)
- rifampicina (medicamento que se utiliza para el tratamiento de la tuberculosis)
Embarazo y lactancia
Embarazo
Debe informar a su médico si cree que está embarazada o que pudiera estarlo ya que Primovist no debe utilizarse durante el embarazo a menos que sea estrictamente necesario.
Lactancia
Informe a su médico si está dando el pecho o a punto de empezar. Su médico valorará si usted debe continuar la lactancia o si debe interrumpirla 24 horas después de la administración de Primovist.
Primovist contiene sodio
Primovist contiene 82 mg de sodio por dosis (basado en la dosis media administrada a una persona de 70 Kg). Esto se debe tener en cuenta si usted está haciendo una dieta baja en sodio.
3. Cómo usar Primovist
Un médico inyecta Primovist en la vena mediante una aguja de pequeño tamaño. Le administrarán Primovist inmediatamente antes de su prueba de RM (resonancia magnética).
Tras la inyección usted estará en observación durante, al menos, 30 minutos.
Dosis recomendada
La dosis correcta de Primovist que se le debe administrar dependerá de su peso corporal:
0,1 ml de Primovist por kilogramo de peso corporal.
Posología en poblaciones especiales
El uso de Primovist no está recomendado en pacientes con problemas renales graves o en pacientes a los que recientemente se les haya o pronto se les va a realizar un trasplante de hígado. Sin embargo, si se requiere el uso, durante una exploración sólo debe administrársele una dosis de Primovist y no debe administrársele una segunda inyección hasta que hayan transcurrido al menos 7 días.
Pacientes de edad avanzada
Si usted tiene 65 años o es mayor no es necesario que se le ajuste la dosis pero podría realizársele un análisis de sangre para comprobar el funcionamiento correcto de sus riñones.
Al final del prospecto se incluye información adicional sobre la administración y el manejo de Primovist.
Si usted usa más Primovist del que debiera:
Una sobredosis es improbable. Si esto sucediera, su médico tratará cualquier síntoma que aparezca.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
También puede llamar al Servicio de Información Toxicológica. Teléfono: 91 562 04 20.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamentopuede producir efectos adversos, aunque no todas las personas los sufran.
La mayoría de efectos adversos son de naturaleza leve a moderada.
Los efectos adversos observados con mayor frecuencia en pacientes recibiendo Primovist (pueden afectar a 5 o más de cada 1.000 pacientes) son náuseas (sensación de mareo), cefalea, sensación de calor, aumento de la presión arterial, dolor de espalda y mareos.
El efecto adverso más serio en pacientes recibiendo Primovist es el shock anafiláctico (una reacción alérgica severa).
Al igual que con otros medios de contraste, pueden producirse casos raros de reacciones alérgicas/alergoides, incluyendo reacciones graves (shock) en casos muy raros, que pueden necesitar de una intervención médica inmediata.
Los primeros signos de que se está produciendo una reacción grave son hinchazón moderada de la cara, labios, lengua o garganta, tos, picor, secreción nasal, estornudos y urticaria (sarpullido como el que causa la ortiga). Informe al personal del departamento de RM (resonancia magnética) si experimenta cualquiera de estos signos o tiene dificultades para respirar.
Pueden ocurrir reacciones retardadas unas horas o días después de la administración de Primovist. Si esto le sucede a usted, informe a su médico o radiólogo.
A continuación se enumeran los efectos adversos comunicados/experimentados, ordenados por frecuencia:
|
Frecuentes: puede afectar hasta 1 de cada 10 personas |
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas |
Raros: pueden afectar hasta 1 de cada 1.000 personas |
No conocida: la frecuencia no puede ser estimada a partir de los datos disponibles |
|
Cefalea Náuseas (sensación de mareo) |
Sensación de torbellino (vértigo) Mareos Entumecimiento y hormigueo Alteraciones del sentido del sabor Alteraciones del sentido del olfato Rubor Aumento de la presión arterial Dificultades respiratorias Vómitos Sequedad de boca Erupción cutánea Picor intenso* Dolor de espalda Dolor en el pecho Reacciones en el lugar de inyección** Sensación de calor Escalofríos Cansancio Sensibilidad anormal |
Incapacidad para sentarse o permanecer de pie Temblor Latidos del corazón anormalmente intensos o rápidos (palpitaciones) Latidos del corazón irregulares (signos de bloqueo cardíaco) Molestias en la boca Aumento de la producción de saliva Enrojecimiento de la piel con ampollas y manchas Aumento de la sudoración Sensación de incomodidad Malestar general |
Ritmo cardiaco rápido Agitación Reacciones de hipersensibilidad /alérgicas (p. ej. shock, presión sanguínea baja, hinchazón de la garganta o la lengua, urticaria (sarpullido como el que causa la ortiga), hinchazón de la cara, secreción nasal, conjuntivitis, dolor de estómago, sensibilidad reducida en la piel, estornudos, tos, picores, palidez) |
* Picor intenso (picor generalizado, picor de los ojos)
** Reacciones en el lugar de inyección (diferentes tipos) incluye los siguientes términos: extravasación involuntaria en el lugar de inyección, sensación de calor en el lugar de inyección, sensación de frío en el lugar de inyección, irritación en el lugar de inyección, dolor en el lugar de inyección
Los siguientes efectos adversos han sido mortales o han puesto en peligro la vida en algunos casos: shock y dificultades respiratorias.
Algunos valores de laboratorio pueden cambiar poco tiempo después de que le hayan administrado Primovist. Por lo tanto, usted debe informar al personal sanitario de que recientemente se le ha hecho una prueba con Primovist en caso de que tengan que hacerle un análisis de sangre u orina.
Se han notificado casos de fibrosis nefrogénica sistémica (que provoca un endurecimiento de la piel y puede afectar también a los tejidos blandos y los órganos internos), asociados al uso de otros medios de contraste de gadolinio.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o radiólogo, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlosdirectamente a través del Sistema Español de Farmacovigilancia de medicamentos de Uso
Humano:https://www.notificaram.es. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Primovist
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamentodespués de la fecha de caducidad que aparece en la etiqueta de la jeringa o del estuche después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Este medicamento debe utilizarse inmediatamente tras su apertura.
Este medicamento es una solución clara, incolora o de color amarillo pálido. Debe ser inspeccionada visualmente antes de ser utilizada. Este medicamento no debe utilizarse en caso de presentar alteraciones significativas del color, de aparición de partículas o en caso de que el envase esté defectuoso.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esa forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Primovist
- El principio activo es gadoxetato de disodio. Cada ml de solución para inyección contiene 0,25 mmol de gadoxetato de disodio (equivalente a 181,43 mg de gadoxetato de disodio).
- Los demás componentes son: caloxetato trisódico, trometamol, hidróxido de sodio para ajustar el pH, ácido clorhídrico para ajustar el pH y agua para preparaciones inyectables.
1 jeringa precargada con 5,0 ml de solución contiene 907 mg de gadoxetato de disodio,
1 jeringa precargada con 7,5 ml de solución contiene 1361 mg de gadoxetato de disodio, [sólo la jeringa de vidrio]
1 jeringa precargada con 10,0 ml de solucióncontiene 1814 mg de gadoxetato de disodio.
Aspecto del producto y contenido del envase
Primovist es un líquido claro, de incoloro a amarillo pálido libre de partículas. El contenido de los envases es:
1, 5, o 10 jeringas precargadas con 5,0 ml de solución para inyección (en jeringa precargada de 10 ml de vidrio o plástico)
1, 5, o 10 jeringas precargadas con 7,5 ml de solución para inyección (en jeringa precargada de 10 ml de vidrio) [sólo la jeringa de vidrio]
1, 5, o 10 jeringas precargadas con 10,0 ml de solución para inyección (en jeringa precargada de 10 ml de vidrio o plástico)
No se comercializan todas las presentaciones.
Titular de la autorización de comercialización:
Bayer Hispania, S.L.
Avda. Baix Llobregat, 3-5 08970 Sant Joan Despí (Barcelona)
España
Responsable de la fabricación:
Bayer Pharma AG Müllerstrasse 178 D-13353 Berlin, Alemania Teléfono: +49 30 468- 1111
Este medicamento está autorizado bajo el nombre de Primovist en los siguientes estados miembros del EEE (Espacio Económico Europeo): Austria, Bélgica, Croacia, Chipre, República Checa, Estonia, Finlandia, Alemania, Grecia, Hungría, Irlanda, Italia, Letonia, Lituania, Luxemburgo, Malta, Holanda, Noruega, Polonia, Portugal, Eslovaquia, Eslovenia, España, Suecia, Reino Unido.
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
Fecha de la última revisión de este prospecto: Septiembre de 2015
Esta información está destinada únicamente a profesionales del sector sanitario:
Insuficiencia renal
Antes de la administración de Primovist, se recomienda evaluar a todos los pacientes para detectar una posible disfunción renal mediante pruebas de laboratorio.
Se han notificado casos de fibrosis nefrogénica sistémica (FNS) asociados a la utilización de algunos medios de contraste de gadolinio en pacientes con insuficiencia renal grave aguda o crónica (TFG o tasa de filtración glomerular < 30 ml/min/1,73 m2). Los pacientes sometidos a trasplante hepático tienen un riesgo especial ya que la incidencia de un fallo renal es elevada en este grupo. Puesto que existe la posibilidad de que pueda ocurrir una FNS con Primovist, éste debe evitarse en pacientes con insuficiencia renal grave y en pacientes en el periodo perioperatorio de un trasplante hepático a no ser que la información diagnóstica sea imprescindible y no pueda obtenerse mediante resonancia magnética (RM) sin contraste. Si el uso de Primovist no puede evitarse, la dosis no debe exceder 0,025 mmol/kg de peso corporal. Durante una exploración no debe administrarse más de una dosis. Debido a la ausencia de información sobre la
administración repetida, la administración de Primovist no debe repetirse a no ser que haya transcurrido un intervalo entre inyecciones de al menos 7 días.
Dado que la eliminación renal del gadoxetato puede estar reducida en los pacientes de edad avanzada, es especialmente importante evaluar a los pacientes de 65 años y mayores para detectar una posible disfunción renal.
La hemodiálisis poco después de la administración de Primovist puede resultar útil para la eliminación corporal de Primovist. No hay evidencia que apoye el inicio de la hemodiálisis para la prevención o tratamiento de la FNS en pacientes que no están sometidos a hemodiálisis.
Embarazo y Lactancia
No debe utilizarse Primovist durante el embarazo a no ser que la situación clínica de la mujer requiera tratamiento con gadoxetato.
La continuación o la interrupción de la lactancia 24 horas después de la administración de Primovist, quedarán a discreción del médico y de la madre en periodo de lactancia.
Población pediátrica
Se realizó un estudio observacional en 52 pacientes pediátricos (de edad> 2 meses y <18 años). Los pacientes fueron sometidos a una RM hepática con realce con Primovist para evaluar lesiones hepáticas focales conocidas o que se sospechen. Se obtuvo información adicional de diagnóstico cuando las imágenes combinadas de RM hepática con y sin realce se compararon con las imágenes de RM sin realce. Se notificaron acontecimientos adversos graves, sin embargo ninguno de ellos fue relacionado con Primovist por el investigador. Debido a la naturaleza retrospectiva y el pequeño tamaño de la muestra de este estudio, no se puede extraer ninguna conclusión definitiva respecto a la eficacia y la seguridad en esta población.
Antes de la inyección
Primovist es un líquido claro, de incoloro a amarillo pálido libre de partículas visibles. El medio de contraste debe ser inspeccionado visualmente antes de ser utilizado. El medio de contraste no debe utilizarse en caso de presentar alteraciones significativas del color, de aparición de partículas o en caso de que el envase esté defectuoso.
Administración
Primovist debe ser administrado sin diluir en forma de inyección intravenosa en bolo con una velocidad de flujo de aproximadamente 2 ml/s. Tras la inyección del medio de contraste se debe lavar la cánula/ vía intravenosa con una solución salina fisiológica (9 mg/ml).
- Los pacientes deben mantenerse en observación durante al menos 30 minutos tras la inyección.
- Primovist no debe mezclarse con otros medicamentos.
- Debe evitarse la inyección intramuscular en sentido estricto.
Manipulación
Primovist está listo para su uso.
La jeringa precargada debe prepararse para la inyección inmediatamente antes de la prueba. Se debe separar la tapa del extremo (capuchón) de la jeringa precargada inmediatamente antes del uso.
Todo el medio de contraste no utilizado debe desecharse siguiendo las normas locales.
La etiqueta separable de las jeringas precargadas debe pegarse en la historia del paciente a fin de permitir un registro preciso del medio de contraste de gadolinio utilizado. También debería registrarse la dosis utilizada. En el caso que se utilicen registros electrónicos de pacientes, deben introducirse en los mismos el nombre del producto, el número de lote y la dosis administrada.
Jeringa de vidrio:
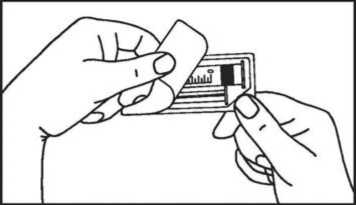
1. Abrir el envase
3. Romper la cubierta protectora
|
fZj-r |
r% | |
|
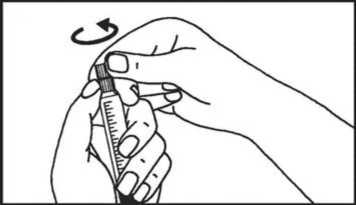
2. Enroscar el émbolo de la jeringa | ||
|
( |
¿ ! | |
|
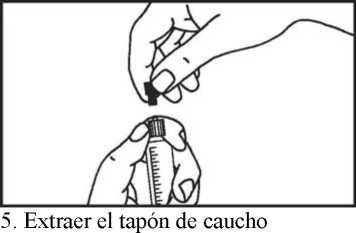
4. Extraer la cubierta protectora | ||
|
t< | ||
6. Extraer el aire de la jeringa
Jeringa de plástico:
INYECCIÓN MANUAL
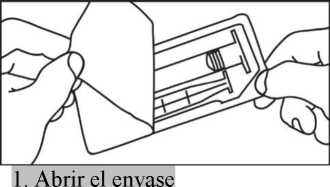
INYECCIÓN CON INYECTOR
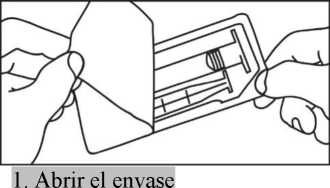
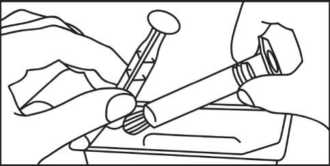
2. Sacar la jeringa y el émbolo del envase

2. Sacar la jeringa del envase

3. Enroscar el émbolo en la jeringa


4. Abrir la tapa con un giro
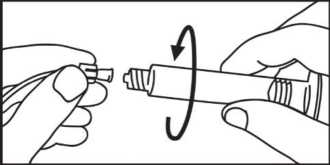
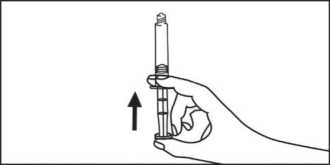
5. Extraer el aire de la jeringa
4. Conectar la punta de la jeringa o el Sistema de tubos girando a la derecha y siga las instrucciones del fabricante de dispositivo

En la sección 3 del prospecto se incluye información adicional sobre el uso de Primovist.
9 de 9